一种具有抗肿瘤增效减毒效果的药用溶液及包含其的药用组合物的制作方法
一种具有抗肿瘤增效减毒效果的药用溶液及包含其的药用组合物
1.本技术是申请号为2015800279084、申请日为2015年5月25日、发明名称为“一种具有抗肿瘤增效减毒效果的药用溶液及包含其的药用组合物”的专利申请的分案申请。
技术领域
2.本发明属于医药领域,涉及一种具有抗肿瘤增效减毒效果的药用溶液及包含其的药用组合物。
背景技术:
3.根据世界卫生组织的统计报告,2014年,全世界恶性肿瘤发病1200万例,死亡850万例。因此,有效地控制恶性肿瘤,是医药工作者艰巨而迫切的任务。
4.目前治疗恶性肿瘤的主要采取手术、放疗和各种抗肿瘤药物化疗,这些方法各有其特点,但均存在有一定的局限性,特别是使用抗肿瘤药物进行化疗时,药效常不明显,如常用抗肿瘤药5-氟尿嘧啶(5-fu)的临床单药有效率仅10%。而且许多抗肿瘤药物具有较明显的毒性。毒性与剂量成正比,为提高疗效,需加大用药剂量,但药物毒性也相应增加,陷入两难境地。因此,设法增加抗肿瘤药物的疗效并减少其药物毒性是提高临床抗肿瘤疗效的重要方向。
5.许多现有抗肿瘤药物由于药物的理化性质、药动学及药效学等原因,必须采取注射方式以全身给药或局部灌洗注药。常用的载体溶液有生理盐水和葡萄糖溶液。此类溶液仅作为抗肿瘤药物的载体溶液,其本身不具备抗肿瘤功效,也不能增强其他抗肿瘤药物的药效。
6.重水(化学名:氧化氘,英文:deuterium oxide,分子式:d2o,分子量:20.03,cas号:7789-20-0)可从海水中分离获得。正常成人体内含重水5克左右。以狗为模型的动物实验证实:外源性重水在体内浓度达到30%以上时出现毒性反应。以上述实验作为依据,理论上,成人体重60公斤计,人体内重水达到18公斤时,始有毒性,人体内有重水18公斤是不可能发生的。此外,美国加利福尼亚州政府在加州化学品目录中明确标示重水不引起癌症和生殖发育缺陷。因此重水应属于无毒物质[d.m.czajka:am.j.physiol.201(1961):357-362;california proposition 65]。gross p.r.等在上世纪60年代发现重水有抑制细胞dna脱氧合成酶的作用(science 133(1961):1131-1133)。随后,laissue等釆用小鼠模型研究重水抗肿瘤作用(cancer res.42(1982)1125-1129)。altermatt等使用人肿瘤细胞株裸鼠荷瘤模型研究口服重水在动物体内抗肿瘤作用(cancer 62(1988):462-466.int.j.cancer.45(1990):475-480.)。近10年来,hartmann等证实重水可抑制体外胰腺癌细胞增殖(anticancer res.25(2005):3407-3412)。bahk等证实重水可抑制体外膀胱癌细胞增殖(j.ind.eng.chem.13(2007):501-507)。
[0007]
上述重水抗肿瘤研究以体外细胞试验为主。众所周知,药物研发中,候选物在体外细胞试验中有效,而到体内有效的机率只有万之一,以体外细胞培养为模型的研究结果,成
药预见性并不强。现仅有的2项动物研究都是釆用传统的单纯重水口服液,其为低渗溶液。作用机理是:提高体内氘元素含量,进而抗肿瘤。为达到有效的体内治疗剂量,需要动物大剂量口服重水口服液。具体做法:动物试验时,用重水和饮用水混合成重水浓度为30%的重水口服液,完全替代饮用水,供动物随意自由饮用,数日至数周后,动物体内氘元素含量达到很高的氘化状态,始有抗肿瘤效果。此重水口服液有严重缺陷:1)目前临床有效的抗肿瘤治疗是多种抗肿瘤药物联合化疗,但大多数抗肿瘤药物因各种原因不能口服,因此很难将重水与许多抗肿瘤药物联合使用,也就无法进行联合化疗而对病人有效治疗;2)每个人自由饮用水量不同,重水随意自由口服,给药量不能量化,无法比较不同人的治疗效果,并受到消化、吸收、代谢等药代动力学因素影响,致摄入量大且药效有限,成药可能性小;3)病人需短时间内大量饮用重水,难以服下,临床依从性差,费用也高;4)许多中晚期肿瘤病人已有吞咽困难或消化道手术,无法进食进水,更无法口服重水。
[0008]
还有,许多肿瘤病人在患病中、晚期时,发生体腔(例如胸腔﹑腹腔﹑盆腔等)的肿瘤转移复发约占50%以上,这是多数病人致死的直接因素。近年发展起来的胸腹腔内温热灌注化疗在预防或治疗肿瘤胸腹膜的转移或复发中已成为一种有效的疗法,但目前使用普通的生理盐水溶解或稀释抗肿瘤药物,直接体腔(热)灌注灌洗给药,也有疗效不高的问题,生理盐水本身也不具有增效抗肿瘤药作用。
[0009]
因此,目前本领域中仍需要具有抗肿瘤作用的药用组合物,尤其对于使用具有增效作用的溶液的药用组合物存在需求。
[0010]
发明简述
[0011]
本发明基于发明人的以下发现:1)使用重水制成不同药用溶液,溶解或稀释其他抗肿瘤药物,注射给药或体腔(热)灌注灌洗联合给药;2)小剂量重水直接注射,改变了肿瘤细胞的细胞周期,肿瘤细胞死亡;3)增效减毒,使用重水直接溶解或稀释小剂量抗肿瘤药,注射给药或体腔(热)灌注灌洗给药,可取得大剂量抗肿瘤药等同的药效,但避免了大剂量抗肿瘤药的毒性;4)提高成药性:重水注射给药可以量化,克服随意饮用无量化指标的成药性缺陷;5)安全:使用一定剂量的重水直接体内注射或体腔(热)灌注灌洗对哺乳动物是安全的。总之,重水本身具有抗肿瘤的药效,与多种不同种类抗肿瘤药物联用,明显协同增加抗肿瘤效果,同时降低抗肿瘤药毒性,用于治疗恶性肿瘤,取得意想不到的效果。
[0012]
本发明的一个方面在于提供一种药用溶液,特征在于,其使用重水作为溶剂。
[0013]
本发明的另一个方面在于提供一种药用组合物,特征在于,所述药用组合物包含本发明的药用溶液、至少一种抗肿瘤药和任选的药学上可用的辅料。
[0014]
本发明的另一个方面在于一种药用溶液,其用于治疗或预防恶性肿瘤,特征在于,所述药用溶液使用重水作为溶剂。
[0015]
本发明的另一个方面在于一种药用组合物,其用于治疗或预防恶性肿瘤,特征在于,所述药用组合物包含本发明的药用溶液、至少一种抗肿瘤药和任选的药学上可用的辅料。
[0016]
本发明的另一方面在于提供本发明药用溶液或药用组合物在制备抗肿瘤药中的用途。
[0017]
本发明的另一个方面在于提供一种联用药物,其特征在于,所述联用药物包含重水和至少一种抗肿瘤药物,其中重水和抗肿瘤药物可分开给药、相继给药或同时给药。
[0018]
本发明的又一方面在于提供一种治疗或预防恶性肿瘤的方法,其包括给予肿瘤患者治疗有效量的本发明药用溶液或药用组合物或联用药物。
[0019]
本发明的另一方面在于提供重水在制备药用溶液中的用途。
[0020]
本发明药用组合物或联用药物可有效地抗肿瘤,并且与现有抗肿瘤药物相比毒性低。本发明药用组合物或联用药物可用于治疗或预防恶性肿瘤。重水具有协同增加抗肿瘤药物的药效;小剂量抗肿瘤药即可取得大剂量抗肿瘤药的等同药效,进而减少抗肿瘤药物的用量和减小抗肿瘤药物的毒性。本发明药用组合物或联合药物可用于预防和减少肿瘤侵袭、转移、复发、耐药。
[0021]
附图简述
[0022]
图1.重水对人结肠癌hct-116细胞周期的影响;
[0023]
图2.fcm法检测重水对人结肠癌hct-116细胞周期的影响;
[0024]
图3.重水对人肺癌a549细胞周期的影响;
[0025]
图4.fcm法检测重水对人肺癌a549细胞周期的影响;
[0026]
图5.葡萄糖重水溶液联合5-fu对人结肠癌hct-116细胞裸鼠移植瘤瘤体积的影响。
[0027]
图6.葡萄糖重水溶液联合5-fu对人结肠癌hct-116细胞裸鼠移植瘤瘤重的影响。
[0028]
图7.葡萄糖重水溶液联合5-fu对人结肠癌hct-116细胞裸鼠移植瘤荷瘤动物体重的影响。
[0029]
图8.氯化钠重水溶液联合吉西他滨对人乳腺癌mcf-7细胞裸鼠移植瘤瘤体积的影响。
[0030]
图9.氯化钠重水溶液联合吉西他滨对人乳腺癌mcf-7细胞裸鼠移植瘤瘤重的影响。
[0031]
图10.氯化钠重水溶液联合吉西他滨对人乳腺癌mcf-7细胞裸鼠移植瘤荷瘤动物体重的影响。
[0032]
图11.氯化钠重水溶液联合吉西他滨对人肺癌a549细胞裸鼠移植瘤瘤体积的影响。
[0033]
图12.氯化钠重水溶液联合吉西他滨对人肺癌a549细胞裸鼠移植瘤瘤重的影响。
[0034]
图13.氯化钠重水溶液联合吉西他滨对人肺癌a549细胞裸鼠移植瘤荷瘤动物体重的影响。
[0035]
以上图中,dj和hw均表示重水。
[0036]
发明详述
[0037]
在本技术涉及以下实施方案:
[0038]
实施方案1.一种药用溶液,特征在于,其使用重水作为溶剂。
[0039]
实施方案2.实施方案1所述的药用溶液,其适合于胃肠外给药。
[0040]
实施方案3.实施方案1所述的药用溶液,特征在于,所述药用溶液包含氯化钠,其中100ml药用溶液包含0.1克-5克氯化钠,优选0.5克-2.5克氯化钠的氯化钠重水溶液。
[0041]
实施方案4.实施方案1所述的药用溶液,特征在于,所述药用溶液为由重水和氯化钠配制的氯化钠浓度为每100ml药用溶液包含0.9克氯化钠且ph被调整为4.5-7.0的氯化钠重水溶液。
[0042]
实施方案5.实施方案1所述的药用溶液,特征在于,所述药用溶液包含葡萄糖,其中每100ml药用溶液包含0.1克-50克葡萄糖,优选5克-50克葡萄糖的葡萄糖重水溶液。
[0043]
实施方案6.实施方案1所述的药用溶液,特征在于,所述药用溶液为由重水和葡萄糖配制的葡萄糖浓度为每100ml药用溶液包含5克或者10克葡萄糖且ph被调整为3.2-6.5的葡萄糖重水溶液。
[0044]
实施方案7.实施方案1所述的药用溶液,特征在于,所述药用溶液为由重水、氯化钠和葡萄糖配制的每100ml药用溶液包含0.9克氯化钠和5克葡萄糖且ph被调整为3.5-5.5的葡萄糖氯化钠重水溶液。
[0045]
实施方案8.实施方案1所述的药用溶液,特征在于,所述药用溶液为由重水、氯化钠、氯化钾和氯化钙配制的每100ml药用溶液包含0.85克氯化钠、0.03克氯化钾和0.033克氯化钙(caci2·
2h2o)且ph被调整为4.5-7.5的林格重水溶液。
[0046]
实施方案9.实施方案1所述的药用溶液,特征在于,所述药用溶液为由重水、乳酸钠、氯化钠、氯化钾和氯化钙配制的每100ml药用溶液包含0.310克乳酸钠、0.600克氯化钠、0.030克氯化钾和0.020克氯化钙(caci2·
2h2o)且ph被调整为6.0-7.5的乳酸钠林格重水溶液。
[0047]
实施方案10.实施方案1所述的药用溶液,特征在于,所述药用溶液为由重水、乳酸钠、葡萄糖、氯化钠、氯化钾和氯化钙配制的每100ml药用溶液包含0.310克乳酸钠、0.600克氯化钠、0.030克氯化钾、0.020克氯化钙和5克葡萄糖且ph被调整为3.6-6.5的复方乳酸钠葡萄糖重水溶液。
[0048]
实施方案11.实施方案1所述的药用溶液,特征在于,所述药用溶液为由重水和果糖配制的每1000ml药用溶液包含50克-100克果糖且ph被调整为4.0-6.5的果糖重水溶液。
[0049]
实施方案12.实施方案1所述的药用溶液,特征在于,所述药用溶液为由重水、果糖和氯化钠配制的每1000ml药用溶液包含50克果糖与9克氯化钠且ph被调整为4.0-6.5的果糖氯化钠重水溶液。
[0050]
实施方案13.实施方案1所述的药用溶液,特征在于,所述药用溶液为由重水、甘油、果糖和氯化钠配制的每1000ml药用溶液包含100克甘油、50克果糖与9克氯化钠且ph被调整为3.0-6.0的甘油果糖氯化钠重水溶液。
[0051]
实施方案14.实施方案1所述的药用溶液,特征在于,所述药用溶液为由重水、醋酸钠、氯化钠、氯化钾和氯化钙配制的每500ml药用溶液包含1.9克醋酸钠、3.0克氯化钠、0.15克氯化钾和0.1克氯化钙(caci2·
2h2o)且ph被调整为6.0-7.4的醋酸钠林格重水溶液。
[0052]
实施方案15.实施方案1所述的药用溶液,特征在于,所述药用溶液为重水和碳酸氢钠配制的每100ml药用溶液包含1-50克碳酸氢钠,优选5克-10克碳酸氢钠,最优选5克碳酸氢钠且ph被调整为7.5-8.5的碳酸氢钠重水溶液。
[0053]
实施方案16.实施方案1所述的药用溶液,特征在于,所述药用溶液为由重水、氯化钠、氯化钾、葡萄糖、磷酸二氢钾、磷酸氢二钠和碳酸氢钠配制的每100ml药用溶液包含0.8克氯化钠、0.04克氯化钾、0.1克葡萄糖、0.006克磷酸二氢钾、0.00475克磷酸氢二钠和0.035克碳酸氢钠且ph被调整为6.0-7.5的hank氏平衡盐重水溶液。
[0054]
实施方案17.实施方案1所述的药用溶液,特征在于,所述药用溶液为由重水、氯化钠、氯化钾、葡萄糖、磷酸二氢钾、磷酸氢二钠和碳酸氢钠配制的每100ml药用溶液包含0.8
克氯化钠、0.04克氯化钾、0.1克葡萄糖、0.006克磷酸二氢钾、0.00475克磷酸氢二钠和0.22克碳酸氢钠且ph被调整为6.0-7.5的eagles平衡盐重水溶液。
[0055]
实施方案18.实施方案1所述的药用溶液,特征在于,所述药用溶液为由重水、氯化钠、氯化钾、氯化钙、氯化镁、醋酸钠和柠檬酸钠配制的每100ml药用溶液包含0.64克氯化钠、0.075克氯化钾、0.048克氯化钙、0.03克氯化镁、0.39克醋酸钠、0.17克柠檬酸钠且ph被调整为6.0-7.5的平衡盐重水溶液。
[0056]
实施方案19.一种药用组合物,特征在于,所述药用组合物包含实施方案1-18中任一项的药用溶液、至少一种抗肿瘤药和任选的药学上可用的辅料。
[0057]
实施方案20.实施方案19的药用组合物,其中所述抗肿瘤药选自抗肿瘤细胞毒类药物和单克隆抗体抗肿瘤药物。
[0058]
实施方案21.实施方案20的药用组合物,其中所述抗肿瘤细胞毒类药物包括抗代谢物、植物抗肿瘤药、肿瘤抗生素、烷基化剂和铂制剂。
[0059]
实施方案22.实施方案21的药用组合物,其中抗代谢物包括5-氟尿嘧啶、吉西他滨、氟尿苷、培美曲塞、雷替曲塞、氟达拉滨、阿糖胞苷,所述肿瘤抗生素包括丝裂霉素、表柔比星、平阳霉素、柔红霉素、阿霉素、吡柔比星、阿柔比星,所述铂制剂包括顺铂、奥沙利铂、卡铂、奈达铂,所述植物抗肿瘤药包括紫杉醇、紫杉醇脂质体、紫杉醇白蛋白型、多西紫杉醇、依托泊苷、羟基喜树碱,所述烷基化剂包括塞替派、卡莫司汀、尼莫司汀、福莫司汀、雌莫司汀、环磷酰胺、马利兰。
[0060]
实施方案23.实施方案20的药用组合物,其中单克隆抗体抗肿瘤药包括贝伐单抗、西妥昔单抗、曲妥珠单抗、帕尼妥单抗、尼妥珠单抗、重组人血管内皮抑素。
[0061]
实施方案24.实施方案1-18中任一项的药用溶液或实施方案19-23中任一项的药用组合物在制备抗肿瘤药物中的用途。
[0062]
实施方案25.实施方案1-18中任一项的药用溶液或实施方案19-23中任一项的药用组合物,其用于治疗或预防恶性肿瘤。
[0063]
实施方案26.一种联用药物,其特征在于,包含重水和至少一种抗肿瘤药物,其中重水和抗肿瘤药物可分开给药、相继给药或同时给药。
[0064]
实施方案27.一种治疗或预防恶性肿瘤的方法,其包括给予肿瘤患者治疗有效量的实施方案1-18中任一项的药用溶液或实施方案19-23中任一项的药用组合物或实施方案27的联用药物。
[0065]
实施方案28.实施方案27的方法,其中所述恶性肿瘤选自:肺癌、结直肠癌、原发性肝癌、食道癌、胃癌及贲门癌、胰腺癌、肾细胞癌、膀胱癌、前列腺癌、头颈癌、鼻咽癌、宫颈癌、卵巢癌、乳腺癌、脑瘤、骨及关节肉瘤、甲状腺癌、皮肤癌、恶性黑色素瘤、恶性淋巴瘤、白血病、各种恶性肿瘤的并发症和复发如肿瘤细胞胸腹盆腔转移和种植、恶性胸腹盆腔积液。
[0066]
实施方案29.实施方案28的方法,其中肺癌包括小细胞肺癌(sclc)、非小细胞肺癌(nsclc);结直肠癌包括早期结直肠癌、进展期结直肠癌;原发性肝癌包括肝细胞型、肝管细胞型、混合型;食道癌包括腺癌、鳞癌、腺鳞癌、小细胞癌;胃癌及贲门癌包括腺癌、鳞癌、腺鳞癌、小细胞癌、恶性胃肠间质瘤;胰腺癌包括导管细胞癌、破骨细胞样巨癌细胞;肾细胞癌包括透明细胞癌、乳头状肾细胞癌;膀胱癌包括尿路上皮癌、鳞状细胞癌、腺癌;前列腺癌包括腺癌、导管腺癌、尿路上皮癌、鳞状细胞癌;头颈癌包括鳞癌、腺癌、腺鳞癌;鼻咽癌包括鳞
状细胞癌、腺癌;宫颈癌包括鳞癌、腺癌、肉瘤;卵巢癌包括卵巢上皮癌、生殖细胞肿瘤、卵巢性索间质肿瘤;乳腺癌包括上皮性肿瘤、间叶性肿瘤、肌上皮瘤;脑瘤包括原发性脑瘤和脑转移瘤、骨及关节肉瘤包括软骨肉瘤、成骨肉瘤、尤文肉瘤、软组织肉瘤;甲状腺癌包括乳头状癌、滤泡癌、髓样癌;皮肤癌包括基底细胞癌和鳞状细胞癌;恶性黑色素瘤包括表浅扩散性黑色素瘤、结节性黑色素瘤、肢端雀班黑色素瘤;恶性淋巴瘤包括霍奇金淋巴瘤和非霍奇金淋巴瘤;白血病包括急性白血病、慢性白血病。
[0067]
实施方案30.重水在制备实施方案1-18中任一项的药用溶液中用途。
[0068]
实施方案31.实施方案30的用途,其中所述药用溶液能作为广谱抗肿瘤增效剂协同增效抗肿瘤药效果。
[0069]
在本发明所述药用溶液或药用组合物中,每100ml药用溶液或药用组合物包含重水1-99.9ml重水,优选9-99.9ml重水,更优选20-99.9ml重水,更优选30-99.9ml重水,更优选40-99.9ml重水,更优选50-99.9ml重水,更优选60-99.9ml重水,更优选70-99.9ml重水,更优选80-99.9ml重水,更优选90-99.9ml重水,最优选95-99.9ml重水。
[0070]
用于本发明中的重水,来源于重水工厂生产,可由商业途径购得,其中氘元素的同位素丰度为1-99.9%,优选为30-99.9%,更优选为50-99.9%,更优选为70-99.9%,最优选为90-99.9%。例如可以使用美国剑桥同位素实验室公司提供的重水,其中氘元素的同位素丰度为90-99.9%(d90-99.9%)。
[0071]
所述药学上可用的辅料:水、氯化钠、氯化钾、氯化钙、氯化镁、乳酸钠、醋酸钠、柠檬酸钠、碳酸氢钠、磷酸二氢钾、磷酸氢二钠、碳酸氢钠、葡萄糖、果糖、白蛋白、脂质体、透明质酸、聚乙二醇。
[0072]
所述抗肿瘤药选自抗肿瘤细胞毒类药物和单克隆抗体抗肿瘤药物。
[0073]
抗肿瘤细胞毒类药物选自抗代谢物、植物抗肿瘤药、肿瘤抗生素、烷基化剂和铂制剂。抗代谢物包括5-氟尿嘧啶、吉西他滨、氟尿苷、培美曲塞、雷替曲塞、氟达拉滨、阿糖胞苷,优选的是5-氟尿嘧啶、吉西他滨和培美曲塞。肿瘤抗生素包括丝裂霉素、表柔比星、平阳霉素、柔红霉素、阿霉素、吡柔比星、阿柔比星,优选的是丝裂霉素和表柔比星。铂制剂包括顺铂、奥沙利铂、卡铂、奈达铂,优选的是顺铂和奥沙利铂。植物抗肿瘤药包括紫杉醇、紫杉醇脂质体、紫杉醇白蛋白型、多西紫杉醇、依托泊苷、羟基喜树碱,优选的是紫杉醇、紫杉醇脂质体、紫杉醇白蛋白型和多西紫杉醇。烷基化剂包括塞替派、卡莫司汀、尼莫司汀、福莫司汀、雌莫司汀、环磷酰胺、马利兰,优选的是塞替派和卡莫司汀。
[0074]
单克隆抗体抗肿瘤药包括贝伐单抗、西妥昔单抗、曲妥珠单抗、帕尼妥单抗、尼妥珠单抗、重组人血管内皮抑素,优选的是贝伐单抗和重组人血管内皮抑素。
[0075]
本发明药用溶液使用制药领域中制备溶液的标准方法制备,符合《中国药典》、《美国药典》以及《欧洲药典》中的相应标准。
[0076]
本发明药用溶液与抗肿瘤药物的配合时,遵循《中国药典》、《美国药典》以及《欧洲药典》所规定的药用溶液与抗肿瘤药物的溶解或稀释配合比例。
[0077]
本发明所述药用溶液、药用组合物或联用药物的各成分可分开、相继或同时给予。
[0078]
本发明所述药用溶液或组合物为灌洗灌注液、注射液、悬浮液或乳液或栓塞内含液各种制剂,优选灌洗灌注液和注射液。
[0079]
本发明所述药用溶液或药用组合物适用于体腔(热)灌注灌洗、静脉注射、动脉介
入注射、鞘内注射和瘤内瘤周注射,优选体腔(热)灌注灌洗给药和静脉注射给药。对于静脉注射给药,选用剂量为:1ml/kg-20ml/kg。
[0080]
所述恶性肿瘤选自:肺癌、结直肠癌、原发性肝癌、食道癌、胃癌及贲门癌、胰腺癌、肾细胞癌、膀胱癌、前列腺癌、头颈癌、鼻咽癌、宫颈癌、卵巢癌、乳腺癌、脑瘤、骨及关节肉瘤、甲状腺癌、皮肤癌、恶性黑色素瘤、恶性淋巴瘤、白血病、各种恶性肿瘤的并发症和复发如肿瘤细胞胸腹盆腔转移和种植、恶性胸腹盆腔积液等。
[0081]
肺癌包括小细胞肺癌(sclc)、非小细胞肺癌(nsclc)等;结直肠癌包括早期结直肠癌、进展期结直肠癌等;原发性肝癌包括肝细胞型、肝管细胞型、混合型等;食道癌包括腺癌、鳞癌、腺鳞癌、小细胞癌等;胃癌及贲门癌包括腺癌、鳞癌、腺鳞癌、小细胞癌、恶性胃肠间质瘤等;胰腺癌包括导管细胞癌、破骨细胞样巨癌细胞、其他等;肾细胞癌包括透明细胞癌、乳头状肾细胞癌;膀胱癌包括尿路上皮癌、鳞状细胞癌、腺癌等;前列腺癌包括腺癌、导管腺癌、尿路上皮癌、鳞状细胞癌;头颈癌包括鳞癌、腺癌、腺鳞癌;鼻咽癌包括鳞状细胞癌、腺癌;宫颈癌包括鳞癌、腺癌、肉瘤;卵巢癌包括卵巢上皮癌、生殖细胞肿瘤、卵巢性索间质肿瘤;乳腺癌包括上皮性肿瘤、间叶性肿瘤、肌上皮瘤;脑瘤包括原发性脑瘤和脑转移瘤、骨及关节肉瘤包括软骨肉瘤、成骨肉瘤、尤文肉瘤、软组织肉瘤;甲状腺癌包括乳头状癌、滤泡癌、髓样癌;皮肤癌包括基底细胞癌和鳞状细胞癌;恶性黑色素瘤包括表浅扩散性黑色素瘤、结节性黑色素瘤、肢端雀班黑色素瘤;恶性淋巴瘤包括霍奇金淋巴瘤和非霍奇金淋巴瘤;白血病包括急性白血病、慢性白血病。
[0082]
本文中所述的“包含”既涵盖仅包含所提及的物质或成分的情形,又涵盖除了包含所提及的物质或成分以外还包含其它不妨碍预期目标实现的其它物质或成分的情形。
[0083]
除非另有说明,本文中表示物质量的数值都理解为被“约”修饰。
[0084]
下面结合实施例对本发明作进一步的说明。应理解的是本发明范围不局限于这些实施例。
[0085]
本技术实施例中所用的细胞株均可商业购得。
[0086]
实施例1
[0087]
称取0.9克氯化钠,加入99ml重水(d,99.8%,来自美国剑桥同位素实验室公司,下同),搅拌溶解氯化钠,加入数滴氢氧化钠溶液调节溶液ph值至7.0,再加入重水至终体积100ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明每100ml药用溶液包含0.9克氯化钠的氯化钠重水溶液。
[0088]
实施例2
[0089]
称取5克葡萄糖,加入99ml重水搅拌溶解葡萄糖,加入数滴盐酸溶液调节ph值至5.5,再加入重水至终体积100ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明每100ml药用溶液包含5克葡萄糖的葡萄糖重水溶液。
[0090]
实施例3
[0091]
分别称取10克葡萄糖,加入99ml重水搅拌溶解葡萄糖,加入数滴盐酸溶液调节ph值至5.5,再加入重水至终体积100ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明每100ml药用溶液包含10克葡萄糖的葡萄糖重水溶液。
[0092]
实施例4
[0093]
分别称取0.9克氯化钠和5克葡萄糖,加入重水99ml,搅拌溶解,加入数滴盐酸溶液
调节ph值至5.0,再加重水至终体积100ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明每100ml药用溶液包含0.9克氯化钠和5克葡萄糖的葡萄糖氯化钠重水溶液。
[0094]
实施例5
[0095]
分别称取0.85克氯化钠、0.03克氯化钾、0.033克氯化钙(caci2·
2h2o),加入99ml重水,搅拌溶解,加入数滴氢氧化钠溶液调节ph值至7.0,再加入重水至终体积100ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明林格重水溶液。
[0096]
实施例6
[0097]
分别称取0.31克乳酸钠、0.6克氯化钠、0.03克氯化钾和0.02克氯化钙(caci2·
2h2o),加入99ml重水,搅拌溶解,加入数滴氢氧化钠溶液调节ph值至7.0,再加入重水至终体积100ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明乳酸钠林格重水溶液。
[0098]
实施例7
[0099]
分别称取0.31克乳酸钠、0.6克氯化钠、0.03克氯化钾、0.02克氯化钙(caci2·
2h2o)、5克葡萄糖,加入99ml重水,搅拌溶解,加入数滴盐酸溶液调节ph值至6.0,再加入重水至终体积100ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明复方乳酸钠葡萄糖林格重水溶液。
[0100]
实施例8
[0101]
分别称取25克或50克果糖,加入499ml重水,搅拌溶解,加入数滴盐酸溶液调节ph值至6.0,再加入重水至终体积500ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明每500ml药用溶液包含25克或50克果糖的果糖重水溶液。
[0102]
实施例9
[0103]
分别称取12.5克果糖、2.25克氯化钠,加入249ml重水,搅拌溶解,加入数滴盐酸溶液调节ph值至6.0,再加入重水至终体积250ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明果糖氯化钠重水溶液。
[0104]
实施例10
[0105]
分别称取100克甘油、50克果糖、9克氯化钠,加入999ml重水,搅拌溶解,加入数滴盐酸溶液调节ph值至6.0,再加入重水至终体积1000ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明甘油果糖氯化钠重水溶液。
[0106]
实施例11
[0107]
分别称取1.9克醋酸钠、3.0克氯化钠、0.15克氯化钾和0.1克氯化钙,加入499ml重水,搅拌溶解,加入数滴氢氧化钠溶液调节ph值至7.0,再加入重水至终体积500ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明复方醋酸钠重水溶液。
[0108]
实施例12
[0109]
分别称取5克或10克碳酸氢钠,加入99ml重水,搅拌溶解,加入数滴氢氧化钠溶液调节ph值至8.0,再加入重水至终体积100ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明每100ml药用溶液包含5克或10克碳酸氢钠的碳酸氢钠重水溶液。
[0110]
实施例13
[0111]
分别称取0.8克氯化钠、0.04克氯化钾、0.1克葡萄糖、0.006克磷酸二氢钾、0.00475克磷酸氢二钠、0.035克碳酸氢钠,加入99ml重水,搅拌溶解,加入数滴氢氧化钠溶液调节ph值至7.0,再加入重水至终体积100ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得
到本发明hank氏平衡盐重水溶液。
[0112]
实施例14
[0113]
分别称取0.8克氯化钠、0.04克氯化钾、0.1克葡萄糖、0.006克磷酸二氢钾、0.00475克磷酸氢二钠、0.22克碳酸氢钠,加入99ml重水,搅拌溶解,加入数滴氢氧化钠溶液调节ph值至7.0,再加入重水至终体积100ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明eagles重水溶液。
[0114]
实施例15
[0115]
分别称取0.64克氯化钠、0.075克氯化钾、0.048克氯化钙、0.03克氯化镁、0.39克醋酸钠、0.17克柠檬酸钠,加入99ml重水,搅拌溶解,加入数滴氢氧化钠溶液调节ph值至7.0,再加入重水至终体积100ml,用微孔滤膜过滤,灌装密封,灭菌消毒,即得到本发明复方平衡盐重水溶液。
[0116]
实施例16
[0117]
重水体外抑制人肿瘤细胞生长的研究,mtt(噻唑蓝)法:
[0118]
细胞株:表1中所用各型肿瘤细胞株均由南京凯基生物科技发展有限公司提供,均来自美国国家肿瘤细胞株库,均可以从市场上自由购买,下同。
[0119]
方法:
[0120]
1.取已培养3~4天处于指数生长期的培养细胞一瓶,加入适量0.25%trypsin-edta液,使贴壁细胞脱落,用l0ml含10%胎牛血清的rpmi 1640培养液配成悬液。
[0121]
2.在血细胞计数板上作细胞计数,一般活细胞应在97%以上。
[0122]
3.用完全培养基稀释细胞悬液,配成1
×
104个细胞/ml悬液。
[0123]
4.取12孔细胞培养板,每孔加入细胞悬液300μl。加入细胞过程应控制在4小时以内。将平板置37℃、5%co2温箱中培养24小时。
[0124]
5.以美国剑桥同位素实验室公司提供的重水溶解粉状rpmi medium1640(美国gibco生命公司,编号:31800-022)成为细胞培养液(以下实施例中未特别说明的培养液均采用粉状rpmi medium 1640和重水配制),浓度如表1中所示,分别加入细胞培养板内。
[0125]
6.将细胞培养板在37℃,含5%co2空气及100%湿度的温箱中孵育3天。
[0126]
7.用无血清rpmi1640培养液将mtt配成1mg/ml溶液,每孔加入200μl,37℃温育4小时,使mtt还原为甲臜。
[0127]
8.吸出上清液,加入200μl dmso使甲臜溶解,用平板摇床摇匀。
[0128]
9.用酶标仪在参考波长450nm,检测波长570nm处检测每个小孔的吸光度。
[0129]
10.实验重复1次。
[0130]
结果计算:以生理盐水对照处理的肿瘤细胞为对照组,计算重水对肿瘤细胞的生长抑制率。以重水的不同含量及对细胞的生长抑制率作图可得到剂量反应曲线,从中求出重水的半数抑制浓度(ic
50
)。
[0131]
肿瘤细胞生长抑制率%=(1-od实验/od对照)
×
100%
[0132]
表1(a-1).重水体外抑制人肿瘤细胞生长
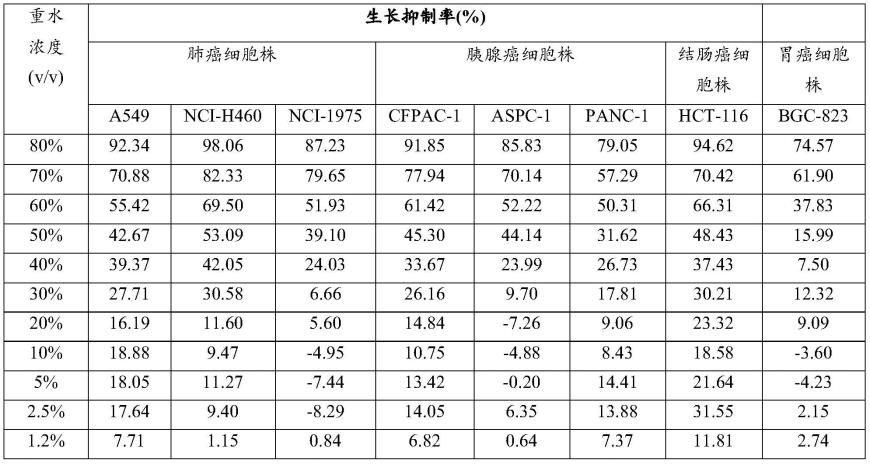
[0133][0134]
表1(a-2).重水体外抑制人肿瘤细胞生长
[0135][0136][0137]
表1(b)列出了重水对于不同种类肿瘤细胞的ic
50
和ic
10
(以百分含量体积表示)。
[0138]
表1(b-1).重水体外抑制人肿瘤细胞生长的ic50和ic10
[0139][0140]
表1(b-2).重水体外抑制人肿瘤细胞生长的ic50和ic10
[0141][0142]
从表17(b)的结果可以看出:重水对于不同种类肿瘤细胞的ic50、ic10均不相同。
[0143]
结果表明:重水对多种癌细胞株生长均有一定的抑制作用,重水含量越高,对肿瘤细胞生长的抑制作用越明显。
[0144]
实施例17
[0145]
重水联合5-氟尿嘧啶(5-fu)对体外人结肠癌hct-116细胞(中等耐药株)生长的抑制作用:
[0146]
细胞株:人结肠癌细胞hct-116,由南京凯基生物科技发展有限公司提供。
[0147]
受试药品:5-氟尿嘧啶(5-fu)、实施例1制备的氯化钠重水溶液。
[0148]
方法:取氯化钠重水溶液以表2中所示含量稀释5-氟尿嘧啶,加入细胞培养板中,体外抑制肿瘤细胞生长,mtt法,实验方法同实施例16。
[0149]
实验重复1次。
[0150]
结果:发现5-fu对人结肠癌hct-116细胞(中等耐药株)有一定的抑制生长作用,与重水联用,可明显增加抗肿瘤作用,结果见表2.
[0151]
表2.重水联合5-fu对人结肠癌hct-116细胞(中等耐药株)生长的抑制
[0152][0153]
结果表明:从表2可以看出:重水与5-fu联用,增加对耐药株肿瘤细胞(中等耐药株)生长的抑制,特别是5-fu在低浓度时,重水增敏效应更为明显,因此,重水具有抗耐药增敏效应。
[0154]
实施例18
[0155]
重水与5-氟尿嘧啶或吉西他滨联用对人结肠癌hct-116细胞、人肺癌细胞a549侵袭的抑制作用(transwell法)
[0156]
细胞株:人结肠癌hct-116细胞以及人肺癌a549细胞由南京凯基生物科技发展有限公司提供。
[0157]
受试药品:吉西他滨(gem)、5-氟尿嘧啶(5-fu)、实施例1制备的氯化钠重水溶液。
[0158]
方法:
[0159]
细胞培养
[0160]
1.细胞复苏
[0161]
1.1.调配37℃~40℃的温水,从液氮中取出冻存管,立即投入37℃~40℃温水中迅速晃动,直至冻存液完全溶解;
[0162]
1.2.将细胞冻存悬液转移到离心管内,加入约5ml培养液,轻轻吹打混匀;
[0163]
1.3.将细胞悬液经800~1000r/min离心5min,弃上清夜;
[0164]
1.4.向细胞沉淀内加入完全培养液,轻轻吹打混匀,将细胞悬液转移到培养瓶内,补足培养液进行培养。
[0165]
transwell检测细胞侵袭
[0166]
1.根据细胞处理组别分别加入受试药品:单独用生理盐水稀释吉西他滨或5-fu;或者取氯化钠重水溶液,以表3中所示含量稀释吉西他滨(重水+吉西他滨)或5-fu(重水+5-fu),分别作用于a549及hct116细胞,然后将细胞置于37℃,5%co2培养箱中孵育24h;
[0167]
2.细胞经过上述受试药品孵育处理24h后,撤去血清,使用不完全培养基继续饥饿培养细胞24h;
[0168]
3.提前将matrigel基质胶放置4℃过夜融化;
[0169]
4.然后将融化的matrigel胶使用不完全培养基稀释一倍,transwell上室加入30ul稀释的matrigel,于37℃孵育120min,使matrigel聚合成胶;
[0170]
5.将不同组别的细胞进行消化、计数,使用不完全培养基调整细胞密度至1
×
105个/ml,取细胞悬液100μl加入transwell小室的上室,下室加入500μl含20%fbs的培养基;
[0171]
6.将24孔细胞培养板置于37℃,5%co2培养箱中培养24小时;
[0172]
7.细胞计数:用棉签擦去基质胶和上室内的细胞,移去transwells,倒置,风干,24孔板中加入500μl含0.1%结晶紫,将小室置于其中,使膜浸没在染料中,在37℃保持30min后取出,pbs清洗,直径上取3个视野,照相(放大倍数200x),计数。
[0173]
8.实验重复1次。
[0174]
结果
[0175]
表3.重水对a549、hct-116细胞侵袭的抑制作用
[0176][0177]
表3中,以重水(1.8%)为例,其表示为细胞培养液内重水浓度为1.8%(v/v),下同。
[0178]
结果表明:重水本身具有抑制a549、hct-116细胞侵袭的作用,与含量成正比。
[0179]
表4. 5-氟尿嘧啶(5-fu)对hct-116细胞侵袭的抑制作用
[0180]
组别细胞数对照76.0
±
4.65-fu(0.195ug/ml)66.0
±
2.65-fu(0.39ug/ml)47.3
±
4.05-fu(0.78ug/ml)31.3
±
1.55-fu(1.56ug/ml)23.0
±
4.65-fu(3.125ug/ml)12.0
±
2.05-fu(6.25ug/ml)10.7
±
1.55-fu(12.5ug/ml)6.3
±
0.6
[0181]
表4中,以5-fu(0.195ug/ml)为例,其表示以生理盐水为溶媒,5-fu的浓度为0.195ug/ml。
[0182]
表5.重水与5-fu联合使用对hct-116细胞侵袭的抑制作用
[0183][0184]
表5中,以重水(30%)+5-fu(0.195ug/ml)为例,其表示细胞培养液内重水浓度为30%(v/v),5-fu浓度为0.195ug/ml,下同。
[0185]
结果表明:30%重水与5-fu联合使用,明显抑制hct-116细胞侵袭,特别当5-fu在浓度仅为0.195ug/ml时,两者联用,即可明显抑制hct-116细胞侵袭。
[0186]
表6.吉西他滨(gem)对a549细胞侵袭的抑制作用
[0187]
组别细胞数对照178.3
±
13.8gem(1.95nm)160.0
±
6.6gem(3.9nm)112.7
±
3.5gem(7.8nm)59.0
±
2.0gem(15.6nm)51.7
±
3.1gem(31.2nm)37.3
±
2.3gem(62.5nm)22.3
±
0.6gem(125nm)16.0
±
1.0gem(250nm)9.7
±
2.1
[0188]
表7.重水与gem联合使用对a549细胞侵袭的抑制作用
[0189][0190]
结果表明:重水与吉西他滨联合使用,明显抑制a549细胞侵袭,特别当吉西他滨在浓度仅为1.95nm时,两者联用,即可明显抑制a549细胞侵袭。
[0191]
以上结果说明重水具有抑制多种肿瘤细胞转移的效果,并与剂量成正比,也可联合其他药物共同抑制肿瘤细胞转移。
[0192]
实施例19
[0193]
重水对人肺癌a549细胞和结肠癌hct-116细胞周期的影响
[0194]
材料
[0195]
人肺腺癌细胞a549和结肠癌细胞hct-116细胞由南京凯基生物科技发展有限公司提供,于37℃、5%co2、饱和湿度的培养箱中培养。
[0196]
kga511细胞周期检测试剂盒由中国南京凯基生物科技发展有限公司提供。
[0197]
流式细胞仪为美国becton-dickinson提供的facs calibur。
[0198]
受试药品:吉西他滨(gem)、5-氟尿嘧啶(5-fu)、实施例1制备的氯化钠重水溶液。
[0199]
方法
[0200]
细胞培养
[0201]
1细胞复苏
[0202]
1.1调配37℃~40℃的温水,从液氮中取出细胞冻存管,立即投入37℃~40℃温水中迅速晃动,直至冻存液完全溶解;
[0203]
1.2将细胞冻存悬液转移到离心管内,加入约5ml培养液,轻轻吹打混匀;
[0204]
1.3将细胞悬液经800~1000r/min离心5min,弃上清夜;
[0205]
1.4向细胞沉淀内加入完全培养液,轻轻吹打混匀,将细胞悬液转移到培养瓶内,补足培养液进行培养。
[0206]
2细胞传代
[0207]
2.1培养瓶中的细胞覆盖率达到80%-90%时,把原有培养基吸掉;
[0208]
2.2加适当的胰蛋白酶(0.25%),消化1-2分钟;
[0209]
2.3细胞都变圆后加入等体积的含血清的培养基终止消化;
[0210]
2.4用移液枪吹打细胞,把细胞都悬浮起来,然后将细胞吸到15ml的离心管中,1000转离心5分钟;
[0211]
2.5倒掉上清液,加1-2ml培养基,将细胞重新悬浮转移至培养瓶中继续培养。
[0212]
pi单染法检测细胞周期
[0213]
1将对数生长期的细胞消化接种到六孔板中,次日,待细胞贴壁后,根据组别设置加入相应的含受试药品的细胞培养基,同时设立阴性对照组;
[0214]
2受试药品作用72h后,用0.25%胰酶(不含edta)消化收集细胞;
[0215]
3用pbs洗涤细胞一次(离心2000rpm,5min),收集5
×
105细胞;
[0216]
4制备的单细胞悬液用体积分数为70%乙醇固定2小时(或过夜),4℃保存,染色前用pbs洗去固定液(如需要,细胞悬液用200目筛网过滤一次);
[0217]
5加入100μl rnase a,在37℃水浴30min;
[0218]
6再加入400μl pi染色混匀,4℃避光30min;
[0219]
7上机检测,记录激发波长488nm处红色荧光。
[0220]
结果
[0221]
表8.重水对人结肠癌hct-116细胞周期的影响(%,n=6)
[0222]
组别g1期s期g2期对照(生理盐水)82.53
±
1.769.40
±
1.838.06
±
1.89重水(30%,v/v)89.19
±
3.816.61
±
1.414.21
±
0.955-fu(12.5ug/ml,生理盐水为溶媒)32.69
±
8.6626.07
±
11.3241.24
±
2.97重水(30%,v/v)+5-fu(12.5ug/ml)49.16
±
4.470.30
±
0.2650.53
±
4.26
[0223]
表9.重水对人肺癌a549细胞周期的影响(%,n=6)
[0224]
组别g1期s期g2期对照(生理盐水)80.29
±
5.0213.50
±
1.336.21
±
4.52重水(30%,v/v)86.23
±
3.690.31
±
0.2813.47
±
3.94gm(250nm,生理盐水为溶媒)73.73
±
3.7315.55
±
5.5110.71
±
2.39重水(30%,v/v)+gm(250nm)87.32
±
1.600.08
±
0.0112.6
±
1.46
[0225]
5-fu和吉西他滨为细胞毒类代谢抗肿瘤药,主要作用于dna合成期即s期肿瘤细胞,从表8和表9结果以及图1-4可见:重水阻滞肿瘤细胞从s期进入g2期,重水与5-fu和吉西他滨联用后,使得5-fu和吉西他滨更有效地杀灭s期肿瘤细胞,s期肿瘤细胞明显减少,起协同增效作用。
[0226]
实施例20
[0227]
重水联合5-氟尿嘧啶腹腔灌注(洗)对艾氏腹水瘤(eac)小鼠的药效实验
[0228]
受试动物:icr小鼠,周龄:4-5w,性别:雄性,由上海西普尔-必凯实验动物有限公司提供。
[0229]
细胞株:艾氏腹水瘤细胞株由南京凯基生物科技发展有限公司提供。
[0230]
受试药品:5-氟尿嘧啶(5-fu)、实施例1制备的氯化钠重水溶液。
[0231]
实验方法:
[0232]
1.模型的制备:取eac腹水液,调整浓度为1x 107个/ml,以每只0.1ml接种于小鼠腹腔。
[0233]
2.分组与给药:接种后3天将动物随机分组。同时,各组小鼠开始给药,给药方案见表10。
[0234]
表10.组别及给药方案:
[0235][0236]
在表10中,“氯化钠重水溶液0.1ml/只+5-fu20mg/kg”表示每只小鼠给予氯化钠重水溶液0.1ml,并且将5-fu溶于氯化钠重水溶液中以达到20mg/kg的给药量。
[0237]
3.观测指标
[0238]
给药结束后,每组抽取三只小鼠腹水,计算腹水体积以及腹水中肿瘤细胞数量,其余各组动物继续饲养,观察每组动物中位生存时间(即median survival time,mst)来评价每组的生存时间。
[0239]
治疗组与对照组的比较,采用t/c(%)来表示,计算公式为:
[0240][0241]
t mst:治疗组mst;c mst:阴性对照组mst。
[0242]
评价标准以125%为界,当t/c%≥125%时。视为有效,反之则无效。
[0243]
4.统计处理
[0244]
均值用x
±
sd表示,组间分析用t检验进行统计学处理,应用spss(staffstical package for the social science)17.0对结果进行统计分析。
[0245]
5.结果:
[0246]
5.1生存期指标:腹腔注药对动物存活天数的影响
[0247]
表11.腹腔注药对动物存活天数的影响(n=8)
[0248]
组别mst(天)t/c(%)生理盐水(0.4ml/只)14.1
±
1.9 5-fu(20mg/kg)(生理盐水为溶媒)21.8
±
2.9*154.6%5-fu(30mg/kg)(生理盐水为溶媒)22.3
±
4.9*158.1%氯化钠重水溶液(0.4ml/只)17.2
±
3.2**121.9%氯化钠重水溶液(0.1ml/只)+5-fu(20mg/kg)21.4
±
3.1*151.7%氯化钠重水溶液(0.2ml/只)+5-fu(20mg/kg)24.1
±
2.7*170.9%氯化钠重水溶液(0.4ml/只)+5-fu(20mg/kg)25.7
±
2.6*182.2%
[0249]
与阴性对照组相比:*p《0.001,**p《0.05。
[0250]
表12.先氯化钠重水溶液腹腔灌洗,再腹腔注药对动物存活天数的影响(n=8)
[0251]
组别mst(天)t/c(%)生理盐水(0.4ml/只)15.3
±
1.9 氯化钠重水溶液(0.1ml/只)+5-fu(20mg/kg)26.1
±
3.7*170.5%氯化钠重水溶液(0.2ml/只)+5-fu(20mg/kg)29.1
±
3.1*190.1%氯化钠重水溶液(0.4ml/只)+5-fu(20mg/kg)34.5
±
3.3*225.4%
[0252]
与阴性对照组相比:*p《0.001。
[0253]
结果表明,重水氯化钠溶液+5-fu联用组与与生理盐水对照组相比,中位生存时间延长,p值《0.01,t/c(%)≥150%;也优于单用5-fu组。
[0254]
如先用氯化钠重水溶液腹腔灌洗后,再腹腔注药,可将小鼠中位生存期明显延长,超过仅用氯化钠重水溶液腹腔注药,分别为29.1
±
3.1天vs.24.1
±
2.7天;34.5
±
3.3天vs.25.7
±
2.6天,p值均《0.05,显示先用重水腹腔灌洗再注药具有优势。
[0255]
5.2腹水指标:给药结束后,用脱颈椎法处死实验各组小鼠各三只,常规消毒,无菌条件下开腹,收集腹水,计算体积。
[0256]
表13.氯化钠重水溶液腹腔注药对腹水量的影响(n=3)
[0257]
组别腹水量(ml)生理盐水(0.4ml/只)14.3
±
1.45-fu(20mg/kg)(生理盐水为溶媒)6.9
±
0.9*5-fu(30mg/kg)(生理盐水为溶媒)4.9
±
0.5*氯化钠重水溶液(0.4ml/只)9.9
±
0.3**氯化钠重水溶液(0.1ml/只)+5-fu(20mg/kg)7.0
±
1.3*氯化钠重水溶液(0.2ml/只)+5-fu(20mg/kg)5.9
±
0.5*氯化钠重水溶液(0.4ml/只)+5-fu(20mg/kg)4.7
±
0.3*
[0258]
与阴性对照组相比:*p《0.001,**p《0.05。
[0259]
表14.先氯化钠重水液腹腔灌洗后,再腹腔注药对腹水量的影响(n=3)
[0260]
组别腹水量(ml)
生理盐水(0.4ml/只)12.2
±
0.7氯化钠重水溶液(0.1ml/只)+5-fu(20mg/kg)5.8
±
0.7*氯化钠重水溶液(0.2ml/只)+5-fu(20mg/kg)3.3
±
0.1*氯化钠重水溶液(0.4ml/只)+5-fu(20mg/kg)2.6
±
0.1*
[0261]
与阴性对照组相比:*p《0.001。
[0262]
结果表明,与生理盐水对照组相比,氯化钠重水溶液组的腹水量减少,p《0.05;氯化钠重水溶液+5-fu联用组与单用5-fu组比较,腹水体积也有减少,分别为:7.0
±
1.3ml,5.9
±
0.5ml,4.7
±
0.3ml vs 6.9
±
0.9ml,p均《0.05。
[0263]
氯化钠重水溶液腹腔灌洗后,再腹腔注药组,腹水量明显減少于未灌洗的腹腔注药组,分别为5.8
±
0.7ml vs.7.0
±
1.3ml;3.3
±
0.1ml vs.5.9
±
0.5ml;2.6
±
0.1ml vs.4.7
±
0.3ml;p均《0.01,显示出先用重水腹腔灌洗再给药的优势。
[0264]
实施例21
[0265]
用重水联合顺铂和重水联合顺铂以及表柔比星腹腔内保留式温热(42℃)灌洗荷鼠对肝癌h22腹水瘤的抑制作用
[0266]
实验方法:
[0267]
动物:昆明小鼠,周龄:4-5w,性别:雄性,由上海西普尔-必凯实验动物有限公司提供。
[0268]
细胞株:肝癌h22腹水瘤细胞株由南京凯基生物科技发展有限公司提供。
[0269]
模型的制备:1
×
107/ml h22瘤细胞悬液0.2ml(含h22细胞数2
×
106),接种于小鼠腹腔。
[0270]
受试药品:顺铂、表柔比星、实施例5制备的林格重水溶液。
[0271]
分组与给药:接种7-8天小鼠成模后,随机分组每组18只。
[0272]
顺铂、表柔比星溶于42℃林格重水溶液中灌洗荷鼠腹腔。
[0273]
1).空白对照组(42℃普通林格注射液,10ml/kg);
[0274]
2).常规化疗组(顺铂0.6mg/kg+42℃普通林格注射液10ml/kg);
[0275]
3).重水小剂量+顺铂组(42℃林格重水溶液5ml/kg+顺铂0.6mg/kg);
[0276]
4).重水中剂量+顺铂组(42℃林格重水溶液20ml/kg+顺铂0.6mg/kg);
[0277]
5).重水高剂量+顺铂组(42℃林格重水溶液40ml/kg+顺铂0.6mg/kg);
[0278]
6).重水小剂量+顺铂组+表柔比星(42℃林格重水溶液5ml/kg+顺铂0.6mg/kg+表柔比星0.2mg/kg);
[0279]
7).重水中剂量+顺铂组+表柔比星(42℃林格重水溶液20ml/kg+顺铂0.6mg/kg+表柔比星0.2mg/kg);
[0280]
8).重水高剂量+顺铂组+表柔比星(42℃林格重水溶液40ml/kg+顺铂0.6mg/kg+表柔比星0.2mg/kg)。
[0281]
用上述组合物灌洗小鼠腹腔,给予后保留腹腔内10分钟,重复3次,隔天1次,连续5次,每天用药前测量小鼠的体重、腹围,并观察其日常生活状态。用药结束24h后(第11天)处死各组8只小鼠测量腹水量,并解剖小鼠观察腹腔脏器及肺脏的转移情况。其余剩下小鼠观察生存时间,计算生命延长率。
[0282]
4.观测指标:同实施例21。
[0283]
5.统计处理:同实施例21。
[0284]
6.结果:
[0285]
表15.42℃重水联合顺铂、表柔比星腹腔灌洗对动物存活天数的影响(表15.42℃重水联合顺铂、表柔比星腹腔灌洗对动物存活天数的影响(n=10)
[0286][0287]
与阴性对照组相比:*p《0.001。
[0288]
表16.42℃重水联合顺铂、表柔比星腹腔灌洗对腹水量的影响(n=8)
[0289][0290]
与阴性对照组相比:*p《0.001,**p《0.0001。
[0291]
顺铂是抗肿瘤药铂类制剂代表,表柔比星是广谱抗肿瘤抗生素,重水具有广谱抗肿瘤增效作用。结果表明,腹腔内温热(42℃)重水与顺铂以及表柔比星联用灌洗可明显延长荷h22腹水瘤小鼠生存时间,抑制荷h22腹水瘤小鼠腹水的生成,改善荷瘤小鼠生存质量,具抗肿瘤药效。
[0292]
实施例22
[0293]
用重水联合奥沙利铂和重水联合奥沙利铂以及丝裂霉素腹腔内保留式温热(42℃)灌洗荷鼠腹腔对肉瘤s180(腹水型)的抑制作用
[0294]
实验方法:
[0295]
动物:昆明小鼠,周龄:4-5w,性别:雄性,由上海西普尔-必凯实验动物有限公司提供。
[0296]
细胞株:肉瘤s180(腹水型)细胞株由南京凯基生物科技发展有限公司提供。
[0297]
模型的制备:1
×
107/ml s180瘤细胞悬液0.2ml,接种于小鼠腹腔。
[0298]
受试药品:奥沙利铂、丝裂霉素、实施例2制备的葡萄糖重水溶液。
[0299]
分组与给药:接种7-8天小鼠成模后,随机分组每组12只。
[0300]
奥沙利铂、丝裂霉素溶于42℃葡萄糖重水溶液内灌洗荷鼠腹腔。
[0301]
1).空白对照组(42℃普通5%葡萄糖注射液,5ml/kg);
[0302]
2).常规化疗组(奥沙利铂0.8mg/kg+42℃普通5%葡萄糖注射液5ml/kg);
[0303]
3).重水小剂量+奥沙利铂组(42℃葡萄糖重水溶液5ml/kg+奥沙利铂0.8mg/kg);
[0304]
4).重水中剂量+奥沙利铂组(42℃葡萄糖重水溶液20ml/kg+奥沙利铂0.8mg/kg);
[0305]
5).重水高剂量+奥沙利铂组(42℃葡萄糖重水溶液40ml/kg+奥沙利铂0.8mg/kg)。
[0306]
6).重水小剂量+奥沙利铂组+丝裂霉素(42℃葡萄糖重水溶液5ml/kg+奥沙利铂0.8mg/kg+丝裂霉素0.4mg/kg);
[0307]
7).重水中剂量+奥沙利铂组+丝裂霉素(42℃葡萄糖重水溶液20ml/kg+奥沙利铂0.8mg/kg+丝裂霉素0.4mg/kg);
[0308]
8).重水高剂量+奥沙利铂组+丝裂霉素(42℃葡萄糖重水溶液40ml/kg+奥沙利铂0.8mg/kg+丝裂霉素0.4mg/kg)。
[0309]
用42℃的葡萄糖重水溶液联合不同组合灌洗腹腔,给予后保留腹腔内10分钟,重复3次,隔天1次,连续5次,每天用药前测量小鼠的体重、腹围,并观察其日常生活状态。用药结束24h后(第11天)处死各组4只小鼠测量腹水量,并解剖小鼠观察腹腔脏器及肺脏的转移情况。其余剩下小鼠观察生存时间,计算生命延长率。
[0310]
4.观测指标:同实施例21。
[0311]
5.统计处理:同实施例21。
[0312]
6.结果:
[0313]
表17.重水联合奥沙利铂、丝裂霉素腹腔42℃灌洗对动物存活天数的影响(n=8)
[0314][0315]
与阴性对照组相比:*p《0.0001。
[0316]
表18.重水联合奥沙利铂、丝裂霉素腹腔42℃灌洗对腹水量的影响(表18.重水联合奥沙利铂、丝裂霉素腹腔42℃灌洗对腹水量的影响(n=8)
[0317][0318][0319]
与阴性对照组相比:*p《0.0001,**p《0.00001。
[0320]
奥沙利铂是第三代抗肿瘤药铂类制剂,丝裂霉素是抗肿瘤抗生素,对g0-s期肿瘤细胞敏感,重水具有广谱抗肿瘤增效作用,对s期肿瘤细胞也很敏感,联用加强抗肿瘤药效。结果表明,重水联合奥沙利铂、丝裂霉素腹腔内温热(42℃)重水灌洗同样可延长荷肉瘤
s180小鼠生存时间,抑制荷肉瘤s180小鼠腹水的生成。实施例21和实施例22说明重水与铂类制剂、抗肿瘤抗生素联用抑制不同肿瘤生长具有普遍适用性。
[0321]
实施例23
[0322]
重水联合5-氟尿嘧啶静脉注射对人结肠癌hct-116细胞裸鼠移植瘤的生长抑制作用
[0323]
动物:balb/c裸小鼠,鼠龄:6-7周,体重:18-20g,性别:雌性。由上海斯莱克实验动物有限公司提供。
[0324]
细胞株:人结肠癌hct-116细胞由南京凯基生物科技发展有限公司提供。
[0325]
受试药品:5-氟尿嘧啶(5-fu),实施例2制备的葡萄糖重水(5%)溶液(每100ml含5克葡萄糖)。
[0326]
实验方法:
[0327]
1模型的制备
[0328]
采用常规程序,取瘤种,复苏培养,收集培养的hct-116细胞悬液,加入无菌生理盐水制成浓度为1x107个/ml,以每只0.1ml接种于裸小鼠右侧腋窝皮下。
[0329]
2组别与给药方案
[0330]
裸鼠移植瘤用游标卡尺测量移植瘤直径,接种10天后,在肿瘤生长至100-110mm3时将动物随机分组,每组8只。同时开始给药,尾静脉注射给药,每3天1次,连续21天。使用测量瘤径的方法,动态观察受试样品的抗肿瘤效应,并记录动物体重,以观察受试样品的毒性。给药21天后随即处死裸鼠,手术剥取瘤块称重,拍照。同时常规分离骨髓有核细胞,提取细胞dna,用uv-260紫外分光光度仪测定od值,以od值作为dna含量的代表值,观察受试样品抑制dna合成的影响。
[0331]
实验共设7组,每组8只:
[0332]
①
阴性对照组:5%葡萄糖注射液10ml/kg。
[0333]
②
紫杉醇阳性药对照组:生理盐水稀释紫杉醇(8mg/kg)。
[0334]
③
5-fu大剂量阳性对照组:5%葡萄糖注射液稀释5-fu(30mg/kg)。
[0335]
④
5-fu小剂量对照组:5%葡萄糖注射液稀释5-fu(12mg/kg)。
[0336]
⑤
试验组一:葡萄糖重水溶液(5ml/kg)稀释5-fu(12mg/kg)。
[0337]
⑥
试验组二:葡萄糖重水溶液(10ml/kg)稀释5-fu(12mg/kg)。
[0338]
⑦
试验组三:葡萄糖重水溶液(20ml/kg)稀释5-fu(12mg/kg)。
[0339]
3观测指标
[0340]
①
以相对肿瘤体积评价抗肿瘤活性:
[0341]
肿瘤体积(tumor volume,tv)的计算公式为:
[0342]
tv=1/2
×a×
b2其中a、b分别表示长宽。
[0343]
根据测量的结果计算出相对肿瘤体积(relative tumor volume,rtv),计算公式为:
[0344]
rtv=v
t
/v0[0345]
其中v0为分笼给药时(即d0)测量所得肿瘤体积,v
t
为每一次测量时的肿瘤体积。
[0346]
相对肿瘤增殖率t/c(%),计算公式如下:
[0347][0348]
t
rtv
:治疗组rtv;c
rtv
:阴性对照组rtv
[0349]
疗效评价标准:t/c%》40%为无效;t/c%≤40%,并经统计学处理p《0.05为有效。
[0350]
②
以瘤重评价药物抗肿瘤活性:
[0351]
肿瘤生长抑制率(%),计算公式如下:
[0352][0353]
评价标准:肿瘤生长抑制率《40%为无效;肿瘤生长抑制率≥40%,并经统计学处理p《0.05为有效。
[0354]
③
以骨髓dna含量观察药物对骨髓的抑制作用,监测药物毒性。
[0355]
4统计处理
[0356]
均值用x
±
sd表示,组间分析用t检验进行统计学处理,应用spss(staffstical package for the social science)17.0对结果进行统计分析。
[0357]
5结果
[0358]
以移植瘤体积评价抗肿瘤活性:结果表明,重水联合小剂量5-fu对移植瘤有较好的抑瘤作用,给药21天后,分别为葡萄糖重水溶液(5ml/kg)联合5-fu组:瘤体积1.22
±
0.15cm3;葡萄糖重水溶液(10ml/kg)联合5-fu组:瘤体积1.45
±
0.25cm3;葡萄糖重水溶液(20ml/kg)联合5-fu组:瘤体积1.27
±
0.24cm3,与阴性对照组比较,t/c均《40%。而单用小剂量5-fu组瘤体积有減少,为2.27
±
0.30cm3,t/c为80.91%,》40%,未达到药学有效标准。由此可见,使用重水联合5-fu,重水明显提升了5-fu抗肿瘤效果,见图5。
[0359]
以移植瘤重评价抗肿瘤活性:结果表明,重水联合小剂量5-fu对移植瘤有较好的抑瘤作用,给药21天后,分别为葡萄糖重水溶液(5ml/kg)联合5-fu时,抑制率为56.32%;葡萄糖重水溶液(10ml/kg)联合与5-fu时,抑制率为53.70%;葡萄糖重水溶液(20ml/kg)联合5-fu时,抑制率为54.22%;与阴性对照组瘤重比较,t/c均》40%,p《0.001;全部达到药学有效标准。而单用小剂量5-fu组时,抑制率为23.64%,未达到药学有效标准。由此可见,使用重水联合5-fu,重水明显提升了5-fu抗肿瘤效果,见表19.和图6。
[0360]
表19.重水联合5-fu对人结肠癌hct-116细胞裸鼠移植瘤的影响(n=8)
[0361][0362]
与阴性对照组相比:*p《0.001,**p《0.05。肿瘤生长抑制率》40%,为药学有效。
[0363]
毒性减少:重要的是,在大剂量紫杉醇和5-fu阳性对照组中,虽然肿瘤生长抑制明显,但荷瘤鼠体重下降明显,自18.4
±
0.5克分别降至16.8
±
0.9克和17.4
±
0.5克,骨髓dna含量也减少,说明紫杉醇和5-fu对动物的毒性明显。而葡萄糖重水溶液仅联合三分之一的5-fu(10mg/kg)用量,可以达到大剂量紫杉醇和5-fu(30mg/kg)同样的药效(等效性),给药期间荷瘤鼠体重无减少,骨髓dna含量也无减少,没有紫杉醇和5-fu在大剂量时引起的相应毒性。由于抗肿瘤药毒性对临床病人具有较大危害,甚至某些体弱、老年病人无法接受,寻找毒副作用小、杀伤效果强的化疗药物,已成为肿瘤治疗领域中亟待解决的难题。因此重水联合小剂量5-fu使用,具有明显临床应用优势,见表19.图7。
[0364]
实施例24
[0365]
重水联合吉西他滨静脉注射对人乳腺癌mcf-7细胞裸鼠移植瘤的生长抑制作用
[0366]
动物:balb/c裸小鼠,6-7周,体重:18-20g,性别:雌性,由上海斯莱克实验动物有限公司提供。
[0367]
细胞株:人乳腺癌mcf-7细胞由南京凯基生物科技发展有限公司提供。
[0368]
受试药品:吉西他滨(gem)、实施例1制备的氯化钠重水溶液。
[0369]
实验方法:
[0370]
1模型的制备
[0371]
采用常规程序,取瘤种,复苏培养,收集培养的mcf-7细胞悬液,加入无菌生理盐水制成浓度为1x107个/ml,以每只0.1ml接种于裸小鼠右侧腋窝皮下。
[0372]
2组别与给药方案
[0373]
裸鼠移植瘤用游标卡尺测量移植瘤直径,接种10天后,在肿瘤生长至100-110mm3时将动物随机分组,每组8只。同时开始给药,尾静脉注射给药,每3天1次,连续21天。使用测量瘤径的方法,动态观察受试样品的抗肿瘤效应。同时记录动物体重,以观察受试样品的毒性。给药21天后随即处死裸鼠,手术剥取瘤块称重,拍照。同时常规分离骨髓有核细胞,提取细胞dna,用uv-260紫外分光光度仪测定od值,以od值作为dna含量的代表值,观察受试样品抑制dna合成的影响。
[0374]
实验共设7组,每组8只:
[0375]
实验共设7组:
[0376]
①
阴性对照组:生理盐水10ml/kg。
[0377]
②
紫杉醇阳性对照组:生理盐水稀释紫杉醇(8mg/kg)。
[0378]
③
吉西他滨阳性对照组:生理盐水稀释吉西他滨(20mg/kg)。
[0379]
④
吉西他滨小剂量对照组:生理盐水稀释吉西他滨(10mg/kg)。
[0380]
⑤
试验组一:氯化钠重水溶液(5ml/kg)稀释吉西他滨(10mg/kg)。
[0381]
⑥
试验组二:氯化钠重水溶液(10ml/kg)稀释吉西他滨(10mg/kg)。
[0382]
⑦
试验组三:氯化钠重水溶液(20ml/kg)稀释吉西他滨(10mg/kg)。
[0383]
3观测指标,同实施例23。
[0384]
4统计处理,同实施例23。
[0385]
5结果
[0386]
以移植瘤体积评价抗肿瘤活性:氯化钠重水溶液联合小剂量吉西他滨对移植瘤有较好的抑瘤作用,给药21天后,分别为氯化钠重水溶液(5ml/kg)联合吉西他滨组:瘤体积1.949
±
0.491cm3;氯化钠重水溶液(10ml/kg)联合吉西他滨组:瘤体积1.743
±
0.503cm3;氯化钠重水溶液(20ml/kg)联合吉西他滨组:瘤体积1.671
±
0.386cm3,与阴性对照组比较,t/c均《40%,达到药学有效标准。而单用小剂量吉西他滨组瘤体积仅有少量減少,为2.757
±
0.342cm3,t/c为60.39%,》40%,未达到药学有效标准。使用重水联合吉西他滨,重水明显提升了吉西他滨抗肿瘤效果,见图8。
[0387]
以移植瘤重评价抗肿瘤活性:氯化钠重水溶液联合小剂量吉西他滨对移植瘤有较好的抑瘤作用,给药21天后,分别为氯化钠重水溶液(5ml/kg)联合吉西他滨时抑制率为48.82%;氯化钠重水溶液(10ml/kg)联合吉西他滨时抑制率为57.78%;氯化钠重水溶液(20ml/kg)联合吉西他滨时抑制率为60.70%;与阴性对照组比较,p《0.001;t/c均》40%,达到药学有效标准。而单用小剂量吉西他滨组瘤重仅有少量减少,抑制率为39.18%,《40%,未达到药学有效标准。由此可见,重水明显提升了小剂量吉西他滨作用效果,见表20和图9。
[0388]
表20.重水联合吉西他滨对人乳腺癌mcf-7细胞裸鼠移植瘤的影响(n=8)
[0389][0390]
与阴性对照组相比:*p《0.001,**p《0.05。肿瘤生长抑制率》40%,为药学有效。
[0391]
毒性减少:重要的是,在实验期间,阴性对照组荷瘤鼠平均体重增加了3.3克;而紫杉醇阳性对照和吉西他滨阳性对照组,虽瘤重减少明显,但荷瘤鼠体重增加很少,骨髓dna含量也增加很少,说明紫杉醇和吉西他滨对动物有一定毒性。而氯化钠重水溶液联合二分之一剂量的吉西他滨(10mg/kg),可以达到紫杉醇(8mg/kg)和大剂量吉西他滨(20mg/kg)同样的药效(等效性),但荷瘤鼠体重增加与阴性对照组相似,骨髓dna含量也增加,没有紫杉醇和吉西他滨在大剂量时引起的相应毒性,由于抗肿瘤药毒性对临床病人具有较大危害,甚至某些体弱、老年病人无法接受,是临床抗肿瘤化疗难点之一,因此重水联合小剂量吉西他滨使用,具有明显临床使用优势。见表20和图10。
[0392]
5-fu和吉西他滨为细胞毒类抗肿瘤药中的抗代谢物,从实施例23和实施例24可见,重水可与抗代谢类抗肿瘤药联用,抑制不同肿瘤生长具有普遍适用性。
[0393]
实施例25
[0394]
重水与吉西他滨联用静脉注射对人肺癌a549细胞裸鼠移植瘤的生长抑制作用
[0395]
动物:balb/c裸小鼠,6-7周,体重:18-20g,性别:雌性,由上海斯莱克实验动物有限公司提供
[0396]
细胞株:人肺癌a549细胞由南京凯基生物科技发展有限公司提供。
[0397]
受试药品:吉西他滨(gem)、实施例1制备的氯化钠重水溶液。
[0398]
1.取瘤种复苏并接种,加入无菌生理盐水制成细胞悬液,接种于动物右上肢腋窝皮下。接种肿瘤细胞数约为5
×
106/只。
[0399]
2组别与给药方案
[0400]
裸鼠移植瘤用游标卡尺测量移植瘤直径,接种10天后,肿瘤生长至100-110mm3时将动物随机分组,每组8只。同时开始给药,尾静脉注射给药,每3天1次,连续21天。使用测量瘤径的方法,动态观察受试样品的抗肿瘤效应。同时记录动物体重,观察受试样品的毒性。给药21天后随即处死裸鼠,手术剥取瘤块称重,拍照。
[0401]
实验共设7组:
[0402]
①
生理盐水对照组:生理盐水10ml/kg。
[0403]
②
紫杉醇阳性对照组:生理盐水稀释紫杉醇(8mg/kg)。
[0404]
③
吉西他滨阳性对照组:生理盐水稀释吉西他滨(20mg/kg)。
[0405]
④
吉西他滨小剂量对照组:生理盐水稀释吉西他滨(10mg/kg)。
[0406]
⑤
试验组一:氯化钠重水溶液(5ml/kg)稀释吉西他滨(10mg/kg)。
[0407]
⑥
试验组二:氯化钠重水溶液(10ml/kg)稀释吉西他滨(10mg/kg)。
[0408]
⑦
试验组三:氯化钠重水溶液(20ml/kg)稀释吉西他滨(10mg/kg)。
[0409]
3观测指标,同实施例23。
[0410]
4统计处理,同实施例23。
[0411]
5结果:
[0412]
以移植瘤体积和瘤重评价抗肿瘤活性:结果表明,给药21天后,单用吉西他滨小剂量组与生理盐水对照组比较,瘤重有减少,2.23
±
0.2克,抑制率为23.6%,但尚未达到药学有效标准。如氯化钠重水注射液与吉西他滨联用,与生理盐水对照组比较,对移植瘤均有较好的抑瘤作用,瘤重有显著差异;分别为氯化钠重水溶液5ml与吉西他滨联用:瘤重1.34
±
0.38克,肿瘤增殖率为54.22%;氯化钠重水溶液10ml与吉西他滨联用:瘤重1.35
±
0.34克,肿瘤增殖率为53.70%;氯化钠重水溶液20ml与吉西他滨联用:瘤重1.28
±
0.46克,肿瘤增殖率为56.32%;p均《0.001;全部达到药学有效标准,结果见图11、12。
[0413]
表21.氯化钠重水注射液对人肺癌裸鼠移植瘤瘤重的影响(n=8)
[0414][0415]
与对照组相比:*p《0.001,瘤重抑制率大于药学40%,为有效。
[0416]
重要的是,在紫杉醇阳性对照组和吉西他滨阳性对照组中,虽瘤重减少明显,瘤重分别为0.94
±
0.25和1.04
±
0.13克,肿瘤増殖率分别为67.97和64.54%;但荷瘤鼠体重几乎没有增加,说明紫杉醇和吉西他滨对动物毒性明显。而重水与小剂量吉西他滨联用,可以达到大剂量紫杉醇和吉西他滨同样的等效性,又没有相应毒性,给药期荷瘤鼠体重增加。结果见表21和图13。
[0417]
实施例26
[0418]
重水与紫杉醇联用静脉注射对人卵巢癌skov3细胞裸鼠移植瘤的生长抑制作用
[0419]
动物:balb/c裸小鼠,鼠龄:6-7周,体重:18-20g,性别:雌性,由上海斯莱克实验动物有限公司提供。
[0420]
细胞株:卵巢癌skov3细胞由南京凯基生物科技发展有限公司提供。
[0421]
受试药品:紫杉醇,实施例1制备的氯化钠重水溶液。
[0422]
实验方法:
[0423]
1.取瘤种复苏并接种
[0424]
取瘤种复苏并接种,加入无菌生理盐水制成细胞悬液,接种于动物右上肢腋窝皮下。接种肿瘤细胞数约为5
×
106/只。
[0425]
2.组别与给药方案
[0426]
裸鼠移植瘤用游标卡尺测量移植瘤直径,接种10天后,在肿瘤生长至100-110mm3时将动物随机分组。同时开始给药,尾静脉注射给药,每3天1次,连续21天。记录动物体重,观察受试样品的毒性。给药21天后随即处死裸鼠,手术剥取瘤块称重。
[0427]
实验共设6组,每组5只:
[0428]
①
生理盐水对照组:生理盐水10ml/kg。
[0429]
②
紫杉醇阳性对照组:生理盐水稀释紫杉醇(8mg/kg)。
[0430]
③
氯化钠重水溶液(10ml/kg)
[0431]
④
试验组一:氯化钠重水溶液(5ml/kg)稀释紫杉醇(8mg/kg)。
[0432]
⑤
试验组二:氯化钠重水溶液(10ml/kg)稀释紫杉醇(8mg/kg)。
[0433]
⑥
试验组三:氯化钠重水溶液(20ml/kg)稀释紫杉醇(8mg/kg)。
[0434]
3观测指标,同实施例23。
[0435]
4统计处理,同实施例23。
[0436]
结果见表22。
[0437]
表22.氯化钠重水溶液联合紫杉醇对人卵巢癌skov3细胞裸鼠移植瘤瘤重的影响(n=5)
[0438][0439]
与对照组相比:*p《0.01.
[0440]
紫杉醇是重要的抗肿瘤植物药,有不同种类,包括紫杉醇、紫杉醇脂质体、紫杉醇
白蛋白型、多西紫杉醇,作用机理类似。结果表明,给药21天后,氯化钠重水溶液10ml/kg和20ml/kg与紫杉醇8mg/kg联用组与模型组(生理盐水)比较,对荷瘤裸鼠人卵巢癌skov3细胞移植瘤有较好的抑瘤作用,肿瘤瘤重显著差异,肿瘤抑制率t/c在21天为54.9%,p《0.001;而单用紫杉醇8mg/kg组与模型组比较,虽有减少,但未达药效标准》40%。氯化钠重水溶液5ml/kg+紫杉醇12mg/kg联用组与模型组(生理盐水)比较,虽有减少,但未达药效标准》40%。重水作为广谱抗肿瘤增效剂,亦增强抗肿瘤植物药的药效。
[0441]
实施例27
[0442]
重水与塞替派联用静脉注射对人膀胱癌5637细胞裸鼠移植瘤的生长抑制作用
[0443]
动物:balb/c裸小鼠,鼠龄:6-7周,体重:18-20g,性别:雌性,由上海斯莱克实验动物有限公司提供。
[0444]
细胞株:人膀胱癌5637细胞由南京凯基生物科技发展有限公司提供。
[0445]
受试药品:塞替派、实施例1制备的氯化钠重水溶液。
[0446]
实验方法:
[0447]
1.取瘤种复苏并接种
[0448]
取瘤种复苏并接种,加入无菌生理盐水制成细胞悬液,接种于动物右上肢腋窝皮下。接种肿瘤细胞数约为5
×
106/只。
[0449]
2.组别与给药方案
[0450]
裸鼠移植瘤用游标卡尺测量移植瘤直径,接种10天后,在肿瘤生长至100-110mm3时将动物随机分组。同时开始给药,尾静脉注射给药,每3天1次,连续21天。记录动物体重,观察受试样品的毒性。给药21天后随即处死裸鼠,手术剥取瘤块称重。
[0451]
实验共设6组,每组5只:
[0452]
①
生理盐水对照组:生理盐水10ml/kg。
[0453]
②
紫杉醇阳性对照组:生理盐水稀释塞替派(0.2mg/kg)。
[0454]
③
试验组一:氯化钠重水溶液(1ml/kg)稀释塞替派(0.2mg/kg)。
[0455]
④
试验组二:氯化钠重水溶液(10ml/kg)稀释塞替派(0.2mg/kg)。
[0456]
⑤
试验组三:氯化钠重水溶液(20ml/kg)稀释塞替派(0.2mg/kg)。
[0457]
3观测指标,同实施例23。
[0458]
4统计处理,同实施例23。
[0459]
结果表明,给药21天后,氯化钠重水溶液10ml/kg和20ml/kg二种剂量与塞替派0.2mg/kg联用时,与模型组(生理盐水)比较,对荷瘤裸鼠人膀胱癌56373细胞移植瘤有较好的抑瘤作用,肿瘤瘤重显著差异,肿瘤抑制率t/c在21天分别为47.0%和63.4%,p《0.01和p《0.001;而单用塞替派0.2mg/kg组与模型组比较,无有效差异。氯化钠重水溶液5ml/kg+塞替派0.2mg/kg联用组与模型组(生理盐水)比较,无有效差异。结果见表23。
[0460]
表23.氯化钠重水溶液联合塞替派对人膀胱癌56373细胞裸鼠移植瘤瘤重的影响(n=5)
[0461][0462]
与对照组相比:*p《0.01,**p《0.001。
[0463]
塞替派为乙撑亚胺类烷基化剂,参与鸟嘌呤结合,影响dna合成,对多种肿瘤细胞有效,特别是对膀胱癌细胞,重水联合塞替派使用,可见协同增加塞替派抗膀胱癌56373细胞效果,使癌细胞生长抑制率由单用时39%升高到54%-63.4%,验证了重水作为广谱抗肿瘤增效剂的功能,但重水在很小剂量(1ml/kg)时,效果不明显。
[0464]
实施例28
[0465]
重水联合贝伐单抗静脉注射对人胰腺癌panc-1细胞裸鼠移植瘤微血管密度的抑制作用
[0466]
动物:balb/c裸小鼠,鼠龄:6-7周,体重:18-20g,性别:雌性。由上海斯莱克实验动物有限公司提供。
[0467]
细胞株:人胰腺癌panc-1细胞由南京凯基生物科技发展有限公司提供。
[0468]
受试药品:贝伐单抗(bevacizumab,avastin,roche公司),实施例1制备的氯化钠重水溶液。
[0469]
实验方法:
[0470]
1模型的制备
[0471]
采用常规程序,取瘤种,复苏培养,收集培养的panc-1细胞悬液,加入无菌生理盐水制成浓度为1x107个/ml,以每只0.1ml接种于裸小鼠右侧腋窝皮下。
[0472]
2组别与给药方案
[0473]
用游标卡尺测量裸鼠移植瘤直径,接种10天后,在肿瘤生长至100-110mm3时将动物随机分组。同时开始给药,尾静脉注射给药,每3天1次,连续14天。记录动物体重,以观察受试样品的毒性。给药14天后停药1周,处死裸鼠,手术剥取瘤块称重并检查微血管密度(mvd),采用标准envisiontm法进行染色,以weidner微血管方法计数微血管量,在100倍镜下观察全视野,选取肿瘤微血管密度最高区计数,以400倍镜下计数3个高倍视野内微血管数,取其平均值为mvd值。
[0474]
实验共设4组,每组5只:
[0475]
①
阴性对照组:0.9%氯化钠注射液10ml/kg。
[0476]
②
贝伐单抗阳性对照组:0.9%氯化钠注射液稀释贝伐单抗(5mg/kg)。
[0477]
③
试验组一:氯化钠重水溶液(10ml/kg)稀释贝伐单抗(5mg/kg)。
[0478]
④
试验组二:氯化钠重水溶液(20ml/kg)稀释贝伐单抗(5mg/kg)。
[0479]
3观测指标,同实施例23。
[0480]
4统计处理,同实施例23。
[0481]
5结果,见表24,25。
[0482]
表24.重水联合贝伐单抗对移植瘤瘤重的影响(n=5)
[0483]
组别瘤重(g)生长抑制率(%)阴性对照组1.97
±
0.29 贝伐单抗阳性对照组1.12
±
0.17*43.1氯化钠重水溶液(10ml/kg)稀释贝伐单抗(5mg/kg)1.04
±
0.13*47.2氯化钠重水溶液(20ml/kg)稀释贝伐单抗(5mg/kg)0.93
±
0.2*53.7
[0484]
与阴性对照组相比:*p《0.01。
[0485]
表25.重水联合贝伐单抗对微血管密度(mvd)的影响(n=5)
[0486]
组别mvd阴性对照组31.10
±
4.47贝伐单抗阳性对照组22.40
±
3.22*氯化钠重水溶液(10ml/kg)稀释贝伐单抗(5mg/kg)18.80
±
1.58*氯化钠重水溶液(20ml/kg)稀释贝伐单抗(5mg/kg)16.60
±
1.92*
[0487]
与阴性对照组相比:*p《0.05。
[0488]
肿瘤组织生长时需大量血液供应,贝伐单抗是微血管生长抑制剂,当肿瘤组织内微血管生长受抑制,微血管减少,血液供应减少。结果表明,重水作为广谱抗肿瘤增效剂,也可以增强贝伐单抗减少肿瘤组织微血管密度(mvd)的作用,减少胰腺癌panc-1细胞的血液供应,进而抑制肿瘤生长。
[0489]
实施例29
[0490]
药物安全性研究:氯化钠重水溶液静脉给药毒性试验
[0491]
试验方法:
[0492]
sd大鼠,6-7周,雌雄各半,雄:280-338克,雌:212-268克,由北京维通利华实验动物公司提供。
[0493]
受试品:实施例1制备的氯化钠重水溶液。
[0494]
试验一单次给药观察毒性
[0495]
给药:采用最大给药量方法,采用实施例1制备的氯化钠重水溶液2ml/100g,静脉推注,给药速度2ml/min,共20只大鼠,雌雄各半。对照组给予同体积的0.9%氯化钠注射液,共10只大鼠,雌雄各半。
[0496]
表26.给药分组表
[0497][0498]
*表示对照组给予同体积的0.9%氯化钠注射液。
[0499]
试验结果:
[0500]
1.一般症状观察
[0501]
大鼠氯化钠重水溶液单次静脉给药毒性试验按照最大给药体积20ml/kg给予受试物。给药后供试品组动物均立即出现活动减少、呼吸急促以及小便量增多的症状,上述症状在给药后1小时内可恢复,其余未发现明显异常情况。
[0502]
连续观察14天,每天至少观察1次,动物外观体征、行为活动、粪便性状均未见异常并未见死亡。
[0503]
2.体重
[0504]
试验期间动物一般状况良好、体重增长呈正常趋势。
[0505]
表27.氯化钠重水溶液单次静脉毒性试验大鼠体重变化(雄性)(g,)
[0506]
组别给药后0天给药后7天给药后14天氯化钠重水溶液304.40
±
21.10333.00
±
21.47360.50
±
16.30对照组309.40
±
10.09334.80
±
9.58364.40
±
11.19
[0507]
注:氯化钠重水溶液组n=10,对照组n=5。
[0508]
表28.大鼠氯化钠重水溶液单次静脉给药毒性试验大鼠体重变化(雌性)(g,)
[0509]
组别给药后0天给药后7天给药后14天氯化钠重水溶液248.80
±
17.08264.20
±
19.58275.80
±
19.45对照组250.20
±
6.22267.60
±
10.97278.40
±
11.72
[0510]
注:氯化钠重水溶液组n=10,对照组n=5。
[0511]
讨论:供试品氯化钠重水溶液大鼠单次静脉给药毒性试验给予氯化钠重水溶液,按照最大给药体积20ml/kg给予受试物。给药后时发现后有活动减少、呼吸急促等症状,其余未发现与供试品给药相关毒性,连续观察2周,动物体重正常增长并未出现死亡现象。根据本次试验结果,供试品氯化钠重水溶液大鼠单次静脉给药的最小致死量(mld)大于20ml/kg。
[0512]
试验二多次重复给药观察毒性
[0513]
给药:采用多次重复最大给药量方法,采用实施例1制备的氯化钠重水溶液2ml/100g,静脉推注,给药速度2ml/min,每天一次,连续五天。共20只大鼠,雌雄各半。对照组给予同体积的0.9%氯化钠注射液,共10只大鼠,雌雄各半。
[0514]
表29.给药分组表
[0515][0516]
*表示对照组给予同体积的0.9%氯化钠注射液。
[0517]
试验结果:
[0518]
1.一般症状观察
[0519]
大鼠氯化钠重水溶液多次重复静脉给药毒性试验,按照最大给药体积20ml/kg给予受试物,每天一次,连续五天。每次给药后供试品组动物均立即出现活动减少、呼吸急促
以及小便量增多的症状,上述症状在给药后1小时内可恢复,其余未发现明显异常情况。
[0520]
连续观察3个月,每天至少观察1次,动物外观体征、行为活动、粪便性状均未见异常并未见死亡。
[0521]
2.体重
[0522]
试验期间动物一般状况良好、体重增长呈正常趋势。
[0523]
表30.氯化钠重水溶液多次重复静脉给药毒性试验大鼠体重变化(雄性)(g,)
[0524]
组别给药后0天给药后30天给药后90天氯化钠重水溶液305.20
±
20.90352.00
±
31.72452.40
±
30.14对照组303.20
±
11.10361.01
±
29.65461.91
±
31.19
[0525]
注:氯化钠重水溶液组n=10,对照组n=5。
[0526]
表31.大鼠氯化钠重水溶液多次重复静脉给药毒性试验大鼠体重变化(雌性)(g,)
[0527]
组别给药后0天给药后30天给药后90天氯化钠重水溶液243.52
±
14.88293.20
±
18.83395.63
±
29.54对照组251.28
±
11.22298.12
±
14.67405.42
±
26.12
[0528]
注:氯化钠重水溶液组n=10,对照组n=5。
[0529]
供试品氯化钠重水溶液大鼠多次重复静脉给药毒性试验给予氯化钠重水溶液,按照最大给药体积20ml/kg给予受试物。给药后时发现后有活动减少、呼吸急促等症状,其余未发现与供试品给药相关毒性,连续观察3月,动物体重正常增长并未出现死亡现象。根据本次试验结果,供试品氯化钠重水溶液大鼠多次重复静脉给药的最小致死量(mld)大于20ml/kg。
[0530]
虽然已经展示和讨论了本发明的一些方面,但是本领域的技术人员应该意识到,可以在不背离本发明原理和精神的条件下对上述方面进行改变,因此本发明的范围将由权利要求以及等同的内容所限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1