一种禽大肠杆菌病三价灭活疫苗及其制备方法
1.本发明属于生物技术领域,具体地说,本发明涉及一种禽大肠杆菌病三价灭活疫苗及其制备方法。
背景技术:
2.禽致病性大肠杆菌病是由某些特定血清型的致病性大肠杆菌(pathogenicescherichia coli)通过多种途径感染不同日龄、品种的鸡,引发不同日龄、品种鸡的急性败血症、肝周炎等多种症状,尤其对雏鸡具有很高的感染率和死亡率,常常继发多种病毒性、呼吸道性疾病等,是影响养鸡业发展的主要细菌性疾病之一。
3.禽致病性大肠杆菌(avian pathogenic escherichia coli,apec)血清型繁多,国内外研究表明了apec的致病性血清多数以o1、o2、o35、o36、o78型血清群是最为主要的致病血清型,不同的区域流行的血清型不同,其致病性也存在差异。
4.此外,apec亦是通过其携带质粒和遗传物质交换而传播耐药基因的主要来源。多年的生产实践表明,通过消除易感因素或通过药物防控禽大肠杆菌病效果甚微,且随着耐药菌株不断产生及药物残留问题的增加,禽产品质量安全愈来愈受到人们的重视。因此,利用非抗生素方法防控apec将是未来发展的必然趋势,其中接种疫苗是有效防控禽大肠杆菌病发生和流行、减少禽产品污染及保证食品安全的重要途径。
5.基因工程类疫苗由于其生产成本较高、生物安全难以保证,在实际生产中不如灭活疫苗应用广泛,目前市面上所流通的大肠杆菌灭活疫苗多为蜂胶佐剂疫苗,且多是针对o78型单一血清型进行保护,但大肠杆菌疫苗对不同血清型的交叉保护能力较差,故应针对优势流行血清型制备多价疫苗以提供保护。已有产品采用蜂胶佐剂制苗虽然具有较好的安全性,但蜂胶佐剂制苗难以产生较高的保护力,因此应该寻找对家禽产生较小副作用且制苗后具有较高保护力的佐剂。
技术实现要素:
6.本发明的目的在于提供o36、o78、o109血清型禽致病性大肠杆菌,致病性较强,灭活后能保留较强免疫原性,适合用于制备治疗禽大肠杆菌病的药物。本发明另一个目的是提供一种禽大肠杆菌病三价灭活疫苗,能够诱导产生较高的抗体水平,并且能够保护当前流行的大肠杆菌o78、o36和o109等血清型强毒株的感染。
7.本发明采用如下技术方案:
8.一株禽致病性大肠杆菌菌株,为大肠埃希氏菌(escherichia coli)ec-yp1907-106,已于2021年12月1日保藏于中国典型培养物保藏中心,保藏地址为:中国,武汉,武汉大学,其保藏号为cctcc m 20211519可用于预防o109血清型禽致病性大肠杆菌感染,一次免疫后,保护效果为 90%以上。
9.本发明所述禽致病性大肠杆菌菌株在制备疫苗中的应用。
10.本发明提供所述保藏号为cctcc m 20211519的禽致病性大肠杆菌灭活疫苗。
11.本发明还提供,该疫苗含有灭活的o109、o36和o78三种血清型大肠埃希氏菌,三种大肠埃希氏菌分别经通气培养后收获菌液再经灭活,再混合后而制成灭活疫苗。
12.本发明提供的疫苗中,o36血清型大肠埃希氏菌,其保藏号为cctcc m20211520,o78血清型大肠埃希氏菌,其保藏号为cctcc m 20211518,均已于 2021年12月1日保藏于中国典型培养物保藏中心,保藏地址为:中国,武汉,武汉大学。
13.可用于预防o109、o78、o36血清型禽致病性大肠杆菌感染,一次免疫后,保护效果为80%以上。
14.本发明的所述禽致病性大肠杆菌灭活疫苗中,灭活的各大肠埃希氏菌菌株的抗原含量大于等于1.2
×
10
10
cfu/ml。
15.本发明所述的疫苗中,还包含佐剂。
16.本发明所述的疫苗中,所述佐剂为铝胶佐剂或医用白油佐剂。
17.本发明所述禽致病性大肠杆菌灭活疫苗的方法,其包括如下步骤:
18.1)制备禽致病性大肠杆菌菌株灭活抗原
19.取所述禽致病性大肠杆菌菌株接种于lb培养基中培养,并分别进行一级和二级种子繁殖;然后转接培养,并进行灭活处理;
20.2)配制疫苗
21.将灭活处理的菌液稀释或浓缩,使灭活前活菌数大于等于1.2
×
10
10
cfu/ml;取灭活菌液与佐剂按3:1体积比进行混匀,搅拌并乳化处理,得所述禽致病性大肠杆菌灭活疫苗。
22.具体地,步骤1)中所述转接培养的条件为二级种子液按照体积比1:100转接至摇瓶中,37℃震荡摇床180r/min,发酵至三小时后,每0.5h测定一次od
600
,当发酵液od
600
测定为1.3时,停止发酵。通过高速冷冻离心机4℃,8000r/min 离心15min,弃上清,采用原体积发酵液的1/20体积的生理盐水重悬菌泥,充分震荡混匀后取100μl菌液倍比稀释后通过活菌计数确定各菌液的终浓度;
23.所述灭活处理采用所述菌液加入体积比0.5%甲醛溶液,37℃摇床100r/min 灭活48h。
24.本发明以ec-yg1908-580、ec-yp1907-106、ec-yp1907-54菌株为疫苗制备用菌株,医用白油或者铝胶作为佐剂,通过不同批次的动物实验确定疫苗的安全性、免疫剂量、疫苗抗原含量、免疫保护期以达到最佳免疫保护效果。并通过免疫保护实验中鸡群的死亡率、发病率以及通过酶联免疫吸附试验对鸡群体内的抗体水平评估数据,确定该疫苗的免疫效果优于同类产品。
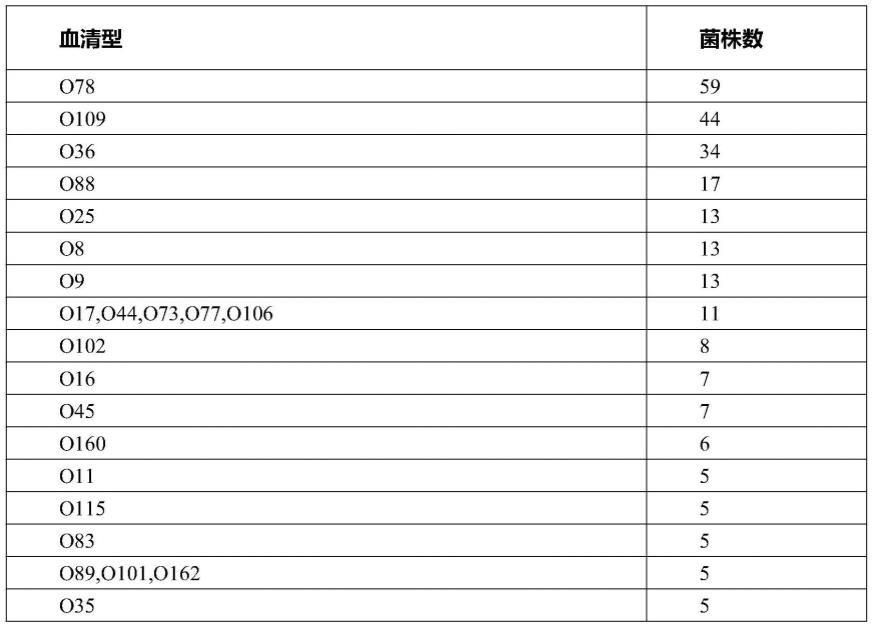
25.本发明的有益效果为:
26.1.本疫苗候选菌株来源于多个省市的病料的分离株并通过血清学分型、毒力基因检出分析以及雏鸡致病性试验共同确定的;
27.2.本疫苗的菌种是通过甲醛溶液灭活的;
28.3.本疫苗的佐剂可采用医用白油佐剂或铝胶佐剂,二者制苗后均可产生对鸡群很好的保护作用,且不影响鸡群的生长性能。
29.4.本疫苗对于蛋鸡以及肉鸡均具有保护作用。
30.综上所述,禽大肠杆菌o9、o78、o109各单价苗对于同型菌株的感染能够做到较好的保护效果,但仅针对相同的单一血清型禽大肠杆菌进行保护,交叉保护效果不理想。因此,针对目前主要流行的o78、o9和o109血清型,本发明研发了禽大肠杆菌病三价灭活疫苗以达到能够同时对这三种血清的大肠杆菌的感染进行保护并且选用黏度较低的白油佐剂或者铝胶佐剂疫苗免疫后抗体产生时间、维持水平均优于蜂胶佐剂。
31.综上所述,本发明所研发的禽大肠杆菌三价灭活疫苗,具有良好的免疫原性,免疫动物后结果表明对鸡只安全,能够诱导产生较高的抗体水平,并且能够保护当前流行的大肠杆菌o78、o36和o109等血清型强毒株的攻击,产生理想的保护效果,有广阔的应用前景。
具体实施方式
32.以下结合实施例对本发明作进一步说明,但不用来限制本发明的范围。实施例中采用的仪器、试剂等,如无特别说明,均为现有技术中已有的常规仪器、试剂,可通过商业途径获得。
33.本发明所提供的禽致病性大肠杆菌(escherichia coli) ec-yg1908-580、ec-yp1907-106、ec-yp1907-54是从发病鸡器官组织中筛选并培养获得的强毒株,通过完全灭活后,降低致病性,但保留免疫原性,使用该菌来制备灭活疫苗,以对家禽提供更完善的免疫保护。上述菌株在麦康凯培养基上的菌落形态特征:鲜桃红色或微红色,菌落中心呈深桃红色、圆形、扁平、边缘整齐、表面光滑、湿润。在营养琼脂培养基上呈圆形边缘整齐、表面光滑、半透明、小凸起。其生化特性表现为:甲基红试验呈阳性,吲哚产生和乳糖发酵是阳性。
34.下面结合实施例对本发明进行详细的描述。
35.实施例1:菌株的分离纯化及理化性质分析
36.(1)禽大肠杆菌分离鉴定
37.无菌采集因禽大肠杆菌病淘汰鸡的心脏、肝脏、脾脏等器官,接种环蘸取切面后在麦康凯琼脂平板上三区划线,挑选单菌落增菌纯化培养后通过测序鉴定,确定为大肠杆菌后即将菌液与50%的甘油1:1混合冻存于-20℃冰箱进行短期保存。
38.(2)禽大肠杆菌血清型鉴定
39.将已经纯化并用甘油保藏的大肠杆菌按照体积比1:100转接于1mllb培养基中在37℃、180r/min的摇床上震荡培养12h进行活化增菌,增菌液作为血清型分型的模板,通过玻片凝集方法对352株大肠杆菌进行血清型分型鉴定,部分主要血清型如表1。其中如表1所示,优势血清型的是o78、o109、o36血清型。
40.表1部分血清型鉴定结果
[0041][0042][0043]
(3)禽大肠杆菌毒力基因检测
[0044]
对筛选出的优势血清菌株以及文献中报道的致病性血清菌株进行18对毒力基因的检测,这些毒力基因包含黏附素相关基因:fimh、tsh;铁相关基因:iucc,、 iuta、iron、sita、feob、iucd;热稳定毒素:asta、保护素相关基因:trat、iss、 ompt、cvac;菌毛基因:fimc;耶尔森菌毒力岛:irp2、fyua;其他毒力基因: colv、hlye。对各个毒力基因的检出率进行统计,并根据毒力基因检出个数对优势血清型大肠杆菌菌株进一步筛选。
[0045]
在18个毒力基因中,fimh、feob检出率为100%;iron、sita、iss、fimc、asta 这5个毒力基因检出率在90%以上;iucc、iuta、trat、ompt、iucd这5个毒力基因检出率在80%以上;colv、hlye这2个毒力基因检出率为0%;其余毒力基因检出率较低,对于检出率较高的毒力基因提示其可能为保守毒力基因,具体检出结果见表2。
[0046]
表2 o35、o36、o78、o109血清型大肠杆菌各毒力基因检出结果
[0047]
[0048][0049]
实施例2:疫苗候选菌株的筛选
[0050]
雏鸡致病性试验
[0051]
如表3,依据血清型、毒力基因检出个数筛选出d580(o78)、d573(o78)、d224(o35)、d106(o109)、d104(o36)、d54(o36)这6株菌进行雏鸡致病性试验,筛选出强毒株作为疫苗候选菌株。
[0052]
表3 o109、o78、o36、o35血清型菌株雏鸡致病性试验结果
[0053]
[0054][0055]
依照菌株致病性判定标准,这6株菌都归属于高致病菌株,其中挑选 d580(o78)、d106(o109)、d54(o36)这3株毒力较强的apec作为疫苗制备菌株,分别命名为escherichia coli ec-yg1908-580、escherichia coli ec-yp1907-106、escherichia coli ec-yp1907-54。并于2021年12月 1日保藏于中国典型培养物保藏中心,保藏地址为:中国,武汉,武汉大学,保藏编号分别为cctcc m 20211518、cctcc m 20211519、cctcc m 20211520。
[0056]
实施例3:禽大肠杆菌o36、o78、o109三价灭活疫苗免疫效力检测
[0057]
(1)禽大肠杆菌o36、o78、o109各单价苗的制备
[0058]
将已活化的ec-yg1908-580、ec-yp1907-106、ec-yp1907-54接种到lb中复苏后,划线接种于lb平板上,置培养箱中37℃震荡培养过夜,次日挑选单菌落分别进行一级和二级种子繁殖,二级种子的菌液按照1:100接种于摇瓶,于37℃震荡摇床180r/min增菌发酵,发酵至三小时后,每0.5h测定一侧od
600
,当od
600
达到1.3时,停止发酵,通过高速冷冻离心机4℃,8000r/min离心15min进行集菌,弃掉上清,采用原体积发酵液的1/20体积的生理盐水重悬菌泥,充分震荡后每种血清型菌株各取100μl菌液倍比稀释后通过活菌计数确定最终各菌液的菌量。
[0059]
将调好浓度的3种血清型菌株分别加总体积的0.5%的甲醛溶液,将菌液放 37℃摇床100r/min灭活48h,灭活24h与灭活48h时应进行无菌检验,依现行《中国兽药典》附录进行无菌检验,确保无活菌生长,灭活完全。
[0060]
铝胶佐剂制苗:将各血清型灭活完成的菌液与铝胶佐剂按照体积比3:1混合,装入密封的容器内放于摇床上4℃,300r/min充分混匀12h并加入终浓度为 0.01%硫柳汞,乳化完成后即为禽大肠杆菌各单价灭活疫苗,该疫苗中每株菌的含量为1.2
×
10
10
cfu/ml。
[0061]
白油佐剂制苗:将各血清型灭活完成的菌液与白油佐剂按照体积比3:1混合,装入密封的容器内,通过恒速强力电动搅拌机对疫苗进行充分乳化,并加入终浓度为0.01%硫柳汞,混匀后即为禽大肠杆菌各单价灭活疫苗,该疫苗中每株菌的含量为1.2
×
10
10
cfu/ml。
[0062]
(2)禽大肠杆菌病三价灭活疫苗制备
[0063]
将已活化的ec-yg1908-580、ec-yp1907-106、ec-yp1907-54接种到lb中复苏后,划线接种于lb平板上,置培养箱中37℃震荡培养过夜,次日挑选单菌落分别进行一级和二级种子繁殖,二级种子的菌液按照1:100接种于摇瓶,于37℃震荡摇床180r/min增菌发酵,发酵至三小时后,每0.5h测定一侧od
600
,当od
600
达到1.3时,停止发酵,通过高速冷冻离心机4℃,8000r/min离心15min进行集菌,弃掉上清,采用原体积发酵液的1/20体积的生理盐水重悬菌泥,充分震荡后每种血清型菌株各取100μl菌液倍比稀释后通过活菌计数确定最终各菌液的菌量。
[0064]
将调好浓度的3种血清型菌株分别加总体积的0.5%的甲醛溶液,将菌液放 37℃摇床100r/min灭活48h,灭活24h与灭活48h时应进行无菌检验,依现行《中国兽药典》附录进行无菌检验,确保无活菌生长,灭活完全。
[0065]
铝胶佐剂制苗:将3种血清型灭活完成的菌液等体积混合在一起并与铝胶佐剂按照体积比3:1混合,装入密封的容器内放于摇床上4℃,300r/min充分混匀 12h并加入终浓度为0.01%硫柳汞,乳化完成后即为禽大肠杆菌病铝胶佐剂三价灭活疫苗,该疫苗中每株菌的含量为1.2
×
10
10
cfu/ml。
[0066]
油佐剂制苗:将3种血清型灭活完成的菌液等体积混合在一起并与油佐剂按照体积比3:1混合,通过恒速强力电动搅拌机对疫苗进行充分乳化,并加入终浓度为0.01%硫柳汞,乳化完成后即为禽大肠杆菌病油佐剂三价灭活疫苗,该疫苗中每株菌的含量为1.2
×
10
10
cfu/ml。
[0067]
(3)安全性试验
[0068]
如表4,对禽大肠杆菌o36、o78、o109各单价苗以及禽大肠杆菌o36、o78、 o109三价灭活疫苗进行安全性检验,剔除不合格批次,保证疫苗安全性。
[0069]
表4禽大肠杆菌灭活疫苗安全性检验
[0070][0071]
(4)免疫保护试验
[0072]
疫苗免疫的程序:在14日龄时经颈部皮下进行一次免疫,疫苗浓度为每毫升疫苗中每株菌的浓度为1.2
×
10
10
cfu/ml,免疫剂量0.2ml。免疫14天后,经胸肌肌肉注射ec-yg1908-580、ec-yp1907-106、ec-yp1907-54攻毒,攻毒剂量为 1.0
×
10
10
cfu/只。每批10只鸡,共做3批实验,平均结果如表5。少数攻毒鸡存活时一般认为是个体差异导致,并无保护
力。
[0073]
表5禽大肠杆菌o36、o78、o109单价苗免疫保护率
[0074][0075]
禽大肠杆菌o9、o78、o109各单价苗对于同型菌株的感染能够做到较好的保护效果,但仅针对相同的单一血清型禽大肠杆菌进行保护,对其他血清型并未形成有效交叉保护。
[0076]
表6第一批禽大肠杆菌三价灭活苗免疫保护率
[0077][0078]
表7第二批禽大肠杆菌三价灭活苗免疫保护率
[0079][0080]
表8第三批禽大肠杆菌三价灭活苗免疫保护率
[0081][0082]
如表5~8,使用三个批次的大肠杆菌三价灭活疫苗分别免疫spf鸡。攻毒后,两种佐剂的三价灭活苗对鸡群均有显著的保护效果,效果优于单价苗的效果。
[0083]
表9禽大肠杆菌三价灭活苗对同型及异型菌株感染免疫保护率
[0084][0085][0086]
表10与竞品免疫保护效果比较
[0087][0088]
选取两种竞品与本发明制备的疫苗进行免疫保护试验对比保护效果,竞品和本发明仅有o78型大肠杆菌为相同血清型,因此仅采用o78型大肠杆菌进行攻毒。结果表明:本发明所制备的两种疫苗免疫保护效果明显优于两种竞品。鸡大肠杆菌病蜂胶灭活疫苗(o78血清型),霍乱大肠杆菌二联灭活疫苗的产品由山东华宏生物工程有限公司生产。
[0089]
表11与竞品免疫保护期限比较
[0090][0091]
对两种竞品以及本发明中的两种佐剂的大肠杆菌灭活疫苗免疫后4个月进行攻毒,结果显示,本发明所制备的疫苗的保护效果明显优于竞品。
[0092]
本发明所研发的禽大肠杆菌三价灭活疫苗,具有良好的免疫原性,免疫动物后结果表明对鸡只安全,能够诱导产生较高的抗体水平,并且能够保护当前流行的大肠杆菌o78、o36和o109等血清型强毒株的攻击,产生理想的保护效果,有广阔的应用前景。禽大肠杆菌病三价灭活疫苗以达到能够同时对这三种血清的大肠杆菌的感染进行保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1