Stat3信号通路抑制剂的应用
stat3信号通路抑制剂的应用
技术领域
1.本发明涉及生物医药技术领域,具体是stat3信号通路抑制剂的应用。
背景技术:
2.长期压力介导下丘脑-垂体-肾上腺轴紊乱,导致糖皮质激素水平升高,进而造成一系列代谢疾病。尤其是以胰岛素抵抗和肥胖为特征的代谢类疾病成为严重威胁人类健康和生命安全的重大疾病。由于其涉及人群广泛,极大降低病人生活质量及家庭幸福感,社会经济负担巨大,其治疗药物和手段的研发一直是生命科学领域的研究重点。
3.高水平糖皮质激素造成的代谢综合征是以肥胖、高血糖、高血脂、抑郁和焦虑为特征的机体病理状态。已经成为当下中国社会面临的严峻的人口健康问题。在慢性压力之下,长期高水平糖皮质激素导致病人出现烦渴,过渡排尿,过度进食和减少活动的状态。
4.肠道作为营养物质吸收的主要器官之一,参与机体内能量吸收和能量存储的重要任务。肠道细胞的更迭由位于隐窝的肠道干细胞产生新生细胞,并顺肠绒毛向上迁移,肠绒毛顶端细胞凋亡脱落。打破肠道增殖凋亡平衡导致肠道过度增长,肠道及其表面绒毛的长短直接控制了机体与食物的接触的表面积。肠道过度增殖导致更多的营养物质被机体吸收,从而造成能量盈余引起肥胖的发生。
5.肝脏作为机体的主要器官,参与机体内消化,能量存储和分泌性蛋白质的合成等重要任务。其分泌的成纤维细胞生长因子参与调控肠道细胞的增殖。
技术实现要素:
6.本发明提供一种stat3信号通路抑制剂的应用,stat3信号通路抑制剂可抑制糖皮质激素作用下肠道的过度增长,降低营养物质的吸收,以治疗或预防肥胖。
7.为达此目的,本发明提供如下的技术方案:
8.本发明的第一个方面,提供了stat3信号通路抑制剂在如下任意制剂中的应用:
9.1)抑制肠道增长的制剂;
10.2)改善糖皮质激素导致的代谢类疾病的制剂;
11.3)改善脂肪肝的制剂。
12.优选的,糖皮质激素导致的代谢类疾病包括:糖皮质激素导致的肥胖。
13.优选的,所述stattic通过抑制肝脏p-stat3和stat3蛋白及磷酸化程度发挥作用。
14.优选的,所述制剂包括药物、保健品、功能性食品。
15.本发明的第二个方面,提供了一种抑制肠道增长和/或改善糖皮质激素导致的肥胖的药物组合物,包括:
16.1)治疗有效剂量的stat3信号通路抑制剂;和
17.2)药学上可接受的载体。
18.优选的,所述药物组合物为注射剂。
19.优选的,所述药物组合物的给药方式包括:静脉注射、肌肉注射、腹腔注射。
20.优选的,所述stat3信号通路抑制剂包括stattic。
21.本发明的第三个方面,提供了皮质脂酮在破坏了肠道增殖凋亡平衡、促进肠道增长中的应用。
22.与现有技术相比,本发明有益效果及显著进步在于:
23.1、皮质脂酮引起肥胖的原因是多样的,包括能量摄入过多,运动能力下降等。涉及不同的通路。本发明首次发现:皮质脂酮可以促使肠道增殖凋亡平衡破坏,并导致肠道增长,从而促进吸收,引起肥胖;
24.2、本发明更进一步研究出,stat3抑制剂可以通过抑制肝脏stat3蛋白表达量或磷酸化水平,抑制肠道增长,降低营养物质的吸收及过多能量积累,从而减缓皮质脂酮造成的肥胖。
附图说明
25.为更清楚地说明本发明的技术方案,下面将对本发明的实施例所需使用的附图作一简单介绍。
26.显而易见地,下面描述中的附图仅是本发明中的部分实施例的附图,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图,但这些其他的附图同样属于本发明实施例所需使用的附图之内。
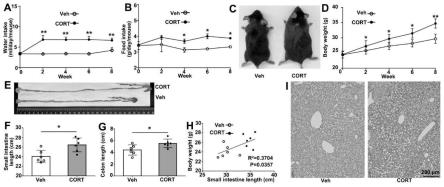
27.图1a为本发明实施例1的小鼠在糖皮质激素造模期间进水量;
28.图1b为本发明实施例1的小鼠在糖皮质激素造模期间进食量;
29.图1c为本发明实施例1的小鼠在造模后的体型;
30.图1d为本发明实施例1的小鼠在造模期间体重增长曲线;
31.图1e为本发明实施例1的小鼠造模后的肠道形态;
32.图1f为本发明实施例1的小鼠小肠长度统计;
33.图1g为本发明实施例1的小鼠结肠长度统计;
34.图1h为本发明实施例1的小鼠肠道长度和体重相关性分析;
35.图1i为本发明实施例1的小鼠肝脏红油氧染色;
36.图2a为本发明实施例2的小鼠小肠h&e染色;
37.图2b为本发明实施例2的小鼠肠绒毛长度统计分析;
38.图2c为本发明实施例2的小鼠小肠edu染色;
39.图2d为本发明实施例2的小鼠小肠edu染色统计分析;
40.图2e为本发明实施例2的小鼠小肠ki67免疫荧光;
41.图2f为本发明实施例2的小鼠小肠ki67免疫荧光统计分析;
42.图2g为本发明实施例2的小鼠小肠tunel染色;
43.图2h为本发明实施例2的小鼠小肠tunel统计分析;
44.图2i为本发明实施例2的小鼠小肠cc3免疫荧光;
45.图2j为本发明实施例2的小鼠小肠cc3统计分析;
46.图3a为本发明实施例3的组间主成分分析;
47.图3b为本发明实施例3的表达基因venn图分析;
48.图3c为本发明实施例3的显著差异基因火山图分析;
49.图3d为本发明实施例3的kegg代谢通路分析;
50.图3e为本发明实施例3的显著差异基因热图分析;
51.图4a为本发明实施例4的组间主成分分析;
52.图4b为本发明实施例4的表达基因venn图分析;
53.图4c为本发明实施例4的显著差异基因火山图分析;
54.图4d为本发明实施例4的kegg代谢通路分析;
55.图4e为本发明实施例4的显著差异基因热图分析;
56.图4f为本发明实施例4的stat3和p-stat3表达量分析;
57.图4g为本发明实施例4的stat3表达量定量分析;
58.图4h为本发明实施例4的p-stat3表达量定量分析;
59.图5a为本发明实施例5的小鼠在stattic作用下进水量;
60.图5b为本发明实施例5的小鼠在stattic作用下进食量;
61.图5c为本发明实施例5的小鼠在stattic作用下的体型;
62.图5d为本发明实施例5的小鼠在stattic作用下体重增长曲线;
63.图5e为本发明实施例5的小鼠stattic作用下肠道形态;
64.图5f为本发明实施例5的小鼠小肠长度统计;
65.图5g为本发明实施例5的小鼠结肠长度统计;
66.图5h为本发明实施例5的小鼠肝脏红油氧染色;
67.图6a为本发明实施例6的小鼠小肠h&e染色;
68.图6b为本发明实施例6的小鼠肠绒毛长度统计分析;
69.图6c为本发明实施例6的小鼠小肠edu染色;
70.图6d为本发明实施例6的小鼠小肠edu染色统计分析;
71.图6e为本发明实施例6的小鼠小肠ki67免疫荧光;
72.图6f为本发明实施例6的小鼠小肠ki67免疫荧光统计分析;
73.图6g为本发明实施例6的小鼠小肠tunel染色;
74.图6h为本发明实施例6的小鼠小肠tunel统计分析;
75.图6i为本发明实施例6的小鼠小肠cc3免疫荧光;
76.图6j为本发明实施例6的小鼠小肠cc3统计分析。
具体实施方式
77.为使本发明实施例的目的、技术方案、有益效果及显著进步更加清楚,下面,将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述。
78.显然,所有描述的这些实施例仅是本发明的部分实施例,而不是全部的实施例;基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
79.需要理解的是:
80.术语“stattic”,是一种有效的stat3抑制剂,可以抑制stat3磷酸化(磷酸化位点为y705和s727)。stattic抑制高亲和力磷酸肽与stat3的sh2域结合。stattic可改善alport综合征(as)小鼠的肾功能不全。stattic的化学式为:
[0081][0082]
术语“肥胖”,是一定程度的明显超重与脂肪层过厚,是体内脂肪,尤其是甘油三酯积聚过多而导致的一种状态。由于食物摄入过多或机体代谢的改变而导致体内脂肪积聚过多造成体重过度增长并引起人体病理、生理改变或潜伏。
[0083]
术语“制剂”,是以各类具有医研价值的碳基生物为原料,利用传统技术或现代生物技术制造,作用于人体各类生理症状的预防(保健)、治疗和诊断的各种形态制剂。包括生物制剂、药物制剂,其中生物制剂包括保健生物制剂:如乳酸钙、维生素d等;医用生物制剂:如疫苗等。药物制剂是按照一定的剂型要求所制成的,可以最终提供给用药对象使用的药品。
[0084]
术语“信号通路”,是能够把胞外的分子信号经过细胞膜传到细胞胞内然后发生效应的一系列酶促反应通路。基础科研中不限定从胞外到胞内,指信息从一个分子传到另外的分子的过程。信号通路本质上就是前人研究的比较透彻的一些分子,包括他的调控方式的一个总结。
[0085]
对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本发明中的具体含义。
[0086]
还需要说明的是,以下的具体实施例可以相互结合,对于其中相同或相似的概念或过程可能在某些实施例中不再赘述。
[0087]
下面,以具体的实施例对本发明的技术方案进行详细说明。
[0088]
实施例1长期注射皮质脂酮导致小鼠肥胖
[0089]
实验小鼠:6-8周龄雄性c56bl/6j小鼠
[0090]
实验步骤:
[0091]
1.1、向实验组(cort)小鼠持续三周注射40mg/kg/day皮质脂酮,对照组(veh)注射溶剂;
[0092]
1.2、记录实验组和对照组小鼠建模期间的进水量(图1a)、进食量(图1b)、体重变化(图1d);
[0093]
1.3、三周后解剖小鼠,并记录实验组和对照组小鼠的体型(图1c)、肠道形态(图1e)、小肠长度(图1f)、结肠长度(图1g);
[0094]
1.4、将实验组和对照组小鼠肝脏进行红油氧染色(图1i);
[0095]
1.5、统计实验组和对照组小鼠肠道长度和体重的关联(图1h)。
[0096]
实验结果:
[0097]
如图1a-i所示,相比于对照组,实验组小鼠在进食量,进水量,体重均出现显著性上调。实验组小鼠小肠和结肠长度出现不同程度的增长,均具有显著性差异。且小肠长度和体重呈正相关。实验组小鼠肝脏脂肪积累显著增加。可见,长期注射皮质脂酮导致小鼠肥胖。
[0098]
实施例2长期注射皮质脂酮导致小鼠肠道增殖凋亡平衡破坏
[0099]
分组处理:6-8周龄雄性c56bl/6j小鼠,向实验组(cort)小鼠持续三周注射40mg/kg/day皮质脂酮,对照组(veh)注射溶剂。
[0100]
实验步骤
[0101]
2.1、苏木精-伊红染色,小鼠经原位灌注后取肠道,将小肠纵向剪开制成瑞士卷于冰切机中冷冻固定,切取15um切片进行苏木精-伊红染色。先后将切片先后置于苏木精,伊红染色液中,经乙醇梯度脱水,二甲苯透明后使用树脂封片,于显微镜下使用白光观察。
[0102]
2.2、edu染色,小鼠腹腔注射5mg/kg edu,12h后麻醉灌注,取小肠进行冰冻切片,使用edu kit进行荧光显色,滴加封片剂,封片后与荧光显微镜下观察;
[0103]
2.3、ki67免疫荧光,小鼠经原位灌注后取肠道,将小肠纵向剪开制成瑞士卷于冰切机中冷冻固定,切取15um切片进行免疫荧光染色。使用添加10%驴血清含0.5%triton x的的dpbs封闭一小时,加入一抗(ki67)4度过夜孵育,吸去一抗后滴加fitc标记的二抗避光孵育一小时,吸去二抗滴加封片剂,封片后于荧光显微镜下观察;
[0104]
2.4、tunel染色:每个样本上滴加100μl浓度为20μg/ml的proteinase k溶液,使其被全部覆盖,室温孵育10min。每个样本滴加100μl 1
×
equilibration buffer使其全部覆盖待检样本区域,室温孵育30min。滴加12-dutp labeling mix常温孵育1小时,滴加封片剂,封片后与荧光显微镜下观察。
[0105]
2.5、cc3免疫荧光,小鼠经原位灌注后取肠道,将小肠纵向剪开制成瑞士卷于冰切机中冷冻固定,切取15um切片进行免疫荧光染色。使用添加10%驴血清含0.5%triton x的的dpbs封闭一小时,加入一抗(cc3)4度过夜孵育,吸去一抗后滴加fitc标记的二抗避光孵育一小时,吸去二抗滴加封片剂,封片后于荧光显微镜下观察;
[0106]
并根据上述染色结果图分别进行统计分析:数据以平局值
±
sem表示。使用prism分析,采用studentt检验。p值小于0.05认为存在显著性差异。
[0107]
实验结果
[0108]
苏木精-伊红染色结果及统计分析结果如图2a、2b所示,可见,实验组小鼠小肠绒毛显著增长。
[0109]
edu染色及ki67免疫荧光结果及统计分析结果如图2c-2f所示,可见,实验组小鼠肠道细胞向上延伸增长,隐窝较深,具有统计学差异。
[0110]
tunel染色及cc3免疫荧光结果及统计分析结果如图2g-2j所示,可见,实验组小鼠肠道细胞凋亡显著下调,结果指示皮质脂酮破坏小鼠肠道增殖凋亡平衡,促进肠道干细胞增殖,抑制肠道上皮细胞凋亡。
[0111]
实施例3小肠rna-seq结果分析
[0112]
分组处理:6-8周龄雄性c56bl/6j小鼠,向实验组(cort)小鼠持续三周注射40mg/kg/day皮质脂酮,对照组(veh)注射溶剂。
[0113]
实验步骤
[0114]
3.1、提取组织总rna,使用trizol提取组织rna;
[0115]
3.2、实时定量pcr,使用反转录试剂盒移除基因组dna并将rna反转录成cdna;使用sybr green mix进行实时定量pcr反应;利用cfx connect real-time pcr detection进行数据分析;
[0116]
3.3、小肠rna-seq分析:使用oligo(dt)筛选出mrna,加入fragmentation buffrt
断裂mrna,进行反转录合成cdna,进而合成稳定的双链dna;加入end repair mix将双链dna修饰为平末端,对连接adapter后的产物进行纯化和片段分选;使用illumina进行测序,经过原始数据质控除杂后,与小鼠参考基因组进行比对并分析。
[0117]
实验结果:组间主成分分析(图3a),表达基因venn图分析(图3b),显著差异基因火山图分析(图3c),kegg代谢通路分析(图3d),显著差异基因热图分析(图3e)。
[0118]
其中,pca分析(图3a)指出,实验组和对照组基因表达存在明显差异,其中存在显著性差异且共同表达的435个基因中,其中235个基因在实验组上调。将435个基因比对kegg数据库进行富集分析,涉及20个kegg子分类,其中抗凋亡相关基因如bcl_2,bcl_xl,tff3等基因在实验组中显著上调。
[0119]
实施例4肝脏rna-seq分析及stat3蛋白表达分析
[0120]
分组处理:6-8周龄雄性c56bl/6j小鼠,向实验组(cort)小鼠持续三周注射40mg/kg/day皮质脂酮,对照组(veh)注射溶剂。
[0121]
实验步骤:
[0122]
4.1、肝脏rna-seq分析:通实施例3的小肠rna-seq结果分析;
[0123]
4.2、蛋白免疫印记
[0124]
4.2.1、使用添加蛋白酶抑制剂,磷酸酶抑制剂的ripa裂解小鼠组织;
[0125]
4.2.2、于冷冻匀浆仪中研磨裂解的小鼠组织,提取组织总蛋白;
[0126]
4.2.3、使用bca测定蛋白浓度,加入sds煮沸蛋白变性;
[0127]
4.2.4、使用sds-page胶进行蛋白质分析,并转印与pvdf膜上,使用5%的脱脂乳粉进行封闭,然后加入一抗与4度过夜孵育;
[0128]
4.2.5、吸去一抗后加入hrp酶标记的二抗常温孵育1小时,吸去二抗后滴加混合好的ecl显影液进行化学发光并记录。
[0129]
实验结果:组间主成分分析(图4a),表达基因venn图分析(图4b),显著差异基因火山图分析(图4c),kegg代谢通路分析(图4d),显著差异基因热图分析(图4e),stat3和p-stat3表达量分析(图4f),stat3表达量定量分析(图4g),p-stat3表达量定量分析(图4h)。
[0130]
其中,pca分析(图4a)指出,实验组和对照组基因表达存在明显差异,其中存在显著性差异且共同表达的689个基因,将689个基因比对kegg数据库进行富集分析,涉及20个kegg子分类,其中超过220个基因富集在siganl transduction类别,此类别中涉及多个信号通路。其中jak-stat信号通路与细胞增殖凋亡紧密相关,通路中14个基因出现显著性差异,如抗凋亡基因cdkn1a,fgf21等。
[0131]
对其关键转录因子stat3进行蛋白定量,结果(4f-h)显示相比于对照组,实验组p-stat3和stat3蛋白水平显著上调。
[0132]
实施例5stattic抑制皮质脂酮所造成的肥胖表型
[0133]
分组处理:腹腔注射20mg/kg stattic隔天一次为期八周,溶剂注射作为对照,同时注射40mg/kg/day皮质脂酮,veh-veh组每天颈部注射溶剂,腹腔注射溶剂隔天一次作为对照、cort-stattic组腹腔注射20mg/kg stattic隔天一次,同时每天注射40mg/kg/day皮质脂酮、veh-stattic组每天颈部溶剂注射,腹腔注射20mg/kg stattic隔天一次、cort-veh组腹腔注射溶剂隔天一次,同时每天注射40mg/kg/day皮质脂酮。
[0134]
实验步骤:同实施例1。
[0135]
实验结果:小鼠在stattic作用下进水量(图5a),小鼠在stattic作用下进食量(图5b),小鼠在stattic作用下的体型(图5c),小鼠在stattic作用下体重增长曲线(图5d),小鼠stattic作用下肠道形态(图5e),小鼠小肠长度统计(图5f),小鼠结肠长度统计(图5g),小鼠肝脏红油氧染色(图5h)。
[0136]
相比于健康对照组,stattic处理组小鼠进水量无显著差异,进食量并无显著性差异,体重显著下降。小肠和结肠长度均显著降低。stattic肝脏脂肪积累显著减少。stattic处理组小鼠各项指标均更接近于健康对照。
[0137]
实施例6stattic恢复皮质脂酮造成的小鼠肠道增殖凋亡平衡破坏
[0138]
分组处理:腹腔注射20mg/kg stattic隔天一次为期三周,溶剂注射作为对照,同时注射40mg/kg/day皮质脂酮,veh-veh组每天颈部注射溶剂,腹腔注射溶剂隔天一次作为对照、cort-stattic组腹腔注射20mg/kg stattic隔天一次,同时每天注射40mg/kg/day皮质脂酮、veh-stattic组每天颈部溶剂注射,腹腔注射20mg/kg stattic隔天一次、cort-veh组腹腔注射溶剂隔天一次,同时每天注射40mg/kg/day皮质脂酮。
[0139]
实验方法:同实施例2。
[0140]
实验结果:
[0141]
苏木精-伊红染色结果及统计分析结果如图6a、6b所示,相比于健康对照组,stattic处理组小鼠小肠绒毛无明显增长,且显著短于实验组。
[0142]
edu染色结果及统计分析结果如图6c、6d所示,可见,实验组小鼠肠道细胞向上延伸增长,具有统计学差异。
[0143]
ki67免疫荧光结果及统计分析结果如图6e、6f所示,相比于健康对照,stattic处理组小鼠隐窝深度并无明显差异。
[0144]
tunel及cc3免疫荧光染色结果及统计分析结果如图6g-j所示,相比于健康对照,stattic处理组小鼠肠道细胞凋亡显著上调。
[0145]
综上所述,相比于对照组,stattic处理组凋亡上调,更接近于健康对照组。结果指示stattic一定程度上恢复了皮质脂酮造成的小鼠肠道增殖凋亡平衡破坏。
[0146]
在上述说明书的描述过程中:
[0147]
术语“本实施例”、“本发明实施例”、“如
……
所示”、“进一步的”、“进一步改进的技术分方案”等的描述,意指该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中;在本说明书中,对上述术语的示意性表述不是必须针对相同的实施例或示例,而且,描述的具体特征、结构、材料或者特点等可以在任意一个或者多个实施例或示例中以合适的方式结合或组合;此外,在不产生矛盾的前提下,本领域的普通技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合或组合。
[0148]
最后应说明的是:
[0149]
以上各实施例仅用以说明本发明的技术方案,而非是对其的限制;
[0150]
尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换,而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,本领域技术人员根据本说明书内容所做出的非本质改进和调整或
者替换,均属本发明所要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1