一种融合纳米囊泡及其制备方法与应用
1.本发明涉及生物医学技术领域,具体涉及一种融合纳米囊泡及其制备方法与应用。
背景技术:
2.自身免疫病是由于机体免疫系统不能正确识别自身抗原和异己抗原,从而攻击自身组织引发疾病。随着全球年均发病率和患病率稳步上升,自身免疫性疾病已成为仅次于心血管疾病和癌症的第三大慢性病。目前临床上治疗自身免疫病的常用药物是全身免疫抑制剂,如甲氨蝶呤,单克隆抗体,和糖皮质激素。但是这些药物存在耐药性和副作用大的缺点。银屑病和特异性皮炎属于发病率较高的自身免疫病,主要病损部位在皮肤。
3.趋化因子ccl20又称巨噬细胞炎性蛋白(mip-3α),单核细胞、巨噬细胞、小胶质细胞、星形胶质细胞、肥大细胞、角质细胞、成骨细胞、成纤维细胞、内皮细胞和上皮细胞都可表达ccl20。ccl20是趋化因子受体ccr6的唯一配体,对淋巴细胞具有强烈的趋化作用,而对中性粒细胞的趋化作用较弱。趋化因子受体ccr6表达在th17细胞上,而银屑病特异性皮炎等自身免疫病都与th17细胞密切相关。ccr6-ccl20轴与自身免疫病密切相关,已有针对ccr6的小分子药物在临床前研究阶段。
4.间充质干细胞具有多向分化的功能,是来源于骨髓、脐带、脂肪、牙龈等组织的一类具有高度自我更新和多向分化潜能的成体干细胞,并能分泌多种细胞因子及生长因子,具有免疫调节、组织修复、抗炎等作用。牙龈间充质干细胞(gingiva-derived mesenchymal stem cell,gmsc)是从牙龈组织提取的多能干细胞,已被报道治疗多种炎症性疾病。细胞外囊泡(extracellular vesicles,evs)是指由细胞分泌的有着膜结构的囊泡状小体,是细胞间通讯的关键信使,由多种细胞分泌,内含有特定的蛋白质、脂质、细胞因子和核酸。
5.目前外泌体的应用已经涉及肿瘤治疗领域、医学基础和免疫领域。近几年关于植物外泌体的研究也在不断增加,植物外泌体与动物外泌体结构相似,也含有核酸、脂质和蛋白质等物质。相比于动物外泌体,植物外泌体的来源更多,更容易大批量制备,且免疫原性低,毒性小。但是动物外泌体可以通过基因工程的方法表达各种与疾病相关的蛋白,而植物外泌体难以进行改造和修饰。目前常见的修饰方法如脂质体修饰常常导致植物外泌体形态和活性的改变。
技术实现要素:
6.本发明的目的在于克服现有技术的不足,提供一种融合纳米囊泡及其制备方法与应用。本发明首次将植物来源的外泌体与人来源的间充质干细胞囊泡进行膜融合制备融合囊泡来治疗自身免疫病。
7.为实现上述目的,本发明采取的技术方案为:一种融合纳米囊泡,所述融合纳米囊泡包括间充质干细胞囊泡和植物外泌体融合而成的膜结构。研究表明,植物外泌体与动物外泌体结构相似,含有核酸、脂质和蛋白质等物质,并且植物外泌体来源广、免疫原性低,毒
性小,但是存在难以进行修饰的特点。本技术发明人经过大量的实验研究和验证,将植物来源的外泌体与人来源的间充质干细胞囊泡进行挤出融合制备得到融合纳米囊泡,该纳米囊泡具有很好的靶向性和生物相容性,并且具有治疗特异性皮炎和银屑病的效果。
8.作为本发明所述的融合纳米囊泡的优选实施方式,所述间充质干细胞为牙龈间充质干细胞。
9.作为本发明所述的融合纳米囊泡的优选实施方式,所述牙龈间充质干细胞表达趋化因子受体。
10.作为本发明所述的融合纳米囊泡的优选实施方式,所述趋化因子受体包括ccr6。本技术发明人采用基因工程的方法使牙龈间充质干细胞表达趋化因子ccr6。
11.作为本发明所述的融合纳米囊泡的优选实施方式,所述植物外泌体为西柚外泌体。本技术发明人经过实验筛选和验证,最终选择西柚外泌体与间充质干细胞囊泡制备融合纳米囊泡,西柚外泌体具有来源广、免疫原性低的特点,与间充质干细胞囊泡融合实现了对西柚外泌体的修饰,制备得到的融合纳米囊泡具有更好的生物相容性和疗效。
12.作为本发明所述的融合纳米囊泡的优选实施方式,所述植物外泌体和间充质干细胞细胞膜的总蛋白含量比为植物外泌体:间充质干细胞细胞膜=1:2。
13.本发明还提供所述的融合纳米囊泡的制备方法,包括以下步骤:
14.(1)提取纯化植物外泌体;
15.(2)制备过表达趋化因子受体的间充质干细胞细胞膜囊泡;
16.(3)将植物外泌体和间充质干细胞囊泡混合并经聚碳酸酯膜挤出,得所述融合纳米囊泡。
17.本发明还提供所述的融合纳米囊泡在制备用于治疗自身免疫病的药物中的应用。
18.作为本发明所述的应用的优选实施方式,所述自身免疫病包括银屑病或特异性皮炎。
19.本发明还提供一种药物组合物,所述药物组合物包括所述的融合纳米囊泡。
20.本发明的有益效果:本发明提供一种融合纳米囊泡及其制备方法与应用。本发明首次将植物来源的外泌体与人来源的间充质干细胞囊泡进行膜融合制备融合纳米囊泡,本发明的融合纳米囊泡具有很好的靶向性和生物相容性,该融合纳米囊泡具有抗炎抗氧化作用,并且具有免疫调节功能,能有效治疗特异性皮炎和银屑病,为制备用于治疗自身免疫病特别是特异性皮炎和银屑病的药物提供了一种新来源。
附图说明
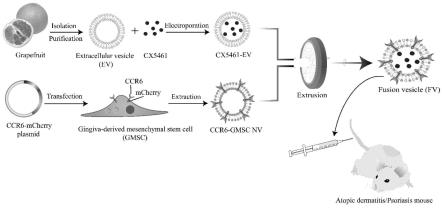
21.图1为实施例1的融合纳米囊泡制备流程示意图;
22.图2为cck-8法检测十种不同来源的植物外泌体对lps诱导的hacat细胞增殖的影响;
23.图3为流式检测生姜外泌体和西柚外泌体对lps诱导的巨噬细胞细胞内ros水平的影响;
24.图4:a为蔗糖梯度离心法纯化后的西柚外泌体;b为gevs,gev@cx5461,nvs,ccr6-nvs,fv@cx5461的电镜图;c为gevs,gev@cx5461,nvs,ccr6-nvs,fv@cx5461的zeta电位;d为gevs的粒径分布图;e为融合纳米囊泡(fv@cx5461)的粒径分布图;f为fv@cx5461的共聚焦
显微镜图;g为western blot检测外泌体的标志蛋白以及ccr6受体的表达情况图;h为gevs包载cx5461的包封率以及fv@cx5461的包封率;
25.图5为流式检测raw264.7细胞内的ros水平图;
26.图6为qpcr实验检测hacat细胞炎症因子mrna水平图;
27.图7为流式检测m2型巨噬细胞比例图,其中双阳性细胞(cd206和f4/80)代表m2巨噬细胞;
28.图8为流式检测cfse标记的pbmcs的第七天的增殖情况图;
29.图9:a为银屑病模型给药模式图;b为活体成像显示药物分布情况图;c为第7天取样时各组小鼠皮肤代表性照片;d为造模及治疗期间各组小鼠的pasi分数变化图;e为he染色及免疫组化结果图;f为elisa检测各组小鼠血清的炎症细胞因子水平图;
30.图10:a为特异性皮炎动物模型给药模式图;b为活体成像显示药物分布情况图;c为第7天取样时各组小鼠皮肤代表性照片;d为造模及治疗期间各组小鼠的疾病严重指数变化图;e为he染色和甲苯胺蓝(tb)染色及免疫组化结果图;f为elisa检测各组小鼠血清的炎症细胞因子水平图;
31.图11:a为分别注射了gevs,gev@cx5461,nvs,ccr6-nvs,fv@cx5461的小鼠器官he染色图;b为分别注射了gevs,gev@cx5461,nvs,ccr6-nvs,fv@cx5461的小鼠血常规结果图。
具体实施方式
32.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
33.实施例1融合纳米囊泡的制备
34.本实施例提供融合纳米囊泡的制备方法,所述融合纳米囊泡制备流程示意图如图1所示,具体包括以下步骤:
35.1、植物外泌体的制备
36.(1)通过文献调研选择了十种可食用植物:生姜、西柚、橙、葡萄柚叶子、柠檬、石斛、虎杖、三七、苦参,提取各种植物的外泌体,并通过细胞增殖实验验证其对于脂多糖(lps)诱导的炎症状态下角质形成细胞的增殖的影响,具体实验方法为:先用lps刺激角质形成细胞24h后,分别加入不同浓度梯度的上述外泌体继续培养24h,用cck-8试剂盒检测细胞活力,实验结果如图2所示。由图2可知,生姜外泌体和西柚外泌体能抑制炎性角质细胞增殖。进一步验证生姜外泌体和西柚外泌体对于炎症的影响,具体实验方法为:先用lps诱导巨噬细胞raw264.7的炎症模型,用生姜外泌体和西柚外泌体处理24h后,dcfh-da探针孵育30min后流式检测巨噬细胞细胞内活性氧(ros)水平,结果如图3所示。由图3可知,只有西柚外泌体降低了炎性巨噬细胞内的ros水平。
37.(2)西柚外泌体(gevs)的提取纯化:将新鲜的西柚去皮,然后放入高速榨汁机中,在4℃下匀浆1分钟;收集汁液并通过滤纸过滤;在500x g离心10分钟、2,000x g离心20分钟、10,000x g离心1小时和40,000x g离心1小时后收集上清液;然后在4℃条件下以150,000x g离心2小时,得到含有西柚外泌体的沉淀;然后,将西柚外泌体的沉淀在蔗糖梯度(20mm tri-ci,ph 7.2中的8%/30%/45%/60%蔗糖)中以150,000x g的速度离心进行纯
化,得西柚外泌体(gevs)。
38.2、过表达趋化因子ccr6的牙龈干细胞囊泡(ccr6-nvs)的制备,包括以下步骤:从拔牙术中丢弃的的废弃牙龈组织中分离出来人牙龈来源的间充质干细胞(gmscs),将牙龈组织切成1mm3小块,分散转移到的培养皿中,并加入含有10%胎牛血清的dmem-f12,在37℃恒温培养箱孵育。等到细胞贴壁后再培养7天;取第2-5代的gmscs用于实验。通过构建并转染plv-cmv-mcs-mcherry-6xhis-ires-bla质粒获得了稳定表达趋化因子受体ccr6的gmscs(ccr6-gmscs),然后将ccr6-gmscs与hm缓冲液置于冰上孵育;经反复研磨后,5000rpm离心10分钟去除细胞内其他杂质,然后12000rpm离心10分钟得到细胞膜,用0.22μm孔径聚碳酸酯膜过滤器挤压过滤得到过表达ccr6受体的细胞膜囊泡(ccr6-nvs)。
39.3、载药融合纳米囊泡(fv@cx5461)的制备,包括以下步骤:将1mg cx5461与蛋白含量为2mg的gevs混合,并用电穿孔缓冲液(1.15mm磷酸钾ph 7.2、25mm氯化钾)稀释至1ml;将混合物添加到0.4cm电极杯中,并使用bio-rad gene pulser xcell电转系统在300v和150μf条件下电转1秒;然后将混合物在冰上孵育1小时,然后重复电转一次;电转后,将混合物在冰上再孵育30分钟使膜复合;在以100,000
×
g离心70分钟以去除未加载的cx5461后,得到包载cx546的西柚外泌体(gev@cx5461);将制备好的gev@cx5461与ccr6-gmscs细胞膜以1:2的总蛋白含量比混合后使用0.22μm孔径聚碳酸酯膜过滤器反复挤压10次得到融合纳米囊泡(fv@cx5461)。
40.实施例2
41.本实施例分别对实施例1制备的西柚外泌体(gevs),载cx546的西柚外泌体(gev@cx5461),牙龈间充质干细胞囊泡(nvs),过表达趋化因子ccr6的牙龈干细胞囊泡(ccr6-nvs),融合纳米囊泡(fv@cx5461)进行表征,实验结果如图4所示。其中图4a为蔗糖梯度离心提取纯化的gevs;图4b刻意看出,gevs,gev@cx5461,nvs,ccr6-nvs,fv@cx5461呈球形,有双层膜结构。由图4c~e可以看出,gevs的平均粒径在100nm,zeta电位平均在-25mv,符合外泌体的标准;fv@cx5461平均粒径在150nm,zeta电位平均在-22mv,粒径属于纳米囊泡的范围。由图4f可以看出,用wga488染料(绿色荧光)对gevs进行染色,然后再与表达mcherry(红色荧光)的ccr6-nvs用挤压法制备融合囊泡,共聚焦显微镜拍摄结果显示fv@cx5461呈绿色荧光和红色荧光的共表达,说明成功的融合了gevs和ccr6-nvs。由图4g的westernblot的结果可知,融合纳米囊泡不仅表达gevs表达外泌体的标志蛋白,还表达ccr6蛋白,进一步证明成功的融合了gevs和ccr6-nvs。由图4h可知,fv@cx5461的小分子药物cx5461的包封率较高。
42.实施例3
43.本实施例分别测定实施例1制备的西柚外泌体(gevs),载cx546的西柚外泌体(gev@cx5461),牙龈间充质干细胞囊泡(nvs),过表达趋化因子ccr6的牙龈干细胞囊泡(ccr6-nvs),融合纳米囊泡(fv@cx5461)的体外抗氧化作用,具体实验如下:先用1μg/ml的lps诱导raw264.7细胞24h形成巨噬细胞炎症模型;分别加入gevs,nvs,ccr6-nvs,gev@cx5461和fv@cx5461继续培养24h后,用dcfh-da探针与细胞孵育后通过流式细胞术检测细胞内ros水平。实验结果如图5所示。由图5可以看出,gevs,nvs,ccr6-nvs,gev@cx5461和fv@cx5461在炎症条件下降低了raw 264.7细胞(小鼠巨噬细胞)中的ros水平,其中fv@cx5461的效果最显著。
44.实施例4
45.本实施例分别测定实施例1制备的西柚外泌体(gevs),载cx546的西柚外泌体(gev@cx5461),牙龈间充质干细胞囊泡(nvs),过表达趋化因子ccr6的牙龈干细胞囊泡(ccr6-nvs),融合纳米囊泡(fv@cx5461)的体外抗炎作用,具体实验如下:lps诱导hacat细胞24h形成细胞炎症模型,再分别加入gevs,nvs,ccr6-nvs,gev@cx5461和fv@cx5461继续培养24h,收集细胞,提取rna,通过qpcr实验检测炎症因子il-1,il-6,和tnf-α的mrna水平,实验结果如图6所示。由图6可以看出,gevs,nvs,ccr6-nvs,gev@cx5461和fv@cx5461都能减少lps诱导的hacat细胞产生的的炎症因子il-1,il-6,和tnf-α的mrna水平,fv@cx5461的效果最显著。
46.实施例5
47.本实施例分别测定实施例1制备的西柚外泌体(gevs),载cx546的西柚外泌体(gev@cx5461),牙龈间充质干细胞囊泡(nvs),过表达趋化因子ccr6的牙龈干细胞囊泡(ccr6-nvs),融合纳米囊泡(fv@cx5461)诱导巨噬细胞m2极化的作用,具体实验如下:用lps诱导巨噬细胞炎症模型,然后加入等量gevs,nvs,ccr6-nvs,gev@cx5461和fv@cx5461继续培养24h后,收集细胞标记f4/80和cd206抗体,上机检测,结果实验结果如图7所示。由图7可以看出,nvs,ccr6-nvs和fv@cx5461能诱导巨噬细胞m2极化,且fv@cx5461作用最强。
48.实施例6
49.本实施例探究实施例1制备的西柚外泌体(gevs),载cx546的西柚外泌体(gev@cx5461),牙龈间充质干细胞囊泡(nvs),过表达趋化因子ccr6的牙龈干细胞囊泡(ccr6-nvs),融合纳米囊泡(fv@cx5461)对pbmc细胞的影响,具体实验如下:用ficoll淋巴细胞分离液从健康志愿者的外周静脉血中分离得到pbmc,用cfse标记后均匀铺板,实验组分别加入gevs,nvs,ccr6-nvs,gev@cx5461和fv@cx5461,对照组加入等体积pbs缓冲液。在培养第7天后用流式细胞检测细胞增殖的情况,实验结果如图8所示。由图8可以看出,nvs,ccr6-nvs,和fv@cx5461能抑制人pbmc的增殖,且fv@cx5461的抑制效果最显著。
50.实施例7
51.本实施例检测融合纳米囊泡(fv@cx5461)对银屑病的治疗效果,具体实验方法如下:取35只小鼠,麻醉后在其背部脱毛,然后从第0天开始每天涂抹咪喹莫特软膏(imq)进行银屑病造模。将造模成功的小鼠随机分为7组,每组5只,分别为:空白对照组(nc)、imq造模组(imq)、gevs治疗组、gev@cx5461治疗组、牙龈干细胞囊泡组(nvs)、ccr6-nvs治疗组、fv@cx5461治疗组。gevs治疗组,nvs治疗组,ccr6-nvs治疗组,gev@cx5461治疗组和fv@cx5461治疗组每天尾静脉注射20mg/kg剂量的治疗药物,从第4天开始给药到第6天,在第7天取样进行组织病理学检测。每日对小鼠背部皮肤进行拍照观察和评分。实验流程如图9a所示,实验结果如图9b~f所示。
52.由图9b药物的分布的ivis spectrum成像系统分析可知,ccr6-nvs和fv@cx5461主要在病变的皮肤中积累,而gevs很少出现在皮肤上,由此说明,fv@cx5461和ccr6-nvs可以靶向炎症部位;由图9c可知,在造模期间,与nc组相比,其他组的pasi(银屑病病损面积和严重程度指数)评分增加,并伴有银屑病样病理变化,包括红斑、银屑和表皮增厚;由图9d可知,经过治疗后,fv@cx5461组的pasi迅速下降,银屑病症状明显改善,其他组的pasi也出现不同程度的下降;图9e的苏木精-伊红(h&e)染色和皮肤组织免疫组织化学分析结果显示,fv@cx5461减少了表皮厚度和炎症细胞浸润,并抑制了角质形成细胞的过度增殖;图9f的
elisa检测显示fv@cx5461组的血清炎性细胞因子il-1β、il-17、il-22和il-12/23p40水平显着降低。由上述结果可知,fv@cx5461在银屑病小鼠体内可以有效减轻银屑病的疾病严重程度,并通过减少免疫细胞浸润来抑制炎症反应,且效果比糖皮质激素类药物地塞米松(dex)更好;gevs和nvs可以缓解银屑病,融合后的fv@cx5461缓解银屑病的效果比单独用gevs或者nvs更好。
53.实施例8
54.本实施例检测融合纳米囊泡(fv@cx5461)对特异性皮炎的治疗效果,具体实验方法如下:取35只6~8周健康雄性balb/c小鼠麻醉后被剃除背部毛发,随机分为7组,每组5只,分别为空白对照组(nc)、造模组(dncb)、gevs治疗组、gev@cx5461治疗组、牙龈干细胞囊泡治疗组(nvs)、ccr6-nvs治疗组、fv@cx5461治疗组。在第一周涂抹1%dncb(200μl丙酮/橄榄油3:1混合物作为药物溶剂)3次和在接下来的两周内每隔一天涂抹一次0.5%dncb(200μl丙酮/橄榄油3:1混合物作为药物溶剂)进行特异性皮炎造模。nc组用相同剂量的溶剂处理。从第三周开始,各组小鼠每隔一天通过尾静脉注射治疗药物。特应性皮炎小鼠模型中皮肤炎症的严重程度根据四个临床体征(红斑、银屑/干燥、水肿和糜烂)以0到4分进行评分:0、无症状;1、较轻;2、中度;3、严重;4、非常严重。单项分数的总和用作特异性皮炎严重指数。实验结果如图10所示。
55.图10a为实验流程图;由图10b的活体成像可知,与gevs和nvs相比,ccr6-nvs和fv@cx5461在皮肤组织中显著聚集,表明在fv@cx5461因为有ccr6受体而具有特应性皮炎模型中的靶向能力;由图10c可知,dncb造模组在第21天表现出严重的特应性皮炎样症状,包括红斑、鳞屑、水肿和糜烂,而fv@cx5461治疗组的皮肤病变情况明显减轻;由图10d可知,fv@cx5461组的疾病严重程度指数也在治疗后期显著下降,he染色和甲苯胺蓝(tb)染色的结果表明fv@cx5461处理后小鼠的皮褶厚度减小且减少了肥大细胞浸润;图10e的免疫组化实验发现fv@cx5461治疗组的炎性细胞因子il-6、tnf-α、il-17减少;图10f的elisa实验的结果显示经fv@cx5461治疗后血清中ige、il-4、il-1β和il-17的细胞因子水平下降。由上述结果可知,fv@cx5461治疗特应性皮炎的有效性,疗效比地塞米松效果更好。
56.实施例9
57.本实施例对融合纳米囊泡(fv@cx5461)的安全性进行了评价,具体实验方法如下:分别给健康的小鼠尾静脉注射gevs,nvs,ccr6-nvs,gev@cx5461和fv@cx5461,24h后取样做h&e染色和血常规检测,实验结果如图11所示。
58.图11a的小鼠器官切片h&e染色结果显示,注射fv@cx5461后各个器官组织形态、细胞形态与正常小鼠相似;图11b的血常规结果显示,注射后的小鼠白细胞、红细胞、血小板、血红蛋白、淋巴细胞、单核细胞、中性粒细胞的含量都在正常范围内。由上述结果可知,融合纳米囊泡fv@cx5461的安全性较高。
59.最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1