一种可注射水凝胶/纳米凝胶载药缓释体系及其制备方法和用途
本发明属于生物医药领域,具体涉及一种可注射水凝胶/纳米凝胶载药缓释体系及其制备方法和用途。
背景技术:
1、随着社会老龄化的不断加重,脊柱退变性疾病(如腰椎间盘突出症、腰椎管狭窄症等)发病率不断增高,腰腿痛已成为发病率最高的疼痛性疾病之一。据报道,全球腰腿痛患病率高达12%;一项who调查显示,37%的青少年每月会至少出现一次腰痛。脊柱的退变是源于椎间盘的退变(变性、失水),椎间盘由内部的髓核和周围包围的纤维环组成。随着脊柱退变性疾病的不断进展,常规保守治疗仅能部分缓解临床症状,大部分患者不得不最终接受手术治疗。虽然目前针对脊柱退变性疾病的手术方式众多,并且不断趋近微创化,但无论何种手术方式都无法克服如手术损伤、术后复发、邻近节段退变加速、远期疗效不确切等问题,这无疑给个人和社会带来沉重的经济、社会负担。针对椎间盘退变初期的患者,尤其是仅表现为盘源性腰痛的患者,如果能通过某种方式延缓甚至逆转椎间盘退变进程,将从源头上减少脊柱退变性疾病的发生。随着生物工程技术的发展,通过髓核组织工程技术,实现椎间盘髓核再生、修复已成为可能。
2、通过构建可以作为细胞和生物大分子(药物、细胞因子、mirna等)转运载体的髓核替代生物诱导支架材料,结合再生医学为代表的生物医学工程技术,使退变髓核组织再生成为可能。髓核生物医学工程策略的目标是抑制内部炎症反应、促进髓核细胞再生、恢复ecm合成/分解代谢平衡,最终真正恢复椎间盘的生理功能并满足生物力学需求。在这个过程中,髓核替代支架材料的选择处于核心地位。理想的髓核替代支架材料除了具有常规生物材料必须的性能外(如良好的生物安全性和可降解性、与天然髓核相似的生物力学特性、可注射性),还应能够适应髓核内部微环境变化并智能调控其生物学活性。但是大量研究结果显示,由于椎间盘内组织结构复杂、血供极差、力学环境复杂,现有材料如天然材料:脱细胞基质、藻酸盐、多肽水凝胶,以及人工合成材料:透明质酸、plga等,都不能很好地满足体外功能化髓核的构建要求。在国际上,已有大量科学家通过一些包括纤维蛋白凝胶(gelfoamtm),透明质酸海绵(hyaff)以及多肽水凝胶等在内的可以搭载细胞生长的髓核替代支架材料产品进行临床前期研究,但是仍然没有一款成熟的功能化髓核内药物递送产品应用于临床。
3、近年来,人们不断的尝试利用微球、纳米胶束、外泌体、脱细胞基质等递药体系作为髓核替代支架材料,但由于缺乏力学属性、制备工艺复杂、原材料昂贵等局限,始终无法满足上述全部需求。水凝胶材料近年来持续受到关注,并广泛应用于各种组织修复领域。可注射水凝胶固有的渗透性、吸水性、可降解性、良好的生物相容性,以及巨大的载药控释能力和力学支撑潜力,在髓核替代支架材料的选择中具有巨大的应用潜力。然而,可注射水凝胶作为药物递送载体应用于椎间盘再生存在注射后水凝胶材料外渗的潜在风险。因此,需要研究一种可注射性好,并且注射后可以自增强的水凝胶。同时,该水凝胶最好能够具有ph和ros双响应的炎症响应特性,可以迅速对炎症微环境的变化和刺激进行感知和响应,精准可控的将药物释放于疾病部位。
4、此外,microrna(mirna)是一类由18-24个核苷酸序列组成的小型非编码rna,广泛存在于真核生物中,并参与基因调节。成熟的mirna在细胞质中引导risc复合体(mirisc)靶向3’-utr区域中带有部分互补序列的mrna,导致转录沉默或mrna降解,进而调控细胞的多种生理活动。mirna调节失衡在椎间盘退变的发生过程中扮演着重要角色。大量的研究表明,多种mirnas表达异常将导致髓核内部细胞炎症、ecm降解、髓核细胞凋亡等,并通过不同作用机制加速椎间盘髓核退变。因此,寻找并探索mirnas作用靶点和规律,并通过mirnas基因治疗的方法调节髓核细胞功能,在退变椎间盘髓核修复中具有巨大的应用前景。
5、mirnas基因治疗可根据mirnas自身表达情况分为mirnas缺乏时的mirna替代疗法以及过表达时的mirna抑制疗法。然而,无论哪种方法,如何将外源mirna或mirna抑制剂精准、稳定的转运到靶区域是mirna基因治疗退变髓核成败的关键。基于椎间盘内无血管的特殊结构特点,以及mirnas全身递送的诸多局限(如靶器官外异常聚集、靶器官局部低生物活性及多次用药等),mirnas全身递送的方法并不适用于髓核的mirnas基因治疗。然而,由于椎间盘髓核特殊的封闭结构,单纯局部注射mirnas又会导致局部浓度过高、转染效率不足、清除率过快等一系列问题。目前mirna载体又存在装载效率不足、不稳定、制备复杂、生物免疫原性和无法实现智能长效缓释等不足。因此,寻找一种适合椎间盘盘内局部递送mirnas的转运载体,并结合炎症响应型水凝胶共同构建智能mirnas递药系统,在退变髓核mirnas基因治疗中具有重大的科学意义。
技术实现思路
1、本发明的目的是提供一种可注射水凝胶/纳米凝胶载药缓释体系及其制备方法和用途。
2、本发明提供了一种纳米凝胶,它是由如下重量配比的原料制备而成:
3、单(6-氨基-6-去氧)β环糊精3~5份、mmp-2响应型多肽8~12份、氧化葡聚糖8~12份。
4、进一步地,前述的纳米凝胶是由如下重量配比的原料制备而成:
5、单(6-氨基-6-去氧)β环糊精4份、mmp-2响应型多肽10份、氧化葡聚糖10份。
6、进一步地,所述mmp-2响应型多肽的氨基酸序列如seq id no.1所示。
7、本发明还提供了前述的纳米凝胶的制备方法,它包括如下步骤:
8、将单(6-氨基-6-去氧)β环糊精和mmp-2响应型多肽溶于溶剂中,加入氧化葡聚糖,搅拌后而得;
9、优选地,将单(6-氨基-6-去氧)β环糊精和mmp-2响应型多肽溶于溶剂中,滴加氧化葡聚糖,剧烈搅拌后将溶液再加入溶剂中,继续搅拌,透析,过滤,离心、冻干后得到纳米凝胶;
10、更优选地,所述溶剂为pbs。
11、本发明还提供了前述的纳米凝胶作为mrna载体中的用途。
12、本发明还提供了一种载microrna的纳米凝胶,它是由如下重量配比的原料制备而成:
13、前述的纳米凝胶1~20份、microrna 1份;
14、优选地,
15、前述的纳米凝胶5~20份、microrna 1份;
16、更优选地,所述microrna为antagomir-21。
17、本发明还提供了一种载microrna的纳米凝胶的制备方法,它包括如下步骤:将纳米凝胶和microrna在溶剂中混合搅拌后而得。
18、本发明还提供了一种水凝胶前驱体,它含有如下重量分数的组分:
19、接枝苯硼酸的羧甲基壳聚糖4~7份、接枝3,4,5羟基苯甲醛的明胶8~12份、丙炔酸改性的聚乙二醇分子6~10份、水700~1000份;
20、优选地,它含有如下重量分数的组分:
21、接枝苯硼酸的羧甲基壳聚糖6份、接枝3,4,5羟基苯甲醛的明胶10份、丙炔酸改性的聚乙二醇分子8份、水880份。
22、进一步地,所述接枝苯硼酸的羧甲基壳聚糖是按照如下方法制备而成:
23、在羧甲基壳聚糖和3-醛基苯硼酸中加入还原剂后在溶剂中反应得到羧甲基壳聚糖接枝的苯硼酸;
24、和/或,所述接枝3,4,5羟基苯甲醛的明胶是按照如下方法制备而成:
25、在明胶和3,4,5-羟基苯甲醛中加入还原剂后在溶剂中反应得到接枝3,4,5羟基苯甲醛;
26、和/或,所述丙炔酸改性的聚乙二醇分子是按照如下方法制备而成:
27、将聚乙二醇、丙炔酸和催化剂溶于有机溶剂中,反应得到丙炔酸改性的聚乙二醇分子;
28、优选地,
29、所述接枝苯硼酸的羧甲基壳聚糖是按照如下方法制备而成:
30、在羧甲基壳聚糖水溶液中加入3-醛基苯硼酸dmso溶液,然后加入还原剂反应得到羧甲基壳聚糖接枝的苯硼酸;
31、和/或,所述接枝3,4,5羟基苯甲醛的明胶是按照如下方法制备而成:
32、在明胶水溶液中加入3,4,5-羟基苯甲醛dmso溶液,然后加入还原剂反应得到接枝3,4,5羟基苯甲醛。
33、进一步地,
34、所述羧甲基壳聚糖、3-醛基苯硼酸和还原剂的质量比为1:(0.1~1):(0.1~1);
35、和/或,所述明胶、3,4,5-羟基苯甲醛和还原剂的质量比为1:(0.1~1):(0.1~1);
36、和/或,所述聚乙二醇、丙炔酸和催化剂的质量比为1:(0.1~1):(0.01~0.1);
37、优选地,所述还原剂为nabh3cn或nabh4;和/或,所述催化剂为对甲苯磺酸一水合物。
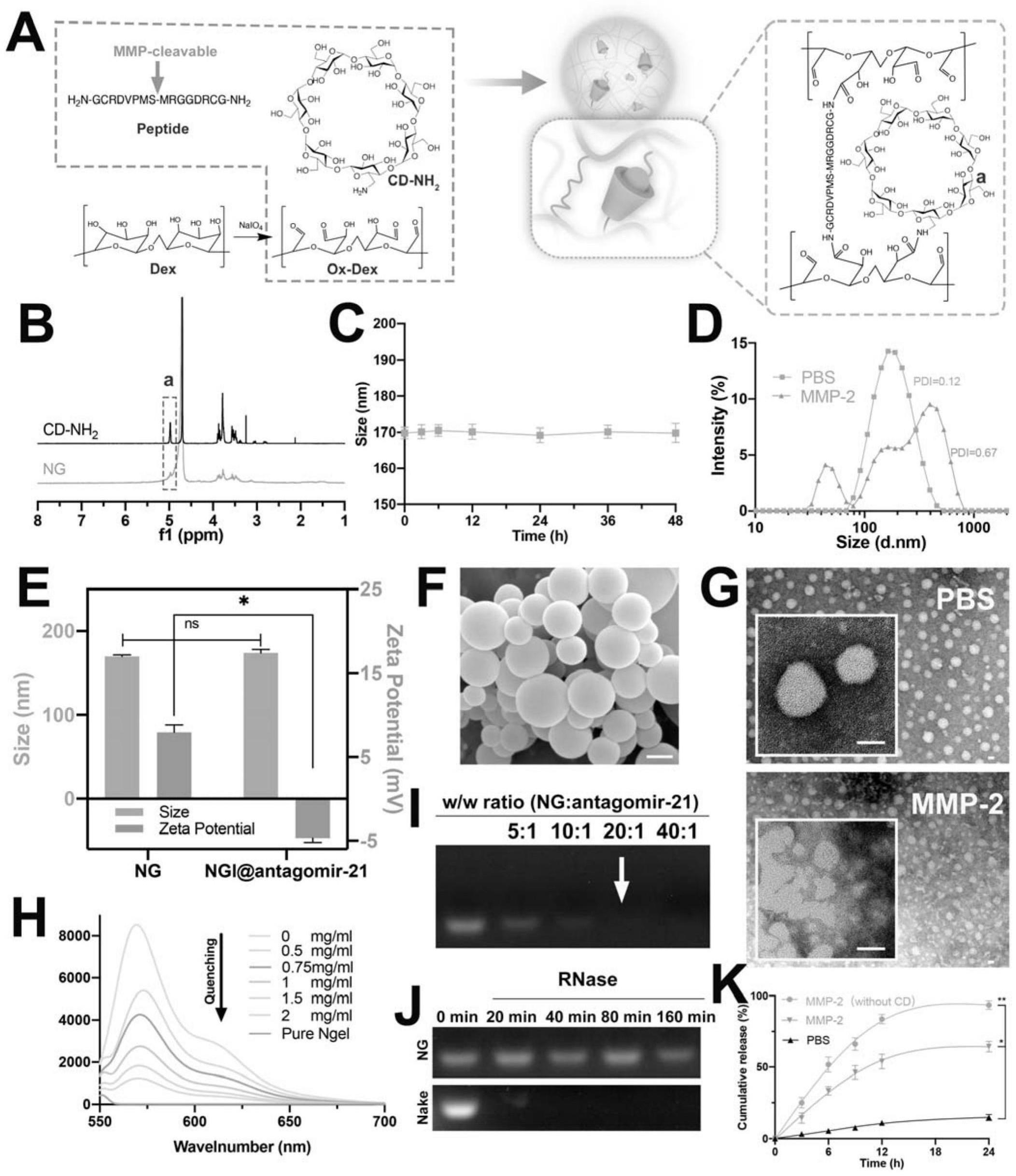
38、进一步地,前述的水凝胶前驱体还含有如下重量份数的组分:
39、前述的载microrna的纳米凝胶0.001~0.005份;
40、优选地,它还含有如下重量份数的组分:
41、前述的载microrna的纳米凝胶0.001~0.002份。
42、本发明还提供了一种水凝胶,它是前述的水凝胶前驱体固化反应而成。
43、进一步地,所述固化反应的条件是在20~30℃静置。
44、本发明还提供了前述的水凝胶在制备退变髓核修复材料中的用途。
45、进一步地,所述退变髓核修复材料是髓核替代材料和/或促髓核再生材料。
46、本发明中,mmp-2响应型多肽是指对mmp-2(基质金属蛋白酶-2)的刺激做出相应响应的多肽,其序列为gcrdvpms-mrggdrcg(seq idno.1)。
47、与现有技术相比,本发明的有益效果为:
48、(1)为了解决髓核替代支架材料的问题,本发明设计了一种自增强的水凝胶体系,即“以弱机械强度”的水凝胶状态注射到椎间盘内部后,自我增强其机械强度,最终达到一种“较强机械强度”的水凝胶状态。这种成胶时间和机械强度可调的水凝胶构建模式,将很好的用于椎间盘再生中,具有防止渗漏及增强脊柱稳定性的作用。该水凝胶还具有ph和ros双响应的炎症响应特性,载药后可根据髓核内部的不同炎症程度释放内部的药物,实现智能给药。同时,本发明水凝胶还具有良好的抗氧化性能和抗炎性能,有利于抑制退变髓核进程,促进退变髓核修复。
49、(2)为了解mirna转运载体的问题,本发明设计了一种能够对mmp-2响应的纳米凝胶载药颗粒。同时,该纳米凝胶装载胆固醇修饰的mirna药物时,是mirna药物中的胆固醇分子与环糊精分子(cd)主客体自组装而形成的,这种自组装作用是物理的相互作用形式,是较弱的作用力,也是可逆的。本发明mirna转运载体有利于mirna药物智能缓释给药,促进ecm再生。
50、(3)本发明将纳米凝胶载药颗粒装载在自增强的水凝胶体系中,最终构建出一种可注射、自增强、具有炎症响应特性、可智能化给药的椎间盘内mirna水凝胶递送体系,该水凝胶递送体系同时具有抗炎抗氧化和促进ecm再生的效果,具有优异的促进退变髓核再生、修复的功效。
51、(4)本发明水凝胶递送体系缓释mirna药物(如mirna-21抑制剂antagomir-21)的机制为:①水凝胶对椎间盘内的炎性环境(低ph和高ros)响应,智能裂解释放出纳米凝胶载药颗粒;②纳米凝胶载药颗粒在mmp-2存在下智能裂解;③mirna药物自发缓慢的从ox-dex-cd中释放出来。
52、综上,本发明首先提供了一种可注射水凝胶,该可注射水凝胶植入退变髓核内部后可以自发的增强自身模量,起到充分填充和避免渗漏的作用,同时该水凝胶具有很强的抗炎抗氧化作用,可促进退变髓核的修复。此外,本发明可注射水凝胶具有ph和ros双响应的炎症响应特性,载药后可根据髓核内部的不同炎症程度释放内部的药物。其次,本发明提供了一种可以载mirna的纳米凝胶载药颗粒,该纳米凝胶可在mmp-2存在下智能裂解,释放可以促ecm再生的药物,促进退变髓核修复。本发明将可注射水凝胶与载mirna的纳米凝胶相结合,最终构建一种可注射、自增强、具有炎症响应特性、可智能化给药的mirna水凝胶递送体系,该水凝胶递送体系同时具有抗炎抗氧化和促进ecm再生的效果,可有效促进退变髓核再生、修复。本发明为退变髓核修复提供新思路,最终避免手术带来的风险和巨大的经济花费,具有良好的应用前景。
53、显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
54、以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!