用于组织工程的支架及其在促进细胞分布中的应用
1.本发明涉及一种由生物材料制造的医疗器械,尤其涉及一种以姜黄素为活性成分,辅以聚合物的粉末,以其为敷料,用于促进烧伤创面的愈合。
背景技术:
2.组织工程的发展正逐渐改变着传统的医学治疗,并进一步向临床应用的再生医学发展。生物材料支架是组织工程领域中至关重要的组成部分,它为细胞的粘附、生长和发育提供了合适的机械强度、空间和环境。然而,理想的细胞支架不应仅仅提供生长空间和临时支撑。它还应具有良好的亲和力,实现细胞与材料的良好整合;维持支架形状稳定的力学强度以满足临床应用中组织缺损和修复的实际需要。
3.再生组织的形状应与患者的组织缺损相匹配,这对组织工程的临床转化至关重要。合成的高分子生物材料可以有效地控制其力学性能,但其生物活性有限。天然材料具有较好的活性,但其多孔支架由于力学特性弱、孔隙率高,在使用过程中难以保持原有的形貌和微观结构。
4.组织再生的另一个关键因素是均质化的组织生长。有许多工作试图解决构建高密度接种和种子细胞均匀分布的挑战。多孔支架较高的比表面积可为细胞粘附生长提供接触面,并有利于营养成分渗透。而多孔支架多采用滴注的接种方式,细胞依靠重力和亲水性在支架内分布。这种不受控制的细胞接种模式导致大部分细胞粘附在支架外表面,而支架内部的细胞分布受到阻碍。因此,很多学者尝试通过增加支架的孔径来提高接种的均匀性,但孔径增加也会导致支架无法“锁住”细胞,使得支架内的细胞液流出,不仅细胞损失增加,还降低接种效率,且支架内部的细胞分布仍较少。
5.由于受组织工程多孔支架结构设计的限制,在细胞接种时常会产生难以避免的流失,且难以制备大块均匀的再生组织。天然生物材料构建的多孔支架,更是因其力学性能不足,在体内再生过程中难以抵抗动态的力学环境并维持其形状稳定性,而限制了其在再生医学中进一步的应用。
技术实现要素:
6.本发明的一个目的在于提供一种用于组织工程的支架,利于细胞的保留和储存,提高细胞在支架内的分布数量。
7.本发明的另一个目的在于提供一种用于组织工程的支架,促进细胞在支架内的均匀性,利于在组织工程中的应用。
8.本发明的再一个目的在于提供一种用于组织工程的支架,适用于循环压缩的细胞接种方式,提高细胞的载量。
9.本发明的又一个目的在于提供一种用于组织工程的支架,作为支架材料利于组织再生和重建。
10.本发明的第五个目的在于提供一种用于组织工程的支架,作为医疗器械在骨修复
中的应用。
11.一种用于组织工程的支架,包括蚕丝纤维与丝素蛋白(分子量≥100,000道尔顿),蚕丝纤维与丝素蛋白具有化学交联而形成多孔结构。
12.这种支架具有β-折叠物理交联和(环氧)化学交联的双重交联网络(即“双网络”)。环氧交联剂可以与丝素蛋白以及蚕丝纤维上的氨基和羟基形成化学结合,使得丝素蛋白自身与交联剂形成化学交联的同时,内部均匀分散的短纤维也与丝素蛋白形成稳定的交联结构,以及内部相互连通的微孔结构。
13.蚕丝纤维的复合会抑制冰晶的生长降低支架内微孔孔径,通过调节丝素蛋白与蚕丝短纤维的复合比例,可以调控支架的微孔孔径。即蚕丝纤维的长度增长,总浓度以及蚕丝纤维所占比例增高,会使孔径降低。蚕丝纤维长度减小,总浓度以及纤维占比减少,可以使孔径增大比如:10μm~800μm,孔隙率为80%~98%。蚕丝纤维的复合还显著增强支架的力学性能,其模量可在10kpa~200kpa范围内调节。
14.本发明的支架表现出良好的吸水性,可吸收自身重量8倍以上的水份,并在水环境下优异的弹性和耐疲劳性,在压缩应变超过80%条件下仍能恢复原状,抵抗多次的动态压缩力学环境。
15.本发明的用于组织工程的支架,蚕丝纤维与丝素蛋白的比例为5wt%~200wt%,尤其是按重量,丝素蛋白:蚕丝纤维为2:1。
16.本发明的用于组织工程的支架,所用蚕丝短纤维的长度范围为50μm~900μm,尤其是100μm~200μm,有效增加支架整体强度。
17.本发明的用于组织工程的支架,具有微孔构造,其重量/体积比为0.04~0.12。
18.利用蚕丝纤维增强丝素蛋白复合支架的相互连通的微孔结构和水环境下优异压缩回弹性,可以适用于新型的循环压缩细胞接种方法,将细胞悬液滴加在支架表面或者将材料浸没到细胞悬液之后,仅通过简单的支架挤压回弹循环5次以上,比如:5次~20次,即可实现细胞在支架内部的便捷、快速和均匀地高浓度(6
×
107个细胞/ml)负载与储存(锁定),可以适用于各种细胞的接种,包括但不限于:软骨、骨、神经和皮肤等多种组织细胞,以及骨髓干细胞、胚胎干细胞和神经干细胞等干细胞。
19.本发明的支架简单、快捷、适用于多种组织再生,根据临床患者的实际需求,可以定制个性化形态结构的纤维增强丝素蛋白弹性支架,并构建再生组织。通过简单的灌注冷冻成型制备所需形状的组织工程支架,可用于制备人耳软骨支架,关节软骨支架等软组织填充支架以及应用于创面再生、脊髓神行再生等其它组织工程所需的支架。
20.将细胞悬液滴加在支架表面或者将材料浸没到细胞悬液之后,仅通过简单的支架挤压回弹循环,比如:5~20次,可以实现细胞在支架内部的便捷、快速、均匀地高浓度负载与锁定。该技术具有高度通用性,该技术可以根据临床患者的实际需求,比如:用于骨修复(如:软骨)的医疗器械。
21.制取本发明支架的方法如下:
22.先将丝素蛋白与蚕丝短纤维(纤维长度范围为50μm~900μm)于水中混合,丝素蛋白的浓度为0.01g/ml~0.15g/ml(尤其是0.05g/ml),蚕丝纤维与丝素蛋白的混合比例为5wt%~200wt%;
23.然后,按丝素蛋白和蚕丝纤维总质量,每克加入3mmol的环氧交联剂(如:乙二醇二
缩水甘油醚);
24.混合均匀后加入不同形状模具中,如:但不限于圆柱状、片状、人耳状以及其它适配组织缺损的形状;
25.再将模具放入-80℃到-30℃冷冻1小时~10小时,实现冰晶的取向化生长和形成,以及结构的固定;
26.之后,将模具放入-20℃到-10℃环境中12小时~48小时,进一步化学交联;
27.最后,将模具放置室温环境下解冻后脱模,经冷冻干燥,即得到用于组织工程的支架。
28.本发明所用的蚕丝纤维,可通过将脱胶蚕丝加入强碱溶液(ph10~12),经水解而得。
29.本发明的方法,为了加快交联,在加入交联剂后,还按丝素蛋白和蚕丝纤维溶液总体积加入0.1v/v%~0.5v/v%(相对于)的催化剂:四甲基乙二胺。
附图说明
30.图1为支架的制备流程图;
31.图2为多孔支架双网络交联机制示意图,其中,图a为纯丝素蛋白水溶液,图b为按重量蚕丝纤维:丝素蛋白为2:1的水溶液状态,图c为按重量丝素蛋白:蚕丝纤维为2:1的水溶液状态;
32.图3为不同混合比例丝素蛋白与蚕丝短纤维混合后溶液的表观图;
33.图4为不同混合比例丝素蛋白与蚕丝短纤维混合后制备成多孔支架的表观图,其中,图a为纯丝素蛋白冻干支架,图b为按重量蚕丝纤维:丝素蛋白为2:1的冻干支架,图c为按重量丝素蛋白:蚕丝纤维为2:1的冻干支架;
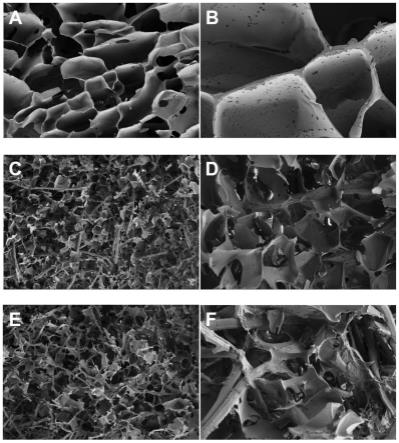
34.图5为不同混合比例支架的sem图;其中,图a为sf与蚕丝短纤维比例1:0的样本的截面于100倍电镜图,图b为sf与蚕丝短纤维比例1:0的样本的截面于500倍电镜图,图c为sf与蚕丝短纤维比例1:0.5的样本的截面于100倍电镜图,图d为sf与蚕丝短纤维比例1:0.5的样本的截面于500倍电镜图,图e为sf与蚕丝短纤维比例1:1的样本的截面于100倍电镜图,图f为sf与蚕丝短纤维比例1:1的样本的截面于500倍电镜图;
35.图6为不同混合比例支架的孔径分布结果图;
36.图7为丝素蛋白-蚕丝短纤维交联结构的红外光谱分析结果图;
37.图8为不同混合比例支架的力学性能测试结果图;
38.图9为体外细胞接种效率检测图,其中,“纵切面表观”栏为倒置荧光显微镜拍摄的dapi染色结果图,“上层水平切面”、“中层水平切面”和“下层水平切面”三栏均为激光共聚焦显微镜拍摄细胞活、死染色结果图;
39.图10体内植入后4周和8周星形再生组织形态分析;其中,图a为纯丝素蛋白支架俯视图及其星形再生软骨组织的形态,图b为与图a对应的侧视图,图c为sf与蚕丝短纤维比例1:2支架俯视图及其星形再生软骨组织的形态,图d为与图c对应的侧视图,图e为裸鼠皮肤下星形软骨大体视图(黑色箭头为皮下张力方向),图f为植入支架的重量统计,图g为再生软骨体积统计图;图h为支架俯视图投影面积结果图;图i为再生软骨组织厚度结果图;图j为在体植入后边缘区域的变形程度示意图;
40.图11星形再生组织在皮下植入后4周和8周的组织学和定量评价;其中,图a1为纯丝素蛋白支架植入后4周的he染色结果图,图a2为图a1中大框处he染色结果图,图a3为图a1中大框处safranin-o染色结果图,图a4为图a1中大框处ii型胶原免疫组化染色图,图a5为a1中小框处he染色结果图,图a6为a1中小框处safranin-o染色结果图,图a7为图a1中大框处ii型胶原免疫组化染色图,图b1为纤维增强型丝素蛋白(sf与蚕丝短纤维比例1:2)支架植入后4周的he染色结果图,图b2为图b1中大框处he染色结果图,图b3为图b1中大框处safranin-o染色结果图,图b4为图b1中大框处ii型胶原免疫组化染色图,图b5为a1中小框处he染色结果图,图b6为b1中小框处safranin-o染色结果图,图b7为图b1中大框处ii型胶原免疫组化染色图,图c1为纯丝素蛋白支架植入后8周的he染色结果图,图c2为图c1中大框处he染色结果图,图c3为图c1中大框处safranin-o染色结果图,图c4为图c1中大框处ii型胶原免疫组化染色图,图c5为c1中小框处he染色结果图,图c6为c1中小框处safranin-o染色结果图,图c7为图c1中大框处ii型胶原免疫组化染色图,图d1为纤维增强型丝素蛋白(sf与蚕丝短纤维比例1:2)支架植入后8周的he染色结果图,图d2为图d1中大框处he染色结果图,图d3为图d1中大框处safranin-o染色结果图,图d4为图d1中大框处ii型胶原免疫组化染色图,图d5为d1中小框处he染色结果图,图d6为d1中小框处safranin-o染色结果图,图d7为图d1中大框处ii型胶原免疫组化染色图,图e为总糖胺聚糖(gag)检测结果统计图,图f为弹性蛋白含量统计图,图g为总胶原蛋白统计图,图h为杨氏模量统计图;
41.图12体内再生人耳形状软骨组织;其中,图a1为人耳形纤维增强型丝素蛋白(sf与蚕丝短纤维比例1:0.5)支架一角度的照片,图a2为图a1另一角度的照片,图b1为图a1所示支架体外培养2周后的照片(再生组织保持原形状和大小不变),图b2为图b1另一角度的照片,,图c1为图a1所示支架按组织工程软骨皮下植入裸鼠后即刻的照片,图c2为图c1另一角度的照片,图d1为体内植入后6周再生耳软骨在裸鼠皮下的形状外观图,图d2为图d1所示软骨剥离后的外观照片,图d3为图d2剥离软骨截面照片,图e1为体内植入后12周再生耳软骨在裸鼠皮下的形状外观图,图e2为图e1所示软骨剥离后的外观照片,图e3为图e2剥离软骨截面照片,图f1为支架体内6周后再生软骨组织切面he染色,图f2为支架体内6周后再生耳软骨周围区域he染色,图f3为支架体内6周后再生耳软骨周围区域safranin-o染色,图f4为支架体内6周后再生耳软骨周围区域ii型胶原的免疫组化染色,图f5为支架体内6周后再生耳软骨边缘区域he染色,图f6为支架体内6周后再生耳软骨边缘区域safranin-o染色,图f7为支架体内6周后再生耳软骨边缘区域ii型胶原的免疫组化染色;图g1为支架体内12周后再生软骨组织切面he染色,图g2为支架体内12周后再生耳软骨周围区域he染色,图g3为支架体内12周后再生耳软骨周围区域safranin-o染色,图g4为支架体内12周后再生耳软骨周围区域ii型胶原的免疫组化染色,图g5为支架体内12周后再生耳软骨边缘区域he染色,图g6为支架体内12周后再生耳软骨边缘区域safranin-o染色,图g7为支架体内12周后再生耳软骨边缘区域ii型胶原的免疫组化染色。
具体实施方式
42.以下结合附图详细描述本发明的技术方案。本发明实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精
神和范围,其均应涵盖在本发明的权利要求范围中。
43.本发明以下实施例所用的各项试验方法具体说明如下:
44.1)形态结构的表征与测试
45.通过sem对支架结构进行表征,观察支架的形态是否发生变形、坍塌以及孔径大小和整体结构。
46.2)力学性能测试与表征
47.将支架制备成直径6mm、高6mm的圆柱体,以力学测试仪测试其在平放状态下的抗压强度、应力应变曲线以及循环压缩性能等。
48.3)吸水性能测试与表征
49.将支架制备成直径6mm、高6mm的圆柱体,测试其在水环境下自身吸收水的最大质量。
50.4)软骨细胞培养
51.无菌条件下切取兔耳软骨组织,切成1~2mm3,置于含0.15%胶原酶的培养基(dmem)中,37℃摇床中消化过夜(100r/min,8~10h)。将收获的软骨细胞接种到含有10%胎牛血清(fbs)和1%青霉素-链霉素-两性霉素b的dmem培养皿(10cm2)中,37℃、5%co2条件下培养。取第2代软骨细胞备用。
52.5)软骨细胞高密度、均匀接种
53.收集软骨细胞并与培养液混合,制备形成6
×
107个细胞/ml的细胞混悬液,取50μl细胞混悬液,接种于已消毒的支架上并用无菌镊子反复按压,静置4h后添加培养基并于体外培养1周,每2天换液1次。
54.6)冠状面总体细胞分布
55.取体外培养一周后组织样品,并用4%多聚甲醛固定48h,脱水,石蜡包埋,冠状切片(厚度为5μm),通过dapi染色进行观察。
56.7)不同水平面细胞密度
57.取体外培养一周后组织样品,分为三等份,观察上、中和下不同部分的细胞活力及细胞密度,经活死细胞染色,在共聚焦激光扫描显微镜下进行观察。
58.8)动物手术方法
59.使用雄性裸鼠(约4周),戊巴比妥腹腔注射麻醉,俯卧位,消毒、铺巾。取背部切口,长约1.5cm,切开皮肤,钝性分离切口周围皮肤,在无齿镊的辅助下,将培养好的再生组织埋入裸鼠皮下,切口处使用5-0缝线进行缝合。对于埋入组织后的皮下残留气体,采用1ml注射器抽吸,从而使皮肤紧贴再生组织。于裸鼠皮下分别培养4周、8周后取材,后续进行相关分析。
60.9)再生组织形态的表征与测试
61.观察支架(星形)再生组织的形态,是否发生变形、压缩。通过对再生组织进行俯视、侧面观投影,分析再生组织的形状变化参数,包括:投影面积和投影高度。同时,对再生组织进行体积和湿重的定量测量。
62.10)再生软骨组织的定性定量检测
63.大体观察体内培养4、8周的标本,并用4%多聚甲醛固定48h,脱水,石蜡包埋,切片(厚度为5μm),he、safranin-o染色,观察组织结构及细胞外基质分泌情况,免疫组织化学方
法检测ii型胶原的表达情况,并将每组的5个样本称湿重后进行总胶原、总gag、弹性蛋白(elastin)测定。
64.11)生物力学检测
65.样品分别放置于生物力学分析仪上,沿垂直支架方向以1mm/min的速度压缩,直到支架破碎。记录力与位移曲线,计算杨氏模量。
66.12)支架制取
67.本实施例支架制取方法如图1所示。
68.概括的,剪碎蚕茧,将蚕茧碎片脱胶,获得蚕丝。在碱性溶液中加入脱胶蚕丝水解得到蚕丝短纤维(纤维长度范围为50μm~900μm)。
69.将丝素蛋白(sf)500mg(5%w/v)溶于10ml去了离子水中形成透明的溶液。将sf与蚕丝短纤维分别按质量比为1:0、1:0.5和1:1加入短纤维混合均匀
70.将sf与蚕丝短纤维的混合溶液中加入3mmol/g乙二醇二缩水甘油醚(egde)交联剂与0.25%v/v的四甲基乙二胺(temed)催化剂,混合均匀后加入不同形状模具中,如:但不限于圆柱状、片状、人耳状以及其它适配组织缺损的形状。再将模具放入-80℃到-30℃冷冻1小时~10小时,实现冰晶的取向化生长和形成,以及结构的固定。之后,将模具放入-20℃到-10℃环境中12小时~48小时,进一步化学交联。最后,将模具放置室温环境下解冻后脱模,并洗去支架上残留的交联剂成分,再次冷冻12小时后,置于冷冻干燥机中冷冻干燥,即得到用于组织工程的支架。
71.13)统计方法
72.数据用spss软件进行分析。组间比较采用one-wayanova,*p<0.05表示具有统计学差异。所有数值均以均数
±
标准差表示。
73.实施例1支架的结构及力学性能表征
74.由图2可见,sf与蚕丝短纤维以1:0、1:0.5混合所得的混合溶液具有良好的均匀性,大体上看不到聚集成团的现象,而1:1混合的溶液其聚集明显,适量的蚕丝短纤维作为功能性材料成分可以保持混合溶液的均匀性。
75.egde两端含有环氧基,可与亲核试剂反应,包括是丝素蛋白和蚕丝短纤维的氨基、羟基,特别是氨基基团,由此产生交联结构。在冰冻条件下,大部分溶剂被冻成冰晶,在多孔支架上形成孔洞。剩余的聚合物溶液、交联剂和催化剂集中在局部区域,从而形成孔壁结构(参见图3)。由图4可见,sf与蚕丝短纤维混合制备的多孔支架在冻干保存时均能保持模具的目的形状,其中以1:1制备的多孔支架,其表面粗糙、凹凸不平,这是由于蚕丝短纤维含量过高无法均匀分散所致;以1:0和1:0.5制备的支架,其表面平整并且均匀度较好。sem可见(图5),在不含有纤维成分的支架中,其孔径较大分布在100~500μm(图6),交联的丝素蛋形成网络结构,而在复合纤维成分的支架中,可以观察到其孔径更小,且多分布在20~100μm,具有相互交织纤维成分,产生出了新的交联网络结构。
76.红外光谱分析印证了上述结果(图7),可以看到由于受egde化学交联的影响,酰胺带的波峰向低波转移,支架能不仅存在丝素蛋白β折叠的物理交联,并且产生了新的交联结构。压缩测试的结果可见(图8)单纯sf支架的力学性能较弱,在加入纤维成分后机械强度明显增强,以1:0、1:0.5和1:1制备的多孔支架弹性模量分别为16.31
±
1.01,41.22
±
1.40和46.82
±
2.04kpa,从循环压缩力学测试的结果还可以看到,通过纤维成分的加入,双网络结
构赋予了支架更好的弹性与耐疲劳性,确保了细胞支架在体内动态的力学环境中能保持良好的顺应性、形变恢复性。
77.实施例2软骨细胞高密度、均匀接种
78.制得的支架用于软骨细胞培养,考察冠状面总体细胞分布和不同水平面细胞密度。体外培养1周后,将支架切成不同切片分析接种效果(图9),部分样品沿纵向切开,dapi染色可见细胞分布更加均匀,支架内部细胞与接种表面无显著差异。同时,将其余支架从上、中和下三段水平切割,采用活死染色法观察不同水平的细胞活力和密度,可以看到各个水平面细胞分布均匀,且处于中层内部的细胞无明显死亡。
79.由此可见,本实施例的支架充分发挥了蚕丝纤维增强的的丝素蛋白弹性湿润状态下海绵状的压吸特性,允许在细胞悬液接种过程中反复对支架施加压力,积极增加细胞扩散的数量和速率,使更多的细胞被吸收并均匀分布到支架整体上。
80.该支架亲水性好,该特性为支架内部的细胞提供了极佳的营养交换效率,不仅可以使细胞在支架内部分布均匀,更可以使内部细胞吸收到营养,保持良好的细胞活力。
81.实施例3动物实验
82.将在本实施例制得的支架中培养好的再生组织埋入裸鼠皮下,并进行再生组织形态的表征与测试、再生软骨组织的定性定量检测和生物力学检测。
83.采样时可以看到,每个样本都保留了软骨光滑的象牙状外观,形状与原始形状相似。其中丝素蛋白支架组软骨表面颗粒状明显,边缘变形严重;纤维增强型丝素蛋白支架组的表面更光滑、更平坦(图10)。再生组织在体内生长过程中,由于基质分泌,组织的湿重和总体积稳步增加。俯视图投影区域和侧视图厚度定量分析可见两组形状都发生了轻微的变化,最终变形率分别为2.4%和2.9%;侧视图图像显示,纤维增强丝素蛋白构建的再生软骨在不同时间点的厚度一致性优于纯丝素蛋白支架构建的软骨。重要的是,纤维增强丝素蛋白构建的软骨在周围区域和中心区域都比纯丝素蛋白构建的软骨表现出更显著的均匀厚度,表明纤维增强型丝素蛋白弹性支架能够保持原有的精确结构。
84.两组再生星状软骨水平切片组织学检查显示,典型的软骨诱捕结构变得更加明显,随着培养时间的延长,支架逐渐降解,通过safranin-o和免疫组化ii型胶原染色捕捉到gag沉积增强和ii型胶原表达增强(图11)。进一步观察组织学的高倍镜视野可以观察到,纯丝素蛋白支架组显示精确结构的维护性差,并有萎缩的趋势;纤维增强支架再生的软骨组织结构更完整地保存了下来。定量分析进一步支持大体观察和组织学结果。弹性软骨特异性ecm含量(如:总胶原蛋白、gag和弹性蛋白)呈逐渐增加的趋势,说明体内环境有利于软骨再生的改善。与皮下植入4周和8周时纯丝素蛋白构建的再生软骨模量分别为0.615
±
0.03mpa和1.38
±
0.07mpa相比,纤维增强组的再生软骨模量分别为1.60
±
0.11mpa和3.10
±
0.17mpa两组的定量生化和生物力学结果也有统计学差异,且纤维增强型丝素蛋白组再生软骨组织表现更为成熟,说明纤维成分的加入对软骨的形成有积极作用。
85.制备人耳形状的纤维增强型丝素大那笔多孔支架,复合软骨细胞成功地再生出人耳形态的软骨样组织,并在裸鼠皮下植入12周后,基本保持了其原始的大小、形状。软骨样结构明显,并且力学强度出色。(图12)
86.可见,本实施例提供的支架在再生医学中的应用优势,皮下高压环境下进行体内培养,与原始形状相比,未观察到任何退化迹象,显示出良好的形状保持能力。机械强度试
验,以及二维面积和支架高度变化的定量分析,甚至三维形状观察都揭示了同样的结论,并且纤维成分的加入对软骨的形成有积极作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1