一种包含SN38的抗体药物偶联物中间体及其制备方法与流程
本发明涉及抗体药物偶联物领域,具体涉及一种抗体药物偶联物中间体及其制备方法。
背景技术:
1、抗体偶联药物(antibody-drug conjugate,adc)作为一种新型的生物靶向药物,实现了单抗靶向作用和小分子药物细胞毒性的强强联合,现已成为肿瘤靶向治疗发展最快的领域之一。adc的三个组成单元(抗体、细胞毒素和连接子)共同组成靶向药物递送系统,其中抗体实现靶向性,连接子保证adc在血液转运过程中的稳定性,而到达作用靶点后,毒素发挥对癌细胞的杀伤作用。目前有60多种adc药物正在推进抗肿瘤治疗临床试验,其中绝大多数毒素为微管蛋白抑制剂,少部分为dna抑制剂。dna抑制剂相比较微管蛋白抑制剂有两个优势:1)dna抑制剂(picomolar ic 50values)比微管蛋白抑制剂(sub-nanomolar ic50values)有更高活性,在治疗较少抗原的肿瘤中起到更好的作用;2)能够杀死不在分裂期的癌症细胞,在进行实体瘤治疗方面具有优势。
2、喜树碱类化合物是临床中应用的拓扑异构酶1(top1)抑制剂,对临床上生长缓慢的实体瘤有良好的效果。但是喜树碱的特殊结构导致其水溶性及脂溶性都很差,必须进行水溶性改造。以喜树碱为弹头的adc药物为解决上述缺陷提供了新的方案。
3、目前已有2款以喜树碱衍生物为弹头的adc药物获批上市,为enhertu(trastuzumab deruxtecan)和trodelvy(sacituzumab govitecan),它们在治疗肿瘤尤其是恶性肿瘤方面满足了极大的临床需求。阿斯利康/第一三共研发的enhertu以组织蛋白酶b活化的ggfg四肽作为linker,并引入一小段自裂解结构,释放出来的是exatecan的衍生物dxd。在her2阳性转移性乳腺癌中,99例患者使用enhertu的客观缓解率为54.5%,疾病控制率为93.9%。sacituzumab govitecan的连接子为mcc-triazole spacer-peg7-x-lysine-pabc,在细胞中溶酶体(ph在5左右)中分解释放喜树碱(sn38)。sacituzumab govitecan的三阴乳腺癌临床二期结果显示,其有效率高达30%,69.5%的患者肿瘤都出现了缩小,而三阴乳腺癌临床几乎是“无药可治”。此外,针对多线治疗失败的小细胞肺癌,sacituzumabgovitecan可以使60%的患者肿瘤缩小;针对化疗、靶向和pd-1治疗都失败的非小细胞肺癌,sacituzumab govitecan的控制率高达43%。但临床试验中,尽管治疗效果显著,但同时也存在较为严重的adc毒性引发的安全性问题,如血液系统毒性、神经毒性、肺毒性、皮肤毒性、肝毒性、眼毒性、代谢异常、心脏毒性等,因此改善adc药物的安全性是目前药物开发中需要高度关注和解决的问题。
4、此外,部分adc的连接子及载荷的合成中也存在金属离子反应产物不便于去除问题,如sacituzumab govitecan所用到的cl2a-sn38在合成过程中涉及到点击化学反应(click反应)(参见中国专利申请公开号cn102448494a,说明书第50页第[0273]段),因此会导致该反应产物中含有cu2+,且不易去除。
5、连接子(linker)在adc结构中起着至关重要的作用,其会影响adc的药代动力学参数、治疗指数和药效。linker可维持adc复合物在血流中的稳定性,连接子的设计首先要考虑到稳定性,因为adc药物的半衰期比较长,所以需要连接子的性质稳定,这样才能防止连接子在血液中被分解提前释放毒素。如果连接子在血液中不够稳定,就会导致adc在进入肿瘤细胞之前就被分解,药物对肿瘤的打击作用就会降低,甚至会误杀其他细胞。而且,在肿瘤细胞内化adc的过程中,linker应能够快速释放细胞毒性药物。由此,连接子对于开发的adc药品的安全性、有效性具有显著的决定作用。并且根据连接子结构的不同,也极大的影响adc的制备过程的难度系数、生产成本以及环境友好性,并且极大的影响adc药品的质量,如adc的稳定性等,进而会影响adc药物的安全性。
技术实现思路
1、本发明提供了一种包含sn38的抗体药物偶联物中间体及其制备方法,该制备方法步骤简单,节约成本,在反应中不会引入重金属离子,具有更高的环境友好性,并且采用该制备方法合成的抗体药物偶联物中间体具有良好的稳定性,从而显著提升adc药物的安全性。
2、本发明涉及一种如式(ⅰ)所示的抗体药物偶联物中间体:
3、
4、其中:
5、x1为烷烃链或peg链,
6、x2为h或-c(o)nr1r2,且,
7、r1选自氢、卤素、羟基、取代或非取代的c1-6烷基、取代或非取代的c1-6羟烷基、取代或非取代的c1-6氨基烷基、取代或非取代的c1-6烷氧基、取代或非取代的c1-6烷酰基和取代或非取代的c1-6烷醛基;
8、r2选自氢和取代或非取代的c1-6烷基;其中各取代的c1-6烷基任选被1-5个独立地选自以下的取代基取代:卤素、羟基、氨基、羰基、羧基、5-10元杂环基和c1-6卤代烷基,其中所述5-10元杂环基具有1-3个选自氧、氮和硫的杂原子。
9、优选的,所述的x1选自:或其中所述的m选自1、2、3、4、5、6,优选的,m为5;其中所述的p选自1、2、3、4、5、6,优选的,p为2。
10、优选的,所述x1选自:
11、
12、优选的,所述的r1或r2选自:h、甲基、乙基、丙基、丁基、戊基、庚基、cl、br、
13、优选的,所述的x2为:
14、
15、优选的,所述的抗体药物偶联物中间体的结构如式(1)-(16)所示:
16、
17、
18、
19、
20、
21、本发明还提供了一种抗体药物偶联物中间体的制备方法。
22、进一步的,所述的抗体药物偶联物中间体的结构为:
23、
24、
25、所述的r1选自氢、取代或非取代的c1-6烷基、取代或非取代的c1-6羟烷基、取代或非取代的c1-6氨基烷基、取代或非取代的c1-6烷氧基、取代或非取代的c1-6烷酰基和取代或非取代的c1-6烷醛基;
26、所述的r2选自氢和取代或非取代的c1-6烷基;其中各取代的c1-6烷基任选被1-5个独立地选自以下的取代基取代:卤素、羟基、氨基、羰基、羧基、5-10元杂环基和c1-6卤代烷基,其中所述5-10元杂环基具有1-3个选自氧、氮和硫的杂原子。
27、优选的,r1或r2选自:h、甲基、乙基、丙基、丁基、戊基、庚基、甲氧基、乙氧基、cl、br、
28、进一步的,所述的式(4)化合物的制备方法为:
29、反应a:将化合物a和化合物b溶于溶剂中,室温搅拌适当时间后置于低温条件下加入还原剂,再搅拌适当时间后,再置于室温搅拌过夜,反应结束后旋干溶剂并进行萃取、干燥和纯化;
30、反应b:将sn38和dnpc溶于溶剂中,加入有机碱,室温搅拌适当时间,反应结束后旋干溶剂并进行打浆和过滤;
31、反应c:将反应b的产物溶于溶剂中,加入反应a的产物及有机碱,室温搅拌适当时间,反应结束后旋干溶剂并进行纯化;
32、反应d:将反应c的产物溶于溶剂中,加入酸,低温条件下搅拌适当时间,反应结束后旋干溶剂后与mc-vc-pab-pnp一起溶于溶剂中,低温条件下再搅拌适当时间,加入有机碱,反应结束后旋干溶剂并进行纯化。
33、反应进程1:
34、
35、进一步的,所述的式(12)化合物的制备方法为:
36、反应a:将化合物a和化合物b溶于溶剂中,室温搅拌适当时间后置于低温条件下加入还原剂后搅拌适当时间,再置于室温搅拌过夜,反应结束后旋干溶剂并进行萃取、干燥和纯化;
37、反应b:将sn38和dnpc溶于溶剂中,加入有机碱,室温搅拌适当时间,反应结束后旋干溶剂并进行打浆和过滤;
38、反应c:将反应b的产物溶于溶剂中,加入反应a的产物及有机碱,室温搅拌适当时间,反应结束后旋干溶剂并进行纯化;
39、反应d:将反应c的产物溶于溶剂中,加入酸,低温条件下搅拌适当时间,反应结束后旋干溶剂后与mp2-vc-pab-pnp一起溶于溶剂中,低温条件下搅拌适当时间,加入有机碱,反应结束后旋干溶剂并进行纯化。
40、反应进程2:
41、
42、进一步的,所述的化合物(i-1)的制备方法为:
43、反应a:将化合物a和化合物b溶于溶剂中,室温搅拌适当时间后置于低温条件下中加入还原剂后搅拌适当时间,再置于室温搅拌过夜,反应结束后旋干溶剂并进行萃取、干燥和纯化;
44、反应b:将sn38和dnpc溶于溶剂中,加入有机碱,室温搅拌适当时间,反应结束后旋干溶剂并进行打浆和过滤;
45、反应c:将反应b的产物溶于溶剂中,加入反应a的产物及有机碱,室温搅拌适当时间,反应结束后旋干溶剂并进行纯化;
46、反应d:将反应c的产物溶于溶剂中,加入二(对硝基苯)碳酸酯和有机碱,恒温搅拌适当时间,反应结束后旋干溶剂并进行纯化;
47、反应e:将反应d的产物和胺类化合物溶于溶剂中,加入有机碱,低温条件下搅拌适当时间,反应结束后旋干溶剂并进行纯化;
48、反应f:将反应e的产物溶于溶剂中,加入酸,低温条件下搅拌适当时间,反应结束后旋干溶剂后与mc-vc-pab-pnp一起溶于溶剂中,低温条件下搅拌适当时间,加入有机碱,反应结束后旋干溶剂并进行纯化。
49、反应进程3:
50、
51、进一步的,所述的化合物(i-2)的制备方法为:
52、反应a:将化合物a和化合物b溶于溶剂中,室温搅拌适当时间后置于低温条件下中加入还原剂后搅拌适当时间,再置于室温搅拌过夜,反应结束后旋干溶剂并进行萃取、干燥和纯化;
53、反应b:将sn38和dnpc溶于溶剂中,加入有机碱,室温搅拌适当时间,反应结束后旋干溶剂并进行打浆和过滤;
54、反应c:将反应b的产物溶于溶剂中,加入反应a的产物及有机碱,室温搅拌适当时间,反应结束后旋干溶剂并进行纯化;
55、反应d:将反应c的产物溶于溶剂中,加入二(对硝基苯)碳酸酯和有机碱,恒温搅拌适当时间,反应结束后旋干溶剂并进行纯化;
56、反应e:将反应d的产物和胺类化合物溶于溶剂中,加入有机碱,低温条件下搅拌适当时间,反应结束后旋干溶剂并进行纯化;
57、反应f:将反应e的产物溶于溶剂中,加入酸,低温条件下搅拌适当时间,反应结束后旋干溶剂后与mp2-vc-pab-pnp一起溶于溶剂中,低温条件下搅拌适当时间,加入有机碱,反应结束后旋干溶剂并进行纯化。
58、反应进程4:
59、
60、进一步的,所述的化合物(i-1)选自:
61、
62、
63、
64、所述的化合物(i-2)选自:
65、
66、
67、进一步的,上述任一反应进程中所述的“低温条件下”为冰水浴下。
68、进一步的,上述任一反应进程中所述的溶剂可独立地为极性溶剂和/或非极性溶剂,所述的极性溶剂为thf、dmf、dma、nmp的一种或几种;所述的非极性溶剂为二氯甲烷、四氯化碳的一种或几种。
69、进一步的,上述任一反应进程中所述的有机碱可独立地为n,n-二异丙基乙胺、三乙胺、吡啶的一种或几种,优选为n,n-二异丙基乙胺以及吡啶中的一种或两种。
70、进一步的,所述的酸为盐酸、三氟乙酸、柠檬酸中的一种或两种。
71、进一步的,所述的胺类化合物为伯胺或仲胺。
72、进一步的,所述的反应a中使用乙酸乙酯进行萃取,所述的纯化采用柱层析法,洗脱剂为二氯甲烷和甲醇。
73、进一步的,所述的反应b中使用乙酸乙酯、正己烷、二氯甲烷中的一种或多种组合进行打浆。
74、进一步的,所述的反应c中采用柱层析法进行纯化,洗脱剂为二氯甲烷和甲醇。
75、进一步的,所述的反应d中采用柱层析法进行纯化,洗脱剂为二氯甲烷和甲醇。
76、进一步的,所述的反应e中采用柱层析法进行纯化,洗脱剂为二氯甲烷和甲醇。
77、进一步的,所述的反应f中采用制备液相法进行纯化,流动相a为mecn,0.1%hcooh,流动相b为h2o,0.1%hcooh。
78、进一步的,所述反应均在氮气保护下进行。
79、本发明提供的制备抗体药物偶联物中间体(具体为连接基团-sn38共价偶联物)的方法,除制备方法步骤简单,降低了由于重金属残留导致的安全性问题,且使用该抗体药物偶联物中间体制备的抗体药物偶联物在体内将具有更高的稳定性。
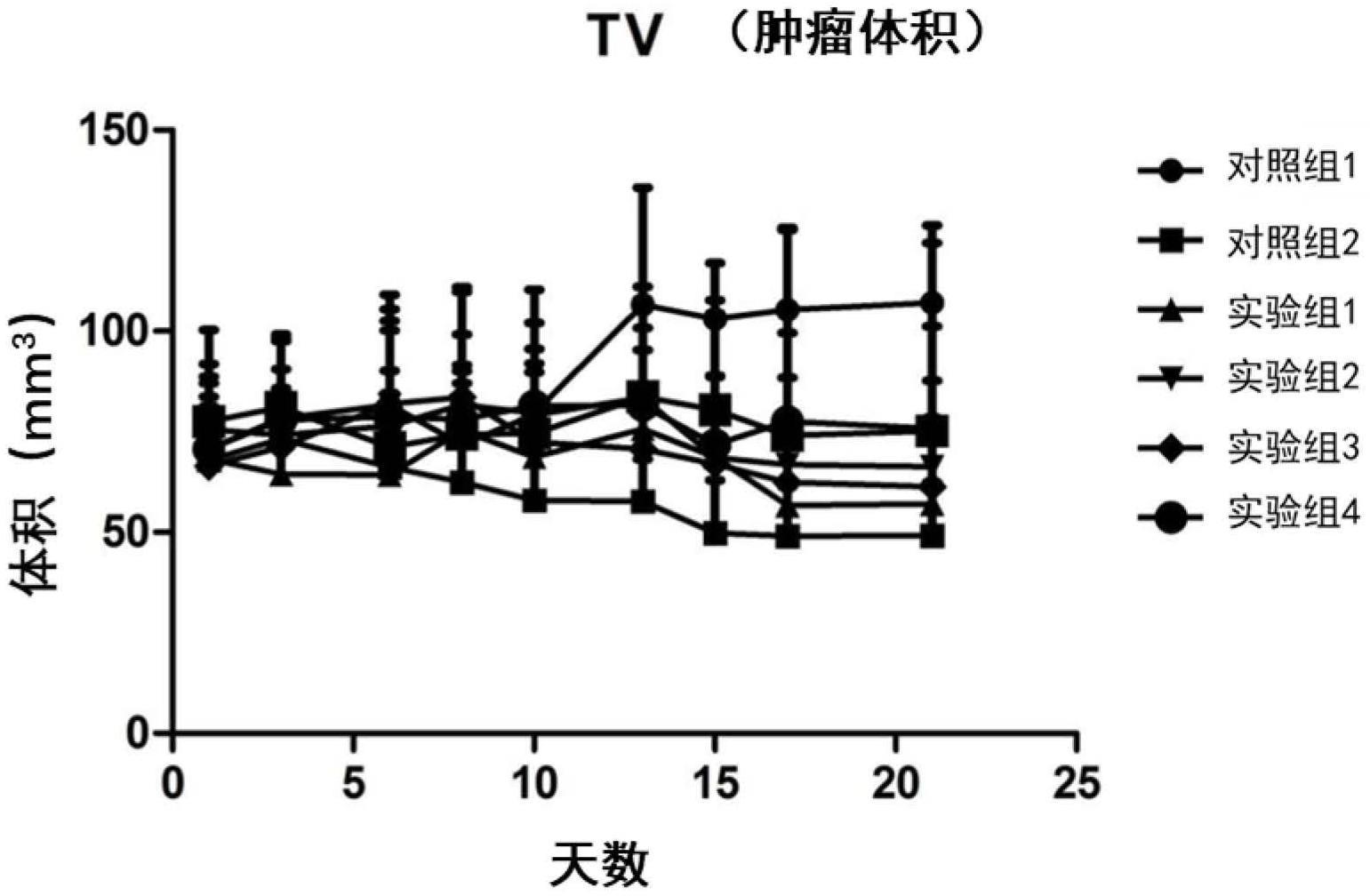
80、同时,发明人惊奇的发现,本发明中的连接子与sn38组合,所制备的抗体药物偶联物能够产生显著的肿瘤抑制效果。
- 还没有人留言评论。精彩留言会获得点赞!