AXL抑制剂SLC-391作为抗病毒治疗药剂的用途的制作方法
本公开提供了使用axl激酶抑制剂治疗包括covid-19的病毒感染性疾病的抗病毒疗法。
背景技术:
1、axl是受体酪氨酸激酶的tam(tyro3、axl和mer)家族的成员。它是一种跨膜受体(分子量:100和140kda),其包含细胞外(n端)结构域和细胞内(c端)酪氨酸激酶结构域。tam家族在正常成人组织和器官系统中起稳态调节因子作用。
2、axl激活可以通过配体依赖性或配体非依赖性受体二聚化来介导。生长停滞特异性蛋白6(gas6)已经被确定为结合axl的细胞外结构域的主要配体,导致gas6/axl复合物的二聚化,并且导致axl的细胞内酪氨酸激酶结构域上酪氨酸残基的自磷酸化。这些细胞内结构域的磷酸化随后触发下游信号传导通路,包括p13k-akt-mtor、mek-erk、nf-κb和jak/stat(gay 2017;wium 2018schoumacher和burbridge 2017)。axl是对肿瘤的发展、生长和扩散以及免疫调节至关重要的多种细胞过程的推定驱动力(schoumacher和burbridge2017),使axl成为抗癌治疗药物的开发的有希望的靶点。
3、此外,axl是i型干扰素响应的关键抑制因子,并且被病毒靶向以阻断抗病毒免疫。已知axl被若干种不同的包膜病毒使用,包膜病毒包括痘病毒、逆转录病毒、黄病毒、沙粒病毒、丝状病毒和α病毒(shimojima 2006、meertens 2012、dowall 2016、meertens 2017)。许多包膜病毒在其膜上展示磷脂酰丝氨酸,通过磷脂酰丝氨酸,它们结合gas6和蛋白s,然后蛋白s结合至axl。经由gas6-axl结合的病毒颗粒通过其酪氨酸激酶结构域有效地激活信号转导,以抑制i型干扰素(ifn)信号传导,并且促进病毒复制(bhattacharyya 2013,meertens 2017)。axl通过两种机制增加病毒感染,即通过“凋亡拟态”增强病毒进入和抑制抗病毒i型干扰素响应。
4、axl信号传导经由socs1/3和tbk1抑制病毒诱导的ifn响应(sharif 2006,cruz2019),导致受感染的细胞中病毒复制增加,并且降低邻近细胞的病毒防御(huang 2015,chen 2018,strange 2019)。axl是独特的i型干扰素响应检测点。ifnr信号传导诱导axl表达。axl是骨髓细胞(树突状细胞、巨噬细胞)、nk细胞和肿瘤细胞中tlr诱导的i型干扰素(ifn)响应的关键负反馈调节机制(rothlin 2007,lee 2019,canadas2018)。
5、治疗性axl受体抑制改善了实验模型中由原发性病毒感染导致的肺部病理,包括axl在肺部内的重要作用(shibata,2014)。在原发性呼吸道合胞病毒(rsv)感染期间,axl抑制增加了产生ifn-γ的t细胞和nk细胞的数量,抑制了rsv复制和全肺il-4和il-13水平。通过axl抑制作用降低了肺内h1n1感染炎症的致死效应。受感染的小鼠的axl抑制增加了产生ifn-β的巨噬细胞和树突状细胞的数量,并且抑制了嗜中性粒细胞的浸润(shibata 2014)。axl-null小鼠对zika发病机制具有抗性,可能是由于病毒进入减少和ifn响应增强的组合(hastings 2019),这表明axl抑制剂在病毒感染期间作为治疗剂的潜在作用。
6、随着axl被若干种不同的包膜病毒(例如,埃博拉、寨卡))靶向以进入细胞,并且抑制病毒免疫响应,axl已经被公认为用于治疗包括sars-cov-2的多种的包膜病毒的感染的良好药物靶标。bms-777607(一种用于axl的抑制剂)在培养的细胞测定中强烈地抑制axl和mer的配体依赖性激活,在30-3600nm的范围内的浓度下有效地阻断gas6触发的受体激活。用bms-777607处理的野生型骨髓来源的树突状细胞比未处理的细胞对病毒感染更不敏感(bhattacharyya 2013)。已经证明另一种axl抑制剂bgb324(贝森替尼(bemcentinib))在动物模型中对致死性埃博拉病毒感染具有效果(dowall,2016)。在初步的体外研究中,贝森替尼显示出保护细胞免受sars-cov-2诱导的细胞病变效应。随后的研究验证了贝森替尼有效地抑制细胞的sars-cov-2感染的能力,支持了axl抑制剂用于治疗早期sars-cov-2感染的潜在用途,并且将其选择作为在英国对住院covid-19患者进行的多中心ii期临床试验中快速跟踪的首个候选药物。(bergenbio,2020年4月28日新闻稿)。
7、如在“axl促进肺和支气管上皮细胞的sars-cov-2感染”(wang 2020)中所公开的,发现酪氨酸蛋白激酶受体axl与宿主细胞膜上的sars-cov-2s蛋白特异性地相互作用。当在不高度表达axl或ace2的细胞中过表达时,axl与ace2一样有效地促进病毒进入。引人注目的是,删除axl,而不是ace2,显著降低了sars-cov-2病毒假型对肺细胞的感染。可溶性人重组axl,而不是ace2,阻断肺细胞中的sars-cov-2病毒假型感染。综上所述,他们的发现表明axl可能在促进人类呼吸系统的sars-cov-2感染中起重要作用,并且是未来临床干预策略的潜在目标。
8、为了进一步支持使用axl抑制剂作为抗病毒药剂的作用,一项研究探索了sars-cov-2感染的全球磷酸化前景(bouhaddou 2020)。sars-cov-2-感染的vero e6细胞的磷酸化蛋白质组分析揭示了宿主细胞途径被病毒感染劫持。sars-cov-2感染促进了酪蛋白激酶ii(ck2)和p39mapk激活,产生多种细胞因子,并且关闭有丝分裂激酶,导致细胞周期停滞。在一项对68种药物和化合物的筛选研究中,发现对p38、ck2、cdk、axl和pikfyve激酶的药理学抑制具有抗病毒活性,代表了潜在的covid-19疗法。对于axl抑制剂吉瑞替尼(gilteritinib)观察到有效的抗病毒活性(ic50=0.807um)。作者指出,已知axl调节各种细胞内途径,包括ras/erk、pi3k和p38。在sars-cov-2感染期间,p38的抑制抑制了细胞因子的产生,并且损害了病毒复制,这表明对axl的抑制,以及随后对p38信号转导的抑制,可能针对与covid-19发病机制相关的多种机制。
9、已经发现用sars-cov-2感染肺癌细胞诱导与上皮细胞向间质细胞转化(emt)一致的代谢和转录变化,包括上调zeb1和axl,从而在感染后下调ace2(stewart 2020)。研究人员发现,用axl抑制剂贝森替尼治疗下调了zeb1。基于他们的发现,他们得出结论,axl抑制剂可以作为一种疗法,使sars-cov-2感染的细胞远离间质表型移动。
10、另一个最近的出版物表明,axl是促进肺和支气管上皮细胞的感染的sars-cov-2的候选受体(wang 2021)。发现酪氨酸蛋白激酶受体axl与sars-cov-2s的n端结构域特异性地相互作用。在sars-cov-2病毒假型和真性sars-cov-2中,hek293t细胞中axl的过表达被证明与ace2的过表达一样有效地促进sars-cov-2的进入,而敲除axl显示显著地减少h1299肺细胞和人类原代肺上皮细胞中的sars-cov-2感染。可溶性人重组axl阻断表达高水平axl的细胞中的sars-cov-2感染。在来自covid-19患者的支气管肺泡灌洗液细胞中,axl表达水平与sars-cov-2s水平密切相关。
11、参考文献:
12、bhattacharyya s等人,(2013)包膜病毒通过直接激活tam受体使树突状细胞中的先天免疫应答失效(enveloped viruses disable innate immune responses indendritic cells by direct activation of tam receptors),《细胞宿主微生物(cellhost microbe.)》,14(2):136-147。
13、canadas i等人,(2018)由特异性干扰素刺激的内源性逆转录病毒引发的肿瘤先天免疫(tumor innate immunity primed by specific interferon-stimulatedendogenous retroviruses),《自然医学(nat med.)》,24(8):1143-1150。
14、chen j等人,(2018)axl通过拮抗i型干扰素信号传导促进星形胶质细胞的寨卡病毒感染(axl promotes zika virus infection in astrocytes by antagonizing type iinterferon signaling.),《自然微生物学(nat microbiol.)》,3:302。
15、cruz vh等人,(2019)axl介导的tbk1激活驱动胰腺癌中的上皮可塑性(axl-mediated activation of tbk1drives epithelial plasticity in pancreaticcancer),《jci洞察力(jci insight)》4月2日,pii126117。
16、dowall sd等人,(2016)抗埃博拉病毒的多种化合物的抗病毒筛选(antiviralscreening of multiple compounds against ebola virus),《病毒(viruses)》,8:27。
17、gay,c.m.,k.balaji和l.a.byers(2017),向axl给予axe:针对人类恶性肿瘤中的axl(giving axl the axe:targeting axl in human malignancy),《英国癌症杂志(br jcancer)》116(4):415-423。
18、hastings ak等人,(2019)tam受体axl的缺失改善了严重寨卡病毒的发病机制并减少小胶质细胞的凋亡(loss of the tam receptor axl ameliorates severe zikavirus pathogenesis and reduces apoptosis in microglia),《交叉科学(iscience)》,13:339。
19、huang mt(2015)axl受体酪氨酸激酶对ifn-α/β信号传导的反馈调节调节hbv免疫(feedback regulation of ifn-alpha/beta signaling by axl receptor tyrosinekinase modulates hbv immunity),《欧洲免疫学杂志(eur j immunol)》,45:1696。
20、lee aj等人,(2019)nk细胞上的i型干扰素受体负调节干扰素γ的产生(type iinterferon receptor on nk cells negatively regulates interferon-gammaproduction),《免疫学前沿(front immunol.)》,10:1261。
21、meertens l.等人,(2012)磷脂酰丝氨酸受体的tim和tam家族介导登革热病毒进入(the tim and tam families of phosphatidylserine receptors mediate denguevirus entry),《细胞宿主和微生物(cell hostµbe)》,12:544。
22、meertens l.等人,(2017)axl介导寨卡病毒进入人类神经胶质细胞并调节先天免疫应答(axl mediates zika virus entry in human glial cells and modulatesinnate immune responses),《细胞报告(cell rep)》18:324。
23、rothlin cv等人,(2007)tam受体是先天免疫应答的多效性抑制剂(tamreceptors are pleiotropic inhibitors of innate immune response),《细胞(cell)》,131:1124-1136。
24、schoumacher m.和m.burbridge(2017),axl和mer受体酪氨酸激酶在对多种抗癌疗法耐药性中的关键作用(key roles of axl and mer receptor tyrosine kinases inresistance to multiple anticancer therapies),《最新肿瘤学报告(curr oncol rep)》19(3):19。
25、sharif mn等人,(2006)twist介导i型ifn和axl对炎症的抑制(twist mediatessuppression of inflammation by type i ifns and axl),《实验医学杂志(j exp med)》203(8):1891-1901。
26、shibata t等人,(2014)axl受体阻断改善了由原发性病毒感染和哮喘的病毒恶化引起的肺部病变(axl receptor blockade ameliorates pulmonary pathologyresulting from primary viral infection and viral exacerbation of asthma),《免疫学杂志(j immunology)》,192:3569。
27、shimojima m等人,(2006)tyro3家族介导的埃博拉病毒和马尔堡病毒的细胞进入(tyro3family-mediated cell entry of ebola and marburg viruses).《病毒学杂志(jvirol)》80:10109。
28、strange dp等人,(2019)axl促进寨卡病毒进入并调节人睾丸支持细胞的抗病毒状态(axl promotes zika virus entry and modulates the antiviral state of humansertoli cells),《微生物学(mbio.)》10:e01372。
29、wium,m等人,(2018)tam受体在自身免疫性疾病和癌症中的双重作用:综述(thedual role of tam receptors in autoimmune diseases and cancer:an overview),《细胞(cells)》7(10):pii e166。
30、bhattacharyya s等人,(2013)包膜病毒通过直接激活tam受体使树突状细胞中的先天免疫应答失效(enveloped viruses disable innate immune responses indendritic cells by direct activation of tam receptors),《细胞宿主微生物(cellhost microbe.)》,14(2):136-147。
31、bouhaddou m等人,(2020)sars-cov-2感染的全球磷酸化前景(the globalphosphorylation landscape of sars-cov-2infection),《细胞(cell)》,182:685-712。
32、wang s等人,(2020)axl促进肺和支气管上皮细胞的sars-cov-2感染(axlpromotes sars-cov-2infection of pulmonary and bronchial epithelial cells),https://doi.org/10.21203/rs.3.rs-35387/v1。
33、stewart等人,(2020)在肺癌模型中,sars-cov-2感染诱导emt样的分子变化,包括zeb1介导的病毒受体ace2的抑制(sars-cov-2infection induces emt-like molecularchanges,including zeb1-mediated repression of the viral receptor ace2,in lungcancer models)。doi:10.1101/2020.05.28.122291,预印本(preprint)。
34、wang等人,(2021)axl是促进肺和支气管上皮细胞的感染的sars-cov-2的候选受体(axl is a candidate receptor for sars-cov-2that promotes infection ofpulmonary and bronchial epithelial cells),《细胞研究(cell research)》(2021)0:1–15;https://doi.org/10.1038/s41422-020-00460-y。
技术实现思路
1、本文提供了使用有效且选择性的axl抑制剂的抗病毒疗法。特别地,axl抑制剂可以用于预防或治疗肺和支气管上皮细胞的感染。重要的是,因为axl在病毒进入以及调节细胞因子产生、病毒复制和emt中起作用,所以本文所述的axl抑制剂能够通过降低病毒复制和抑制病毒进入来进行早期疾病干预,从而预先阻止严重呼吸道症状或其他器官代偿失调的潜在发展。
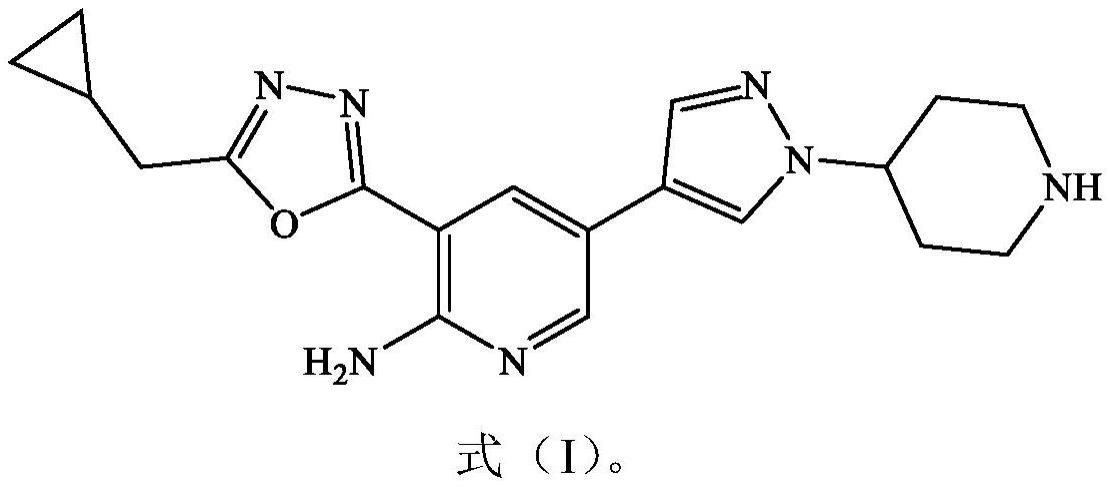
2、具体地,充当抗病毒药剂的axl抑制剂是3-(5-(环丙基甲基)-1,3,4-噁二唑-2-基)-5-(1-(哌啶-4-基)-1h-吡唑-4-基)吡啶-2-胺(“slc-391”)。
3、在各种实施例中,病毒感染由呼吸道病原体引起,呼吸道病原体如冠状病毒,包括感染人类和非人类动物的那些病毒,如β冠状病毒(例如,sars和mers)。
4、在各种实施例中,将抗病毒药剂(slc-391)施用于对病毒感染有症状的患者。在其他实施例中,将抗病毒药剂(slc-391)施用于对病毒感染测试呈阳性的无症状患者。
5、在其他实施例中,抗病毒药剂(slc-391)与第二抗感染药剂(例如干扰素、利巴韦林(ribivarin)等)共同施用。
- 还没有人留言评论。精彩留言会获得点赞!