用于预防和治疗衰老相关疾病的白三烯A4水解酶(LTA4H)的苯并二噁烷调节剂的制作方法
本发明涉及衰老相关的疾病的预防和治疗。本发明涉及通过调节白三烯a4水解酶(“lta4h”)使用苯并二噁烷白三烯产生抑制剂来治疗和/或预防与衰老相关的病状,例如认知障碍、运动障碍和神经炎症。
背景技术:
1、以下内容仅作为背景信息提供,并且不被认为是本发明的现有技术。
2、衰老是多种人类疾病的重要风险因素,该多种人类疾病包括认知障碍、癌症、关节炎、视力丧失、骨质疏松症、糖尿病、心血管疾病和中风。除了自然衰老期间的正常突触丧失之外,突触丧失是许多神经退行性病状常见的早期病理事件,并且与这些病状相关的神经元和认知损伤最相关。因此,衰老仍然是痴呆相关的神经退行性疾病如阿尔茨海默病(ad)的单一最主要的风险因素(bishop n.a.等人,《衰老和认知衰退的神经机制(neuralmechanisms of ageing and cognitive decline)》,《自然(nature)》464(7288),529-535(2010);heeden t.等人,《对衰老思维的洞察:来自认知神经科学的观点(insights intothe ageing mind:a view from cognitive neuroscience)》,《自然评论神经科学(nat.rev.neurosci.)》5(2),87-96(2004);mattson,m.p.等人,《衰老和神经元脆弱性(ageing and neuronal vulnerability)》,《自然评论神经科学》7(4),278-294(2006))。类似地,运动技能的下降与衰老相关。(hoogendam yy等人,《老年与精细运动技能的恶化有关:一项基于人群的中老年人研究(older age relates to worsening of fine motorskills:a population-based study of middle-aged and elderly persons)》,《衰老神经科学前沿(front.aging neurosci.)》,6(2014))。此外,在健康脑和患病脑中(如在ad中),神经炎症与衰老有关。(lynch ma,《年龄相关的神经炎性变化对神经元功能产生负面影响(age-related neuroinflammatory changes negatively impact on neuronalfunction)》,《衰老神经科学前沿》1(6),1-8(2010))。衰老影响身体的所有组织和功能,包括中枢神经系统,并且神经退化和诸如认知或运动技能等功能的下降会严重影响生活质量。认知衰退、运动障碍、神经炎症和神经退行性病症的治疗在预防和逆转损伤方面具有有限的成功。因此,重要的是确定通过防止、对抗或逆转衰老的影响来维持认知和运动的完整性的新的治疗方法。
3、白三烯a4水解酶(“lta4h”或“lta4h”)是一种可溶性单体酶,其可以将脂质代谢物白三烯a4(“lta4”或“lta4”)转化为白三烯b4(“ltb4”或“ltb4”)。lta4h酶通过其产生ltb4脂质代谢物的能力被表征为促炎性的。此外,ltb4脂质代谢物与嗜中性粒细胞募集相关。因此,lta4h酶与诸如动脉粥样硬化、动脉粥样硬化性冠状动脉疾病、类风湿性关节炎、囊性纤维化、慢性阻塞性肺病、脓毒症、成人呼吸窘迫综合征、炎症性肠病和哮喘等疾病有关。(snelgrove rj,《白三烯a4水解酶:促炎性酶的抗炎作用(leukotriene a4hydrolase:ananti-inflammatory role for a proinflammatory enzyme)》,《胸腔(thorax)》66:550-51(2011);shim ym等人,《白三烯a4水解酶—不断发展的治疗靶点(leukotrienea4hydrolase–an evolving therapeutic target)》,《炎性疾病—免疫病理学、临床和药理学基础(inflammatory diseases-immunopathology,clinical and pharmacologicalbases)》(dr.mahin khatami(编辑)),253-278,(2012))。
4、lta4h酶最近被表征为具有另外的催化活性。lta4h不仅表现出将lta4转化为ltb4的环氧化物水解酶活性,而且还表现出另外的氨基肽酶活性(或“肽酶”活性),将pro-gly-pro肽(p-g-p)切割成pro+gly-pro。这种氨基肽酶活性被认为通过减少p-g-p的累积而有助于lta4h的抗炎作用(snelgrove等人,《lta4h在限制慢性肺嗜中性粒细胞炎症中的关键作用(a critical role for lta4h in limiting chronic pulmonary neutrophilicinflammation)》,《科学(science)》330(6000):90-4(2010))。这一发现可能为炎症性疾病中lta4h抑制剂的临床失败提供了见解。已经描述了lta4h酶的调节剂,包括小分子抑制剂。这些包括这样的小分子,该小分子:结合环氧化物水解酶口袋和氨基肽酶活性位点,如sc-57461a;并且选择性地结合lta4h的环氧化物水解酶结合口袋,如松茋水合物(pinostilbene hydrate)(low cm等人,《开发新的lta4h调节剂以选择性地靶向ltb4生成(the development of novel lta4h modulators to selectively target ltb4generation)》,《科学报告(sci.rep.)》7,44449(2017))。
5、本文描述了一类通过抑制lta4h产生白三烯的苯并二噁烷抑制剂。这些苯并二噁烷抑制剂在改善老龄小鼠以及神经炎症的小鼠模型的认知方面表现出意想不到的稳健效果。
6、iii.
技术实现要素:
7、本发明认识到,随着人们年龄的增长,某些血浆蛋白的量也增加。本发明认识到,此类蛋白可以被称为“促衰老因子”,并且调节它们在血液循环中的活性或浓度可以保护或者甚至逆转某些衰老相关的症状和/或疾病。本发明还基于证明lta4h酶及其产物ltb4在老年受试者中的浓度高于在年轻受试者中的浓度的工作。本发明表明,随着从主观认知衰退(scd)到轻度认知障碍(mci)到阿尔茨海默病(ad)的阿尔茨海默病诊断的恶化,lta4h在人血浆中显著增加。此外,本发明还表明,人lta4h血浆水平与简易精神状态检查(mmse)中认知评分的恶化显著相关。
8、本发明基于用本文公开的苯并二噁烷化合物靶向lta4h酶,用于治疗和/或预防年龄相关病症,如认知障碍病状、年龄相关的痴呆、运动功能障碍、神经炎症和神经退行性疾病。本发明尤其认识到需要新的疗法和新的作用机制来治疗和/或预防认知障碍、年龄相关的痴呆、运动障碍、神经炎症和神经退行性疾病。本发明的组合物涉及通过利用lta4h酶的苯并二噁烷抑制剂来治疗和/或预防认知障碍、年龄相关的痴呆、运动障碍、神经炎症和神经退行性疾病的当前疗法的失败和缺点的解决方案。
9、本发明的一个实施方案包括通过向受试者施用有效量的一种或多种苯并二噁烷化合物来治疗被诊断患有认知障碍的受试者,所述苯并二噁烷化合物是lta4h活性的抑制剂。本发明的另一实施方案包括施用有效量的一种或多种苯并二噁烷化合物,并且随后监测受试者认知功能的改善。本发明的另一实施方案包括通过向受试者施用有效量的一种或多种苯并二噁烷化合物来治疗被诊断患有认知障碍的受试者,其中一种或多种苯并二噁烷化合物以导致改善的认知功能、改善的神经发生或减少的神经炎症的方式施用。本发明的另一实施方案包括通过向受试者全身施用有效量的一种或多种苯并二噁烷化合物来治疗被诊断患有认知障碍的受试者。
10、本发明的一个实施方案包括通过向受试者施用有效量的一种或多种苯并二噁烷化合物来治疗被诊断患有神经退行性运动障碍的受试者,所述神经退行性运动障碍作为实例例如但不限于帕金森病。本发明的另一实施方案包括施用有效量的一种或多种苯并二噁烷化合物,并且随后监测受试者运动功能的改善。本发明的另一实施方案包括通过向受试者施用有效量的一种或多种苯并二噁烷化合物来治疗被诊断患有神经退行性运动障碍的受试者,其中一种或多种苯并二噁烷化合物以导致改善的运动功能、神经发生或减少的神经炎症的方式施用。
11、本发明的另外的实施方案包括通过向受试者施用有效量的一种或多种苯并二噁烷化合物来治疗被诊断患有伴皮质下梗死和白质脑病的常染色体显性遗传性脑动脉病(cadasil)的受试者。本发明的另一实施方案包括施用有效量的一种或多种苯并二噁烷化合物,并且随后监测受试者改善的认知功能、神经发生或减少的神经炎症。
12、本发明的另一实施方案包括通过向受试者施用有效量的一种或多种苯并二噁烷化合物来治疗被诊断患有神经炎症或神经炎症相关病症的受试者。本发明的另一实施方案包括施用有效量的一种或多种苯并二噁烷化合物,并且随后监测受试者减轻的神经炎症。本发明的另一实施方案包括通过向受试者施用有效量的一种或多种苯并二噁烷化合物来治疗被诊断患有神经炎症或神经炎症相关病症的受试者,其中一种或多种苯并二噁烷化合物以导致神经炎症减轻的方式施用。
13、本发明的另一实施方案包括通过向受试者施用有效量的一种或多种苯并二噁烷化合物来治疗被诊断患有认知障碍、运动功能障碍或神经炎症或神经发生下降的受试者,其中在施用后受试者遵循锻炼方案。本发明的另一实施方案包括遵循为受试者开出的锻炼方案。本发明的另一实施方案包括受试者以比施用前受试者锻炼更高的强度和/或更高的频率进行锻炼。本发明的另一实施方案包括受试者以与施用前受试者锻炼类似的强度和/或频率进行锻炼。
14、iv.通过引用并入
15、本说明书中提及的所有出版物和专利申请均通过引用并入本文,就像每个单独的出版物或专利申请都具体且单独地指出通过引用并入本文一样。作为实例而非限制,美国专利申请第13/418,377号、第13/785,097号和第13/974,879号、美国专利第8,551,982号、第9,133,146号和第9,662,339号以及pct专利公开第wo/2012/125598号和第wo/2013/131901号。
16、v.附图说明
17、图1示出了个体人血浆中的通过以相对荧光单位(rfu)计的somalogic somascan测定所测量的lta4h水平,所述个体人血浆来自被诊断患有主观认知衰退(scd)、轻度认知障碍(mci)或可能的/可能地阿尔茨海默病(ad)的患者。
18、图2报告了通过与简易精神状态(mmse)评分相关的somalogic somascan测定以rfu计测量的lta4h的血浆水平。
19、图3示出了在情境恐惧条件测试的训练中,在训练箱(training bin)中的平均冷冻时间百分比(s,秒)。
20、图4示出了在情境恐惧条件测试中30秒(s)箱(bin)的平均冷冻时间百分比。
21、图5示出了在整个180秒情境恐惧条件测试中平均的总冷冻时间领唱。
22、图6报告了在给药12天后,小鼠在y-迷宫海马依赖性记忆测试的熟悉臂中训练期间以秒(sec)计的所花费的平均时间。
23、图7报告了在给药12天后,在y-迷宫海马依赖性记忆测试的熟悉臂中训练期间小鼠的平均进入次数。
24、图8报告了在给药12天后,在y-迷宫海马依赖性记忆测试期间,小鼠在新臂(n)或熟悉臂(f)中花费的时间占在任一臂中花费的总时间的平均百分比。
25、图9报告了在给药12天后的测试期间,小鼠进入新臂(n)或熟悉臂(f)的总次数占进入每个臂的总次数的平均百分比。
26、图10报告了在给药26天后,小鼠在y-迷宫海马依赖性记忆测试的熟悉臂中训练期间花费的以秒(sec)计的平均时间。
27、图11报告了在给药26天后,小鼠在训练期间进入y-迷宫海马依赖性记忆测试的熟悉臂的平均次数。
28、图12报告了在给药26天后,在y-迷宫海马依赖性记忆测试期间,小鼠在新臂(n)或熟悉臂(f)中花费的时间占在任一臂中花费的总时间的平均百分比。
29、图13报告了在给药26天后,在y-迷宫海马依赖性记忆测试期间,小鼠进入新臂(n)或熟悉臂(f)的总次数占进入每个臂的总次数的平均百分比。
30、图14报告了在给药29天后,在放射臂水迷宫(rawm)中所有训练和测试试验中小鼠的平均潜伏期。
31、图15报告了在给药29天后,在放射臂水迷宫(rawm)中,在所有训练和测试试验中小鼠所犯错误的平均数。
32、图16报告了在给药29天后,在放射臂水迷宫(rawm)中的最后一次训练试验和最后一次测试试验中小鼠的平均潜伏期。
33、图17报告了在给药29天后,在放射臂水迷宫(rawm)中,在最后一次训练和最后一次测试试验中小鼠所犯错误的平均数。
34、图18报告了在给药18天后,在y-迷宫海马依赖性记忆测试中,小鼠在训练期间在熟悉的臂上花费的以秒(sec)计的平均时间。
35、图19报告了在给药18天后,在y-迷宫海马依赖性记忆测试中,在训练期间,小鼠在小鼠期间在熟悉的臂中进入的平均次数。
36、图20报告了在给药18天后,在y-迷宫海马依赖性记忆测试中的测试期间,小鼠在新臂(n)或熟悉臂(f)中花费的时间占在任一臂中花费的总时间的平均百分比。
37、图21报告了在给药18天后,在y-迷宫海马依赖性记忆测试中的测试期间,小鼠进入新臂(n)或熟悉臂(f)的总次数占进入每条臂的总次数的平均百分比。
38、图22通过测量治疗后10天小鼠脑中平均神经胶质原纤维酸性蛋白(gfap)百分比阈值面积,示出了化合物1对星形胶质细胞活化的lta4h抑制作用。
39、图23通过测量治疗后10天gfap阳性细胞的平均大小,示出了化合物1对星形胶质细胞活化的lta4h抑制作用。
40、图24通过测量治疗后10天gfap阳性细胞的平均大小,示出了化合物1对星形胶质细胞活化的lta4h抑制作用。
41、图25通过在治疗后10天测量穿过海马的ca1区的大下行血管的水通道蛋白4(aqp4)的平均线强度概况,示出了化合物1对星形胶质细胞活化的lta4h抑制作用。
42、图26通过测量治疗后4周的平均gfap百分比阈值面积,示出了化合物1对星形胶质细胞活化的lta4h抑制作用。
43、图27通过测量治疗后4周gfap阳性细胞的平均数量,示出了化合物1对星形胶质细胞活化的lta4h抑制作用。
44、图28通过测量治疗后4周gfap阳性细胞的平均大小,示出了化合物1对星形胶质细胞活化的lta4h抑制作用。
45、图29通过测量在治疗后4周穿过海马的ca1区的大下行血管的aqp4的平均线强度概况,示出了化合物1对星形胶质细胞活化的lta4h抑制作用。
46、图30示出了用媒介物(图像的左栏)或化合物1(图像的右栏)治疗的小鼠的海马的ca1区中aqp4(紫色)顶行、gfap(白色)中间行和aqp4-gfap合并图像底行的代表性共聚焦显微图像。
47、图31报告了如通过荧光强度(x轴)测量的aqp4强度水平与小鼠脑的海马的ca1区中大下行血管的血管周隙中ltb4(lta4h酶促活性的产物)的血浆水平相关。
48、图32报告了如通过荧光强度(x轴)测量的aqp4强度水平与小鼠脑的海马ca1区中大下行血管的脉管系统空间中ltb4(lta4h酶促活性的产物)的血浆水平相关。
49、图33以c57bl/6小鼠中血浆水平的形式报告了化合物1的药代动力学数据,所述c57bl/6小鼠在给药后的多个时间点用10mg/kg、1mg/kg、0.3mg/kg和0.1mg/kg的单次口服管饲剂量治疗。
50、图34以c57bl/6小鼠中血液水平的形式报告了化合物1的药代动力学数据,所述c57bl/6小鼠在给药后的多个时间点用10mg/kg、1mg/kg、0.3mg/kg和0.1mg/kg的单次口服管饲剂量治疗。
51、图35以c57bl/6小鼠中脑水平的形式报告了化合物1的药代动力学数据,所述c57bl/6小鼠在给药后的多个时间点用10mg/kg、1mg/kg、0.3mg/kg和0.1mg/kg的单次口服管饲剂量的化合物1治疗。
52、图36示出了离体使用化合物在人血液中抑制lta4h的效果。钙霉素刺激增加了人血浆中ltb4的可检测水平,当与化合物1一起温育时,ltb4的可检测水平降低。
53、图37示出了在小鼠血液中使用化合物1离体抑制lta4h的效果。钙霉素刺激增加了小鼠血浆中ltb4的可检测水平,当与化合物1温育时,ltb4的可检测水平降低。
54、图38示出了在给药10天后,媒介物和化合物1治疗组小鼠的以克(g)计的体重变化。在该组(研究1组)中未观察到显著差异。
55、图39示出了在给药4周后,媒介物和化合物1治疗组小鼠的以克(g)计的体重变化。在该组(研究1组)中未观察到显著差异。
56、图40示出了在给药10天后,媒介物和化合物1治疗组小鼠的以克(g)计的体重变化。在该组(研究2组)中没有观察到显著差异。
57、图41示出了在给药4周后,媒介物和化合物1治疗组小鼠的以克(g)计的体重变化。在该组(研究2组)中没有观察到显著差异。
58、图42示出了在给药10天后,媒介物和化合物1治疗组小鼠的以克(g)计的体重变化。在该组(研究3组)中未观察到显著差异。
59、图43示出了在给药4周后,媒介物和化合物1治疗组小鼠的以克(g)计的体重变化。在该组(研究3组)中未观察到显著差异。
60、图44报告了在给药10天后,媒介物和化合物1治疗组小鼠在开阔场地测试中行进的总距离。
61、图45报告了在给药10天后,媒介物和化合物1治疗组小鼠在开阔场地测试中行进的平均速度。
62、图46报告了在给药10天后,媒介物和化合物1治疗组小鼠在开阔场地测试中,在中心(c)相对于外周(p)花费的时间百分比。
63、图47报告了在给药4周后,媒介物和化合物1治疗组小鼠在开阔场地测试中行进的总距离。
64、图48报告了在给药4周后,媒介物和化合物1治疗组小鼠在开阔场地测试中行进的平均速度。
65、图49报告了在给药4周后,媒介物和化合物1治疗组小鼠在开阔场地测试中,在中心(c)相对于外周(p)花费的时间百分比。
66、图50报告了在给药8天后,媒介物和化合物1治疗组小鼠的平均筑巢分数。
67、图51报告了在给药12天后,在线悬挂任务中,媒介物和化合物1治疗组小鼠的最大悬挂时间(sec,秒)。
68、图52报告了在给药19天后测试的媒介物和化合物1治疗组小鼠在转棒任务中掉落前的平均时间(sec,秒)。
69、图53示出了在治疗10天和4周后,媒介物和化合物1治疗组小鼠中海马白细胞介素-1β(il-1β)mrna的平均ddct水平。通过taqman qpcr将mrna表达相对于媒介物归一化。
70、图54示出了在治疗10天和4周后,媒介物和化合物1治疗组小鼠中海马离子化钙结合衔接分子1(iba-1)mrna的平均ddct水平。通过taqman qpcr将mrna表达相对于媒介物归一化。iba1是一种小胶质细胞标志物。
71、图55示出了在治疗10天和4周后,媒介物和化合物1治疗组小鼠中海马组织相容性2d区基因座1(h2d1)mrna的平均ddct水平。通过sybr green qpcr将mrna表达相对于媒介物归一化。
72、图56示出了在治疗10天和4周后,媒介物和化合物1治疗组小鼠中海马双皮质素(dcx)mrna的平均ddct水平。通过sybr green qpcr将mrna表达相对于媒介物归一化。双皮质素是神经发生的标志物。
73、图57示出了在治疗10天和4周后,媒介物和化合物1治疗组小鼠中海马早期生长响应蛋白1(egr1)mrna的平均ddct水平。通过sybr green qpcr将mrna表达相对于媒介物归一化。egr1是神经元活动的标志物。
74、图58示出了在治疗10天和4周后,媒介物和化合物1治疗组小鼠中海马camp响应元件结合蛋白1(creb1)mrna的平均ddct水平。通过sybr green qpcr将mrna表达相对于媒介物归一化。creb1被认为是认知障碍中认知功能的标志物。
75、图59示出了在给药4周后,用媒介物或化合物1治疗的小鼠组的海马中的平均iba-1阈值面积百分比。
76、图60报告了通过elisa测量的以pg/ml计的ltb4的水平,所述ltb4来自在向小鼠给药媒介物或化合物1的10天后从用钙霉素刺激或未刺激的小鼠血液中收集的血浆。
77、图61报告了通过elisa测量的以pg/ml计的ltb4的水平,所述ltb4来自在向小鼠给药媒介物或化合物1的4周后从用钙霉素刺激或未刺激的小鼠血液中收集的血浆。
78、图62报告了通过elisa测量的以pg/ml计的ltb4的水平,所述ltb4来自在用媒介物或化合物1对小鼠进行单剂量给药2小时后从用钙霉素刺激或未刺激的幼龄小鼠血液中收集的血浆。报告了三个独立研究组的数据。
79、图63示出了媒介物和化合物1对血脑屏障(bbb)破坏的lps模型的影响。在不同年龄(青年组和老年组)、lps和媒介物或化合物1治疗的脑匀浆中,以荧光素钠(fitc)的相对荧光单位(rfu)测量bbb渗漏。
80、图64示出了在用媒介物或化合物1治疗,然后用急性高剂量的lps治疗以诱导bbb渗漏的小鼠中,ca1海马中跨下行血管的平均aqp4强度。线形图描绘了在60μm线上的平均aqp4强度,每只小鼠6-8个血管。
81、图65示出了在用媒介物或化合物1治疗,然后用急性高剂量的lps治疗以诱导bbb渗漏的小鼠中,ca1海马中跨下行血管的平均gfap强度。线形图描绘了穿过60μm线的平均gfap强度,每只小鼠6-8个血管。
82、图66报告了在用媒介物或化合物1治疗,然后用急性高剂量lps治疗以诱导bbb渗漏的小鼠中ltb4的终末血浆水平。在钙霉素刺激后,通过elisa测量ltb4水平,单位为pg/ml。
83、图67示出了在媒介物、化合物1和sc-47561a治疗的小鼠的皮质中bsg有害基因的下调水平。
84、图68示出了在媒介物、化合物1和sc-47561a治疗的小鼠的皮质中gpb4有害基因的下调水平。
85、图69示出了媒介物、化合物1和sc-47561a治疗的小鼠的皮质中cxcl12有害基因的下调水平。
86、图70是来自用sc-57461alta4h抑制剂治疗的老龄小鼠的脑组织的无偏单细胞rna测序的内皮细胞基因变化的火山图。
87、图71是来自用sc-57461a lta4h抑制剂治疗的老龄小鼠的脑组织的无偏单细胞rna测序的星形胶质细胞基因变化的火山图。
88、图72是来自用sc-57461a lta4h抑制剂治疗的老龄小鼠的脑组织的无偏单细胞rna测序的周细胞基因变化的火山图。
89、图73示出了与媒介物治疗的小鼠相比,来自用化合物1治疗的小鼠的海马的齿状回的纯化神经元中spock3基因的上调。该基因不受sc-57461a治疗的影响。图描绘了用媒介物治疗的小鼠与lta4h抑制剂sc57461a(x轴)或化合物1(y轴)相比的log10倍数变化。黑点代表用化合物1治疗显著上调或下调但用sc57461a治疗不变的基因。箭头指向最高上调的基因之一spock3。
90、图74示出了与媒介物治疗的小鼠相比,用化合物1治疗的小鼠的海马的齿状回的纯化神经元中dcc基因的上调。该基因不受sc-57461a治疗的影响。图描绘了用媒介物治疗的小鼠与lta4h抑制剂sc57461a(x轴)或化合物1(y轴)相比的log10倍数变化。黑点代表用化合物1治疗显著上调或下调但用sc57461a治疗不变的基因。箭头指向最高上调的基因之一dcc。
91、图75示出了来自媒介物、化合物1和sc-47561a治疗的小鼠的皮质的纯化内皮细胞中plat有益基因的上调水平。
92、图76报告了海马的神经元树突中ltb4受体bltr1与β-微管蛋白的组织学。dapi是蓝色的,bltr1是白色的,β-微管蛋白是紫色的。比例尺为20μm。
93、图77报告了在海马的神经元的细胞核中具有neun的lta4h的组织学。dapi是蓝色的,lta4h是白色的,neun是紫色的。比例尺为20μm。
94、图78是与媒介物治疗的小鼠相比,来自对从用sc-57461a lta4h抑制剂治疗的老龄小鼠富集的脑内皮细胞进行的单细胞rna测序的内皮细胞基因变化的火山图。
95、图79是与媒介物治疗的小鼠相比,来自对从用化合物1lta4h抑制剂治疗的老龄小鼠富集的neun+核进行的单细胞rna测序的ca1神经元基因变化的火山图。
96、图80是与媒介物治疗的小鼠相比,来自对从用化合物1lta4h抑制剂治疗的老龄小鼠富集的neun+核进行的单细胞rna测序的dg神经元基因变化的火山图。
97、图81是与媒介物治疗的小鼠相比,来自对从用sc-57461a lta4h抑制剂治疗的老龄小鼠富集的neun+核进行的单细胞rna测序的ca1神经元基因变化的火山图。
98、图82是与媒介物治疗的小鼠相比,来自对从用sc-57461alta4h抑制剂治疗的老龄小鼠富集的neun+核进行的单细胞rna测序的dg神经元基因变化的火山图。
99、图83示出了与用媒介物治疗的小鼠相比,来自用化合物1lta4h抑制剂治疗的老龄小鼠的皮质脑裂解物的pecam-1的减少。
100、图84示出了与媒介物治疗的小鼠相比,来自用化合物1lta4h抑制剂治疗的老龄小鼠的皮质脑裂解物的mmp9的减少。
101、图85以在给药后的多个时间点用1mg/kg的化合物1的单次口服管饲剂量治疗的c57bl/6小鼠中ltb4的血浆水平的形式报告了化合物1的药效学数据。
102、图86示出了通过somalogic somascan测量的与健康对照相比,人cadasil患者的血浆中ltb4受体(ltb4r)的血浆水平的增加。
103、图87示出了通过elisa测量的与健康对照相比,人cadasil患者中ltb4的血浆水平的增加。
104、图88a是示出与用媒介物治疗的小鼠相比,来自从用媒介物或sc-57461alta4h抑制剂长期治疗的老龄小鼠中分离的脑内皮细胞的单细胞测序的前20个重要生物过程基因本体(go)术语的条形图。
105、图88b是列出如图88a中描述的前20个重要go术语的详细信息的表格
106、图89a是示出与用媒介物治疗的小鼠相比,来自从用媒介物或化合物1lta4h抑制剂长期治疗的老龄小鼠中分离的ca1海马神经元的单细胞测序的前20个显著生物过程go术语的条形图。
107、图89b是列出如图89a中描述的前20个重要go术语的详细信息的表格。
108、图90a是示出与用媒介物治疗的小鼠相比,来自从用媒介物或化合物1lta4h抑制剂长期治疗的老龄小鼠中分离的dg海马神经元的单细胞测序的前20个显著生物过程go术语的条形图。
109、图90b是列出如图90a中描述的前20个重要go术语的详细信息的表格。
110、图91a是示出了与用媒介物治疗的小鼠相比,来自从长期用媒介物或sc-57461alta4h抑制剂治疗的老龄小鼠中分离的ca1海马神经元的单细胞测序的前20个显著生物过程go术语的条形图。
111、图91b是列出如图91a中描述的前20个重要go术语的详细信息的表格。
112、图92a是示出与用媒介物治疗的小鼠相比,来自从用媒介物或lta4h抑制剂sc-57461a治疗的老龄小鼠中分离的dg海马神经元的单细胞测序的前20个显著生物过程go术语的条形图。
113、图92b是列出如图92a中描述的前20个重要go术语的详细信息的表格。
114、图93a示出了与年龄匹配的对照相比,在刺激的血浆中测量的cadasil人类受试者中ltb4水平的增加。
115、图93b示出了,在cadsil人类受试者中相对于年龄匹配的对照,未刺激的血浆ltb4水平趋向增加。
116、图94a示出了在刺激的血浆中测量的在cadasil模型notch3r169c转基因小鼠(r169c)中ltb4水平的显著增加。
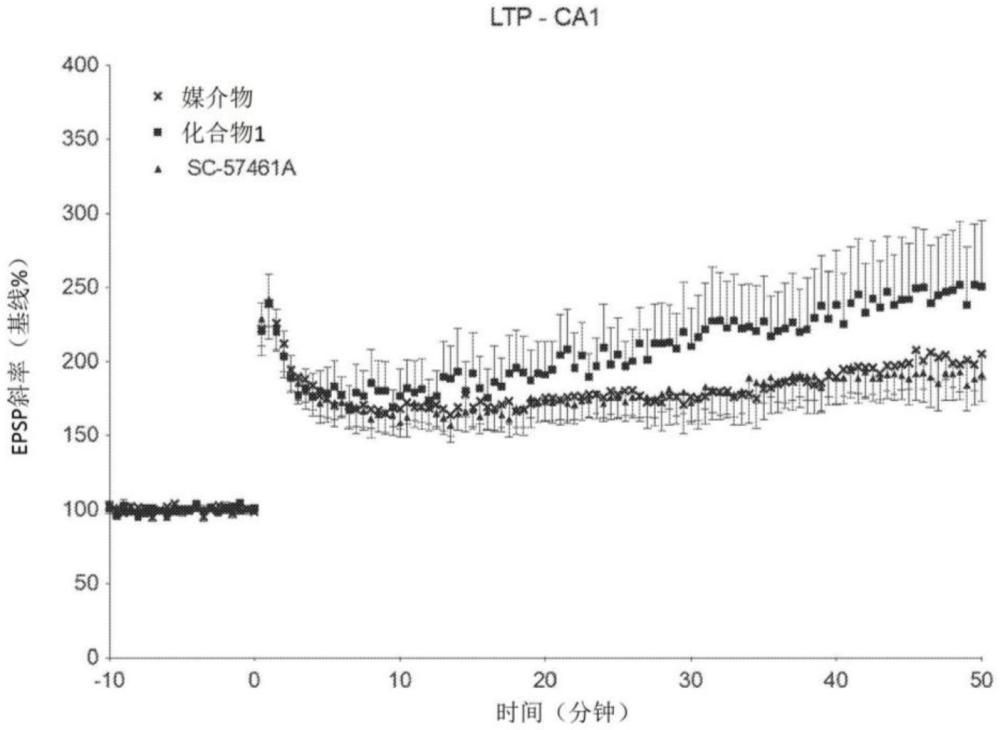
117、图94b示出了在具有未刺激的血浆的组之间检测到的ltb4水平没有变化。
118、图95a示出了用媒介物治疗的cadasil模型notch3r169c转基因小鼠(r169c)的血浆中il-2的趋势性增加,而在用化合物1治疗的那些小鼠中il-2水平显著降低。
119、图95b示出了在用媒介物治疗的cadasil模型notch3r169c转基因小鼠(r169c)中脑皮质裂解物中il-7水平的趋势性增加,而在用化合物1治疗的小鼠中il-7水平显著降低。
120、图96示出了来自用媒介物(x)、化合物1(正方形)或sc57461a(三角形)治疗1个月的老龄小鼠的海马中的ca1神经元的长时程增强的增加。与媒介物或sc57461a小鼠相比,用化合物1治疗的小鼠示出长时程增强的增加。
121、图97示出了来自用媒介物(x)、化合物1(正方形)或sc57461a(三角形)治疗1个月的老龄小鼠的海马中的dg神经元的长时程增强的增加。与媒介物或sc57461a小鼠相比,用化合物1治疗的小鼠示出长时程增强的增加。
122、图98以在给药后6小时用0.3mg/kg、0.1mg/kg和0.03mg/kg的单次口服管饲剂量的化合物治疗的c57bl/6小鼠中ltb4血浆水平的形式报告了化合物1的药效学剂量响应。
123、图99示出了用重组人lta4h蛋白治疗1周的幼龄小鼠中ca1海马突触密度的降低。
124、图100详述了通过比较来自用媒介物或lta4h抑制剂sc-57461a治疗的老龄小鼠的星形胶质细胞的单细胞测序结果而确定的前10个重要生物过程go术语。g:profiler web服务器(https://bitt.cs.ut.ee/gprofiler)。
125、图101详述了通过比较来自用媒介物或lta4h抑制剂sc-57461a治疗的老龄小鼠的周细胞的单细胞测序结果而确定的前10个重要生物过程go术语。g:profiler web服务器(https://bitt.cs.ut.ee/gprofiler)。
126、图102详述了通过比较来自用媒介物或lta4h抑制剂sc-57461a治疗的老龄小鼠的内皮的单细胞测序结果而确定的前10个重要生物过程go术语。g:profiler web服务器(https://bitt.cs.ut.ee/gprofiler)。
127、vi.具体实施方式
128、a.介绍
129、本发明涉及用于治疗和/或预防认知和运动障碍的方法和组合物的鉴定和发现,所述认知和运动障碍包括年龄相关性痴呆、运动技能下降、神经炎症和神经退行性疾病。本文描述了用于治疗患有此类病症的受试者的方法和组合物,这是本发明的方面。本文所述的方法和组合物可用于:预防或治疗认知或运动障碍、年龄相关的痴呆或运动障碍、神经炎症和神经退行性疾病;改善认知或运动障碍、年龄相关的痴呆或运动障碍、神经炎症和神经退行性疾病的症状;延缓衰老相关的认知或运动障碍、年龄相关的痴呆或运动障碍、神经炎症和神经退行性疾病的进展;和/或逆转衰老相关的认知或运动障碍、年龄相关的痴呆或运动障碍、神经炎症和神经退行性疾病的进展。本发明的一个实施方式包括使用lta4h调节性药剂(modulatory agent)作为治疗。本发明的一个实施方案包括lta4h调节性药剂。本发明的另一实施方案包括使用选择性地抑制lta4h酶的环氧化物水解酶活性的lta4h调节剂(modulating agent)。本发明的另一实施方案包括使用抑制lta4h酶的环氧化物水解酶活性和氨基肽酶活性的lta4h调节剂。本发明的另一实施方案包括一种或多种结合至环氧化物水解酶和/或氨基肽酶活性位点的lta4h调节剂。
130、在详细地描述本发明之前,应当理解,本发明不限于所描述的特定方法或组合物,因此它们当然可以变化。也应当理解,本文中所使用的术语仅为了描述特定实施方式,且不意图进行限制,因为本发明的范围将仅受限于所附权利要求。
131、本文讨论的出版物仅仅是用于在本技术的申请日之前提供其公开内容。本文中的任何内容都不应被解释为承认本发明没有资格凭借在先发明而先于此类公开。另外,所提供的公开日期可以不同于可能需要独立确认的实际公开日期。
132、在提供数值范围的情况下,应当理解,除非情境另有明确规定,否则该范围的上限和下限之间的每个中间值,直到下限单位的十分之一,也被具体公开。在规定范围内的任何规定值或中间值与该规定范围内的任何其他规定值或中间值之间的每个较小范围都涵盖在本发明内。这些较小范围的上限和下限可以独立地包括在该范围内或排除在外,并且其中任一个、没有一个或两个限值包括在较小范围内的每个范围也涵盖在本发明内,受限于所述范围中任何明确排除的限值。在规定范围包括所述界限中的一者或两者的情况下,排除那些被包括界限中的任一者或两者的范围也被包括在本发明中。
133、还要注意,权利要求可以被起草成排除任何可选元素。因此,该声明意图用作诸如连接权利要求元素的列举的“单独地”、“仅仅”等的排外性术语的使用或“负面”限制的使用的先行基础。
134、如本领域的技术人员在阅读本公开之后将清楚,本文中所描述且所示出的各个实施方式中的每一者具有分立部件和特征,这些分立部件和特征可以很容易与其他多个实施方式中的任一者的特征分离或组合,而不脱离本发明的范围或精神。任何所列方法可以按所列事件的顺序或按逻辑上可行的任何其他顺序来进行。
135、虽然为了具有功能解释的语法流畅性,已经或将要描述该设备和方法,但是应当明确地理解,除非根据35u.s.c.§112明确表述,否则权利要求不应被解释为必然以任何方式受到“装置”或“步骤”限制的限制,而是应当符合在等同的司法原则下由权利要求提供的定义的含义和等同物的全部范围,并且在权利要求根据35u.s.c.§112明确表述的情况下,将符合根据35u.s.c.§112的完全法定等同物。
136、b.定义
137、除非另外定义,否则本文所使用的所有技术和科学术语均具有与本发明所属领域的普通技术人员所通常理解的含义相同的含义。尽管在本发明的实践或测试中可以使用类似于或等同于本文所述的方法和材料的任何方法和材料,但是现在描述一些潜在的和优选的方法和材料。本文提及的所有出版物都通过引用并入本文,以公开和描述与引用的出版物相关的方法和/或材料。应当理解,在存在矛盾的程度上,本公开取代了所并入的出版物的任何公开内容。
138、要注意,如在本文中和在所附权利要求中所使用,单数形式“一”、“一个”和“该”包括复数个指示物,除非上下文另有明确指示。因此,例如,提及“细胞”包括多个此类细胞,并且提及“肽”包括提及一种或多种肽及其等同物,例如本领域技术人员已知的多肽等。
139、在描述本发明的方法时,术语“宿主”、“受试者”、“个体”和“患者”可互换使用,并且是指根据所公开的方法需要此类治疗的任何哺乳动物。此类哺乳动物包括例如人、羊科动物、牛科动物、马科动物、猪科动物、犬科动物、猫科动物、非人灵长类动物、小鼠和大鼠。在某些实施方案中,受试者是非人类哺乳动物。在一些实施方案中,受试者是农场动物。在其他实施方案中,受试者是宠物。在一些实施方案中,受试者是哺乳动物。在某些情况下,受试者是人类。其他受试者可以包括家养宠物(例如狗和猫)、家畜(例如牛、猪、山羊、马等)、啮齿动物(例如小鼠、豚鼠和大鼠,例如如在疾病的动物模型中),以及非人灵长类动物(例如黑猩猩和猴子)。因此,本发明的受试者包括但不限于哺乳动物,例如人类和其他灵长类动物,如黑猩猩和其他猿和猴物种;和类似物,其中在某些实施方案中,受试者是人。术语受试者还意指包括任何年龄、体重或其他身体特征的人或生物体,其中受试者可以是成人、儿童、婴儿或新生儿。
140、“年轻的”或“年轻个体”意指实足年龄为40岁或更小,例如35岁或更小,包括30岁或更小,例如25岁或更小或22岁或更小的个体。因此,“年轻的”和“年轻个体”可以指年龄在0和40岁之间的受试者,例如0、1、5、10、15、20、25、30、35或40岁。在其他情况下,“年轻的”和“年轻个体”可以指生物学年龄(与实足年龄相反),例如在血浆中没有表现出在相对较老的个体中所表现出的炎性细胞因子水平的个体。相反,这些“年轻的”和“年轻个体”可以指生物学年龄(与实足年龄相反),例如与在相对较老的个体中的水平相比,在血浆中表现出更高水平的抗炎细胞因子的个体。作为实例而非限制,炎性细胞因子是嗜酸性粒细胞趋化因子(eotaxin),并且年轻受试者或年轻个体与老年个体之间的倍数差异为至少1.5倍。类似地,老年人和较年轻的个体在其他炎性细胞因子上的倍数差异可以用来指代生物学年龄。(参见美国专利申请号13/575,437,其通过引用并入本文)。通常,个体是健康的,例如,在收获时个体没有血液恶性肿瘤或自身免疫性疾病。
141、“患有衰老相关的损伤(aging-associated impairment)或处于患有衰老相关的损伤的风险的个体”意指大约超过其预期寿命的50%,诸如超过其预期寿命的60%,例如超过70%,诸如超过75%,80%,85%,90%,95%或甚至99%的个体。个体的年龄将取决于所讨论的物种。因此,这个百分比是基于所讨论的物种的预期寿命。例如,在人类中,此类个体为50岁或更老,例如60岁或更老、70岁或更老、80岁或更老、90岁或更老,并且通常不超过100岁,诸如90岁,即在约50岁和100岁之间,例如50岁、55岁、60岁、65岁、70岁、75岁、80岁、85岁、90岁、95岁、100岁或更老,或在50岁-1000岁之间的任何年龄,其患有如下文进一步描述的衰老相关的病状,例如与自然衰老过程相关的认知或运动障碍;约50岁或更老,例如60岁或更老、70岁或更老、80岁或更老、90岁或更老,并且通常不超过100岁,即在约50岁到100岁之间,例如50岁、55岁、60岁、65岁、70岁、75岁、80岁、85岁、90岁、95岁、100岁的个体,其尚未开始表现出衰老相关的病状(例如认知或运动障碍)的症状;如下文进一步所述,患有由衰老相关的疾病引起的认知或运动障碍的任何年龄的个体,以及被诊断患有通常伴有认知或运动障碍的衰老相关疾病的任何年龄的个体,其中个体尚未开始表现出认知或运动障碍的症状。非人受试者的相应年龄是已知的,并且旨在应用于本文。
142、如本文所用,“治疗”是指以下中的任何一种:(i)预防疾病或病症,或(ii)减少或消除疾病或病症的症状。治疗可以预防性地(在疾病发作之前)或治疗性地(在疾病发作之后)实现。就完全或部分预防疾病或其症状而言,该效果可以是预防性的,和/或就部分或完全治愈疾病和/或可归因于该疾病的不良作用而言,该效果可以是治疗性的。因此,如本文所用的术语“治疗”涵盖哺乳动物中衰老相关的疾病或病症的任何治疗,并且包括:(a)预防在可能易患该疾病但尚未被诊断为患有该疾病的受试者中发生该疾病;(b)抑制疾病,即阻止其发展;或(c)缓解疾病,即引起疾病的消退。治疗可以导致各种不同的物理表现,例如基因表达的调节、组织或器官的再生等。治疗剂可以在疾病发作之前、期间或之后施用。正在进行的疾病的治疗是特别令人感兴趣的,其中该治疗稳定或减轻了患者的不良临床症状。此类治疗可以在受影响的组织的功能完全丧失之前进行。主题疗法可以在疾病的症状阶段期间施用,并且在一些情况下在疾病的症状阶段之后施用。在本发明的另一实施方案中,“治疗”是指将局部组织或血液中的嗜中性粒细胞水平降低到更稳定的状态,即降低到在相同或相似年龄的健康个体中观察到的水平。
143、化学缩写
144、dce=二氯乙烷
145、dcm=二氯甲烷
146、dea=二乙胺
147、dibal-h=氢化二异丁基铝
148、dipea=二异丙基乙胺
149、dma=二甲基乙酰胺
150、dmap=4-二甲基氨基吡啶
151、dme=二甲醚
152、dmf=二甲基甲酰胺
153、dmso=二甲基亚砜
154、et2o=乙醚
155、etoac=乙酸乙酯
156、etoh=乙醇
157、ipa=异丙醇
158、khmds=双(三甲基甲硅烷基)酰胺钾
159、mecn=乙腈
160、meoh=甲醇
161、tbtu=2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲四氟硼酸酯
162、tea=三乙胺
163、tfa=三氟乙酸
164、thf=四氢呋喃
165、tmscf3=(三氟甲基)三甲基硅烷
166、应当理解,除非另有说明,否则术语“式(i)的化合物”和“本发明的化合物”具有相同的含义。
167、在一些实施方案中,所治疗的衰老相关的病状是个体中认知能力的衰老相关的损伤。认知能力或“认知”意指包括注意力和集中力、学习复杂任务和概念、记忆(在短期和/或长期内获取、保留和检索新信息)、信息处理(处理通过五种感官收集的信息)、视觉空间功能(视觉感知、深度感知、使用心理意象、临摹图画、构建物体或形状)、产生和理解语言、言语流畅(寻找单词)、解决问题、做出决定和执行功能(规划和优先排序)的心理过程。“认知衰退”意指这些能力中的一种或多种能力的递降,例如记忆力、语言、思维、判断力等的下降。“认知能力的损伤”和“认知障碍”意指相对于健康个体(例如年龄匹配的健康个体),或相对于个体在较早时间点,例如2周、1个月、2个月、3个月、6个月、1年、2年、5年或10年或更早时间点的能力,认知能力的降低。“衰老相关的认知障碍”意指通常与衰老相关的认知能力的损伤,包括例如与自然衰老过程相关的认知障碍,例如轻度认知障碍(m.c.i.);以及与衰老相关的病症(即随着衰老增加而出现频率增加的病症,例如神经退行性病状,如阿尔茨海默病、帕金森病、额颞叶痴呆、亨廷顿氏病、肌萎缩侧索硬化、多发性硬化、青光眼、肌强直性营养不良、血管性痴呆等)相关的认知障碍。
168、在一些实施方案中,所治疗的衰老相关的病状是个体的运动能力的衰老相关的损伤。运动能力意指包括执行产生运动的复杂肌肉和神经动作的能力的运动过程,例如产生小的运动或精确运动的精细运动技能(例如,写字、系鞋带)和大运动的粗大运动技能(例如,走、跑、踢)。“运动下降”意指这些能力中的一种或多种能力的递降,例如,寻找运动或粗大运动技能的下降等。“运动受损”和“运动障碍”意指相对于健康个体(例如年龄匹配的健康个体),或相对于个体在较早时间点,例如2周、1个月、2个月、3个月、6个月、1年、2年、5年或10年或更早时间点的能力,运动能力/技能的降低。“衰老相关的运动障碍”意指通常与衰老相关的运动能力的障碍或下降,包括,例如,与自然衰老过程相关的运动障碍和与衰老相关的病症(即,随着衰老的增加而出现频率增加的病症,例如,神经退行性病状,如帕金森病、肌萎缩侧索硬化等)相关的运动障碍或下降。
169、在一些实施方案中,所治疗的衰老相关的病状是个体中衰老相关的神经炎症增加。“神经炎症”意指神经系统对损伤、感染或神经退行性疾病的生物化学和细胞响应。此类响应旨在通过涉及中枢神经系统免疫来减少触发因素,以防御潜在的伤害。神经变性发生在中枢神经系统中,并且表现出神经元结构和功能丧失的特征。神经炎性疾病或神经炎性相关的病状或疾病包括,例如但不限于,神经退行性疾病,如阿尔茨海默病、帕金森病、多发性硬化等。
170、c.化合物
171、
172、在一个实施方案中,本发明涉及如上所述的式(i)的化合物(“第一实施方案”),及其药学上可接受的盐,如上所述。在另一实施方案中,本发明涉及如本发明的前一个实施方案(“第二实施方案”)中所述的式(i)的化合物或其药学上可接受的盐,其中基团a是式—nr4r5的基团。在另一实施方案中,本发明涉及如在第一实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中基团a是式b的(4至11元)n-杂环:
173、
174、在另一实施方案中,本发明涉及如第二实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中r4是—h或—(c1-c6)烷基,并且r5是—(c1-c6)烷基;其中所述r4和r5基团的每个—(c1-c6)烷基,当存在时,任选地独立地被一至三个r6基团取代。
175、在另一实施方案中,本发明涉及如紧接地上述实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中r4是—h或—(c1-c6)烷基,并且r5是—(c1-c6)烷基;其中所述r5基团的所述—(c1-c6)烷基被—(c3-c6)环烷基、-(4至11元)杂环烷基、—(c6-c10)芳基或-(5至11元)杂芳基取代;其中所述—(c3-c6)环烷基、-(4至11元)杂环烷基、—(c6-c10)芳基和-(5至11元)杂芳基中的每一者任选地被一至三个独立地选自—(c1-c6)烷基、—cf3和—c(o)or8的基团取代。
176、在另一实施方案中,本发明涉及如本发明的第二实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中r4是—h或—(c1-c6)烷基,并且r5是—(c1-c6)烷基;其中所述r5基团的所述—(c1-c6)烷基独立地被一至三个选自—(c1-c6)烷基、—o(c1-c6)烷基、—c(o)r8、—c(o)or8、—s(o)2r8和—nhc(o)r8的基团取代。
177、在另一实施方案中,本发明涉及如本发明的第二实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中r4和r5各自独立地选自—h或—(c1-c6)烷基。
178、在另一实施方案中,本发明涉及如本发明的第二实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中r4是—h或—(c1-c6)烷基,并且r5是—(c3-c6)环烷基、-(4至11元)杂环烷基、—(c6-c10)芳基和-(5至11元)杂芳基;其中所述r5的前述—(c3-c6)环烷基、-(4至11元)杂环烷基、—(c6-c10)芳基和-(5至11元)杂芳基中的每一者任选地独立地被一至三个选自—(c1-c6)烷基、—o(c1-c6)烷基、—c(o)r8、—c(o)or8、—s(o)2r8和—nhc(o)r8的基团取代。
179、在另一实施方案中,本发明涉及如本发明的第三实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中所述环b是4至8元单环自由基。
180、在另一实施方案中,本发明涉及如紧接地上述实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中所述4至8元单环自由基选自由以下组成的群组:氮杂环丁烷、四氢吡咯、哌啶、六亚甲基亚胺、1,2-二氮杂环丁烷、吡唑烷、咪唑烷、哌嗪、六氢二氮杂异噁唑烷、噁唑烷、四氢2h-1,3-噁嗪、吗啉和六氢-1,4-氧氮杂其中所述单环可以进一步任选地被一至三个选自卤代、—oh、(═o)、—c(o)oh、—c(o)o—(c1-c6)烷基和—(c1-c6)烷基的基团取代。
181、在另一实施方案中,本发明涉及如本发明的第三实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中所述环b是螺环杂环自由基。
182、在另一实施方案中,本发明涉及如紧接地上述实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中所述螺环杂环自由基选自:
183、
184、在另一实施方案中,本发明涉及如本发明的第三实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中所述环b是桥连的双环自由基;或6至11元稠合的双环自由基,其可以是非芳族的或具有一个芳环,条件是双环自由基的芳环,当存在时,未附接至式(i)的化合物的亚甲基碳原子1。
185、在另一实施方案中,本发明涉及如紧接地上述实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中所述6至11元稠合的双环自由基或桥连的双环自由基选自:
186、
187、在另一实施方案中,本发明涉及如本发明的第三实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中l是—ch2—。
188、在另一实施方案中,本发明涉及如本发明的第三实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中l不存在。
189、在另一实施方案中,本发明涉及如本发明的第三实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中所述4至8元杂环b选自氮杂环丁烷基、吡咯烷基、哌啶基和氮杂环庚烷基;其中前述氮杂环丁烷基、吡咯烷基、哌啶基和氮杂环庚烷基环中的每一者任选地被一至三个选自卤代、—oh、(═o)、—c(o)oh、c(o)o—(c1-c6)烷基和—(c1-c6)烷基的基团取代;并且其中
190、l不存在或者是选自—(c1-c6)亚烷基的接头;并且其中
191、r6选自卤代、—or7、—cf3、—cn、—(c1-c6)烷基、—c(o)r7、—c(o)2r7、—c(o)n(r7)2、
192、—n(r7)2、—nhc(o)r7、—nhc(o)n(r7)2、—s(o)2r7、—nh—s(o)2—r7、—(c3-c6)
193、环烷基、-(4至11元)杂环烷基、—(c6-c10)芳基和-(5至11元)杂芳基,其中所述r6基团的所述—(c1-c6)烷基、—o(c1-c6)烷基、—(c3-c6)环烷基、-(4至11元)杂环烷基、—(c6-c10)芳基和-(5至11元)杂芳基中的每一者在可能的情况下任选地被一至三个选自卤代、
194、—oh、—cf3、—cn、(═o)、—(c1-c6)烷基、—c(o)oh、—c(o)o—(c1-c6)烷基、
195、—nh2、—nh(c1-c6)烷基、—n((c1-c6)烷基)2、—s(o)2(c1-c6)烷基、—(c3-c6)环烷基、
196、-(4至11元)杂环烷基、—(c6-c10)芳基和-(5至11元)杂芳基的基团取代。
197、在另一实施方案中,本发明涉及如以上任何实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中x是n。
198、在另一实施方案中,本发明涉及如在除了紧接地上述实施方案之外的任何实施方案中所述的式(i)的化合物或其药学上可接受的盐,其中x是ch。
199、以下是本发明的代表性化合物,它们通过一般合成方案、实施例和本领域已知的方法来制备。
200、
201、
202、
203、
204、
205、
206、
207、
208、
209、
210、
211、
212、
213、
214、
215、
216、
217、
218、
219、
220、
221、
222、
223、
224、
225、
226、
227、
228、
229、
230、
231、
232、
233、
234、
235、
236、
237、
238、
239、
240、
241、
242、
243、
244、
245、
246、
247、
248、
249、
250、
251、
252、
253、
254、
255、
256、
257、
258、
259、
260、
261、在一个实施方案中,本发明涉及表1所示的化合物中的任一者及其药学上可接受的盐。
262、在另一实施方案中,本发明涉及选自由以下组成的群组的化合物:
263、4-(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-基)丁酸;
264、4-(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)苯甲酸;
265、(3s)-3-{4-[(1s,4s)-7-氮杂双环[2.2.1]庚-7-基甲基]苯基}-2,3-二氢[1,4]二噁英并[2,3-b]吡啶;
266、n-(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)甲磺酰胺;
267、(3s)-3-[4-(氮杂环庚烷-1-基甲基)苯基]-2,3-二氢[1,4]二噁英并[2,3-b]吡啶;
268、1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-2-甲基哌啶;
269、7-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-1,7-二氮杂螺[4.4]壬烷-1-甲酰胺;
270、7-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-1,7-二氮杂螺[4.4]壬-2-酮;
271、1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-羧酸;
272、(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-基)(吗啉-4-基)甲酮;
273、8-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-1,3,8-三氮杂螺[4.5]癸烷-2,4-二酮;
274、(3s)-3-{4-[(3-甲氧基哌啶-1-基)甲基]苯基}-2,3-二氢[1,4]二噁英并{2,3-b}吡啶;
275、n-(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}吡咯烷-3-基)-n-甲基乙酰胺;
276、1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-4-(1,1-二氧化-1,2-噻唑烷-2-基)哌啶;
277、(3r)-1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}吡咯烷-3-醇;
278、n-(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)-2-羟基乙酰胺;
279、4-{(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)甲基}苯甲酸;
280、(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)(吗啉-4-基)甲酮;
281、(3s)-3-[4-(吗啉-4-基甲基)苯基]-2,3-二氢[1,4]二噁英并[2,3-b]吡啶;
282、8-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-2,8-二氮杂螺[4.5]癸-1-酮;
283、1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-甲腈;
284、1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-n-甲基哌啶-4-甲酰胺;
285、8-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-2,8-二氮杂螺[4.5]癸-1-酮;
286、n-(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)-2-羟基-2-甲基丙酰胺;
287、n-(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)-1-羟基环丙烷甲酰胺;
288、n-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-n-乙基环戊胺;
289、1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-n-甲基哌啶-4-甲酰胺;
290、n-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-n-甲基环戊胺;
291、1-{(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-3-基)甲基}吡咯烷-2-酮;
292、1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-2-甲基吡咯烷;
293、n-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-2-甲基-1-(吡咯烷-1-基)丙-2-胺;
294、n-环己基-n-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-n′,n′-二甲基乙烷-1,2-二胺;
295、n-(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)乙酰胺;
296、n-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-n-甲基-2-(吡啶-2-基)乙胺;
297、(3s)-3-[4-(吡咯烷-1-基甲基)苯基]-2,3-二氢[1,4]二噁英并[2,3-b]吡啶;
298、1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-3-甲酰胺;
299、1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-甲酰胺;
300、n-(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}吡咯烷-3-基)乙酰胺;
301、1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-n-(2-羟乙基)哌啶-4-甲酰胺;
302、(3s)-3-[4-(1,4-氧杂氮杂环庚烷-4-基甲基)苯基]-2,3-二氢[1,4]二噁英并[2,3-b]吡啶;
303、1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-n-(2-羟乙基)哌啶-4-甲酰胺;
304、4-(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-基)苯甲酸;
305、1-(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-基)脲;
306、7-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-1,7-二氮杂螺[4.4]壬-2-酮;
307、8-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-2-甲基-2,8-二氮杂螺[4.5]癸-1-酮;
308、1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-醇;
309、n-(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-基)甲磺酰胺;
310、3-(1-[4-{(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)丙-1-醇;
311、(3s)-3-{4-[(4-甲基哌啶-1-基)甲基]苯基}-2,3-二氢[1,4]二噁英并{2,3-b}吡啶;
312、n-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-n-乙基乙胺;
313、n-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-1-(甲基磺酰基)哌啶-4-胺;
314、(3s)-3-{4-[(4-氟哌啶-1-基)甲基]苯基}-2,3-二氢[1,4]二噁英并{2,3-b}吡啶;
315、1-(4-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-1,4-二氮杂环庚烷-1-基)乙酮;
316、[(3r)-1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-3-基]乙酸;
317、(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)-甲醇;
318、4-[(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-基)甲基]苯甲酸;
319、(3s)-3-{4-[(4-甲基-1,4-二氮杂环庚烷-1-基)甲基]苯基}-2,3-二氢[1,4]二噁英并{2,3-b}吡啶;
320、(3s)-3-{4-[(3-甲氧基吡咯烷-1-基)甲基]苯基}-2,3-二氢[1,4]二噁英并{2,3-b}吡啶;和
321、n-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-n,2-二甲基丙-2-胺;或其前述中每一者的药学上的盐。
322、在另一实施方案中,本发明涉及选自由以下组成的群组的化合物:
323、(3s)-3-[4-(氮杂环庚烷-1-基甲基)苯基]-2,3-二氢[1,4]二噁英并[2,3-b]吡啶;
324、n-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-n-甲基环戊胺;
325、n-(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-哌啶-4-基)甲磺酰胺;
326、(3s)-3-{4-[(3-甲氧基哌啶-1-基)甲基]苯基}-2,3-二氢[1,4]二噁英并{2,3-b}吡啶;
327、(3s)-3-{4-[(4-甲基哌啶-1-基)甲基]苯基}-2,3-二氢[1,4]二噁英并{2,3-b}吡啶;
328、n-(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)乙酰胺;
329、(3s)-3-{4-[(1s,4s)-7-氮杂双环[2.2.1]庚-7-基甲基]苯基}-2,3-二氢[1,4]二噁英并[2,3-b]吡啶;
330、(3s)-3-[4-(吡咯烷-1-基甲基)苯基]-2,3-二氢[1,4]二噁英并[2,3-b]吡啶;
331、n-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-n-乙基乙胺;
332、n-(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}吡咯烷-3-基)-n-甲基乙酰胺;
333、n-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-2-甲基-1-(吡咯烷-1-基)丙-2-胺;
334、1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-醇;
335、8-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-2,8-二氮杂螺[4.5]癸-1-酮;
336、(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)(吗啉-4-基)甲酮;
337、n-(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}吡咯烷-3-基)乙酰胺;
338、1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-n-甲基哌啶-4-甲酰胺;
339、7-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-1,7-二氮杂螺[4.4]壬-2-酮;
340、(3s)-3-[4-(1,4-氧杂氮杂环庚烷-4-基甲基)苯基]-2,3-二氢[1,4]二噁英并[2,3-b]吡啶;
341、3-(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)丙-1-醇;
342、8-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-2-甲基-2,8-二氮杂螺[4.5]癸-1-酮;
343、(3s)-3-{4-[(4-甲基-1,4-二氮杂环庚烷-1-基)-甲基]苯基}-2,3-二氢[1,4]二噁英并{2,3-b}吡啶;
344、4-(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-基)苯甲酸;
345、(3r)-1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}吡咯烷-3-醇;
346、1-(4-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-1,4-二氮杂环庚烷-1-基)乙酮;
347、1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-甲腈;
348、n-(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)-2-羟基-2-甲基丙酰胺;
349、1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-3-甲酰胺;
350、(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)甲醇;
351、8-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-1,3,8-三氮杂螺[4.5]癸烷-2,4-二酮;
352、n-(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)-1-羟基环丙烷甲酰胺;
353、1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-n-(2-羟乙基)哌啶-4-甲酰胺;
354、n-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-1-(甲基磺酰基)哌啶-4-胺;
355、1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-甲酰胺;
356、4-(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)苯甲酸;
357、1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-2-甲基吡咯烷;
358、1-{(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-3-基)甲基}吡咯烷-2-酮;
359、7-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-1,7-二氮杂螺[4.4]壬-2-酮;
360、1-(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-基)脲;
361、n-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-n-乙基环戊胺;
362、n-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-n-甲基-2-(吡啶-2-基)乙胺;
363、1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-2-甲基哌啶;
364、1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-羧酸;
365、4-{(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)甲基}苯甲酸;
366、(3s)-3-[4-(吗啉-4-基甲基)苯基]-2,3-二氢[1,4]二噁英并[2,3-b]吡啶;
367、(3s)-3-{4-[(4-氟哌啶-1-基)甲基]苯基}-2,3-二氢[1,4]二噁英并{2,3-b}吡啶;
368、(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-基)(吗啉-4-基)甲酮;
369、8-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-2,8-二氮杂螺[4.5]癸-1-酮;
370、n-(1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}哌啶-4-基)-2-羟基乙酰胺;
371、4-[(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-基)甲基]苯甲酸;
372、n-(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-基)甲磺酰胺;
373、1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-n-甲基哌啶-4-甲酰胺;
374、4-(1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-4-基)丁酸;
375、7-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-1,7-二氮杂螺[4.4]壬烷-1-甲酰胺;
376、n-环己基-n-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-n′,n′-二甲基乙烷-1,2-二胺;
377、[(3r)-1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}哌啶-3-基]乙酸;
378、1-{4-[(2s)-2,3-二氢-1,4-苯并二噁英-2-基]苄基}-4-(1,1-二氧化-1,2-噻唑烷-2-基)哌啶;和
379、1-{4-[(3s)-2,3-二氢[1,4]二噁英并[2,3-b]吡啶-3-基]苄基}-n-(2-羟乙基)哌啶-4-甲酰胺;或
380、其前述中每一者的药学上可接受的盐。
381、在另一实施方案中,本发明涉及一种药物组合物,其包含一种或多种如在以上实施方案中的任一者中所定义的式(i)的化合物或其药学上可接受的盐,以及药学上可接受的载剂或赋形剂。
382、除非另有说明,否则如本说明书中使用的所有术语应当以如本领域已知的其普通含义来理解。其他更具体的定义如下:
383、术语“(c1-c6)烷基”是指具有1至6个碳原子的支链和非支链烷基。“—(c1-c6)烷基的实例包括甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、正戊烷、异戊基、新戊基、正己烷、异己烷(例如,2-甲基戊基、3-甲基戊基、2,3-二甲基丁基和2,2-二甲基丁基)。应当理解,(c1-c6)烷基的任何化学上可行的碳原子可以是与另一基团或部分的附接点。
384、术语“(c3-c6)环烷基”是指非芳族的3至6元单环碳环自由基。“(c3-c6)环烷基”的实例包括环丙基、环丁基、环己基、环戊基和环己基。
385、如本文所用,术语“(c6-c10)芳基”是指含有六至十个碳环的芳烃环,并且包括单环和双环,其中至少一个环是芳族的。c6-10芳基的非限制性实例包括苯基、茚满基、茚基、苯并环丁基、二氢萘基、四氢萘基、萘基、苯并环庚基和苯并环庚烯基。
386、如本文所用,术语“4至11元杂环”包括稳定的非芳族4至8元单环杂环自由基或稳定的非芳族6至11元稠合的双环、桥连的双环或螺环杂环自由基。4至11元杂环由碳原子和一个或多个,优选地一至四个选自氮、氧和硫的杂原子组成。杂环可以是饱和的或部分不饱和的。非芳族4至8元单环杂环自由基的非限制性实例包括四氢呋喃基、氮杂环丁烷基、吡咯烷基、吡喃基、四氢吡喃基、二噁烷基、硫基吗啉基、1,1-二氧代-1λ6-硫基吗啉基、吗啉基、哌啶基、哌嗪基和氮杂环庚三烯基(azepinyl)。非芳族6至11元稠合的双环自由基的非限制性实例包括八氢吲哚基、八氢苯并呋喃基和八氢苯并噻吩基。非芳族6至11元桥连的双环自由基的非限制性实例包括2-氮杂双环[2.2.1]庚基、3-氮杂双环[3.1.0]己基和3-氮杂双环[3.2.1]辛基。非芳族6至11元螺环杂环自由基的非限制性实例包括7-氮杂-螺[3,3]庚基、7-螺[3,4]辛基和7-氮杂-螺[3,4]辛基。如本文所用,术语“5至11元杂芳基”包括芳族5至6元单环杂芳基和芳族7至11元杂芳基双环,其中至少一个环是芳族的,其中杂芳基环包含1-4个杂原子如n、o和s。5至6元单环杂芳基环的非限制性实例包括呋喃基、噁唑基、异噁唑基、噁二唑基、吡喃基、噻唑基、吡唑基、吡咯基、咪唑基、四唑基、三唑基、噻吩基、噻二唑基、吡啶基、嘧啶基、哒嗪基、吡嗪基、三嗪基和嘌呤基。7至11元杂芳基双环的非限制性实例包括苯并咪唑基、1,3-二氢苯并咪唑-2-酮、喹啉基、二氢-2h-喹啉基、异喹啉基、喹唑啉基、吲唑基、噻吩并[2,3-d]嘧啶基、吲哚基、异吲哚基、吲唑基、苯并三唑基、苯并呋喃基、苯并吡喃基、苯并二氧杂环戊烯基(benzodioxolyl)、苯并噁唑基、苯并噻唑基、吡咯并[2,3-b]吡啶基和咪唑并[4,5-b]吡啶基。
387、应当理解,当杂环基或杂芳基含有s环原子时,此类s环原子可以以其二价、四价或六价形式存在于环中,即—s—、—s(o)—或—s(o)2—。
388、除非另有说明,否则每个芳基或杂芳基包括其部分或完全氢化的衍生物。例如,喹啉基可以包括十氢喹啉基和四氢喹啉基,萘基可以包括其氢化衍生物,例如四氢萘基。本文所述的芳基和杂芳基化合物的其他部分或完全氢化的衍生物对本领域普通技术人员来说是显而易见的。
389、如本文使用的术语“杂原子”应当被理解为意指除碳以外的原子,例如o、n和s。
390、术语“卤代”或“卤素”是指氟代、氯代、溴代或碘代。
391、符号
392、
393、意指基团r与部分的附接点。
394、在所有烷基或碳链中,一个或多个碳原子可以任选地被杂原子:o、s或n替代,应当理解的是,如果n没有被取代,那么它是nh,还应当理解的是,杂原子可以替代支链或非支链碳链中的末端碳原子或内部碳原子。如上所述,此类基团可以被诸如氧代的基团取代,得到如下定义,例如但不限于:烷氧基羰基、酰基、酰氨基和硫代。
395、对于本技术中公开的所有化合物,在术语与结构相冲突的情况下,应当理解该化合物由结构定义。
396、本发明还涉及药物制剂,其包含作为活性物质的一种或多种本发明的化合物或其药学上可接受的衍生物,任选地与常规赋形剂和/或载剂组合。
397、本发明的化合物还包括它们的同位素标记的形式。本发明的组合的活性药剂的同位素标记的形式与所述活性药剂相同,但事实上所述活性药剂的一个或多个原子被一个或多个原子质量或质量数不同于通常在自然界中发现的所述原子的原子质量或质量数的原子替代。可容易地从商业上获得并且可以根据良好建立的程序并入到本发明的组合的活性药剂中的同位素的实例包括氢、碳、氮、氧、磷、氟和氯的同位素,例如分别为2h、3h、13c、14c、15n、18o、17o、31p、32p、35s、18f和36cl。包含一种或多种上述同位素和/或其他原子的其他同位素的本发明的组合的活性药剂、其前药或其药学上可接受的盐被认为在本发明的范围内。
398、本发明包括使用上述含有一个或多个不对称碳原子的任何化合物,这些化合物可以以外消旋体和外消旋混合物、单一对映异构体、非对映异构体混合物和单独的非对映异构体的形式存在。异构体应当被定义为对映异构体和非对映异构体。这些化合物的所有此类异构形式都明确包括在本发明中。每个立体碳可以是r构型或s构型,或者是构型的组合。
399、本发明的一些化合物可以以多于一种的互变异构体形式存在。本发明包括使用所有此类互变异构体的方法。
400、本发明的化合物仅仅是那些被认为是“化学稳定”的化合物,如本领域技术人员将理解的。例如,将具有“悬挂化合价”或“碳负离子”的化合物不是本文公开的发明方法所预期的化合物。
401、本发明包括式(i)的化合物的药学上可接受的衍生物。“药学上可接受的衍生物”是指任何药学上可接受的盐或酯,或任何其他化合物,其在施用于患者后,能够(直接或间接)提供可用于本发明的化合物,或其药理学活性代谢物或药理学活性残基。药理活性代谢物应被理解为意指能够被酶促或化学代谢的本发明的任何化合物。这包括例如本发明的羟基化的或氧化的衍生化合物。
402、药学上可接受的盐包括那些衍生自药学上可接受的无机和有机的酸和碱的盐。合适的酸的实例包括盐酸、氢溴酸、硫酸、硝酸、高氯酸、富马酸、马来酸、磷酸、乙醇酸、乳酸、水杨酸、琥珀酸、甲苯-对-硫酸、酒石酸、乙酸、柠檬酸、甲磺酸、甲酸、苯甲酸、丙二酸、萘-2-硫酸和苯磺酸。其他酸,如草酸,虽然本身不是药学上可接受的,但也可以用于制备盐,其可用作获得化合物及其药学上可接受的酸加成盐的中间体。衍生自适当碱的盐包括碱金属盐(如钠盐)、碱土金属盐(如镁盐)、铵盐和n—(c1-c4)烷基)4+盐。
403、此外,使用本发明化合物的前药也在本发明的范围内。前药包括那些在简单的化学转化后被修饰以产生本发明的化合物的化合物。简单的化学转化包括水解、氧化和还原。具体地说,当向患者施用前药时,前药可以被转化成上文公开的化合物,从而赋予所需的药理作用
404、d.生物性能的评估
405、在测量酶切割精氨酰-氨基甲基香豆素(arg-amc)的肽键的能力的酶促测定中,评估本发明的化合物与人lta4水解酶相互作用的能力。将lta4h酶(最终1nm)、arg-amc底物(最终50μm)和化合物在室温下在反应缓冲液(50mm tris-hcl(ph 7.5)、100mm kcl、0.5%牛血清白蛋白)中混合1小时。通过测量氨基甲基香豆素产物的荧光(激发波长380nm/发射波长460nm)来评估产物的形成。通常,lta4h酶测定中化合物的优选的效力范围(ic50)在0.1nm至10μm之间,更优选的效力范围是0.1nm至0.1μm,并且最优选的效力范围是0.1nm至10nm。
406、
407、
408、
409、还在人全血(hwb)测定中测试本发明的化合物,以确定它们抑制细胞系统中ltb4合成的能力。将化合物与肝素化的人全血组合,并且在37℃下温育15分钟。然后加入钙霉素(最终20μm,在磷酸盐缓冲盐水中制备,ph 7.4),并且将混合物在37℃下温育另外的30分钟。将样品在低速(1500×g)下离心5分钟,并且去除血浆层。然后使用基于抗体的同质时间分辨荧光法(cisbio,bedford,mass.)来测量血浆ltb4浓度。通常,在hwb测定中,化合物的优选的效力范围(ic50)在10nm至10μm之间,更优选的效力范围是10nm至1μm,并且最优选的效力范围是10nm至100nm。在表3中示出了本发明的代表性化合物在whb测定中的效力。
410、
411、e.治疗
412、本文所述的本发明的方法的方面包括用本文所述的本发明的苯并二噁烷化合物治疗受试者。一个实施方案包括用本文所述的本发明的一种或多种苯并二噁烷化合物治疗人类受试者。本领域技术人员将认识到,用本发明的苯并二噁烷化合物治疗受试者的方法在本领域中是公认的。作为实例而非限制,本文所述的本发明的方法的一个实施方案包括向受试者施用一种或多种本文所述的本发明的苯并二噁烷化合物,用于治疗和/或预防认知障碍和/或年龄相关的痴呆。本发明的一种或多种苯并二噁烷化合物可以通过一种或多种途径(例如ip、iv、po等)施用。此外,本文所述的本发明的苯并二噁烷化合物可以每天施用一次或多次,例如每天一次、每天两次、每天三次、每天四次等,并且此类剂量可以长期施用(例如,大于一个月、大于两个月、大于3至五个月、大于六个月、大于一年等),或者在较短的时间跨度内(例如,短于一个月)急性施用。
413、为了治疗上述疾病和病状,治疗有效剂量通常在每剂量本发明的苯并二噁烷化合物约0.0 1mg至约100mg/kg体重的范围内;优选地每剂量约0.1mg至约20mg/kg体重。例如,对于70kg的人施用,剂量范围将是每剂量本发明的苯并二噁烷化合物约0.7mg至约7000mg,优选地每剂量约7.0mg至约1400mg。可能需要某种程度的常规剂量优化来确定最佳剂量水平和模式。活性成分可以每天施用1至6次。
414、f.施用
415、本文所述的本发明方法的方面包括用本文所述的本发明的苯并二噁烷化合物治疗受试者。本领域技术人员将认识到,用小分子抑制剂如本文所述的本发明的苯并二噁烷化合物治疗受试者的方法在本领域中是公知的。
416、本发明的一个实施方案包括通过向受试者施用有效量的一种或多种本文所述的本发明的苯并二噁烷化合物来治疗被诊断患有认知或运动障碍或神经炎症的受试者。本发明的另一实施方案包括施用有效量的一种或多种本文所述的本发明的苯并二噁烷化合物,并且随后监测受试者认知或运动功能的改善,或神经炎症的减少或神经发生的增加。本发明的另一实施方案包括施用有效量的一种或多种本文所述的本发明的苯并二噁烷化合物,并且随后在一次或多次施用本发明的所述一种或多种苯并二噁烷化合物后监测受试者血液中白三烯b4(ltb4)水平的降低。本发明的另一实施方案涉及监测受试者中lta4h酶促途径下游的其他化学副产物的血液水平变化。
417、在生物化学上,活性药剂的“有效量”或“有效剂量”意指活性药剂的这样的量,该量抑制、拮抗、降低、减少或抑制认知障碍、年龄相关的痴呆、运动功能障碍或神经炎症约20%或更多,例如30%或更多,40%或更多,或50%或更多,在一些情况下60%或更多,70%或更多,80%或更多,或90%或更多,在一些情况下约100%,即至可忽略不计的量,并且在一些情况下逆转认知障碍、年龄相关的痴呆、运动功能障碍或神经炎症的进展。
418、当用作药物时,本发明的苯并二噁烷化合物通常以药物组合物的形式施用。此类组合物可以使用制药领域中熟知的程序来制备,并且包含至少一种本发明的苯并二噁烷化合物。本发明的化合物也可以单独施用或与佐剂组合施用,所述佐剂增强本发明的苯并二噁烷化合物的稳定性,在某些实施方案中促进含有它们的药物组合物的施用,提供增加的溶解或分散,增加的拮抗剂活性,提供辅助疗法等。根据本发明的化合物可以单独使用或与根据本发明的其他活性物质联合使用,任选地还与其他药理学活性物质联合使用。通常,本发明的化合物以治疗或药物有效量施用,但是为了诊断或其他目的,可以以较低的量施用。
419、本发明的苯并二噁烷化合物(以纯的形式或以合适的药物组合物)的施用可以使用可接受的药物组合物施用方式中的任一者进行。因此,施用可以以固体、半固体、冻干的粉末或液体剂型的形式,诸如例如片剂、栓剂、丸剂、软弹性明胶胶囊和硬明胶胶囊、粉末、溶液、悬浮液或气溶胶等,优选地以适于精确剂量的简单施用的单位剂型的形式,例如口服、经颊(例如舌下)、经鼻、胃肠外、局部、经皮、阴道或直肠进行。药物组合物通常将包括常规的药物载剂或赋形剂和作为活性药剂的本发明的化合物,并且此外,可以包括其他药物剂(medicinal agent)、药物剂(pharmaceutical agent)、载剂、佐剂、稀释剂、媒介物或其组合。此类药学上可接受的赋形剂、载剂或添加剂以及制备用于各种模式或施用的药物组合物的方法是本领域技术人员所熟知的。现有技术水平可以由例如以下来证明:《雷明顿:药学的科学与实践(remington:the science and practice of pharmacy)》,第20版,a.gennaro(编辑),lippincott williams&wilkins,2000;《药物添加剂手册(handbook ofpharmaceutical additives)》,michael&irene ash(编辑),gower,1995;《药物赋形剂手册(handbook of pharmaceutical excipients)》,a.h.kibbe(编辑),americanpharmaceutical ass'n,2000;h.c.ansel和n.g.popovish,《药物剂型和药物递送系统(pharmaceutical dosage forms and drug delivery systems)》,第5版,lea和febiger,1990;其中每一篇都通过引用以其整体并入本文,以更好地描述现有技术。
420、如本领域技术人员将预期的,将选择在特定药物制剂中使用的本发明的苯并二噁烷化合物的形式(例如盐),其具有制剂有效所需的合适的物理特性(例如水溶性)。
421、g.适应症
422、主题方法和化合物在治疗(包括预防)衰老相关的病状,例如个体认知能力的损伤,例如认知障碍,包括(但不限于)年龄相关的痴呆、免疫病状、癌症以及身体和功能下降中找到应用。患有衰老相关的认知障碍或处于发展衰老相关的认知障碍的风险中的个体将受益于用主题化合物进行的治疗(例如通过本文公开的方法),所述个体包括约50岁或更老,例如60岁或更老、70岁或更老、80岁或更老、90岁或更老和100岁或更老的个体,即在约50岁和100岁之间,例如50、55、60、65、70、75、80、85、90、95或约100岁,并且患有与自然衰老过程相关的认知障碍(例如轻度认知障碍(m.c.i.))的个体;以及约50岁或更老,例如60岁或更老、70岁或更老、80岁或更老、90岁或更老,并且通常不超过100岁,即在约50岁和90岁之间,例如50、55、60、65、70、75、80、85、90、95或约100岁,尚未开始示出认知障碍的症状的个人。可能由于自然衰老引起的认知障碍/适应症的实例包括以下:
423、1.轻度认知障碍(m.c.i.)
424、轻度认知障碍是适度的认知混乱,其表现为记忆或其他精神功能如规划、遵循指令或做出决策的问题,其随着时间的推移而恶化,而整体精神功能和日常活动没有受损。因此,尽管通常不会发生显著的神经元死亡,但衰老脑中的神经元容易受到亚致死性年龄相关的结构、突触完整性和突触分子加工变化的影响,所有这些都会损害认知功能。患有衰老相关的认知障碍或处于发展衰老相关的认知障碍的风险的个体(其将受益于用主题化合物进行的治疗(例如通过本文公开的方法))还包括患有由衰老相关的病症引起的认知障碍的任何年龄的个体;以及任何年龄的被诊断患有通常伴有认知障碍的衰老相关的病症的个体,其中该个体尚未开始出现认知障碍的症状。此类衰老相关的病症的实例包括以下:
425、2.阿尔茨海默病
426、阿尔茨海默病是一种进行性的、不可避免的认知功能丧失,其与大脑皮质和皮质下灰质中过多的老年斑有关,皮质下灰质还含有β-淀粉样蛋白和由tau蛋白组成的神经原纤维缠结。普通形式影响>60岁的人,并且其发病率随着年龄的增长而增加。它占老年人的痴呆症的超过65%。
427、阿尔茨海默病的病因是未知的。这种疾病在约15%到20%的病例中有家族遗传。剩下的所谓的散发病例具有一些遗传决定因素。这种疾病在大多数早发型病例和一些晚发型病例中具有常染色体显性遗传模式,但具有可变的晚年外显率。环境因素是主动调查的重点。
428、在该疾病的过程中,大脑皮质、海马和皮质下结构(包括meynert基底核的选择性细胞丧失)、蓝斑和中缝背核(nucleus raphae dorsalis)内的突触以及最终地神经元都会丧失。在脑的一些区域(早期疾病中的顶叶和颞叶皮质,晚期疾病中的前额叶皮质)中脑葡萄糖的使用和灌注减少。神经斑或老年斑(由淀粉样蛋白核周围的神经突、星形胶质细胞和神经胶质细胞构成)和神经原纤维缠结(由成对的螺旋丝构成)在阿尔茨海默病的发病机制中起作用。老年斑和神经原纤维缠结随着正常衰老而出现,但它们在患有阿尔茨海默病的患者中更为普遍。
429、3.帕金森病
430、帕金森病(pd)是一种特发性的缓慢发展的退行性cns病症,其特征为运动缓慢和减少(运动迟缓)、肌肉强直、静止性震颤(肌张力障碍)、肌肉冷冻和姿势不稳定。最初被认为主要是一种运动病症,pd现在被认为也导致抑郁和情绪变化。pd还会影响认知、行为、睡眠、自主神经功能和感觉功能。最常见的认知障碍包括注意力和集中力、工作记忆、执行功能、产生语言和视觉空间功能方面的障碍。pd的特征是与运动功能减退相关的症状,其通常先于与认知障碍相关的症状,这有助于疾病的诊断。
431、在原发性帕金森病中,黑质、蓝斑和其他脑干多巴胺能细胞群的着色的神经元退化。原因是未知的。投射到尾状核和壳核的黑质神经元的丧失导致这些区域中神经递质多巴胺的耗竭。发病一般在40岁以后,其中在老年人群体中发病率增加。
432、帕金森病每年在约60,000名美国人中被新诊断,并且目前影响大约一百万美国人。尽管pd本身不是致命的,但其并发症是美国第十四大死亡原因。目前,pd无法治愈,并且治疗通常是为了控制症状,其中在晚期严重病例中需要手术。
433、pd的治疗选择包括药物施用,以帮助控制运动缺陷。这些选择增加或替代神经递质多巴胺,pd患者的神经递质多巴胺具有低的脑浓度。此类药物包括:卡比多巴/左旋多巴(其在脑中产生更多的多巴胺);阿扑吗啡、普拉克索、罗匹尼罗和罗替戈汀(多巴胺激动剂);司来吉兰和雷沙吉兰(防止多巴胺破坏的mao-b抑制剂);恩他卡朋和托卡朋(儿茶酚-o-甲基转移酶[comt]抑制剂,其使脑中产生更多的左旋多巴);苯扎托品和三己芬迪(抗胆碱能药);以及金刚烷胺(控制震颤和僵直)。还经常采用运动/物理疗法来帮助维持身体和心智功能。
434、然而,治疗pd的症状的目前治疗选项是非治愈性的,并且无法阻止疾病进展。另外,目前的药物在晚期pd治疗中往往丧失功效。最常开处方的药物左旋多巴通常会在开始药物后5至10年内导致不良作用。这些不良作用可能较为严重,并且可能导致运动波动和剂量之间运动控制的不可预测的波动以及难以控制的痉挛/抽搐(运动障碍),并且甚至会像pd本身的症状一样致残。因此,仍需要具有新颖作用机制的新颖疗法,其可以单独施用或与当前的pd药物联合施用。
435、4.帕金森综合征
436、继发性帕金森综合征(也称为非典型帕金森病或帕金森叠加)是由基底节中多巴胺作用的丧失或被干扰所致,所述丧失或干扰是由其他特发性退行性疾病、药物或外源毒素导致的。继发性帕金森综合征的最常见病因是摄入抗精神病药物或利血平,它们通过阻断多巴胺受体而引发帕金森综合征。较少见的病因包括一氧化碳或锰中毒、脑积水、结构性病变(肿瘤、影响中脑或基底节的梗塞)、硬膜下血肿和包括黑质纹状体变性在内的退行性病症。某些病症(例如,进行性核上性麻痹症(psp)、多系统萎缩症(msa)、皮质基底节变性(cbd)和路易体痴呆(dlb))可能会在做出特定诊断所必需的主要症状出现之前表现出帕金森综合征症状,并且因此可以被标记为“帕金森综合征”。
437、5.额颞叶痴呆
438、额颞叶痴呆(ftd)是由脑额叶的逐渐恶化所导致的一种病状。随着时间的推移,退化可以进展到颞叶。患病率仅次于阿尔茨海默病(ad),ftd占早老性痴呆病例的20%。基于受影响的额叶和颞叶的功能,症状分为三类:
439、行为变异型ftd(bvftd),其中症状一方面包括嗜睡和非自发行为,并且另一方面包括解除抑制;进行性非流行性失语症(pnfa),其中观察到由发音困难、语音和/或句法错误而导致的言语流畅性下降,但仍能理解词语含义;和语义性痴呆(sd),其中患者说话时的语音和句法正确,言语流畅,但在命名和词语理解方面却越来越困难。所有ftd患者常见的其他认知症状包括执行功能和注意力障碍。其他认知能力(包括知觉、空间技能、记忆和实践能力)通常保持不变。可以通过观察结构mri扫描中显露出的额叶和/或前颞叶萎缩来诊断ftd。
440、存在许多形式的ftd,其中的任何一种均可以使用主题方法和组合物进行治疗或预防。例如,额颞叶痴呆的一种形式是语义性痴呆(sd)。sd的特征在于,在口头领域和非口头领域中都丧失了语义记忆。sd患者经常表现出找词困难的问题。临床体征包括流利的失语症、忘名病、单词含义理解能力受损以及相关的视觉失明(无法匹配语义相关的图片或对象)。随着疾病的进展,尽管病例因几乎没有后期行为症状而被描述为“纯粹的”语义性痴呆,但行为和性格改变经常与在额颞叶痴呆中观察到的那些行为和性格改变相似。结构mri成像显示颞叶萎缩(主要在左侧)的特征性模式,其中下方受累高于上方受累,并且前方颞叶萎缩程度高于后方。
441、作为另一实例,额颞叶痴呆的另一种形式是皮克病(pid,也称为pcd)。这种疾病的一个明确特征是神经元中tau蛋白的累积,积聚成被称为“皮克体”的银染色球形聚集体。症状包括失语(失语症)和痴呆。具有眶额叶功能障碍的患者可能会变得具有攻击性且不适于社交。他们可能会偷窃或表现出迷恋或重复的刻板行为。具有背内侧或背外侧额叶功能障碍的患者可能表现为漠不关心、淡漠或自发性下降。患者可以表现出缺乏自我监控、自我意识异常和无法体会含义。具有双侧后外侧眶额叶皮质和右前脑岛中灰质损失的患者可以表现为进食行为的变化,例如病态性喜食甜食等。具有更多的前外侧眶额叶皮质中病灶性灰质损失的患者可能发展为食欲过盛。虽然一些症状最初可以得到缓解,但是该疾病会继续发展并且患者经常会在两至十年内死亡。
442、6.亨廷顿氏病
443、亨廷顿氏病(hd)是一种遗传性的进行性的神经退行性病症,其特征在于情绪、行为和精神异常的发展;智力或认知功能丧失;和运动异常(运动障碍)。hd的典型体征包括舞蹈症—可以影响面部、手臂、腿部或躯干的不自主的、快速的、不规则的、生涩的运动—的发展以及认知衰退(包括逐渐丧失思维加工和获得智力的能力)。可能会损害记忆力、抽象思维能力和判断力;对时间、地点或身份的认识不正确(定向障碍);躁动加剧;和性格变化(人格分裂)。虽然症状通常在生命的第四年或第五年期间变得明显,但发作的年龄是可变的,并且范围从儿童早期到成年晚期(例如70岁或80岁)。
444、hd在家族内作为常染色体显性性状传播。该病症发生是由染色体4上的基因内异常的长序列或编码指令“重复”(4p16.3)导致的。与hd有关的神经系统功能的进行性丧失是由脑的某些区域(包括基底节和大脑皮质)中的神经元丢失造成的。
445、7.肌萎缩侧索硬化
446、肌萎缩侧索硬化(als)是一种快速进展的总是致命的神经系统疾病,其攻击运动神经元。最初最经常在手中注意到并且较少在脚中注意到肌无力和萎缩以及前角细胞功能障碍的体征。发病部位是随机的,并且进展是不对称的。抽筋是常见的,并且可以先于无力。很少有患者存活30年;50%死于发病的3年内,20%存活5年,并且10%存活10年。
447、诊断特征包括在成年中期或晚期期间发病,以及进行性的广泛的运动受累而无感觉异常。神经传导速度正常,直到疾病晚期。最近的研究也记录了认知障碍的表现,尤其是即时言语记忆、视觉记忆、语言和执行功能的减弱。
448、在als患者的甚至表现正常的神经元中已经报告了细胞体面积、突触数量和总突触长度的减小。已经提出,当活动区的可塑性达到其极限时,突触的持续缺失可以导致功能障碍。促进新突触的形成或预防突触缺失可以维持这些患者的神经元功能。
449、8.多发性硬化
450、多发性硬化(ms)的特征在于cns功能障碍的各种症状和体征,伴有缓解及复发加重。最常见的症状是一肢或多肢、躯干或面部一侧的感觉异常;腿或手无力或笨拙;或视觉障碍,例如,一只眼睛部分失明和疼痛(眼球后视神经炎)、视力模糊或暗点。常见的认知障碍包括在记忆(获取、保留和检索新信息)、注意力和集中力(特别是注意力分散)、信息处理、执行功能、视觉空间功能和言语流畅性方面的障碍。常见的早期症状是导致双重视野(复视)的眼部麻痹、一肢或多肢的短暂性无力、肢体轻微僵直或异常易疲劳、轻微步态功能障碍、膀胱控制困难、眩晕和轻度情绪障碍;它们均表明分散的cns受累,并且经常在疾病被确认之前数月或数年发生。过热会加重症状和体征。
451、这个过程是高度可变的,不可预测的,并且在大多数患者中是间歇性的。起初,数月或数年的缓解可以将发作隔开,尤其是当疾病从后眼球视神经炎开始时。然而,一些患者具有经常的发作,并且迅速丧失活力;对于少数患者,该过程可以是快速发展的。
452、9.青光眼
453、青光眼是一种影响视网膜神经节细胞(rgc)的常见神经退行性疾病。有证据表明在突触和树突中(包括在rgc中)存在分隔的退化程序。最近的证据还表明,在老年人的认知障碍与青光眼之间存在相关性(yochim bp等人,《患有青光眼的老年患者中认知障碍、抑郁症和焦虑症的患病率(prevalence of cognitive impairment、depression and anxietysymptoms among older adults with glaucoma)》,《青光眼杂志(j glaucoma.)》,2012;21(4):250-254)。
454、10.肌强直性营养不良
455、肌强直性营养不良(dm)是一种常染色体显性多系统病症,其特征在于营养不良性肌无力和肌强直。分子缺陷是染色体19q上肌强直素蛋白激酶基因的3′非翻译区中扩增的三核苷酸(ctg)重复。症状可以发生在任何年龄,并且临床严重程度的范围广泛。肌强直主要出现在手部肌肉中,并且甚至在轻度病例中,上睑下垂是常见的。在重度病例中,会出现明显的外周肌无力,通常伴有白内障、过早脱发、脸部消瘦、心律失常、睾丸萎缩和内分泌异常(例如,糖尿病)。智力迟钝在严重的先天性形式中是常见的,而衰老相关的额叶和颞叶认知功能(特别是语言和执行功能)下降在该病症的较轻度成年形式中观察到。被严重影响的人到其五十出头时死亡。
456、11.痴呆
457、痴呆描述了具有严重影响思维和社交能力、足以干扰日常功能的症状的一类病症。除了在上述讨论的衰老相关的病症的晚期阶段中观察到的痴呆以外,痴呆的其他实例还包括下文所述的血管性痴呆和路易体痴呆。
458、在血管性痴呆或“多发梗塞性痴呆”中,认知障碍是由向脑供应血液的问题引起的,通常通过一系列的轻微中风,或者有时通过在其他较小中风之前或之后的一次大中风引起。血管病变可以是弥漫性脑血管疾病的结果,如小血管疾病或局灶性病变,或两者。患有血管性痴呆的患者在急性脑血管事件后表现出急性或亚急性认知障碍,其后观察到进行性认知衰退。认知障碍与在阿尔茨海默病中观察到的认知障碍类似,包括语言、记忆、复杂的视觉处理或执行功能方面的障碍,但是脑中的相关变化不是由ad病理学引起的,而是由脑中血流的长期减少引起的,最终导致痴呆。单光子发射计算机断层扫描(spect)和正电子发射断层扫描(pet)神经成像可以与涉及精神状态检查的评估结合用于确认多发梗塞性痴呆的诊断。
459、路易体痴呆(dlb,也有多个其他名称,包括路易体痴呆、弥漫性路易体病、皮质路易体病以及老年性路易体型痴呆)是一种痴呆,其在解剖学上的特征在于神经元中路易体(α-突触核蛋白和泛素蛋白的团块)的存在,在死后脑组织学分析中可检测到。其主要特征是认知衰退,特别是执行功能下降。警觉性和短期记忆将提高和减弱。
460、持续或反复的伴有生动且详细的图案的幻视经常是早期诊断症状。dlb在其早期阶段通常与阿尔茨海默病和/或血管性痴呆混淆,尽管其中阿尔茨海默病通常开始发生时相当缓慢,但是dlb通常具有快速或急性的发作。dlb症状还包括类似于帕金森病的运动症状的运动症状。dlb与帕金森病中有时出现的痴呆的区别在于痴呆症状相对于帕金森病症状出现的时间期限。当痴呆发作在帕金森病发作后的多于一年时,诊断结果为伴有痴呆的帕金森病(pdd)。当认知症状与帕金森病症状同时开始或者在帕金森症状一年内开始时,诊断为dlb。
461、12.cadasil
462、伴皮质下梗死和白质脑病的常染色体显性遗传性脑动脉病(cadasil)是一种与notch 3基因的突变相关的遗传性病症。(locatelli m等人,《药理学前沿(front.pharmacol.)》,11:321(2020))。它通常发生在中年人身上,其中表现包括导致痴呆和残疾的认知障碍。(同上)其他表现为情绪障碍、有先兆的偏头痛和反复发作的中风。有效的治疗一直难以捉摸,因为疾病发展的方式(发病机理)仍然不确定。(同上)cadasil是最常见的遗传性皮质下类型的血管性痴呆。(kalimo h等人,《未来神经学(futureneurology)》,3(6)(2008))。
463、cadasil的特征在于四种主要的常见症状:有先兆的偏头痛、复发性缺血性中风、精神障碍和认知衰退。第一种通常是表现症状,发生在20-40%的受影响的个体中。第二种症状发生在60-85%有症状的个体中。第三精神障碍发生在25-30%的患者中,其形式为中度/重度抑郁、双相情感疾病、惊恐障碍、精神分裂症和情感淡漠。在60%的患者中出现认知障碍,在35-50岁之间变得临床上可检测到,并且随着年龄的增长而逐渐恶化。(同上)在较年轻的患者中,注意力、记忆力和执行能力障碍占主导地位。(buffon f等人,《神经病学、神经外科及精神病学杂志(j neurol neurosurg psychiatry)》77(2):175-80(2006))。视觉空间能力和推理能力随着年龄的增长而退化,主要是在60岁以后。在25%的患者中出现痴呆症,其中75%的患者年龄超过60岁。但是缺血性发作的次数与痴呆症无关。(同上)
464、cadasil是一种进行性且致命的疾病。迄今为止还没有进行疾病缓解治疗。(locatelli等人,同上)。基于常规的临床实践,对症治疗是临床医生的唯一途径,例如:乙酰唑胺或丙戊酸钠用于偏头痛;每日阿司匹林以减少心脏病发作或中风的机会;和对认知功能丧失的支持性护理。值得注意的是,仍然没有药物明确地显示对与cadasil相关的认知功能丧失有益。(同上)已经研究但失败的干预措施包括多奈哌齐(用于改善阿尔茨海默病认知功能障碍)、加兰他敏(用于治疗阿尔茨海默病认知功能障碍的乙酰胆碱酯酶抑制剂)、左旋多巴(用于阿尔茨海默病和帕金森病)。
465、13.进行性核上性麻痹
466、进行性核上性麻痹(psp)是一种脑部病症,其导致步态和平衡的控制方面的严重和进行性问题,以及复杂的眼球运动和思维问题。这种疾病的典型症状之一是无法正确瞄准眼睛,这是由脑中协调眼球运动的区域中的损伤引起的。一些个体将这种影响描述为模糊不清。受影响的个体经常表现出情绪和行为的改变,包括抑郁和淡漠以及进行性轻度痴呆症。该病症的长的名称表明疾病缓慢地开始并持续恶化(进行性),并且通过损害称为核的、豌豆大小的结构上方(核上)控制眼睛运动的某些脑部分而引起无力(麻痹)。psp在1964年首次被描述为独特的病症,当时三位科学家发表了一篇论文,该论文将该病状与帕金森病区分开来。它有时被称为steele-richardson-olszewski综合征,反映了定义该病症的科学家的组合名称。虽然psp变得进行性地恶化,但没有人死于psp本身。
467、14.共济失调
468、患有共济失调的患者具有协调方面的问题,因为控制运动和平衡的神经系统部分受到影响。共济失调可以影响手指、手、手臂、腿、身体、言语和眼球运动。词语“共济失调”经常被用来描述可能与感染、损伤、其他疾病或中枢神经系统的退行性改变有关的不协调症状。共济失调也被用来表示一组称为遗传性和散发性共济失调的特定的神经系统退行性疾病,该疾病是国家共济失调基金会的关注重点。
469、15.多系统萎缩症
470、多系统萎缩症(msa)是一种退行性神经病症。msa与脑的特定区域中神经细胞的退化有关。这种细胞退化会引起身体的运动、平衡和其他自主功能方面的问题,如膀胱控制或血压调节。
471、msa的病因尚不清楚,并且未确定具体的危险因素。约有55%的病例发生在男性中,其中典型的发病年龄为50多岁至60岁出头。msa经常表现出与帕金森病相同的一些症状。然而,msa患者通常对用于治疗帕金森病的多巴胺药物仅显示出最低限度的响应(如果有的话)。
472、16.衰弱
473、衰弱综合征(“衰弱”)是一种老年综合征,其特征在于功能和身体衰退,包括活动能力减退、肌无力、行动缓慢、耐力差、身体活动不足、营养失调及非自主体重减轻。此类衰退经常是伴随性的,并且是诸如认知功能障碍和癌症的疾病的后果。然而,甚至在未患病的情况下,也可以发生衰弱。患有衰弱的个体具有因骨折、意外跌倒、残疾、合并症及过早死亡引起的负面预后的增加的风险。(c.buigues等人,《益生元制剂对衰弱综合征的影响:一项随机的双盲临床试验(effect of a prebiotic formulation on frailty syndrome:arandomized,double-blind clinical trial)》,《国际分子科学杂志(int.j.mol.sci.)》,2016,17,932)。此外,患有衰弱的个体具有高等医疗保健支出的增加的发生率。(同上)
474、衰弱的常见症状可以通过特定类型的测试来确定。例如,意外体重减轻涉及减轻至少10磅或前一年体重的大于5%;肌无力可以通过在基线时最低20%的握力下降来确定(针对性别和bmi进行调整);行动缓慢可以基于步行15英尺距离所需的时间;耐力差可以通过个体对疲惫的自我报告来确定;并且身体活动不足可以使用标准化调查问卷来测量。(z.palace等人,《衰弱综合征(the frailty syndrome)》,《今日老年医学(today’sgeriatric medicine)》,7(1),第18页(2014))。
475、在一些实施方案中,主题方法和组合物在减缓衰老相关的认知、运动、神经炎症性、神经退行性或其他年龄相关的障碍或病状的进展中找到应用。换句话说,与在用所公开的方法治疗之前或未用所公开的方法进行治疗相比,在用所公开的方法治疗之后,个体的认知、运动、神经炎症性、神经退行性或其他能力或病状将更缓慢地衰退。在一些此类情况下,主题治疗方法包括测定治疗后认知、运动、神经炎症或其他年龄相关的能力或症状衰退的进展,并且确定减缓了衰退的进展。在一些此类情况下,通过与参考进行比较来进行确定,所述参考例如治疗前个体的衰退速率,例如如通过在施用主题血液制品前的两个或更多个时间点提前测量认知、运动、神经炎症性或其他年龄相关的能力或病状所确定的。
476、主题方法和组合物还在稳定个体(例如,患有衰老相关的认知衰退的个体或处于患有衰老相关的认知衰退的风险的个体)的认知、运动、神经炎症性或其他能力或病况中找到应用。例如,个体可以表现出一些衰老相关的认知障碍,并且在用所公开的方法进行治疗之前观察到的认知障碍的进展将会在用所公开的方法进行治疗之后停止。作为另一实例,个体可以处于发展衰老相关的认知衰退的风险中(例如,个体的年龄可以是50岁或更老,或者可以已被诊断患有衰老相关的病症),并且个体的认知能力基本上无变化,即,与在用所公开的方法进行治疗之前相比,在用所公开的方法进行治疗之后,未检测到认知衰退。
477、主题方法和组合物还在减轻患有衰老相关的障碍的个体的认知、运动、神经炎症性或其他年龄相关的障碍中找到应用。换句话说,在用主题方法治疗后,个体中受影响的能力被改善。例如,相对于在用主题方法进行治疗之前在个体中观察到的认知或运动能力,在通过主题方法进行治疗之后,个体的认知或运动能力提高至例如2倍或更多、5倍或更多、10倍或更多、15倍或更多、20倍或更多、30倍或更多或者40倍或更多,包括50倍或更多、60倍或更多、70倍或更多、80倍或更多、90倍或更多或100倍或更多。
478、在一些情况下,用主题方法和组合物进行的治疗使患有衰老相关的认知或运动衰退的个体的认知、运动或其他能力恢复,例如,恢复至个体大约40岁或更小时的其水平。换句话说,消除了认知或运动障碍。
479、17.视神经脊髓炎谱系病症
480、视神经脊髓炎谱系病症(nmosd)也称为德维克病,是罕见的中枢神经系统的炎性疾病。其特征在于视神经炎(视神经炎症)和脊髓炎(脊髓炎症)。通常,患者经历炎症的反复发作,这种发作通过缓解期隔开。该疾病被认为是由通常靶向髓鞘少突胶质细胞糖蛋白(mog-igg)或水通道蛋白4(aqp4-igg)的自身抗体引起的,其会引起视神经和脊髓的脱髓鞘和轴突损伤。
481、18.术后认知功能障碍
482、术后认知衰退在麻醉和手术后发生。它在大于60岁的患者中常见,并且通过手术前和手术后的认知测试进行诊断。患者通常表现出记忆障碍、精神错乱和智力任务表现障碍。
483、19.慢性外伤性脑部病变
484、慢性外伤性脑部病变(cte)是一种神经退行性脑部病症,最常见于运动员、退伍军人或其他具有反复性头部外伤史的人群。它是许多tau蛋白病中的一种,其特征在于患者的脑中的tau蛋白过量,从而引起神经元丧失。症状包括记忆丧失、情绪或性格变化、困惑、判断力下降、冲动控制、攻击性和抑郁。
485、20.创伤性脑损伤
486、创伤性脑损伤(tbi)是由于头部或身体受到猛烈撞击引起的。它也可能是由于受伤期间物体穿透脑组织引起的。它导致出血、组织撕裂、和对脑细胞的物理损害以及细胞死亡。身体症状是变化的,但包括失去意识、头痛、恶心、极度乏力、言语障碍、入睡困难、头晕、视力模糊、对光或声音敏感、记忆丧失和注意力不集中。
487、h.诊断和监测改进方法
488、在一些情况下,在诊断和监测疾病进展以及改善认知疾病、运动障碍、神经炎症性疾病或神经退行性疾病的各种方法中,根据需要,对患有神经退行性疾病的受试者单独使用或组合使用以下类型的评估。以下类型的方法以实例给出,并且不限于所列举的方法。根据需要,可以在实施本发明时使用任何合适的监测疾病的方法。这些方法也由本发明的方法预期。
489、i.总体认知
490、本发明的方法的实施方案进一步包括监测药物或治疗对受试者的影响以用于治疗认知障碍和/或年龄相关的痴呆症的方法,所述方法包括比较治疗之前和之后的认知功能。本领域普通技术人员认识到,存在熟知的评估认知功能的方法。例如而非限制地,所述方法可以包括基于病史、家族史、由专门研究痴呆症和认知功能的临床医生进行的身体和神经系统检查、实验室测试和神经心理学评估来评估认知功能。本发明所预期的另外的实施方案包括:意识状态评估,例如使用格拉斯哥昏迷量表(emv);精神状态检查,包括简易精神测试量表(amts)或简易精神状态检查表(mmse)(folstein等人,《精神病学研究杂志(j.psychiatr.res)》,1975;12:1289-198);高级功能的整体评估;颅内压估计,例如通过眼底检查估计。在一个实施方案中,监测对认知障碍和/或年龄相关的痴呆症的影响包括使用阿尔茨海默病评定量表-认知分量表(adas-cog)的1、2、3、4、5、6、7、8、9、10、11或12分改进。
491、在一个实施方案中,周围神经系统的检查可以用于评估认知功能,其包括以下中的任一种:嗅觉、视野和视敏度、眼球运动和瞳孔(交感神经和副交感神经)、面部感觉功能、面部和肩带肌肉强度、听力、味觉、咽部运动和反射、舌头运动,它们可以单独进行测试(例如,视敏度可以通过snellen图表进行测试;反射锤用于测试反射,包括咬肌、二头肌及三头肌肌腱、膝腱、足踝反射及足底(即,babinski体征);通常以mrc量表1至5计的肌肉强度;肌肉张力及强直的迹象。
492、ii.cadasil
493、本发明的方法的实施方案进一步包括监测用于治疗伴皮质下梗死和白质脑病的常染色体显性遗传性脑动脉病(cadasil)的受试者的药物或治疗效果的方法,所述方法包括比较在治疗之前和之后cadasil的症状。所述症状包括认知障碍,例如作为实例但不限于注意力、记忆力、执行障碍、视觉空间能力、推理和痴呆症。所述症状也可以是在其他类型的认知障碍或痴呆症中监测到的症状,例如本文针对总体认知、阿尔茨海默病、帕金森病、亨廷顿氏病、路易体痴呆症等所描述的那些。
494、本发明的方法的实施方案进一步包括在受试者中诊断cadasil的方法。用于在受试者中诊断cadasil的实施方案包括作为实例但不限于,受试者的磁共振成像(mri)扫描和notch 3基因突变的检测。用于检测cadasil的mri扫描的实例是t2加权mri(扩散张量成像),其检测cadasil的主要特征之一,即非特异性白质病变(脑白质疏松)的存在。这项技术基于测量水的扩散,这是由于由热能产生的水分子的随机运动引起的。(molko n等人,《中风(stroke)》,33(12):2902-08(2002))。它是一种揭示组织微观结构的敏感技术,其进而揭示各种认知相关的疾病如阿尔茨海默病和精神分裂症的微妙变化。(同上)cadasil通常表现为通过常规mri检测到的大脑病变内部和外部的白质和基底神经节内的水扩散大量增加。
495、在受试者中诊断cadasil的另一种方法是检测notch 3基因突变。cadasil中的大多数突变涉及notch 3的细胞外结构域中34个表皮生长因子样重复序列(egfr)中的一个。(locatelli等人,同上)。特别是,98%的notch 3突变发生在编码细胞外结构域上的34个egfr的外显子2-23。(同上)临床/商业实施方案包括例如但不限于athena diagnostics的notch3 cadasil测序测试(第1175号)。
496、iii.帕金森病
497、本发明的方法的实施方案进一步包括监测药物或治疗对受试者的影响以用于治疗运动障碍的方法,所述方法包括比较在治疗之前和之后的运动功能。本领域普通技术人员认识到,存在熟知的评估运动功能的方法。例如而非限制地,所述方法可以包括基于病史、家族史、由专门研究神经变性和运动障碍的临床医生进行的身体和神经系统检查、实验室测试和神经变性评估来评估运动功能。本发明所预期的另外的实施方案包括采用下文讨论的评定量表。
498、已经使用若干评定量表来评估pd的进展。最广泛使用的量表包括统一帕金森病评定量表(updrs,其在1987年提出)(《康复研究与发展杂志(j.rehabil res.dev.)》,201249(8):1269-76)以及hoehn和yahr量表(《神经病学(neruology)》,1967 17(5):427-42)。另外的量表包括运动障碍学会(mds)更新的updrs量表(mds-updrs)以及schwab和england日常生活活动(adl)量表。
499、updrs量表评估31个项目,其分为三个分量表:(1)精神、行为和情绪;(2)日常生活活动;以及(3)运动检查。hoehn和yahr量表将pd分为五个阶段,每个阶段具有不同的子阶段:0-无疾病迹象;1-仅单侧出现症状;1.5-单侧出现症状,但也累及颈部和脊柱;2-双侧出现症状,无平衡障碍;2.5-两侧出现轻微症状,但在提供“拉动”测试时恢复;3-平衡障碍,轻度至中度疾病;4-严重残疾,但能独立行走或站立;和5-在无帮助下需要轮椅或卧床。schwab和england量表将pd分类为若干百分比(从100%-完全独立至10%-完全依赖)。
500、可以采用广泛使用的量表(包括通用运动功能量表(gmf))来评估通用运动功能。这测试了三个组成部分:依赖性、疼痛和不安感。(aberg a.c.等人(2003)《残障与康复(disabil.rehabil.)》,2003年5月6日;25(9):462-72)。运动功能也可以使用家庭监测或可穿戴式传感器进行评估。例如:可以用加速度计感测步态(移动速度、变化性、腿部强直);通过陀螺仪感测姿势(躯干倾斜);通过加速度计感测腿部运动;通过加速度计和陀螺仪感测手部运动;通过加速度计感测震颤(振幅、频率、持续时间、不对称性);通过加速度计感测跌倒;通过加速度计感测步态冷冻;通过加速度计、陀螺仪和惯性传感器感测运动障碍;通过加速度计加陀螺仪感测运动徐缓(持续时间和频率),以及使用麦克风感测失语症(音高)。(pastorino m等人,《物理期刊:会议系列(journal of physics:conference series)》450(2013)012055)。
501、iv.多发性硬化
502、除了监测与认知相关的症状的改善外,还可以使用本领域普通技术人员熟知的技术来监测与多发性硬化(ms)相关的神经变性的进展或改善。作为实例而非限制,可以通过诸如以下的技术来进行监测:脑脊液(csf)监测;磁共振成像(mri)以检测病灶及脱髓鞘斑的发展;诱发电位研究;以及步态监测。
503、例如,可以通过腰椎穿刺进行csf分析以获得压力、外观及csf含量。正常值范围通常如下:压力(70-180mm h2o);外观为清澈且无色;总蛋白(15-60mg/100ml);igg为总蛋白的3-12%;葡萄糖为50-80mg/100ml;细胞计数为0-5个白细胞并且无红细胞;氯化物(110-125meq/l)。结果异常可能表明ms的存在或进展。
504、mri是另一种可以用于监测疾病进展和改善的技术。用mri监测ms的典型标准包括大脑半球和室旁区域中异常白质斑片状区域的外观、存在于小脑和/或脑干以及脊髓的颈部或胸部区域中的病灶。
505、诱发电位可以用于监测受试者ms的进展及改善。诱发电位测量诸如视觉诱发响应(ver)、脑干听觉诱发响应(baer)和体感诱发响应(sser)中的电脉冲的放缓。异常响应有助于表明在中枢感觉路径中传导速度的下降。
506、步态监测也可以用于监测ms受试者的疾病进展和改善。ms经常伴有部分地由于疲劳引起的活动能力损伤及步态异常。例如,可以通过使用由受试者穿戴的移动监测装置来进行监测。(moon,y.等人,《用新型可穿戴运动传感器监测多发性硬化个体的步态(monitoring gait in multiple sclerosis with novel wearable motion sensors)》,《公共科学图书馆·综合(plos one)》,12(2):e0171346(2017))。
507、v.亨廷顿氏病
508、除了监测与认知相关的症状的改善外,还可以使用本领域普通技术人员熟知的技术来监测与亨廷顿氏病(hd)相关的神经变性的进展或改善。作为实例而非限制,可以通过诸如以下的技术来进行监测:运动功能;行为;功能评估;以及成像。
509、可以监测作为疾病进展或改善的适应证的运动功能的实例包括舞蹈症和肌张力障碍、强直、运动徐缓、动眼功能障碍和步态/平衡变化。用于对这些度量进行监测的技术是本领域普通技术人员所熟知的。(参见tang c等人,《在临床前和早期阶段监测亨廷顿氏病的进展(monitoring huntington’s disease progression through preclinical andearly stages)》,《神经退行性疾病管理(neurodegener dis manag)》,2(4):421-35(2012))。
510、hd的精神病效应为监测疾病进展和改善提供了机会。例如,可以进行精神病诊断以便确定受试者是否患有抑郁症、易怒、焦虑不安、焦虑、淡漠和伴有妄想症的精神病。(同上)
511、功能评估也可以用于监测疾病进展或改善。总功能评分技术已有相关报告(同上),并且在一些hd人群中,通常每年下降一分。
512、mri或pet也可以用于监测疾病进展或改善。例如,在hd中存在纹状体投射神经元丧失,并且可以在受试者中监测这些神经元数量的变化。确定hd受试者的神经元变化的技术包括对多巴胺d2受体结合进行成像。(同上)
513、vi.肌萎缩侧索硬化(als)
514、除了监测与认知相关的症状的改善外,还可以使用本领域普通技术人员所熟知的技术来监测与肌萎缩侧索硬化(als)相关的神经变性的进展或改善。作为实例而非限制,可以通过诸如以下的技术来进行监测:功能评估;确定肌肉强度;测量呼吸功能;测量下运动神经元(lmn)损失;以及测量上运动神经元(umn)功能障碍。
515、功能评估可以使用本领域普通技术人员所熟知的功能量表来进行,例如als功能评定量表(alsfrs-r),其评估与延髓、肢体和呼吸功能相关的症状。变化率用于预测生存期以及疾病的进展或改善。另一测量包括功能与生存期综合评估(cafs),通过将生存时间与alsfrs-r的变化相结合来对受试者的临床预后进行排序。(simon ng等人,《定量肌萎缩侧索硬化的疾病进展(quantifying disease progression in amyotrophic lateralsclerosis)》,《神经病学年鉴(ann neurol)》,76:643-57(2014))。
516、肌肉强度可以通过使用复合手动肌肉测试(mmt)评分来测试和量化。这需要使用医学研究委员会(mrc)肌肉强度分级量表从多个肌肉群获取的平均测量值。(同上)除其他技术外,还可以使用手持式测力计(hhd)。(同上)
517、呼吸功能可以使用便携式肺量测定单元进行,其用于获得基线时用力肺活量(fvc)以预测疾病的进展或改善。此外,可以确定最大吸气压力、鼻吸气压(snip)及小口fvc并且用于监测疾病进展/改善。(同上)
518、下运动神经元的丧失是可以用于监测als的疾病进展或改善的另一度量。神经生理指数可以通过测量运动神经传导研究中的复合肌肉动作电位(cmap)来确定,其中参数包括cmap振幅和f波频率。(同上,以及de carvalho m等人,《肌萎缩侧索硬化的神经传导研究(nerve conduction studies in amyotrophic lateral sclerosis)》,《肌肉和神经(muscle nerve)》,23:344-352,(2000))。也可以估计下运动神经元单位数(mune)。在mune中,通过估计个体运动单位对最大cmap响应的贡献,估计供给肌肉的残余运动轴突的数量,并且用于确定疾病进展或改善。(simon ng等人,同上)。用于确定lmn损失的另外的技术包括测试神经兴奋性、电阻抗肌动描记术,并且使用肌肉超音波来检测肌肉厚度的变化。(同上)
519、上运动神经元的功能障碍是可以用于监测als的疾病进展或改善的另一度量。用于确定功能障碍的技术包括对脑及脊髓进行mri或pet扫描,经颅磁刺激;并且确定脑脊液(csf)中生物标志物的水平。
520、vii.青光眼
521、除了监测与认知相关的症状的改善外,还可以使用本领域普通技术人员所熟知的技术来监测与青光眼相关的神经变性的进展或改善。作为实例而非限制,可以通过诸如以下技术来进行监测:确定眼内压;评估视神经盘或视神经乳头的损伤;针对外围视力丧失的视野测试;以及对视神经盘和视网膜进行成像,用于形貌分析。
522、viii.进行性核上性麻痹(psp)
523、除了监测与认知相关的症状的改善外,还可以使用本领域普通技术人员所熟知的技术来监测与进行性核上性麻痹(psp)相关的神经变性的进展或改善。作为实例而非限制,可以通过诸如以下技术来进行监测:功能评估(日常生活活动,或adl);运动评估;精神症状的确定;以及体积性及功能性磁共振成像(mri)。
524、就独立性、部分依赖他人或完全依赖性而言,受试者的功能水平可用于确定疾病的进展或改善。(参见duff,k等人,《进行性核上性麻痹的功能障碍(functionalimpairment in progressive supranuclear palsy)》,《神经病学(neurology)》,80:380-84,(2013))。进行性核上性麻痹评定量表(psprs)是一种评定量表,其包括分为六个类别的二十八项度量:日常活动(按历史记录);行为;延髓、眼运动、肢体运动及步态/中线。结果为0至100范围的评分。六项评分为0至2,并且二十二项评分为0至4,总分可能为100。psprs评分是实用的量度,并且是可靠的患者生存预测指标。它们也对疾病进展敏感,并且用于监测疾病进展或改善。(golbe li等人,《进行性核上性麻痹的临床评定量表(aclinical ratingscale for progressive supranuclear palsy)》,《脑(brain)》,130:1552-65,(2007))。
525、来自updrs(统一帕金森病评定量表)的adl部分也可以用于量化患有psp的受试者的功能活动。(duff k等人,同上)。类似地,schwab和england日常生活活动量表(se-adl)可以用于评估独立性。(同上)此外,updrs的运动功能部分用作用于评估psp患者的疾病进展的可靠量度。例如,运动部分可以包含27种不同的用于量化psp患者的运动功能的量度。这些量度的实例包括静止性震颤、强直、手指敲击、姿势和步态。受试者的疾病进展或改善也可以通过进行由经训练的医务人员完成的基线神经心理学评价来评估,该评估使用神经精神量表(npi)来确定行为异常(例如妄想、幻觉、焦虑不安、抑郁、焦虑、欣快、淡漠、解除抑制、易怒和异常运动行为)的频率和严重程度。(同上)
526、功能性mri(fmri)也可以用于监测疾病的进展和改善。fmri是一种使用mri来测量脑的某些区域中的脑活动变化的技术,其通常基于流向这些区域的血流量。血流量被视为与脑区域激活相关。患有像psp的神经退行性病症的患者可以在mri扫描仪中扫描之前或期间经受身体或精神测试。作为实例而非限制,测试可以是一种良好建立的力控制范式,其中患者需要用受psp影响最严重的手产生力,并且在测试发生后立即通过fmri测量最大随意收缩(mvc)。burciu,rg等人,《进行性核上性麻痹和帕金森病的不同脑活动模式(distinctpatterns of brain activity in progressive supranuclear palsy and parkinson’sdisease)》,《运动障碍(mov.disord.)》,30(9):1248-58(2015))。
527、体积性mri是这样一种技术,其中mri扫描仪确定区域脑容量的体积差异。例如,这可以通过对比不同病症或通过随时间确定患者的脑区域的体积差异来实现。体积性mri可以用于确定像psp的神经退行性病症的疾病进展或改善。该技术为本领域普通技术人员所熟知的。(messina d等人,《帕金森病、进行性核上性麻痹和多系统萎缩症的脑萎缩模式,(patterns of brain atrophy in parkinson’s disease,progressive supranuclearpalsy and multiple system atrophy)》,《帕金森综合征及相关病症(parkinsonism andrelated disorders)》,17(3):172-76(2011))。可以测量的大脑区域的实例包括但不限于颅内体积、大脑皮质、小脑皮质、丘脑、尾状核、尾壳核、苍白球、海马、杏仁核、侧脑室、第三脑室、第四脑室和脑干。
528、ix.神经发生
529、本发明还预期治疗或改善具有减少或受损的神经发生的受试者的神经发生,减少或受损的神经发生本身可以通过例如减退的认知或运动功能或通过与神经炎症相关联来表现。本发明的一个实施方案包括,作为实例而非限制,使用脉冲给药治疗方案向具有减少或受损的神经发生的受试者施用lta4h调节性药剂。
530、本发明的一个实施方案还预期在施用lta4h调节性药剂之前、期间和/或之后确定神经发生的水平。用于评价神经发生的无创技术已被报告。(tamura y.等人,《神经科学杂志(j.neurosci.)》,(2016)36(31):8123-31)。与示踪剂[18f]flt结合使用的正电子发射断层扫描(pet)与bbb转运蛋白抑制剂丙磺舒联合使用,允许示踪剂在脑的神经源性区域中积聚。此类成像允许评价针对神经退行性疾病进行治疗的患者的神经发生。
531、x.视神经脊髓炎谱系病症(nmosd)
532、可以通过血液测试以检测aqp4-igg或mog-igg抗体来诊断视神经脊髓炎谱系病症(nmosd)。疾病监测使用血液测试、脑脊液测试、脊椎穿刺和磁共振成像(mri)或计算机断层(ct)扫描。
533、i.试剂、装置和试剂盒
534、还提供了用于实施一种或更多种上述方法的试剂、装置及其试剂盒。主题试剂、装置及其试剂盒可以较大变化。感兴趣的试剂和装置包括上文关于向受试者施用本文所述的组合物(例如,苯并二噁烷lta4h抑制剂)的方法中所提及的试剂和装置。
535、除上述部件外,主题试剂盒将进一步包括用于实施主题方法的说明书。这些说明书可能以各种形式存在于主题试剂盒中,其中的一种或更多种可能存在于试剂盒中。这些说明书可能存在的一种形式是印在合适的介质或基底(例如,其上印有信息的一张纸或多张纸)上、试剂盒的包装中、包装插页中等的印刷信息。另一种手段是其上已记录有信息的计算机可读介质,例如,软盘、cd、便携式闪存驱动器等。还可能存在的另一种手段是网址,该网址可以经由互联网用来访问远程网站上的信息。在所述试剂盒中可能存在任何合适的装置。
536、j.锻炼
537、锻炼可以以有氧活动或无氧活动为特征,并且可以涉及高卡路里燃烧活动和中等卡路里燃烧活动。锻炼可以涉及力量训练(例如,重量训练或等长锻炼)。锻炼还可以涉及例如跑步、骑自行车、散步、跳舞、行进、游泳、瑜伽、太极、平衡练习、屈腿、跳绳、冲浪、划船、旋转或弯曲手臂或腿、园艺、清洁、积极游戏(诸如保龄球、有氧运动、普拉提和武术)。
538、锻炼方案可以包括以特定频率进行单一锻炼,或者以特定频率进行锻炼的组合。频率可以是每周一次、两次、三次、四次、五次、六次或七次。频率可能会因周而异。锻炼方案的强度和/或频率可以与受试者在施用本发明的组合物之前练习的强度和/或频率相同。与施用本发明的组合物之前受试者练习的水平相比,锻炼方案也可以处于更高水平的强度和/或频率。锻炼方案可能是由健康或健身专业人员建议或规定的,或者锻炼方案可能是由受试者自己发起的。
539、vii.实验实施例
540、a.实验程序
541、somascan测定(somalogic)
542、如前所述(de rojas i等人,《阿尔茨海默病研究与治疗(alzheimers res ther)》10:119(2018)和rodriguez-gomez o等人,《阿尔茨海默病的预防(prev alzheimersdis)》,4(2):100-108(2017),通过facehbi获得来自阿尔茨海默病人群的血浆样品和mmse评分。dta血浆样品被冷冻运送至alkahest,等分并储存在-80℃下,直到使用。如下进行所有三组血浆样品的蛋白质组分析的等分:将原始冷冻的血浆样品在冰上解冻,在0℃下以3,200xg离心30分钟,并且通过0.22um millex gv过滤器(milliporesigma,burlington,ma)过滤以除去低温沉淀物。将滤液等分到冷冻管中,并且储存在-80℃直到使用。如所述(goldl等人,《公共科学图书馆·综合》,5(12):e15004(2010)),通过somalogic,inc.(boulder,colorado)测量1305个蛋白质分析仪的somascan多重蛋白质组分析平台来分析血浆样品。简而言之,将测试样品与一种名为somamer的基于专有适体的亲和试剂的混合物一起温育。两个连续的基于珠的固定和洗涤步骤消除了未结合的或非特异性结合的蛋白质和未结合的somamer,仅留下蛋白质靶结合的somamer。分离出这些剩余的somamer,并且在定制的agilent杂交阵列上同时定量每种试剂。
543、情境恐惧条件反射(cfc)
544、就在其试验前,小鼠被带入测试室中,以避免暴露于来自测试的声音和气味。第1天:为了进行训练,将小鼠置于室内,打开明亮的室内灯和风扇,持续2分钟。然后呈现听觉提示(2000hz,70db,条件刺激(cs))持续30秒。2秒钟的脚电击(0.6ma;非条件刺激(us))被施用持续cs的最后2秒。该程序被重复一次,每次间隔2分钟,并且在第二次电击后30秒,将小鼠从室中取出。在两次试验之间,用70%的乙醇清洗盘子、室壁和网格地板。第2天:训练后七十二小时,将小鼠放回进行训练的同一室(对情境的记忆),并且记录冷冻行为持续3分钟。将小鼠放回到其居住笼子里。在两次试验之间,用70%的乙醇清洗盘子、室壁和网格地板。第3天:情境测试后24小时,将小鼠放回相同的室,并且在新的环境(改变的情境)中并且响应于提示(对提示的记忆)记录冷冻。新的环境包括不同的气味(薄荷水)、声音、室隔板和不同的地板材料。将小鼠置于新的环境中,并且记录冷冻持续2分钟。然后呈现听觉提示(2000hz,70db,cs)持续30秒,并且再次记录冷冻持续2分钟。将小鼠放回到其居住笼子里,在试验之间用乙醇和薄荷水清洗盘子、室壁和地板。
545、y-迷宫
546、大型y-迷宫测试评估了对特定情境的熟悉程度的短期记忆。在测试之前,将小鼠带入实验室中,持续至少30分钟以适应实验室条件(昏暗照明)。对于最初的训练试验,将小鼠置于大型y-迷宫的一条臂的末端,该臂被指定为“起始臂”(臂长:15英寸)。挡住迷宫的第三条臂,允许小鼠自由探索三条臂中的两条(“起始臂”和“熟悉臂”),持续5分钟。每条臂都含有空间提示。三小时后,将小鼠放回到迷宫的“起始臂”中,并且允许探索全部三条臂,其中第三条臂疏通(“新臂”)。使用自动跟踪软件(any-迷宫)跟踪每条臂的进出运动。在昏暗照明条件下进行测试,并且在两次试验之间,用70%乙醇清洁设备。分析在“新臂”和“熟悉臂”中所花费的时间和整体次数,以及作为总体运动活动的量度的总移动距离和速度。
547、放射臂水迷宫(rawm)
548、在测试前至少24小时,向水迷宫(参见,例如,alamed j等人,《两天的放射臂水迷宫学习和记忆任务;稳固地解决转基因小鼠的淀粉样蛋白相关记忆缺陷(two-day radial-arm water maze learning and memory tasks;robust resolution of amyloid-relatedmemory deficits in transgenic mice.)》,《自然协议(nat.protoc.)》,1(4):1671-79(2006))注水,以使其平衡至25℃。用白色乳胶漆对水进行染色,以使动物可视以用于进行追踪,并且允许使用隐藏的平台。将八个不同的视觉提示放置在rawm插入物的八条臂的中的每一个的末端。第1天,对动物进行5次试验,各试验均具有可见平台以及30分钟的试验间间隔。动物花费60秒时间以到达平台。如果动物未在该时间内到达平台,则将它们引导至平台,并且允许停留持续15秒钟,然后从箱中移出。目标臂保持不变,并且针对5次试验中的每一次试验随机分配不同的起始臂,因此,除了直接与平台相对的两条臂外,小鼠在其余各臂中开始探索活动一次。每隔两只小鼠换一次目标臂,并且在所有治疗组之间保持平衡。在每次试验后,将小鼠置于带蓝色垫的空笼子中,并且允许在被放回到其居住笼子中之前在热灯下烘干。测试日为训练后48小时,当时动物经受相同的测试,每个测试5次试验,试验间间隔为30分钟,但具有隐藏的平台。针对错误次数(进入非目标臂)以及到达平台的潜伏期,对动物进行评分。使用any-迷宫软件来记录所有试验。
549、组织收集与组织学
550、在进行盐水灌注后,收集脑,并且通过正中矢状切片分离脑,其中一半固定在新制备的4%pfa中。24-48小时后,将pfa更换为30%蔗糖。24小时后,再次更换为30%蔗糖。将脑组织切片或裂解,并且通过标准组织学方法分析gfap、aqp4或iba1。使用共焦显微镜或轴扫描载玻片扫描仪获取图像。
551、化合物1的药代动力学测量
552、
553、对小鼠进行心脏穿刺,并且使用预先填充有k2edta或肝素的注射器收集血液样品。在给药后的多个时间点以10mg/kg、1mg/kg和0.3mg/kg对c57bl/6小鼠进行单次口服管饲剂量后,使用lc-ms/ms来测量化合物1的血浆和血液水平。用3倍体积的冰冷的水匀浆半脑组织,然后在分析前用空白小鼠血浆进一步稀释2倍。在给药后的多个时间点以10mg/kg、1mg/kg和0.3mg/kg对c57bl/6小鼠进行单次口服管饲剂量后,使用lc-ms/ms来测量化合物1的脑水平。
554、离体ltb4测定
555、将全血与化合物1或媒介物一起温育,然后与钙离子载体(钙霉素,a23187)或10%dmso一起温育。使用elisa来测量血浆中的ltb4水平。
556、开阔场地
557、开阔场地测试用于评估在新环境中的一般运动活动和探索行为。它由正方形竞技场(16英寸x16英寸)组成。在测试之前,将小鼠带到实验室持续至少30分钟以适应实验室条件(昏暗照明)。将小鼠放置在竞技场的中心,使用光束活动系统自动化软件(any-迷宫)在预定的外围和中心空间内进行记录和跟踪持续15分钟。分析在外围和中心区域中行进的总距离、平均速度和花费的时间。
558、筑巢
559、从居住笼子中取出所有筑巢材料,并且在评分前12-18小时给小鼠2个新鲜的窝。由不知道治疗组的实验者以0-5的等级仔细地对巢进行评分:0未受干扰,1受干扰,2平坦,3杯状,4不完全圆顶,5完全圆顶。
560、倒置线悬挂
561、在测试之前,将小鼠带入实验室持续至少20分钟以适应实验室条件(明亮照明)。每只小鼠都被放在网格的中央。然后,在一个连续的动作中,迅速地将网格翻转180度,以将小鼠倒挂起来,其中小鼠的鼻子是小鼠被悬挂的最后一个部分。一旦小鼠完全悬挂,就启动计时器,并且记录下落时间。小鼠测试3次,其中每次测试之间没有休息时间,最大暂停时间为120秒。记录每只动物下落的最大时间和平均时间。
562、转棒
563、通过允许小鼠在i-therm ctr-44旋棒上以5rpm的速度设置在转棒上运行5分钟来训练小鼠,如果小鼠掉落,则将其放回,直到它能够完成5分钟而不掉落。在15分钟后,如果小鼠不能在转棒上停留连续5分钟,则从分析中排除该小鼠。然后对小鼠进行3次试验,其中速度在90秒内从5rpm增加到40rpm;对于每次试验都记录下小鼠掉落的时间。试验间间隔为至少15分钟,以允许小鼠充分的休息。在两次试验之间,用70%的乙醇清洗转棒。
564、qpcr
565、在盐水灌注后收集脑,并且通过正中矢状切片分离,其中一半切成海马和皮质,然后在干冰上快速冷冻。根据制造商的说明,使用rnaeasy qiagen试剂盒从脑组织中分离rna,简而言之,在rlt缓冲液中使用omni bead ruptor来匀浆组织,将rna结合到rna分离柱上,洗涤并洗脱。通过dna酶消化去除污染的dna,并且使用life technologiessuperscript iii试剂盒产生cdna。使用适当的正向引物和反向引物以及sybr green试剂或taqman试剂来制备qpcr的主混合物。该反应在life technologies quantstudio实时pcr系统上运行,并且在quantstudio6软件上使用std ddct方案进行分析。
566、ltb4靶向接合测定
567、使用肝素作为抗凝剂,通过心脏穿刺来收集全血。为每只小鼠收集160μl的全血,一式两份,并且在37℃/5% co2中温育15分钟。在此时间期间,通过将在dmso中配制的10mm钙霉素(sigma c7522)稀释到pbs中来制备0.1mm钙霉素原液。通过在pbs中稀释相同体积的dmso来制备对照溶液。将两种溶液在37℃水浴中超声处理10分钟。将40μl的0.1mm钙霉素(刺激的)或对照溶液(未刺激的)加入到全血的每个孔中,并且在37℃/5%co2下温育30分钟。全血以1000xg旋转10分钟以分离出血浆。通过对收集的刺激的和未刺激的以1:10稀释的血浆运行elisa来检测ltb4水平(enzo life sciences,adi-901-068)。elisa板在bmglabtech clariostar板读取器上在405nm处读取。
568、cadasil小鼠模型
569、如前所述,获得转基因notch3r169c小鼠以及转基因notch3wt和/或野生型小鼠(ghosh m,等人,《神经病学年鉴》,78(6):887-900(2015);rajani rm等人,《神经病理学通讯(acta neuropathologica comm.)》,7(187)(2019);和joutel a等人,《临床研究杂志(j.clin.invest.)》,120(2):433-45(2010),通过引用以其整体并入本文)。给二十只notch3r169c小鼠和10只同窝出生的对照5月龄野生型小鼠以1mg/kg po每天两次施用媒介物或化合物1持续四个月。将小鼠麻醉,并且收集血液和组织用于进一步分析。
570、b.实施例1
571、在来自通过facehbi获得的人类阿尔茨海默病群组的血浆中测量lta4h蛋白的浓度。使用somascan多重蛋白质组分析平台,在患有主观认知衰退(scd)、轻度认知障碍(mci)和阿尔茨海默病(ad)的受试者中测量lta4h水平。
572、图1报告了从sdc到mci,随着阿尔茨海默病诊断的恶化,人lta4h血浆水平的显著增加。(kruskal-wallis检验,p=0.0023使用dunn多重比较:scd相对于mci p=0.0037、scd相对于ad p<0.0001;n=122)。图2报告了人类lta4h血浆水平与简易精神状态检查(mmse)中认知评分恶化显著相关。(spearmann r=-0.2357,p=0.0002;n=332)。
573、总之,该实施例确定了人类中lta4h血浆水平的增加与认知恶化和认知疾病显著相关,表明lta4h可能是年龄相关的认知衰退的驱动因素和/或生物标志物。
574、c.实施例2
575、将年龄在二十至二十二个月(20-22个月)之间的三个独立的老年野生型(wt;c57bl/6)小鼠群组按体重、开阔场地测试中行进的总距离和在开阔场地测试中的平均速度均匀化为两(2)组。第1组每天po施用媒介物对照。第2组每天po施用10mg/kg的lta4h抑制剂化合物1。两组每天给药持续10天或4周。在给药的最后一周期间运行行为测定,并且在研究结束时处死动物用于组织学和分子测定。
576、图3至图5报告了cfc的结果,cfc测量了在8天治疗后的老龄小鼠的情境记忆。图3报告了在任务训练期间的冷冻时间百分比,表明用媒介物或化合物1治疗的小鼠都能够学习任务。(双向anova。(n=14,13))。图4和图5报告了在cfc的测试阶段期间的冷冻时间百分比。(图4:双向anova*p<0.05.(n=14,13);图5:mann-whitney.**p<0.01.(n=13,13))。与用媒介物治疗的小鼠相比,用化合物1治疗的小鼠具有增加的冷冻时间。
577、图6至图9报告了y-迷宫的结果,y-迷宫测量了12天治疗后老龄小鼠的空间记忆。图6报告了时间(非配对t检验。(n=14,14))并且图7报告了在实验的训练阶段期间进入的次数(非配对t检验)。(n=14,14)),表明媒介物和化合物1治疗的小鼠都能够学习任务。图8报告了在测试阶段期间花费在新臂(n)或熟悉臂(f)上的时间百分比(双向anova,配对的t检验*p<0.05。(n=13,13)。用lta4h抑制剂化合物1治疗的小鼠在新臂中花费显著更多的时间,表明在短期治疗的情况下空间记忆的改善。图9报告了两个治疗组中的小鼠同等地进入n臂和f臂(双向anova,配对t检验*p<0.05。(n=13,13))。
578、图10至图13报告了y-迷宫的结果,y-迷宫测量了在26天治疗后老龄小鼠的空间记忆。图10报告了进入训练臂的次数(非配对t检验。(n=14,14))并且图11报告了在实验的训练阶段期间的时间(非配对t检验。(n=14,14)),表明媒介物和化合物1治疗的小鼠在该时间点都能够学习任务。图12报告了在测试阶段期间花费在新臂(n)或熟悉臂(f)上的时间百分比(双向anova,配对t检验*p<0.05。(n=14,14))。图13报告了进入n臂和f臂的百分比(双向anova,配对t检验*p<0.05。(n=14,14))。用lta4h抑制剂化合物1治疗的小鼠进入新臂明显多于进入熟悉臂,表明在长期治疗的情况下空间记忆的改善。
579、图14至图17报告了放射臂水迷宫(rawm)的结果,该放射臂水迷宫测量了在29天治疗后老龄小鼠的空间记忆。图14报告了潜伏期(双向anova。(n=12,12))并且图15报告了在实验的训练和测试阶段期间的错误数量(双向anova。(n=12,12)),表明用lta4h抑制剂化合物1治疗的小鼠在该任务期间在错误数量上具有小的但显著的改善。图16报告了在试验的最后阶段期间发现隐藏的平台的潜伏期(非配对t检验。(n=12,12;12、13))。在最后一次试验期间,用lta4h抑制剂化合物1治疗的小鼠具有在发现平台的时间方面减少的趋势。图17报告了在寻找隐藏的平台的最后一次试验期间的平均错误数(非配对t检验。(n=12,12;12、13))。在最后一次试验期间,用lta4h抑制剂化合物1治疗的小鼠在发现隐藏的平台的错误数量上显著减少。
580、图18至图21报告了y-迷宫的结果,该y-迷宫测量了在18天治疗后老龄小鼠的空间记忆。图18报告了花费在训练臂上的时间(非配对t检验。(n=15,14))并且图19报告了进入训练臂的次数,表明媒介物和化合物1治疗的小鼠在该时间点都能够学习任务(非配对t检验。(n=15,14))。图20报告了在用化合物1抑制lta4h的情况下显著改善了测试阶段期间在新臂(n)或熟悉臂(f)中花费的时间百分比(双向anova,配对t检验****p<0.0001。(n=14,13))。图21报告了进入n臂和f臂的百分比。用lta4h抑制剂化合物1治疗的小鼠进入新臂的次数明显多于进入熟悉臂的次数(双向anova,配对t检验****p<0.0001。(n=14,13)),表明通过18天的治疗,空间记忆有改善。
581、总之,这项工作确定了在小鼠中用化合物1抑制lta4h改善了情境和空间记忆。与之前鉴定通过lta4h抑制剂sc-57461a改善认知的工作相比,使用化合物1的这些结果令人惊讶。发现通过化合物1的认知改善更稳健。首先,化合物1证明比以前的结果更快地改善认知。例如,图4和图5确定了早在给药8天后改善的认知。第二,通过化合物1的认知改善在3组独立的小鼠群组中可重复,具有稳健的统计学意义。并且,第三,确定通过化合物1的抑制可以改善情境和空间记忆域,而以前用sc-57461a的研究仅改善空间记忆。
582、d.实施例3
583、图22至图30报告了星形胶质细胞的组织学的结果。gfap是一种泛星形胶质细胞标志物,其用于测量星形胶质细胞的总数量和大小,作为星形胶质细胞反应性的读数。aqp4是一种水通道,其在血脑屏障周围的星形胶质细胞终足(endfoot)表达。gfap和aqp4随着年龄的增长和患有认知衰退和bbb损伤的疾病而增加(kress bt等人,《神经病学年鉴》,76(6):845-61(2014),owasil r等人,《国际分子科学杂志(int j mol sci)》,21(4)(2020),和qil等人,《生命科学(life sci)》,88(1-2):50-56)。图22报告了gfap面积百分比(mann-whitney检验。(n=10,10)),图23报告了gfap+细胞的数量(mann-whitney检验)。(n=10,10)),并且图24报告了在给药10天后的海马的ca1区中gfap+细胞的平均大小(mann-whitney检验。(n=10,10))。图25报告了在给药媒介物或化合物1的10天后,在穿过ca1海马的大下行血管画出的60微米(μm)长线上的aqp4强度。通过化合物1治疗10天,aqp4强度呈下降趋势(具有重复测量的混合效应分析。p=0.1918。(n=40,40)。
584、图26报告了gfap面积百分比(非配对t检验。(n=15,15)),图27报告了gfap+细胞的数量(非配对t检验。(n=15,15)),并且图28报告了在海马的ca1区中gfap+细胞的平均大小(非配对t检验。(n=15,15))。在4周治疗后,gfap阈值面积百分比显著降低,而gfap+细胞总数没有变化。图29报告了在穿过ca1海马的大下行血管绘制的60微米(μm)长线上aqp4强度的降低(具有重复测量的混合效应分析。****p<0.0001。(n=60,60))。图30示出了在图7中绘制的数据的代表性图像。图31示出了血管周(pearson r=0.4628.**p=0.0026n=40),并且图32示出了血管aqp4荧光强度与ltb4的血浆水平显著相关(pearson r=0.4346,*p=0.0164n=30)。
585、总之,本实施例确定了在老龄小鼠中抑制lta4h持续4周降低了星形胶质细胞的反应性,但没有降低如使用gfap测量的星形胶质细胞总数。此外,在给药4周后,用lta4h抑制剂化合物1的抑制作用降低了在bbb处的aqp4水平,并且早在给药化合物1后10天就在老龄小鼠中观察到这种趋势。与以前鉴定通过lta4h抑制剂sc-57461a改变星形胶质细胞的工作相比,使用化合物1的这些结果令人惊讶。发现通过化合物1在bbb处aqp4的减少比以前的结果发生得更快。图25确定了早在给药后10天aqp4减少的趋势。并且,图29确定了在给药4周后aqp4的显著减少。
586、e.实施例4
587、图33至图35报告了化合物1在以10mg/kg、1mg/kg、0.3mg/kg和0.1mg/kg对c57bl/6小鼠进行单次口服管饲剂量后在多个时间点在血浆、脑和血液中的药代动力学的结果,并且使用lc-ms/ms进行测量。图33和图34报告了在单次剂量后,在血浆和血液中化合物1的水平维持并且可检测持续至多24小时。图35报告了在单次口服剂量后化合物1在小鼠的脑中的检测和动力学,并且在单次剂量后维持并可检测持续至多24小时。
588、总之,本实施例确定了化合物1在血浆、血液和脑中的药代动力学概况。这一新的结果表明,即使在低剂量下,化合物1也是脑渗透的,这对于其他lta4h抑制剂来说还没有被鉴定,并且可以解释与另一种化学结构不同的lta4h抑制剂(sc-57461a)相比,实施例2中描述的化合物1的效果的稳健性。
589、f.实施例5
590、图36至图37报告了在人和小鼠血浆中用化合物1进行的离体靶接合测定的结果。将来自人或小鼠的全血与媒介物或化合物1一起温育,随后进行钙离子载体刺激。产生血浆并且使用elisa测量ltb4水平。ltb4是lta4h水解的产物,因此该测定报告lta4h的酶促活性。图36报告了人类结果,并且图37报告了小鼠结果,确定钙离子载体刺激增加了ltb4血浆水平,并且化合物1治疗将ltb4血浆水平降低至未刺激的水平。
591、总之,本实施例表明化合物1在人和小鼠血液中离体抑制lta4h水解活性。
592、g.实施例6
593、图38至图52报告了用媒介物或化合物1治疗的老龄c57bl6小鼠的一般总体健康结果。图38报告了在第一群组的小鼠中,与媒介物相比,在给予化合物1的10天后体重没有变化(双向anova。(n=14,14))。图39报告了在第一群组的小鼠中,与媒介物相比,给予化合物1的4周后体重没有变化(双向anova。(n=14,14))。图40报告了在第二群组的小鼠中,与媒介物相比,给予化合物1的10天后体重没有变化(双向anova。(n=15,13))。图41报告了在第二群组的小鼠中,与媒介物相比,在给予化合物1的4周后体重没有变化(双向anova。(n=14,14))。图42报告了在第三群组的小鼠中,与媒介物相比,在给予化合物1的10天后体重没有变化(双向anova。(n=15,15))。图43报告了在第三群组的小鼠中,与媒介物相比,在给予化合物1的4周后体重没有变化(双向anova。
594、(n=15,14))。
595、图44报告了与媒介物相比,在给予化合物1的10天后,在开阔场地测试中行进的总距离没有变化。(mann-whitney。(n=13,13)。图45报告了与媒介物相比,在给予化合物1的10天后,在开阔场地测试中速度没有变化。(mann-whitney。(n=13,13)。图46报告了与媒介物相比,在给予化合物1的10天后,在开阔场地测试中在外围(p)或中心(c)花费的时间之间没有差异。两个组在p中都花费了更多的时间(双向anova。配对t检验****p<0.0001。(n=14,14))。图47报告了与媒介物相比,在给予化合物1的4周后,在开阔场地测试中行进的总距离没有变化。(mann-whitney。(n=14,14)。图48报告了与媒介物相比,在给予化合物1的4周后,在开阔场地测试中速度没有变化。(mann-whitney。(n=14,14)。图49报告了与媒介物相比,在给予化合物1的4周后,在开阔场地测试中在外围(p)或中心(c)花费的时间之间没有差异。两个组在p中都花费了更多的时间(双向anova。配对t检验****p<0.0001。(n=13,14))。
596、图50报告了在给予化合物1或媒介物10天后,筑巢建筑评分没有变化(非配对t检验。(n=14,14)。图51报告了在给予化合物1或媒介物12天后,线悬挂测试建筑评分中的最大悬挂时间没有变化(非配对t检验。(n=15,14)。图52报告了在给予化合物1或媒介物19天后,落在转棒任务上之前的平均时间(线悬挂测试建筑得分)没有变化(非配对t检验。(n=15,14)。
597、总之,本实施例表明化合物1不影响小鼠健康的一般读数,包括使用开阔场地测量的体重、运动和焦虑,使用筑巢评分测量的日常生活活动,以及使用线悬挂和转棒测量的运动功能。
598、h.实施例7
599、图53报告了与媒介物相比,在给予化合物1的10天后il1b海马基因表达降低的趋势(单向anova,tukey多重比较检验p=0.07。(n=13,13,11,12)。图54报告了与媒介物相比,在给予化合物1的10天后iba1海马基因表达降低的趋势(单向anova,tukey多重比较检验p=0.07。(n=13,13,12,11)。图55报告了与媒介物相比,在给予化合物1的10天和4周后h2d1海马基因表达降低的趋势(单向anova,tukey多重比较检验p=0.054,p=0.08。(n=14,13,12,12)。图56报告了与媒介物相比,在给予化合物1的4周后dcx海马基因表达增加(单向anova,tukey多重比较检验*p<0.05。(n=14,13,12,12)。图57报告了与媒介物相比,在给予化合物1的10天后,egr1海马基因表达增加(单向anova,tukey多重比较检验*p<0.05。(n=14,13,12,12)。图58报告了与媒介物相比,在给予化合物1的10天后creb1海马基因表达增加(单向anova,tukey多重比较检验*p<0.05。(n=14,13,12,12)。
600、图59报告了与媒介物相比,在给予化合物1的4周后,如通过组织学测量的海马中iba-1阈值面积百分比的减小。(非配对t检验*p<0.05。(n=14,13))。
601、总之,本实施例表明用化合物1治疗老龄小鼠减少了脑中的炎性基因和蛋白质,包括图53il1b基因表达、图54iba1基因表达、图55h2d1基因表达和图59iba1蛋白质表达。化合物1治疗也增加了神经发生标志物dcx的基因表达图56。此外,化合物1治疗增加了对神经元活动重要的立即早期基因的基因表达,包括图57egr1和图58creb1。
602、i.实施例8
603、图60至图62报告了在小鼠血浆中用化合物1进行的体内靶接合测定的结果。来自给予化合物1持续10天的小鼠的全血图60或来自给予化合物1持续4周的小鼠的全血图61与钙离子载体一起温育以刺激ltb4释放。产生血浆并且使用elisa测量ltb4水平。ltb4是lta4h水解的产物,因此该测定报告了lta4h的酶促活性。图60报告了在老龄小鼠中给药10天后化合物1对lta4h的抑制作用(单向anova,tukey多重比较检验****p<0.0001。(n=15,15,15,15)并且图61报告了在老龄小鼠中给药4周后化合物1对lta4h的抑制作用(单向anova,tukey多重比较检验****p<0.0001。(n=15,14,15,14))。图62报告了对于幼龄小鼠中进行的3项独立研究,给予化合物1的小鼠的比较。(单向anova,tukey多重比较检验*p<0.05。(n=3,3,3,3,3))。
604、总之,本实施例表明用化合物1治疗老龄小鼠持续10天或4周抑制lta4h水解活性,并且在3项独立的研究中抑制量没有差异。
605、j.实施例9
606、图63至图66报告了血脑屏障(bbb)渗漏的体内模型的结果。用媒介物或化合物1治疗老龄小鼠4周,然后使用急性高剂量的lps来诱导bbb破坏。通过尾静脉注射荧光素钠,并且使用荧光板读数器测量荧光素钠进入脑的渗漏。图63报告了lps在幼龄小鼠和老龄小鼠中诱导bbb破坏。用化合物1治疗老龄小鼠导致lps后bbb渗漏减少的趋势(带有dunn多重比较的kruskal-wallis检验与事后mann-whitney检验。***p<0.001、**p<0.005、*p<0.05。(n=10,10,8,9,5,7)。图64报告了在给予媒介物或化合物1的4周后,接着给予高剂量lps以诱导bbb破坏,在穿过ca1海马的大下行血管绘制的60微米(μm)长线上的aqp4强度。通过化合物1治疗,aqp4强度有下降趋势(具有重复测量的混合效应分析。p=0.0912。(n=69,57))。图65报告了在给予媒介物或化合物1的4周后,接着给予高剂量lps以诱导bbb破坏,在穿过ca1海马的大下行血管绘制的60微米(μm)长线上的gfap强度。(具有重复测量的混合效应分析。(n=69,57))。图66报告了在小鼠血浆中用化合物1进行的体内靶接合测定的结果。将来自给予化合物1持续4周然后给予高剂量lps的小鼠的全血与钙离子载体一起温育以刺激ltb4释放。产生血浆并且使用elisa测量ltb4水平。ltb4是lta4h水解的产物,因此该测定报告了lta4h的酶促活性。图66报告了给予化合物1后ltb4水平的显著降低,以及在lps后用化合物1治疗的小鼠中的趋势性降低。(带有dunn多重比较的kruskal-wallis检验与事后mann-whitney检验。****p<0.0001(n=8,9,8,9))。
607、总之,本实施例表明用化合物1治疗老龄小鼠提高了对高剂量lps血脑屏障破坏模型的响应。该模型用于模拟cadasil中发生的破坏。这些数据共同表明,用化合物1抑制lta4h可能有利于改善在这些和类似疾病中发生的bbb渗漏。
608、k.实施例10
609、如先前在a部分(上文实验程序)中所述用媒介物或化合物治疗的转基因notch3r169c小鼠经由心脏穿刺在预充有肝素的注射器中收集血液。在盐水和肝素输注后收集脑,并且通过正中矢状切片分离。将一半脑在4% pfa中滴固定,并且24小时后,将脑更换到15%蔗糖溶液中。在pfa中初次固定后48小时,进行向30%蔗糖的二次更换。
610、周细胞
611、然后使用振动切片机将脑切片至50微米厚,并且置于载玻片上用于进行免疫染色,并且如前所述(ghosh同上)用pdgfrβ和凝集素抗体染色以示出周细胞覆盖。通过以大约100μm的间隔在不相邻的切片中随机选择四个视野来分析皮质中每平方毫米所选的视野区域中pdgfrβ阳性周细胞的数量。
612、将用化合物1治疗的转基因notch3r169c小鼠中得到的周细胞覆盖和数量与用媒介物治疗的转基因notch3r169c小鼠或用媒介物治疗的野生型对照小鼠进行比较。与用媒介物治疗的野生型对照小鼠相比,用媒介物治疗的转基因小鼠示出降低的周细胞覆盖和数量。并且,与用媒介物治疗的转基因小鼠相比,用化合物1治疗的转基因小鼠示出周细胞覆盖和数量的增加。周细胞在神经血管单位中起重要作用,并且在这种cadasil转基因小鼠模型notch3r169c中周细胞的损失与血脑屏障功能障碍相关(ghosh同上)。在化合物1的情况下周细胞覆盖和数量的增加表明,用该抑制剂治疗改善了神经血管单位的功能,并且恢复了由于cadasil突变r169c引起的周细胞的损失。这些数据表明,化合物1治疗可能有益于cadasil患者以改善其神经血管单位的功能。
613、血脑屏障完整性
614、白蛋白和纤维蛋白原的存在被测量为脑实质中的阳性信号。如前所述量化信号(ghosh同上)。与媒介物治疗的野生型对照相比,用媒介物治疗的转基因小鼠增加了白蛋白和纤维蛋白原向脑实质中的渗漏。与媒介物治疗的小鼠相比,用化合物1治疗的转基因小鼠表现出降低的白蛋白和纤维蛋白原,表明改善的血脑屏障(bbb)完整性。cadasil患者还表现出bbb渗漏增加,并且这些数据表明化合物1治疗可能有益于人类以改善bbb完整性。
615、gfap和aqp4标志物
616、测量星形胶质细胞的gfap和aqp4标志物以确定星形胶质细胞终足的存在。与媒介物治疗的野生型对照相比,用媒介物治疗的转基因小鼠降低了gfap和aqp4。并且与媒介物治疗的小鼠相比,在化合物1治疗的小鼠中观察到皮质中在凝集素阳性血管处的阳性信号增加。aqp4和gfap是星形胶质细胞的标志物,星形胶质细胞是神经血管单位的重要组成部分,并且在cadasil小鼠模型和人类患者中丧失。在化合物1的情况下星形胶质细胞覆盖的增加表明这种治疗可能有益于改善cadasil人类患者的神经血管功能。
617、另外的血脑屏障标志物
618、血脑屏障改善的标志物诸如内皮细胞、血浆蛋白、细胞粘附蛋白、基底膜蛋白、间隙连接蛋白和紧密连接蛋白都示出与媒介物治疗的小鼠相比,化合物1治疗的小鼠的皮质的显著水平的改善。
619、ltb4水平
620、使用从用化合物1或媒介物对照治疗的转基因notch3r169c小鼠收集的血浆来测量ltb4的血浆水平。与用媒介物对照治疗的小鼠相比,在化合物1治疗的小鼠中观察到ltb4的血浆水平降低。这表明化合物1在cadasil转基因小鼠模型中的靶向接合。
621、l.实施例11
622、转基因notch3r169c小鼠相对于野生型的ltb4和lta4h血浆水平
623、使用从野生型小鼠和转基因notch3r169c小鼠收集的血浆来确定ltb4和lta4h的血浆水平。ltb4和lta4h的测量表明,与野生型相比,在转基因notch3r169c小鼠中两者的浓度都增加。这表明lta4h和ltb4在cadasil转基因小鼠中发生了变化,并且lta4h酶促活性的抑制可能有利于治疗cadasil。
624、m.实施例12
625、用媒介物或sc-57461a市售lta4h抑制剂治疗20-21月龄的雄性c57bl/6小鼠。小鼠以2.5mg/kg po被给予sc-57461a,每日两次,持续一个月。将小鼠麻醉,并且收集血液和组织用于进一步分析。经由心脏穿刺在预先填充有肝素的注射器中收集血液。在acsf灌注后收集脑,并且处理以用于标记的内皮细胞的单细胞rna测序。
626、基于本领域普通技术人员已知的技术对脑内皮细胞(bec)进行分类、测序和分析(参见chen mb等人,《细胞报告(cell rep)》,30(13):4418-32e4(2020),其通过引用以其整体并入本文)。简而言之,在解剖脑膜后,使用miltenyi 130-092-628神经解离试剂盒的说明,显微解剖、切碎并酶促解离定义为海马和皮质的皮质帽。用抗cd31对细胞悬浮液的内皮细胞进行染色,并且用抗cd11b对小胶质细胞进行染色,并且使用sony多用途细胞分选仪ma900使用流式细胞术进行分选。确定门控以将cd31阳性内皮细胞、cd11b阴性内皮细胞与cd11b阳性、cd31阴性的小胶质细胞分开。死亡细胞被排除。将单细胞直接分选到裂解缓冲液中,并且被加工用于cdna合成。在illumina平台上制备文库并测序。将数据返回至alkahest并进行处理,以确定各治疗组之间的差异基因表达。
627、来自用媒介物或lta4h抑制剂sc-4651a治疗的老龄小鼠的bec的单细胞rna测序的基因本体(go)富集
628、表4详述了前5个重要的生物过程go术语,这些术语通过比较来自从用媒介物或lta4h抑制剂sc-57461a治疗的老龄小鼠中分离的bec的单细胞测序结果来确定。g:profiler web服务器(https://bitt.cs.ut.ee/gprofiler)。
629、表4
630、
631、来自表4的数据强调了lta4h抑制对脑内皮细胞基因表达的广泛的有益影响。例如,在老龄小鼠中用sc-57461a长期抑制lta4h会导致内皮环境的变化,影响诸如“血管发育”和“对细胞因子的响应”等go术语(图1)。
632、n.实施例13
633、来自用lta4h抑制剂治疗的老龄小鼠的内皮基因的microbulk qpcr
634、将来自用lta4h抑制剂化合物1或sc57461a治疗的小鼠的脑的纯化内皮细胞中有害基因bsg、gbp4和cxcl12的下调与用媒介物治疗的小鼠的那些下调进行比较。通过qpcr从500个分选的内皮细胞中测量基因表达,并且相对于gapdh对照归一化。
635、用媒介物、1mg/kg化合物1或2.5mg/kg sc57461a(每个治疗组n=3只小鼠)口服每天两次治疗老龄c57bl/6小鼠(21月龄)持续1个月。从每只小鼠中分离出一个皮质帽(皮质和海马),并且使用miltenyi中性解离试剂盒(#130-092-628)解离细胞。使用sony多用途细胞分选仪ma900将细胞分选到干净的、不含rna酶的200ul pcr条带管中,其中含有5ul的rnalater,浓度为每管500个细胞。按照qiagen rneasy micro kit(#74004)的试剂盒方案来分离rna。使用superscript iii试剂盒方案合成cdna,并且使用taqman或sybr绿色引物运行qpcr测定。
636、图67比较了在媒介物、化合物1lta4h小分子抑制剂和sc-47561a市售小分子lta4h抑制剂中bsg基因的下调。化合物1或sc-47561a的治疗导致bsg基因表达的下调。bsg编码basigin/emmprin/cd147,其是细胞表面标志物,该标志物在损伤如中风或炎症后在脑内皮中增加(patrizz a等人,《衰老(aging)》,12(6):5121-39(2020),其通过引用以其整体并入本文)。
637、图68比较了在媒介物、化合物1lta4h小分子抑制剂和sc-47561a市售小分子lta4h抑制剂中gpb4基因的下调。化合物1或sc-47561a的治疗导致gpb4基因表达的下调。gpb4编码鸟苷酸结合蛋白4,其在应答干扰素或tnfα时被上调,表明其作为有害的促炎因子的作用(nair sr等人,《神经病毒学杂志(j neurovirol.)》,23(6):886-902(2017)和intlekoferka等人,《公共科学图书馆·综合》,14(4):e0215389(2019),其通过引用以其整体并入本文)。
638、图69比较了在媒介物、化合物1lta4h小分子抑制剂和sc-47561a市售小分子lta4h抑制剂中促炎基因cxcl12(c-x-c基序趋化因子配体12,也称为基质细胞衍生因子1或sdf-1)的下调。化合物1或sc-47561a的治疗导致cxcl12基因表达的下调。cxcl12是一种有害的促炎性趋化因子,其介导血脑屏障损伤和神经炎症,mai c-l等人,《治疗诊断学(theranostics)》,11(3):1059-78(2021)和stumm rk等人,《神经科学杂志(jneurosci.)》,22(14):5865-78(2002),这些文献通过引用以其整体并入本文)。
639、o.实施例14
640、来自用lta4h抑制剂治疗的老龄小鼠的脑组织的单细胞rna测序
641、用媒介物或2.5mg/kg sc57461a(每个治疗组n=3只小鼠)口服每天两次治疗老龄c57bl/6小鼠(21月龄)持续1个月。分离来自每只小鼠的一个皮质帽(皮质和海马),并且使用sony多用途细胞分选仪ma900解离和分选细胞。根据先前描述的技术(yousf h等人,《生物实验方案(bio protocol.)》,8(22):e3091(2018),其通过引用以其整体并入本文)分析来自单个脑细胞的无偏rna测序。
642、图70示出了来自用lta4h抑制剂sc-57461a治疗的老龄小鼠的脑组织的无偏单细胞rna测序的内皮细胞基因变化的火山图。减少的基因表达用灰点表示,而增加的基因表达用黑点表示。无显著变化的基因未示出。被认为具有-log10 benjamini-hochberg(bh)的显著性的基因调整p值>2(p<0.01)和log10倍数变化>1.3(p<0.05)。中枢神经系统中的内皮细胞与星形胶质细胞和周细胞一起在血液和脑隔室之间维持高度选择性的渗透性屏障,这对于正常的脑生理学是至关重要的。(herland a等人,《公共科学图书馆·综合》.11(3):e0150360(2016)),其通过引用以其整体并入本文)。因此,这些数据表明lta4h抑制导致脑内皮细胞的许多显著基因变化,表明神经血管功能的改善。
643、图71示出了来自用lta4h抑制剂sc-57461a治疗的老龄小鼠的脑组织的无偏单细胞rna测序的星形胶质细胞基因变化的火山图。减少的基因表达用灰点表示,而增加的基因表达用黑点表示。无显著变化的基因未示出。星形胶质细胞对于维持神经血管系统的正常生理和维持血脑屏障的完整性是必需的,它们的细胞过程朝向内皮延伸并插入基底膜(herland上文)。被认为具有-log10 benjamini-hochberg(bh)的显著性的基因调整p值>2(p<0.01)和log10倍数变化>1.3(p<0.05)。这些数据表明lta4h抑制导致星形胶质细胞的许多显著基因改变,表明神经血管功能的改善。
644、图72示出了来自用lta4h抑制剂sc-57461a治疗的老龄小鼠的脑组织的无偏单细胞rna测序的周细胞基因变化的火山图。减少的基因表达用蓝点表示,而增加的基因表达用红点表示。变化不明显的基因表达用黑点表示。被认为具有-log10 benjamini-hochberg(bh)的显著性的基因调整p值>2(p<0.01)和log10倍数变化>1.3(p<0.05)。
645、嵌入在微血管的基底膜中的周细胞是紧紧包围内皮的血管壁细胞。它们沿着毛细血管前小动脉、毛细血管和毛细血管后小静脉延伸其突起。中枢神经系统中的周细胞独特地位于内皮细胞、星形胶质细胞和神经元之间的神经血管单元中。(sweeney md等人,《自然神经科学(nature neuroscience)》,19(771-83)(2016),其通过引用以其整体并入本文)。像星形胶质细胞一样,周细胞传递脑微血管内皮的正常功能和分化所需的线索,并且所有三种细胞类型—内皮细胞、周细胞和星形胶质细胞—都是维持神经血管系统的正常生理学和维持血脑屏障的完整性所必需的(herland同上)。因此,这些数据表明lta4h抑制导致周细胞许多显著的基因改变,表明神经血管功能的改善。
646、p.实施例15
647、用媒介物、化合物1或sc-57461a市售lta4h抑制剂治疗20-21月龄的雄性c57bl/6小鼠。小鼠被口服给予1mg/kg的化合物1或2.5mg/kg的sc-57461a,每日两次,持续一个月。将小鼠麻醉,并且收集血液和组织用于进一步分析。经由心脏穿刺将血液收集在预先填充有肝素的注射器中。在acsf灌注后收集脑,并且处理脑以用于标记的内皮细胞(实验1)或neun阳性神经元细胞核(实验2)的单细胞rna测序。在+独立的小鼠群组中,在4% pfa灌注后收集脑用于组织学终点(实验3)。
648、在实验1中,通过单细胞rna测序技术来确定这些老龄小鼠的脑中的内皮基因表达,所述测序技术是本领域普通技术人员所熟知的(参见,例如,chen mb等人,《细胞报告》,30(13):4418-32e4(2020),其通过引用以其整体并入本文)。观察到,与sc-57461a化合物相比,化合物1在老龄小鼠的脑中产生更稳健的内皮基因表达变化,例如包括vcam1和alpl的有害基因的减少,以及包括selenop和plat的有益基因的增加。
649、在实验2中,还通过单细胞rna测序技术来确定这些老龄小鼠的脑中的神经元基因表达(参见,例如,lacar b等人,《自然通讯(nature comm.)》,7(11022)(2016),其通过引用以其整体并入本文)。观察到,与sc-57461a化合物相比,化合物1在老龄小鼠的脑中产生更稳健的神经元基因表达变化,例如包括cox6a2和sox11的有害基因的减少,以及包括grin1和grin2b的有益基因的增加。
650、在实验3中,还观察了这些老龄小鼠的脑中内皮细胞和神经元的脑组织学。观察到,与sc-57461a化合物相比,化合物1在老龄小鼠的脑中的内皮细胞和神经元中产生更稳健的组织学变化。
651、q.实施例16
652、与lta4h抑制剂相关的有益基因调控
653、用媒介物、1mg/kg化合物1或2.5mg/kg sc57461a(每个治疗组n=3只小鼠)口服每天两次治疗老龄c57bl/6小鼠(21月龄)持续1个月。来自10x genomics的用于小鼠脑组织方案的nucseq用于分离小鼠海马核。每次治疗使用大约65mg的脑组织。nonidet p40用于裂解细胞壁,并且分离的细胞核用draq5和neun抗体染色用于facs分选。对于每个样品收集了大约5,000个细胞核。对于每次治疗收集八个样品,每次治疗总共收集40,000个细胞核。这些样品被准备用于使用10x genomics chromium next gem试剂盒进行测序。
654、图73使用海马的齿状回中的神经元的单细胞rna测序,比较了相对于媒介物治疗的老龄小鼠,化合物1lta4h小分子抑制剂和sc-47561a市售小分子lta4h抑制剂中spock3基因的调节。用化合物1治疗导致齿状回中spock3基因表达的上调。该基因未受到sc-47561a治疗的显著影响。spock3编码富含半胱氨酸的酸性分泌蛋白(sparc),这是一种对突触的发育很重要的分泌蛋白。在成年后,sparc的表达减少,但响应于受伤或疾病被上调。这种上调被认为通过增加含glua1的ampa受体的数量和改善突触功能来发挥保护性的有益作用。此外,在大脑中动脉闭塞(mcao)模型后,sparc治疗改善了神经元健康和恢复,该模型模拟了在疾病如cadasil中的中风和缺血后发生的脑损伤(jones ev等人,《细胞神经科学前沿(front cell neurosci)》,12(22):1-3(2018))。
655、图74使用神经元的单细胞rna测序比较了在媒介物、化合物1lta4h小分子抑制剂和sc-47561a市售小分子lta4h抑制剂治疗的老龄小鼠中dcc基因的调节。用化合物1的治疗导致海马的齿状回中dcc基因表达的上调。该基因未受到sc-57461a治疗的显著影响。dcc编码“在结肠直肠癌中缺失”,这是一种对成年脑中突触可塑性以及学习和记忆重要的细胞粘附蛋白(horn ke等人,《细胞报告》,3:173-85(2013))。
656、来自用lta4h抑制剂治疗的老龄小鼠的microbulk qpcr plat有益基因
657、将来自用lta4h抑制剂化合物1或sc57461a治疗的小鼠的脑的纯化的内皮细胞中有益基因plat的下调与媒介物治疗的小鼠的那些下调进行比较。通过qpcr从500个分选的内皮细胞中测量基因表达,并且相对于gapdh对照进行归一化。
658、用媒介物、1mg/kg化合物1或2.5mg/kg sc57461a(每个治疗组n=3只小鼠)口服每天两次治疗老龄c57bl/6小鼠(21月龄)持续1个月。从每只小鼠中分离出一个皮质帽(皮质和海马),并且使用miltenyi中性解离试剂盒(#130-092-628)解离细胞。使用sony多用途细胞分选仪ma900将细胞分选到干净的、不含rna酶的200ul pcr条带管中,其中含有5ul的rnalater,浓度为每管500个细胞。按照qiagen rneasy micro kit(#74004)的试剂盒方案来分离rna。使用superscript iii试剂盒方案合成cdna,并且使用taqman或sybr绿色引物运行qpcr测定。
659、图75比较了在媒介物、化合物1lta4h小分子抑制剂和sc-47561a市售小分子lta4h抑制剂中plat基因的上调。化合物1或sc-47561a的治疗导致plat基因表达的上调。plat编码组织纤维蛋白溶酶原激活剂,它是一种破坏血凝块所必需的内皮蛋白,并且通常用作治疗中风适应症的治疗剂(wardlaw jm等人,《柳叶刀(lancet)》,379(9834):2364-72(2012))。
660、r.实施例17
661、ltb4受体(bltr1)与β-微管蛋白在海马树突神经元中的共定位以及lta4h与neun在海马神经元中的共定位
662、在染色前,将来自c57bl/6老龄小鼠的脑切片在pbs和0.5% pbst(triton-x 100)中洗涤。在加入一级抗体之前,用10%血清封闭一小时。针对bltr1和β-微管蛋白的一级抗体在4℃下温育过夜,并且二级抗体随后在室温下温育一小时。图像经由共焦显微镜以40倍放大率获得。
663、图76示出了ltb4受体bltr1与树突标志物β-微管蛋白在海马的ca1区中的共定位。该结果表明bltr1在神经元的树突中表达。
664、图77示出了lta4h与神经元细胞核标志物neun在海马的ca1区中的共定位。该结果表明lta4h在神经元中表达。
665、s.实施例18
666、在用lta4h抑制剂治疗的老龄小鼠的脑内皮细胞、ca1神经元、dg神经元中的单细胞rna测序
667、脑内皮细胞
668、用媒介物、1mg/kg化合物1或2.5mg/kg sc57461a(每个治疗组n=3只小鼠)口服每天两次治疗老龄c57bl/6小鼠(21月龄)持续1个月。如实施例12中所述对脑内皮细胞进行分选、测序和分析(参见chen mb等人,《细胞报告》,30(13):4418-32e4(2020),其通过引用以其整体并入本文)。
669、图78示出了来自单细胞rna测序的内皮细胞基因变化的火山图,所述单细胞rna测序在从用sc-57461a lta4h抑制剂治疗的老龄小鼠富集的脑内皮细胞上进行。减少的基因表达用灰点表示,而增加的基因表达用黑点表示。中枢神经系统中的内皮细胞与星形胶质细胞和周细胞一起在血液和脑隔室之间维持高度选择性的渗透性屏障,这对于正常的脑生理学是至关重要的。(herland,同上)因此,这些数据表明lta4h抑制导致脑内皮细胞的许多显著基因变化,表明神经血管功能的改善。
670、ca1海马神经元,dg海马神经元
671、用媒介物、1mg/kg化合物1或2.5mg/kg sc57461a(每个治疗组n=3只小鼠)口服每天两次治疗老龄c57bl/6小鼠(21月龄)持续1个月。来自10x genomics的用于小鼠脑组织方案的nucseq用于分离小鼠海马核。每次治疗使用大约65mg的脑组织。nonidet p40用于裂解细胞壁,并且分离的细胞核用draq5和neun抗体染色用于facs分选。对于每个样品收集了大约5,000个细胞核。对于每次治疗收集8个样品,每次治疗总共收集40,000个细胞核。这些样品被准备用于使用10x genomics chromium next gem试剂盒进行测序。
672、图79示出了来自单细胞rna测序的ca1神经元基因变化的火山图,所述单细胞rna测序在从用化合物1lta4h抑制剂治疗的老龄小鼠富集的neun+核上进行。减少的基因表达用灰点表示,而增加的基因表达用黑点表示。这些数据表明lta4h抑制导致海马的ca1区中神经元的许多显著基因变化,表明突触功能和信号传导的改善
673、图80示出了来自单细胞rna测序的dg神经元基因变化的火山图,所述单细胞rna测序在从用化合物1lta4h抑制剂治疗的老龄小鼠富集的neun+核上进行。减少的基因表达用灰点表示,而增加的基因表达用黑点表示。这些数据表明lta4h抑制导致海马的dg区中神经元的许多显著基因变化,表明突触功能和信号传导的改善。
674、图81示出了来自单细胞rna测序的ca1神经元基因变化的火山图,所述单细胞rna测序在从用sc-57461a lta4h抑制剂治疗的老龄小鼠富集的neun+核上进行。减少的基因表达用灰点表示,而增加的基因表达用黑点表示。这些数据表明lta4h抑制导致海马的ca1区中神经元的许多显著基因变化,表明突触功能和信号传导的改善。
675、图82示出了来自单细胞rna测序的dg神经元基因变化的火山图,所述单细胞rna测序在从用sc-57461a lta4h抑制剂治疗的老龄小鼠富集的neun+核上进行。减少的基因表达用灰点表示,而增加的基因表达用黑点表示。这些数据表明lta4h抑制导致海马的dg区中神经元的许多显著基因变化,表明突触功能和信号传导的改善。
676、t.实施例19
677、用lta4h抑制剂治疗的老龄小鼠的pecam-1和mmp9的降低
678、用媒介物或10mg/kg化合物1lta4h抑制剂口服治疗20-21月龄的雄性c57bl/6小鼠持续一个月。将小鼠麻醉并用盐水灌注。收集脑组织,并且细分为皮质和海马。皮质样品在ripa缓冲液中裂解,并且可溶性上清液级分被送至eve technologies,用于使用luminex技术在心血管疾病小组(cardiovascular disease panel)中进行分析。
679、图83示出了与媒介物相比,用化合物1治疗的老龄小鼠中皮质pecam-1蛋白的趋势性减少。pecam1在导致神经炎症的衰老和疾病中增加(kalinowska a等人,《欧洲神经病学杂志(eur j neurol)》,13(12):1284-90(2006))。该结果表明,化合物1对lta4h的抑制作用可能通过降低皮质pecam-1水平而有助于减少神经炎症。
680、图84示出了与媒介物相比,用化合物1治疗的老龄小鼠中皮质mmp9蛋白的趋势性减少。mmp9在导致认知障碍的衰老和疾病中增加(bruno ma等人,《神经病理学和实验神经病学杂志(j neuropathol exp neurol)》,68(12):1309-18(2009))。该结果表明,化合物1对lta4h的抑制作用可能通过降低皮质mmp9水平而有助于改善认知。
681、u.实施例20
682、血浆ltb4的药效学分析
683、使用肝素作为抗凝剂,通过心脏穿刺来收集全血。为每只小鼠收集160μl的全血,一式两份,并且在37℃/5% co2中温育15分钟。在此时间期间,通过将在dmso中配制的10mm钙霉素(sigma c7522)稀释到pbs中来制备0.1mm钙霉素原液。通过在pbs中稀释相同体积的dmso来制备对照溶液。将两种溶液在37℃水浴中超声处理10分钟。将40μl的0.1mm钙霉素(刺激的)或对照溶液(未刺激的)加入到全血的每个孔中,并且在37℃/5% co2下温育30分钟。全血以1000xg旋转10分钟以分离出血浆。通过对收集的刺激和未刺激的以1:10稀释的血浆运行elisa来检测ltb4水平(enzo life sciences,adi-901-068)。elisa板在bmglabtech clariostar板读取器上在405nm处读取。
684、图85示出了在单次1mg/kg剂量的化合物1后,钙霉素刺激的血浆ltb4水平的药效学读数的降低。该结果示出了对于lta4h水解酶活性,与化合物1的阳性靶标接合。
685、v.实施例21
686、cadasil人类疾病群体中ltb4受体的血浆水平
687、从cadasil疾病人群和年龄/性别匹配的健康对照中获得血浆样品用于分析。如所述(gold l等人,《公共科学图书馆·综合》,5(12):e15004(2010)),在somalogic,inc.(boulder,colorado)通过测量7000种蛋白质分析物的somascan多重蛋白质组分析平台来分析edta血浆样品。简而言之,测试样品与被称为somamer的专有适体亲和试剂的混合物一起温育。两个连续的基于珠的固定和洗涤步骤消除了未结合或非特异性结合的蛋白质和未结合的somamer,仅留下蛋白质靶结合的somamer。分离出这些剩余的somamer,并且在定制的agilent杂交阵列上同时定量每种试剂。
688、图86示出了通过somalogic测量,与健康对照相比,人cadasil患者的血浆中ltb4受体1(ltb4r)的血浆水平的趋势性增加(基于对性别和年龄进行调整的线性模型,p值p=0.06)。ltb4受体1和cadasil之间的这种联系揭示了通过抑制lta4h活性来降低ltb4水平可能是cadasil的有益的治疗策略。
689、cadasil人类疾病群体的ltb4的血浆水平
690、从cadasil疾病人群和年龄/性别匹配的健康对照中获得血浆样品用于分析。使用elisa对1:10稀释的收集的血浆(enzo life sciences,adi-901-068)分析edta血浆样品的ltb4。elisa板在bmg labtech clariostar板读取器上在405nm处读取。
691、图87示出了通过elisa测量,与健康对照相比,人cadasil患者的血浆中ltb4的血浆水平的显著增加。ltb4和cadasil的水平之间的这种联系揭示了通过抑制lta4h活性来降低ltb4水平可能是cadasil的有益的治疗策略。
692、w.实施例22
693、使用来自用lta4h抑制剂治疗的老龄小鼠的脑内皮细胞、ca1海马神经元和齿状回海马神经元的单细胞测序基因本体分析
694、使用g:profiler网络服务器(https://bitt.cs.ut.ee/gprofiler)分析差异调节基因列表来生成go术语。报告了来自生物过程类别的前20个基因本体(go术语),其按照由p值确定的显著性排序。该列表被过滤以报告包括少于1000个基因的重要go术语。
695、图88a以条形图的形式图示了来自从长期用媒介物或sc-57461alta4h抑制剂治疗的老龄小鼠中分离的脑内皮细胞(bec)的单细胞测序的前20个重要生物过程go术语。这种治疗导致了内皮环境的变化,影响了诸如“血管发育”和“对细胞因子的响应”的go术语,这些都是在cadasil患者中直接受到影响的生物过程。图88b是列出如图88a中描述的前20个重要go术语的附加信息的表格。
696、图89a以条形图的形式图示了来自从长期用媒介物或化合物1lta4h抑制剂治疗的老龄小鼠中分离的ca1海马神经元的单细胞测序的前20个重要生物过程go术语。这种治疗强调了lta4h抑制对ca1基因表达的有益影响,所述ca1基因表达与一系列广泛的生物过程有关。例如,在老龄小鼠中用化合物1长期抑制lta4h导致“突触信号传导”和“突触组织”的变化,这些变化是与认知和神经发生直接相关的过程,并且在cadasil患者中受到不利影响。图89b是列出如图89a中描述的前20个重要go术语的附加信息的表格。
697、图90a以条形图的形式图示了来自从长期用媒介物或化合物1lta4h抑制剂治疗的老龄小鼠中分离的dg海马神经元的单细胞测序的前20个重要生物过程go术语。这种治疗强调了lta4h抑制对脑dc神经元基因表达的有益影响,所述脑dc神经元基因表达与一系列广泛的生物过程相关。例如,在老龄小鼠中用化合物1长期抑制lta4h导致突触的变化,影响诸如“突触信号传导”和“突触组织”的go术语,它们是与认知和神经发生直接相关的过程,并且在cadasil患者中受到不利影响。图90b是列出如图90a中描述的前20个重要go术语的附加信息的表格。
698、图91a以条形图的形式示出了来自从长期用媒介物或sc-57461alta4h抑制剂治疗的老龄小鼠中分离的ca1海马神经元单细胞测序的前20个重要生物过程go术语。这种治疗强调了lta4h抑制对脑ca1神经元基因表达的有益影响,所述基因表达与一系列广泛的生物过程相关。例如,在老龄小鼠中用sc-57461a长期抑制lta4h会导致突触的变化,影响诸如“突触信号传导”和“突触组织”的go术语,它们是与认知和神经发生直接相关的过程,并且在cadasil患者中受到不利影响。图91b是列出如图91a中描述的前20个重要go术语的附加信息的表格。初步数据还表明,当使用组织学技术对突触前和突触后蛋白质进行染色并使用半高分辨率共聚焦显微镜成像时,用化合物1进行的治疗趋向于增加海马的ca1区中的突触密度。这表明用化合物1治疗可以增加突触密度,导致本文公开的实施例中描述的功能和认知改善。值得注意的是,在结构上与化合物1不同的sc-574661alta4h抑制剂没有表现出ca1突触密度增加的趋势。
699、图92a以条形图的形式图示了来自从用媒介物或lta4h抑制剂sc-57461a治疗的老龄小鼠中分离的dg海马神经元的单细胞测序的前20个重要生物过程go术语。这种治疗强调了lta4h抑制对脑dg神经元基因表达的有益影响,所述基因表达与一系列广泛的生物过程相关。例如,在老龄小鼠中用sc-57461a长期抑制lta4h导致突触的变化,影响诸如“突触信号传导”和“突触组织”的go术语,它们是与认知和神经发生直接相关的过程,并且在cadasil患者中受到不利影响。图92b是列出如图92a中描述的前20个重要go术语的附加信息的表格。
700、x.实施例23
701、与年龄匹配的对照相比,来自人类cadasil受试者的ltb4血浆分析。
702、从sunnybrook研究所获得来自5名cadasil受试者和5名年龄匹配的对照的全血。在产生血浆之前,用钙霉素刺激全血。首先,将在dmso中的100μl的10mm钙霉素(sigma#c7522)稀释到10ml的pbs中,并且在37℃下超声处理10分钟。在96孔聚苯乙烯板(corning354657)中,将160μl的全血在37℃/5% co2(panasonic mco-230aicuv-pa)中温育15分钟。接下来,将40μl的100μm钙霉素工作溶液加入到每个孔中,并且在37℃/5% co2下再次温育30分钟。在温育后,将板在4℃下以1500rpm离心10分钟。未刺激的血浆以1:10稀释,并且刺激的血浆以1:1000稀释。使用ltb4 elisa试剂盒(enzo life sciences,adi-901-068)按照包括的试剂盒方案来分析两者的ltb4,一式三份。最终读数在bmg labtech clariostar板读取器上在405nm处收集。
703、图93a示出,与年龄匹配的对照相比,在刺激的血浆中测量的cadasil受试者的ltb4水平显著增加。图93b示出了在cadasil受试者中未受刺激的血浆ltb4水平增加的趋势。
704、y.实施例24
705、在给予化合物1持续4个月后,与同窝仔对照相比,来自cadasil转基因小鼠模型notch3r169c的血浆和脑分析。
706、用媒介物或化合物1(1mg/kg)口服每天两次治疗notch3r169c小鼠(5月龄)持续4个月,并且用媒介物治疗同窝出生的wt对照持续4个月。在处死前,注射器被配备有7.5μl的1000u/ml肝素。为了增加ltb4血浆水平,在产生血浆之前用钙霉素刺激全血。首先,将在dmso中的100μl的10mm钙霉素(sigma#c7522)稀释到10ml的pbs中,并且在37℃下超声处理10分钟。在96孔聚苯乙烯板(corning 354657)中,为每只动物收集160μl的小鼠全血,并且在37℃/5% co2(panasonic mco-230aicuv-pa)中温育15分钟。接下来,将40μl的100μm钙霉素工作溶液加入到每个孔中,并且在37℃/5% co2下再次温育30分钟。在温育后,将板在4℃下以1500rpm离心10分钟。将血浆以1:10稀释,并且使用ltb4 elisa试剂盒(enzo lifesciences,adi-901-068)按照包括的试剂盒方案分析血浆的ltb4,一式两份。最终读数在bmg labtech clariostar板读取器上在405nm处收集。解剖脑组织以获得皮质。使用omnibeadruptor 24在ripa缓冲液(emd millipore 20-188)中匀浆三分之一的皮质。裂解物在4℃下以10,000g离心10分钟以收集上清液。通过bca(thermo fisher 23225)确定蛋白质浓度,然后在pbs中稀释至约10mg/ml。样品被送到eve technologies用于分析。
707、图94a示出了在刺激的血浆中测量的notch3r169c转基因小鼠(r169c)中ltb4水平的显著增加。在用化合物1治疗后,在这些小鼠中ltb4水平显著降低。图94b示出了在具有未刺激的血浆的组之间检测到的ltb4水平没有变化。
708、图95a示出了在用媒介物治疗的notch3r169c转基因小鼠(r169c)中的血浆中il-2的趋势性增加。在用化合物1治疗的notch3r169c转基因小鼠中,血浆中的il-2水平显著降低。图95b示出了在用媒介物治疗的notch3r169c转基因小鼠(r169c)中,脑皮质裂解物中的il-7水平存在趋势性增加。在用化合物1治疗的notch3r169c转基因小鼠中,脑皮质裂解物中的il-7水平显著降低。
709、这些结果表明,化合物1可以减少cadasil的小鼠模型中的ltb4和脑炎性细胞因子,并且可能是这种特定患者群体的新的治疗策略。
710、z.实施例25
711、用媒介物、化合物1或sc-57461a治疗持续一个月的老龄小鼠中长时程增强的功能性突触读数。
712、用媒介物、1mg/kg化合物1或2.5mg/kg sc57461a(每个治疗组n=5只小鼠)口服每天两次治疗老龄c57bl/6小鼠(21月龄)持续1个月。电物理记录如下在afasci,inc进行。用氟烷深度麻醉动物并断头。迅速取出大脑,并且放入冰冷的人工脑脊液(acsf)中,其被连续鼓入5% co2/95% o2。acsf由(以mm计)nacl 130.0、kcl 2.5、kh2po4 1.2、cacl22.4、mgso41.3、nahco3 26.0和葡萄糖10.0(ph 7.4)构成。使用组织切片机(stoelting co.、il)制备海马切片(400μm厚),并且在室温下在连续充氧的acsf中温育至少1小时,然后在室温下在室(harvard apparatus)中以浸没模式记录。使用axopatch-2b扩增器和pclamp10.4程序(axon instruments)通过digidata 1320a收集数据。用蠕动泵(dynamax,rainin)以约1.75ml/min的流速用5% co2/95% o2的acsf鼓泡连续灌注切片。
713、使用填充有acsf(电阻:1-3mω)的玻璃微电极记录场群体尖峰(ps)。通过同心双极刺激电极(fhc,inc.)以10秒的间隔输送双相电流脉冲(对于一个相位,0.2毫秒的持续时间,总共0.4毫秒)。在该频率刺激下没有观察到明显的突触抑制或易化。为了记录背侧齿状回中的场群体尖峰,将刺激电极放置在海马裂上以刺激旁路穿孔通路纤维,并且将记录电极放置在颗粒细胞层的内部。为了记录dg中的电场epsp,将刺激电极放置在海马裂上以刺激旁路穿孔通路纤维,并且将记录电极放置在颗粒细胞层的内部。在解剖后8小时内记录切片。钛刺激由2组100个脉冲(0.4毫秒双极脉冲持续时间,100hz)组成,持续1秒,间隔5秒。用clampfit10.4从负波的初始相位测量epsp的斜率和群体尖峰的振幅。用3个连续迹线的平均值来测量每个数据点。ltp被绘制为在高频刺激后相对于基线的百分比(平均值±sem)。
714、图96使用电生理学技术长时程增强(ltp)比较了用媒介物、化合物1lta4h小分子抑制剂和sc47561a市售小分子lta4h抑制剂治疗的老龄小鼠的小鼠中对神经元信号传导的功能结果。用化合物1的治疗导致ltp增加,这表明在用化合物1抑制lta4h后,在海马的ca1区中的神经元信号传导增加。令人惊讶的是,用市售工具化合物lta4h抑制剂sc47561a治疗没有示出相同的ltp增加。
715、图97使用电生理学技术长时程增强(ltp)比较了用媒介物、化合物1lta4h小分子抑制剂和sc47561a市售小分子lta4h抑制剂治疗的老龄小鼠的小鼠中对神经元信号传导的功能结果。用化合物1的治疗导致ltp增加,这表明在用化合物1抑制lta4h后,在海马的dg区中的神经元信号传导增加。令人惊讶的是,用市售工具化合物lta4h抑制剂sc47561a治疗没有示出相同的ltp增加。
716、aa.实施例26
717、化合物1的药效学剂量响应。
718、使用肝素作为抗凝剂,通过心脏穿刺来收集全血。为每只小鼠收集160μl的全血,一式两份,并且在37℃/5% co2中温育15分钟。在此时间期间,通过将在dmso中配制的10mm钙霉素(sigma c7522)稀释到pbs中来制备0.1mm钙霉素原液。通过在pbs中稀释相同体积的dmso来制备对照溶液。将两种溶液在37℃水浴中超声处理10分钟。将40μl的0.1mm钙霉素(刺激的)或对照溶液(未刺激的)加入到全血的每个孔中,并且在37℃/5% co2下温育30分钟。全血以1000xg旋转10分钟以分离出血浆。通过对收集的刺激和未刺激的以1:10稀释的血浆运行elisa来检测ltb4水平(enzo life sciences,adi-901-068)。elisa板在bmglabtech clariostar板读取器上在405nm处读取。
719、图98示出了在单剂量0.3mg/kg、0.1mg/kg或0.03mg/kg剂量的化合物1后,血浆ltb4水平的药效学读数的剂量响应。这些结果示出了对于lta4h水解酶活性和药效学剂量响应,与化合物1的阳性靶标接合。
720、bb.实施例27
721、与媒介物相比,用重组蛋白治疗1周的幼龄小鼠的突触密度降低。
722、幼龄的8周大的野生型(wt;c57bl/6)小鼠按体重在各组之间均质化。小鼠每天被静脉内(iv)给予pbs媒介物对照或重组人lta4h蛋白持续连续的7天。重组人lta4h(bio-techne,4008-sn)在通过尾静脉静脉内注射以4.6ug/150ul给药之前,用缓冲液交换到无菌pbs中。在给药后6周收集脑组织,并且使用homer1(突触后)和突触蛋白(突触前)抗体对突触进行染色。使用airyscan在共聚焦显微照片上收集图像,并且将突触密度量化为海马的ca1区中突触前和突触后标志物的并列。
723、图99报告了在用pbs对照或人重组lta4h蛋白治疗的小鼠的海马的ca1区中作为并列突触蛋白(突触前)和homer1(突触后)标志物测量的突触的数量。在lta4h治疗的动物中,突触的数量显著减少。示出的所有数据均为平均值±s.e.m.;*p<0.05,非配对t检验,n=42张图像,来自每组5只小鼠。这些结果表明,外周施用的人重组lta4h蛋白对3个月大的野生型(c57bl/6)小鼠的海马突触密度有显著的有害作用。
724、cc.实施例28
725、来自用lta4h抑制剂治疗的老龄小鼠的脑组织的单细胞rna测序
726、用媒介物或2.5mg/kg sc57461a(每个治疗组n=3只小鼠)口服每天两次治疗老龄c57bl/6小鼠(21月龄)持续1个月。分离来自每只小鼠的一个皮质帽(皮质和海马),并且使用sony多用途细胞分选仪ma900解离和分选细胞。根据先前描述的技术(yousf h等人,《生物实验方案(bio protocol.)》,8(22):e3091(2018),其通过引用以其整体并入本文)分析来自单个脑细胞的无偏rna测序。
727、来自图100的数据强调了lta4h抑制对脑星形胶质细胞基因表达的广泛的有益影响。例如,在老龄小鼠中用sc-57461a长期抑制lta4h会导致星形胶质细胞的变化,影响诸如“对碳水化合物的响应”和“细胞葡萄糖稳态”的go术语。
728、来自图101的数据强调了lta4h抑制对脑周细胞基因表达的广泛的有益影响。例如,在老龄小鼠中用sc-57461a长期抑制lta4h会导致周细胞的变化,影响诸如“血管生成”和“血管形态发生”的go术语。
729、来自图102的数据强调了lta4h抑制对脑内皮细胞基因表达的广泛的有益影响。例如,在老龄小鼠中用sc-57461a长期抑制lta4h会导致内皮细胞的变化,影响诸如“血管发育”和“血管形态发生”的go术语。
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!