一种基于表观遗传调控的pH响应型脂质体及其制备方法和应用
本发明属于药物制剂制备,具体涉及一种基于表观遗传调控的ph响应型脂质体及其制备方法和应用。
背景技术:
1、公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
2、免疫疗法是继手术、放射疗法、化学疗法以及靶向药物治疗后近年来最热门的肿瘤治疗方式,开启了肿瘤治疗的新时代。然而,大多数患者并不能从中获益,免疫治疗的总体有效率仅为10%~30%,主要原因肿瘤发生了免疫逃逸。2023年science translationalmedicine杂志一篇报道提出表观遗传失调是肿瘤发生免疫逃逸的重要原因。此外,英国爱丁堡大学steven m.pollard研究团队在cell杂志上揭示了肿瘤通过表观遗传调控重塑肿瘤免疫微环境,破坏免疫原性和免疫识别机制,在最具侵略性的间充质多形性胶质母细胞瘤亚型中驱动获得免疫逃逸程序。基于此,开发基于调控表观遗传的疗法以抑制肿瘤免疫逃逸,对提高肿瘤免疫治疗具有重要意义,有望为肿瘤免疫治疗提供新思路。
3、表观遗传是一种基因序列不发生变化,但基因表达水平、修饰等表观遗传是一种基因序列不发生变化,但基因表达水平、修饰等却可以产生可遗传改变的现象,它对基因调控主要包括3个方面,分别是dna甲基化修饰、组蛋白修饰和非编码rna调控。dna甲基化是目前研究得最多的表观遗传学机制,它是一种常见的dna修饰,指在dna甲基转移酶(dnamethyltransferase,dnmt)催化作用下,以s-腺苷甲硫氨酸(s-adenosyl methionine,sam)作为甲基供体,通过共价键结合的方式获得一个甲基基团的化学修饰过程。异常的dna高度甲基化会抑制基因的表达,肿瘤细胞正是利用这一点,使肿瘤抗原启动子高度甲基化,抑制肿瘤抗原表达,规避了抗原提呈细胞对肿瘤细胞表面抗原的摄取处理与递呈,逃避了免疫效应细胞的识别与杀伤。除利用高度dna甲基化的表观遗传调控机制以抑制肿瘤抗原表达外,肿瘤细胞还可调控组蛋白乙酰化机制直接控制pd-l1。其中bet蛋白家族成员溴结构域蛋白4(bromodomain-containing protein 4,brd4)重点参与了pd-l1的表达,其可以与编码pd-l1的cd274启动子和增强子区的乙酰化组蛋白h3k27ac结合促进pd-l1的表达,从而帮助肿瘤细胞逃避免疫监视和杀伤。然而,现有技术中鲜有将表观遗传学干预与免疫治疗相结合的治疗方法用于癌症治疗。
技术实现思路
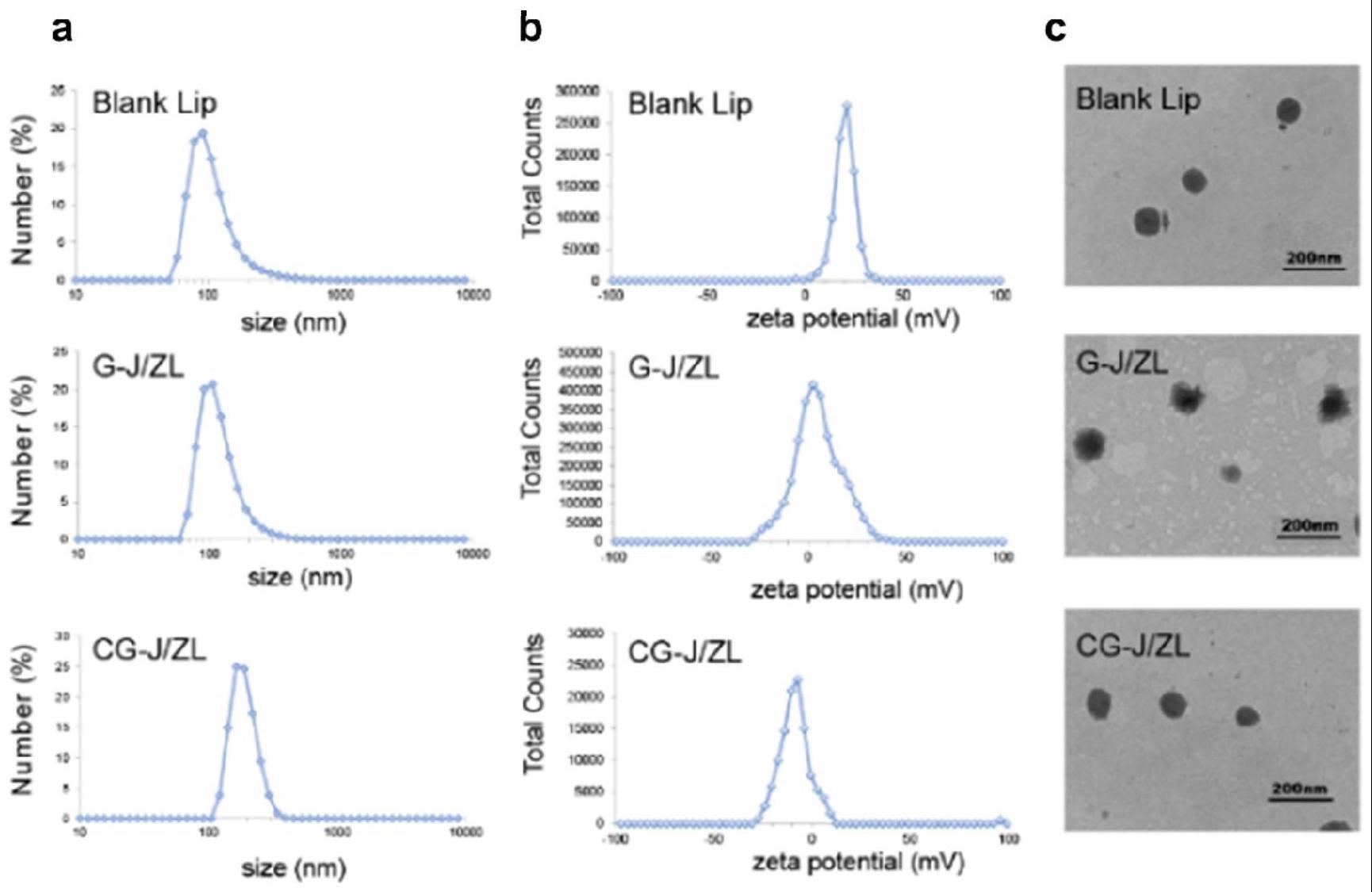
1、针对现有技术的不足,发明人经长期的技术与实践探索,提供一种基于表观遗传调控的ph响应型脂质体及其制备方法和应用。本发明通过试验研究基于静电吸附作用压缩佐剂胞嘧啶-磷酸-鸟嘌呤(cytosine-phosphate-guanine,cpg)得到共载的阳离子脂质体(g-j/zl),以促进抗原递呈细胞成熟。为降低阳离子脂质体的毒性,将ph敏感材料外壳材料羧甲基壳聚糖-聚乙二醇-天冬酰胺-甘氨酸-精氨酸(cmcs-peg-ngr,cpn)与上述荷正电阳离子脂质体g-j/zl通过静电吸附组装得到适用于“双向调控”的ph响应型脂质体cg-j/zl。基于上述研究成果,从而完成本发明。
2、为实现上述技术目的,本发明采用的技术方案如下:
3、本发明提供一种基于表观遗传调控的ph响应型脂质体,所述ph响应型脂质体包含内核,所述内核是由共载泽布拉林和jq-1的阳离子脂质体构成;和,
4、在所述内核上,包覆有外壳,所述外壳是由羧甲基壳聚糖-聚乙二醇-天冬酰胺-甘氨酸-精氨酸(cmcs-peg-ngr,cpn)材料构成。
5、在一个具体实施例中,所述阳离子脂质体还含有胞嘧啶-磷酸-鸟嘌呤(cytosine-phosphate-guanine,cpg),所述胞嘧啶-磷酸-鸟嘌呤作为一种免疫佐剂,可诱发机体产生多种免疫学效应,提高系统免疫和黏膜免疫水平,从而增强上述脂质体的免疫治疗效果。
6、泽布拉林是一种dna甲基转移酶抑制剂,其不仅可以上调肿瘤相关抗原的表达,还可以通过癌睾丸抗原诱导肿瘤细胞上主要组织相容性复合体(major histocompatibility complex,mhc)i类分子的增强,最终增加免疫系统对肿瘤细胞的识别。而jq1是一种小分子抑制剂,可通过抑制brd4表达下调免疫检查点pd-l1。本发明通过将上述两种药物复配作为脂质体的药物活性成分使用,从而将表观遗传学干预与免疫治疗相结合,产生协同作用,从而有效增强癌症(如乳腺癌)的免疫治疗效果。
7、所述ph响应型脂质体的平均粒径为190.3±4.3nm,平均电位为-13.5±0.608mv。
8、一些实施例方案中,所述泽布拉林和jq-1的质量比为1~3:1,优选为1.25:1。
9、所述阳离子脂质体可利用现有已知脂质体辅料成分通过已知常规方法(如薄膜分散法)制备获得,在此不做具体限定。
10、本发明还提供上述基于表观遗传调控的ph响应型脂质体的制备方法,所述制备方法包括:
11、s1、阳离子脂质体制备:取大豆卵磷脂、(2,3-二油酰基-丙基)-三甲胺(氯盐)dotap和胆固醇,并取jq-1溶于有机溶剂中,蒸发形成薄膜,除去残留有机溶剂;之后将泽布拉林溶液加入其中进行水化,之后将cpg溶液加入制备的阳离子脂质体中经处理后即得;
12、s2、向步骤s1制得的阳离子脂质体中加入羧甲基壳聚糖-聚乙二醇-天冬酰胺-甘氨酸-精氨酸溶液,进行孵育,过滤后即得。
13、其中,所述大豆卵磷脂、dotap和胆固醇的质量比为10-20:1-2:3-5;进一步为20:1:5;所述大豆卵磷脂与jq-1的质量比为2-7:1,进一步为5:1;所述泽布拉林和jq-1的质量比为1~3:1,优选为1.25:1;
14、所述有机溶剂选自乙醇;
15、所述泽布拉林溶液为含有泽布拉林的生理盐水溶液,其浓度为1-10mg/ml,优选为5mg/ml。
16、所述水化具体条件为:在50~60℃条件下水化处理10~60min,优选为在55℃条件下水化30min;
17、所述处理的具体步骤包括:在室温下静置10-60min后,经不同孔径滤膜挤出后即得。
18、所述滤膜孔径包括0.45μm和0.22μm;具体的,以0.45μm滤膜挤出三次,0.22μm滤膜挤出三次。
19、所述步骤s2中,所述羧甲基壳聚糖-聚乙二醇-天冬酰胺-甘氨酸-精氨酸为发明人课题组前期制备合成,在诸如“基于cmcs/pei双ph敏感共递送dox和基因纳米载体的制备和评价”(王明芳,山东大学,2015.)等文献中已经公开,在此不再赘述。
20、所述孵育具体条件为:在室温条件下孵育10-60min,进一步为30min;
21、所述过滤具体采用0.22μm微孔滤膜过滤。
22、采用上述方法制得的ph响应型脂质体命名为cg-j/zl,其形态圆整,分散性良好,平均粒径为190.3±4.3nm,电位为-13.5±0.608mv。在肿瘤微环境(弱酸环境)中,cpn外壳发生电荷翻转逐渐从cg-j/zl表面脱落,暴露阳离子脂质体内核g-j/zl,从而实现脂质体cg-j/zl的ph响应性给药。
23、本发明还提供上述基于表观遗传调控的ph响应型脂质体在制备抗肿瘤药物中的应用。
24、同时,需要说明的是,肿瘤在本发明中如本领域技术人员所知的那样加以使用,其包括良性肿瘤和/或恶性肿瘤。良性肿瘤被定义为不能在体内形成侵略性、转移性肿瘤的细胞过度增殖。反之,恶性肿瘤被定义为能够形成全身性疾病(例如在远端器官中形成肿瘤转移)的具有多种细胞异常和生化异常的细胞。
25、本发明的又一具体实施方式中,本发明的ph响应型脂质体可用于治疗恶性瘤。恶性瘤包括在所述器官中的原发性肿瘤及在远端器官中的相应继发性肿瘤(肿瘤转移)。可用本发明的药物治疗的恶性瘤的实例包括实体瘤和血液瘤。实体瘤可以是乳腺、膀胱、骨、脑、中枢和外周神经系统、内分泌腺(如甲状腺和肾上腺皮质)、食道、子宫内膜、生殖细胞、头和颈、肝、肺、喉和下咽的肿瘤、间皮瘤、卵巢、胰腺、前列腺、结肠、直肠、肾、小肠、软组织、睾丸、胃、皮肤(如黑色素瘤)、输尿管、阴道和外阴的肿瘤等。
26、本发明还提供一种抗肿瘤药物,所述抗肿瘤药物包括上述基于表观遗传调控的ph响应型脂质体。
27、一些实施方案中,所述ph响应型脂质体的粒径大小为190.3±4.3nm,电位为-13.5±0.608mv。
28、上述一个或多个技术方案的有益技术效果:
29、上述技术方案提供一种基于表观遗传调控的ph响应型核壳脂质体。首先,通过薄膜分散法制备共载泽布拉林和jq-1的阳离子脂质体(j/zl)。进一步基于静电吸附作用压缩佐剂胞嘧啶-磷酸-鸟嘌呤(cytosine-phosphate-guanine,cpg)得到共载的阳离子脂质体(g-j/zl),以促进抗原递呈细胞成熟。为降低阳离子脂质体的毒性,将ph敏感材料外壳材料羧甲基壳聚糖-聚乙二醇-天冬酰胺-甘氨酸-精氨酸(cmcs-peg-ngr,cpn)与荷正电阳离子脂质体g-j/zl通过静电吸附组装得到适用于“双向调控”的ph响应型脂质体cg-j/zl,其将表观遗传学干预与免疫治疗相结合,从而有效增强癌症(如乳腺癌)的免疫治疗效果,因此具有良好的实际应用前景。
- 还没有人留言评论。精彩留言会获得点赞!