一种生物基自供电综合医疗智能软骨支架及其制备方法
本发明涉及智能医疗软骨支架制造,具体涉及到一种生物基自供电综合医疗智能软骨支架及其制备方法。
背景技术:
1、软骨是膝盖、髋关节、踝关节和肩关节等重要关节的重要组成部分,扮演着关节润滑和缓冲的关键角色。高强度的机械运动、类风湿性关节炎和与年龄相关的退行性变化可能导致软骨缺损,给患者带来疼痛和运动障碍。关节软骨在骨暴露时限制了自身的修复能力,因此治疗软骨缺损一直是全球研究的热点课题。同种异体骨软骨移植被广泛应用于治疗严重的软骨缺损,因为它可以从多种来源获得所需的材料。然而,解决移植物保存成本、外源性疾病和同种异体抗原引起的强烈免疫反应等问题仍然具有挑战性。自体骨软骨移植可以有效避免同种异体抗原引起的问题,但其所需组织原材料的可获得性有限,因此在治疗大范围缺损时不适用。此外,微裂隙自愈的研究仍处于初级阶段,其有效性的科学证据还不足。静脉内注射、关节内注射或细胞移植的干细胞治疗显示出有限的疗效,需要进一步研究其长期疗效和安全性。近年来,由于修复材料供应量不受限制,软骨组织工程技术受到了广泛关注。这种技术通常由种子细胞、工程支架和细胞生长因子组成。然而,植入的工程支架生成的透明软骨仍然显示出有限的效果,在重复的关节运动下无法承受正常软骨的应力,容易受到损伤。因此,需要一种简单有效的方法来加速软骨细胞的增殖,以提高修复效果。
2、大量证据表明,电刺激可以积极促进血管生成、改善血液循环和具有抗炎作用,还可以在手术过程中促进肉芽组织形成和胶原合成。植入电池的电力源包括储能电容器、压电器件、光电子学和无线传输等技术,从而避免了使用外部电池和物理束缚。然而,植入电池仍然存在一些缺点,例如功能单一、电路复杂、功率密度低以及可能引起二次创伤等问题。未来发展的方向是设计更加多功能的植入电池,具备更高的功率密度和更简化的电路结构,以实现更广泛的应用。同时,需要进一步研究和解决电池可能引起的安全性和生物相容性等问题,以确保其在医学领域的可靠性和可持续性应用。
3、软骨细胞对电刺激非常敏感,直流、交流和双相电流已被证明可以促进软骨修复的过程。电场已被报道能够刺激软骨细胞中关键基因表达并增加蛋白聚糖和胶原蛋白的合成。然而,目前基于直流接触或电容耦合的设备在电刺激应用中存在一些缺点,例如对外部电源的依赖、感染风险高、非生物相容性、非生物降解性以及可能需要二次手术等,这限制了它们在临床应用中的使用。因此,迫切需要开发一种生物相容性的、可植入关节的、自供能的生物电子设备,能够进行电刺激并在修复过程完成时在体内降解。这样的设备可以提供持续且可调节的电刺激,促进软骨细胞增殖和分化,加速软骨修复过程。同时,设备的生物降解性使其能够逐渐被人体吸收,避免了二次手术的需求,提高了治疗的效果和便利性。此外,与软骨缺损治疗相关的另一个限制是医生和患者无法实时观察软骨修复的状态,导致治疗过程成为人体的“黑箱”。通常需要借助大型医疗设备,如x光、计算机断层扫描和磁共振成像设备来监测软骨修复过程,这增加了治疗的成本和复杂性。因此,在智能医疗和物联网时代,寻找一种有效的方法来刺激和加速软骨生长,并能实时监测软骨修复状态具有重要意义。
4、基于麦克斯韦定律的摩擦电纳米发电机被认为是一种新型能源技术,由王中林教授在2012年首次发现。这种发电机作为组织电池可以将机械能转化为电能,实现电刺激下软骨组织的再生。通过摩擦电化和静电感应的耦合,它能够将组织运动或机械刺激转化为电能信号。纳米摩擦发电机可以适用于多个生理系统的信号感测,包括呼吸系统、心血管系统和消化系统。通过合适的结构配置和材料选择,摩擦电材料如聚偏二氟乙烯、聚二甲基硅氧烷、聚四氟乙烯、聚酰胺和苯胺醛树脂等可以用于构建发电机。然而,这些材料在体内通常不可降解、生物不相容,甚至具有毒性。相比之下,动物皮肤提取的胶原聚集体作为纳米摩擦发电机具有一些优势。胶原聚集体具有高敏感性、高能量密度和良好的应用前景。作为来自动物皮肤的天然聚合物,胶原聚集体具有低抗原性、生物非毒性和体内可降解性,因此适用于可植入医疗材料。然而,胶原聚集体也存在一些局限性,如正极性不足、功率密度低和力学强度差。这些问题限制了其在摩擦发电机中的应用。因此,对于胶原聚集体的进一步研究和改进是必要的,以提高其性能和适用性。
技术实现思路
1、为了克服现有技术的不足,本发明旨在提供一种生物基自供电综合医疗智能软骨支架及其制备方法。该支架由智能可降解多孔支架和基于摩擦电纳米发电机的自供电压力敏感器相互集成而成。该发明中的压力敏感器具有在复杂体内关节环境下的高信号稳定性、灵敏度、检测限、发电功率和循环使用稳定性。它可以作为软骨修复过程中的电刺激能量来源。智能软骨支架的孔洞结构与自供电压力敏感层的大凸起形成经典的“榫卯结构”。这种设计使得组织电池能够通过发送电信号反馈由于材料降解和细胞增殖引起的结构变化。在修复过程中,压力敏感器可以实时反馈软骨修复的状态,从而打破软骨缺损修复时的“黑箱”状态。同时,该智能支架可以在体内降解。支架部分的降解速度可以被设计得高于压力敏感层,以确保压力敏感器部分在软骨修复期结束之前能够正常工作。因此,这种生物基自供电综合医疗智能软骨支架具有广泛的应用前景。它可以被广泛应用于检测软骨损伤修复的状态,并在智能医疗护理领域发挥重要作用。
2、为了实现上述目的,本发明采用的技术方案是:
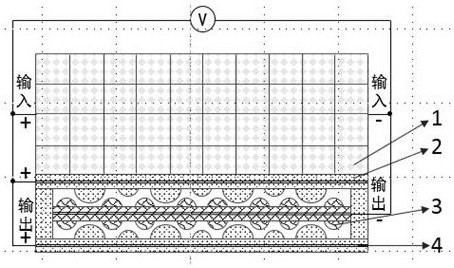
3、一种生物基自供电综合医疗智能软骨支架,其特征在于,包括多孔软骨支架层、自发电压力敏感层中的正/负摩擦层和电极层:
4、基于纳米摩擦发电机的压力敏感层,综合检测人体关节处的机械运动并转化为电信号并传输电信号检测软骨缺损。当压力敏感层受到关节压力时,正负摩擦层由于接触-分离产生交流电压,对外变现为特异性电信号,打破软骨修复过程中的难以实时检测伤口愈合程度的“黑箱”状态;
5、自发电压力敏感层收集关节机械能并转化为电能并通过整流桥储存在电能储存设备中用以电刺激诱导软骨修复。储存的电能通过导线对多孔软骨支架中的细胞进行电刺激,加速软骨细胞的增殖和干细胞分化从而加速缺损的修复。
6、进一步,所述的压力敏感层正摩擦层通过聚苯乙烯微球模板法制备具有双面微凸的高比表面积结构,其材料组成为为胶原聚集体、壳聚糖和羟基磷灰石。
7、进一步,所述的压力敏感层负摩擦层通过不同直径的聚苯乙烯微球模板法制备具有双重微凸的高比表面积结构,其材料为聚己内酯-聚二甲基硅氧烷嵌段共聚物/氟磷灰石。
8、进一步,所述胶原聚集体来源为羊皮、猪皮、鱼皮、牛皮鸵鸟皮的任意一种。
9、进一步,所述的软骨支架由聚己内酯、聚乳酸-羟基乙酸共聚物和羟基磷灰石共混并以洗去法制备。
10、进一步,压力敏感层的缺损敏感效应是通过与多孔支架间孔洞的榫卯结构互补结合、支架降解造成结构变化和支架中软骨细胞增殖造成的支架弹性模量变化而实现。
11、一种生物基自供电综合医疗智能软骨支架的制备方法,包括以下步骤:
12、单一直径聚苯乙烯微球溶液,滴在去离子水薄水层覆盖的亲水玻璃基板上干燥后通过聚二甲基硅氧烷进行倒模,得到正摩擦层模板。
13、两种直径聚苯乙烯微球溶液,滴在去离子水薄水层覆盖的亲水玻璃基板上干燥后通过聚二甲基硅氧烷进行倒模,得到负摩擦层基本模板。
14、胶原聚集体、壳聚糖和羟基磷灰石混合液,在上述正摩擦层模板中双面成型,得到正摩擦层。
15、合成聚己内酯-聚二甲基硅氧烷嵌段共聚物并加入氟磷灰石得到混合液,在上述负摩擦层模板中成型为负摩擦层。正负摩擦层组装为密封的“负-正-负”三明治结构。
16、聚己内酯、聚乳酸-羟基乙酸共聚物、羟基磷灰石和氯化钠混合液干燥成型,并以洗去氯化钠制备多孔软骨支架。
17、进一步,单一直径的聚苯乙烯微球直径范围为0.1~30 μm,溶液密度为(g/cm3) (0~1.15);两种直径的微球直径范围分别为0.1~30 μm和30~250 μm,且在溶液中的密度比例为(0~1.15) : (0~1.15);胶原聚集体、壳聚糖和羟基磷灰石的质量百分率比为(0~100) :(0~100) : (0~30);聚己内酯-聚二甲基硅氧烷嵌段共聚物和氟磷灰石的质量百分率比为(0~100) : (0~40);聚己内酯、聚乳酸-羟基乙酸共聚物、羟基磷灰石和氯化钠的质量百分率比为(0~100) : (0~100) : (0~30) : (0~100);
18、进一步,包括如下制备步骤:
19、(1)正摩擦层模板制备:玻璃基板(直径10 cm)在40~100℃的食人鱼溶液(h2o2和h2so4的混合物,体积比为3 : 7)中洗涤,形成亲水性表面。用去离子水反复冲洗玻璃基板,并在氮气流下干燥。将0~25 wt%的聚苯乙烯微球(0.1~30 μm)分散在质量比为(0~10) : (0~10)的乙醇/水混合溶剂中,制备悬浮液,将1~10 ml去离子水滴在清洗后的玻璃表面形成薄水层,将聚苯乙烯微球悬浮液滴在水面上,促进微球在三相固液气界面的自组装。水和乙醇在室温下完全蒸发后形成均匀的微球阵列。将制备好的混合的聚二甲基硅氧烷液体缓慢涂覆在微球阵列表面,然后将得到的涂覆阵列置于40~80℃烘箱中0.5~10 h,剥离聚二甲基硅氧烷模板。
20、(2)负摩擦层模板制备:玻璃基板(直径10 cm)在40~100℃的食人鱼溶液(h2o2和h2so4的混合物,体积比为3 : 7)中洗涤,形成亲水性表面。用去离子水反复冲洗玻璃基板,并在氮气流下干燥。将密度比例为(0~1.15) : (0~1.15)的(0.1~30 μm)(30~250 μm)两种直径聚苯乙烯微球分散在质量比为(0~10) : (0~10)的乙醇/水混合溶剂中,制备悬浮液,将1~10 ml去离子水滴在清洗后的玻璃表面形成薄水层,将聚苯乙烯微球悬浮液滴在水面上,促进微球在三相固液气界面的自组装。水和乙醇在室温下完全蒸发后形成均匀的微球阵列。将制备好的混合的聚二甲基硅氧烷液体缓慢涂覆在微球阵列表面,然后将得到的涂覆阵列置于40~80℃烘箱中0.5~10 h,剥离聚二甲基硅氧烷模板。
21、(3)正摩擦层制备:将胶原聚集体、壳聚糖和羟基磷灰石按质量百分率比为(0~100) : (0~100) : (0~30)溶解或分散于5~100 ml去离子水中,在25~60℃下高速搅拌0.1~10 h,制备胶原聚集体、壳聚糖和羟基磷灰石混合溶液。在正摩擦层模板上覆盖10~90%混合物,在25~60℃烤箱中干燥0.1~10 h。将银纳米线悬浮液均匀旋涂干燥后,将剩余的混合物涂覆在银纳米线上,并以另一个正摩擦层模板覆盖,在25~60℃烤箱中干燥0.1~10 h,剥离上下两块聚二甲基硅氧烷模板,得到具有双面微凸结构的正摩擦层。
22、(4)负摩擦层制备及压力敏感层组装:在10~100 ml二氯甲烷中加入0. 05~0.1mmol 端羟基聚二甲基硅氧烷和10~100 mmol 的ε-己内酯。加入0~5 mmol盐酸乙醚,10~45℃氩气保护下搅拌0.5~10 h。加入100~1000 ml冷甲醇(冷藏至0℃)沉淀,用二氯甲烷/冷甲醇洗涤1~5次,除去未反应单体ε-己内酯。最后通过真空干燥得到聚己内酯/聚二甲基硅氧烷嵌段共聚物。将0.5~5 g 嵌段共聚物溶解于2~50 ml二氯甲烷中,加入0~2 g 氟磷灰石快速搅拌1~20 h,制得均匀的负摩擦层混合溶液。将10~90%混合液缓慢涂覆在负摩擦层模板上,然后在25~80℃下干燥0.5~10h。将银纳米线悬浮液均匀旋涂干燥后,将剩余的混合物涂覆在银纳米线上,得到负摩擦层。负摩擦层和正摩擦层按负-正-负“三明治”结构组装。将三层材料垂直放置在70%的负摩擦层混合液,并通过滚动/干燥过程封装以获得压力敏感器部分。
23、(5)软骨支架制备和智能支架组装:。将聚己内酯、聚乳酸-羟基乙酸共聚物、羟基磷灰石、氯化钠按质量百分率比为(0~100) : (0~100) : (0~30) : (0~100)混合,在25~100℃下搅拌1~20 h,使其均匀溶解分散于10~100 ml二氯甲烷溶剂中。将均匀的混合液放置在4 × 4 × 1 cm3的特氟龙模具中,底部放置上述制备的自供电压力压力敏感器,在25~50℃下干燥1~30 h以去除溶剂。然后在去离子水中洗涤3~5次,去除内部的氯化钠,在25~50℃烘箱烘干1~30 h后得到智能软骨支架。
24、与现有技术相比,本发明的有益效果是:
25、(1)本发明制备的智能软骨支架可通过将人体关节机械运动转化电信号,并对软骨缺损的大小和恢复程度进行特异化响应,从而打破人体的“黑箱”状态。
26、(2)本发明制备的智能软骨支架可收集人体关节处的机械能并转化为电能并进行储存,用以电刺激软骨细胞增殖和干细胞分化。
27、(3)本发明制备的智能软骨支架的支架材料和压力敏感层的降解率可按需调控,从而达到软骨修复前保持稳定高效运行的目的。
28、(4)本发明制备的智能软骨支架同时具备低生物毒性、可体内降解、自供电、诱导伤口修复、实时检测灵敏度高和耐用性优异等优点,打破软骨损伤患者缺损修复时的“黑箱”状态,在医疗康复和非临床诊断领域具有较高的实际应用价值
- 还没有人留言评论。精彩留言会获得点赞!