一种含青天葵提取物的抗氧化纳米纤维复合膜及制备方法和应用与流程
本发明属于纳米材料和食品包装材料领域,特别涉及到利用静电纺丝技术将青天葵植物提取物制备成一种含青天葵提取物的抗氧化纳米纤维复合膜的方法及其应用。
背景技术
食品抗氧化活性包装是将一定量的抗氧化剂分散在包装材料中或涂敷在材料表面,通过抑制食品的氧化分解,延长食品货架期的一种活性包装方式。抗氧化剂是一类能够清除氧自由基,抑制或消除以及减缓氧化反应的物质。目前食品包装中使用的抗氧化剂主要有人工合成抗氧化剂和天然抗氧化剂。人工合成抗氧化剂可以通过化学合成的方法得到,主要有丁基羟基茴香醚(bha)、二丁基羟基甲苯(bht)、没食子酸丙酯(pg)、特丁基对苯二酚(tbhq)等,这些抗氧化剂抗氧化性作用强,稳定性好,但研究发现它们皆有一定的毒性,这在很大程度上限制了其应用。天然抗氧化剂来源于生物体(植物、动物、微生物),主要包括甘草、大蒜、维生素c(vc)、维生素e(ve)、茶多酚、磷脂、氨基酸等,其中vc和ve比较常见,但其见光易分解,稳定性差,使其应用受到一定限制。来源于植物的天然抗氧化活性物质(黄酮类、酚酸类、多糖类)具有抗氧化性好、安全性高和环境友好等优点,近年来,以含有这些活性物质的植物提取液制备食品抗氧化活性包装材料受到了人们的关注。
静电纺丝是一种简单且广泛使用的制备聚合物纳米纤维的技术。聚合物溶液或熔体在高压静电作用下,克服自身的表面张力和粘滞力,以高速螺旋运动落到接收板上,形成类似无纺布状的纤维集合体。利用静电纺丝制得的纳米纤维直径为5-1000nm,由于聚合物纳米纤维具有高的比表面积、大的孔隙率及良好的机械性能,因而在食品、纺织、国防及生物医用材料等领域具有广阔的应用前景。
青天葵(nerviliafordii),又名独叶莲、珍珠叶等,广泛分布于广东、广西、海南地区,是华南地区的特有药材。青天葵含有黄酮、甾体、三萜、氨基酸、挥发油等多种活性成分,其中的黄酮类等物质具有良好的抗氧化活性,然而迄今为止,有关采用静电纺丝技术混纺青天葵提取物制备抗氧化纳米包装膜的研究未见报道。虽然植物提取液中的黄酮类、酚酸类物质抗氧化效果好,但其难溶于水,且不稳定,进而限制了其在食品包装领域中的应用。
技术实现要素:
为了克服上述现有技术的缺点与不足,本发明的首要目的在于提供一种含青天葵提取物的抗氧化纳米纤维复合膜的制备方法。
本发明另一目的在于提供一种由上述方法制备的含青天葵提取物的抗氧化纳米纤维复合膜。
本发明再一目的在于提供上述含青天葵提取物的抗氧化纳米纤维复合膜在食品包装材料领域的应用。
本发明的目的通过下述方案实现:
一种含青天葵提取物的纳米纤维复合膜的制备方法,包括如下步骤:
将青天葵提取物、聚乙烯吡咯烷酮(pvp)和聚乙烯醇溶液(pva)混合制成纺丝溶液,然后将纺丝溶液通过静电纺丝装置,进行静电纺丝,得到含青天葵提取物的纳米纤维膜;其中纺丝电压为13-25kv,针头到接收器的距离为12-16cm,纺丝速率为0.2-0.6ml/h。
所述纺丝溶液的制备方法为:将聚乙烯醇溶于水中得到质量体积分数为5%-10%的聚乙烯醇溶液;将聚乙烯吡咯烷酮溶于90%乙醇溶液,得到质量体积分数为9%-19%的聚乙烯吡咯烷酮溶液,然后加入青天葵提取物;再将含有青天葵提取物的聚乙烯吡咯烷酮溶液加入到聚乙烯醇溶液中;聚乙烯醇溶液与聚乙烯吡咯烷酮溶液的体积比为1:1-2:1,所得混合溶液中青天葵提取物的浓度为3.5-4.5mg/ml。
优选地,所述纺丝溶液中所添加聚乙烯吡咯烷酮溶液的质量体积分数为15%,所添加聚乙烯醇溶液的质量体积分数为10%,聚乙烯醇溶液与聚乙烯吡咯烷酮溶液的体积比为1:1,混合纺丝溶液中青天葵提取物的浓度为4mg/ml。
所述青天葵提取物的制备方法为:
(1)将青天葵粉碎,用有机溶剂提取;
(2)将步骤(1)所述提取产物依次通过石油醚、乙酸乙酯萃取或依次通过石油醚、乙酸乙酯、正丁醇萃取,每相萃取3-5次、每次3-5h,得到青天葵提取物。
步骤(1)所述有机溶剂为乙醇、甲醇或丙酮中的一种或多种,体积分数为40%-95%,料液比为1:5-1:20,所述提取为回流提取法、超声波强化浸提法、微波辅助浸提法中的一种或多种,次数为1-3次,每次1-3h,提取温度为50℃-90℃。
优选地,步骤(1)所述青天葵为青天葵叶,有机溶剂为体积分数56%的乙醇,提取温度为75℃,料液比为1:14;提取次数为2次,每次2h。
所述步骤(2)是将步骤(1)所述青天葵提取物依次通过石油醚、乙酸乙酯萃取,每相萃取4次,每次4h。
所述纺丝电压为15kv,针头到接收器的距离为14cm,纺丝速率为0.3ml/h。
一种根据上述方法制备的含青天葵提取物的抗氧化纳米纤维复合膜。
所述含青天葵提取物的抗氧化纳米纤维复合膜在抗氧化包装材料中的应用。
本发明所述室温的温度为30-35℃,常温的温度为28-35℃。
本发明使用的pvp是两亲性物质,一方面对包埋青天葵提取物进行包埋,另一方面改善了青天葵提取物水溶性差的特点。其次基材pva与pvp具有良好的生物相容性,利用该基材包埋青天葵提取物改善了其水溶性差的特点,并且可将其应用于食品包装领域。
本发明相对于现有技术,具有如下的优点及有益效果:
(1)本发明采用静电纺丝技术将聚合物、植物提取物共纺制得天然抗氧化纳米纤维膜,拓展了静电纺丝技术的应用范围。
(2)本发明适用的基材具有良好生物相容性,所加的青天葵是天然提取物,绿色安全,且该复合膜最终能够降解,对环境污染小。
(3)本发明工艺简单、条件温和、操作简便,同时,通过聚合物对黄酮类物质进行包埋,增强了黄酮类物质的稳定性;另外,所制备的纳米纤维膜黄酮缓释效果好,具有良好的抗氧化性。
(4)本发明制备的纳米纤维复合膜具有较好的抗氧化性、低毒性,所以在食品包装材料领域具有广阔的应用前景。
附图说明
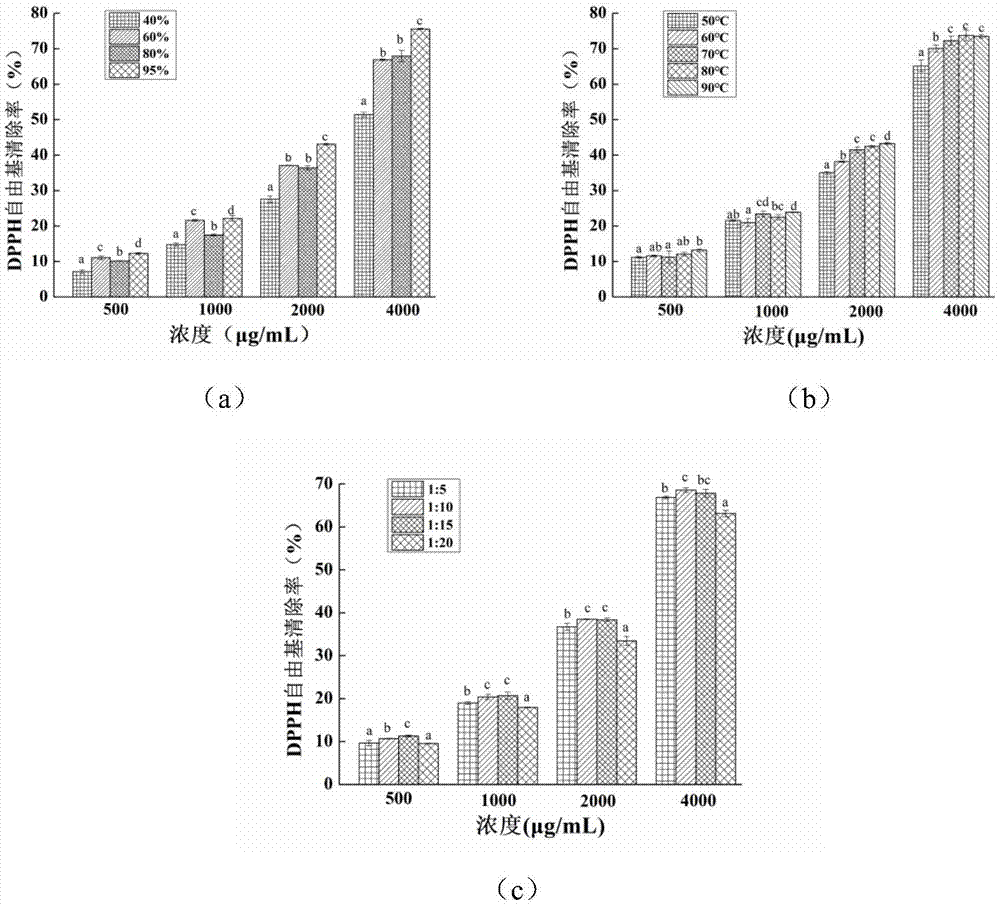
图1为实施例1不同乙醇体积分数(a)、不同提取温度(b)、不同料液比(c)的dpph自由基清除率图。
图2为实施例2不同萃取部位的dpph自由基清除率图。
图3为实施例5的脂质抗氧化能力测定结果图。
图4为实施例6的还原能力测定结果图。
图5为实施例7纳米纤维复合膜扫描电镜图。
图6为实施例8纳米纤维复合膜扫描电镜图。
图7(a)为实施例9,(b)为实施例10,(c)为实施例11的纳米纤维复合膜扫描电镜图。
图8为实施例12在不同的释放介质中的dpph自由基清除率图。
图9为实施例12在不同的释放介质中总黄酮含量测定图。
图10为实施例13红外吸收光谱图。
具体实施方式
下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例中所用试剂如无特殊说明均可从市场常规购得。
实施例1
青天葵提取条件的优化,具体步骤如下:
(1)选取不同的条件提取青天葵
20g青天葵叶粉末溶于40%、60%、80%、95%乙醇溶液中,按料液比1:20于80℃下回流提取2次,每次2h,然后通过旋转蒸发仪浓缩,得各醇提物;
20g青天葵叶粉末溶于60%乙醇溶液中,于50℃、60℃、70℃、80℃、90℃提取温度下,按料液比1:20回流提取2次,每次2h,然后通过旋转蒸发仪浓缩,得各醇提物;
20g青天葵叶粉末溶于60%乙醇溶液中,按料液比1:5、1:10、1:15、1:20于70℃下回流提取2次,每次2h,然后通过旋转蒸发仪浓缩浓缩,得各醇提物;
(2)将浓缩得到的各醇提物通过测定dpph自由基清除率来判定其抗氧化特性,具体测试方法:
第一支离心管加0.4ml样品溶液和3.6mldpph乙醇溶液(150mm),混匀,记为a1;
第二支离心管加0.4ml样品溶液和3.6ml无水乙醇,混匀,记为a2;
第三支离心管加0.4ml无水乙醇和3.6mldpph乙醇,混匀,记为a0;
在517nm下对测试a1、a2和a3的吸光度进行测定。
清除率=(1-(a1-a2)/a0)*100%
上述实验条件下提取物的抗氧化性见图1。
(3)通过响应面实验进一步优化青天葵提取方法,具体步骤如下:
选取不同乙醇体积分数55%、60%、65%,不同提取温度65℃、70℃、75℃,不同料液比1:5、1:10、1:15三因素三水平进行响应面实验。
(4)将步骤(3)中所得的实验结果通过bbd软件进行分析,通过比较dpph清除率的实际值和预测值进行分析比较,通过对模型的显著性、失拟项的显著性和r2进行分析,结合响应面图得到最佳的青天葵提取条件是乙醇体积分数56%、提取温度75℃、料液比1:14。
实施例2
不同萃取溶剂得到的青天葵提取物的抗氧化活性评价,具体操作步骤如下:
(1)按照实施例1中的方法制备青天葵醇提物。具体步骤如下:20g青天葵粉末,在乙醇体积分数56%、温度75℃、料液比1:14条件下提取,通过旋转蒸发仪浓缩得醇提物。
(2)选择石油醚、乙酸乙酯和正丁醇3种萃取剂,根据萃取剂极性的不同,依次得到不同极性的青天葵提取物。具体方法为:将(1)中所得醇提物加入100ml水溶解,然后加入等量的石油醚,萃取4h,收集上层,即为石油醚萃取相,下层水相再次用100ml石油醚萃取,相同方法重复3次,然后将所有的上层石油醚萃取相蒸发浓缩,此为石油醚提取物。石油醚萃取完后,下层水相接着加入100ml乙酸乙酯进行萃取,萃取4h,收集上层,即为乙酸乙酯萃取相,下层水相再次用100ml乙酸乙酯萃取,相同方法重复3次,然后将所有的上层乙酸乙酯萃取相蒸发浓缩,此为乙酸乙酯提取物。乙酸乙酯萃取完后,下层水相接着加入100ml正丁醇进行萃取,萃取4h,收集上层,即为正丁醇萃取相,下层水相再次用正丁醇萃取,相同方法重复3次,然后将所有的上层正丁醇萃取相蒸发浓缩,此为得正丁醇提取物,下层为水提取物。
(3)将步骤(2)中所得的四种提取物通过实施例1的方法对dpph自由基清除率进行测定,用质量浓度为20-200μg/ml的抗坏血酸溶液代替样品溶液作标品。
图2为上述工艺条件下的不同萃取溶剂的dpph自由基清除率图,由图可知,抗氧化效果最佳的萃取部位即乙酸乙酯部位。
实施例3
不同萃取相的总酚含量测定采用福林酚比色法,具体步骤如下:
(1)按照实施例2中的方法制备不同青天葵提取物。
(2)取100μl用70%乙醇配置的不同浓度(0.1mg/ml,0.5mg/ml,1mg/ml,2mg/ml)的各萃取相,加入0.5ml福林酚试剂和7.9ml水,混合均匀。避光5min,后加入1.5ml的10%na2co3溶液,混匀后在室温下避光2h,在765nm下测定其吸光度。用不同浓度的没食子酸(20,40,60,80,100μg/ml)作标品,通过标曲计算得各萃取相的总酚含量,上述工艺条件下总酚含量测定结果见表1。通过比较发现,乙酸乙酯部位总酚含量最高,即抗氧化效果最好。
表1不同萃取部位的总酚含量测定结果
实施例4
不同萃取相的总黄酮含量测定采用alcl3-hac-naac(ph5.5)法,具体步骤如下:
(1)按照实施例2中的方法制备不同青天葵提取物。
(2)取200μl用70%乙醇配置的不同浓度(0.1mg/ml,0.5mg/ml,1mg/ml,2mg/ml)的各萃取相,加入300μl的0.1mol/lalcl3溶液、200μl的hac-naac(ph5.5)缓冲溶液后用70%乙醇补足溶液至5ml,室温下混合均匀后,在405nm下对其吸光度进行测定。用不同浓度的芦丁(5-35μg/ml)作标品,通过标曲计算得各萃取相的总黄酮含量,上述工艺条件下总黄酮含量测定结果见表2。结果发现乙酸乙酯部位黄酮含量最高,抗氧化效果最好。
表2不同萃取部位的总黄酮含量测定结果
实施例5
对抗氧化效果最好的乙酸乙酯相进行脂质过氧化能力的测定,采用卵黄脂蛋白为底物的lpo模型反应体系,具体步骤如下:
(1)按照实施例2中的方法制备青天葵的乙酸乙酯提取物。
(2)卵黄液的制备:新鲜鸡蛋去卵清,卵黄用等体积的0.1m磷酸缓冲液(ph7.4)配成1:1的悬液,磁力搅拌10min,再用pbs稀释成1:25的卵黄悬液,置于4℃,备用。
(3)取0.2ml的步骤(2)溶液,后加入0.1ml步骤(1)所得的乙酸乙酯提取物和0.2ml的25mmfeso4溶液,用pbs补充溶液至2ml,混匀,置于37℃水浴1h。取出后,加入0.5ml的20%三氯乙酸(tca)溶液,静置10min后在4000rpm下离心10min。取离心后的上清液2ml,加入1ml的0.8%硫代巴比妥酸(tba)溶液,沸水浴15min后取出冷却至室温,在532nm下测定其吸光度。用抗坏血酸作标品。
计算公式抑制率s(%)=((a0-ax)/a0)*100%
其中ax为含乙酸乙酯提取物的吸光值,a0为不含乙酸乙酯提取物的吸光值。
上述工艺条件下的脂质过氧化测定结果见图3。
实施例6
对抗氧化效果最好的乙酸乙酯相进行还原能力的测定,采用普鲁士蓝法,具体步骤如下:
(1)按照实施例2中的方法制备青天葵的乙酸乙酯提取物。
(2)取1ml不同浓度(0.1-6mg/ml)的步骤(1)溶液,加入2.5ml的0.2m磷酸缓冲液(ph6.6)、2.5ml的1%铁氰化钾溶液,混匀后在50℃水浴20min。取出后,冷却至室温,加入2.5ml的10%三氯乙酸溶液后混匀,静置1min终止反应,将混合液在3000rpm下离心10min。精密吸取2.5ml上清液于测试管中,依次加入2.5ml蒸馏水和0.1%氯化铁溶液,混匀,室温反应10min,在700nm下测定其吸光度。用抗坏血酸作标品。
上述工艺条件下乙酸乙酯提取物的还原能力测定结果见图4。
实施例7
一种含青天葵乙酸乙酯提取物的抗氧化纳米纤维复合膜的制备方法,具体步骤如下:
(1)按照实施例2中的方法制备青天葵的乙酸乙酯提取物;
(2)8g聚乙烯醇溶于100ml蒸馏水中,于80℃搅拌2h,得到质量体积分数为8%聚乙烯醇溶液,冷却至室温;
(3)取9g、11g、13g、15g、17g、19g聚乙烯吡咯烷酮溶于100ml的90%乙醇中,于常温搅拌均匀,分别得到质量体积分数为9%、11%、13%、15%、17%、19%聚乙烯吡咯烷酮溶液;加入800mg步骤(1)制备的青天葵的乙酸乙酯提取物,使其浓度为8mg/ml;
(4)取等量的(3)溶液加入到等量的(2)溶液中,混合均匀,得到不同配比的混合纺丝溶液,此时青天葵乙酸乙酯提取物的浓度为4mg/ml;
(5)将(3)中所得纺丝溶液吸入10ml注射器,装上直径0.6mm针头,调整针头到接收器的距离为14cm,调节电压在15kv,温度为27℃,湿度为60%,流速控制在0.3ml/h,纺丝8h,然后在35℃下真空干燥12h,即得到不同配比的纳米纤维复合膜。
上述工艺条件下制备的纳米纤维复合膜的sem见图5。通过电镜图发现,15%pvp具有较好的纤维形貌。
实施例8
本实施例与实施例7的不同之处在于聚乙烯吡咯烷酮的质量体积分数为15%,然后分别加入质量体积分数为5%、6%、7%、8%、9%、10%聚乙烯醇溶液。
上述工艺条件下制备的纳米纤维复合膜的sem见图6,通过电镜图发现,10%pva具有较好的纤维形貌。
实施例9
本实施例与实施例7的不同之处在于聚乙烯吡咯烷酮的质量体积分数为15%,聚乙烯醇的质量体积分数为10%,针头到接收器的距离为12cm、14cm、16cm。
实施例10
本实施例与实施例7的不同之处在于聚乙烯吡咯烷酮的质量体积分数为15%,聚乙烯醇的质量体积分数为10%,纺丝电压在10kv、15kv、20kv。
实施例11
本实施例与实施例7的不同之处在于聚乙烯吡咯烷酮的质量体积分数为15%,聚乙烯醇的质量体积分数为10%,流速为0.15ml/h、0.3ml/h、0.45ml/h。
图7(a)、(b)、(c)分别为实施例9、实施例10和实施例11的纳米纤维复合膜扫描电镜图。通过电镜图发现,在纺丝电压15kv、接收距离14cm、流速0.3ml/h的条件下,纺丝膜具有较好的纤维形貌。
实施例12
含青天葵提取物纳米纤维复合膜作为抗氧化包装材料在不同食品模拟体系中的应用,具体步骤如下:
(1)配置甲乙丙丁四种纳米纤维膜,具体配置步骤如下:
甲:3gpvp溶于20ml的90%乙醇中,于常温搅拌均匀,加入160mg样品,使样品浓度为8mg/ml;2gpva溶于20ml水中,于80℃搅拌2h,得到10%pva溶液,冷却至室温;将这两者混合,配成最终体积比为10%pva:15%pvp=1:1,样品浓度为4mg/ml的40ml纺丝溶液。
乙:同甲,配成最终体积比为10%pva:10%pvp=1:1,样品浓度为4mg/ml的40ml纺丝溶液。
丙:同甲,配成最终体积比为10%pva:15%pvp=2:1,样品浓度为4mg/ml的40ml纺丝溶液。
丁:同甲,配成最终体积比为10%pva:10%pvp=2:1,样品浓度为4mg/ml的40ml纺丝溶液。
(2)将(1)中所得各纺丝溶液吸入10ml注射器,装上直径0.6mm针头,调整针头到接收器的距离为14cm,调节电压在15kv,温度为27℃,湿度为60%,流速控制在0.3ml/h,纺丝8h,然后在35℃下真空干燥12h,即得到不同的纳米纤维复合膜。
(3)取一定质量(2)纺丝膜分别溶于不同的释放介质(水、3%乙酸、10%乙醇、50%乙醇、95%乙醇)中,在25℃下培养,每隔1d取样,进行dpph清除力和总黄酮含量的测定。
图8为上述工艺条件下不同膜的抗氧化实验测定结果。图9为上述工艺条件下不同膜中青天葵提取物的释放曲线。由图9可知,由于青天葵提取物是疏水性物质,所以包含在纳米纤维复合膜中的青天葵提取物在95%乙醇中释放的速率最快,但是最终也能持续释放25天以上。其次,包含在纳米纤维复合膜中的青天葵提取物在水中也能进行持续性释放,说明本发明很好的改善了青天葵提取物的水溶性差的问题,扩大了其在食品包装领域的应用。
实施例13
(1)15gpvp溶于90%乙醇中,于常温搅拌均匀,得到15%pvp溶液,制备15%pvp纳米纤维膜;
(2)10g聚乙烯醇溶于100ml蒸馏水中,于80℃搅拌2h,得到10%聚乙烯醇溶液,冷却至室温,制备10%pva纳米纤维膜;
(3)按照实施例10中方法制备甲、乙、丙、丁纳米纤维复合膜;
(4)将(1)、(2)、(3)所得的纳米纤维复合膜及青天葵乙酸乙酯提取物进行红外光谱扫描,扫描范围4000~400cm-1,前者采用atr,后者采用krr压片(见图10)。
由图10(a)可知,纯pvp的特征吸收峰为3435cm-1处的o-h吸收峰,2955cm-1处的c-h伸缩峰,1644cm-1处的c=o吸收峰;纯pva的特征吸收峰为3275cm-1处的o-h吸收峰,2936cm-1处的ch2,1680cm-1处的c=o吸收峰,1420cm-1处的ch2弯曲振动峰,1088cm-1处的c-o-c伸缩峰;
从图10(b)可以看出,随着pva含量的增大,o-h吸收峰想低频率移动,说明氢键的形成,而且在2936cm-1、1680cm-1、1088cm-1处pva的特征吸收峰也随着pva含量增大,峰型增加。所制备的4种纤维膜中,提取物的吸收峰都已消失不见,说明其被包埋在纤维里。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!