基于电子束选区熔化技术制备多孔钽医用植入材料的方法与流程
本发明属于多孔医用金属植入材料的制备领域,具体涉及一种基于电子束选区熔化技术制备多孔钽医用植入材料的方法。
背景技术:
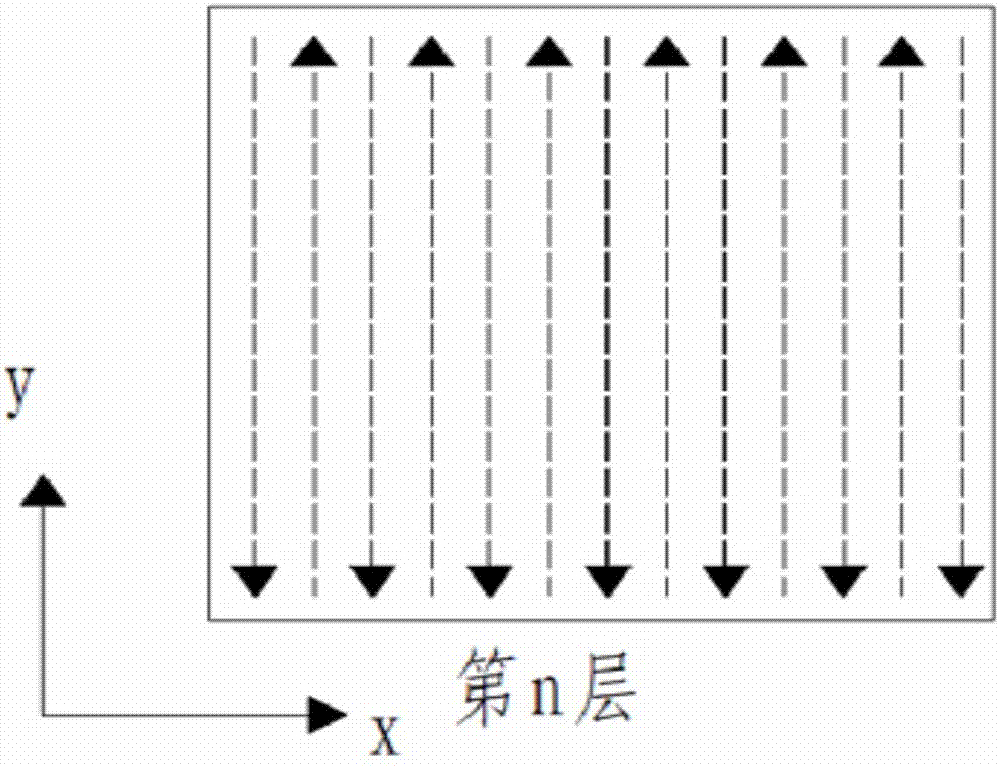
:多孔钽是一种泡沫状的多孔金属,孔径为400μm~600μm,孔隙率为70%~80%,弹性模量约为3gpa,介于人体松质骨(0.1gpa~1.5gpa)和皮质骨(12gpa~18gpa)之间,远低于钛合金(110gpa)和钴铬钼合金(220gpa)。1997年美国食品药品管理局(fda)已批准多孔钽作为生物医用材料进行人工髋臼的临床治疗。与其他生物医用金属材料相比,多孔钽具有高容积孔隙率、低弹性模量及高表面摩擦系数的典型特性,是一种比较理想的骨替代材料。在力学性能方面,多孔钽的弹性模量、表面摩擦系数、抗疲劳性能与人体骨组织相近;在生物性能方面,多孔钽表现出良好的生物相容性、耐腐蚀性和骨诱导特性,其应用前景有望赶超目前临床应用最广泛的钛合金材料,从而成为医用植入材料研究的新方向。尽管多孔钽具备上述诸多优点,但钽的熔点高达2996℃,并且钽与氧、氢等杂质元素有较高的亲和力,因此在医药行业标准yy/t0966-2014《外科植入物金属材料纯钽》中,对氧、氢等杂质元素的含量有严格的限定,如表1所示。表1yy/t0966-2014中多孔钽植入体中杂质元素的上限值元素conhsi上限值/%0.0100.01500.0100.00150.0050国内外报道的多孔钽的制备工艺主要有:气相沉积法、有机泡沫浸渍法、粉末烧结法和激光快速成形法。由于多孔钽在孔隙率、力学性能以及化学成分等方面的严苛要求,钽粉烧结法、泡沫浸渍烧结法和浆料发泡等传统制备方法难以满足多孔钽医用植入材料高精度和高稳定性的要求。气相沉积法因制备出的多孔钽孔隙度高、形貌均匀、纯度高,力学性能好,成为制备医用多孔钽的主要方法。美国zimmer公司采用气相沉积法(专利号为us5282861,名称为“opencelltantalumstructuresforcancellousboneimplantsandcellandtissuereceptors”)制备的多孔钽植入材料已经获得了商业化应用,并且占据了我国人工关节市场份额的1/3。近年来,随着精准医疗理念的普及,临床对植入物提出了定制化的需求,如何根据个体需求制备成分符合标准、性能与人体匹配的多孔钽植入体,成为医学界和工程界的研究热点。而市场上应用最广泛的美国zimmer公司的标准化多孔钽,采用的是传统的化学气相沉积技术,无法实现定制化多孔钽植入材料的制备。金属3d打印技术是实现多孔材料定制化制造的有效手段,可有效控制孔径大小、孔隙率和孔隙分布,典型代表有激光选区熔化技术和电子束选区熔化技术,并已经应用于金属医用植入材料的制备。授权公告号为cn102796910b的专利“一种采用激光选束烧结成型制备多孔钽医用植入材料的方法”中,采用激光束将有机粘接剂与钽粉混合物以逐层扫描的方式进行预烧结,得到多孔钽植入体毛坯,再经低温脱脂、高温烧结及冷却等后处理工艺,最终得到多孔钽植入材料。该方法工序繁冗,大量有机添加剂的使用极易导致多孔钽医用植入材料中氧、碳和氮等杂质元素的超标,降低了多孔钽植入材料的生物相容性和长期使用过程中的生物稳定性。技术实现要素:本发明所要解决的技术问题在于针对上述现有技术的不足,提供了一种基于电子束选区熔化技术制备多孔钽医用植入材料的方法。该方法先利用软件建立多孔钽医用植入材料三维模型并进行切层处理,然后根据切层数据采用电子束对钽粉进行选区熔化扫描,最终得到多孔钽医用植入材料,由于钽粉在真空条件下进行熔化成型,且钽粉中无任何添加剂,避免了钽加热后的氧化现象,降低了碳、氧等杂质元素的污染,同时满足了定制化多孔钽医用植入材料的要求;该方法得到的多孔钽医用植入材料无需进行烧结和退火等后处理程序,方便高效。为解决上述技术问题,本发明采用的技术方案是:基于电子束选区熔化技术制备多孔钽医用植入材料的方法,其特征在于,该方法包括以下步骤:步骤一、利用三维模型重构软件对二维医学ct图像或mri数据进行重构,建立多孔钽医用植入材料的三维粗模,然后依次利用结构优化软件和支撑添加软件对多孔钽医用植入材料的三维粗模进行优化和添加,得到多孔钽医用植入材料的三维模型;步骤二、利用切层软件对步骤一中得到的多孔钽医用植入材料的三维模型进行切片处理,得到切层数据,然后将所述切层数据导入电子束选区熔化设备中;步骤三、将钽粉装入到电子束选区熔化设备的粉仓中,并对电子束选区熔化设备的成型室进行抽真空;步骤四、将粉仓中的钽粉均匀铺设在抽真空后的成型室的底板上,然后采用电子束对底板上的钽粉进行预热;步骤五、根据步骤二中的切层数据采用电子束对步骤四中预热后的钽粉进行选区熔化扫描,得到单层实体片层;步骤六、重复步骤四中的铺粉和预热工艺以及步骤五中的选区熔化扫描工艺,直至单层实体片层逐层堆积,形成多孔钽医用植入材料的电子束选区熔化成型件,冷却至室温后取出;步骤七、将步骤六中取出的多孔钽医用植入材料的电子束选区熔化成型件置于手套箱中,去除孔隙中未熔化的钽粉,得到多孔钽医用植入材料。上述的基于电子束选区熔化技术制备多孔钽医用植入材料的方法,其特征在于,步骤一中所述三维模型重构软件为mimics软件或matlab软件,所述结构优化软件为pro/engineer软件、solidworks软件或unigraphic软件,所述支撑添加软件为magics软件。上述的基于电子束选区熔化技术制备多孔钽医用植入材料的方法,其特征在于,步骤二中所述切层软件为autofab软件、netfabb软件或magics软件,所述切层数据以stl格式或amf格式存储。上述的基于电子束选区熔化技术制备多孔钽医用植入材料的方法,其特征在于,步骤二中所述切片处理的每层切片的厚度为20μm~100μm。上述的基于电子束选区熔化技术制备多孔钽医用植入材料的方法,其特征在于,步骤三中所述钽粉的球形率大于80%,粉末粒度为5μm~60μm,粉末流动性不大于30s/50g,氧的质量含量不大于800ppm。上述的基于电子束选区熔化技术制备多孔钽医用植入材料的方法,其特征在于,步骤三中所述抽真空的真空度不大于1.0×10-2pa。上述的基于电子束选区熔化技术制备多孔钽医用植入材料的方法,其特征在于,步骤四中所述预热时电子束的扫描电流为20ma~40ma,电子束扫描速率为1.0×103mm/s~8.0×104mm/s,所述预热的温度为900℃~1500℃。上述的基于电子束选区熔化技术制备多孔钽医用植入材料的方法,其特征在于,步骤五中所述选区熔化扫描时电子束的扫描电流为2ma~20ma,电子束扫描速率为1.0×104mm/s~6.0×105mm/s。上述的基于电子束选区熔化技术制备多孔钽医用植入材料的方法,其特征在于,步骤五中所述选区熔化扫描的电子束扫描路径中相邻两条扫描线的方向相反,相邻所述单层实体片层的电子束扫描路径互相垂直。上述的基于电子束选区熔化技术制备多孔钽医用植入材料的方法,其特征在于,步骤七中所述多孔钽医用植入材料的孔隙度为40%~90%,弹性模量为0.5gpa~4gpa,化学成分满足医药行业标准yy/t0966-2014《外科植入物金属材料纯钽》的要求。本发明与现有技术相比具有以下优点:1、本发明多孔钽医用植入材料的整个制备过程是在真空条件下完成,且钽粉中无任何添加剂,避免了钽加热后的氧化现象,降低了碳、氧等杂质元素的污染,满足了定制化多孔钽医用植入材料的要求,提高了多孔钽医用植入材料的生物稳定性和生物相容性。2、本发明中先将钽粉预热,再采用电子束对预热后的钽粉进行选区熔化,使得多孔钽医用植入材料在成型过程中始终处于保温状态,在成型的同时进行了随形退火处理,降低了多孔钽医用植入材料的各向异性,确保了多孔钽医用植入材料力学性能的稳定,并且省略了后处理工艺,方便高效。3、本发明采用电子束选区熔化技术,利用软件建立多孔钽医用植入材料三维模型,可通过调整多孔钽医用植入材料三维模型的结构来调整多孔钽医用植入材料的结构和尺寸,从而可以根据个体需求设计多孔钽医用植入材料的外形、内部孔隙及力学性能等参数,实现多孔钽医用植入材料与人体高度的匹配性,同时产品的成形精度和生产效率可满足现代化医疗对定制化植入材料的需求,极大降低了医疗成本和手术风险。4、本发明制备的多孔钽医用植入材料的孔隙度为40%~90%、弹性模量为0.5gpa~4gpa,化学成分满足医药行业标准yy/t0966-2014《外科植入物金属材料纯钽》的要求。下面结合附图和实施例对本发明的技术方案作进一步的详细描述。附图说明图1是本发明实施例1建立的多孔钽医用植入材料的三维模型图。图2a是本发明电子束选区熔化法制备多孔钽医用植入材料的第n层单层实体片层的电子束扫描路径示意图。图2b是本发明电子束选区熔化法制备多孔钽医用植入材料的第n+1层单层实体片层的电子束扫描路径示意图。图3是本发明实施例1制备的多孔钽医用植入材料的照片。具体实施方式实施例1本实施例包括以下步骤:步骤一、利用mimics软件对二维医学ct图像进行重构,建立多孔钽医用植入材料的三维粗模,然后利用pro/engineer软件和magics软件依次对多孔钽医用植入材料的三维粗模进行优化和添加,得到多孔钽医用植入材料的三维模型,如图1所示;步骤二、利用autofab软件对步骤一中得到的多孔钽医用植入材料的三维模型进行切片处理,得到切层数据,然后将切层数据以stl格式存储并导入电子束选区熔化设备中;所述切片处理的每层切片的厚度为90μm;步骤三、将钽粉装入到电子束选区熔化设备的粉仓中,并对电子束选区熔化设备的成型室抽真空至真空度为2.0×10-3pa;所述钽粉的球形率为88%,粉末粒度为48μm,流动性为14s/50g,氧的质量含量为600ppm;步骤四、将钽粉均匀铺设在成型室的底板上,采用电子束将钽粉预热至1100℃;所述预热时电子束的扫描电流为36ma,电子束扫描速率为3.0×103mm/s;步骤五、采用电子束根据步骤二中的各层切片数据对步骤四中预热后的钽粉进行选区熔化扫描,得到单层实体片层;所述选区熔化扫描时电子束扫描电流为12ma,电子束扫描速率为4.0×104mm/s,所述选区熔化扫描的电子束扫描路径中相邻两条扫描线的方向相反,相邻两个所述单层实体片层的电子束扫描路径互相垂直,如图2a和图2b所示,电子束扫描路径中的扫描线用带箭头的虚线段表示,其中,n≥1;步骤六、重复步骤四中的铺粉和预热工艺以及步骤五中的选区熔化扫描工艺,直至单层实体片层逐层堆积,形成多孔钽医用植入材料的电子束选区熔化成型件,冷却至室温后再取出;步骤七、将步骤六中取出的多孔钽医用植入材料的电子束选区熔化成型件置于手套箱中,在氩气气氛保护下去除孔隙中未熔化的钽粉,得到多孔钽医用植入材料,如图3所示。将图1和图3对比可以看出,多孔钽医用植入材料的外形和内部孔隙与建立的三维模型图高度相似,且精度较高,说明通过电子束选区熔化技术可以根据个体需求设计多孔钽医用植入材料的外形和内部孔隙,实现多孔钽医用植入材料与人体高度的匹配性,满足现代化医疗对定制化植入材料的需求。经检测,本实施例制备的多孔钽医用植入材料的孔隙度为75%,弹性模量为1.7gpa,其化学成分满足医药行业标准yy/t0966-2014《外科植入物金属材料纯钽》的要求。实施例2本实施例包括以下步骤:步骤一、利用mimics软件对mri数据进行重构,建立多孔钽医用植入材料的三维粗模,然后利用pro/engineer软件和magics软件依次对多孔钽医用植入材料的三维粗模进行优化和添加,得到多孔钽医用植入材料的三维模型;步骤二、利用netfabb软件对步骤一中得到的多孔钽医用植入材料的三维模型进行切片处理,得到切层数据,然后将切层数据以amf格式存储并导入电子束选区熔化设备中;所述切片处理的每层切片的厚度为60μm;步骤三、将钽粉装入到电子束选区熔化设备的粉仓中,并对电子束选区熔化设备的成型室抽真空至真空度为3.0×10-3pa;所述钽粉的球形率为82%,粉末粒度为34μm,流动性为30s/50g,氧的质量含量为550ppm;步骤四、将钽粉均匀铺设在成型室的底板上,采用电子束将钽粉预热至1050℃;所述预热时电子束的扫描电流为32ma,电子束扫描速率为5.0×103mm/s;步骤五、采用电子束根据步骤二中的各层切片数据对步骤四中预热后的钽粉进行选区熔化扫描,得到单层实体片层;所述选区熔化扫描时电子束扫描电流为16ma,电子束扫描速率为6.0×104mm/s,所述选区熔化扫描的电子束扫描路径中相邻两条扫描线的方向相反,相邻两个所述单层实体片层的电子束扫描路径互相垂直,如图2a和图2b所示,电子束扫描路径中的扫描线用带箭头的虚线段表示,其中,n≥1;步骤六、重复步骤四中的铺粉和预热工艺以及步骤五中的选区熔化扫描工艺,直至单层实体片层逐层堆积,形成多孔钽医用植入材料的电子束选区熔化成型件,冷却至室温后再取出;步骤七、将步骤六中取出的多孔钽医用植入材料的电子束选区熔化成型件置于手套箱中,在氩气气氛保护下去除孔隙中未熔化的钽粉,得到多孔钽医用植入材料。经检测,本实施例制备的多孔钽医用植入材料的孔隙度为52%,弹性模量为3.7gpa,其化学成分满足医药行业标准yy/t0966-2014《外科植入物金属材料纯钽》的要求。实施例3本实施例包括以下步骤:步骤一、利用mimics软件对二维医学ct图像进行重构,建立多孔钽医用植入材料的三维粗模,然后利用solidworks软件和magics软件依次对多孔钽医用植入材料的三维粗模进行优化和添加,得到多孔钽医用植入材料的三维模型;步骤二、利用magics软件对步骤一中得到的多孔钽医用植入材料的三维模型进行切片处理,得到切层数据,然后将切层数据以amf格式存储并导入电子束选区熔化设备中;所述切片处理的每层切片的厚度为20μm;步骤三、将钽粉装入到电子束选区熔化设备的粉仓中,并对电子束选区熔化设备的成型室抽真空至真空度为2.0×10-3pa;所述钽粉的球形率为95%,粉末粒度为5μm,流动性为10s/50g,氧的质量含量为800ppm;步骤四、将钽粉均匀铺设在成型室的底板上,采用电子束将钽粉预热至900℃;所述预热时电子束的扫描电流为20ma,电子束扫描速率为7.0×103mm/s;步骤五、采用电子束根据步骤二中的各层切片数据对步骤四中预热后的钽粉进行选区熔化扫描,得到单层实体片层;所述选区熔化扫描时电子束扫描电流为2ma,电子束扫描速率为6.0×105mm/s,所述选区熔化扫描的电子束扫描路径中相邻两条扫描线的方向相反,相邻两个所述单层实体片层的电子束扫描路径互相垂直,如图2a和图2b所示,电子束扫描路径中的扫描线用带箭头的虚线段表示,其中,n≥1;步骤六、重复步骤四中的铺粉和预热工艺以及步骤五中的选区熔化扫描工艺,直至单层实体片层逐层堆积,形成多孔钽医用植入材料的电子束选区熔化成型件,冷却至室温后再取出;步骤七、将步骤六中取出的多孔钽医用植入材料的电子束选区熔化成型件置于手套箱中,在氩气气氛保护下去除孔隙中未熔化的钽粉,得到多孔钽医用植入材料。经检测,本实施例制备的多孔钽医用植入材料的孔隙度为40%,弹性模量为4.0gpa,其化学成分满足医药行业标准yy/t0966-2014《外科植入物金属材料纯钽》的要求。实施例4本实施例包括以下步骤:步骤一、利用mimics软件对mri数据进行重构,建立多孔钽医用植入材料的三维粗模,然后利用pro/engineer软件和magics软件依次对多孔钽医用植入材料的三维粗模进行优化和添加,得到多孔钽医用植入材料的三维模型;步骤二、利用magics软件对步骤一中得到的多孔钽医用植入材料的三维模型进行切片处理,得到切层数据,然后将切层数据以stl格式存储并导入电子束选区熔化设备中;所述切片处理的每层切片的厚度为50μm;步骤三、将钽粉装入到电子束选区熔化设备的粉仓中,并对电子束选区熔化设备的成型室抽真空至真空度为1.0×10-2pa;所述钽粉的球形率为81%,粉末粒度为15μm,流动性为11s/50g,氧的质量含量为660ppm;步骤四、将钽粉均匀铺设在成型室的底板上,采用电子束将钽粉预热至950℃;所述预热时电子束的扫描电流为26ma,电子束扫描速率为4.0×103mm/s;步骤五、采用电子束根据步骤二中的各层切片数据对步骤四中预热后的钽粉进行选区熔化扫描,得到单层实体片层;所述选区熔化扫描时电子束扫描电流为5ma,电子束扫描速率为5.0×104mm/s,所述选区熔化扫描的电子束扫描路径中相邻两条扫描线的方向相反,相邻两个所述单层实体片层的电子束扫描路径互相垂直,如图2a和图2b所示,电子束扫描路径中的扫描线用带箭头的虚线段表示,其中,n≥1;步骤六、重复步骤四中的铺粉和预热工艺以及步骤五中的选区熔化扫描工艺,直至单层实体片层逐层堆积,形成多孔钽医用植入材料的电子束选区熔化成型件,冷却至室温后再取出;步骤七、将步骤六中取出的多孔钽医用植入材料的电子束选区熔化成型件置于手套箱中,在氩气气氛保护下去除孔隙中未熔化的钽粉,得到多孔钽医用植入材料。经检测,本实施例制备的多孔钽医用植入材料的孔隙度为64%,弹性模量为2.6gpa,其化学成分满足医药行业标准yy/t0966-2014《外科植入物金属材料纯钽》的要求。实施例5本实施例包括以下步骤:步骤一、利用mimics软件对二维医学ct图像进行重构,建立多孔钽医用植入材料的三维粗模,然后利用solidworks软件和magics软件依次对多孔钽医用植入材料的三维粗模进行优化和添加,得到多孔钽医用植入材料的三维模型;步骤二、利用autofab软件对步骤一中得到的多孔钽医用植入材料的三维模型进行切片处理,得到切层数据,然后将切层数据以stl格式存储并导入电子束选区熔化设备中;所述切片处理的每层切片的厚度为60μm;步骤三、将钽粉装入到电子束选区熔化设备的粉仓中,并对电子束选区熔化设备的成型室抽真空至真空度为1.0×10-2pa;所述钽粉的球形率为90%,粉末粒度为23μm,流动性为12s/50g,氧的质量含量为750ppm;步骤四、将钽粉均匀铺设在成型室的底板上,采用电子束将钽粉预热至1000℃;所述预热时电子束的扫描电流为28ma,电子束扫描速率为8.0×103mm/s;步骤五、采用电子束根据步骤二中的各层切片数据对步骤四中预热后的钽粉进行选区熔化扫描,得到单层实体片层;所述选区熔化扫描时电子束扫描电流为8ma,电子束扫描速率为2.0×104mm/s,所述选区熔化扫描的电子束扫描路径中相邻两条扫描线的方向相反,相邻两个所述单层实体片层的电子束扫描路径互相垂直,如图2a和图2b所示,电子束扫描路径中的扫描线用带箭头的虚线段表示,其中,n≥1;步骤六、重复步骤四中的铺粉和预热工艺以及步骤五中的选区熔化扫描工艺,直至单层实体片层逐层堆积,形成多孔钽医用植入材料的电子束选区熔化成型件,冷却至室温后再取出;步骤七、将步骤六中取出的多孔钽医用植入材料的电子束选区熔化成型件置于手套箱中,在氩气气氛保护下去除孔隙中未熔化的钽粉,得到多孔钽医用植入材料。经检测,本实施例制备的多孔钽医用植入材料的孔隙度为81%,弹性模量为1.1gpa,其化学成分满足医药行业标准yy/t0966-2014《外科植入物金属材料纯钽》的要求。实施例6本实施例包括以下步骤:步骤一、利用mimics软件对mri数据进行重构,建立多孔钽医用植入材料的三维粗模,然后利用unigraphic软件和magics软件依次对多孔钽医用植入材料的三维粗模进行优化和添加,得到多孔钽医用植入材料的三维模型;步骤二、利用netfabb软件对步骤一中得到的多孔钽医用植入材料的三维模型进行切片处理,得到切层数据,然后将切层数据以stl格式存储并导入电子束选区熔化设备中;所述切片处理的每层切片的厚度为60μm;步骤三、将钽粉装入到电子束选区熔化设备的粉仓中,并对电子束选区熔化设备的成型室抽真空至真空度为1.0×10-2pa;所述钽粉的球形率为90%,粉末粒度为23μm,流动性为12s/50g,氧的质量含量为750ppm;步骤四、将钽粉均匀铺设在成型室的底板上,采用电子束将钽粉预热至1000℃;所述预热时电子束的扫描电流为33ma,电子束扫描速率为8.0×103mm/s;步骤五、采用电子束根据步骤二中的各层切片数据对步骤四中预热后的钽粉进行选区熔化扫描,得到单层实体片层;所述选区熔化扫描时电子束扫描电流为8ma,电子束扫描速率为2.0×105mm/s,所述选区熔化扫描的电子束扫描路径中相邻两条扫描线的方向相反,相邻两个所述单层实体片层的电子束扫描路径互相垂直,如图2a和图2b所示,电子束扫描路径中的扫描线用带箭头的虚线段表示,其中,n≥1;步骤六、重复步骤四中的铺粉和预热工艺以及步骤五中的选区熔化扫描工艺,直至单层实体片层逐层堆积,形成多孔钽医用植入材料的电子束选区熔化成型件,冷却至室温后再取出;步骤七、将步骤六中取出的多孔钽医用植入材料的电子束选区熔化成型件置于手套箱中,在氩气气氛保护下去除孔隙中未熔化的钽粉,得到多孔钽医用植入材料。经检测,本实施例制备的多孔钽医用植入材料的孔隙度为90%,弹性模量为0.5gpa,其化学成分满足医药行业标准yy/t0966-2014《外科植入物金属材料纯钽》的要求。实施例7本实施例包括以下步骤:步骤一、利用matlab软件对二维医学ct图像进行重构,建立多孔钽医用植入材料的三维粗模,然后利用pro/engineer软件和magics软件依次对多孔钽医用植入材料的三维粗模进行优化和添加,得到多孔钽医用植入材料的三维模型;步骤二、利用magics软件对步骤一中得到的多孔钽医用植入材料的三维模型进行切片处理,得到切层数据,然后将切层数据以stl格式存储并导入电子束选区熔化设备中;所述切片处理的每层切片的厚度为90μm;步骤三、将钽粉装入到电子束选区熔化设备的粉仓中,并对电子束选区熔化设备的成型室抽真空至真空度为1.0×10-2pa;所述钽粉的球形率为88%,粉末粒度为51μm,流动性为14s/50g,氧的质量含量为620ppm;步骤四、将钽粉均匀铺设在成型室的底板上,采用电子束将钽粉预热至1280℃;所述预热时电子束的扫描电流为36ma,电子束扫描速率为8.0×104mm/s;步骤五、采用电子束根据步骤二中的各层切片数据对步骤四中预热后的钽粉进行选区熔化扫描,得到单层实体片层;所述选区熔化扫描时电子束扫描电流为15ma,电子束扫描速率为5.0×105mm/s,所述选区熔化扫描的电子束扫描路径中相邻两条扫描线的方向相反,相邻两个所述单层实体片层的电子束扫描路径互相垂直,如图2a和图2b所示,电子束扫描路径中的扫描线用带箭头的虚线段表示,其中,n≥1;步骤六、重复步骤四中的铺粉和预热工艺以及步骤五中的选区熔化扫描工艺,直至单层实体片层逐层堆积,形成多孔钽医用植入材料的电子束选区熔化成型件,冷却至室温后再取出;步骤七、将步骤六中取出的多孔钽医用植入材料的电子束选区熔化成型件置于手套箱中,在氩气气氛保护下去除孔隙中未熔化的钽粉,得到多孔钽医用植入材料。经检测,本实施例制备的多孔钽医用植入材料的孔隙度为52%,弹性模量为3.2gpa,其化学成分满足医药行业标准yy/t0966-2014《外科植入物金属材料纯钽》的要求。实施例8本实施例包括以下步骤:步骤一、利用mimics软件对二维医学ct图像进行重构,建立多孔钽医用植入材料的三维粗模,然后利用solidworks软件和magics软件依次对多孔钽医用植入材料的三维粗模进行优化和添加,得到多孔钽医用植入材料的三维模型;步骤二、利用magics软件对步骤一中得到的多孔钽医用植入材料的三维模型进行切片处理,得到切层数据,然后将切层数据以stl格式存储并导入电子束选区熔化设备中;所述切片处理的每层切片的厚度为100μm;步骤三、将钽粉装入到电子束选区熔化设备的粉仓中,并对电子束选区熔化设备的成型室抽真空至真空度为1.0×10-2pa;所述钽粉的球形率为93%,粉末粒度为60μm,流动性为14s/50g,氧的质量含量为710ppm;步骤四、将钽粉均匀铺设在成型室的底板上,采用电子束将钽粉预热至1500℃;所述预热时电子束的扫描电流为40ma,电子束扫描速率为1.0×103mm/s;步骤五、采用电子束根据步骤二中的各层切片数据对步骤四中预热后的钽粉进行选区熔化扫描,得到单层实体片层;所述选区熔化扫描时电子束扫描电流为20ma,电子束扫描速率为3.0×105mm/s,所述选区熔化扫描的电子束扫描路径中相邻两条扫描线的方向相反,相邻两个所述单层实体片层的电子束扫描路径互相垂直,如图2a和图2b所示,电子束扫描路径中的扫描线用带箭头的虚线段表示,其中,n≥1;步骤六、重复步骤四中的铺粉和预热工艺以及步骤五中的选区熔化扫描工艺,直至单层实体片层逐层堆积,形成多孔钽医用植入材料的电子束选区熔化成型件,冷却至室温后再取出;步骤七、将步骤六中取出的多孔钽医用植入材料的电子束选区熔化成型件置于手套箱中,在氩气气氛保护下去除孔隙中未熔化的钽粉,得到多孔钽医用植入材料。经检测,本实施例制备的多孔钽医用植入材料的孔隙度为78%,弹性模量为2.1gpa,其化学成分满足医药行业标准yy/t0966-2014《外科植入物金属材料纯钽》的要求。以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制。凡是根据发明技术实质对以上实施例所作的任何简单修改、变更以及等效变化,均仍属于本发明技术方案的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1