一种具有一氧化氮合酶活性的贵金属纳米材料及其应用的制作方法
本发明属于人工模拟酶领域,涉及贵金属纳米材料的类酶催化性质,具体涉及一种具有一氧化氮合酶活性的贵金属纳米材料及其应用。
背景技术:
一氧化氮(no)是细胞内的一种重要的信使分子,其生理功能已受到广泛的关注与深入的研究。1998年,美国的三位科学家因发现no即是内皮细胞松弛因子(edrf)而获得诺贝尔生理学与医学奖。no不仅在心血管系统中发挥着重要的作用,而且在免疫调节,癌症的发病与治疗,以及组织损伤修复等生理过程中行使着重要的功能。因此,基于no的疾病治疗受到人们越来越多的关注。
目前,提高no的水平主要通过两种方式:一种是利用催化剂催化no供体s-亚硝基巯基加合物类(rsno),如s-亚硝基白蛋白(albsno)、s-亚硝基半胱氨酸(cysno)和s-亚硝基谷胱甘肽(gsno)等,释放no;另一种是通过影响一氧化氮合酶的表达或调控一氧化氮合酶的活性从而调节体内no的浓度。
jia等利用金纳米颗粒诱导血清中的rsno释放no,证明了金纳米颗粒对rsno具有诱导作用(jiahy,liuy,zhangxj,etal.potentialoxidativestressofgoldnanoparticlesbyinduced-noreleasinginserum.journaloftheamericanchemicalsociety,2008,131(1):40-41.)。随着越来越多的no供体的出现,还出现了一些在近红外光的影响下,上转化纳米颗粒催化no供体可控释放no的研究(zhangx,tiang,yinw,etal.controllablegenerationofnitricoxidebynear‐infrared‐sensitizedupconversionnanoparticlesfortumortherapy.advancedfunctionalmaterials,2015,25(20):3049-3056.)。
内源性no一般通过一氧化氮合酶催化l-精氨酸氧化产生,反应分为两步:第一步是l-精氨酸在一氧化氮合酶的催化作用下被氧化成为nω-羟基-l-精氨酸,第二步是nω-羟基-l-精氨酸继续被氧化生成l-瓜氨酸并产生no,两步反应过程都需要消耗氧气和还原型辅酶ii(nadph)。1992年,研究人员第一次指出辣根过氧化物酶能催化nω-羟基-l-精氨酸产生l-瓜氨酸和no,其中nω-羟基-l-精氨酸是一氧化氮合酶催化l-精氨酸转化成l-瓜氨酸和no的中间产物(boucherjl,geneta,vadons,etal.formationofnitrogenoxidesandcitrullineuponoxidationofnω-hydroxy-l-argininebyhemeproteins.biochemicalandbiophysicalresearchcommunications,1992,184(3):1158-1164.)。2002年,新的研究发现辣根过氧化物酶能催化羟基脲产生no(huangj,sommersem,kim-shapirodb,etal.horseradishperoxidasecatalyzednitricoxideformationfromhydroxyurea.journaloftheamericanchemicalsociety,2002,124(13):3473-3480.)。然而,目前还没有发现与一氧化氮合酶具有相同功能的类似物,可以直接催化l-精氨酸产生l-瓜氨酸和no。
近年来,纳米酶领域迅速崛起,不同形貌、尺度和材料的纳米酶层出不穷。相较于天然酶,纳米酶更经济、更稳定,也更容易大规模生产制备,已成为各领域的研究热点。贵金属纳米颗粒催化剂在催化领域占有重要的地位,掺有贵金属纳米颗粒的固体催化剂表现出良好的催化活性,如铂纳米颗粒具有过氧化物酶、过氧化氢酶、超氧化物歧化酶和氧化酶四种酶的活性。到目前为止,未发现有关于具有一氧化氮合酶活性的纳米酶的研究报导。
技术实现要素:
针对上述问题,本发明提供一种具有一氧化氮合酶活性的贵金属纳米材料及其应用,该贵金属纳米材料能够催化l-精氨酸与nadph发生反应生成l-瓜氨酸和no,并在人源细胞内表现一氧化氮合酶活性,显著提高细胞内no的水平。
第一方面,本发明提供了一种具有一氧化氮合酶活性的贵金属纳米材料,包括:gnrs@au、gnrs@ag、gnrs@auag、gnrs@pd、gnrs@pt或gnrs@sio2中的任意一种或至少两种的组合。
本发明提供的贵金属纳米材料以金纳米棒(goldnanorods,gnrs)为内核,并在表面分别包被au、ag、au/ag合金、pd、pt或sio2外层,得到gnrs@au、gnrs@ag、gnrs@auag、gnrs@pd、gnrs@pt或gnrs@sio2,具有一氧化氮合酶活性,催化l-精氨酸与nadph发生反应生成l-瓜氨酸和no,显著提高细胞内no的水平。
第二方面,本发明提供了一种如第一方面所述的贵金属纳米材料催化l-精氨酸产生no的方法,包括如下步骤:
(1)向缓冲液中加入l-精氨酸溶液;
(2)加入贵金属纳米材料;
(3)加入nadph溶液,产生no。
优选地,步骤(1)所述缓冲液包括tris-hcl缓冲液、pbs缓冲液或磷酸盐缓冲液中的任意一种或至少两种的组合,优选为tris-hcl缓冲液。
优选地,步骤(1)所述缓冲液的浓度为10-100mm,例如可以是10mm、20mm、30mm、40mm、50mm、60mm、70mm、80mm、90mm或100mm,优选为50mm。
优选地,步骤(1)所述缓冲液的ph值为7.0-8.0,例如可以是7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9或8.0,优选为7.4。
优选地,步骤(1)所述l-精氨酸溶液的浓度为1-1000mm,例如可以是1mm、5mm、10mm、50mm、100mm、150mm、200mm、250mm、300mm、350mm、400mm、450mm、500mm、550mm、600mm、650mm、700mm、750mm、800mm、850mm、900mm、950mm或1000mm,优选为5-500mm,进一步优选为50mm。
优选地,步骤(1)所述l-精氨酸溶液与所述缓冲液的体积比为(0.1-200):100,例如可以是0.1:100、0.15:100、0.3:100、0.6:100、0.9:100、1.5:100、3:100、6:100、9:100、15:100、30:100、60:100、90:100、150:100或200:100,优选为(0.3-30):100,进一步优选为3:100。
优选地,在步骤(2)加入贵金属纳米材料之前还包括向步骤(1)缓冲液和l-精氨酸溶液的混合液中加入ctab溶液的步骤。
优选地,所述ctab溶液的浓度为1-100mm,例如可以是1mm、5mm、10mm、15mm、20mm、25mm、30mm、35mm、40mm、45mm、50mm、55mm、60mm、65mm、70mm、75mm、80mm、85mm、90mm、95mm或100mm,优选为10mm。
优选地,所述ctab溶液与步骤(1)所述缓冲液的体积比为(1-100):200,例如可以是1:200、5:200、1:20、2:20、3:20、4:20、5:20、6:20、7:20、8:20、9:20或1:2,优选为1:20。
优选地,步骤(2)所述贵金属纳米材料的浓度为1.0-10nm,例如可以是1.0nm、2.0nm、3.0nm、4.0nm、5.0nm、6.0nm、7.0nm、8.0nm、9.0nm或10nm,优选为1-5nm。
优选地,步骤(2)所述贵金属纳米材料与步骤(1)所述缓冲液的体积比为(1-50):1000,例如可以是1:1000、5:1000、10:1000、15:1000、20:1000、25:1000、30:1000、35:1000、40:1000、45:1000或50:1000。
优选地,步骤(2)所述贵金属纳米材料表面修饰有ctab。
优选地,步骤(3)所述nadph溶液的浓度为10-1000mm,例如可以是10mm、50mm、100mm、150mm、200mm、250mm、300mm、350mm、400mm、450mm、500mm、550mm、600mm、650mm、700mm、750mm、800mm、850mm、900mm、950mm或1000mm,优选为50-500mm,进一步优选为50mm。
优选地,步骤(3)所述nadph溶液与步骤(1)所述缓冲液的体积比为(0.1-50):10,例如可以是0.1:50、0.35:10、0.5:10、0.7:10、3.5:10、5:10、7:10、35:10或50:10,优选为(0.7-7):10,进一步优选为7:10。
优选地,步骤(3)所述nadph溶液分1-5次加入,例如可以是1次、2次、3次、4次或5次,优选为分3次加入。
作为优选技术方案,一种贵金属纳米材料催化l-精氨酸产生no的方法,包括如下步骤:
(1)向浓度为10-100mm,ph值为7.0-8.0的缓冲液中加入浓度为1-1000mm的l-精氨酸溶液,所述l-精氨酸溶液与所述缓冲液的体积比为(0.1-200):100;
(2)向步骤(1)所述缓冲液和l-精氨酸溶液的混合液中加入浓度为1-100mm的ctab溶液,所述ctab溶液与所述缓冲液的体积比为(1-100):200;
(3)加入浓度为1-5nm的贵金属纳米材料,所述贵金属纳米材料与所述缓冲液的体积比为(1-50):1000;
(4)加入浓度为10-1000mm的nadph溶液,所述nadph溶液与所述缓冲液的体积比为(0.1-50):10;
(5)在贵金属纳米材料的催化作用下,l-精氨酸与nadph发生反应,生成no。
第三方面,本发明提供了一种贵金属纳米材料在细胞内催化l-精氨酸产生no的方法,包括如下步骤:
1)向细胞中加入含有贵金属纳米材料的培养基;
2)在co2培养箱中孵育步骤1)所述细胞。
优选地,步骤1)所述细胞包括人急性单核细胞白血病细胞和/或人脐静脉血管内皮细胞。
优选地,步骤1)所述细胞的数量为(1-5)×105个,例如可以是1×105个、2×105个、3×105个、4×105个或5×105个。
优选地,步骤1)所述贵金属纳米材料表面修饰有nh2。
优选地,步骤1)所述贵金属纳米材料包括gnrs@sio2-nh2、谷胱甘肽封闭gnrs@sio2-nh2或半胱氨酸封闭gnrs@sio2-nh2中的任意一种或至少两种的组合。
优选地,步骤1)所述贵金属纳米材料的质量浓度为1-100μg/ml,例如可以是1μg/ml、5μg/ml、10μg/ml、15μg/ml、20μg/ml、25μg/ml、30μg/ml、35μg/ml、40μg/ml、45μg/ml、50μg/ml、55μg/ml、60μg/ml、65μg/ml、70μg/ml、75μg/ml、80μg/ml、85μg/ml、90μg/ml、95μg/ml或100μg/ml,优选为10-60μg/ml。
优选地,步骤2)所述孵育的时间为1-20h,例如可以是1h、2h、3h、4h、5h、6h、7h、8h、9h、10h、11h、12h、13h、14h、15h、16h、17h、18h、19h或20h,优选为1-15h,进一步优选为2-12h。
第四方面,本发明提供了一种检测贵金属纳米材料在细胞内催化l-精氨酸产生的no的方法,包括如下步骤:
1’)向细胞中加入含有no荧光探针的培养基;
2’)在co2培养箱中孵育步骤1’)所述细胞;
3’)采用流式细胞仪分析细胞内no的荧光强度。
优选地,步骤1’)所述no荧光探针包括4-氨基-5-甲基氨基-2,7-二氟荧光素二乙酸酯和/或4,5-二氨基荧光素二乙酸酯,优选为4-氨基-5-甲基氨基-2,7-二氟荧光素二乙酸酯。
优选地,步骤1’)所述no荧光探针的浓度为1-10μm,例如可以是1μm、2μm、3μm、4μm、5μm、6μm、7μm、8μm、9μm或10μm,优选为5μm。
优选地,步骤2’)所述孵育的时间为5-60min,例如可以是5min、10min、15min、20min、25min、30min、35min、40min、45min、50min、55min或60min,优选为20min。
本发明中,no荧光探针装载在细胞中,实现了细胞中no的实时检测。
与现有技术相比,本发明具有如下有益效果:
(1)本发明的贵金属纳米材料具有一氧化氮合酶活性,可以催化l-精氨酸和nadph发生反应产生no;
(2)当gnrs@au-ctab的终浓度为6pm时,no的生成量最大;
(3)表面平滑的gnrs@auag-ctab具有最优的催化性能,no的生成量最高;
(4)在thp1细胞内,当gnrs@sio2-nh2的浓度为60μg/ml、孵育时间为12h时,no的生成量最大;
(5)在huvec细胞内,当gnrs@sio2-nh2的浓度为60μg/ml、孵育时间为6h时,no的生成量最大。
附图说明
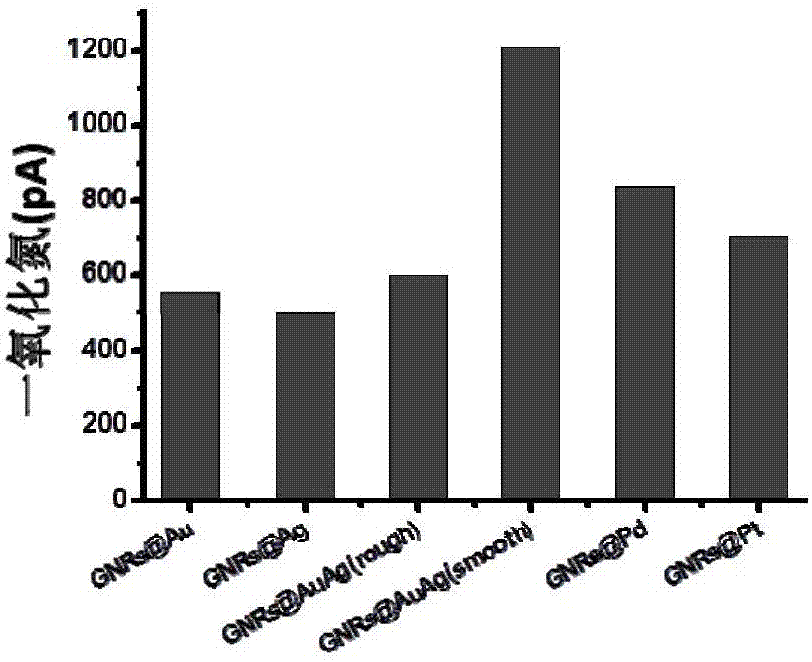
图1(a)为no的生成量与贵金属纳米材料的浓度关系曲线,图1(b)为no的生成量与贵金属纳米材料的种类的关系柱状图;
图2(a)为thp1细胞no的生成量与gnrs@sio2-nh2的浓度和孵育时间的关系柱状图,图2(b)为thp1细胞no的生成量与gnrs@sio2-nh2、谷胱甘肽封闭gnrs@sio2-nh2和半胱氨酸封闭gnrs@sio2-nh2的浓度的关系柱状图;
图3(a)为huvec细胞no的生成量与gnrs@sio2-nh2的浓度和孵育时间的关系柱状图,图3(b)为huvec细胞no的生成量与gnrs@sio2-nh2、谷胱甘肽封闭gnrs@sio2-nh2和半胱氨酸封闭gnrs@sio2-nh2的浓度的关系柱状图。
具体实施方式
为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
实施例1贵金属纳米材料的浓度对no生成量的影响
取30μll-精氨酸(50mm)于1mltris-hcl缓冲液(50mm,ph=7.4)中,然后加入50μlctab溶液(10mm),混匀后分别加入1.7μl、10μl、14μl和27μl浓度为1nm的gnrs@au-ctab;将no检测电极置于反应液中,浸没深度为2-3mm,待电极稳定后,向反应液中按照100μl-100μl-500μl的方式加入nadph溶液(50mm),每次间隔1min;检测第三次加入nadph溶液后的电流变化值(δi),作贵金属纳米结构浓度-δi曲线。
实施例2贵金属纳米材料的种类对no生成量的影响
取30μll-精氨酸(50mm)于1mltris-hcl缓冲液(50mm,ph=7.4)中,然后加入5μlctab溶液(0.1m),混匀后分别加入2μl浓度为5nm(终浓度为6pm)的gnrs@au-ctab、gnrs@ag-ctab、gnrs@auag-ctab(粗糙)、gnrs@auag-ctab(平滑)、gnrs@pd-ctab和gnrs@pt-ctab;将no检测电极置于反应液中,浸没深度为2-3mm,待电极稳定后,向反应液中按照100μl-100μl-500μl的方式加入nadph溶液(50mm),每次间隔1min;检测第三次加入nadph溶液后的电流变化值(δi)。
实施例3
取3μll-精氨酸(500mm)于1mltris-hcl缓冲液(50mm,ph=7.4)中,然后加入50μlctab溶液(10mm),混匀后加入14μl浓度为1nm(终浓度为8pm)的gnrs@au-ctab,吹打混匀;将no检测电极置于反应液中,浸没深度为2-3mm,待电极稳定后,向反应液中按照350μl-350μl的方式加入nadph溶液(50mm),每次间隔1min;检测第二次加入nadph溶液后的电流变化值(δi)。
实施例4
取300μll-精氨酸(5mm)于1mlpbs缓冲液(50mm,ph=7.4)中,然后加入5μlctab溶液(100mm),混匀后加入1μl浓度为10nm(终浓度为16pm)的gnrs@au-ctab;将no检测电极置于反应液中,浸没深度为2-3mm,待电极稳定后,向反应液中加入70μlnadph溶液(500mm),检测电流变化值(δi)。
实施例5
取1μll-精氨酸(1m)于1mltris-hcl缓冲液(10mm,ph=7.0)中,然后加入500μlctab溶液(1mm),混匀后加入17μl浓度为0.1nm(终浓度为1pm)的gnrs@au-ctab;将no检测电极置于反应液中,浸没深度为2-3mm,待电极稳定后,向反应液中加入1ml-1ml-1ml-1ml-1mlnadph溶液(10mm),检测电流变化值(δi)。
实施例6
取2mll-精氨酸(1mm)于1ml磷酸盐缓冲液(100mm,ph=8.0)中,混匀后加入50μl浓度为1nm(终浓度为20pm)的gnrs@au,吹打混匀;将no检测电极置于反应液中,浸没深度为2-3mm,待电极稳定后,向反应液中加入10μlnadph溶液(1m),检测电流变化值(δi)。
对比例1
与实施例1相比,贵金属纳米材料终浓度为0.05pm的gnrs@au-ctab,其他条件与实施例1相同。
对比例2
与实施例1相比,贵金属纳米材料终浓度为25pm的gnrs@au-ctab,其他条件与实施例1相同。
实验结果如表1所示。
表1贵金属纳米材料的类一氧化氮酶活性的体外研究
从实施例1及图1(a)可以看出,no的生成量与gnrs@au-ctab的浓度在一定范围内呈正相关:随着gnrs@au-ctab的浓度的增加,no的生成量增大,当gnrs@au-ctab的终浓度为6pm时,no的生成量最大;随着gnrs@au-ctab的浓度的进一步增加,no的生成量逐渐减小,可能是由于过多的gnrs@au-ctab在溶液中聚集,比表面积变小,催化性能减弱。
从实施例2及图1(b)可以看出,no的生成量与贵金属纳米材料的种类有关:表面平滑的gnrs@auag-ctab具有最优的催化性能,no的生成量最高。
从实施例1-6对比来看,浓度为6pm的表面平滑的gnrs@auag-ctab具有最优的催化性能。
与实施例1相比,对比例1的gnrs@au-ctab的浓度较低,无法有效催化l-精氨酸和nadph反应生成no;对比例2的gnrs@au-ctab的浓度较高,在溶液中聚集成为粒径较大的微米结构,催化性能显著降低。
实施例7贵金属纳米材料在人急性单核细胞白血病细胞中的催化性能
(1)向4×106个人急性单核细胞白血病(thp1)细胞加入1ml5μm4-氨基-5-甲基氨基-2,7-二氟荧光素二乙酸酯(daf-fmda)no荧光探针溶液,重悬于离心管中后,在37℃、5%co2培养箱中孵育20min,离心除去未装载的no探针;
(2)将细胞铺至12孔板,加入含有gnrs@sio2-nh2的质量浓度分别为0μg/ml、10μg/ml、30μg/ml和60μg/ml的1640培养基,在37℃、5%co2培养箱中分别孵育2h、6h和12h;
(3)离心除去多余的纳米颗粒后,使用无酚红无血清的dmem培养基重悬细胞,用流式细胞仪检测细胞内no的荧光强度。
实施例8
与实施例7相比,贵金属纳米材料使用谷胱甘肽封闭gnrs@sio2-nh2,其他条件与实施例7相同。
实施例9
与实施例7相比,贵金属纳米材料使用半胱氨酸封闭gnrs@sio2-nh2,其他条件与实施例7相同。
实施例10贵金属纳米材料在人脐静脉血管内皮细胞中的催化性能
(1)将人脐静脉血管内皮细胞(huvec)接种到6孔板中,每孔2×105个细胞,孵育过夜;
(2)除去原培养基并用pbs清洗1-2遍,每孔加入200μl5μmdaf-fmdano荧光探针溶液,在37℃、5%co2培养箱中孵育20min,除去未装载的no探针并用pbs清洗2遍;
(3)加入含有gnrs@sio2-nh2的质量浓度分别为0μg/ml、10μg/ml、30μg/ml和60μg/ml的1640培养基,在37℃、5%co2培养箱中分别孵育2h、6h和12h;
(4)除去培养基并用pbs清洗后,将细胞消化下来并用无酚红无血清的dmem培养基重悬细胞,用流式细胞仪检测细胞内no的荧光强度。
实施例11
与实施例10相比,贵金属纳米材料使用谷胱甘肽封闭gnrs@sio2-nh2,其他条件与实施例10相同。
实施例12
与实施例10相比,贵金属纳米材料使用半胱氨酸封闭gnrs@sio2-nh2,其他条件与实施例10相同。
实施例13
(1)向1×106个人急性单核细胞白血病(thp1)细胞加入1ml1μmdaf-fmdano荧光探针溶液,重悬于离心管中后,在37℃、5%co2培养箱中孵育5min,离心除去未装载的no探针;
(2)将细胞铺至12孔板,加入含有gnrs@sio2的质量浓度为100μg/ml的1640培养基,在37℃、5%co2培养箱中孵育1h;
(3)离心除去多余的纳米颗粒后,使用无酚红无血清的dmem培养基重悬细胞,用流式细胞仪检测细胞内no的荧光强度。
实施例14
(1)将人脐静脉血管内皮细胞(huvec)接种到6孔板中,每孔5×105个细胞,孵育过夜;
(2)除去原培养基并用pbs清洗1-2遍,每孔加入200μl10μm4,5-二氨基荧光素二乙酸酯(daf-2diacetate)no荧光探针溶液,在37℃、5%co2培养箱中孵育60min,除去未装载的no探针并用pbs清洗2遍;
(3)加入含有gnrs@sio2-nh2的质量浓度为100μg/ml的1640培养基,在37℃、5%co2培养箱中孵育20h;
(4)除去培养基并用pbs清洗后,将细胞消化下来并用无酚红无血清的dmem培养基重悬细胞,用流式细胞仪检测细胞内no的荧光强度。
如图2(a)所示,在实施例7中,thp1细胞的荧光强度随gnrs@sio2-nh2的质量浓度和孵育时间的增加而增大,当gnrs@sio2-nh2的浓度为60μg/ml、孵育时间为12h时,thp1细胞的荧光强度最强;如图2(b)所示,实施例8-9使用谷胱甘肽或半胱氨酸封闭gnrs@sio2-nh2的活性位点后,gnrs@sio2-nh2的类一氧化氮酶活性明显被抑制。
如图3(a)所示,在实施例10中,huvec细胞的荧光强度随gnrs@sio2-nh2的质量浓度和孵育时间的增加而增大,当gnrs@sio2-nh2的浓度为60μg/ml、孵育时间为6h时,huvec细胞的荧光强度最强;如图3(b)所示,实施例11-12使用谷胱甘肽或半胱氨酸封闭gnrs@sio2-nh2的活性位点后,gnrs@sio2-nh2的类一氧化氮酶活性明显被抑制。
与实施例7相比,实施例13的gnrs@sio2表面未修饰nh2,表面呈负电荷,进入细胞的gnrs@sio2减少,no的生成量减少;实施例14使用daf-2diacetateno荧光探针,与no形成的荧光产物稳定性略低,得到的荧光强度较低。
综上所述,本发明的贵金属纳米材料具有一氧化氮合酶活性,可以催化l-精氨酸和nadph发生反应产生no;当gnrs@au-ctab的浓度为6pm时,no的生成量最大;表面平滑的gnrs@auag-ctab具有最优的催化性能,no的生成量最高;在thp1细胞内,当gnrs@sio2-nh2的浓度为60μg/ml、孵育时间为12h时,no的生成量最大;在huvec细胞内,当gnrs@sio2-nh2的浓度为60μg/ml、孵育时间为6h时,no的生成量最大。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!