三层核壳结构的复合离子筛,选择性电极及含锂酸性溶液的电化学氧化还原选择性提锂方法
本发明涉及资源回收,具体涉及一种三层核壳结构的复合离子筛、选择性电极以及从含锂酸性溶液中电化学氧化还原提锂的方法。
背景技术:
1、锂被誉为“白色石油”,是国家24种战略性矿产资源之一。近年来,锂化合物被广泛应用于锂电池、玻璃陶瓷、航空航天等各个传统工业领域。随着新能源汽车和储能设备的快速发展,锂产品的需求量与日俱增。
2、锂化合物主要由矿物和含锂卤水两种一次资源生产,矿产来源主要分布在澳大利亚和中国,而卤水主要分布在南美洲(阿根廷、玻利维亚和智利)。随着新能源产业的快速发展,锂的需求不断增加,含锂的废旧材料作为宝贵二次资源,也被用来生产锂盐产品。目前,全球的锂回收率极低,不到1%,需要回收更多的二次资源以满足新能源产业对锂化合物不断增长的需求。玻璃和陶瓷行业是锂的第二大应用领域,其中硅酸铝锂(las)微晶玻璃是通过控制结晶而制成的多晶玻璃,主要成分为li-al-si-o,li2o含量为3%~6%,回收价值高。采用压煮法和石灰石焙烧回收las微晶玻璃具有工艺流程简单的特点,但需要在高温高压下进行,碱耗量大,耗时长,后期除杂复杂,制约了其工业化应用。电化学氧化还原技术是高效选择性提锂最有效的方法。电化学氧化还原提锂技术最重要的是选择性电极的制备与锂离子传输困难问题的解决,磷酸铁锂(lfp)、锂锰氧化物(lmo)、钛酸锂(lto)是最为常用的电化学活性物质。钛酸锂因其制备工艺复杂无法得到大规模的应用;锂锰氧化物具有高吸附容量、高选择性的优点,但是其在酸性条件下热力学不稳定,易发生锰溶损,电极结构发生变化导致电极材料难以充分利用,在长周期循环实验中会出现容量衰减的现象;磷酸铁锂具有在酸性条件下热力学稳定、经济性良好的优点,但其选择性差,实际吸附容量较低,将会导致整体的锂回收率偏低,不利于大规模工业应用。
3、公开号为cn116710400a的中国专利申请公开了一种电化学脱嵌法盐湖提锂用电极材料,该专利申请中采用二氧化钒包覆磷酸铁锂,包覆厚度为1~10nm,可以提升电极导电性,增大其电流密度,从而使嵌入的锂离子加速脱出到电解液中,提升提锂效率。但是,由于磷酸铁锂的选择性差,实际吸附容量较低,因此在酸性条件下提锂时整体的锂回收率偏低。
4、公开号为cn116723997a的中国专利申请公开了一种电化学脱嵌法盐湖提锂用磷酸铁锂正极材料,该专利申请中采用氧化铝包覆磷酸铁锂,其目的是对磷酸铁锂颗粒进行表面改性,加快卤水在材料内部的浸润过程,并进一步扩散到颗粒表面。但是,由于磷酸铁锂的选择性差,实际吸附容量较低,因此在酸性条件下提锂时整体的锂回收率偏低。
5、公开号为cn104253270a的中国专利申请公开了一种磷酸铁锂包覆锰酸锂复合电极材料,该专利申请中将磷酸铁锂、锰酸锂与葡萄糖共混,使磷酸铁锂均匀包覆在尖晶石型锰酸锂表面,所获得的复合电极材料具有良好的电化学温度性及抗过充电性能。但是,该专利申请的磷酸铁锂包覆锰酸锂是作为复合电极材料使用,并非作为提锂材料使用。
6、公开号为cn116724425a的中国专利申请公开了一种电极材料,该专利申请中采用介孔二氧化硅为内核,表面生长磷酸铁锂,该专利申请利用介孔二氧化硅的多孔性,提高了传质效率,锂离子吸附和脱附过程均发生在磷酸铁锂的内层,提高了吸附和脱嵌效率。但是,由于磷酸铁锂的选择性差,实际吸附容量较低,因此在酸性条件下提锂时整体的锂回收率偏低。
技术实现思路
1、本发明要解决的技术问题是提供一种三层核壳结构的复合离子筛、选择性提锂电极以及使用该电极从锂铝硅玻璃浸出液中高效提锂的方法。相比于传统的锂铝硅玻璃的提锂方法,本发明的方法能够极大地降低浸出过程的反应时间和反应温度,从而降低能耗,实现经济高效的锂资源回收;并且所合成的三层核壳结构的选择性提锂电极在保持锂锰氧化物原有优势的基础上,具有更好的耐酸性以及更大的锂离子扩散系数,在酸性浸出液中实现高效提锂并达到高吸附锂容量。
2、具体的,本发明第一方面提供了一种三层核壳结构的复合离子筛,该复合离子筛中,最内层为碳材料,中间层为锂锰氧化物,外层为磷酸铁锂。
3、发明人在研究中发现,在电化学氧化还原提锂的过程中,核壳结构的内层材料锂离子传输阻力较大,扩散系数小,导致核壳结构选择性电极在电化学氧化还原提锂实验过程中吸附容量减少,在长周期循环实验中会出现容量大幅衰减的现象。
4、此外,锂锰氧化物与磷酸铁锂的热力学稳定性严重依赖溶液的ph值。锰系离子筛的热力学稳定范围为ph>5,在碱性溶液中,锰系离子筛电化学氧化后以稳定的固体mno2形式存在,因此在强碱性环境下具有优异的循环稳定性与选择性。但是当ph 3~5,锰系离子筛中的电化学活性物质锂锰氧化物会发生歧化反应,转化成无法吸锂的mn(oh)2+,造成mn溶损,大大降低了锰系离子筛的循环稳定性,导致电极的电化学可逆性差,在长周期循环实验中会出现容量大幅衰减的现象。因此锰系离子筛并不适合于酸性环境下的电化学氧化还原提锂。
5、与锰系离子筛不同,磷酸铁锂的热力学稳定范围为ph 3~5,在这一ph范围时,磷酸铁锂电化学氧化后以稳定的固体fepo4形式存在,因此在酸性环境下具有优异的循环稳定性与选择性。但是当ph>5时,磷酸铁锂的热力学性能变得不稳定,电化学活性物质fepo4会转化成无法吸锂的fe(oh)3,造成吸脱附容量的大幅衰减,结构发生变化导致电极材料难以充分利用,且电极的电化学可逆性变差,在长周期循环实验中会出现容量衰减的现象。
6、基于上述研究发现,发明人以碳材料作为最内层材料,在其表面合成具有高吸附容量的锂锰氧化物作为中间层,以及在外层包覆在酸性条件下稳定的磷酸铁锂材料,形成三层核壳结构的复合离子筛,从而解决了锂离子扩散系数小,传输阻力大,锰系离子筛不耐酸的缺陷,提高了锂锰氧化物在酸性溶液中提锂的稳定性和电化学性能。同时,该复合离子筛还具备高选择性和高吸附容量的优点。
7、需要指出的是,本发明中的“磷酸铁锂”指的是lifepo4,“锂锰氧化物”包括各类锰锂化合物中的一种或多种,例如limn2o4、li4mn5o12、li1.6mn1.6o4等等。
8、在本发明的一些实施方案中,所述复合离子筛中,最内层碳材料的粒径≤1μm,进一步地优选为0.5~1μm,例如可以为0.5μm、0.6μm、0.7μm、0.8μm、0.9μm、1μm等。
9、在本发明的一些实施方案中,所述复合离子筛中,中间层材料锂锰氧化物的厚度优选地≤5μm,进一步地优选为1~5μm,例如可以为1μm、2μm、3μm、4μm、5μm等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。
10、在本发明的一些实施方案中,所述复合离子筛中,外层材料磷酸铁锂的厚度优选地≥1μm,进一步地优选为1~5μm,例如可以为1μm、2μm、3μm、4μm、5μm等等。
11、发明人在研究过程中发现,磷酸铁锂在酸性条件下会吸附h+,在长周期循环吸脱附实验中会出现容量大幅衰减的现象,若外层材料磷酸铁锂的厚度小于1μm,磷酸铁锂对于锂锰氧化物中间层的保护作用不佳,导致复合离子筛在长周期循环电化学氧化还原提锂过程中,磷酸铁锂所吸附的氢离子会破坏中间层的锂锰氧化物,导致锂锰氧化物中的电化学活性物质发生歧化反应,转化成无法吸锂的mn(oh)2+,造成mn溶损,大大降低了复合离子筛的循环稳定性,导致电极的电化学可逆性差,在长周期循环实验中会出现容量大幅衰减的现象。因此外层材料的厚度需≥1μm。
12、在本发明的一些实施方案中,所述的外层材料磷酸铁锂与中间层材料锂锰氧化物的质量比为(0.2~5):1,例如可以为0.2:1、0.3:1、0.4:1、0.5:1、0.6:1、0.7:1、0.8:1、0.9:1、1:1、2:1、3:1、4:1、5:1等等。但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。当外层材料磷酸铁锂与中间层材料锂锰氧化物的质量比处于上述范围内时,不仅可以保证磷酸铁锂能够与锂锰氧化物表面形成完整的包覆层,从而使复合离子筛具备良好的耐酸性,而且具有较高的经济性,满足工业化应用的要求。
13、进一步地,在本发明的一些实施方案中,上述核壳结构的复合离子筛的制备方法包括以下步骤:
14、将碳材料-锂锰氧化物、磷源与铁源于溶液中混合均匀后,进行水热反应,得到复合离子筛前驱体碳材料-锂锰氧化物-磷酸铁;
15、将所述复合离子筛前驱体、锂源于还原性气氛中混合、焙烧,得到三层核壳结构的复合离子筛碳材料-锂锰氧化物-磷酸铁锂。
16、本发明中,锂锰氧化物既可以通过购买得到,也可以通过合成得到。其中对于合成的方法不限,既可以采用固相合成法,也可以采用液相合成法(共沉淀法、溶胶-凝胶法、水热合成法等等)。
17、在示意性的实施方案中,可以采用水热法合成内层材料为碳材料的锂锰氧化物,具体步骤可包括:将碳材料、锰源与碱性溶液混合,反应完全得到c-mn(oh)2;经过过滤、洗涤、干燥后,在空气中焙烧获得c-mnooh前驱体;然后将c-mnooh前驱体与锂源溶液混合,水热合成碳材料-锂锰氧化物。
18、在本发明的一些实施方案中,所述的碳材料包括炭黑、乙炔黑、石墨、碳纤维、碳纳米管、石墨烯、科琴黑中的一种,或它们中的任意组合。
19、在本发明的一些实施方案中,在碳材料表面合成mn(oh)2时,所述锰源可为各类可溶性的含锰化合物,包括但不限于氯化锰、硫酸锰、硝酸锰、醋酸锰中的一种,或它们中的任意组合。上述氯化锰、硫酸锰、硝酸锰、醋酸锰均可以通过本领域常规途径获得。
20、在本发明的一些实施方案中,在碳材料表面合成mn(oh)2时,碱性溶液可以包括但不限于氢氧化钠溶液、氢氧化钾溶液中的一种,或它们的混合;该碱性溶液的浓度可以为0.01~10mol/l,优选为1~5mol/l,例如可以为0.01、0.02、0.04、0.05、0.08、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0mol/l等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。
21、在本发明的一些实施方案中,在碳材料表面合成mnooh前驱体时,优选地控制焙烧温度为100℃~1000℃,例如可以为100℃、200℃、300℃、400℃、500℃、600℃、700℃、800℃、900℃、1000℃等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。
22、在本发明的一些实施方案中,在碳材料表面合成mnooh前驱体时,优选地控制焙烧时间为2~72h,例如可以为2h、3h、4h、5h、6h、7h、8h、9h、10h、12h、15h、16h、18h、20h、24h、30h、32h、36h、40h、45h、48h、50h、56h、60h、64h、70h、72h等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。
23、在本发明的一些实施方案中,水热法合成碳材料-锂锰氧化物时,所述锂源溶液可以采用本领域常用的含锂化合物,包括但不限于锂的无机酸盐、有机酸盐或者碱;例如可以包括碳酸锂、氢氧化锂、氯化锂、溴化锂、氟化锂、硝酸锂、醋酸锂、草酸锂、硫酸锂、乙酸锂、甲酸锂中的一种,或它们中的任意组合;优选地,所述锂源为氯化锂、氢氧化锂或碳酸锂。上述碳酸锂、氢氧化锂、氯化锂、溴化锂、氟化锂、硝酸锂、醋酸锂、草酸锂、硫酸锂、乙酸锂、甲酸锂均可以通过本领域常规途径获得。该锂源溶液的浓度可以为1~10mol/l,例如可以为1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0mol/l等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。
24、在本发明的一些实施方案中,水热法合成碳材料-锂锰氧化物时,水热反应时优选地控制反应釜中的溶液ph值为5.0~14.0,例如可以为5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0、14.0等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。
25、在本发明的一些实施方案中,水热法合成碳材料-锂锰氧化物时,水热反应的温度优选地为100℃~300℃,例如可以为100℃、110℃、120℃、130℃、140℃、150℃、160℃、170℃、180℃、190℃、200℃、210℃、220℃、230℃、240℃、250℃、260℃、270℃、280℃、290℃、300℃等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。
26、在本发明的一些实施方案中,水热法合成碳材料-锂锰氧化物时,控制水热反应的时间为2~48h,优选为12~36h,例如可以为2h、3h、4h、5h、6h、7h、8h、9h、10h、12h、15h、16h、18h、20h、22h、24h、25h、30h、32h、36h、40h、45h、48h等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。
27、在本发明的一些实施方案中,购买或合成得到碳材料-锂锰氧化物后,优选地对其进行充分研磨,以控制颗粒的d50粒径≤6μm,从而有利于后续水热法包覆磷酸铁锂这一反应的进行。
28、在对碳材料-锂锰氧化物颗粒表面包覆磷酸铁锂时,同样的可以采用多种方法进行,包括但不限于固相包覆法(机械混合法、固相反应法等)、液相包覆法(水热法、溶胶-凝胶法、沉淀法等)。优选地通过水热的方法进行包覆,与其他方法相比,水热法不仅工艺步骤简单,而且能够于碳材料-锂锰氧化物颗粒表面形成较为均匀、完整的磷酸铁锂包覆层。
29、在本发明的一些实施方案中,水热法合成磷酸铁锂时,所述磷源可以采用本领域常用的含磷化合物,包括但不限于磷酸钠、磷酸钾、磷酸二氢钠、磷酸铵、磷酸中的一种,或它们中的任意组合;优选地,所述磷源为磷酸。上述磷酸钠、磷酸钾、磷酸二氢钠、磷酸铵、磷酸可以通过本领域常规途径获得。
30、在本发明的一些实施方案中,水热法合成磷酸铁锂时,所述铁源可以采用本领域常用的含铁化合物,包括但不限于氯化铁、氯化亚铁、硫酸铁、硫酸铁、硫酸亚铁、硝酸铁、硝酸亚铁、醋酸铁、醋酸亚铁,以及它们的各种水合物(例如feso4·7h2o、fecl3·6h2o等等)的一种或多种;优选地,所述铁源为氯化铁或硫酸铁。上述氯化铁、氯化亚铁、硫酸铁、硫酸铁、硫酸亚铁、硝酸铁、硝酸亚铁、醋酸铁、醋酸亚铁,以及它们的各种水合物可以通过本领域常规途径获得。
31、在本发明的一些实施方案中,水热法合成磷酸铁锂时,需控制反应液的ph在3.0~5.0的范围内,例如可以为3.0、3.5、4.0、4.5、5.0等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。若ph<3.0或>5.0,将难以在锰系离子筛的表面合成得到磷酸铁锂。
32、在本发明的一些实施方案中,水热法合成磷酸铁锂时,需控制水热反应的温度为100℃~300℃,优选为150℃~250℃,例如可以为100℃、110℃、120℃、130℃、140℃、150℃、160℃、170℃、180℃、190℃、200℃、210℃、220℃、230℃、240℃、250℃、260℃、270℃、280℃、290℃、300℃等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。
33、在本发明的一些实施方案中,水热法合成磷酸铁锂时,控制水热反应的时间为2~72h,优选为12~36h,例如可以为2h、3h、4h、5h、6h、7h、8h、9h、10h、12h、15h、16h、18h、20h、22h、24h、25h、28h、30h、32h、35h、36h、48h、72h等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。
34、在本发明的一些实施方案中,复合离子筛前驱体与锂源焙烧时,所述复合离子筛前驱体与锂源的摩尔比优选为1:(1~2),例如可以为1:1、1:1.2、1:1.5、1:1.6、1:1.8、1:2等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。其中,锂源可以采用本领域常用的含锂化合物。
35、在本发明的一些实施方案中,复合离子筛前驱体与锂源焙烧时,所述还原性气氛包括但不限于氢气,或氢气与惰性气体组成的混合气体。
36、在本发明的一些实施方案中,复合离子筛前驱体与锂源焙烧时,焙烧温度优选为500℃~800℃,例如可以为500℃、550℃、600℃、650℃、70℃、750℃、800℃等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。焙烧时间优选为1~12h,例如可以为1h、2h、3h、4h、5h、6h、7h、8h、9h、10h、11h、12h等等,但并不仅限于所列举的数值,该数值范围内其他未列举的数值或范围同样适用。
37、进一步地,在本发明的一些实施方案中,所述核壳结构的选择性提锂电极的制备方法包括以下步骤:
38、将三层核壳结构的复合离子筛、粘结剂、导电剂、有机溶剂进行混合,得到前驱体溶液;
39、向所述前驱体溶液中加入有机造孔剂,得到含有有机造孔剂的前驱体溶液;
40、将所述含有有机造孔剂的前驱体溶液涂布于电极基体材料上,成膜后除去有机造孔剂。
41、在本发明的一些实施方案中,所述粘结剂包括聚氯乙烯、聚偏二氟乙烯、聚四氟乙烯、丁苯、水性聚苯烯酸酯中的至少一种。
42、在本发明的一些实施方案中,所述导电剂包括炭黑、乙炔黑、石墨、碳纤维、碳纳米管、石墨烯、科琴黑、复合导电浆料中的至少一种。
43、在本发明的一些实施方案中,所述有机溶剂包括n-甲基吡咯烷酮、n-乙基吡咯烷酮、n-乙烯基吡咯烷酮、二甲基甲酰胺、二甲基乙酰胺中的至少一种。
44、在本发明的一些实施方案中,所述电极基体材料可以为惰性金属和/或非金属导电材料;其中,所述惰性金属可包括金、银、铂、钯、铑、铱等等。在一些实施方案中,所述电极基体材料可以包括石墨片、钛片、碳布、碳毡中的至少一种。
45、在本发明的一些实施方案中,所述有机造孔剂为包括聚苯乙烯、聚乙二醇、聚氯乙烯、聚甲醛、环氧树脂、聚乙醇酸、木质素、纤维素、半纤维素中的至少一种。
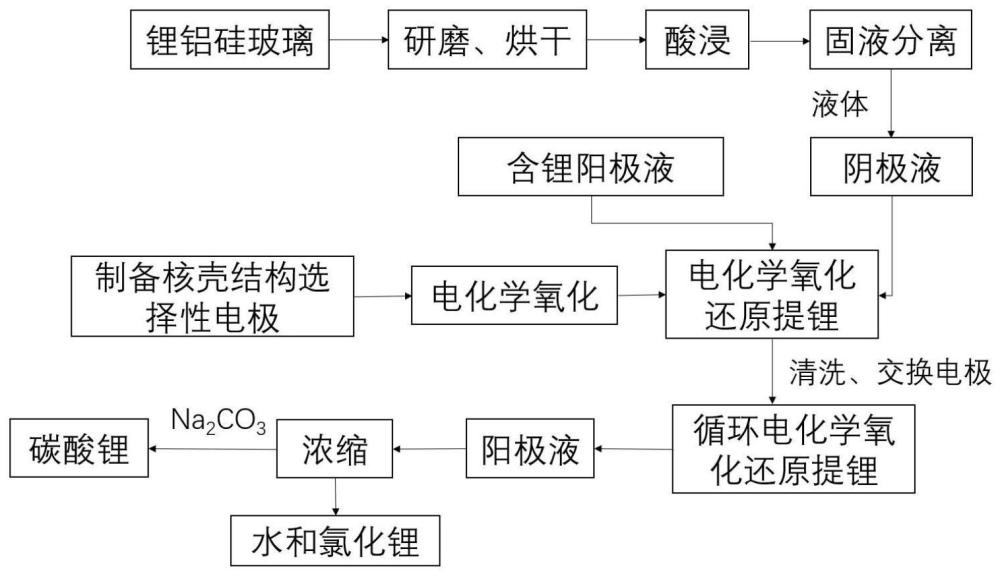
46、在本发明的一些实施方案中,所述核壳结构的复合离子筛、有机溶剂、粘结剂、导电剂、有机造孔剂的重量比优选为8:1~10:1~10:1~10:1~3;例如可以为8:1~10:1~10:1~10:2,或者为8:1~10:1~10:5:1~3,或者为8:1~10:5:1~10:1~3,或者为8:5:1~10:1~10:1~3等等。
47、在本发明的一些实施方案中,可通过低温烘干的方式除去膜中的有机溶剂,所述低温烘干的温度优选为40℃~120℃,例如可以为40℃、50℃、60℃、70℃、80℃、90℃、100℃、110℃、120℃等等。
48、在本发明的一些实施方案中,成膜后继续通过高温烘干的方式除去膜中的有机造孔剂,其中,高温烘干的温度大于等于有机造孔剂的挥发/分解温度,从而使有机造孔剂挥发或者分解,产生的气体从基体材料扩散至选择性提锂电极表面,并最终进入大气,造成均匀、贯穿选择性提锂电极的孔。所述高温烘干的温度优选为150℃~250℃,例如可以为150℃、160℃、170℃、180℃、190℃、200℃、210℃、220℃、230℃、240℃、250℃等等;所述高温烘干的时间优选为2~24h,例如可以为2h、3h、4h、5h、6h、8h、10h、12h、15h、16h、18h、20h、22h、24h等等。
49、第二方面,本发明提供了一种从酸性含锂溶液中电化学氧化还原提锂的方法,包括以下步骤:
50、提供一种电化学系统,所述电化学系统包括阳极腔、阴极腔和隔膜;所述阳极腔中设置有阳极液,所述阴极腔中设置有阴极液,所述阴极液为酸性含锂溶液;所述阳极腔与所述阴极腔通过所述隔膜隔开;
51、将上述的三层核壳结构的选择性提锂电极作为阳极放入所述阳极液中;
52、将上述的三层核壳结构的选择性提锂电极进行活化处理后,作为阴极放入所述阴极液中;
53、将所述阳极和阴极连接电源,进行提锂。
54、在本发明的一些实施方案中,所述阴极液为ph=3.5~4的含锂溶液,或者为锂铝硅玻璃的酸浸出液。
55、目前,废旧锂铝硅玻璃主要使用高温焙烧-水浸法、高温焙烧-碱浸法、石灰石焙烧-水浸法、石灰石+cacl2掺杂焙烧-水浸法、压煮法等方法来处理。这些方法虽然工艺流程简单,但大多需要在高温高压下进行,碱耗量大、耗时长、后期除杂复杂,制约了其工业化应用。本发明中,采用酸浸法代替传统的方法,不仅可以有效的降低反应温度,缩短浸出时间,而且浸出液杂质含量更低,避免了传统工艺煅烧转晶工序,解决了高温焙烧的环境问题,能耗更低,更有利于实现低能耗的清洁工业应用。
56、在本发明的一些实施方案中,所述锂铝硅玻璃的酸浸出液是将锂铝硅玻璃研磨成粉末,于酸性溶液中加热搅拌浸出后得到的。其中,浸出后对固液混合物进行分离,得到浸出液和浸出渣。所述固液分离操作采用常规分离手段,例如离心分离、旋流分离或过滤分离等,用于后续选择性提锂。
57、在本发明的一些实施方案中,所述酸性溶液可为常用的无机酸,包括但不限于hcl、hno3、h2so4中的一种或多种。所述酸性溶液的浓度可以为0.01~10mol/l,例如0.01mol/l、0.05mol/l、0.1mol/l、0.2mol/l、0.5mol/l、0.8mol/l、1mol/l、2mol/l、3mol/l、4mol/l、5mol/l、6mol/l、7mol/l、8mol/l、9mol/l、10mol/l等等。
58、在本发明的一些实施方案中,所述搅拌的速率可以为10~2000rpm,例如10rpm、100rpm、200rpm、400rpm、500rpm、800rpm、1000rpm、1200rpm、1500rpm、1800rpm、2000rpm等等。所述加热的温度可以为0~250℃,例如0℃、10℃、30℃、50℃、80℃、100℃、120℃、150℃、180℃、200℃、220℃、250℃等等。
59、本发明中,所述阳极液优选为ph 3~5的含锂溶液。在本发明的一些实施方案中,所述阳极液可以氯化锂溶液、溴化锂溶液、氟化锂溶液、硝酸锂溶液、醋酸锂溶液、草酸锂溶液、硫酸锂溶液、乙酸锂溶液、甲酸锂溶液等含锂溶液中的一种或多种;阳极液的浓度可以为0.01~1m,例如0.01m、0.1m、0.2m、0.3m、0.4m、0.5m、0.6m、0.7m、0.8m、0.9m、1m等等。
60、本发明中,所述隔膜为阴离子交换膜。
61、在一些可选的实施方案中,所述电化学系统可以包括一个或多个阳极腔、一个或多个阴极腔以及一个或多个隔膜。其中,阳极腔、阴极腔与隔膜的数量一一对应,即一个阳极腔和一个阴极腔构成一组腔组合,所述电化学系统包括一组或多组所述腔组合,并且阳极腔和阴极腔之间均通过隔膜隔开。如此,则可以扩大电化学氧化还原提锂的规模,提高电化学氧化还原提锂的效率,有利于实现产业化。
62、在本发明的一些实施方案中,所述电化学氧化还原提锂的方法还包括以下步骤:
63、当提锂结束后,取出阳极和阴极,清洗后交换电极,继续进行提锂;
64、重复上述步骤进行循环提锂,直至阴极液中的锂含量低于10ppm;
65、回收所述阳极液中的锂。
66、在上述电化学氧化还原提锂的过程中,阴极液中的锂离子被阴极中的核壳结构的复合离子筛选择性吸附,直至达到吸附平衡;接着,交换阴极和阳极后继续进行电化学氧化还原提锂时,阴极中的复合离子筛吸附的锂离子发生解吸,并进入到阳极液。重复上述提锂步骤,从而实现了阴极液中锂离子的分离并富集于阳极液中。
67、在本发明的一些实施方案中,所述提锂的电压可以为0.3~1.2v,例如0.3v、0.4v、0.5v、0.6v、0.7v、0.8v、0.9v、1.0v、1.1v、1.2v等等;所述提锂的时间可以为1~100h,例如1h、5h、10h、20h、30h、40h、50h、60h、70h、80h、90h、100h等等。
68、所述循环提锂的循环次数根据阴极液中含锂的浓度等因素确定,在本发明的一些实施方案中,循环次数可以为3~500次。
69、在本发明的一些实施方案中,回收所述阳极液中的锂的方法包括:对所述阳极液进行浓缩,获得粗水和锂盐粗品。进一步地,可向浓缩后的阳极液中加入na2co3,从而可以获得碳酸锂粗品。
70、在本发明的一些实施方案中,所述活化包括以下步骤:
71、提供一活化装置,所述活化装置包括阳极腔、阴极腔和隔膜;其中,所述阳极腔中设置有盐溶液,所述阴极腔中设置有导电电极和氧化剂溶液;
72、将待活化的电极放入到阳极腔的盐溶液中;
73、所述待活化电极连接电源的正极,阴极腔中的所述导电电极作为对电极并且连接电源的负极,施加恒电流对所述待活化电极进行电活化。
74、在本发明的一些实施方案中,所述氧化剂溶液包括含有fe2+、fe3+、cu2+、cu+、i2、i3-、sn4+、cr3+、cd2+、pb2+、po43-、v3+、sn2+、hcooh、hcho、ch3oh、sbo+、vo2+、h2moo4、mno4-、tl3+、ag+中的至少一种的溶液。所述氧化剂溶液的浓度可以为0.001~10mol/l,例如0.001、0.01、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、2、3、4、5、6、7、8、9、10mol/l等等。
75、在本发明的一些实施方案中,所述盐溶液包括含有cl-、so42-、so32-、no3-、no2-、po43-、co32-、氯酸根、高氯酸根的可溶盐中的至少一种的溶液。所述盐溶液的浓度可以为0.1~10mol/l,例如0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、2、3、4、5、6、7、8、9、10mol/l等等。
76、在本发明的一些实施方案中,所述导电电极为惰性导电电极;进一步地,所述导电电极包括碳电极、石墨电极、碳布电极、钛电极、玻碳电极、碳毡电极、铂电极、金电极、不锈钢电极、铜电极、银电极、铝电极、金属合金电极中的至少一种。
77、在本发明的一些实施方案中,所述活化电压可以为0.3~1v,例如0.3v、0.4v、0.5v、0.6v、0.7v、0.8v、0.9v、1.0v等等;活化时间可以为0.1~100h,例如0.1h、1h、5h、10h、20h、30h、40h、50h、60h、70h、80h、90h、100h等等。
78、另外,关于详细的造孔和活化的工艺,在2022年6月10日向国家知识产权局提交的专利申请202210656925.6(公开日为2022年8月2日)和2022年10月13日向国家知识产权局提交的专利申请202211254215.7(公开日为2022年12月27日)中已经有详细的记载,在此全部引入作为参考。
79、与现有技术相比,本发明的有益效果在于:
80、1、与传统的高温焙烧-水浸、高温焙烧-碱浸、石灰石焙烧-水浸、石灰石+cacl2掺杂焙烧-水浸、压煮法相比,本发明提供的酸浸法可以有效的降低反应温度,缩短浸出时间,浸出液杂质含量更低,避免了传统工艺煅烧转晶工序,解决了高温焙烧的环境问题,能耗更低,更有利于实现低能耗的清洁工业应用。
81、2、本发明提供的三层核壳结构的选择性提锂电极,以碳材料为内层,可以有效地解决在电化学氧化还原提锂过程中锂离子传输阻力较大,扩散系数小的问题,大大缩短了锂离子在电极内的扩散路径。
82、3、本发明提供的三层核壳结构的选择性提锂电极,采用磷酸铁锂作为外层材料进行包覆,利用磷酸铁锂在酸性条件下稳定的特性,从而解决了锂锰氧化物不耐酸的缺陷,提高了锂锰氧化物在酸性溶液中提锂的稳定性和电化学性能,可以实现在酸性条件下使用高吸附锂容量的锂锰氧化物进行高效提锂。
83、4、本发明提供的三层核壳结构的选择性提锂电极电化学氧化还原提锂技术,可以有效的应用于锂铝硅玻璃的酸浸出体系中,通过调节体系的电流和电压以实现锂的选择性吸附/脱附,且可实现吸吸附/脱附的循环工艺,极大地降低能耗和工艺流程,易于工业化生产。
- 还没有人留言评论。精彩留言会获得点赞!