一种减少沉淀过程中母液排放量和沉淀剂单耗的方法与流程
本发明属于金属材料中金属粉末的制备技术领域,特别是提供了一种减少沉淀过程中母液排放量和沉淀剂单耗的方法。
背景技术:
化学沉淀法作为一种生产超细金属粉末的经典生产方法,被广泛应用于各种领域。一般采用两种溶液发生反应,其基本的化学反应方程式如下:
MA+bB=MB↓+bA (1)
对于任一可逆的化学反应,在一定条件下达到化学平衡状态时,体系中各反应物和生成物的物质的量不再发生变化,其活度熵为一定值。化学反应平衡的标志是化学反应体系内的各物质的浓度不再随时间的变化而变化,达到动态平衡状态。达到平衡时,各物质的百分含量保持不变、各物质的浓度保持不变、各物质的物质的量和质量保持不变。对于有气体参加的反应,平衡时混合气体的总压强保持不变、混合气体的平均密度保持不变。若有有色物质参加反应,则体系的颜色保持不变。若有沉淀剂参加反应,沉淀物的量保持不变。总体系的温度保持不变。因此建立平衡后,各物质的浓度就不发生改变了。反过来说,如果化学反应达到平衡后,各物质的浓度不再发生改变,则平衡就没有发生移动。其平衡遵循化学平衡常数。
对于上述反应,若增加沉淀剂bB的反应浓度,在其他条件相同的情况下,可以促使化学反应平衡向右进行,这样可使金属元素M在化学沉淀过程中反应更完全,得到的目标产物沉淀物MB量更多。实际上,在大多数化学沉淀反应中,为了使反应完全,大多数都采用过量地加入沉淀剂bB的做法。而过量的沉淀剂bB将会残留在母液中。
随着环保的要求越来越高,这种母液一般需通过各种方法进行处理后达标才能排放,处理成本也较高。
碳酸钴在工业化生产即为生活中应用较为广泛,在陶瓷工业用作着色剂,采矿业中用作选矿剂,在有机工业用于制造催化剂、伪装涂料和化学温度指示剂,农业上用作微量元素肥料,分析化学中用作分析试剂。碳酸钴晶体不易溶于水,且其原料在水中的溶解性较好,工业生产碳酸钴通常采用沉淀法。
以氯化钴为沉淀剂生产碳酸钴为例,沉淀反应方程式分别为:
CoCl2+NH4HCO3=CoCO3↓+HCl+NH4Cl (2)
沉淀反应结束后,浆料经过过滤将碳酸钴粉体与母液分离,然后用水将浆料进行洗涤,将残留在浆料中的其他杂质清洗干净后再将粉体与洗水过滤分离。为了保证母液中钴离子都生成碳酸钴沉淀物,同时调节母液的酸碱性,必须加入过量的碳酸氢铵溶液,过量的碳酸氢铵与产物盐酸进一步反应,其反应方程式为:
HCl+NH4HCO3=NH4Cl+H2O+CO2↑ (3)
其总反应方程式为:
CoCl2+2NH4HCO3=CoCO3↓+2NH4Cl+H2O+CO2↑ (4)
上述方程中,碳酸氢铵物质的量为氯化钴的两倍,实际生产中,为了保证钴离子的最大限度沉淀,碳酸氢铵的量大于氯化钴物质的量的两倍,这样母液中除了生成的氯化铵外,还会有较多过量的碳酸氢铵存在。
这些母液和洗水在后期通过三效蒸发蒸发结晶后,过滤回收氯化铵。这样过量的碳酸氢铵将大量损耗,造成较大的浪费。另一方面,正常每生产一吨钴,合计约30吨左右的废水完全通过蒸汽三效蒸发,其蒸汽消耗为12.5吨,造成很大的能量消耗。
技术实现要素:
为解决上述问题,本发明在保证产品质量和收率的前提下,减少母液排放量,降低生产成本。
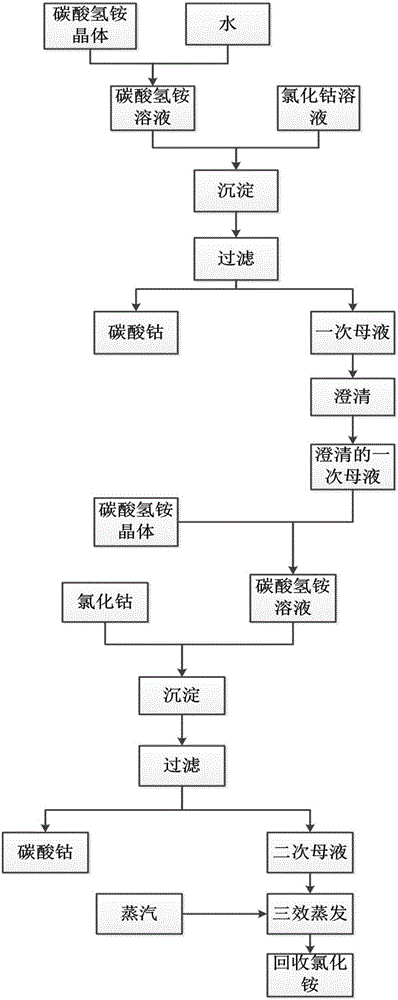
本发明适用于沉淀反应,为了减少母液排放量,将前一次沉淀反应结束后过滤得到的母液循环使用,进行下一轮的沉淀反应。
本发明提供的减少沉淀过程中母液排放量和沉淀剂单耗的方法具体包括以下步骤:
1)将过量沉淀剂与金属盐溶液反应;过量的沉淀剂保证沉淀反应向正反应方向进行,提高反应产率。
2)反应结束后,过滤,得到目标产物和第一次母液;
3)用第一次母液溶解沉淀剂,与金属盐溶液反应,进行第二轮的沉淀反应,反应结束后过滤得到目标产物和第二次母液;
4)按照步骤3)操作,将母液循环使用,进行N次沉淀反应,得到目标产物和第N次母液;
5)将第N次母液处理达标后排放。
上述母液循环过程中,所溶解的沉淀剂的量为与对应的金属盐反应消耗的物质的量。
上述母液至少循环使用一次,理论上重复次数越多,生产单位金属量产生的母液排放量越少,能量消耗减少,降低了母液的处理成本。
本发明方法可用于生产沉淀物碳酸钴,其中沉淀剂为碳酸氢铵,金属溶液为氯化钴溶液,即将前一次沉淀过程中产生的母液代替水,用来溶解碳酸氢铵晶体,得到的碳酸氢铵溶液继续与氯化钴反应。实际生产中,碳酸氢铵的浓度需要控制一定浓度,其物质的量要大于氯化钴物质的量的两倍,促使反应向正反应方向进行,才能确保沉淀反应进行完全,保证钴母液中残留的钴离子不超标,因此,在反应结束时,母液中仍有大量碳酸氢铵,直接排放造成很大的浪费。采用本发明提供的方法,能减少每吨钴金属量的碳酸氢铵的单耗,降低生产成本。
为了防止过滤不充分母液中仍有少量固体沉淀物,或者其它固体杂质,将前一次母液经静置澄清后再来溶解沉淀剂。
关于合成碳酸钴的沉淀反应,其母液的循环使用的次数优选为一次。其原因在于:母液循环次数越多,单耗虽然降低。但是如果母液循环次数太多,也将带来一些其他问题,由于氯化钴溶液和碳酸氢铵中多少会含有少量的杂质,如铁、钙、镁等,循环次数增多,这些杂质在系统中反复循环会产生富集,到了一定浓度后会混入到碳酸钴中,从而导致产品碳酸钴的杂质超标,影响产品质量。同时,循环次数增多,NH4+离子会越来越高,NH4+与Co2+离子会形成稳定的钴铵络合离子,导致母液中钴含量越来越高,从而影响钴的实收率,造成钴的损失。基于以上两种原因,母液循环次数不是越多越好,而是只能循环有限次数。在实际生产中,在保证产品收率的前提下,需要既保证碳酸钴的杂质不超标、又保证母液钴含量不超标,同时能降低碳酸氢铵的消耗。当母液循环两次及以上时,排放的母液中,钴离子含量超标,而产品碳酸钴中,钙、镁杂质的含量超标,难以保证产品的质量。
当原料钴的相对质量为1吨时,实际碳酸氢铵用量为3.4吨。碳酸氢铵浓度为180g/L,3.4吨碳酸氢铵需配制体积18.9m3。过量碳酸氢铵的量为0.722吨。来自氯化钴溶液和碳酸氢铵溶液中的水以及反应产生的母液水量约30m3,母液中主要成分分别是水、反应生成的氯化铵、过量的碳酸氢铵,还有少量的未沉淀完成的钴离子(游离钴离子和钴氨络合离子),以及少量的其他金属离子,如铁、钙、镁等。实际检测母液中氯离子约为39~40g/L,由于部分碳酸氢铵在30℃以上分解,少量氨气挥发,碳酸氢铵含量约为20~24g/L,将该母液用作溶解碳酸氢铵的溶剂,能够达到较优的减少沉淀过程中母液排放量和沉淀剂单耗的效果,同时保证产品的最优质量和达标的排放,而且还可以提高母液中氯化铵的浓度,从而减少三效蒸发时的蒸汽消耗量,降低生产成本。
上述第N次母液经三效蒸发回收氯化铵,在回收资源的同时,保证母液排放达标。
本发明提供的方法可用于草酸钴、氢氧化钴或碳酸锰等的工业化生产。
与现有技术相比,本发明的有益效果在于:
本发明是在保证产品质量和收率的前提下,减少每吨金属量的母液排放量,而且还可以提高母液中可回收化合物的浓度,从而减少三效蒸发时的蒸汽消耗量,降低生产成本。同时能减少每吨金属量的沉淀剂的单耗,降低生产成本。
附图说明
图1是本发明结构示意图;
图2是本发明的实施例1的结构示意图。
具体实施方式
为了更好地理解本发明,下面结合实施例进一步阐明本发明的内容,但本发明的内容不仅仅局限于下面的实施例。
对比例:
取约合钴的相对质量为1吨的氯化钴原料2.2吨与碳酸氢铵用量为3.4吨进行沉淀反应。其中碳酸氢铵浓度为180g/L,3.4吨碳酸氢铵需配制体积18.9m3。反应结束后,过滤,得到目标产物碳酸钴和一次母液,母液中过量碳酸氢铵的量为0.722吨。来自氯化钴溶液和碳酸氢铵溶液中的水以及反应产生的母液水量约30m3,一次母液中主要成分分别是水、反应生成的氯化铵、过量的碳酸氢铵,还有少量的未沉淀完成的游离钴离子和钴氨络合离子,以及少量的其他金属离子,如铁、钙、镁等。实际检测母液中氯离子约为39~40g/L,由于部分碳酸氢铵在30℃以上分解,少量氨气挥发,碳酸氢铵含量约为20~24g/L,将上述母液经三效蒸发回收氯化铵,其中所需蒸汽量为12.5吨。
实施例1:
实施例1是在对比例基础上进行的改进,澄清上述对比例中的一次母液,由于实际一次沉淀过程中需要消耗3.4吨碳酸氢铵,上述一次母液中还有过量的碳酸氢铵0.722吨,再在一次母液中新加入2.678吨碳酸氢铵,与1吨的氯化钴发生第二次沉淀反应。反应结束后,过滤得目标沉淀物,所得滤液为二次母液,将二次母液经三效蒸发回收氯化铵。该方案将母液回用一次,生产了2吨钴金属量,所需要的碳酸氨铵为6.078吨,平均每吨钴金属量需用碳酸氢铵3.039吨。平均每生产一吨钴金属量可节约碳酸氢铵10.62%。
实施例2:
实施例1是在对比例基础上进行的改进,澄清上述对比例中的二次母液,再在二次母液中新加入2.678吨碳酸氢铵,与1吨的氯化钴发生第三次沉淀反应。反应结束后,过滤得目标沉淀物,所得滤液为三次母液,将三次母液经三效蒸发回收氯化铵。该方案生产3吨钴金属量,需要的碳酸氢铵量8.756吨,平均单耗2.919吨。平均每生产一吨钴金属量可节约碳酸氢铵0.481吨,减少了14.15%。
表1上述三种方案对比:
表2上述三种方案中排出母液和碳酸钴中的杂质含量:
本发明中所述的具体实施案例仅为本发明的较佳实施案例而已,并非用来限定本发明的实施范围。即凡依本发明申请专利范围的内容所作的等效变化与修饰,都应作为本发明的技术范畴。
- 还没有人留言评论。精彩留言会获得点赞!