一种高纯度3R铜铁矿结构CuFeO2微晶材料的制备方法与流程
本发明涉及一种高纯度3r铜铁矿结构cufeo2微晶材料的制备方法,属于金属氧化物半导体材料合成制备领域。
背景技术:
cufeo2作为次生铜铁矿化合物,普遍存在铜矿床的氧化区底部,这一结论是由rogers在1913年提出。cufeo2晶体结构是由二维密堆积的cu+和fe3+o6八面体沿c轴交替堆叠而成,由于堆叠方式的不同,将会分别形成六方2h结构(以…ababab…方式堆叠)和菱方3r结构(以…abcabc…方式堆叠)。在实际制备条件下,菱方3r结构具有相对较低的形成能,因此更常见。cufeo2具有优异光催化性能、电化学性能、光电转换性能、磁学性能,从而被广泛的应用于p型透明氧化物薄膜、二极管、太阳能电池及光催化等领域中。正因为cufeo2具有诸多用途,所以有关铜铁矿的合成和性能的研究已逐渐成为科学家研究的焦点。cufeo2的制备主要包括固态反应、溶胶-凝胶,水热合成等方法,但是合成产物大部分都是2h结构与3r结构的混合相。而且铜空位、间隙氧等点缺陷,以及cuo、cu2o、fe2o3、cufe2o4等副产物经常被引入。这一事实导致非常严重的后果:文献中提供的cufeo2基本物理化学性质通常不准确且不一致,限制了对该材料的进一步开发和研究。
技术实现要素:
为解决上述技术问题,本发明提供一种高纯度3r铜铁矿结构cufeo2微晶材料的制备方法,避免了常规合成方法中引入的点缺陷以及杂相,致使cufeo2材料基本物理化学性质参数的准确性存在偏差的现象,进而可以全面掌握检测和探索其基本物理化学性质,更好的挖掘其在各种新型光电转换功能材料和器件中的应用潜力。
本发明通过以下技术方案实现:
一种高纯度3r铜铁矿结构cufeo2微晶材料的制备方法,具体步骤如下:
(1)将cu(no3)2.3h2o和fe(no3)3.9h2o按照摩尔比1:1加入去离子水中,磁力搅拌溶解,得到混合溶液;
(2)在步骤(1)的混合溶液中逐滴滴加naoh溶液,再依次超声、磁力搅拌;
(3)在步骤(2)的溶液中滴加正丙醛后继续磁力搅拌至形成胶状悬浮液;
(4)将步骤(3)的胶状悬浮液加入反应釜中,胶状悬浮液的填充率为85%,密封釜体后置于程序控温烘箱中,设定反应温度为100~180℃,反应时间为6~24h,反应结束后,待釜体自然冷却至室温,打开釜体取出反应产物,反应产物洗涤干燥后得到高纯度3r铜铁矿结构cufeo2微晶材料。
步骤(1)混合溶液中cu(no3)2的浓度为0.5~0.8mol/l。
步骤(1)磁力搅拌器的搅拌转速为300~400转/min,搅拌10~15min。
步骤(2)naoh溶液按照naoh是cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的4~10倍进行添加。
步骤(2)naoh溶液的浓度为1.5~4mol/l,滴加速度为1.5~2.5ml/min。
步骤(2)超声功率为300~400w,超声10~15min。
步骤(2)和步骤(3)磁力搅拌转速为400~500转/min,搅拌10~15min。
步骤(3)正丙醛的滴加速度是4~5ml/min,添加的正丙醛的体积与cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的体积摩尔比l:mol为1~2:10。
步骤(4)洗涤是依次使用去离子水、稀硝酸、无水乙醇等离心清洗5~8次。
步骤(4)干燥是在恒温烘箱中60~80℃干燥10~12h。
本发明与现有技术相比,还有以下几个突出效果:
(1)该方法制备工艺简单、工艺参数容易控制、实验重复性好、单次产量高。
(2)该方法使用的反应原材料来源广泛,环境污染小、价格低廉、生产成本低。
(3)当反应温度为100~180℃时,均可得到纯度极高的3r铜铁矿结构cufeo2微晶材料,晶粒尺寸并未随着反应温度变化而发生明显变化,粒径尺寸在2μm左右,但晶粒的结晶性随着反应温度的升高有一定的提高。
(4)本发明在较低温度下或较短时间内通过一步反应法皆可制备高纯度3r铜铁矿结构cufeo2微晶材料,首次开发出的一种高纯度3r铜铁矿结构cufeo2微晶材料高产率、低成本的快速制备方法,对于促进cufeo2半导体材料及其在光催化分解水制氢、降解污染物、光还原co2、透明导电氧化物及铁磁材料等光电功能转换材料和器件领域的应用发展,具有十分重要的学术价值和应用前景。
附图说明
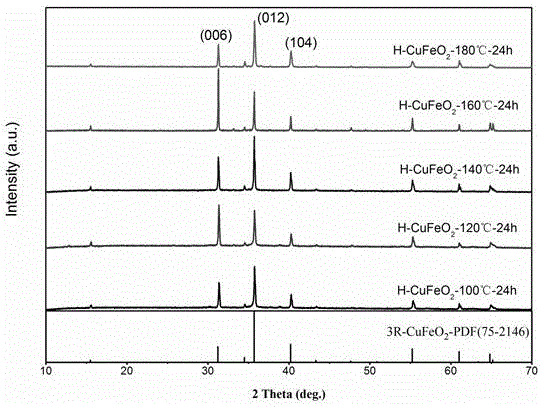
图1为实施例1-5制备出的材料的x射线衍射图谱,
图2为实施例1及实施例6-8制备出的材料x射线衍射图谱;
图3为实施例1-5制备出的材料的扫描电镜图;
图4为实施例1及实施例6-8制备出的材料的扫描电镜图;
图5为实施例1制备出的材料的x射线光电子能谱图;
图6为实施例1制备出的材料的降解有机污染物甲基橙的速率图;
图7为实施例1制备出的材料的光电流图。
具体实施方式
下面结合附图和具体实施例对本发明作进一步详细说明,但本发明的保护范围并不限于所述内容。
实施例1
一种高纯度3r铜铁矿结构cufeo2微晶材料的制备方法,具体步骤如下:
(1)将cu(no3)2.3h2o和fe(no3)3.9h2o按照摩尔比1:1加入去离子水中,在磁力搅拌器中充分搅拌15min溶解,磁力搅拌器的搅拌转速为300转/min,得到混合溶液,混合溶液中cu(no3)2的浓度为0.5mol/l;
(2)在步骤(1)的混合溶液中逐滴加入naoh溶液,naoh溶液的浓度为4mol/l,滴加速度为1.5ml/min,naoh的物质的量量按照cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的9倍进行添加,再依次超声12min、磁力搅拌12min,超声功率为350w,磁力搅拌器的搅拌转速为450转/min;
(3)在步骤(2)的溶液中滴加正丙醛后继续磁力搅拌至形成胶状悬浮液,正丙醛的滴加速度是4.5ml/min,磁力搅拌器的搅拌转速为450转/min,搅拌12min;添加的正丙醛的体积与cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的体积摩尔比l:mol为2:10;
(4)将步骤(3)的胶状悬浮液加入反应釜中,胶状悬浮液的填充率为85%,密封釜体后置于程序控温烘箱中,设定反应温度为180℃,反应时间为24h,反应结束后,待釜体自然冷却至室温,打开釜体取出反应产物,反应产物洗涤依次使用去离子水、稀硝酸、无水乙醇等离心清洗6次,然后在恒温烘箱中80℃干燥10h干燥后得到高纯度3r铜铁矿结构cufeo2微晶材料。
实施例2
一种高纯度3r铜铁矿结构cufeo2微晶材料的制备方法,具体步骤如下:
(1)将cu(no3)2.3h2o和fe(no3)3.9h2o按照摩尔比1:1加入去离子水中,在磁力搅拌器中充分搅拌12min溶解,磁力搅拌器的搅拌转速为350转/min,得到混合溶液,混合溶液中cu(no3)2的浓度为0.6mol/l;
(2)在步骤(1)的混合溶液中逐滴加入naoh溶液,naoh溶液的浓度为2mol/l,滴加速度为2.5ml/min,naoh的物质的量按照cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的6倍进行添加,再依次超声15min、磁力搅拌15min,超声功率为300w,磁力搅拌器的搅拌转速为400转/min;
(3)在步骤(2)的溶液中滴加正丙醛后继续磁力搅拌至形成胶状悬浮液,正丙醛的滴加速度是5ml/min,磁力搅拌器的搅拌转速为500转/min,搅拌10min;添加的正丙醛的体积与cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的体积摩尔比l:mol为1.5:10;
(4)将步骤(3)的胶状悬浮液加入反应釜中,胶状悬浮液的填充率为85%,密封釜体后置于程序控温烘箱中,设定反应温度为160℃,反应时间为24h,反应结束后,待釜体自然冷却至室温,打开釜体取出反应产物,反应产物洗涤依次使用去离子水、稀硝酸、无水乙醇等离心清洗7次,然后在恒温烘箱中70℃干燥11h干燥后得到高纯度3r铜铁矿结构cufeo2微晶材料。
实施例3
一种高纯度3r铜铁矿结构cufeo2微晶材料的制备方法,具体步骤如下:
(1)将cu(no3)2.3h2o和fe(no3)3.9h2o按照摩尔比1:1加入去离子水中,在磁力搅拌器中充分搅拌11min溶解,磁力搅拌器的搅拌转速为400转/min,得到混合溶液,混合溶液中cu(no3)2的浓度为0.7mol/l;
(2)在步骤(1)的混合溶液中逐滴加入naoh溶液,naoh溶液的浓度为3mol/l,滴加速度为2ml/min,naoh的物质的量按照cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的5倍进行添加,再依次超声15min、磁力搅拌15min,超声功率为300w,磁力搅拌器的搅拌转速为400转/min;
(3)在步骤(2)的溶液中滴加正丙醛后继续磁力搅拌至形成胶状悬浮液,正丙醛的滴加速度是4ml/min,磁力搅拌器的搅拌转速为400转/min,搅拌15min;添加的正丙醛的体积与cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的体积摩尔比l:mol为1:10;
(4)将步骤(3)的胶状悬浮液加入反应釜中,胶状悬浮液的填充率为85%,密封釜体后置于程序控温烘箱中,设定反应温度为140℃,反应时间为24h,反应结束后,待釜体自然冷却至室温,打开釜体取出反应产物,反应产物洗涤依次使用去离子水、稀硝酸、无水乙醇等离心清洗8次,然后在恒温烘箱中80℃干燥12h干燥后得到高纯度3r铜铁矿结构cufeo2微晶材料。
实施例4
一种高纯度3r铜铁矿结构cufeo2微晶材料的制备方法,具体步骤如下:
(1)将cu(no3)2.3h2o和fe(no3)3.9h2o按照摩尔比1:1加入去离子水中,在磁力搅拌器中充分搅拌15min溶解,磁力搅拌器的搅拌转速为300转/min,得到混合溶液,混合溶液中cu(no3)2的浓度为0.8mol/l;
(2)在步骤(1)的混合溶液中逐滴加入naoh溶液,naoh溶液的浓度为2.5mol/l,滴加速度为2ml/min,naoh的物质的的量按照cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的8倍进行添加,再依次超声10min、磁力搅拌10min,超声功率为400w,磁力搅拌器的搅拌转速为400转/min;
(3)在步骤(2)的溶液中滴加正丙醛后继续磁力搅拌至形成胶状悬浮液,正丙醛的滴加速度是5ml/min,磁力搅拌器的搅拌转速为400转/min,搅拌10min;添加的正丙醛的体积与cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的体积摩尔比l:mol为2:10;
(4)将步骤(3)的胶状悬浮液加入反应釜中,胶状悬浮液的填充率为85%,密封釜体后置于程序控温烘箱中,设定反应温度为120℃,反应时间为24h,反应结束后,待釜体自然冷却至室温,打开釜体取出反应产物,反应产物洗涤依次使用去离子水、稀硝酸、无水乙醇等离心清洗5次,然后在恒温烘箱中70℃干燥11h干燥后得到高纯度3r铜铁矿结构cufeo2微晶材料。
实施例5
一种高纯度3r铜铁矿结构cufeo2微晶材料的制备方法,具体步骤如下:
(1)将cu(no3)2.3h2o和fe(no3)3.9h2o按照摩尔比1:1加入去离子水中,在磁力搅拌器中充分搅拌13min溶解,磁力搅拌器的搅拌转速为400转/min,得到混合溶液,混合溶液中cu(no3)2的浓度为0.7mol/l;
(2)在步骤(1)的混合溶液中逐滴加入naoh溶液,naoh溶液的浓度为3.5mol/l,滴加速度为1.5ml/min,naoh的物质的的量按照cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的8倍进行添加,再依次超声10min、磁力搅拌10min,超声功率为350w,磁力搅拌器的搅拌转速为450转/min;
(3)在步骤(2)的溶液中滴加正丙醛后继续磁力搅拌至形成胶状悬浮液,正丙醛的滴加速度是4ml/min,磁力搅拌器的搅拌转速为400转/min,搅拌15min;添加的正丙醛的体积与cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的体积摩尔比l:mol为2:10;
(4)将步骤(3)的胶状悬浮液加入反应釜中,胶状悬浮液的填充率为85%,密封釜体后置于程序控温烘箱中,设定反应温度为100℃,反应时间为24h,反应结束后,待釜体自然冷却至室温,打开釜体取出反应产物,反应产物洗涤依次使用去离子水、稀硝酸、无水乙醇等离心清洗8次,然后在恒温烘箱中60℃干燥12h干燥后得到高纯度3r铜铁矿结构cufeo2微晶材料。
实施例6
一种高纯度3r铜铁矿结构cufeo2微晶材料的制备方法,具体步骤如下:
(1)将cu(no3)2.3h2o和fe(no3)3.9h2o按照摩尔比1:1加入去离子水中,在磁力搅拌器中充分搅拌15min溶解,磁力搅拌器的搅拌转速为300转/min,得到混合溶液,混合溶液中cu(no3)2的浓度为0.8mol/l;
(2)在步骤(1)的混合溶液中逐滴加入naoh溶液,naoh溶液的浓度为4mol/l,滴加速度为1.5ml/min,naoh的物质的的量按照cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的10倍进行添加,再依次超声15min、磁力搅拌12min,超声功率为300w,磁力搅拌器的搅拌转速为450转/min;
(3)在步骤(2)的溶液中滴加正丙醛后继续磁力搅拌至形成胶状悬浮液,正丙醛的滴加速度是5ml/min,磁力搅拌器的搅拌转速为500转/min,搅拌10min;添加的正丙醛的体积与cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的体积摩尔比l:mol为1:10;
(4)将步骤(3)的胶状悬浮液加入反应釜中,胶状悬浮液的填充率为85%,密封釜体后置于程序控温烘箱中,设定反应温度为180℃,反应时间为6h,反应结束后,待釜体自然冷却至室温,打开釜体取出反应产物,反应产物洗涤依次使用去离子水、稀硝酸、无水乙醇等离心清洗5次,然后在恒温烘箱中80℃干燥10h干燥后得到高纯度3r铜铁矿结构cufeo2微晶材料。
实施例7
一种高纯度3r铜铁矿结构cufeo2微晶材料的制备方法,具体步骤如下:
(1)将cu(no3)2.3h2o和fe(no3)3.9h2o按照摩尔比1:1加入去离子水中,在磁力搅拌器中充分搅拌10min溶解,磁力搅拌器的搅拌转速为400转/min,得到混合溶液,混合溶液中cu(no3)2的浓度为0.7mol/l;
(2)在步骤(1)的混合溶液中逐滴加入naoh溶液,naoh溶液的浓度为1.8mol/l,滴加速度为2.5ml/min,naoh的物质的的量按照cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的10倍进行添加,再依次超声10min、磁力搅拌15min,超声功率为400w,磁力搅拌器的搅拌转速为400转/min;
(3)在步骤(2)的溶液中滴加正丙醛后继续磁力搅拌至形成胶状悬浮液,正丙醛的滴加速度是4ml/min,磁力搅拌器的搅拌转速为400转/min,搅拌15min;添加的正丙醛的体积与cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的体积摩尔比l:mol为1.5:10;
(4)将步骤(3)的胶状悬浮液加入反应釜中,胶状悬浮液的填充率为85%,密封釜体后置于程序控温烘箱中,设定反应温度为180℃,反应时间为12h,反应结束后,待釜体自然冷却至室温,打开釜体取出反应产物,反应产物洗涤依次使用去离子水、稀硝酸、无水乙醇等离心清洗5次,然后在恒温烘箱中60℃干燥12h干燥后得到高纯度3r铜铁矿结构cufeo2微晶材料。
实施例8
一种高纯度3r铜铁矿结构cufeo2微晶材料的制备方法,具体步骤如下:
(1)将cu(no3)2.3h2o和fe(no3)3.9h2o按照摩尔比1:1加入去离子水中,在磁力搅拌器中充分搅拌10min溶解,磁力搅拌器的搅拌转速为400转/min,得到混合溶液,混合溶液中cu(no3)2的浓度为0.6mol/l;
(2)在步骤(1)的混合溶液中逐滴加入naoh溶液,naoh溶液的浓度为3mol/l,滴加速度为1.5ml/min,naoh的物质的的量按照cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的10倍进行添加,再依次超声10min、磁力搅拌10min,超声功率为300w,磁力搅拌器的搅拌转速为500转/min;
(3)在步骤(2)的溶液中滴加正丙醛后继续磁力搅拌至形成胶状悬浮液,正丙醛的滴加速度是5ml/min,磁力搅拌器的搅拌转速为400转/min,搅拌15min;添加的正丙醛的体积与cu(no3)2.3h2o和fe(no3)3.9h2o总物质的量的体积摩尔比l:mol为2:10;
(4)将步骤(3)的胶状悬浮液加入反应釜中,胶状悬浮液的填充率为85%,密封釜体后置于程序控温烘箱中,设定反应温度为180℃,反应时间为18h,反应结束后,待釜体自然冷却至室温,打开釜体取出反应产物,反应产物洗涤依次使用去离子水、稀硝酸、无水乙醇等离心清洗8次,然后在恒温烘箱中70℃干燥11h干燥后得到高纯度3r铜铁矿结构cufeo2微晶材料。
如图1所示为实施例1-5制备出的材料的x射线衍射图谱;图中横坐标为衍射角度,纵坐标为相对强度,从图中可以看出,实施例1-5均制备出cufeo2晶体材料,对应标准衍射图谱编号为#75-2146,为具有3r铜铁矿结构的cufeo2,材料结晶性好,纯度高。
如图2所示为实施例1及实施例6-8制备出的材料x射线衍射图谱;图中横坐标为衍射角度,纵坐标为相对强度,从图中可以看出,实施例1及实施例7-9均可以制备出cufeo2晶体材料,对应标准衍射图谱编号为#75-2146,为具有3r铜铁矿结构的cufeo2。
如图3所示为实施例1-5制备出的材料的扫描电镜图;从图中可以看出,随着反应温度的改变所制备出的cufeo2材料粒径并未发生明显变化,约为粒径为2μm左右的片状结构,微观形貌多为六方片状(截面为层状结构),符合典型的铜铁矿材料晶体结构。
如图4所示为实施例1及实施例6-8制备出的材料的扫描电镜图;从图中可以看出,随着反应时间的改变所制备出的cufeo2材料粒径并未发生明显变化,约为粒径为2μm左右的片状结构,微观形貌多为六方片状。
如图5所示为实施例1制备出的材料的x射线光电子能谱图(xps),其中图a为cufeo2材料的全谱;图b为cu2p的两个特征谱线cu-2p3/2和cu-2p1/2,分别对应于932.5ev和952.4ev,内插图为cu的俄歇峰在569.3ev,排除了零价cu,表明为cu1+;图c可以看出fe-2p的两个特征谱线fe-2p3/2和fe-2p1/2,分别对应于711.2ev和724.8ev,表明为fe3+;图d为o-2s的特征谱峰,结合能分别在528.2、529.8、531.6ev三个特征位置,这与文献报道相一致。
如图6所示为实施例1制备出的材料的降解有机污染物甲基橙的速率图,单一的cufeo2材料在无光照的条件下,600min内对甲基橙的降解为0;对于实施例1制备得到的cufeo2-h2o2体系,其在600min内对有机污染物甲基橙有10%的降解;对于实施例1制备得到的cufeo2-h2o2-光照体系,在300w的氙灯光照下,其在600min内对有机污染物甲基橙有93%的降解;整个降解过程中,当光照射到cufeo2材料上,cufeo2材料内部产生光生电子空穴对,h2o2充当电子牺牲剂的角色,将光生电子捕获后,剩余的光生空穴转移到cufeo2材料表面氧化甲基橙,将其分解。
如图7为实施例1制备出的材料的光电流图,从图7a中可以看出,cufeo2材料具有较好的光电转换功能,可以有效的分解水制氢,如图7b进一步表明cufeo2材料作为光电转换材料具有较好的稳定性。
- 还没有人留言评论。精彩留言会获得点赞!