一种废旧锰酸锂和磷酸铁锂正极材料的综合回收方法与流程
本发明属于电池回收的技术领域,具体属于一种废旧锰酸锂和磷酸铁锂正极材料综合回收锂制备电池级碳酸锂的方法。
背景技术:
随着现代科技的高速发展,社会能源与环境生态污染问题日益突出,在国家大力推行新能源电池的开发与应用的背景下,各种废弃电池对生态环境的污染问题已成为社会关注的焦点。特别是近年来,消费者对此类产品的需求量日益增加,导致锂离子电池的产量及废旧锂离子电池的数量不断增长,锂电池日益广泛地应用势必会产生大量的废旧电池。而磷酸铁锂以及锰酸锂电池由于其生产成本低,安全性能佳,循环性能好等优点,已被广泛应用于动力电池和储能电池。
锂电池在经过近千次充放电循环后,其内部工作离子将逐渐丧失活性,在废旧锂离子电池中,其镍、钴、锰、锂等有价金属的含量很可观,甚至相当一部分有价金属已经超过了其在矿石中的含量,若随意丢弃不但对环境带来威胁,而且造成金属资源的浪费,因此对废旧锂电池的回收利用具有十分重要的意义。
废旧锂电池回收工艺分为前端物理拆解和后端化学回收,前端物理拆解即为利用物理方法,通过刺穿、破碎、过筛等工序,将废旧锂电池中的各种成分进行大致的物理筛分,得到壳体材料和正极粉等初步产物;而后端化学回收则是利用化学方法,通过一定的工艺对正极材料中的相关成分进行化学反应回收,而且后端化学回收主要是采用火法法和湿法法两种回收模式。
在工业作业中,针对废旧锂电池的后端化学回收,因为湿法回收法较为经济、安全、环保,因此其应用较为广泛。所以,在目前来说,对于废旧锂电池的后端化学回收其主要是以湿法为主,并且以火法为辅的回收模式。以三元材料的锂电池为例,其湿法回收一般采用的工艺为:还原酸浸、净化除杂、萃取分离的工艺流程;而针对磷酸铁锂材料的湿法回收,其步骤为先经放电、拆解、分选、粉碎、高温氧化酸浸,之后再逐步回收分离金属,得到纯净浸出液。如专利申请号为cn201810076950.0的中国发明专利申请,其公开了一种经高温氧化、浸出提锂等工序的回收方法,其可达到一定的锂浸出效果,但该方法需要经过高温煅烧,作业过程能耗大,而且能源利用率低,同时其产品在回收过程中对氧化剂臭氧的加入及氧化剂的使用存在一定的安全隐患,其未完全反应的臭氧如果不及时处理将会对环境造成较大的破坏,而且其工艺条件细节较难控制。又如专利申请号为cn201910801848.7的中国发明专利申请,该方法能直接利用磷酸铁锂电池废料提取锂,但该方法依然需要添加硝酸钠、次氯酸钠等氧化剂,且此类氧化剂的使用同样具有安全隐患,且该方法在提取过程中必须在高温条件,因此能源消耗也比较大,能源利用率低。在现今锂离子电池产量和废旧锂离子电池数量不断增长的情况,亟需对其回收工艺加以突破开发,以在保证环境安全的前提下,提升资源的有效回收利用。
技术实现要素:
(1)要解决的技术问题
针对现有技术的不足,本发明的目的在于提供一种废旧锰酸锂和磷酸铁锂正极材料的综合回收方法,该回收方法旨在解决现有技术工艺作业过程能耗大,能源利用率低,而且存在一定的安全隐患,同时还会对环境造成较大的破坏,并且其工艺条件细节较难控制的技术问题;该回收方法能够同时回收处理两种废旧锂离子电池的正极材料,并且无需添加现有技术中所需的氧化剂和还原剂,而且无需高温反应,能耗小能源利用率高,同时工艺简单综合回收率高,并且工艺过程节能环保,安全性高,具有较高的经济效益。
(2)技术方案
为了解决上述技术问题,本发明提供了这样一种废旧锰酸锂和磷酸铁锂正极材料的综合回收方法,该回收方法的具体步骤为:
步骤一、磷酸铁锂粉料调浆;将废旧锂电池回收的磷酸铁锂粉料置于密封的反应釜a中,并加水对其搅拌成浆;
其中,反应釜a为带密封性搅拌装置的反应釜。
步骤二、锰酸锂还原浸出;将废旧锂电池回收的锰酸锂材料置于反应釜b中,对其加水并搅拌成浆,之后向其加入盐酸并搅拌,反应产生氯气;
该步骤过程中进行的反应方程式为:
2limn2o4+16hcl=2licl+3cl2+4mncl2+8h2o;
步骤三、磷酸铁锂氧化浸出;向反应釜a中加入浓盐酸至反应体系ph为强酸性,并将步骤二中产生的氯气通入反应釜a中,进行氧化浸出,在反应过程中持续补加浓盐酸,使反应体系的ph维持为强酸性;
其中,在该反应体系中,强酸性对本领域技术人员来说是较为清楚的,即ph值小于等于5即可;此外,在该反应中,当检测反应体系溶液中无二价铁后,即氧化浸出反应完成,就可停止充入氯气,并将多余的氯气通过二级吸收塔进行二级碱液吸收。
该步骤过程中进行的反应方程式为:
2lifepo4+cl2=2licl+2fepo4
步骤四、固液分离;将反应釜a中的浸出浆料进行固液分离,得到氯化锂浸出液和磷酸铁锂浸出渣;将反应釜b中的浸出浆料进行固液分离,得到锰酸锂浸出液和锰酸锂浸出渣;
其中,反应釜a中的浆料通过压滤固液分离后,得到氯化锂浸出液和磷酸铁锂浸出渣,其磷酸铁锂浸出渣的主要成分为磷酸铁;反应釜b中的浆料通过压滤固液分离后,得到锰酸锂浸出液和锰酸锂浸出渣,其锰酸锂浸出渣主要成分为碳渣。
步骤五、洗涤;对磷酸铁锂浸出渣进行洗涤,得到磷酸铁渣及磷酸铁锂洗涤液;对锰酸锂浸出渣进行洗涤,得到碳渣及锰酸锂洗涤液;
其中,该步骤中得到的磷酸铁锂洗涤液可返回至反应釜a中,循环利用进行磷酸铁锂氧化浸出;该步骤中得到的锰酸锂洗涤液可返回至反应釜b中,循环利用进行锰酸锂还原浸出。
步骤六、中性除杂;将步骤四中固液分离得到的氯化锂浸出液和锰酸锂浸出液进行混合,并向其中缓缓加入无机碱溶液至混合溶液的ph值为6.5-7.5;
其中,向混合溶液中加入无机碱溶液至ph值为6.5-7.5,从而除去混合溶液中的铝、铁、铜等金属杂质离子。
该步骤过程中进行的反应方程式为:
fe3++3oh-=fe(oh)3↓
al3++3oh-=al(oh)3↓
步骤七、碱性除杂;向步骤六得到的溶液中缓缓加入无机碱溶液,将混合溶液的ph调至强碱性;
其中,在该反应体系中,强碱性对本领域技术人员来说是较为清楚的,即ph值大于等于12即可;此外,在该步骤中,通过将混合溶液的ph调至强碱性,从而除去溶液中锰等杂质离子。
该步骤过程中进行的反应方程式为:
mg2++2oh-=mg(oh)2↓
mn2++2oh-=mn(oh)2↓
步骤八、浓缩析钠;将步骤七得到的混合溶液进行蒸发浓缩,之后再对其进行过滤去渣,得到高浓度含锂溶夜;
其中,通过蒸发浓缩,可将混合溶液中的氯化钠析出,并通过过滤去渣将其出去,得到高浓度的含锂溶夜。
步骤九、沉锂;向可溶性碳酸盐和乙二胺四乙酸的混合溶液中缓缓加入步骤八中得到的高浓度含锂溶夜,并持续搅拌使其反应完全,之后再将其离心分离,得到分离渣,并对分离渣进行洗涤和干燥,即回收得到电池级碳酸锂。
其中,乙二胺四乙酸即的通俗称呼为edta。
该步骤过程中进行的反应方程式为:
2li++co32-=li2co3↓
ca2++edta===ca-edta
优选地,在步骤一中,控制所述废旧锂电池回收的磷酸铁锂粉料与水的液固比为3:1-8:1,并使其搅拌时间为0.5-3.0h。
优选地,在步骤二中,控制所述废旧锂电池回收的锰酸锂材料与水的液固比为1:1-3:1,并使加入盐酸的质量百分浓度为10-31%,且控制盐酸与锰酸锂的总摩尔比为3:1-10:1,并使其搅拌反应的时间为2-4h,搅拌反应的温度为常温。
优选地,在步骤三中,控制所述加入浓盐酸的质量百分浓度为15-31%,并使反应体系强酸性的ph值为0.5-5.0,并控制反应的温度为15-100℃。
进一步的,在步骤三中,反应完全后,使反应剩余的氯气经两级液碱吸收。
优选地,在步骤五中,所述对磷酸铁锂浸出渣和锰酸锂浸出渣进行洗涤,控制洗涤水的温度为25-100℃,洗涤时间为0.5-2h。
优选地,在步骤六中,所述无机碱溶液为氢氧化钠、氢氧化钾或氢氧化锂中的至少一种,并控制所述无机碱溶液的质量百分浓度为5-10%,反应温度为10-85℃。
优选地,在步骤七中,所述无机碱溶液为氢氧化钠、氢氧化钾或氢氧化锂中的至少一种,并控制所述无机碱溶液的质量百分浓度为5-10%,且将所述混合溶液的ph值调至ph≥12,反应温度为10-90℃。
优选地,在步骤八中,控制所述蒸发浓缩的温度为100-110℃,并使所述蒸发浓缩后溶液中li+的浓度为20-30g/l。
优选地,在步骤九中,所述可溶性碳酸盐为碳酸钠或碳酸钾中的至少一种,并控制所述可溶性碳酸盐和乙二胺四乙酸混合溶液中可溶性碳酸盐的浓度为150-250g/l,且使所述可溶性碳酸盐和乙二胺四乙酸混合溶液的ph值为11-13,并控制搅拌反应时间为0.5-2h。
进一步的,在步骤九中,所述离心分离得到沉锂母液,并将沉锂母液返回至步骤八中作为原料进行浓缩析钠。
其中,针对可溶性碳酸盐和乙二胺四乙酸混合溶液的调制,可先将计算量的可溶性碳酸盐固体加入至纯水中搅拌溶解,并过滤去除杂质,其可溶性碳酸盐的加入量一般为步骤八中高浓度含锂溶夜中锂离子摩尔量的0.5-0.6倍,再用液碱将其ph值调整为11-13,并向其中加入乙二胺四乙酸(edta),edta的加入量为溶液中钙离子摩尔量的1-2倍;之后再持续搅拌使其反应完全,在搅拌反应过程中加热升温,使其温度达到85-100℃,并缓慢加入步骤八中得到的高浓度含锂溶夜,搅拌反应0.5-2h,之后再将其离心分离,得到分离渣,并对分离渣进行洗涤和干燥,即回收得到电池级碳酸锂。
(3)有益效果
与现有技术相比,本发明的有益效果在于:
首先,本发明的方法能够同时回收处理两种废旧锂离子电池的正极材料,废旧锰酸锂和磷酸铁锂正极材料,并且无需添加现有技术中单独回收处理锰酸锂材料酸溶过程中的还原剂(双氧水、亚硝酸钠、亚硝酸氢钠等),又无需添加现有技术中单独回收处理磷酸铁锂材料氧化提锂过程中的氧化剂(naclo3、o3、naclo等),降低了生产成本,并且工艺简单综合回收率高,具有较高的经济效益,同时工艺过程节能环保。
其次,本发明的方法工艺简单,安全稳定性强,本发明的方法在步骤三中的磷酸铁锂氧化浸出是利用步骤二中产生的氯气作为氧化剂直接或间接氧化亚铁离子,从而无需加入额外的氧化剂就可以直接完成对磷酸铁锂的湿法提锂,进而降低了生产成本;同时,步骤二中产生氯气的速度可以通过控制步骤二中加入盐酸的速率来控制,从而保证了氯气反应及整个工序的作业安全;此外,步骤二和步骤三都可以在常温条件下进行,无需高温反应,生产工艺及条件简单,更易实现工业化,并且能源利用率高,适合推广使用。
最后,本发明方法制备得到的碳酸锂主含量可高达99.64%,达到了电池级要求,其中锰酸锂中锂的回收率高达99.5%,磷酸铁锂中锂的回收率高达98.8%。
总体而言,该回收方法能够同时回收处理两种废旧锂离子电池的正极材料,并且无需添加现有技术中所需的氧化剂和还原剂,而且无需高温反应,能耗小能源利用率高,同时工艺简单综合回收率高,并且工艺过程节能环保,安全性高,具有较高的经济效益。
附图说明
为了更清楚的说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术中描述所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一种实施方式,对于本领域普通技术人员来说,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
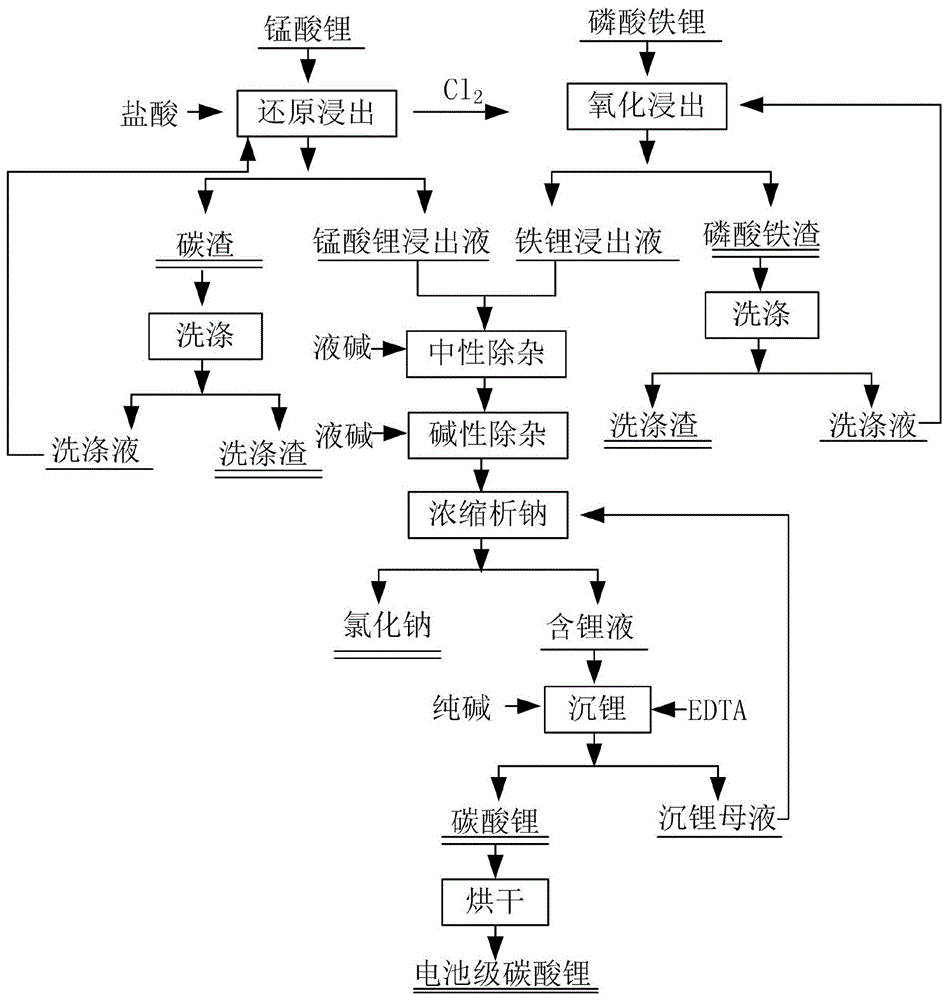
图1为本发明一种具体实施方式的工艺流程图。
具体实施方式
为使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面对本发明具体实施方式中的技术方案进行清楚、完整的描述,以进一步阐述本发明,显然,所描述的具体实施方式仅仅是本发明的一部分实施方式,而不是全部的样式。
实施例1
本具体实施例为对不同类型废旧锂电池前端物理拆解回收得到的锰酸锂和磷酸铁锂正极材料进行综合回收利用,其大致步骤可见附图1,图1为其工艺流程图,具体步骤为:
(1)磷酸铁锂粉调浆:将100kg磷酸铁锂粉料(li:4.0%)置于带密封性搅拌反应釜a内,加水调浆,液固比为:3:1,开启搅拌。
(2)锰酸锂还原浸出:将锰酸锂38kg(li:3.5%)置于密闭反应釜b内加水调浆,至液固比为1:1,开启搅拌调浆,再缓慢加入31%浓盐酸,盐酸的加入量为:浓盐酸与锰酸锂的总摩尔比为8:1,随着盐酸的加入,反应逐渐产生氯气。
(3)磷酸铁锂氧化浸出:向反应釜a中加入浓盐酸10kg至反应体系ph值为0.5左右,将步骤(2)产生的氯气导入反应釜a中进行氧化浸出,反应过程中补加2kg盐酸维持反应体系的ph值为0.5左右,检测溶液中无二价铁后,停止充入氯气;开启引风塔将多余的氯气通过二级吸收塔内进行二级碱液吸收。
(4)固液分离:反应完全后,分别将反应釜a与反应釜b内的浸出浆料进行固液分离,反应釜a中的浆料压滤后,得到氯化锂浸出液和磷酸铁渣,将反应釜b中的浆料进行固液分离,得到锰酸锂浸出液和锰酸锂浸出渣,其锰酸锂浸出渣主要成分为碳渣。
(5)洗涤:将磷酸铁锂浸出渣分别用300l自来水洗涤,洗涤水温度为:70℃,洗涤时间为1.0h,洗涤后得到磷酸铁渣湿渣以及洗涤液,洗涤液返回反应釜a中循环使用,将锰酸锂浸出渣用100l自来水洗涤,洗涤水温度为:70℃,洗涤后得到碳渣以洗涤液,洗涤液返回反应釜b中进行循环利用。
(6)中性除杂:将磷酸铁锂浸出液与锰酸锂浸出液合并后得含锂溶液350l,缓慢加入10%液碱溶液至反应体系的ph值为7.0,过滤。
(7)碱性除杂:将步骤(6)中的中性除杂液350l用10%液碱溶液调至反应体系的ph值为12,除去溶液中锰等杂质离子。
(8)浓缩析钠:将步骤(7)得到的含锂溶液加热蒸发浓缩至溶液中li+浓度为20g/l,蒸发浓缩温度为110℃,溶液过滤后得到含锂溶夜175l,其中li含量30g/l。
(9)沉锂:将42kg纯碱固体加入至200l纯水中搅拌溶解(na2co3含量为210g/l),过滤,用0.3kg液碱调节溶液中的ph为12,再向纯碱溶液中加入0.2kg乙二胺四乙酸(edta),edta的量为溶液中的钙离子摩尔量的1.5倍,开启搅拌升温,在温度80下,缓慢加入步骤(8)得到的含锂溶液175l,搅拌反应0.5~2h,经离心分离、洗涤、干燥得到电池级碳酸锂27.3kg。
经计算,该实施例中锂的综合回收率为97.2%,具体回收数据见下述表1,而碳酸锂的化学成分分析具体见下述表2,该碳酸锂质量满足ys/t582—2006电池级标准要求。
实施例2
本具体实施例为对不同类型废旧锂电池前端物理拆解回收得到的锰酸锂和磷酸铁锂正极材料进行综合回收利用,其大致步骤可见附图1,图1为其工艺流程图,具体步骤为:
(1)磷酸铁锂粉调浆:将100kg磷酸铁锂粉料(li:3.8%)置于带密封性搅拌反应釜a内,加水调浆,液固比为:2:1,开启搅拌。
(2)锰酸锂还原浸出:将锰酸锂40kg(li:3.7%)置于密闭反应釜b内加水调浆,至液固比为1:1,开启搅拌调浆,再缓慢加入25%浓盐酸,盐酸的加入量为:浓盐酸与锰酸锂的总摩尔比为9:1,随着盐酸的加入,反应逐渐产生氯气。
(3)磷酸铁锂氧化浸出:向反应釜a中加入浓盐酸5kg至反应体系ph值为1.0左右,将步骤(2)产生的氯气导入反应釜a中进行氧化浸出,反应过程中补加3kg盐酸维持反应体系的ph值为1.0左右,检测溶液中无二价铁后,停止充入氯气。开启引风塔将剩余的氯气通过二级吸收塔内进行二级碱液吸收。
(4)固液分离:反应完全后,分别将反应釜a与反应釜b内的浸出浆料进行固液分离,反应釜a中的浆料压滤后,得到氯化锂浸出液和磷酸铁渣,将反应釜b中的浆料进行固液分离,得到锰酸锂浸出液和锰酸锂浸出渣,其锰酸锂浸出渣主要成分为碳渣。
(5)洗涤:将磷酸铁锂浸出渣分别用400l自来水洗涤,洗涤水温度为:80℃,洗涤时间为1.0h,洗涤后得到磷酸铁渣湿渣以及洗涤液,洗涤液返回反应釜a中循环使用,将锰酸锂浸出渣用200l自来水洗涤,洗涤水温度为:80℃,洗涤后得到碳渣以洗涤液,洗涤液返回反应釜b中进行循环利用。
(6)中性除杂:将磷酸铁锂浸出液与锰酸锂浸出液合并后得含锂溶液300l,缓慢加入5%液碱溶液至反应体系的ph值为7.5,过滤得中性除杂液280l。
(7)碱性除杂:将步骤(6)中的中性除杂液280l用5%液碱溶液调至反应体系的ph值为12,除去溶液中锰等杂质离子。
(8)浓缩析钠:将步骤(7)得到的含锂溶液加热蒸发浓缩至溶液中li+浓度为23g/l,蒸发浓缩温度为105℃,溶液过滤后得到含锂溶夜184l,其中li含量28g/l。
(9)沉锂:将46.5kg纯碱固体加入至202l纯水中搅拌溶解(na2co3含量为230g/l),过滤,用0.5kg液碱调节溶液中的ph为13,再向纯碱溶液中加入0.1kg乙二胺四乙酸(edta),edta的量为溶液中的钙离子摩尔量的1.8倍,开启搅拌升温,在温度90℃下,缓慢加入步骤(8)得到的含锂溶液175l,搅拌反应0.5~2h,经离心分离、洗涤、干燥得到电池级碳酸锂27.01kg。
经计算,该实施例中锂的综合回收率为96%,具体回收数据见下述表1,而碳酸锂的化学成分分析具体见下述表2,该碳酸锂质量满足ys/t582—2006电池级标准要求。
实施例3
本具体实施例为对不同类型废旧锂电池前端物理拆解回收得到的锰酸锂和磷酸铁锂正极材料进行综合回收利用,其大致步骤可见附图1,图1为其工艺流程图,具体步骤为:
(1)磷酸铁锂粉调浆:将100kg磷酸铁锂粉料(li:3.65%)置于带密封性搅拌反应釜a内,加水调浆,液固比为:4:1,开启搅拌。
(2)锰酸锂还原浸出:将锰酸锂50kg(li:3.3%)置于密闭反应釜b内加水调浆,至液固比为3:1,开启搅拌调浆,再缓慢加入20%浓盐酸,盐酸的加入量为:浓盐酸与锰酸锂的总摩尔比为10:1,随着盐酸的加入,反应逐渐产生氯气。
(3)磷酸铁锂氧化浸出:向反应釜a中加入浓盐酸3kg至反应体系ph值为2.0左右,将步骤(2)产生的氯气导入反应釜a中进行氧化浸出,反应过程中补加5kg盐酸维持反应体系的ph值为2.0左右,检测溶液中无二价铁后,停止充入氯气。开启引风塔将剩余的氯气通过二级吸收塔内进行二级碱液吸收。
(4)固液分离:反应完全后,分别将反应釜a与反应釜b内的浸出浆料进行固液分离,反应釜a中的浆料压滤后,得到氯化锂浸出液和磷酸铁渣,将反应釜b中的浆料进行固液分离,得到锰酸锂浸出液和锰酸锂浸出渣,其锰酸锂浸出渣主要成分为碳渣。
(5)洗涤:将磷酸铁锂浸出渣分别用280l自来水洗涤,洗涤水温度为:50℃,洗涤时间为1.5h,洗涤后得到磷酸铁渣湿渣以及洗涤液,洗涤液返回反应釜a中循环使用,将锰酸锂浸出渣用150l自来水洗涤,洗涤水温度为:50℃,洗涤后得到碳渣以洗涤液,洗涤液返回反应釜b中进行循环利用。
(6)中性除杂:将磷酸铁锂浸出液与锰酸锂浸出液合并后得含锂溶液550l,缓慢加入31%液碱溶液至反应体系的ph值为7.0,过滤得中性除杂液540l。
(7)碱性除杂:将步骤(6)中的中性除杂液540l用15%液碱溶液调至反应体系的ph值为13,除去溶液中锰等杂质离子。
(8)浓缩析钠:将步骤(7)得到的含锂溶液加热蒸发浓缩至溶液中li+浓度为26g/l,蒸发浓缩温度为100℃,溶液过滤后得到含锂溶夜207l,其中li含量25g/l。
(9)沉锂:将47.6kg纯碱固体加入至216l纯水中搅拌溶解(na2co3含量为220g/l),过滤,用1kg液碱调节溶液中的ph为12,再向纯碱溶液中加入0.17kg乙二胺四乙酸(edta),edta的量为溶液中的钙离子摩尔量的1.6倍,开启搅拌升温,在温度90℃下,缓慢加入步骤(8)得到的含锂溶液207l,搅拌反应0.5~2h,经离心分离、洗涤、干燥得到电池级碳酸锂27.65kg。
经计算,该实施例中锂的综合回收率为98.01%,具体回收数据见下述表1,而碳酸锂的化学成分分析具体见下述表2,该碳酸锂质量满足ys/t582—2006电池级标准要求。
实施例4
本具体实施例为对不同类型废旧锂电池前端物理拆解回收得到的锰酸锂和磷酸铁锂正极材料进行综合回收利用,其大致步骤可见附图1,图1为其工艺流程图,具体步骤为:
(1)磷酸铁锂粉调浆:将100kg磷酸铁锂粉料(li:3.5%)置于带密封性搅拌反应釜a内,加水调浆,液固比为:5:1,开启搅拌。
(2)锰酸锂还原浸出:将锰酸锂60kg(li:3.0%)置于密闭反应釜b内加水调浆,至液固比为3:1,开启搅拌调浆,再缓慢加入15%浓盐酸,盐酸的加入量为:浓盐酸与锰酸锂的总摩尔比为7:1,随着盐酸的加入,反应逐渐产生氯气。
(3)磷酸铁锂氧化浸出:向反应釜a中加入浓盐酸4kg至反应体系ph值为3.0左右,将步骤(2)产生的氯气导入反应釜a中进行氧化浸出,反应过程中补加2kg盐酸维持反应体系的ph值为3.0左右,检测溶液中无二价铁后,停止充入氯气。开启引风塔将剩余的氯气通过二级吸收塔内进行二级碱液吸收。
(4)固液分离:反应完全后,分别将反应釜a与反应釜b内的浸出浆料进行固液分离,反应釜a中的浆料压滤后,得到氯化锂浸出液和磷酸铁渣,将反应釜b中的浆料进行固液分离,得到锰酸锂浸出液和锰酸锂浸出渣,其锰酸锂浸出渣主要成分为碳渣。
(5)洗涤:将磷酸铁锂浸出渣分别用648l自来水洗涤,洗涤水温度为:25℃,洗涤时间为1.5h,洗涤后得到磷酸铁渣湿渣以及洗涤液,洗涤液返回反应釜a中循环使用,将锰酸锂浸出渣用137l自来水洗涤,洗涤水温度为:25℃,洗涤后得到碳渣以洗涤液,洗涤液返回反应釜b中进行循环利用。
(6)中性除杂:将磷酸铁锂浸出液与锰酸锂浸出液合并后得含锂溶液648l,缓慢加入31%液碱溶液至反应体系的ph值为7.0,过滤得中性除杂液640l。
(7)碱性除杂:将步骤(6)中的中性除杂液640l用15%液碱溶液调至反应体系的ph值为14,除去溶液中锰等杂质离子。
(8)浓缩析钠:将步骤(7)得到的含锂溶液加热蒸发浓缩至溶液中li+浓度为30g/l,蒸发浓缩温度为103℃,溶液过滤后得到含锂溶夜233l,其中li含量22g/l。
(9)沉锂:将45kg纯碱固体加入至225l纯水中搅拌溶解(na2co3含量为200g/l),过滤,用0.8kg液碱调节溶液中的ph为13,再向纯碱溶液中加入0.2kg乙二胺四乙酸(edta),edta的量为溶液中的钙离子摩尔量的1.5倍,开启搅拌升温,在温度95℃下,缓慢加入步骤(8)得到的含锂溶液233l,搅拌反应1.0h,经离心分离、洗涤、干燥得到电池级碳酸锂27.09kg。
经计算,该实施例中锂的综合回收率为96.03%,具体回收数据见下述表1,而碳酸锂的化学成分分析具体见下述表2,该碳酸锂质量满足ys/t582—2006电池级标准要求。
实施例5
本具体实施例为对不同类型废旧锂电池前端物理拆解回收得到的锰酸锂和磷酸铁锂正极材料进行综合回收利用,其大致步骤可见附图1,图1为其工艺流程图,具体步骤为:
(1)磷酸铁锂粉调浆:将100kg磷酸铁锂粉料(li:3.3%)置于带密封性搅拌反应釜a内,加水调浆,液固比为:6:1,开启搅拌。
(2)锰酸锂还原浸出:将锰酸锂30kg(li:3.5%)置于密闭反应釜b内加水调浆,至液固比为1:1,开启搅拌调浆,再缓慢加入10%浓盐酸,盐酸的加入量为:浓盐酸与锰酸锂的总摩尔比为8:1,随着盐酸的加入,反应逐渐产生氯气。
(3)磷酸铁锂氧化浸出:向反应釜a中加入浓盐酸1kg至反应体系ph值为4.0左右,将步骤(2)产生的氯气导入反应釜a中进行氧化浸出,反应过程中补加2kg盐酸维持反应体系的ph值为4.0左右,检测溶液中无二价铁后,停止充入氯气。开启引风塔将剩余的氯气通过二级吸收塔内进行二级碱液吸收。
(4)固液分离:反应完全后,分别将反应釜a与反应釜b内的浸出浆料进行固液分离,反应釜a中的浆料压滤后,得到氯化锂浸出液和磷酸铁渣,将反应釜b中的浆料进行固液分离,得到锰酸锂浸出液和锰酸锂浸出渣,其锰酸锂浸出渣主要成分为碳渣。
(5)洗涤:将磷酸铁锂浸出渣分别用347l自来水洗涤,洗涤水温度为:45℃,洗涤时间为0.5h,洗涤后得到磷酸铁渣湿渣以及洗涤液,洗涤液返回反应釜a中循环使用,将锰酸锂浸出渣用123l自来水洗涤,洗涤水温度为:45℃,洗涤后得到碳渣以洗涤液,洗涤液返回反应釜b中进行循环利用。
(6)中性除杂:将磷酸铁锂浸出液与锰酸锂浸出液合并后得含锂溶液723l,缓慢加入31%液碱溶液至反应体系的ph值为6.8,过滤得中性除杂液715l。
(7)碱性除杂:将步骤(6)中的中性除杂液715l用15%液碱溶液调至反应体系的ph值为14,除去溶液中锰等杂质离子。
(8)浓缩析钠:将步骤(7)得到的含锂溶液加热蒸发浓缩至溶液中li+浓度为25g/l,蒸发浓缩温度为107℃,溶液过滤后得到含锂溶夜155l,其中li含量27g/l。
(9)沉锂:将40kg纯碱固体加入至178l纯水中搅拌溶解(na2co3含量为225g/l),过滤,用2.5kg液碱调节溶液中的ph为14,再向纯碱溶液中加入0.35kg乙二胺四乙酸(edta),edta的量为溶液中的钙离子摩尔量的1.8倍,开启搅拌升温,在温度80℃下,缓慢加入步骤(8)得到的含锂溶液178l,搅拌反应1.5h,经离心分离、洗涤、干燥得到电池级碳酸锂22.74kg。
经计算,该实施例中锂的综合回收率为98.2%,具体回收数据见下述表1,而碳酸锂的化学成分分析具体见下述表2,该碳酸锂质量满足ys/t582—2006电池级标准要求。
表1.废旧锰酸锂与磷酸铁锂正极材料各实施例锂综合回收率
表2.各实施例得到电池级碳酸锂产品主含量及各杂质指标
以上描述了本发明的主要技术特征和基本原理及相关优点,对于本领域技术人员而言,显然本发明不限于上述示范性具体实施方式的细节,而且在不背离本发明的构思或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将上述具体实施方式看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。
此外,应当理解,虽然本说明书按照各实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施方式中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
- 还没有人留言评论。精彩留言会获得点赞!