一种纳米碳化二钼材料及其制备方法和应用
1.本发明属于功能材料及其合成技术领域,具体涉及一种纳米碳化二钼材料及其制备方法和应用。
背景技术:
2.碳化二钼属于一种过渡金属碳化物陶瓷材料,具有很高的机械强度和很强的耐腐蚀性,起初主要作为磨料被用于机械加工领域。随着更加深入的研究,人们发现碳化二钼还具有很高的催化活性。直到今天,碳化二钼材料已经在各种催化细分领域被广泛研究。
3.氢能是一种清洁燃料,是国家“双碳”目标下重点发展的新能源。在主流的制氢技术中,电解水制氢以其高效、环保的特点广受关注。电解水的主要成本来源为电能,在电解过程中使用催化剂可有效降低析氢过电位,达到节约电能的目的。pt/c已经作为商用的析氢催化剂在电解水产业中被广泛使用,但其价格较高,无形中增加了电解水制氢的成本。研究表明碳化二钼具有类pt的电子结构,具有很高的电催化析氢活性。
4.碳化二钼材料的合成过程往往需要900℃以上的高温条件,制备出的碳化二钼材料容易烧结成块,不能提供足够多的活性位点催化析氢过程。另外,在一些基于气相碳源的合成方法中,如专利cn111841593a公开了一种碳化钼基催化剂,气相碳(ch4)的使用容易使碳化二钼材料表面“积碳”,影响其催化活性。进一步探索和优化碳化二钼基材料及其制备工艺,具有重要的研究和应用意义。
技术实现要素:
5.本发明的主要目的在于针对现有技术存在的问题和不足,提供一种纳米碳化二钼材料及其制备方法,有效解决现有碳化钼基催化剂存在的易烧结和表面“积碳”等问题,表现出优异的电催化析氢性能;且涉及的制备方法较简单、反应条件温和,所得产物纯度高,适合推广应用。
6.为实现上述目的,本发明采用的技术方案为:
7.一种纳米碳化二钼材料的制备方法,包括如下步骤:
8.1)将moo3粉与无机盐磨混合均匀,得mo源前驱体;
9.2)将mo源前驱体和固相碳源分开置于含有高温区和低温区的反应装置中;将mo源前驱体置于低温区,固相碳源置于高温区;
10.3)通入载气,气氛炉加热至高温区的温度为800~1100℃,低温区温度为400~800℃;冷却,取出高温区处的产物,即得所述纳米碳化二钼材料。
11.优选的,所述高温区的温度为800~900℃。
12.上述方案中,所述无机盐包括nacl、kcl、cacl2、kbr、nabr中的一种或几种。
13.上述方案中,所述固相碳源包括碳纳米管、石墨烯、碳纤维、活性炭粉末等中的一种或几种。
14.上述方案中,所述碳纳米管直径外径为20~200nm、内径2~50nm;石墨烯片径为
0.5~5μm,厚度为0.8~2nm;碳纤维直径为0.1~10μm;活性炭粉末的粒径为5~50μm。
15.上述方案中,所述无机盐与moo3粉末的质量比为1:(0.25~10);固相碳源与moo3粉的质量比为1:(10~200)。
16.上述方案中,所述反应装置可选用气氛炉等。
17.上述方案中,步骤3)中所述载气为氩气、氮气、氦气、氢气等中的一种或几种;其流量为20~200sccm。
18.上述方案中,步骤3)中所述高温区的升温速率为1~200℃/min。
19.优选的,所述高温区升温速率为15~50℃/min。
20.上述方案中,步骤3)中所述低温区的升温速率为1~200℃/min。
21.优选的,所述低温区升温速率为10~50℃/min。
22.上述方案中,步骤3)中所述低温区温度控制在450~800℃;其温度低于同时期高温区温度。
23.优选的,所述低温区温度为500~600℃。
24.上述方案中,所述保温反应时间为5min~10h。
25.优选的,所述保温时间为0.5~2h。
26.根据上述方案制备得到纳米碳化二钼材料,它以固相碳源为碳源和模板,通过转变固相碳源中的单质碳得到:通过“自蔓延反应”转变碳模板中的单质碳形成碳化二钼纳米晶(粒径为80~150nm),并进一步堆叠而成,宏观形貌与固相碳源模板相关;通过采用不同形貌的固体碳源模板即可实现对碳化二钼基材料宏观形貌的可控调节,并可有效解决使用气相碳源引起的碳化二钼材料表面“积碳”等问题,同步实现单相碳化二钼材料(或高纯碳化二钼材料与碳复合材料)的高效制备,可为高性能碳化二钼基材料的制备提供一条新思路。
27.将根据上述方案制备的纳米碳化二钼材料应用于电催化领域,其可以作为析氢催化剂涂覆在电极表面来制备电催化析氢电极。
28.与现有技术相比,本发明的有益效果为:
29.1)采用固相碳源作为碳模板,同时利用moo3和nacl生成的气相中间体(moo2cl2)作为钼源,可实现碳模板中的碳单质到碳化二钼的快速转变,显著缩短反应时间;同时制备得到的碳化二钼材料无杂质,无需进一步提纯;可有效改善纳米碳化二钼材料在高温下易烧结团聚等问题,有效避免使用气相碳源引起的碳化二钼材料表面“积碳”等问题;同时通过采用不同形貌固体碳源模板的简单手段即可实现对碳化二钼基材料形貌的可控调节;
30.2)本发明涉及的制备方法简便,所用原料简单易得,副产物少,产物纯度较高(单相碳化二钼),适合大规模生产;
31.3)该方法制备出的纳米碳化二钼材料具有良好的电催化析氢性能,优于大部分碳化二钼电催化剂,在电解水制氢领域有非常广阔的应用前景。
附图说明
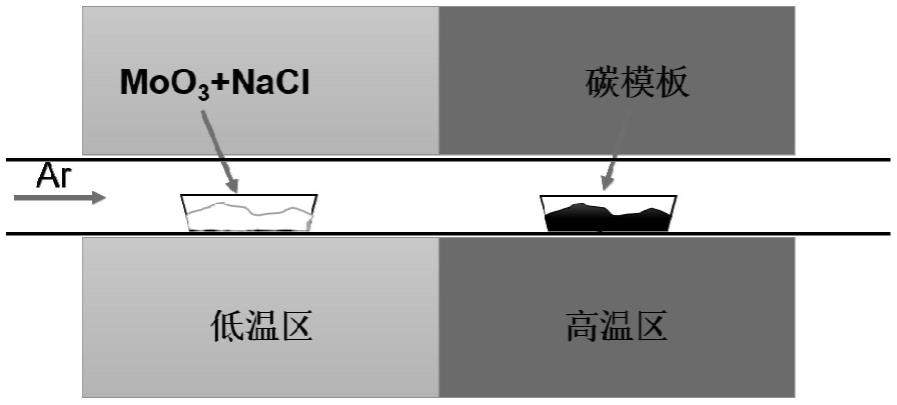
32.图1为本发明所述纳米碳化二钼材料的制备流程示意图;
33.图2为本发明实施例1~4制备得到的纳米碳化钼材料的xrd图谱;
34.图3为本发明实施例1制备得到的纳米碳化钼材料的扫描电镜图;
35.图4为本发明实施例2制备得到的纳米碳化钼材料的扫描电镜图;
36.图5为本发明实施例2制备得到的纳米碳化钼材料的透射电镜图和元素分布图;
37.图6为本发明实施例3制备得到的纳米碳化钼材料的扫描电镜图;
38.图7为本发明实施例4制备得到的纳米碳化钼材料的扫描电镜图;
39.图8为本发明实施例1、3、4制备得到的纳米碳化钼材料在1m koh溶液中的电催化析氢反应极化曲线图;
40.图9为本发明实施例1、3、4制备得到的纳米碳化钼材料在1m koh溶液中的tafel斜率图;
41.图10为本发明对比例1制备得到的材料的xrd图谱;
42.图11为本发明对比例2制备得到的碳化钼材料的xrd图谱。
具体实施方式
43.下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
44.实施例1
45.一种纳米碳化二钼材料,其制备流程示意图见图1,具体包括如下步骤:
46.1)将700mg三氧化钼和300mg氯化钠研磨混合均匀,得到mo源前驱体;
47.2)将mo源前驱体和10mg晶须碳纳米管(外径为80~150nm,内径为5~10nm)分别置于如图1所示的坩埚中,随后将坩埚放进管式炉中,使mo源前驱体置于位于上风向的非加热区(该位置已用温度计校准,当中心加热区温度为900℃时,此处温度刚好为500~600℃)、晶须碳纳米管置于下风向的中心加热区;
48.3)通入流量为80sccm的氩气后将管式炉以15℃/min的升温速率升温至高温区温度为900℃,保温时间为1h;自然冷却到室温后取出反应后的管式炉中心加热区产物,即得最终产物。
49.本实施例所得产物的xrd图谱见图2;结果表明所得产物为纯相碳化二钼。
50.图3为本实施例所得产物的扫描电镜图,结果表明,与原始晶须碳纳米管较光滑的表面不同,制备出的碳化二钼晶须碳纳米管由一个个小纳米晶堆积而成,且表面比较粗糙,晶须碳纳米管直径(外径)为80~200nm,纳米晶尺寸为80~150nm。
51.称取5mg本实施例所得产物分散于1ml异丙醇中,并滴入20μlnafion溶液,超声30min后滴到碳布上烘干制备成析氢电极,放入1m koh中进行测试,测得的电催化析氢反应极化曲线和tafel斜率图分别如图8和图9所示。结果表明:当电流密度为10macm-2
时,析氢反应过电位仅为99mv,而其tafel斜率仅为56mv dec-1
,证明其有很好的电催化析氢性能。
52.实施例2
53.一种纳米碳化二钼材料,其制备方法与实施例1大致相同,不同之处在于将实施例1中高温区温度变成800℃,低温区温度保持不变。
54.图2中的xrd图谱显示本实施例制得的产物为石墨碳和碳化二钼复合材料,图4中的扫描电镜图可以看到产物几乎保持了晶须碳纳米管原本的形貌。
55.图5中的tem图(a-c)为本实施例所得产物(保温反应1h后)中不同位置观察到的某三个完整形貌晶须碳纳米管的反应状态图,可以看到晶须碳纳米管原本光滑的表面沿着轴向逐步变得粗糙。图5d为图5b所得产物的元素分布图,可以看出碳化二钼仅存在于晶须碳纳米管粗糙的一端;表明碳化二钼的形成存在沿晶须碳纳米管的轴向从一端“自蔓延反应”反应到另一端的反应过程。
56.实施例3
57.一种纳米碳化二钼材料,其制备方法与实施例1大致相同,不同之处在于将实施例1中10mg晶须碳纳米管替换成16mg碳纤维(直径4~8μm)。
58.图2所述xrd图谱显示本实施例所得产物为石墨碳和碳化二钼复合相;图6中的扫描电镜图显示碳纤维被一层多孔碳化二钼包裹,晶粒大小为80~200nm,孔洞大小为100~200nm。
59.参考实施例1所述方法,测得本发明所得产物的电催化析氢反应极化曲线和tafel斜率图分别如图8和图9所示。结果表明:当电流密度为10macm-2
时,析氢反应过电位仅为115mv,而其tafel斜率仅为62mv dec-1
。
60.实施例4
61.一种纳米碳化二钼材料,其制备方法与实施例1大致相同,不同之处在于将实施例1中10mg晶须碳纳米管固相碳源换成10mg石墨烯(片径1~5μm)。
62.图2中的xrd图谱显示本实施例所得产物为纯相碳化二钼;图7中的扫描电镜图可以看到沿石墨烯生长的碳化二钼纳米晶堆积成片状,纳米晶尺寸为80~150nm。
63.参考实施例1所述方法,测得本发明所得产物的电催化析氢反应极化曲线和tafel斜率图分别如图8和图9所示。结果表明:当电流密度为10macm-2
时,析氢反应过电位仅为150mv,而其tafel斜率仅为63mv dec-1
。
64.对比例1
65.一种碳化二钼材料,其制备方法与实施例1大致相同,不同之处在于控制其高温区温度为700℃,低温区温度保持不变。
66.本对比例所得产物的xrd图见图10,结果表明在该温度下制备出的材料为moo2,不能制备出碳化二钼材料。
67.对比例2
68.一种碳化二钼材料,其制备方法与实施例1大致相同,不同之处在于将实施例1中晶须碳纳米管固相碳源与mo源前驱体混合后一同放置于高温区。
69.图11为本对比例所得产物的xrd图,结果表明:所得产物中物相除mo2c外,还包含nacl、mo、moo2等杂相。
70.上述实施例仅是为了清楚地说明所做的实例,而并非对实施方式的限制。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或者变动,这里无需也无法对所有的实施方式予以穷举,因此所引申的显而易见的变化或变动仍处于本发明创造的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1