桥粒芯糖蛋白2(DSG2)结合蛋白质及其用途的制作方法
本申请要求2012年9月25日提交的美国临时专利申请系列No.61/705,523的权益,该申请的全部内容以引用方式并入本文。
政府权利的声明
本发明是在美国国立卫生研究院(the National Institutes ofHealth)授予的R01CA080192和RO1HLA078836下由美国政府资助而作出的。在本发明中,美国政府具有某些权利。
背景技术:
人类腺病毒(Ad)已经分成6种类型(A至F),目前包含51种血清型。大部分的Ad血清型使用了柯萨奇病毒蛋白受体(CAR)作为主要的附着受体(Bergelson et al.,1997)。但是,B类Ad血清型不这样。最近,我们基于它们受体的使用,研究了新的一组B类Ad(Tuve et al.,2006)。1组(Ad16,21,35,50)几乎专门使用CD46作为受体;2组(Ad3,Ad7,14)共用一个或多个普通的未识别的受体,该受体并非为CD46并且其暂时命名为受体X;3组(Ad11)优选地与CD46相互作用,而且如果CD46被阻断,则还使用受体X。
B类Ad是常见的人类病原体。自从2005年以来,观察到在大部分的美国军事训练场中同时出现多种B类血清型。其包含血清型Ad3,Ad7和Ad14(Metzgar et al.,2007)。在2007年,已经在美国和亚洲的多处发现一种新型的高度致病的毒株且可能更有毒的毒株Ad14(Ad14a)(Louie et al.,2008;Tate et al.,2009)。近来,根据Ad14a的受体的使用,我们证明Ad14a属于B类2组Ad(Wang et al.,2009)。总而言之,所有使用受体X的血清型(Ad3,Ad7,Ad14,Ad14a,和Ad11)在本文中均称为AdB-2/3。
AdB-2/3作为基因转移载体与上皮起源的肿瘤(其代表了大部分的实体肿瘤)具有显著的相关性(Yamamoto and Curiel,2010)。上皮细胞保持了多种细胞间连接和顶底极性。上皮细胞的重要特征在原位上皮癌和癌细胞系中是保守的(Turley et al.,2008)。CAR和CD46通常陷于上皮癌细胞的紧密和粘附连接中,并且未接近使用这些附着受体的Ad(Coyne and Bergelson,2005;Strauss et al.,2009)。相反,AdB-2/3高效地感染上皮癌细胞,这是部分通过诱导可以想象的上皮细胞向间充质细胞转化(EMT)的过程来实现的(Strauss et al.,2009)。AdB-2/3的另一个与众不同的特征是它们能够在复制过程中产生亚病毒十二面体颗粒,其由Ad纤维和五邻体基体组成(Norrby et al.,1967)。五邻体-十二面体(PtDd)不能由全长的五邻体基体蛋白质组装,但是必须在残基37和38之间通过蛋白质水解自发地进行N-末端截短(Fuschiotti et al.,2006)。该切割位点在Ad3,Ad7,Ad11和Ad14中是保守的,但是在Ad2和Ad5中不存在。在Ad3的情况下,以大量过量的5.5×106PtDd/感染病毒的量形成PtDd(Fender et al.,2005),并且已经表明PtDd通过破坏细胞间连接而增强Ad3的感染性,由此有利于病毒的传播(Walters et al.,2002)。
发明概述
在一个方面中,本发明提供了分离的多肽,其包含SEQ ID NO:1-11的任意一项所述的氨基酸序列。在另一个方面中,本发明提供了重组AdB-2/3纤维多肽,其包含:
(a)一个或多个AdB-2/3纤维多肽杆结构域或其功能等价物;
(b)与一个或多个AdB-2/3纤维多肽杆结构域可操作地连接的并且位于该AdB-2/3纤维多肽杆结构域的C-末端的AdB-2/3纤维多肽球结构域,其中所述的AdB-2/3纤维多肽球结构域包含任意一个SEQ ID NO:1-11的多肽;以及
(c)与一个或多个AdB-2/3纤维多肽杆结构域可操作地连接的并且位于该AdB-2/3纤维多肽杆结构域的N-末端的一个或多个非AdB-2/3衍生的二聚化结构域。在一个实施方案中,AdB-2/3纤维多肽不包含AdB-2/3纤维多肽尾部结构域。在另一个实施方案中,每个球结构域均选自Ad3纤维多肽球结构域,Ad7纤维多肽球结构域,Ad11纤维多肽球结构域,Ad 14纤维多肽球结构域,Ad14a纤维多肽球结构域,它们的组合以及它们的功能等价物。在另一个实施方案中,每个球结构域均包含SEQ ID NO:112-18的任意一项的氨基酸序列或它们的组合。在另一个实施方案中,二聚化结构域包含选自SEQ ID NO:24和SEQ ID NO:25中的氨基酸序列。在另一个实施方案中,重组AdB-2/3纤维多肽包含或由SEQ ID N0:28-34的任意一项的氨基酸序列组成。在另一个实施方案中,AdB-2/3纤维多肽是多聚化的,例如二聚化的。在另一个实施方案中,AdB-2/3纤维多肽进一步包含与重组的AdB-2/3纤维多肽缀合的一种或多种化合物,例如治疗剂、诊断剂和成像剂。
在另一个方面中,本发明提供了分离的核酸,其编码本发明的分离的肽或重组AdB-2/3纤维多肽,本发明提供了包含分离的核酸的重组表达载体,以及包含重组表达载体的宿主细胞。
在另一个实施方案中,本发明提供了药物组合物,其包含:
(a)本发明的任意一个实施方案或实施方案的组合的AdB-2/3纤维多聚体;以及药物可接受的载体。
在另一个方面中,本发明提供了用于增强治疗性治疗或诊断与上皮组织有关的紊乱,和/或将上皮组织成像的方法,其包含向有需要的受试对象给予:
(a)足以治疗所述的紊乱的量的一种或多种治疗剂、足以诊断所述的紊乱的量的诊断剂,和/或足以将上皮组织成像的量的成像剂;以及
(b)足以增强一种或多种治疗剂、诊断剂和/或成像剂的效力的量的、本发明的任意一个实施方案或实施方案的组合的AdB-2/3纤维多聚体或药物组合物。
与上皮组织有关的此类示例性紊乱包含实体肿瘤,肠易激综合征,炎性肠病,Crohn病,溃疡性结肠炎,便秘,胃食管反流病,Barrett食管炎,慢性阻塞性肺病,哮喘,支气管炎,肺气肿,囊肿性纤维化,间质性肺病,肺炎,原发性肺动脉高压,肺栓塞,肺结节病,肺结核,胰腺炎,胰管紊乱,胆管梗阻,胆囊炎,胆总管结石病,脑功能障碍,银屑病,皮炎,血管球性肾炎,肝炎,糖尿病,甲状腺疾病,蜂窝组织炎,感染,肾盂肾炎,和胆结石。
在另一个方面中,本发明提供了用于治疗与上皮组织有关的紊乱的方法,其包含向有需要的受试对象给予足以治疗所述的紊乱的量的、本发明的任意一个实施方案或实施方案的组合的AdB-2/3纤维多聚体或药物组合物。在示例性的实施方案中,此类紊乱可以为病毒感染或适体重量。
在另一个实施方案中,本发明提供了用于改善化合物向上皮组织的传递的方法,其包含将上皮组织与一种或多种待传递至上皮组织的化合物、以及足以增强一种或多种化合物传递至上皮组织的量的、本发明的任意一个实施方案或实施方案的组合的AdB-2/3纤维多聚体或药物组合物相接触。在示例性的实施方案中,一种或多种化合物可以为诊断剂或成像剂。
在另一个方面中,本发明提供了用于改善物质向表达桥粒芯糖蛋白2(DSG2)的组织的传递的方法,其包含将所述的表达DSG2的组织与以下物质相接触:
(a)一种或多种待传递至所述的组织的化合物;以及
(b)足以增强一种或多种化合物传递至所述的组织的量的、本发明的任意一个实施方案或实施方案的组合的AdB-2/3纤维多聚体或药物组合物。
在另一个方面中,本发明提供了在组织中用于诱导上皮细胞向间充质细胞转化(EMT)的方法,其包含将所述的上皮组织与足以诱导EMT的量的、本发明的任意一个实施方案或实施方案的组合的AdB-2/3纤维多聚体或药物组合物相接触。
在另一个方面至,本发明提供了用于识别候选化合物的方法,其中所述的候选化合物用于以下的一种或多种:治疗与上皮组织有关的紊乱;改善物质向上皮组织的传递;改善物质向表达DSG2的组织的传递;在组织中诱导EMT;和/或治疗AdB-2/3感染,所述的方法包含:
(a)在促进多聚体与DSG2结合的条件下,将本发明的任意一种实施方案或实施方案的组合的AdB-2/3纤维多聚体与DSG2相接触,其中所述的接触是在一种或多种测试化合物存在下实施的;以及
(b)识别与AdB-2/3纤维多聚体竞争性结合DSG2的阳性测试化合物(与对照相比);
其中阳性测试化合物为用于以下一种或多种的候选化合物:治疗与上皮组织有关的紊乱;改善物质向上皮组织的传递;改善物质向表达DSG2的组织的传递;在组织中诱导EMT;和/或治疗AdB-2/3感染。
附图说明
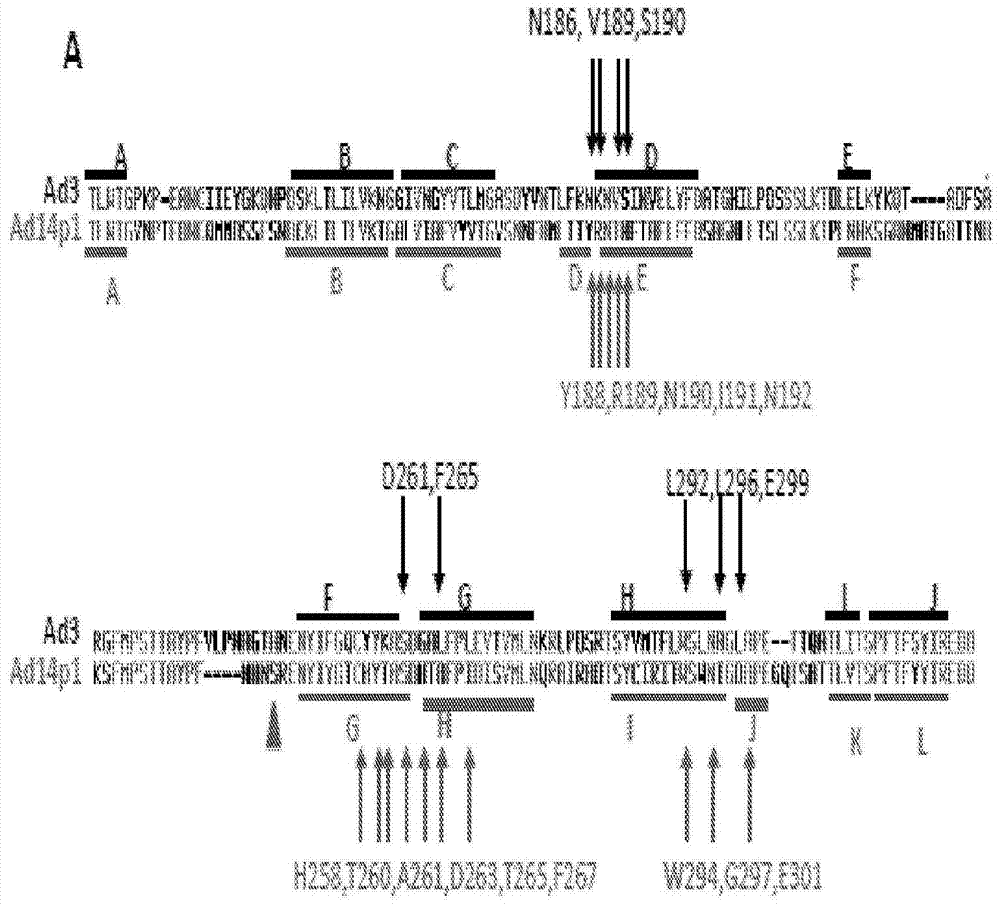
图1.所发现的重要地涉及与DSG2结合的残基。A)示出了Ad3和Ad14p1纤维球的氨基酸序列。在Ad3球(PDB编号1H7Z_A)和Ad14球(PDB:3F0Y_A)中出现的β折叠用横线表示。黑色箭头表示在Ad3纤维球中的残基,当该纤维球单独突变时,将消除或减少与DSG2的结合。与亲本毒株Ad14(deWit)相比,Ad14p1在纤维蛋白球(24)的FG环内删除了2个氨基酸残基,用三角形表示。B)二聚的Ad3纤维球突变体的示意性结构。纤维球结构域和一个杆基元通过挠性连接体与同源二聚化的K卷曲结构域融合(41)。所述的蛋白质发生自体二聚化,并且可以通过His-Ni-NTA亲和色谱法纯化。C-F)二聚化的Ad3纤维球突变体与可溶性DSG2的结合分析。C和D)考马斯染色。每个泳道中加载10μg纯化的Ad3纤维球(未煮沸的)。箭头表示三聚体形式的纤维球。凝胶包含SDS和含有DTT的上样缓冲剂,如之前所报告(41),DTT使三聚体纤维球的二聚体解聚。E和F)使用可溶性重组DSG2作为探针、然后使用抗DSG2-mAb和抗小鼠IgG-HRP的Western印迹。为了比较,显示JO-1(0.5μg/泳道)。扫描Western印迹并对信号定量。
图2.Ad3纤维球的3D模型。该结构是基于PDB编号1H7Z_A。上方面板:与DSG2结合有关的4个重要的区域。重要的残基示于三聚体纤维球的等值面上。面对受体,由顶部(顶面)观察。下方面板:结合的所有重要的残基。右侧:在微小的侧向旋转后,沟槽的放大照片。
图3.Ad3病毒被二聚化的Ad3球突变体的竞争。A)在二聚的纤维球突变体存在下3H-标记的Ad3病毒的相对附着。将1.8x 105HeLa细胞与浓度为2.5和100μg/ml的Ad3球突变体在冰上温育1小时。然后以400pfu/细胞将3H-Ad3病毒加在冰上,在温育1小时。洗掉未结合的病毒。将与PBS温育的病毒颗粒的附着作为100%。N=3。B)在HeLa细胞上Ad3-GFP病毒感染的竞争。将1.5x 105HeLa细胞接种于24孔板中。在浓度升高的条件下,将细胞与Ad3球突变体在室温下温育1小时。然后,加入以100pfu/细胞加入Ad3-GFP病毒,并且在18小时后,通过流式细胞仪分析GFP的表达。左侧面板:GFP阳性细胞的百分率。右侧面板:平均荧光强度。N=3。标准偏差低于10%。C)在具有多个突变的二聚的纤维球突变体存在下,3H-标记的Ad3病毒的相对附着。如B)中所述来实施该研究。标准偏差低于10%。D)在HeLa细胞上Ad3-GFP病毒感染的竞争。如C)中所述来实施该研究。标准偏差低于10%。
图4.与可溶性CD46结合的Ad3纤维球的分析。包含不同数量的杆基元的Ad3纤维球和野生型Ad3纤维球(泳道1:Ad3-S6/Kn,泳道2:Ad3-S5/Kn,泳道3:Ad3-S4/Kn,泳道4:Ad3-S3/Kn,泳道5:Ad3-S2/Kn,泳道6:Ad3-S/Kn)、JO-1(泳道7)和结合CD46的Ad35纤维球(泳道8)被印迹,并与可溶性DSG2(上方面板)和可溶性CD46(下方面板)杂交。通过抗DSG2mAb或抗CD46mAb来检测结合情况。
图5.DSG2结合降低与打开上皮连接的能力之间的相关性。A)在极化的结肠癌T84细胞上测量的跨上皮电阻(TEER)。在Transwell小室中培养细胞,直至TEER恒定,即形成紧密的连接。然后,在1小时内将总计为5μg的二聚化的Ad3纤维球(处于PBS中)加入至顶部小室中。在所示的时间点测量TEER。N=6。对于时间点1.5和4小时而言,JO-1与D261N和N186D之间的差异是显著的(p<0.01)。箭头表示加入和除去Ad3纤维球。B)依立替康治疗的增强。将总计4x106A549细胞皮下注射至CB17-SCID/beige小鼠中。一旦肿瘤的体积达到~100mm3(移植后15天),对小鼠静脉注射2mg/kg JO-1,E299V,N186D,或PBS,然后在1小时后静脉注射依立替康(37.5mg/kg)。在第25天重复治疗。N=5。“依立替康”与“E299V+依立替康”组、或者“依立替康”与“N186+依立替康”组之间的差异不显著。从第20天开始,“依立替康”与“JO-1+依立替康”之间的差异显著(p<0.01)。
图6.增加与DSG2结合的氨基酸的取代。A)示出了Ad3纤维球的氨基酸序列。β折叠由横线表示。箭头表示Ad3纤维球内的残基,当其发生突变时,在集落印迹检测中将产生更强的信号,表明与DSG2的结合更强。B)3个球单体的等值面。左侧面板:由顶部观察;右侧面板:由侧面观察。在顶部,V239和Y250未暴露,表明球的结构改变,而未涉及与DSG2的直接结合。C)增强与DSG2结合的所有突变的位置。在2个球单体中,用洋红色显示残基。1个单体的等值面用灰色透明来显示。
图7.非二聚化的Ad3纤维球与DSG2的相互作用的SPR分析。A)将DSG2固定在传感器芯片上,并由控制液体池中自动减去背景。在3分钟内注射2.5μg/ml的Ad3纤维球(w/o二聚化结构域:“noDD”),然后为2.5分钟的解离时间。B)SPR数据的总结。注射浓度范围为2.5至10μg/ml的球,并使用BIAeval软件来评价动力学和亲和性参数。将提取的值收回至表中。Wt=不具有突变的Ad3纤维球。
图8.Ad3纤维球突变体JO-2的电子显微镜检查和3D结构。A-C)使用SST对JO-2进行负染色。可以看见二聚的形式,但是更高级的组织也是可见的,大约50nm的异源复合物用细箭头绘出,并且更小的规则的“十二面体样”的颗粒用粗箭头绘出。特写视图示于B和C中。D-G)非二聚化形式的(K217E/F224S突变体)的晶体学结构。D)蛋白质晶体。E)野生型Ad3球用灰色填色,而EF环217-224单独填色。该EF环217-224为突变体中变得无序的环。在突变体结构中,这些残基是不稠密的。F)突变体以草图显示。G)这2个结构叠图显示EG环在K217E/F224S突变体中是完全无序的。底部面板显示1个单体的特写视图。K217和F224似乎是树枝状的。
图9.对DSG2的亲和性增加的、二聚的Ad3纤维球突变体的分析。A)在HeLa细胞上Ad3-GFP病毒感染与二聚的亲和性增强的突变体Y250F和JO-1(二聚的wtAd3纤维球)的竞争。试验环境如图3C中所述。左侧面板:GFP阳性细胞的百分率。右侧面板:平均荧光强度。N=3。标准偏差低于10%。B)在HeLa细胞上,Ad3-GFP病毒感染与Ad3球突变体(其与DSG2的结合增强,但不具有二聚化结构域)的竞争。将1.5x 105HeLa细胞接种至24孔板中。将细胞与浓度增加的Ad3球突变体在室温下温育1小时。然后,以100pfu/细胞加入Ad3GFP病毒,并在18小时后分析GFP的表达。C)在结肠癌T84细胞上的TEER。试验环境与图5A中相同。示出4小时时的TEER。N=3。
图10.亲和性增强的JO-1形式与化疗的组合。A)依立替康(I)治疗的增强。试验环境与图5B中相同。从第20天开始,“JO-1+I”与“JO-2+依立替康”组、以及“JO-2+I”与“JO-4+I”组之间的差异显著。N=5。B)在卵巢癌模型中,JO-4在低于JO-1的剂量下增强了PLD的治疗。由原发性卵巢癌ovc316细胞建立乳房脂肪垫肿瘤。当肿瘤体积达到100mm3时开始治疗。使用2mg/kg JO-1或0.5mg/kg JO-4静脉注射小鼠,然后在1小时后,静脉注射PEG化的脂质体阿霉素(PLD)(1mg/kg)。C)在预后差的三阴性乳腺癌(TNBC)中,JO-4增强了治疗。将总计4x106TNBC MDA-MB-231细胞注射至CB17SCID-beige小鼠的乳房脂肪垫中。静脉注射JO-4(2mg/kg),1小时后,使用西妥昔单抗(C)(10mg/kg,i.p.)和紫杉醇(nab-P)(5mg/kg,i.v)。每周给予治疗,N=10。在第25天时,nab-P+C与JO-4+nab-P+C的P<0.01。
图11.JO-4的药代动力学、毒性和免疫原性。A)JO-1和JO-4的血清清除。使用JO-1或O-4(2mg/kg)静脉注射具有皮下TC1-hDSG2肿瘤(~600mm3)的hDSG2转基因小鼠,并通过ELISA分析血清样品。N=3。注意y轴具有对数坐标。B)在注射JO-1或JO-4后在hDSG2/TC1-hDSG2转基因小鼠中淋巴细胞和血小板的计数。N=3。C)在具有TC1-hDSG2肿瘤的免疫活性hDSG2转基因小鼠中的治疗研究。当肿瘤体积达到~80mm3时,静脉注射JO-1或JO-4(2mg/kg)、或者PBS,1小时后注射PLD/Doxil(i.v.1.5mg/kg)。如箭头所示来重复治疗。然后,使肿瘤再生长大约2周。从第15天开始,通过ELISA检测血清抗JO-1/J)-4抗体。在第28天和第35天实施2个治疗周期。在多个治疗周期后,即使在可检测的抗体存在下,JO-1和JO-4是持续有效的。从第31天开始,JO-1/PLD与O-4/PLD之间的差异是显著的。N=10。
图12.纤维球序列的比对。显示消除/降低Ad3球与DSG2结合的残基。
图13.由人类和接种加强针的小鼠得到的血清不能抑制JO-4的活性。A)通过ELISA分析人类血清与JO-4的结合。使用对抗Ad3纤维球的兔多克隆抗体用于捕获,然后使用重组JO-1蛋白质、人类血清(1:20至1:1000稀释)和抗人类IgG-HRP。IgG被耗尽的商业人类Ab血清用作阴性对照(水平线)。由通常从事Ad3病毒工作的科学家得到的血清用作阳性对照。P1至P38为用于卵巢癌患者(得自the Pacific卵巢癌Research Consortium)的血清样品。
发明详述
所有引用的参考文献均以引用方式全文并入本文。在本申请中,除非另作说明,所用的技术可以在多个公知的参考文献的任意一个中找到,例如Molecular Cloning:A Laboratory Manual(Sambrook,et al.,1989,Cold Spring Harbor Laboratory Press),Gene Expression Technology(Methods in Enzymology,Vol.185,edited by D.Goeddel,1991.Academic Press,San Diego,CA),“Guide to Protein Purification”in Methods in Enzymology(M.P.Deutshcer,ed.,(1990)Academic Press,Inc.);PCRProtocols:A Guide to Methods and Applications(Innis,et al.1990.Academic Press,San Diego,CA),Culture of Animal Cells:A Manual of Basic Technique,2nd Ed.(R.I.Freshney.1987.Liss,Inc.New York,NY),Gene Transfer and Expression Protocols,pp.109-128,ed.E.J.Murray,The Humana Press Inc.,Clifton,N.J.),and the Ambion 1998 Catalog(Ambion,Austin,TX)。
如本文所用,除非上下文中另外清除的说明,否则单数形式"a","an"和"the"可以包含复数的指代物。如本文所用,除非另外明确陈述,否则“和”可以与“或”交换使用。
如本文所用,氨基酸残基按如下缩写:丙氨酸(Ala;A),天冬酰氨(Asn;N),天冬氨酸(Asp;D),精氨酸(Arg;R),半胱氨酸(Cys;C),谷氨酸(Glu;E),谷氨酰胺(Gln;Q),甘氨酸(Gly;G),组氨酸(His;H),异亮氨酸(Ile;I),亮氨酸(Leu;L),赖氨酸(Lys;K),蛋氨酸(Met;M),苯丙氨酸(Phe;F),脯氨酸(Pro;P),丝氨酸(Ser;S),苏氨酸(Thr;T),色氨酸(Trp;W),酪氨酸(Tyr;Y),和缬氨酸(Val;V)。
如本文所用,缩写“Ad”是指腺病毒,并且其后通常为表明腺病毒血清型的数字。例如“Ad3”是指腺病毒血清型3。
除非上下文另外清楚地说明,否则本发明的任意一个方面的所有实施方案可以组合使用。
在第一个方面中,本发明提供了分离的多肽,其包含或由以下氨基酸序列组成:TLWTG(V/P)(N/K)P(----/T)(E/R)ANC(Q/I)(M/I)(M/E)(Y/A/N/D)(S/G)(S/K)(E/Q)(S/N)(N/P)D(C/S)KL(I/T)L(I/T)LVK(T/N)G(A/G)(L/I)V(T/N)(A/G)(F/Y)V(Y/T)(V/L)(I/M)G(V/A)
S(N/D)(N/D/Y)(F/V)N(M/T)L(T/F)(T/K)(Y/H/N)(R/K)N(I/V)(N/S)(F/I)(T/N)(A/V)EL(F/Y)FD
(S/A)(A/T)G(N/H)(L/I)L(T/P)(S/R/D)(L/S)SSLKT(P/D)L(N/E)X2X3(S/Y)(G/K)Q(N/T)(M/--)(A/--)(T/--)(G/--)A(I/L/D)X4(N/S)A(K/R)(S/G)FMPSTTAYPFX5(--/L)(N/P)(N/D/V)
(N/A)(S/G)(R/T)(E/H)(N/K/--)X6N X7I(Y/F)G(T/Q)C(H/Y)Y X8ASD(H/G/R)(T/A)(A/L)FP
(I/L)(D/E)(I/V)(S/T)VMLN(Q/R/K)R(A/L)(I/L/P)(R/N/D)(A/D/N/S)(D/E/R)TSY(C/V)(I/M)(R/T)(I/V/F)(T/L)WS(W/L)X9
(T/A)G(D/L/V)APE(G/V/--)(Q/--)T(S/T)(A/Q)(T/A)TL(V/I)
TSPFTF(Y/S)YIREDD(SEQ ID NO:1);其中
X2为H,L,或P;
X3为K或E;
X4为T,F,S,或L;
X5为V,D,或缺乏;
X6为E,G),或缺乏;
X7为Y或F;
X8为T,K,或E;以及
X9为N或S;
其中以下的至少一个是真实的:
X2为P;
X3为E;
X4为S,或L;
X5为D;
X6为G);
X7为F;
X8为E;或者
X9为S。
根据本发明的这一方面的分离的多肽包含突变体AdB-2/3球结构域,其可以用于生产例如重组AdB-2/3纤维多肽,与目前已知的DSG2结合多肽相比,所述的AdB-2/3纤维多肽对桥粒芯糖蛋白2(DSG2)提供了显著增强的亲和性。如以下实例中所示,并入了本发明该第一个方面的突变体球结构域的、本发明的重组AdB-2/3纤维多肽在用于治疗与上皮有关的紊乱中,与目前已知的DSG2结合多肽相比进一步显示出在治疗上是更有效的,例如在一系列癌症模型中具有改善的效力。此外,本发明的分离的肽还可以用作例如对抗AdB-2/3病毒的抗原。
在一个实施方案中,本发明的第一个方面的分离的多肽包含或由以下氨基酸序列组成:
TLWTG(V/P)(N/K)P(E/R)ANC(Q/I)(M/I)(M/E)(Y/A/N/D)(S/G)(S/K)(E/Q)(S/N)(N/P)D
(C/S)KL(I/T)L(I/T)LVK(T/N)G(A/G)
(L/I)V(T/N)(A/G)(F/Y)V(Y/T)(V/L)(I/M)G(V/A)S(N/D)
(N/D/Y)(F/V)N(M/T)L(T/F)(T/K)(Y/H/N)(R/K)N(I/V)(N/S)(F/I)(T/N)(A/V)EL(F/Y)FD(S/A)
(A/T)G(N/H)(L/I)L(T/P)(S/R/D)(L/S)SSLKT(P/D)L(N/E)X2X3(S/Y)(G/K)Q(N/T)A(I/L/D)
X4(N/S)A(K/R)(S/G)FMPSTTAYPF X5(--/L)(N/P)(N/D/V)(N/A)(S/G)(R/T)(E/H)(N/K/--)X6NX7I(Y/F)G(T/Q)C(H/Y)YX8ASD(H/G/R)(T/A)(A/L)FP(I/L)(D/E)(I/V)(S/T)VMLN(Q/R/K)R(A/L)(I/L/P)(R/N/D)(A/D/N/S)(D/E/R)TSY(C/V)(I/M)(R/T)(I/V/F)(T/L)WS
(W/L)X9
(T/A)G(D/L/V)APET(S/T)(A/Q)(T/A)TL(V/I)TSPFTF(Y/S)YIREDD(SEQ ID NO:2)。
在另一个实施方案中,本发明的第一个方面的分离的多肽包含或由以下氨基酸序列组成:
TLWTG(V/P)(N/K)P(E/R)ANC(Q/I)(M/I)(M/E)(Y/A/N/D)(S/G)(S/K)(E/Q)(S/N)(N/P)D
(C/S)KL(I/T)L(I/T)LVK(T/N)G(A/G)
(L/I)V(T/N)(A/G)(F/Y)V(Y/T)(V/L)(I/M)G(V/A)S(N/D)
(N/D/Y)(F/V)N(M/T)L(T/F)(T/K)(Y/H/N)(R/K)N(I/V)(N/S)(F/I)(T/N)(A/V)EL(F/Y)FD(S/A)
(A/T)G(N/H)(L/I)L(T/P)(S/R/D)(L/S)SSLKT(P/D)L(N/E)X2X3(S/Y)(G/K)Q(N/T)A(I/L/D)
X4(N/S)A(K/R)(S/G)FMPSTTAYPF X5L(N/P)(N/D/V)(N/A)(S/G)(R/T)(E/H)(N/K/)X6NX7I(Y/F)G(T/Q)C(H/Y)YX8ASD(H/G/R)(T/A)(A/L)FP(I/L)(D/E)(I/V)(S/T)VMLN
(Q/R/K)R(A/L)(I/L/P)(R/N/D)(A/D/N/S)(D/E/R)TSY(C/V)(I/M)(R/T)(I/V/F)(T/L)WS(W/L)X9
(T/A)G(D/L/V)APET(S/T)(A/Q)(T/A)TL(V/I)TSPFTF(Y/S)YIREDD(SEQ ID NO:3)。
在另一个实施方案中,本发明的第一个方面的分离的多肽包含或由以下氨基酸序列组成:
TLWTGPKPEA NCIIEYGKQN PDSKLTLILV KNGG(I/L)VNGYV TLMGASDYVN TLFKNKNVSI NVELYFDATGHILPDSSSLK TDLEX2X3YKQTAD X4SARGFMP
STTAYPFX5LP NAGTHNX6NX7I FGQCYY X8ASD GALFPLEVTV MLNKRLPDSR
TSYVMTFLWS LX9AGLAPETT QATLITSPFT FSYIREDD(SEQ ID NO:4)。
在所有这些实施方案中,以下的至少一个是真实的:
X2为P;
X3为E;
X4为S,或L;
X5为D;
X6为G);
X7为F;
X8为E;或者
X9为S。
在多个实施方案中,这些陈述的至少2,3,4,5,6,7或所有8个都是真实的。在一个示例性实施方案中,至少X7为F。在另一个实施方案中,至少X3为E并且X4为S。在另一个实施方案中,至少X9为S。在另一个实施方案中,至少X5为D。在另一个实施方案中,至少X4为L。在另一个实施方案中,至少X2为P并且X8为E。在另一个实施方案中,至少X6为G并且X8为E。
在多个其他的实施方案中,分离的多肽包含或由以下肽中的一个组成:
(a)TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGIVNGYVTLMGASD
YVNTL
FKNKNVSINVELYFDATGHILPDSSSLKTDLELKYKQTADFSARGFMPSTTAYPFVLPNAGTHNENFIFGQCYYKASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLNAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:5);
(b)TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGIVNGYVTLMGASD
YVN
TLFKNKNVSINVELYFDATGHILPDSSSLKTDLELEYKQTADSSARGFMPSTTAYPFVLPNAGTHNENYIFGQCYYKASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLNAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:6);
(c)TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGIVNGYVTLMGASD
YVNTL
FKNKNVSINVELYFDATGHILPDSSSLKTDLELKYKQTADFSARGFMPSTTAYPFVLPNAGTHNENYIFGQCYYKASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLSAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:7);
(d)TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGIVNGYVTLMGASD
YVNTL
FKNKNVSINVELYFDATGHILPDSSSLKTDLELKYKQTADFSARGFMPSTTAYPFDLPNAGTHNENYIFGQCYYKASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLNAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:8);
(e)TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGLVNGYVTLMGASDYVN
TLFKNKNVSINVELYFDATGHILPDSSSLKTDLEPKYKQTADFSARGFMPSTTAYPFVLPNAGTHNENYIFGQCYYEASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLNAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:9);
(f)TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGIVNGYVTLMGASDYV
NTLFKNKNVSINVELYFDATGHILPDSSSLKTDLELKYKQTADLSARGFMPSTTAYPFVLPNAGTHNENYIFGQCYYKASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLNAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:10);以及
(g)TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGIVNGYVTLMGASDYV
NTLFKNKNVSINVELYFDATGHILPDSSSLKTDLELKYKQTADFSARGFMPSTTAYPFVLPNAGTHNGNYIFGQCYYEASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLNAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:11)。
在第二个方面中,本发明提供了重组AdB-2/3纤维多肽,其包含:
(a)一个或多个AdB-2/3纤维多肽球结构域,或其功能等价物;
(b)与一个或多个AdB-2/3纤维多肽球结构域可操作地连接并且位于该AdB-2/3纤维多肽球结构域的C-末端的AdB-2/3纤维多肽球结构域,其中所述的AdB-2/3纤维多肽球结构域包含本发明的第一个方面的任意一个实施方案或实施方案的组合的多肽;以及
(c)与所述的一个或多个AdB-2/3纤维多肽球结构域可操作地连接并且位于该AdB-2/3纤维多肽球结构域的N-末端的一个或多个非AdB-2/3衍生的二聚化结构域。
如本文所用,“AdB-2/3”为使用DSG2作为用于病毒结合的上皮细胞受体的任何腺病毒血清型。到目前为止,已经识别Ad3,Ad7,Ad11,Ad14,和Ad14a血清型。关于其他Ad血清型的识别,本领域的那些技术人员可以基于本文所公开的DSG2结合检测而容易地识别属于AbD-2/3家族的那些。例如表面等离子体共振(SPR)研究(使用了包含固定的重组DSG2的传感器),结合DSG2竞争研究,可以用于测定新型Ad血清型是否结合DSG2。诸如功能分析的丧失和获得之类的其他示例性研究在WO2011/156761中详细描述。
腺病毒病毒体为二十面体,其可表征为位于衣壳12个顶点的每个顶点的基底处的纤维。病毒体上的纤维为同源三聚体结构,其由3个单独纤维多肽组成。每个腺病毒纤维多肽为不对称结构,其由以下部分组成:N-末端尾部,其与衣壳五聚体基体蛋白质相互作用,并包含用于将蛋白质运输至细胞核中所必需的信号;杆,其包含大量的15个残基的重复单元;以及C-末端球结构域,其包含用于受体结合的决定因子(J.S.Hong and J.A.Engler,Journal of Virology 70:7071–7078(1996))。所有的腺病毒都是通过纤维末端上的球结构而附着在它们的受体上的。因此,如本文所用,术语AdB-2/3“纤维多肽”是指包含N-末端尾部结构域、球结构域和C-末端球结构域的全长纤维多肽。纤维多肽自发地组装成同源三聚体,称为“纤维”,其位于衣壳12个顶点的每个顶点的基体处、腺病毒病毒体的外部上。
在优选的实施方案中,重组多肽不包含得自Ad纤维多肽的尾部结构域。如下文中详细公开的那样,本发明人识别了重要的残基,该残基的突变得到对DSG2的亲和性显著增强的纤维多肽,以及显著增强的治疗效力。因此,本发明的这一方面的多肽可以用于例如形成用于上文所述的本发明的多种方法中的AdB-2/3纤维多聚体。在该方面中,重组多肽可以包含得自任何AdB-2/3病毒的球结构域或任何突变体(取代、加入、删除、嵌合等),使得该球结构域保留或改善了对DSG2的结合亲和性,并且能够通过二聚化结构域(功能等价物)形成多聚体(例如二聚体)。例如表面等离子体共振(SPR)研究(使用了包含固定的重组DSG2的传感器),结合DSG2竞争研究,可以用于测定待评估的重组多肽是否结合DSG2。
如整个本申请中所用,术语“多肽”在其最广泛的含义上是指亚单位氨基酸的序列。本发明的多肽可以包含L-氨基酸,D-氨基酸(其在体内会抵抗L-氨基酸特异性的蛋白酶),或D-和L-氨基酸的组合。本文所述的多肽可以是化学合成的或重组表达的。所述的多肽可以与其他化合物连接,从而促进其体内半衰期的增长(例如PEG化、HES化、PAS化、糖基化),或者可以以Fc融合或以去免疫的变体的形式生产。此类连接可以是共价的或非共价的,这是本领域的那些技术人员所理解的。
如本文所用,术语“可操作地连接”是指元件的排列,其中对多个结构域进行构造使得它们作为一个单元发挥它们的预期目的。该术语不要求多个结构域在多肽上紧密相邻,其中在结构域之间可以存在间隔序列/连接体序列,其长度可以是完全可变的。在一个非限定性的实施方案中,在重组AdB-2/3纤维多肽的任意2个结构域之间的间隔序列的长度可以为大约0个氨基酸至大约20个氨基酸。在多个其他的非限定性实施方案中,间隔序列的长度可以为0-20,0-19,0-18,0-17,0-16,0-15,0-14,0-13,0-12,0-11,0-10,0-9,0-8,0-7,0-6,0-5,0-4,0-3,0-2,0-1,1-20,1-19,1-18,1-17,1-16,1-15,1-14,1-13,1-12,1-11,1-10,1-9,1-8,1-7,1-6,1-5,1-4,1-3,1-2,2-20,2-19,2-18,2-17,2-16,2-15,2-14,2-13,2-12,2-11,2-10,2-9,2-8,2-7,2-6,2-5,2-4,2-3,3-20,3-19,3-18,3-17,3-16,3-15,3-14,3-13,3-12,3-11,3-10,3-9,3-8,3-7,3-6,3-5,3-4,4-20,4-19,4-18,4-17,4-16,4-15,4-14,4-13,4-12,4-11,4-10,4-9,4-8,4-7,4-6,4-5,5-20,5-19,5-18,5-17,5-16,5-15,5-14,5-13,5-12,5-11,5-10,5-9,5-8,5-7,5-6,6-20,6-19,6-18,6-17,6-16,6-15,6-14,6-13,6-12,6-11,6-10,6-9,6-8,6-7,7-20,7-19,7-18,7-17,7-16,7-15,7-14,7-13,7-12,7-11,7-10,7-9,7-8,8-20,8-19,8-18,8-17,8-16,8-15,8-14,8-13,8-12,8-11,8-10,8-9,9-20,9-19,9-18,9-17,9-16,9-15,9-14,9-13,9-12,9-11,9-10,10-20,10-19,10-18,10-17,10-16,10-15,10-14,10-13,10-12,10-11,11-20,11-19,11-18,11-17,11-16,11-15,11-14,11-13,11-12,12-20,12-19,12-18,12-17,12-16,12-15,12-14,12-13,13-20,13-19,13-18,13-17,13-16,13-15,13-14,14-20,14-19,14-18,14-17,14-16,14-15,15-20,15-19,15-18,15-17,15-16,16-20,16-19,16-18,16-17,17-20,17-19,17-18,18-20,18-19,19-20,20,19,18,17,16,15,14,13,12,11,10,9,8,7,6,5,4,3,2,1,或者长度为0个氨基酸。
如本文所用,“重组多肽”是指非天然形成的蛋白质产物,其中重组多肽的结构域衍生自一个或多个其他的蛋白质或人工衍生的序列,例如本发明的突变的球结构域多肽。例如每个球结构域可以衍生自不同的天然形成的蛋白质。重组多肽可以通过多种机制构建,包含但不限于标准的DNA操作技术以及通过重组多肽的亚单元部分的化学组装。化学组装可以得到作为分子遗传形式的等价物形式,或者备选地结合了等价物功能。在优选的实施方案中,通过标准的重组DNA技术可以生产重组多肽。根据本文的教导,用于本发明重组多肽的这种重组生产和分离的技术恰好在本领域的技术水平范围内。
在一个实施方案中,每个球结构域选自Ad3球结构域,Ad7球结构域,Ad11球结构域,Ad 14球结构域,Ad14a球结构域,它们的组合和它们的功能等价物。纤维球二聚化需要球结构域,纤维球二聚化是结合DSG2以及细胞间连接的瞬间打开所必需的。因此,根据以下提供的实例,本领域的那些技术人员可以容易地测定这些Ad病毒血清型的球结构域的功能等价物。例如表面等离子体共振(SPR)研究(使用了包含固定的重组DSG2的传感器),结合DSG2竞争研究,可以用于测定待评估的重组多肽是否结合DSG2。诸如功能分析的丧失和获得之类的其他示例性研究在实施例1中详细描述。
重组多肽可以包含1至22个AdB-2/3纤维多肽球结构域。因此,在多个实施方案中,多肽包含1-22,1-21,1-20,1-19,1-18,1-17,1-16,1-15,1-14,1-13,1-12,1-11,1-10,1-9,1-8,1-7,1-6,1-5,1-4,1-3,1-2,2-22,2-21,2-20,2-19,2-18,2-17,2-16,2-15,2-14,2-13,2-12,2-11,2-10,2-9,2-8,2-7,2-6,2-5,2-4,2-3,3-22,3-21,3-20,3-19,3-18,3-17,3-16,3-15,3-14,3-13,3-12,3-11,3-10,3-9,3-8,3-7,3-6,3-5,3-4,4-22,4-21,4-20,4-19,4-18,4-17,4-16,4-15,4-14,4-13,4-12,4-11,4-10,4-9,4-8,4-7,4-6,4-5,5-22,5-21,5-20,5-19,5-18,5-17,5-16,5-15,5-14,5-13,5-12,5-11,5-10,5-9,5-8,5-7,5-6,6-22,6-21,6-20,6-19,6-18,6-17,6-16,6-15,6-14,6-13,6-12,6-11,6-10,6-9,6-8,6-7,7-22,7-21,7-20,7-19,7-18,7-17,7-16,7-15,7-14,7-13,7-12,7-11,7-10,7-9,7-8,8-22,8-21,8-20,8-19,8-18,8-17,8-16,8-15,8-14,8-13,8-12,8-11,8-10,8-9,9-22,9-21,9-20,9-19,9-18,9-17,9-16,9-15,9-14,9-13,9-12,9-11,9-10,10-22,10-21,10-20,10-19,10-18,10-17,10-16,10-15,10-14,10-13,10-12,10-11,11-22,11-21,11-20,11-19,11-18,11-17,11-16,11-15,11-14,11-13,11-12,12-22,12-21,12-20,12-19,12-18,12-17,12-16,12-15,12-14,12-13,13-22,13-21,13-20,13-19,13-18,13-17,13-16,13-15,13-14,14-22,14-21,14-20,14-19,14-18,14-17,14-16,14-15,15-22,15-21,15-20,15-19,15-18,15-17,15-16,16-22,16-21,16-20,16-19,16-18,16-17,17-22,17-21,17-20,17-19,17-18,18-22,18-21,18-20,18-19,19-22,19-21,19-20,20-22,20-21,21-22,1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,或22AdB-2/3纤维蛋白质球结构域。在存在多于1个AdB-2/3纤维蛋白质球结构域,每个球结构域可以是一致的,或者球结构域的一个或多个拷贝在单一的重组多肽中可以是不同的。在优选的实施方案中,重组AdB-2/3纤维多肽具有单一的球结构域。
在另一个实施方案中,在重组多肽中的一个或多个(或者所有的)球结构域包含或由根据SEQ ID NO 12的氨基酸序列组成:GVL(T/S)LKC(L/V)(T/N)PLTT(T/A)(G/S)GSLQLKVG(G/S)GLTVD(D/T)T(D/N)G(T/F/S)L(Q/K/E)ENI(G/S/K)(A/V)(T/N)TPL(V/T)K(T/S)(G/N)HSI(G/N)L(S/P)(L/I)G(A/P/N)GL(G/Q)(T/I)(D/E)(E/Q)NKLC(T/S/A)KLG(E/Q/N)GLTF(N/D)S(N/S)N(I/S)(C/I)(I/A)(D/N/L)(D/K)N(I/--)NTL。在本文所示的该序列和其他可变的序列中,可变的残基在括号内注释,并且“-”表示残基可以缺乏。
在另一个实施方案中,在重组多肽中的一个或多个(或者所有的)球结构域包含或由根据SEQ ID NO 13的氨基酸序列组成:GVLTLKCLTPLTTTGGSLQLKVGGGLT(V/I)DDTDG(T/F)L(Q/K)ENI(G/S)ATTPLVKTGHSIGL(S/P)LG(A/P)GLGT(D/N)ENKLC(T/A)KLG(E/Q)GLTFNSNNICI(D/N)DNINTL。
在另一个实施方案中,在重组多肽中的一个或多个(或者所有的)球结构域包含或由选自以下的氨基酸序列组成:SEQ ID NO:14(Ad3),SEQ ID NO:15(Ad7),SEQ ID NO:16(Ad11),SEQ ID NO:17(Ad14),和SEQ ID NO:18(Ad14a)。
AdB-2/3纤维多肽球结构域包含或由本发明的第一个方面的任意一个实施方案或实施方案的组合组成(即SEQ ID NO:1-11中的任意一个);这些多肽的结构域在本发明的第一个方面中详细描述。
如本文所用,“二聚化结构域”为在包含该二聚化结构域的重组多肽中促进二聚化的肽序列。任何合适的非AdB-2/3衍生的二聚化结构域都可以用于本发明的重组多肽中,只要其允许重组多肽二聚化并由此与DSG2结合即可。二聚化结构域是非AdB-2/3衍生的,因为其在AdB-2/3纤维多肽中不是天然形成的结构域。本领域的那些技术人员已知的并适用于本发明的多种二聚化结构域的非限定性实例包含但不限于至少一个螺旋;或由螺旋、卷曲和另一个螺旋形成的结构等;卷曲螺旋结构;在例如许多细胞表面信号传递受体中的二聚化结构域;抗体的Fc区或铰链区;亮氨酸拉链;STAT蛋白质N末端结构域;FK506结合蛋白质;LexA蛋白质C末端结构域;细胞核受体;FkpA的N末端结构域;由A.maxima得到的柑橘类胡萝卜素蛋白质;由流感得到的M1基质蛋白质;由流感病毒得到的神经氨酸苷酶;E.coli墨角藻糖醛缩酶等。(例如参见O'Shea,Science.254:539(1991),Barahmand-Pour et al.,Curr.Top.Microbiol.Immunol.211:121-128(1996);Klemm et al.,Annu.Rev.Immunol.16:569-592(1998);Klemm et al.,Annu.Rev.Immunol.16:569-592(1998);Ho et al.,Nature.382:822-826(1996);and Pomeranz et al.,Biochem.37:965(1998))。其他的实例包含在牛乳头瘤病毒E2蛋白质中的残基325至410(Dostatni,N.,et al.,EMBO J 7(1988)3807-3816;Haugen,T.,et al.EMBO J 7(1988)4245-4253;McBride,A.,et al.,EMBO J 7(1988)533-539;McBride,A.,et al.,Proc Natl Acad Sci USA 86(1989)510-514);I型脱碘酶(D1):DFLVIYIEEAHASDGW(SEQ ID NO:19)或ADFL--YI-EAH—DGW(SEQ ID NO:20);HIV-1衣壳蛋白质:QGPKEPFRDYVDRFYKTLRA(SEQ ID NO:21);酵母菌GCN4的亮氨酸拉链二聚化基元:HMKQL D VEEL S NYHL N VARL K VGER(SEQ ID NO:22);在Escherichia coli中转录终止蛋白质中的亮氨酸拉链;以及BglG:GVTQLMREMLQLIKFQFSLNYQEESLSYQRLVT(SEQ ID NO:23)。在优选的实施方案中,二聚化结构域包含EVSALEK(SEQ ID NO:24)和/或KVSALKE(SEQ ID NO:25)的一个或多个拷贝。
在本发明的重组多肽中识别可以起到二聚化结构域作用的合适的肽序列或其突变体恰好在本领域的技术水平范围内。例如可以通过以下标准来评估重组AdB-2/3纤维多肽的二聚化,所述的标准包含在蔗糖梯度中沉淀,对胰岛素蛋白质水解的抗性以及在聚丙烯酰胺凝胶中的电泳淌度(Hong and Engler,Journal of Virology 70:7071-7078(1996))。
重组多肽可以包含一个或多个非AdB-2/3衍生的二聚化结构域。因此,在多个实施方案中,重组多肽包含1,2,3,4,5,6,7,8,9,10或更多的非AdB-2/3衍生的二聚化结构域。在多肽中存在多个结构域的情况下,优选的是每个二聚化结构域是相同的。
在优选的实施方案中,间隔序列肽位于二聚化结构域和一个或多个杆结构域之间。在另一个优选的实施方案中,间隔序列肽为具有结构挠性的肽。事实上,可以使用具有结构挠性的任何肽。例如挠性肽可以包含氨基酸残基的重复(例如Gly-Gly-Gly-Ser(SEQ ID NO:26)),或者氨基酸残基的任何其他合适的重复。在另一个实施方案中,可以使用抗体的铰链区。间隔序列可以为能够保持充足多肽二聚化并保持充足多肽与DSG2结合的能力的任何合适的长度。
在一个优选的实施方案中,重组AdB-2/3多肽包含一个或多个杆结构域,其均包含或由Ad3球结构域(SEQ ID NO:14)组成。
这种优选的实施方案可以与本文所述的任意一种实施方案或实施方案的组合一起使用。例如可以使用任何合适的球结构域,并且可以使用任何合适的二聚化结构域,包含但不限于EVSALEK(SEQ ID NO:24)和/或KVSALKE(SEQ ID NO:25)中的一个或多个拷贝。类似地,在二聚化结构域与杆结构域之间和/或杆结构域与球结构域之间可以使用任何合适的间隔序列肽。在最优选的实施方案中,重组AdB-2/3多肽包含或由JO-1(SEQ ID NO:27)或其多聚体(例如二聚体)组成。
重组多肽可以包含其他的结构域,例如用于分离多肽的结构域和/或检测结构域。可以加入分离结构域,从而有利于在例如重组多肽生产后纯化/分离该多肽。可以使用任何合适的分离结构域,包含但不限于HIS,CBP,CYD(共价的但是可分离的NorpD肽),Strep II,FLAG,HPC(蛋白质C的重链C)肽标签,GST和MBP亲和性标签。如本文所用,“检测结构域”是指可以被检测的一个或多个氨基酸序列。可以使用任何合适的检测结构域,包含但不限于固有的荧光蛋白质(例如绿色荧光蛋白质和得自非生物发光的珊瑚虫类物种的荧光蛋白质);需要辅助因子的荧光或发光蛋白质(例如藻胆蛋白或荧光素酶);以及可被特异性抗体或其他特异性天然或非天然的结合探针识别的抗原决定簇,包含但不限于染料、酶辅助因子和基因工程改造的结合分子(其可以是荧光或发光标记的)。
在其他优选的实施方案中,重组AdB-2/3纤维多肽包含或由以下一个氨基酸序列组成:
(a)MRGSHHHHHHGSKVSALKEKVSALKEKVSALKEKVSALKEKVSAL
KEGSGGGSGGGSGGGSNSIALKNN
TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGIVNGYVTLMGASDYVNTL
FKNKNVSINVELYFDATGHILPDSSSLKTDLELKYKQTADFSARGFMPSTTAYPFVLPNAGTHNENFIFGQCYYKASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLNAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:28);
(b)MRGSHHHHHHGSKVSALKEKVSALKEKVSALKEKVSALKEKVSAL
KEGSGGGSGGGSGGGSNSIALKNN
TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGIVNGYVTLMGASDYVN
TLFKNKNVSINVELYFDATGHILPDSSSLKTDLELEYKQTADSSARGFMPSTTAYPFVLPNAGTHNENYIFGQCYYKASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLNAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:29);
(c)MRGSHHHHHHGSKVSALKEKVSALKEKVSALKEKVSALKEKVSAL
KEGSGGGSGGGSGGGSNSIALKNN
TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGIVNGYVTLMGASDYVNTL
FKNKNVSINVELYFDATGHILPDSSSLKTDLELKYKQTADFSARGFMPSTTAYPFVLPNAGTHNENYIFGQCYYKASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLSAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:30);
(d)MRGSHHHHHHGSKVSALKEKVSALKEKVSALKEKVSALKEKVSAL
KEGSGGGSGGGSGGGSNSIALKNN
TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGIVNGYVTLMGASDYVNTL
FKNKNVSINVELYFDATGHILPDSSSLKTDLELKYKQTADFSARGFMPSTTAYPFDLPNAGTHNENYIFGQCYYKASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLNAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:31);
(e)MRGSHHHHHHGSKVSALKEKVSALKEKVSALKEKVSALKEKVSAL
KEGSGGGSGGGSGGGSNSIALKNN
TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGLVNGYVTLMGASDYVN
TLFKNKNVSINVELYFDATGHILPDSSSLKTDLEPKYKQTADFSARGFMPSTTAYPFVLPNAGTHNENYIFGQCYYEASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLNAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:32);
(f)MRGSHHHHHHGSKVSALKEKVSALKEKVSALKEKVSALKEKVSALKEGSGGGSGGGSGGGSNSIALKNN
TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGIVNGYVTLMGASDYV
NTLFKNKNVSINVELYFDATGHILPDSSSLKTDLELKYKQTADLSARGFMPSTTAYPFVLPNAGTHNENYIFGQCYYKASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLNAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:33);和
(g)MRGSHHHHHHGSKVSALKEKVSALKEKVSALKEKVSALKEKVSALKEGSGGGSGGGSGGGSNSIALKNN
TLWTGPKPEANCIIEYGKQNPDSKLTLILVKNGGIVNGYVTLMGASDYV
NTLFKNKNVSINVELYFDATGHILPDSSSLKTDLELKYKQTADFSARGFMPSTTAYPFVLPNAGTHNGNYIFGQCYYEASDGALFPLEVTVMLNKRLPDSRTSYVMTFLWSLNAGLAPETTQATLITSPFTFSYIREDD(SEQ ID NO:34)。
在另一个实施方案中,重组多肽为多聚体形式,例如二聚体、三聚体等。在优选的实施方案中,多聚体包含在每个同源三聚体中通过二聚化结构域的二聚化而形成的二聚体(即多肽为通过球结构域的三聚化而形成的同源三聚体)。在多聚体形式(例如二聚体)中,重组多肽包含AdB-2/3纤维多聚体,并且可以用于上文所述的本发明的多种方法中。如本领域的那些技术人员所理解的那样,此类多聚体可以包含本发明的一致的重组多肽的多聚体,或者可以包含本发明的不同的重组多肽的多聚体。在一个实施方案中,二聚化结构域在形成多聚体一部分的每个重组多肽中是相同的。在另一个实施方案中,二聚化结构域在形成多聚体一部分的每个重组多肽中是不同的。在另一个实施方案中,杆和/或球结构域在形成多聚体一部分的每个重组多肽中是相同的。在另一个实施方案中,杆和/或球结构域在形成多聚体一部分的每个重组多肽中是不同的。
可以根据本领域从业者公知的方法来测定AdB-2/3纤维多聚化。例如可以通过以下标准来评估重组AdB-2/3纤维构造的多聚化,所述的标准包含在蔗糖梯度中沉淀,对胰岛素蛋白质水解的抗性以及在聚丙烯酰胺凝胶中的电泳淌度(Hong and Engler,Journal of Virology 70:7071-7078(1996))。关于电泳淌度,纤维多聚体是非常稳定的复合物,并且当样品在SDS-PAGE之前未煮沸时,在与该多聚体的分子量一致的分子量下运行。但是,在煮沸时,多聚体结构被破坏,并且随后在于蛋白质单体一致的尺寸下运行所述的蛋白质。
重组多肽或其多聚体形式可以储存在溶液中或者被冷冻。
在另一个实施方案中,本发明的重组多肽与用于与上皮组织有关的紊乱的一种或多种治疗剂结合(例如缀合)。例如在本发明的治疗方法中可以使用此类缀合物。用于将本发明的多肽与所关注的治疗剂缀合(例如通过共价结合或化学交联)的方法是本领域的那些技术人员所公知的。任何合适的治疗剂可以用于形成根据本发明的这种实施方案的缀合物,包含但不限于降解肿瘤基质的化合物(例如松弛肽),烷化剂,血管再生术抑制剂,抗体,抗代谢物,抗有丝分裂剂,抗增殖剂,Aurora激酶抑制剂,凋亡促进剂(例如Bcl-xL,Bcl-w和Bfl-1)的抑制剂,死亡受体途径的活化剂,Bcr-Abl激酶抑制剂,BiTE(双特异性T细胞衔接系统)抗体,生物反应调节剂,细胞周期蛋白依赖性激酶抑制剂,细胞周期抑制剂,环氧合酶-2抑制剂,生长因子抑制剂,热休克蛋白(HSP)-90抑制剂,去甲基化试剂,组蛋白去乙酰化酶(HDAC)抑制剂,激素治疗,免疫试剂,凋亡抑制蛋白(IAP)插入抗生素,激酶抑制剂,哺乳动物雷帕霉素靶蛋白抑制剂,microRNA's丝裂原激活的细胞外信号调节激酶抑制剂,多价结合蛋白,非甾体抗炎药(NSAID),聚ADP(腺苷二磷酸)-核糖聚合酶(PARP)抑制剂,铂类化疗,Polo样激酶(Plk)抑制剂,蛋白酶体抑制剂,嘌呤类似物,嘧啶类似物,受体酪氨酸激酶抑制剂,维甲酸/三角肌植物生物碱,小型抑制性核酸(siRNA),拓扑异构酶抑制剂等。
落入这些不同类别的示例性治疗剂包含但不限于:多西紫杉醇;阿霉素;依立替康;紫杉醇白蛋白结核型紫杉醇颗粒阿霉素HCL脂质体BiTE抗体,例如阿德木单抗(Micromet MT201),blinatumomab(Micromet MT103)等;siRNA基治疗剂;烷化剂,包含不孕津,AMD-473,AP-5280,apaziquone,苯达莫司汀,brostallicin,白消安,卡波醌,卡氮芥(BCNU),苯丁酸氮芥,(laromustine,VNP 40101M),环磷酰胺,氮烯唑胺,地西他滨,5’-氮胞苷,雌二醇氮芥,福莫司汀,葡磷酰胺,异环磷酰胺,KW-2170,环己亚硝脲(CCNU),马磷酰胺,美法仑,二溴甘露醇,二溴卫矛醇,嘧啶亚硝脲,氮芥N-氧化物,雷莫司汀,替莫唑胺,噻替派,(苯达莫司汀),苏消安,异环磷酰胺等;血管再生术抑制剂,包含内皮特异性受体酪氨酸激酶(Tie-2)抑制剂,表皮生长因子受体(EGFR)抑制剂,胰岛素生长因子-2受体(IGFR-2)抑制剂,基质金属蛋白酶-2(MMP-2)抑制剂,基质金属蛋白酶-9(MMP-9)抑制剂,血小板衍生的生长因子受体(PDGFR)抑制剂,凝血酶敏感蛋白类似物,血管内皮生长因子受体酪氨酸激酶(VEGFR)抑制剂等;抗代谢物,包含(培美曲塞二钠,LY231514,MTA),5-阿扎胞苷,(卡培他滨),卡莫氟,(克拉屈滨),克罗拉宾,阿糖胞苷,cytarabine ocfosfate,胞嘧啶阿拉伯糖苷,地西他滨,去铁敏,去氧氟尿苷,依氟鸟氨酸,EICAR(5-乙炔基-1-.β.-D-呋喃核糖苷-4-氨甲酰),依诺他滨,ethnylcytidine,氟达拉滨,单独的5-氟尿嘧啶或与甲酰四氢叶酸组合的,(吉西他滨),羟基脲,(美法仑),巯嘌呤,6-巯嘌呤核糖苷,甲氨蝶呤,甲氨蝶呤类似物(例如曲麦克特和普拉曲沙),霉酚酸,奈拉滨,诺拉曲塞,ocfosfate,pelitrexol,喷司他丁,雷替曲塞,三氮唑核苷,triapine,曲麦克特,S-1,噻唑呋林,替加氟,TS-1,阿糖腺苷等;Bcl-2蛋白质抑制剂,包含AT-101((-)棉子酚),(G3139或奥利默森(Bcl-2-靶向反义寡核苷酸)),IPI-194,IPI-565,N-(4-(4-((4'-氯代(1,1'-二苯基)-2-基)甲基)哌嗪-1-基)苯甲酰基)-4--(((1R)-3-(二甲基氨基)-1-((苯基硫基)甲基)丙基)氨基)-3-硝基苯磺酰胺)(ABT-737),N-(4-(4-((2-(4-氯代苯基)-5,5-二甲基-1-环己-1-烯-1-基)甲基)哌嗪-1-基)苯甲酰基)-4-(((1R)-3-(吗啉-4-基)-1-((苯基硫基)甲基-)丙基)氨基)-3-((三氟甲基)砜基)苯磺酰胺(ABT-263),GX-070(obatoclax)等;Bcr-Abl激酶抑制剂,包含(BMS-354825),(伊马替尼)等;CDK抑制剂,包含AZD-5438,BMI-1040,BMS-032,BMS-387,CVT-2584,flavopyridol,GPC-286199,MCS-5A,PD0332991,PHA-690509,seliciclib(CYC-202,R-roscovitine),ZK-304709等;EGFR抑制剂,包含ABX-EGF,抗EGFR免疫脂质体,EGF疫苗,EMD-7200,(西妥昔单抗),HR3,IgA抗体,(吉非替尼),(厄洛替尼或OSI-774),TP-38,EGFR融合蛋白质,(拉帕替尼)等;ErbB2受体抑制剂,包含CP-724-714,CI-1033(卡奈替尼),(曲妥单抗),(拉帕替尼),(2C4,帕妥珠单抗),TAK-165,GW-572016(ionafarnib),GW-282974,EKB-569,PI-166,dHER2(HER2疫苗),APC-8024(HER-2疫苗),抗HER/2neu双特异性抗体,B7.her2IgG3,AS HER2三官能双特异性抗体,mAb AR-209,mAb 2B-1等;组蛋白去乙酰化酶抑制剂,包含罗米地辛,LAQ-824,MS-275,trapoxin,辛二酰苯胺氧肟酸(SAHA),TSA,丙戊酸等;HSP-90抑制剂,包含17-AAG-nab,17-AAG,CNF-101,CNF-1010,CNF-2024,17-DMAG,格尔德霉素,IPI-504,KOS-953,(HSP-90的人类重组抗体),NCS-683664,PU24FC1,PU-3,根赤壳菌素,SNX-2112,STA-9090VER49009等;死亡受体途径的活化剂,包含TRAIL,靶向TRAIL或死亡受体(例如DR4和DR5)的抗体或其他试剂,例如Apomab,conatumumab,ETR2-ST01,GDC0145,(来沙木单抗),HGS-1029,LBY-135,PRO-1762和曲妥单抗;铂类化疗,包含顺铂,(奥沙利铂)依铂,洛铂,奈达铂,(加铂),沙铂,皮卡铂等;VEGFR抑制剂,包含(贝伐单抗),ABT-869,AEE-788,阿西替尼(AG-13736),AZD-2171,CP-547,632,IM-862,MACUGEN(pegaptamib),(索拉非尼,BAY43-9006),帕唑帕尼(GW-786034),vatalanib(PTK-787,ZK-222584),(舒尼替尼,SU-11248),VEGF Trap,ZACTIMAThi(凡德他尼,ZD-6474)等;树突状细胞治疗(sipuleucel-T,);拓扑异构酶抑制剂,包含阿柔比星,9-氨基喜树碱,氨萘非特,安吖啶,becatecarin,贝洛替康,BN-80915,(盐酸依立替康),喜树碱,右旋丙亚胺,氟替康,edotecarin,或(表柔比星),依托泊苷,依沙替康,abraxane,依立替康,10-羟基喜树碱,吉马替康,勒托替康,米托葱醌,卢比替康,吡喃阿霉素,匹杉琼,鲁比替康,索布佐生,SN-38,他氟泊苷,托泊替康等;抗体,包含(贝伐单抗),CD40特异性抗体,chTNT-1/B,迪诺塞麦,(西妥昔单抗),(zanolimumab),IGF I R特异性抗体,林妥珠单抗,(依决可单抗),(WX G250),(利妥昔单抗),ticilimumab,曲妥单抗等;激素治疗,包含(阿那曲唑),(依西美坦),阿佐昔芬,(比卡鲁胺),(西曲瑞克),地加瑞克,地洛瑞林,(曲洛司坦),地塞米松,(氟他胺),(雷洛昔芬),(法倔唑),(法乐通),(氟维司琼),(来曲唑),福美坦,糖皮质激素s,(度骨化醇),(碳酸司维拉姆),拉索昔芬,醋酸亮丙瑞林,(megesterol),(米非司酮),(尼鲁米特),(枸橼酸它莫西芬),(阿巴瑞克),泼尼松,(非那司提),rilostane,(乙基酰胺),(黄体生成激素释放激素(LHRH)),(组氨瑞林implant),(曲洛司坦或modrastane),(fosrelin,戈舍瑞林)等;免疫试剂,包含干扰素α,干扰素α-2a,干扰素α-2b,干扰素β,干扰素γ-1a,(干扰素γ-1b),干扰素γ-n1,它们的组合等。其他试剂包含(IFN-α),BAM-002(氧化谷胱甘肽),(他索纳明),(托西莫单抗),(阿仑单抗),CTLA4(细胞毒性淋巴细胞抗原4),氮烯唑胺,地尼白介素,依帕珠单抗,(来诺拉提),蘑菇多糖,白细胞干扰素α,咪喹莫特,MDX-010(抗CTLA-4),黑素瘤疫苗,米妥莫单抗,莫拉司亭,MYLOTARG.TM.(吉妥珠单抗奥唑米星),(非格司亭),OncoVAC-CL,(奥戈伏单抗),pemtumomab(Y-muHMFG1),(sipuleucel-T),sargaramostim,裂褶菌素,替西硫津,(牛型结核杆菌疫苗),乌苯美司,(immunotherapeutic,Lorus Pharmaceuticals),Z-100(Specific Substance of Maruyama(SSM)),WF-10(四氯代十氧化物(TCDO)),(阿地白介素),(胸腺法新),(达克珠单抗),(90Y-替伊莫单抗)等;奥法木单抗;生物反应调节剂包含,苛丽碱,蘑菇多糖,sizofuran,溶链菌PF-3512676(CpG-8954),乌苯美司等;嘧啶类似物,包含阿糖胞苷(ara C或阿拉伯糖苷C),胞嘧啶阿拉伯糖苷,去氧氟尿苷,(氟达拉滨),5-FU(5-氟尿嘧啶),氟尿苷,(吉西他滨),(雷替曲塞),(三乙酰尿苷曲沙他滨)等;嘌呤类似物,包含(硫鸟嘌呤)和(巯嘌呤);抗有丝分裂剂,包含batabulin,埃博霉素D(KOS-862),N-(2-((4-羟基苯基)氨基)吡啶-3-基)-4-甲氧基苯磺酰胺,伊沙匹隆(BMS 247550),紫杉醇,(多西紫杉醇),PNU100940(109881),帕土匹龙,XRP-9881(拉洛他赛),长春氟宁,ZK-EPO(合成的埃博霉素)等;以及其他化疗试剂,例如(ABI-007),ABT-100(法尼基转移酶抑制剂),(Ad5CMV-p53疫苗),或(洛弗斯塔特因),(polyI:polyC12U,一种合成的RNA),(依昔舒林),(帕米膦酸),小白菊内酯衍生物,L-天冬酰胺酶,阿他美坦(1-甲基-3,17-二酮-雄甾-1,4-二烯),(他佐罗汀),AVE-8062(考布他汀衍生物),BEC2(米妥莫单抗),恶液质素或恶质素(肿瘤坏死因子),canvaxin(疫苗),(癌症疫苗),(西莫白介素),(二盐酸组胺),(人类乳头瘤病毒疫苗),(C:(环磷酰胺);H:(羟基阿霉素);O:长春新碱P:泼尼松),(醋酸环丙氯地孕酮),考布他汀A4P,DAB(389)EGF(通过His-Ala连接体与人类表皮生长因子融合的白喉毒素的催化和转运结构域)或(白喉毒素),氮烯唑胺,放线菌素,5,6-二甲基占吨酮-4-乙酸(DMXAA),恩尿嘧啶,EVIZON.TM.(squalamine lactate),(T4N5脂质体洗剂),圆皮海绵内酯,DX-8951f(依沙替康甲磺酸盐),enzastaurin,EPO906(埃博霉素B),(四价人乳头瘤病毒疫苗(6,11,16,18型)重组疫苗),GMK(神经节苷脂缀合物疫苗),(前列腺癌疫苗),哈洛夫酮,组氨瑞林,羟基尿素,伊班膦酸,IGN-101,IL-13-PE38,IL-13-PE38QQR(cintredekin besudotox),IL-13-绿脓杆菌外毒素,干扰素-.α.,干扰素-.γ.,或(米伐木肽),洛那法尼,5,10-亚甲基四氢叶酸酯,米替福新(十六烷基磷酸胆碱),(AE-941),(曲麦克特葡糖醛酸),(喷司他丁),(一种核糖核酸酶),(黑素瘤疫苗治疗),(IL-2疫苗),(鲁比替康),(抗体基细胞药品),MAb(鼠科单克隆抗体),紫杉醇,(由人参得到的糖苷配基皂苷类,包含20(S)原人参萜二醇(aPPD)和20(S)原人参萜三醇(aPPT)),帕尼单抗,(研究的癌疫苗),培加帕加司,PEG干扰素A,苯妥帝尔,甲基苄肼,瑞马司他,(卡妥索单抗),(来那度胺),RSR13(乙丙昔罗),LA(兰乐肽),(阿维A),十字孢碱(链霉菌属星形孢子),甲磺酸盐(PT100),(贝沙罗汀),(DHA-紫杉醇),(canfosfamide,TLK286),temilifene,(替莫唑胺),替米利芬,沙利度胺,(STn-KLH),诺拉曲特(2-氨基-3,4-二氢-6-甲基-4-含氧-5-(4-吡啶基硫代)喹唑啉二氢氯化物),(adenovector:包含用于肿瘤坏死因子α的基因的DNA载体),或(波生坦),维生素A酸(Retin-A),粉防乙碱,(砒霜),ukrain(由白屈菜植物得到的生物碱的衍生物),维生素(抗αvβ3抗体),(莫特沙芬钆),(阿曲生坦),(聚谷氨酸紫杉醇),(曲贝替定),ZD-6126,(右雷佐生),(唑来磷酸),克唑替尼,阿霉素等。
在另一个优选的实施方案中,所述的治疗剂包含与桥粒芯糖蛋白-2结合的化合物;优选的是,与DSG2结合并打开紧密连接的化合物。
在其他的实施方案中,所述的治疗剂包含放射性粒子/辐射治疗。可以使用主治医师认为合适的任何适合的放射性治疗或粒子,包含但不限于钴-60,碘-131,铱-192,锶-89,钐153,铼-186和铅-212。
在优选的实施方案中,治疗剂为抗肿瘤治疗剂,并且包含本文所述的化疗或抗肿瘤单克隆抗体。在另一个优选的实施方案中,抗肿瘤治疗剂包含选自以下的抗体:曲妥单抗,cetumiximab,帕妥珠单抗,apomab,conatumumab,来沙木单抗,贝伐单抗,贝伐单抗,迪诺塞麦,zanolimumab,林妥珠单抗,依决可单抗,利妥昔单抗,ticilimumab,托西莫单抗,阿仑单抗,依帕珠单抗,米妥莫单抗,吉妥珠单抗奥唑米星,奥戈伏单抗,pemtumomab达克珠单抗,帕尼单抗,卡妥索单抗,奥法木单抗,和替伊莫单抗。有用的抗肿瘤mAb及其特定用途的非限定性实例列于表1中,并且在Campoli,M.,et al.,Principles&Practice of Oncology 23(1&2):1-19(2009)中进一步描述,该文献以引用方式并入本文。
表1:用于癌症治疗的肿瘤抗原特异性mAb
在另一个实施方案中,本发明的重组多肽与一种或多种诊断剂或成像剂结合(例如缀合)。本发明的重组多肽及其多聚体广泛应用于将任意一种诊断剂、成像剂或其他化合物传递至包含细胞间连接(其中与所关注的靶物接近受到了限制)的上皮组织中。在多个非限定性实施方案中,成像剂可以包含可以直接或间接产生可检测信号的化学化合物。许多此类的成像剂是本领域的那些技术人员已知的。适用于所公开的方法和组合物中的成像剂的实例为放射性同位素、荧光分子、磁性颗粒(包含纳米颗粒)、金属颗粒(包含纳米颗粒)、磷光发光分子、酶、抗体、配体和它们的组合,同时诊断剂可以包含这样的化合物,其为用于特定的上皮紊乱的、与所述的成像剂结合的诊断标志物。此外,用于检测和测量成像剂所产生的信号的方法也是本领域的那些技术人员所已知的。例如可以通过闪烁计数或直接显示来检测放射性同位素;可以使用荧光分光光度计来检测荧光分子;可以使用分光光度计来检测荧光分子或者使用照相机直接显示荧光分子;可以检测或显示由酶催化的反应产物来检测酶;可以通过检测与抗体偶联的二级检测标记来检测抗体。在一个优选的实施方案中,成像剂和/或诊断剂为通过直接的肿瘤结合或者通过使成像剂或诊断剂与可以结合肿瘤的化合物偶联而可以用于检测肿瘤的试剂。
在多个实施方案中,所述的成像剂可以为荧光成像剂,同时诊断剂可以包含这样的化合物,其为用于特定的上皮紊乱的、与所述的荧光成像剂结合的诊断标志物。荧光成像剂可以为具有可检测的荧光信号的任何化学部分。该成像剂可以单独使用或者与其他成像剂组合使用。可以用于本文所公开的组合物和方法中的合适的荧光剂的实例包含但不限于荧光素(FITC),5-羧基荧光素-N-羟基琥珀酰亚胺酯,5,6-羧甲基荧光素,硝基苯-2-氧杂-1,3-二唑-4-基(NBD),荧光胺,OPA,NDA,吲哚花青绿染料,花青染料(例如Cy3,Cy3.5,Cy5,Cy5.5和Cy7),4-乙酰氨基-4'-异硫氰酸二苯-2,2'二磺酸,吖啶,吖啶异硫代氰酸酯,5-(2'-氨基乙基)氨基萘-1-磺酸(EDANS),4-氨基-N-[3-乙烯基砜基)苯基萘亚胺-3,5二磺酸酯,N-(4-苯胺-1-萘基)马来酰亚胺,邻氨基苯甲酰胺,BODIPY,亮黄,香豆素,7-氨基-4-甲基香豆素(AMC,香豆素120),7-氨基-4-三氟甲基香豆素(香豆满151),焰红染料,4',6-二脒基-2-苯基吲哚(DAPI),5',5”-二溴焦棓酸-磺酚酞(溴焦酚红),7-二乙基氨基-3-(4'-异硫代氰酰苯基)-4-甲基香豆素二亚乙基三胺五乙酸酯,4,4'-二异硫代氰酰二氢-芪-2,2'-二磺酸,4,4'-二异硫氰酸二苯-2,2'-二磺酸,5-[二甲基氨基]萘-1-砜基氯化物(DNS,丹磺酰氯),4-(4'-二甲基氨基苯基偶氮)苯甲酸(DABCYL),4-二甲基氨基苯基偶氮苯基-4'-异硫代氰酸酯(DABITC),曙红,曙红异硫代氰酸酯,赤藓红B,赤藓红,异硫代氰酸酯,溴化乙锭,乙锭,5-羧基荧光素(FAM),5-(4,6-二氯代三嗪-2-基)氨基荧光素(DTAF),2',7'-二甲氧基-4'5'-二氯代-6-羧基荧光素(JOE),荧光素异硫代氰酸酯,IR144,IR1446,孔雀绿异硫氰酸酯,4-甲基伞行酮,邻甲酚酞,硝基酪氨酸,副蔷薇苯胺,酚红,B-藻红蛋白,临苯二甲醛,芘,芘丁酸酯,琥珀酰亚胺基1-芘丁酸酯,活性红4(汽巴[R]艳红3B-A),6-羧基-X-若丹明(ROX),6-羧基若丹明(R6G),丽丝胺若丹明B砜基氯化物若丹明(Rhod),5,6-四甲基若丹明,若丹明B,若丹明123,若丹明X异硫代氰酸酯,磺酰若丹明B,磺酰若丹明101,磺酰若丹明101的砜基氯化物衍生物(德克萨斯红),N,N,N',N'-四甲基-6-羧基若丹明(TAMRA),四甲基若丹明,四甲基若丹明异硫代氰酸酯(TRITC),核黄素,蔷薇酸,香豆素-6等,包含它们的组合。这些荧光成像部分可以得自多种市售来源(包含Molecular Probes,Eugene,Oreg.和Research Organics,Cleveland,Ohio),或者可以通过本领域的那些普通技术人员来合成。
在另一个实例中,所述的成像剂可以包含磁共振成像(MRI)剂,同时诊断剂可以包含这样的化合物,其为用于特定的上皮紊乱的、与所述的MRI剂的诊断标志物。MRI剂为具有可检测的磁共振信号或者可以影响(例如增强或迁移)另一种试剂的磁共振信号的任何化学部分。这种类型的成像剂可以单独使用或者与其他的成像剂组合使用。在另一个实例中,钆基MRI剂可以起到成像剂的作用。可以并入至所公开的成像剂中的合适的MRI剂的实例为对氨基-苄基二亚乙基三胺五乙酸(p-NH2-Bz-DTPA,化合物7),其为二亚乙基三胺五乙酸(DTPA)的缀合物形式,已知其强烈地结合钆并且被批准作为磁共振对比剂而用于临床用途中。在大的高分子(例如本文所公开的枝状底物)上引入MRI剂可以得到大的T1弛豫(高对比)并且可以在单一分子上具有多个拷贝(这可以增强信号)。通过将MRI成像剂与例如荧光成像剂结合,可以实时通过MRI检测、成像和跟踪所得的试剂。其他成像剂包含PET剂,其可以通过引入18F或用于64Cu或68Ga的螯合剂来制备。此外,可以利用放射性核的加入来促进SPECT成像和放射剂量的传递,同时诊断剂可以包含这样的化合物,其为用于特定的上皮紊乱的、与所述的PET剂结合的诊断标志物。
在一些实施方案中,诊断剂为诊断成像剂,包含但不限于正电子发射成像(PET)剂,计算机成像(CT)剂,磁共振成像(MRI)剂,核磁成像剂(NMI),荧光透视剂和超声对比剂。此类诊断剂包含放射性同位素,例如碘(I)(包含123I,125I,131I等)、钡(Ba)、钆(Gd)、锝(Tc)(包含99Tc)、磷(P)(包含31P)、铁(Fe)、锰(Mn)、铊(Tl)、铬(Cr)(包含51Cr),碳(C)(包含14C)等之类的元素;荧光标记的化合物或它们的复合物、螯合物、加成物和缀合物。可以使用任何合适的PET剂,包含但不限于碳-11,氮-13,氧-15,氟-18,11C-美托咪酯和它们的葡萄糖类似物,包含但不限于氟脱氧葡萄糖(使用氟-18标记的葡萄糖类似物)。
在其他的实施方案中,诊断剂为编码蛋白质(当其在细胞内表达时可以容易地检测,包含但不限于β-半乳糖苷酶,绿色荧光蛋白,荧光素酶等)的标志物基因和标记的核酸探针(例如放射性标记的或荧光标记的探针)。在一些实施方案中,诊断剂或成像剂与本文所提供的AdB-2/3多聚体的共价缀合是根据多种缀合工艺来完成的。在其他的实施方案中,诊断剂与所提供的AdB-2/3多聚体非共价结合。
在另一个方面中,本发明提供了编码所述的多肽或本发明的任意一个实施方案的核酸。该核酸可以包含RNA或DNA,并且可以根据本文的教导,使用标准的分子学技术来制备和分离。所述的核酸可以包含用于促进表达和/或纯化所编码的蛋白质的其他结构域,包含polyA序列,修饰的Kozak序列,编码抗原决定簇标签的序列,输出信号,分泌信号,核定位信号和质膜定位信号。
在其他的方面中,本发明提供了提供了重组表达载体,其包含与启动子可操作地连接的、本发明的任意一个方面的核酸。“重组表达载体”包含将核酸编码区或基因与能够有效表达基因产物的任何启动子可操作地连接的载体。用于驱动所公开的核酸在哺乳动物系统中表达的启动子序列可以是构成型的(通过多种启动子中的任意一种来驱动,包含但不限于CMV,SV40,RSV,actin,EF)或诱导型的(通过多种诱导型启动子中的任意一种来驱动,包含但不限于四环素、脱皮激素、甾体化合物应答的)。此外,用于感染原核细胞的表达载体的构建也是本领域公知的,因此可以通过标准的技术来完成。(例如参见Sambrook,Fritsch,and Maniatis,in:Molecular Cloning,A Laboratory Manual,Cold Spring Harbor Laboratory Press,1989;Gene Transfer and Expression Protocols,pp.109-128,ed.E.J.Murray,The Humana Press Inc.,Clifton,N.J.,和the Ambion1998 Catalog(Ambion,Austin,TX))。表达载体以附加体或者整合至宿主染色体DNA中的形式在宿主有机体中必须是可复制的,并且可以包含任何适用于给定用途的任何其他的成分,包含但不限于选择性标志物,例如抗生素抗性基因。
在另一个方面中,本发明提供了包含本文所公开的重组表达载体的宿主细胞及其后代,其中所述的宿主细胞可以是原核的或真核的。所述的细胞可以被瞬时或稳定地转染。表达载体这种转染至原核和真核细胞中可以通过本领域已知的任何技术来完成,包含但不限于标准的细菌转化,磷酸钙共沉淀,电穿孔,或脂质体介导的、DEAE右旋糖苷介导的、聚阳离子介导的或病毒介导的转染。(例如参见Molecular Cloning:A Laboratory Manual(Sambrook,et al.,1989,Cold Spring Harbor Laboratory Press;Culture of Animal Cells:A Manual of Basic Technique,2ndEd.(R.I.Freshney.1987.Liss,Inc.New York,NY)。使用表达载体转染的培养细胞的技术来生产一定量的多肽是本领域公知的。
在另一个方面中,本发明提供了药物组合物,其包含:
(a)本发明的AdB-2/3纤维多聚体;以及
(b)药物可接受的载体。
AdB-2/3纤维多聚体可以为根据本发明的任意一个方面、实施方案或实施方案的组合的、引入了本发明第一个方面的任意一个实施方案的突变体球结构域多肽(即SEQ ID NO:1-11)的任何此类多聚体。
所述的药物组合物可以进一步包含用于治疗与上皮组织有关的紊乱的一种或多种治疗剂,包含但不限于上文所公开的那些。在优选的实施方案中,治疗剂为抗肿瘤治疗剂,并且包含本文所述的化疗或抗肿瘤单克隆抗体。在其他优选的实施方案中,抗肿瘤治疗剂包含选自以下的抗体:曲妥单抗,cetumiximab,帕妥珠单抗,Apomab,conatumumab,来沙木单抗,贝伐单抗,贝伐单抗,迪诺塞麦,zanolimumab,林妥珠单抗,依决可单抗,利妥昔单抗,ticilimumab,托西莫单抗,阿仑单抗,依帕珠单抗,米妥莫单抗,吉妥珠单抗奥唑米星,奥戈伏单抗,pemtumomab达克珠单抗,帕尼单抗,卡妥索单抗,奥法木单抗,和替伊莫单抗。
药物可接受的载体是无毒性的、生物相容性的,并且可以选择使得其不会不利地影响多聚体(以及其后结合的任何其他的治疗剂)的生物活性。用于肽的示例性药物可接受的载体在Yamada的美国专利No.5,211,657中有所描述。所述的组合物可以配制成固体、半固体、凝胶、液体或气体形式的制备物,例如片剂、胶囊、粉末、颗粒、软膏、溶液、栓剂、吸入剂和注射液,从而允许口服、肠胃外或手术给予。通过注射、输注或冲洗而进行肠胃外传递、以及局部传递的合适的载体包含蒸馏水、生理磷酸盐缓冲盐水、正常的或乳酸Ringer溶液、右旋糖溶液、Hank溶液或丙二醇。此外,可以使用无菌的固定油作为溶剂或悬浮介质。就该目的而言,可以使用任何生物相容性的油,包含合成的甘油单酯或甘油二酯。此外,诸如油酸之类的脂肪酸在注射剂的制备中具有用途。载体和试剂可以混合成液体、悬液、可聚合的或不可聚合的凝胶、糊剂或药膏。此外,载体还可以包含传递媒介物,其能保持(即扩大、延迟或调节)所述的试剂(多种)的传递或者增强治疗剂(多种)的传递、吸收、稳定性或药代动力学。此类传递介质可以包含但不限于由蛋白质、脂质体、碳水化合物、合成有机化合物、无机化合物、聚合的或共聚的水凝胶和聚合的微团组成的微粒子、微球体、纳米球体或纳米颗粒。合适的水凝胶和微团传递系统包含在国际公开No.WO 2004/009664 A2中公开的PEO:PHB:PEO共聚物和共聚物/环糊精复合物,以及在美国公开No.2002/0019369 A1中公开的PEO和PEO/环糊精复合物。此类水凝胶可以在预计作用的位点局部注射,或者皮下或肌肉内注射,从而形成缓释储库。
对于鞘内(IT)或脑室内(ICV)传递而言,合适的无菌传递系统(例如液体、凝胶、悬液等)可以用于给予所述的组合物。对于非肽能试剂的口服给药而言,所述的组合物可以携带于惰性填料或稀释剂(蔗糖、玉米淀粉或纤维素)中。
此外,本发明的组合物还包含生物相容性赋形剂,例如分散剂或润湿剂、悬浮剂、稀释剂、缓冲剂、渗透增强剂、乳化剂、粘结剂、增稠剂、风味剂(用于口服给药)。给以肠胃外给予注射剂量的示例性配制物,其中所述的注射剂量为多聚体在具有药物载体(其可以为无菌液体,例如水、油、盐水、甘油或乙醇)的生理可接受的稀释剂中形成的溶液或悬液的剂量。此外,诸如润湿剂或乳化剂、表面活性剂、pH缓冲物质等之类的辅助物质可以存在于包含修饰多肽的组合物中。药物组合物的其他成分包含石油(例如动物、植物或合成起源的),例如大豆油和矿物油。通常,诸如丙二醇或聚乙二醇之类的二醇是用于注射溶液的优选的液体载体。
此外,所述的药物组合物还可以以储库注射物或植入制备物的形式给予,其中所述的储库注射物或植入制备物可以以允许所述的多聚体和其他治疗剂(如果存在)缓慢释放或脉动式释放的方式配制。
所述的药物组合物除了包含本发明的多肽以外,还可以包含(a)冻干保护剂;(b)表面活性剂;(c)膨胀剂;(d)张力调节剂;(e)稳定剂;(f)防腐剂和/或(g)缓冲剂。在一些实施方案中,在药物组合物中的缓冲剂为Tris缓冲剂,组氨酸缓冲剂,磷酸盐缓冲剂,柠檬酸盐缓冲剂或醋酸盐缓冲剂。所述的药物组合物还可以包含冻干保护剂,例如蔗糖、山梨醇或海藻糖。在某些实施方案中,所述的药物组合物包含防腐剂,例如杀藻胺,苄索氯铵,洗必太,苯酚,间甲酚,苄基醇,对羟基苯甲酸甲酯,对羟基苯甲酸丙酯,氯丁醇,邻甲酚,对甲酚,氯甲酚,硝酸苯汞,硫汞撒,苯甲酸,和它们的多种混合物。在其他的实施方案中,所述的药物组合物包含膨胀剂,例如甘氨酸。在其他的实施方案中,所述的药物组合物包含表面活性剂,例如聚山梨醇酯-20,聚山梨醇酯-40,聚山梨醇酯-60,聚山梨醇酯-65,聚山梨醇酯-80聚山梨醇酯-85,泊洛沙姆-188,山梨醇单月桂酸酯,山梨醇单棕酸酯,山梨醇单硬脂酸酯,山梨糖醇单油酸酯,山梨糖醇三月桂酸酯,山梨糖醇三硬脂酸酯,山梨糖醇酐三油酸酯,或它们的组合。此外,所述的药物组合物还可以包含张力调节剂,例如使得配制物与人类血液基本等张或等渗的化合物。示例性张力调节剂包含蔗糖,山梨醇,甘氨酸,蛋氨酸,甘露醇,右旋糖,纤维醇,氯化钠,精氨酸和精氨酸氢氧化物。在其他的实施方案中,所述的药物组合物额外包含稳定剂,例如这样的分子,当与所关注的蛋白质结合时,其基本上会抑制或降低冻干或液体形式的所关注的蛋白质的化学和/或物理学不稳定性。示例性的稳定剂包含蔗糖,山梨醇,甘氨酸,纤维醇,氯化钠,蛋氨酸,精氨酸,和精氨酸氢氯化物。
所述的药物组合物可以以任何合适的方式包装。在一个实施方案中,所述的药物组合物包装成包含AdB-2/3纤维多聚体的容器(例如小瓶)的试剂盒。在一个优选的实施方案中,所述的试剂盒在相同的或分开的容器(例如小瓶)中进一步包含与AdB-2/3纤维多聚体一起给予受试对象的治疗剂、诊断剂或成像剂。
在其他的方面中,本发明提供了试剂盒,其包含(a)本发明的一种或多种重组多肽/AdB-2/3纤维多聚体、分离的核酸、重组表达载体和/或宿主细胞;以及(b)它们用于治疗与上皮组织有关的紊乱的说明书。所述的试剂盒可以进一步包含用于本发明的方法中的治疗剂。
在另一个方面中,本发明提供了用于增强治疗性治疗,或诊断与上皮组织有关的紊乱,和/或将上皮组织成像的方法,其包含向有需要的受试对象给予:
(a)足以治疗所述的紊乱的量的一种或多种治疗剂、足以诊断所述的紊乱的量的诊断剂,和/或足以将上皮组织成像的量的成像剂;以及
(b)足以增强一种或多种治疗剂、诊断剂和/或成像剂的效力的量的、本发明的AdB-2/3纤维多聚体或本发明的药物组合物。
本发明这一方面的方法可以通过改善治疗剂、诊断剂和/或成像剂与其靶物的接近以及在上皮组织中的散播而用于增强治疗性治疗、诊断或成像与上皮组织有关的紊乱。尽管不想被任何机制所束缚,但是本发明人认为这可以通过互补机制而发生:靶物受体由底侧移动至细胞的顶表面,因此使靶向受体(例如单克隆抗体)的治疗剂、诊断剂和/或成像剂更好地接近上皮组织靶物,并且更好地通过破坏细胞间连接而使治疗剂渗透。DSG2为AdB-2/3的主要的高亲和性受体。DSG2为钙结合跨膜糖蛋白,其属于钙粘着蛋白家族。在上皮细胞中,DSG2为细胞-细胞粘附结构的成分。其胞质尾部与一系列蛋白质相互作用,其中所述的蛋白质与细胞粘附以及细胞间连接/细胞形态学的调节剂直接接触。已经显示DSG2在一系列上皮恶性病(包含胃癌、鳞状细胞癌、黑素瘤、转移性前列腺癌和膀胱癌)中过表达。
尽管不想被任何机制所束缚,但是本发明人认为AdB-2/3纤维多聚体与DSG2结合引发了DSG2介导的细胞间连接的瞬间打开,这会改善在上皮细胞中与靶物结合的治疗剂、诊断剂、成像剂或任何其他所关注的化合物的接近,否则所述的靶物至少在一定程度上被捕获在细胞间连接中。此类活性的详细实例在本文中提供。因此,本发明的方法可以使用本发明的任何的AdB-2/3纤维多聚体(其用于引发DSG2介导的细胞间连接的瞬间打开)来实施。包含本发明的一种或多种AdB-2/3纤维多聚体的示例性多聚体(可以用于所述的这些方法中)包含但不限于AdB-2/3病毒体,AdB-2/3衣壳,AdB-2/3十二面体颗粒(PtDd)(由AdB-2/3在它们的复制过程中生产的亚病毒十二面体颗粒),和重组AdB-2/3纤维多聚体。
本发明的方法广泛地用于将任意一种治疗剂、诊断剂、成像剂或其他化合物传递至包含细胞间连接(其中与所关注的靶物的接近受到限制)的上皮组织中(由于DSG2在上皮细胞中广泛表达)。如本文所用,“与上皮组织有关的紊乱”为其中给予/穿过上皮细胞/上皮组织的治疗剂、诊断剂或成像剂在改善治疗、诊断和/或成像效力中为患者提供临床益处的任何紊乱。此类紊乱包含但不限于实体肿瘤(即具有上皮细胞连结的任何肿瘤),胃肠紊乱(包含但不限于肠易激综合征,炎性肠病,Crohn病,溃疡性结肠炎,便秘,胃食管返流疾病,Barrett食管炎等),皮肤病(包含但不限于银屑病和皮炎),肺紊乱(包含但不限于慢性阻塞性肺病,哮喘,支气管炎,肺气肿,囊肿性纤维化,间质性肺病,肺炎,胰管紊乱,脑功能障碍(即可以通过血-脑屏障而受益于药品的改善的运送的任何脑功能障碍),原发性肺动脉高压,肺栓塞,肺结节病,肺结核等),肾紊乱(包含但不限于血管球性肾炎),肝病(包含但不限于肝炎),内分泌紊乱(包含但不限于糖尿病和甲状腺疾病),胰管紊乱(包含但不限于胰腺炎),胆管紊乱(包含但不限于胆管梗阻,胆囊炎,胆总管结石病,胆结石等)和上皮组织感染(包含但不限于蜂窝组织炎,肺炎,肝炎,和肾盂肾炎)。在一个优选的实施方案中,与上皮组织有关的紊乱包含实体肿瘤,包含但不限于乳腺肿瘤,肺肿瘤,结肠肿瘤,直肠肿瘤,皮肤肿瘤,内分泌肿瘤,胃肿瘤,前列腺肿瘤,卵巢肿瘤,子宫肿瘤,子宫颈肿瘤,肾肿瘤,黑素瘤,胰腺肿瘤,肝脏肿瘤,脑肿瘤,头颈肿瘤,鼻咽肿瘤,胃部肿瘤,鳞状细胞癌,腺癌,膀胱肿瘤,和食道肿瘤。如本领域的那些技术人员所理解的那样,此类肿瘤包含原发性肿瘤、局部浸润的肿瘤以及转移的肿瘤。
如本文所用,“增强效力”是指在治疗剂、诊断剂和/或成像剂的效力超过使用单独的治疗剂、诊断剂和/或成像剂所见到的效力的任何增加。例如治疗效力的量度可以根据待治疗的紊乱而改变,但是主治医师可以容易地识别。例如效力的这种增加包含但不限于相对于单独治疗剂的治疗的、以下的一种或多种的增加:(a)降低紊乱的严重性;(b)限制或抑制待治疗的紊乱(多种)的特征性症状的发展;(c)抑制待治疗的紊乱(多种)的特征性症状的恶化;(d)在之前患有所述的紊乱(多种)的患者中,限制或抑制所述的紊乱(多种)的复发;以及(e)在之前具有所述的紊乱(多种)的症状的患者中,限制或抑制症状的复发。在一个非限定性实例中,治疗实体肿瘤提供了诱导肿瘤受体由上皮细胞的底侧运出、从而得到改善的接近并杀灭肿瘤的能力。
对于癌症而言,存在用于定义肿瘤应答的标准和测量应答的标准方法。这些包含肿瘤应答,其可通过监测肿瘤尺寸或疾病的血清标志物的变化来测定。部分应答为肿瘤减小50%以上,而完全应答定义为肿瘤完全消失。用于测量肿瘤的方法是医生所公知的,并且包含生理检查、放射学检测(例如CT扫描、MRI、PET扫描、X射线)、以及血清标志物(例如前列腺特异性抗原),其用于监测前列腺癌。癌症治疗的治疗效力的其他测量包含测量进展的时间、无进展生存和总体生存。
改善的诊断效力包含与单独给予诊断剂相比,效力的任何改善,包含但不限于增加诊断检测的特异性和/或敏感性。改善的成像效力包含与单独给予成像剂相比,效力的任何改善,包含但不限于特异性、敏感性、再现性、对比增强、疾病的更小位点的检测、疾病的更精确的描绘(例如疾病的尺寸和形状,例如肿瘤、脓肿等)。
在多个实施方案中,在跨越患者群体,与单独的治疗剂、诊断剂和/或成像剂的效力相比,效力增加5%,10%,15%,20%,25%,50%,75%,100%或更多的益处。
可以使用本发明的方法来治疗任何合适的受试对象,优选为人类受试对象。
可以靶向上皮组织并且其向上皮组织的传递可以通过瞬间打开细胞间连接来改善的任何治疗、诊断、成像或其他化合物可以用于本发明的方法中。在一个实施方案中,治疗剂选自抗体,免疫缀合物,纳米颗粒,核酸治疗剂,和它们的组合,化疗,疫苗,放射性粒子/放疗(“辐射”),细胞免疫治疗(包含过继性T细胞治疗和树突状细胞治疗)(例如:给予T细胞的瘤内渗透),吸入治疗,基因治疗构建体(包含但不限于AdB-2/3病毒作为基因治疗载体,并且与Ad5基基因治疗载体共同给予),其他核酸治疗剂,和它们的组合。
在多个实施方案中,所述的治疗剂选自烷化剂,血管再生术抑制剂,抗体,抗代谢物,抗有丝分裂剂,抗增殖剂,Aurora激酶抑制剂,凋亡促进剂(例如Bcl-xL,Bcl-w和Bfl-1)的抑制剂,死亡受体途径的活化剂,Bcr-Abl激酶抑制剂,BiTE(双特异性T细胞衔接系统)抗体,生物反应调节剂,细胞周期蛋白依赖性激酶抑制剂,细胞周期抑制剂,环氧合酶-2抑制剂,生长因子抑制剂,热休克蛋白(HSP)-90抑制剂,去甲基化试剂,组蛋白去乙酰化酶(HDAC)抑制剂,激素治疗,免疫试剂,凋亡抑制蛋白(IAP)插入抗生素,激酶抑制剂,哺乳动物雷帕霉素靶蛋白抑制剂,microRNA's丝裂原激活的细胞外信号调节激酶抑制剂,多价结合蛋白,非甾体抗炎药(NSAID),聚ADP(腺苷二磷酸)-核糖聚合酶(PARP)抑制剂,铂类化疗,Polo样激酶(Plk)抑制剂,蛋白酶体抑制剂,嘌呤类似物,嘧啶类似物,受体酪氨酸激酶抑制剂,维甲酸/三角肌植物生物碱,小型抑制性核酸(siRNA),拓扑异构酶抑制剂等。
落入这些不同类别的示例性治疗剂包含但不限于:多西紫杉醇;阿霉素;依立替康;紫杉醇白蛋白结核型紫杉醇颗粒阿霉素HCL脂质体BiTE抗体,例如阿德木单抗(Micromet MT201),blinatumomab(Micromet MT103)等;siRNA基治疗剂;烷化剂,包含不孕津,AMD-473,AP-5280,apaziquone,苯达莫司汀,brostallicin,白消安,卡波醌,卡氮芥(BCNU),苯丁酸氮芥,(laromustine,VNP 40101M),环磷酰胺,氮烯唑胺,地西他滨,5’-氮胞苷,雌二醇氮芥,福莫司汀,葡磷酰胺,异环磷酰胺,KW-2170,环己亚硝脲(CCNU),马磷酰胺,美法仑,二溴甘露醇,二溴卫矛醇,嘧啶亚硝脲,氮芥N-氧化物,雷莫司汀,替莫唑胺,噻替派,(苯达莫司汀),苏消安,异环磷酰胺等;血管再生术抑制剂,包含内皮特异性受体酪氨酸激酶(Tie-2)抑制剂,表皮生长因子受体(EGFR)抑制剂,胰岛素生长因子-2受体(IGFR-2)抑制剂,基质金属蛋白酶-2(MMP-2)抑制剂,基质金属蛋白酶-9(MMP-9)抑制剂,血小板衍生的生长因子受体(PDGFR)抑制剂,凝血酶敏感蛋白类似物,血管内皮生长因子受体酪氨酸激酶(VEGFR)抑制剂等;抗代谢物,包含(培美曲塞二钠,LY231514,MTA),5-阿扎胞苷,(卡培他滨),卡莫氟,(克拉屈滨),克罗拉宾,阿糖胞苷,cytarabine ocfosfate,胞嘧啶阿拉伯糖苷,地西他滨,去铁敏,去氧氟尿苷,依氟鸟氨酸,EICAR(5-乙炔基-1-.β.-D-呋喃核糖苷-4-氨甲酰),依诺他滨,ethnylcytidine,氟达拉滨,单独的5-氟尿嘧啶或与甲酰四氢叶酸组合的,(吉西他滨),羟基脲,(美法仑),巯嘌呤,6-巯嘌呤核糖苷,甲氨蝶呤,甲氨蝶呤类似物(例如曲麦克特和普拉曲沙),霉酚酸,奈拉滨,诺拉曲塞,ocfosfate,pelitrexol,喷司他丁,雷替曲塞,三氮唑核苷,triapine,曲麦克特,S-1,噻唑呋林,替加氟,TS-1,阿糖腺苷等;Bcl-2蛋白质抑制剂,包含AT-101((-)棉子酚),(G3139或奥利默森(Bcl-2-靶向反义寡核苷酸)),IPI-194,IPI-565,N-(4-(4-((4'-氯代(1,1'-二苯基)-2-基)甲基)哌嗪-1-基)苯甲酰基)-4--(((1R)-3-(二甲基氨基)-1-((苯基硫基)甲基)丙基)氨基)-3-硝基苯磺酰胺)(ABT-737),N-(4-(4-((2-(4-氯代苯基)-5,5-二甲基-1-环己-1-烯-1-基)甲基)哌嗪-1-基)苯甲酰基)-4-(((1R)-3-(吗啉-4-基)-1-((苯基硫基)甲基-)丙基)氨基)-3-((三氟甲基)砜基)苯磺酰胺(ABT-263),GX-070(obatoclax)等;Bcr-Abl激酶抑制剂,包含(BMS-354825),(伊马替尼)等;CDK抑制剂,包含AZD-5438,BMI-1040,BMS-032,BMS-387,CVT-2584,flavopyridol,GPC-286199,MCS-5A,PD0332991,PHA-690509,seliciclib(CYC-202,R-roscovitine),ZK-304709等;EGFR抑制剂,包含ABX-EGF,抗EGFR免疫脂质体,EGF疫苗,EMD-7200,(西妥昔单抗),HR3,IgA抗体,(吉非替尼),(厄洛替尼或OSI-774),TP-38,EGFR融合蛋白质,(拉帕替尼)等;ErbB2受体抑制剂,包含CP-724-714,CI-1033(卡奈替尼),(曲妥单抗),(拉帕替尼),(2C4,帕妥珠单抗),TAK-165,GW-572016(ionafarnib),GW-282974,EKB-569,PI-166,dHER2(HER2疫苗),APC-8024(HER-2疫苗),抗HER/2neu双特异性抗体,B7.her2IgG3,AS HER2三官能双特异性抗体,mAb AR-209,mAb 2B-1等;组蛋白去乙酰化酶抑制剂,包含罗米地辛,LAQ-824,MS-275,trapoxin,辛二酰苯胺氧肟酸(SAHA),TSA,丙戊酸等;HSP-90抑制剂,包含17-AAG-nab,17-AAG,CNF-101,CNF-1010,CNF-2024,17-DMAG,格尔德霉素,IPI-504,KOS-953,(HSP-90的人类重组抗体),NCS-683664,PU24FC1,PU-3,根赤壳菌素,SNX-2112,STA-9090VER49009等;死亡受体途径的活化剂,包含TRAIL,靶向TRAIL或死亡受体(例如DR4和DR5)的抗体或其他试剂,例如Apomab,conatumumab,ETR2-ST01,GDC0145,(来沙木单抗),HGS-1029,LBY-135,PRO-1762和曲妥单抗;铂类化疗,包含顺铂,(奥沙利铂)依铂,洛铂,奈达铂,(加铂),沙铂,皮卡铂等;VEGFR抑制剂,包含(贝伐单抗),ABT-869,AEE-788,阿西替尼(AG-13736),AZD-2171,CP-547,632,IM-862,MACUGEN(pegaptamib),(索拉非尼,BAY43-9006),帕唑帕尼(GW-786034),vatalanib(PTK-787,ZK-222584),(舒尼替尼,SU-11248),VEGF Trap,ZACTIMAThi(凡德他尼,ZD-6474)等;树突状细胞治疗(sipuleucel-T,);拓扑异构酶抑制剂,包含阿柔比星,9-氨基喜树碱,氨萘非特,安吖啶,becatecarin,贝洛替康,BN-80915,(盐酸依立替康),喜树碱,右旋丙亚胺,氟替康,edotecarin,或(表柔比星),依托泊苷,依沙替康,abraxane,依立替康,10-羟基喜树碱,吉马替康,勒托替康,米托葱醌,卢比替康,吡喃阿霉素,匹杉琼,鲁比替康,索布佐生,SN-38,他氟泊苷,托泊替康等;抗体,包含(贝伐单抗),CD40特异性抗体,chTNT-1/B,迪诺塞麦,(西妥昔单抗),(zanolimumab),IGF I R特异性抗体,林妥珠单抗,(依决可单抗),(WX G250),(利妥昔单抗),ticilimumab,曲妥单抗等;激素治疗,包含(阿那曲唑),(依西美坦),阿佐昔芬,(比卡鲁胺),(西曲瑞克),地加瑞克,地洛瑞林,(曲洛司坦),地塞米松,(氟他胺),(雷洛昔芬),(法倔唑),(法乐通),(氟维司琼),(来曲唑),福美坦,糖皮质激素s,(度骨化醇),(碳酸司维拉姆),拉索昔芬,醋酸亮丙瑞林,(megesterol),(米非司酮),(尼鲁米特),(枸橼酸它莫西芬),(阿巴瑞克),泼尼松,(非那司提),rilostane,(乙基酰胺),(黄体生成激素释放激素(LHRH)),(组氨瑞林implant),(曲洛司坦或modrastane),(fosrelin,戈舍瑞林)等;免疫试剂,包含干扰素α,干扰素α-2a,干扰素α-2b,干扰素β,干扰素γ-1a,(干扰素γ-1b),干扰素γ-n1,它们的组合等。其他试剂包含(IFN-α),BAM-002(氧化谷胱甘肽),(他索纳明),(托西莫单抗),(阿仑单抗),CTLA4(细胞毒性淋巴细胞抗原4),氮烯唑胺,地尼白介素,依帕珠单抗,(来诺拉提),蘑菇多糖,白细胞干扰素α,咪喹莫特,MDX-010(抗CTLA-4),黑素瘤疫苗,米妥莫单抗,莫拉司亭,MYLOTARG.TM.(吉妥珠单抗奥唑米星),(非格司亭),OncoVAC-CL,(奥戈伏单抗),pemtumomab(Y-muHMFG1),(sipuleucel-T),sargaramostim,裂褶菌素,替西硫津,(牛型结核杆菌疫苗),乌苯美司,(immunotherapeutic,Lorus Pharmaceuticals),Z-100(Specific Substance of Maruyama(SSM)),WF-10(四氯代十氧化物(TCDO)),(阿地白介素),(胸腺法新),(达克珠单抗),(90Y-替伊莫单抗)等;奥法木单抗;生物反应调节剂包含,苛丽碱,蘑菇多糖,sizofuran,溶链菌PF-3512676(CpG-8954),乌苯美司等;嘧啶类似物,包含阿糖胞苷(ara C或阿拉伯糖苷C),胞嘧啶阿拉伯糖苷,去氧氟尿苷,(氟达拉滨),5-FU(5-氟尿嘧啶),氟尿苷,(吉西他滨),(雷替曲塞),(三乙酰尿苷曲沙他滨)等;嘌呤类似物,包含(硫鸟嘌呤)和(巯嘌呤);抗有丝分裂剂,包含batabulin,埃博霉素D(KOS-862),N-(2-((4-羟基苯基)氨基)吡啶-3-基)-4-甲氧基苯磺酰胺,伊沙匹隆(BMS 247550),紫杉醇,(多西紫杉醇),PNU100940(109881),帕土匹龙,XRP-9881(拉洛他赛),长春氟宁,ZK-EPO(合成的埃博霉素)等;以及其他化疗试剂,例如(ABI-007),ABT-100(法尼基转移酶抑制剂),(Ad5CMV-p53疫苗),或(洛弗斯塔特因),(polyI:polyC12U,一种合成的RNA),(依昔舒林),(帕米膦酸),小白菊内酯衍生物,L-天冬酰胺酶,阿他美坦(1-甲基-3,17-二酮-雄甾-1,4-二烯),(他佐罗汀),AVE-8062(考布他汀衍生物),BEC2(米妥莫单抗),恶液质素或恶质素(肿瘤坏死因子),canvaxin(疫苗),(癌症疫苗),(西莫白介素),(二盐酸组胺),(人类乳头瘤病毒疫苗),(C:(环磷酰胺);H:(羟基阿霉素);O:长春新碱P:泼尼松),(醋酸环丙氯地孕酮),考布他汀A4P,DAB(389)EGF(通过His-Ala连接体与人类表皮生长因子融合的白喉毒素的催化和转运结构域)或(白喉毒素),氮烯唑胺,放线菌素,5,6-二甲基占吨酮-4-乙酸(DMXAA),恩尿嘧啶,EVIZON.TM.(squalamine lactate),(T4N5脂质体洗剂),圆皮海绵内酯,DX-8951f(依沙替康甲磺酸盐),enzastaurin,EPO906(埃博霉素B),(四价人乳头瘤病毒疫苗(6,11,16,18型)重组疫苗),GMK(神经节苷脂缀合物疫苗),(前列腺癌疫苗),哈洛夫酮,组氨瑞林,羟基尿素,伊班膦酸,IGN-101,IL-13-PE38,IL-13-PE38QQR(cintredekin besudotox),IL-13-绿脓杆菌外毒素,干扰素-.α.,干扰素-.γ.,或(米伐木肽),洛那法尼,5,10-亚甲基四氢叶酸酯,米替福新(十六烷基磷酸胆碱),(AE-941),(曲麦克特葡糖醛酸),(喷司他丁),(一种核糖核酸酶),(黑素瘤疫苗治疗),(IL-2疫苗),(鲁比替康),(抗体基细胞药品),MAb(鼠科单克隆抗体),紫杉醇,(由人参得到的糖苷配基皂苷类,包含20(S)原人参萜二醇(aPPD)和20(S)原人参萜三醇(aPPT)),帕尼单抗,(研究的癌疫苗),培加帕加司,PEG干扰素A,苯妥帝尔,甲基苄肼,瑞马司他,(卡妥索单抗),(来那度胺),RSR13(乙丙昔罗),LA(兰乐肽),(阿维A),十字孢碱(链霉菌属星形孢子),甲磺酸盐(PT100),(贝沙罗汀),(DHA-紫杉醇),(canfosfamide,TLK286),temilifene,(替莫唑胺),替米利芬,沙利度胺,(STn-KLH),诺拉曲特(2-氨基-3,4-二氢-6-甲基-4-含氧-5-(4-吡啶基硫代)喹唑啉二氢氯化物),(adenovector:包含用于肿瘤坏死因子α的基因的DNA载体),或(波生坦),维生素A酸(Retin-A),粉防乙碱,(砒霜),ukrain(由白屈菜植物得到的生物碱的衍生物),维生素(抗αvβ3抗体),(莫特沙芬钆),(阿曲生坦),(聚谷氨酸紫杉醇),(曲贝替定),ZD-6126,(右雷佐生),(唑来磷酸),克唑替尼,阿霉素等。
在另一个优选的实施方案中,所述的治疗剂包含与桥粒芯糖蛋白-2结合的化合物;优选的是,与DSG2结合并打开紧密连接的化合物。
在其他的实施方案中,所述的治疗剂包含放射性粒子/辐射治疗。可以使用主治医师认为合适的任何适合的放射性治疗或粒子,包含但不限于钴-60,碘-131,铱-192,锶-89,钐153,铼-186和铅-212。
在优选的实施方案中,治疗剂为抗肿瘤治疗剂,并且包含本文所述的化疗或抗肿瘤单克隆抗体。在另一个优选的实施方案中,抗肿瘤治疗剂包含选自以下的抗体:曲妥单抗,cetumiximab,帕妥珠单抗,apomab,conatumumab,来沙木单抗,贝伐单抗,贝伐单抗,迪诺塞麦,zanolimumab,林妥珠单抗,依决可单抗,利妥昔单抗,ticilimumab,托西莫单抗,阿仑单抗,依帕珠单抗,米妥莫单抗,吉妥珠单抗奥唑米星,奥戈伏单抗,pemtumomab达克珠单抗,帕尼单抗,卡妥索单抗,奥法木单抗,和替伊莫单抗。有用的抗肿瘤mAb及其特定用途的非限定性实例列于上表1中,并且在Campoli,M.,et al.,Principles&Practice of Oncology 23(1&2):1-19(2009)中进一步描述,该文献以引用方式并入本文。
所述的单克隆抗体治疗剂可以为任何类型的单克隆抗体,包含但不限于标准的单克隆抗体、人源化的单克隆抗体、由小鼠或其他来源生成的完全人类抗体、嵌合单克隆抗体及其片段。“人源化的单克隆抗体”是指由非人类单克隆抗体衍生得到的单克隆抗体,例如小鼠单克隆抗体。备选地,人源化的单克隆抗体可以衍生自这样的嵌合抗体,其保留或基本保留了亲代非人类单克隆抗体的抗原结合性质,但是当将其给予人类时,与亲代单克隆抗体相比,展现出降低的免疫原性。例如嵌合单克隆抗体可以包含人类和鼠科的抗体片段,通常为人类恒定区和小鼠可变区。可以使用本领域已知的多种方法来制备人源化的单克隆抗体,包含但不限于:(1)将由非人类单克隆抗体得到的互补性决定区嫁接到人类骨架区和恒定区(“人源化”);以及(2)移植非人类单克隆抗体的可变结构域,但是通过替代表面残基而使用人类样的表面来“遮盖”它们(“镶面”)。这些方法在例如Jones et al.,Nature 321:522-525(1986);Morrison et al.,Proc.Natl.Acad.Sci.,U.S.A.,81:6851-6855(1984);Morrison and Oi,Adv.Immunol.,44:65-92(1988);Verhoeyer et al.,Science 239:1534-1536(1988);Padlan,Molec.Immun.28:489-498(1991);Padlan,Molec.Immunol.31(3):169-217(1994);and Kettleborough,C.A.et al.,Protein Eng.4(7):773-83(1991)中有所公开。可以使用常规的技术将单克隆抗体形成片段,并且按照与整个抗体相同的方式针对用途来筛选所述的片段。例如可以使用胃蛋白酶处理抗体而形成F(ab')2片段。可以处理所得的F(ab')2片段以减少二硫桥,从而生产Fab'片段。可以使用木瓜蛋白酶处理IgG抗体而获得Fab片段;可以使用胃蛋白酶消化IgG抗体而获得F(ab')片段。此外,还可以通过硫醚键或二硫键结合下文所述的Fab'来生产F(ab')片段。Fab'片段为通过切割F(ab')2的铰链区的二硫键而获得的抗体片段。可以通过使用还原剂(例如二硫苏糖醇)来处理F(ab')2片段而获得Fab'片段。此外,还可以通过在重组细胞中表达编码此类肽的核酸而生成抗体片段肽(例如参见Evans et al.,J.Immunol.Meth.184:123-38(1995))。例如编码一部分F(ab')2片段的嵌合基因可以包含编码H链的CH1结构域和铰链区的DNA序列,其后为翻译终止密码子,从而产生此类截短的抗体片段分子。单克隆抗体片段的非限定实例包含:(i)Fab片段,一种基本上由VL、VH、CL和CH1结构域组成的一价片段;(ii)F(ab)2和F(ab')2片段,在铰链区包含2个通过二硫桥连接的Fab片段的二价片段;(iii)基本上由VH和CH1结构域组成的Fd片段;(iv)基本上由抗体的单臂的VL和VH结构域组成的Fv片段;(v)dAb片段(Ward et al.,(1989)Nature 341:544-546),其基本上由VH结构域组成;以及(vi)一种或多种分离的CDR或功能抗体决定簇。
在可以与本发明的任意一个实施方案或实施方案的组合结合的一个优选的实施方案中,所述的紊乱包含Her-2阳性的肿瘤,并且所述的方法包含本发明的AdB-2/3纤维多聚体与合适的单克隆抗体治疗(单独的,或者与化疗、放疗或它们的组合组合的)一起共同给予。在另一个优选的实施方案中,单克隆抗体为曲妥单抗。在可以与这些实施方案的任意一个结合的另一个优选的实施方案中,Her-2阳性的肿瘤选自乳腺肿瘤,胃部肿瘤,结肠肿瘤,和卵巢肿瘤。在另一个优选的实施方案中,所述的方法是在未对曲妥单抗产生足够的应答(例如肿瘤缓解的缺乏、肿瘤复发或对曲妥单抗发展出抗性)的患者上实施的。此外,这些实施方案的方法还可以用于帮助减少获得治疗效力所需的曲妥单抗的剂量,并且由此可以限制副作用(例如曲妥单抗有关的心脏毒性)。
在可以与本发明的任意一个实施方案或实施方案的组合结合的另一个优选的实施方案中,所述的紊乱包含EGFR-阳性的肿瘤,并且所述的方法包含本发明的AdB-2/3纤维多聚体与合适的单克隆抗体治疗(单独的,或者与化疗、放疗或它们的组合组合的)一起共同给予。在另一个优选的实施方案中,单克隆抗体为西妥昔单抗。在可以与这些实施方案的任意一个结合的另一个优选的实施方案中,EGFR-阳性的肿瘤选自肺肿瘤,结肠肿瘤,乳腺肿瘤,直肠肿瘤,头颈肿瘤,和胰腺肿瘤。在另一个优选的实施方案中,所述的方法是在未对西妥昔单抗产生足够的应答(例如肿瘤缓解的缺乏、肿瘤复发或对西妥昔单抗发展出抗性)的患者上实施的。此外,这些实施方案的方法还可以用于帮助减少获得治疗效力所需的西妥昔单抗的剂量,并且由此可以限制副作用(例如在西妥昔单抗治疗过程中经常发生的痤疮样皮疹)。
在可以与本发明的任意一个实施方案或实施方案的组合结合的另一个优选的实施方案中,所述的紊乱包含上皮肿瘤,并且所述的方法包含本发明的AdB-2/3纤维多聚体与血管内皮生长因子(VEGF)抑制剂(单独的,或者与其他化疗、放疗或它们的组合组合的)一起共同给予。可以使用任何合适的VEGF抑制剂,包含但不限于贝伐单抗。
在可以与本文所述的任意一个实施方案或实施方案的组合结合的另一个实施方案中,涉及实体肿瘤的方法进一步包含给予能够降解肿瘤基质蛋白质的化合物。可以使用用于降解肿瘤基质蛋白质的任何合适的化合物,包含但不限于松弛肽,胶原酶,胰岛素,分散酶,MMP(金属蛋白酶)-1,和MMP8。此类化合物的传递可以为任何合适的机制,包含基因治疗,其与AdB-2/3纤维多聚体和治疗剂分开给予,或者与AdB-2/3纤维或治疗剂形成缀合物来给予。
在可以与本文所述的任意一个实施方案或实施方案的组合结合的其他实施方案中,所述的方法进一步包含与其他连接开放剂组合给予AdB-2/3多聚体。如本文所用,“连接开放剂”为能够瞬间打开细胞间连接的化合物。可以使用任何合适的连接开放剂。在一个非限定性实施方案中,连接开放剂包含封闭带毒素(Zot),其为一种霍乱弧菌(Vibrio cholerae)生产的毒素,该毒素具有可逆地改变肠上皮连接的能力,从而使高分子通过粘膜屏障(Fasano et al.(1991)Proc Natl Acad Sci U S A 88:5242-5246)。Zot衍生的六肽(AT-1001)已经被研发出来。在另一个实施方案中,(Clostridium perfringens)肠毒素由紧密连接处除去了claudins-3和-4((SonodaN,et al.(1999)J Cell Biol 147:195-204)。在另一个实施方案中,由人类Ad、HPV和HTLV-1编码的肿瘤蛋白可以通过使连接蛋白ZO-1错位而瞬间打开上皮连接(Latorre IJ,et al.(2005)J Cell Sci118:4283-4293)。在其他的实施方案中,多种人类病毒参与紧密连接或者其他的细胞连接分子,从而进入至上皮细胞中。在这些病毒中由肝炎C病毒(Evans MJ,et al.(2007)Nature 446:801-805)、呼吸道肠道病毒(Barton ES,et al.(2001)Cell 104:441-451)和单纯胞疹病毒(Geraghty RJ,et al.(1998)Science 280:1618-1620)。
在另一个实施方案中,治疗剂为吸入治疗剂。在本发明的方法中可以使用任何合适的吸入治疗剂。在多个非限定性实施方案中,吸入治疗剂选自皮质甾体,支气管扩张药,β激动剂,抗胆碱能剂,舒喘灵左旋沙丁胺醇吡布特罗异丙托溴胺氯地米松,布地缩松,氟尼缩松氟替卡松,曲安奈德,氟替卡松(皮质甾体)和沙美特罗formotorol(长效β-激动剂支气管扩张药)和布地缩松(皮质甾体)舒喘灵(β激动剂)和异丙托铵(抗胆碱能剂)(布地缩松(PULMICORT),和噻托溴铵(抗胆碱能剂支气管扩张药)。
在另一个实施方案中,所述的化合物包含诊断剂或成像剂。本发明的方法广泛地用于将任何诊断剂、成像剂或其他化合物传递至包含细胞间连接(其中所关注的靶物的接近受到限制)的上皮组织中。在多个非限定性实施方案中,成像剂可以包含能够直接或间接产生可检测的信号的任何化学化合物。许多此类成像剂是本领域的那些技术人员已知的。适用于所公开的方法和组合物中的成像剂的实例为放射性同位素、荧光分子、磁性颗粒(包含纳米颗粒)、金属颗粒(包含纳米颗粒)、磷光发光分子、酶、抗体、配体和它们的组合,同时诊断剂可以包含这样的化合物,其为用于特定的上皮紊乱的、与所述的成像剂结合的诊断标志物。此外,用于检测和测量成像剂所产生的信号的方法也是本领域的那些技术人员所已知的。例如可以通过闪烁计数或直接显示来检测放射性同位素;可以使用荧光分光光度计来检测荧光分子;可以使用分光光度计来检测荧光分子或者使用照相机直接显示荧光分子;可以检测或显示由酶催化的反应产物来检测酶;可以通过检测与抗体偶联的二级检测标记来检测抗体。在一个优选的实施方案中,成像剂和/或诊断剂为通过直接的肿瘤结合或者通过使成像剂或诊断剂与可以结合肿瘤的化合物偶联而可以用于检测肿瘤的试剂。
在一个实例中,所述的成像剂可以包含荧光成像剂,同时诊断剂可以包含这样的化合物,其为用于特定的上皮紊乱的、与所述的荧光成像剂结合的诊断标志物。荧光成像剂为具有可检测的荧光信号的任何化学部分。该成像剂可以单独使用,或者与其他的成像剂组合使用。可以用于本文所公开的组合物和方法中的合适的荧光剂的实例包含但不限于荧光素(FITC),5-羧基荧光素-N-羟基琥珀酰亚胺酯,5,6-羧甲基荧光素,硝基苯-2-氧杂-1,3-二唑-4-基(NBD),荧光胺,OPA,NDA,吲哚花青绿染料,花青染料(例如Cy3,Cy3.5,Cy5,Cy5.5和Cy7),4-乙酰氨基-4'-异硫氰酸二苯-2,2'二磺酸,吖啶,吖啶异硫代氰酸酯,5-(2'-氨基乙基)氨基萘-1-磺酸(EDANS),4-氨基-N-[3-乙烯基砜基)苯基萘亚胺-3,5二磺酸酯,N-(4-苯胺-1-萘基)马来酰亚胺,邻氨基苯甲酰胺,BODIPY,亮黄,香豆素,7-氨基-4-甲基香豆素(AMC,香豆素120),7-氨基-4-三氟甲基香豆素(香豆满151),焰红染料,4',6-二脒基-2-苯基吲哚(DAPI),5',5”-二溴焦棓酸-磺酚酞(溴焦酚红),7-二乙基氨基-3-(4'-异硫代氰酰苯基)-4-甲基香豆素二亚乙基三胺五乙酸酯,4,4'-二异硫代氰酰二氢-芪-2,2'-二磺酸,4,4'-二异硫氰酸二苯-2,2'-二磺酸,5-[二甲基氨基]萘-1-砜基氯化物(DNS,丹磺酰氯),4-(4'-二甲基氨基苯基偶氮)苯甲酸(DABCYL),4-二甲基氨基苯基偶氮苯基-4'-异硫代氰酸酯(DABITC),曙红,曙红异硫代氰酸酯,赤藓红B,赤藓红,异硫代氰酸酯,溴化乙锭,乙锭,5-羧基荧光素(FAM),5-(4,6-二氯代三嗪-2-基)氨基荧光素(DTAF),2',7'-二甲氧基-4'5'-二氯代-6-羧基荧光素(JOE),荧光素异硫代氰酸酯,IR144,IR1446,孔雀绿异硫氰酸酯,4-甲基伞行酮,邻甲酚酞,硝基酪氨酸,副蔷薇苯胺,酚红,B-藻红蛋白,临苯二甲醛,芘,芘丁酸酯,琥珀酰亚胺基1-芘丁酸酯,活性红4(汽巴[R]艳红3B-A),6-羧基-X-若丹明(ROX),6-羧基若丹明(R6G),丽丝胺若丹明B砜基氯化物若丹明(Rhod),5,6-四甲基若丹明,若丹明B,若丹明123,若丹明X异硫代氰酸酯,磺酰若丹明B,磺酰若丹明101,磺酰若丹明101的砜基氯化物衍生物(德克萨斯红),N,N,N',N'-四甲基-6-羧基若丹明(TAMRA),四甲基若丹明,四甲基若丹明异硫代氰酸酯(TRITC),核黄素,蔷薇酸,香豆素-6等,包含它们的组合。这些荧光成像部分可以得自多种市售来源(包含Molecular Probes,Eugene,Oreg.和Research Organics,Cleveland,Ohio),或者可以通过本领域的那些普通技术人员来合成。
在另一个实例中,所述的成像剂可以包含磁共振成像(MRI)剂,同时诊断剂可以包含这样的化合物,其为用于特定的上皮紊乱的、与所述的MRI剂的诊断标志物。MRI剂为具有可检测的磁共振信号或者可以影响(例如增强或迁移)另一种试剂的磁共振信号的任何化学部分。这种类型的成像剂可以单独使用或者与其他的成像剂组合使用。在另一个实例中,钆基MRI剂可以起到成像剂的作用。可以并入至所公开的成像剂中的合适的MRI剂的实例为对氨基-苄基二亚乙基三胺五乙酸(p-NH2-Bz-DTPA,化合物7),其为二亚乙基三胺五乙酸(DTPA)的缀合物形式,已知其强烈地结合钆并且被批准作为磁共振对比剂而用于临床用途中。在大的高分子(例如本文所公开的枝状底物)上引入MRI剂可以得到大的T1弛豫(高对比)并且可以在单一分子上具有多个拷贝(这可以增强信号)。通过将MRI成像剂与例如荧光成像剂结合,可以实时通过MRI检测、成像和跟踪所得的试剂。其他成像剂包含PET剂,其可以通过引入18F或用于64Cu或68Ga的螯合剂来制备。此外,可以利用放射性核的加入来促进SPECT成像和放射剂量的传递,同时诊断剂可以包含这样的化合物,其为用于特定的上皮紊乱的、与所述的PET剂结合的诊断标志物。
在一些实施方案中,诊断剂为诊断成像剂,包含但不限于正电子发射成像(PET)剂,计算机成像(CT)剂,磁共振成像(MRI)剂,核磁成像剂(NMI),荧光透视剂和超声对比剂。此类诊断剂包含放射性同位素,例如碘(I)(包含123I,125I,131I等)、钡(Ba)、钆(Gd)、锝(Tc)(包含99Tc)、磷(P)(包含31P)、铁(Fe)、锰(Mn)、铊(Tl)、铬(Cr)(包含51Cr),碳(C)(包含14C)等之类的元素;荧光标记的化合物或它们的复合物、螯合物、加成物和缀合物。可以使用任何合适的PET剂,包含但不限于碳-11,氮-13,氧-15,氟-18,11C-美托咪酯和它们的葡萄糖类似物,包含但不限于氟脱氧葡萄糖(使用氟-18标记的葡萄糖类似物)。
在其他的实施方案中,诊断剂为编码蛋白质(当其在细胞内表达时可以容易地检测,包含但不限于β-半乳糖苷酶,绿色荧光蛋白,荧光素酶等)的标志物基因和标记的核酸探针(例如放射性标记的或荧光标记的探针)。在一些实施方案中,诊断剂或成像剂与本文所提供的AdB-2/3多聚体的共价缀合是根据多种缀合工艺来完成的。在其他的实施方案中,诊断剂与所提供的AdB-2/3多聚体非共价结合。
在另一个方面中,本发明提供了用于改善物质向上皮组织的传递的方法,其包含将上皮组织与以下物质相接触:(a)一种或多种待传递至上皮组织的化合物;以及(b)足以增强一种或多种化合物传递至上皮组织的量的、本发明的AdB-2/3纤维多聚体。在这一方面中,所述的化合物可以为任何合适的化合物,例如上文详细描述的那些。在优选的实施方案中,一种或多种化合物包含成像剂。在另一个优选的实施方案中,上皮组织包含实体肿瘤,包含本申请中公开的那些的任意一种。在多个非限定性实施方案中,实体肿瘤选自乳腺肿瘤,肺肿瘤,结肠肿瘤,直肠肿瘤,胃肿瘤,前列腺肿瘤,卵巢肿瘤,子宫肿瘤,皮肤肿瘤,内分泌肿瘤,子宫颈肿瘤,肾肿瘤,黑素瘤,胰腺肿瘤,肝脏肿瘤,脑肿瘤,头颈肿瘤,鼻咽肿瘤,胃部肿瘤,鳞状细胞癌,腺癌,膀胱肿瘤,和食道肿瘤。包含本发明的一个或多个AdB-2/3纤维多聚体的、可以用于这些方法中的示例性多聚体包含但不限于AdB-2/3病毒体,AdB-2/3衣壳,AdB-2/3十二面体颗粒(PtDd)(由AdB-2/3在它们的复制过程中生产的亚病毒十二面体颗粒),和重组AdB-2/3纤维多聚体。
在另一个方面中,本发明提供了用于改善物质向表达桥粒芯糖蛋白2(DSG2)的细胞或组织的传递的方法,其包含将表达DSG2的细胞或组织与以下物质相接触:(a)一种或多种待传递至上皮组织的化合物;以及(b)足以增强一种或多种化合物传递至组织的量的、本发明的AdB-2/3纤维多聚体。表达DSG2的示例性组织类型包含但不限于上皮细胞/组织(例如本文所公开的那些),人类血小板和粒细胞。如以下实例中所示,DSG2在非极化的细胞中起到受体的作用。因此,这些方法不仅在上皮细胞和组织中具有用途,而且还与例如在AdB-2/3发病机理和AdB-2/3载体(用于基因治疗)的血管内应用中具有相关性。包含本发明的一种或多种AdB-2/3纤维多聚体的、可以用于这些方法中的示例性多聚体包含但不限于AdB-2/3病毒体,AdB-2/3衣壳,AdB-2/3十二面体颗粒(PtDd)(由AdB-2/3在它们的复制过程中生产的亚病毒十二面体颗粒),和重组AdB-2/3纤维多聚体。
在另一个方面中,本发明提供了在组织中诱导上皮细胞向间充质细胞转化(EMT)的方法,其包含将上皮组织与有效诱导EMT的量的、本发明的AdB-2/3纤维多聚体相接触。EMT为细胞分化转移程序,其中上皮细胞失去了特征(例如细胞间连接)并获得了间充质细胞的性质。EMT可表征为间充质细胞标志物的表达增加、细胞外基质化合物的表达增加、上皮细胞标志物的表达减少、转录因子的位置改变、激酶活化、以及细胞间连接解离。包含本发明的一种或多种AdB-2/3纤维多聚体的、可以用于这些方法中的示例性多聚体包含但不限于AdB-2/3病毒体,AdB-2/3衣壳,AdB-2/3十二面体颗粒(PtDd)(由AdB-2/3在它们的复制过程中生产的亚病毒十二面体颗粒),和重组AdB-2/3纤维多聚体。
在本发明的所有方面和方法的实施方案中,治疗剂、诊断剂和/或成像剂可以与AdB-2/3多聚体(例如通过上文公开的本发明的组合物)一起给予,或者可以分开给予。在一个实施方案中,治疗剂和AdB-2/3多聚体可以通过任何合适的共价结合或非共价结合而附着。在一个非限定性的实施方案中,AbB-2/3多聚体可以附着在毒素或其他药品上,从而杀灭实体肿瘤细胞。
根据局部方式给予或系统方式给予对于待治疗的条件是否是最适合的,AdB-2/3纤维多聚体和/或治疗剂可以以主治医师认为合适的任何方式给予。如本文所用,认为术语“系统性传递”和“系统性给予”包含但不限于口服和胃肠外途径,包含肌肉内(IM)、皮下、静脉内(IV)、动脉内、吸入、舌下、口腔、局部、经皮、鼻内、直肠、阴道和使得传递试剂有效地分散至预期治疗作用的一个或多个位点的其他给予途径。用于本发明组合物的优选的系统传递途径包含静脉内、肌肉内、皮下和吸入。在一个优选的实施方案中,采用静脉内给予,例如用于治疗散播的肿瘤(和用于单克隆抗体的传递)。在另一个实施方案中,口服传递是优选的,例如用于治疗胃肠(GI)上皮紊乱。在另一个实施方案中,鼻内或气溶胶传递优选用于传递至肺,例如用于肺的上皮紊乱。
AdB-2/3纤维多聚体可以与另一种分子(例如用于保护多肽免于酶降解的脂质或脂质体)联合引入。例如聚合物(特别是聚乙二醇(PEG))的共价连接已经用于保护某些蛋白质免于在肌体内被酶水解,并由此延长半衰期。
在测定会保持所需的治疗作用水平的间隔下,周期性地系统给予AdB-2/3纤维多聚体和/或治疗剂。例如静脉内注射给予可以每天一次,每周一次,每2周至4周一次或者更低频率的间隔。医生在考虑可能影响试剂组合的作用的多种因素后来测定剂量方案。这些因素包含待治疗的状况的进展程度,患者的年龄、性病和体重,以及其他的临床因素。AdB-2/3纤维多聚体和/或治疗剂的剂量将根据给予的多聚体和/或治疗剂的功能以及任何药品传递媒介物(例如缓释传递媒介物)的存在和本性而改变。此外,剂量可以调节,从而说明给予频率的改变以及传递试剂(多种)的药代动力学行为。AdB-2/3纤维多聚体的剂量范围通常为0.01至250mg/kg、优选为0.1至10mg/kg、并且更优选的是0.1至0.5mg/kg。医疗从业者可以容易地确认经批准的治疗剂的剂量。此外,由于治疗剂向上皮组织(例如癌症)的渗透增强,治疗剂还可以能够以减少的剂量给予。
AdB-2/3纤维多聚体可以在给予治疗剂之前、同时或之后给予受试对象。在优选的实施方案中,同时给予治疗剂和AdB-2/3纤维多聚体。治疗剂相对于AdB-2/3纤维多聚体给予的时机可以改变以取得最大的治疗效果。优选的是,在确保与由AdB-2/3纤维多聚体与DSG2结合而引起的细胞间连接的瞬间打开相关联时给予治疗剂。例如治疗剂可以在给予AdB-2/3纤维多聚体之前、同时或之后给予。在其他优选的实施方案中,治疗剂可以在给予AdB-2/3纤维多聚体之后给予,例如直至5分钟,10分钟,15分钟,30分钟,45分钟,1小时,2小时,3小时,4小时,5小时,6小时,8小时,10小时,12小时,18小时,24小时,30小时,36小时,40小时,42小时,48小时,54小时,60小时,66小时,72小时,78小时,84小时,90小时,或者在给予AdB-2/3纤维多聚体之后直至96小时。
在另一个方面中,本发明提供了用于治疗与上皮组织有关的紊乱的方法,其包含向有需要的收拾对象给予有效治疗所述的紊乱的量的、本发明的AdB-2/3纤维多聚体。在该实施方案中,未传递其他治疗剂。在非限定性的实施方案中,使用单一治疗来治疗选自以下的紊乱:AdB-2/3病毒感染、实体肿瘤或可以使用AdB-2/3基基因传递载体治疗的紊乱。例如在治疗实体肿瘤中,所述的方法包含改善免疫系统细胞与紊乱位点的接近,例如通过渗透(例如预存的天然杀伤细胞、T细胞或树突状细胞)。此外,所述的方法还可以用于治疗与上文讨论的上皮细胞(可以受益于免疫系统的细胞与靶物上皮细胞的改善的接近)有关的任意一种紊乱。在一个优选的实施方案中,所述的紊乱为实体肿瘤,并且所述的方法包含改善免疫系统对肿瘤的攻击。所述的方法可以用于上文讨论的任意一种实体肿瘤。除非上下文另外明确地说明,否则本发明的第一个方面的所有实施方案和实施方案的组合可以用于第二个方面中。包含本发明的一种或多种AdB-2/3纤维多聚体的、可以用于这些方法中的示例性多聚体包含但不限于AdB-2/3病毒体,AdB-2/3衣壳,AdB-2/3十二面体颗粒(PtDd)(由AdB-2/3在它们的复制过程中生产的亚病毒十二面体颗粒),和重组AdB-2/3纤维多聚体。
在另一个方面中,本发明提供了用于识别候选化合物的方法,其中所述的候选化合物用于治疗以下的一种或多种:治疗与上皮组织有关的紊乱;改善物质向上皮组织的传递;改善物质向表达DSG2的组织的传递;在组织中诱导EMT;和/或治疗AdB-2/3感染,所述的方法包含:(a)在促进多聚体与DSG2结合的条件下,将本发明的AdB-2/3纤维多聚体与DSG2相接触,其中所述的接触是在一种或多种测试化合物存在下实施的;以及(b)识别与AdB-2/3纤维多聚体竞争性结合DSG2的阳性测试化合物(与对照相比);其中阳性测试化合物为用于以下一种或多种的候选化合物:治疗与上皮组织有关的紊乱;改善物质向上皮组织的传递;改善物质向表达DSG2的组织的传递;在组织中诱导EMT;和/或治疗AdB-2/3感染。
与AdB-2/3纤维多聚体竞争性结合DSG2的阳性测试化合物为通过它们与DSG2的相互作用而瞬间打开细胞间连接的候选化合物。用于证明所述的化合物能够通过它们与DSG2的相互作用而时间打开细胞间连接的定期复查检测可以通过任何合适的方法来实施,包含但不限于在以下实施例中公开的研究。如此被识别用于治疗与上皮组织有关的紊乱、改善物质向上皮组织的传递、改善物质向表达DSG2的组织的传递或诱导组织中的EMT的化合物在本发明的任意一种方法中可以用作AdB-2/3多聚体的取代物。此外,AdB-2/3代表了导致呼吸道感染(一些严重的)和咽结膜热的重要的人类病原体。因此,可以治疗AdB-2/3感染的化合物是有用的。如本文所公开的那样,作为AdB-2/3使用的主要的高亲和性受体以及由此可以减少AdB-2/3与DSG2的化合物为用于治疗或限制AdB-2/3感染的发展的候选化合物。
包含本发明的一种或多种AdB-2/3纤维多聚体的、可以用于这些方法中的示例性多聚体包含但不限于AdB-2/3病毒体,AdB-2/3衣壳,AdB-2/3十二面体颗粒(PtDd)(由AdB-2/3在它们的复制过程中生产的亚病毒十二面体颗粒),和重组AdB-2/3纤维多聚体。可以使用任何合适的对照,包含但不限于在测试化合物缺乏下,与DSG2结合的AdB-2/3多聚体。
在一个实施方案中,DSG包含重组DSG2。在另一个实施方案中,所述的方法使用了在细胞表面上表达DSG2(内源的或重组的)的细胞。
在一个非限定性的实施方案中,可以使用表面等离子体共振(SPR)研究(使用了包含固定的重组DSG2的传感器),结合DSG2竞争性研究,来识别与DSG2结合的AdB-2/3纤维多聚体的候选化合物。在另一个实施方案中,所述的识别包含传导研究,其中当功能AdB-2/3病毒体传导表达DSG2的上皮细胞的能力降低时,检测为测试化合物能够减少结合。在另一个实施方案中,对表达DSG2的细胞提取物进行电泳分离和Western印迹,并在测试化合物存在下,使用标记的AdB-2/3纤维多聚体来探测Western印迹。在另一个实施方案中,可以使用斑点印迹检测,例如在Wang et al.,J.Virology(2007)81:12785-12792;和Wang et al.(2008)82:10567-10579中描述的那些。
当测试化合物包含多肽序列时,此类多肽可以是化学合成的或重组表达的。如上文所公开的那样,可以使用本领域标准的方法来完成重组表达。此类表达载体可以包含细菌或病毒表达载体,并且此类宿主细胞可以为原核的或真核的。使用固相、液相、肽浓缩技术或它们的组合的公知技术而制备的合成多肽可以包含天然和非天然氨基酸。用于肽合成的氨基酸可以为具有标准的脱保护、中和、偶联和洗涤方案的标准的Boc(Nα-氨基保护的Nα-叔丁氧羰基)氨基酸树脂,或者标准的碱不稳定的、Nα-氨基保护的9-芴基甲氧羰基(Fmoc)氨基酸。Fmoc和BocNα-氨基保护的氨基酸可以得自Sigma,Cambridge Research Biochemical,或者本领域的那些技术人员所熟悉的其他化学公司。此外,可以使用本领域的那些技术人员所熟悉的其他Nα-保护基团来合成多肽。固相肽合成可以通过本领域的那些技术人员所熟悉的技术来完成,并且可以通过例如使用自动化合成仪来提供。
当测试化合物包含抗体时,此类抗体可以为多克隆或单克隆的。抗体可以为人源化的、完全人类的、或鼠科形式的抗体。此类抗体可以通过公知的方法来制备,例如Harlow and Lane,Antibodies;A Laboratory Manual,Cold Spring Harbor Laboratory,Cold Spring Harbor,N.Y.,(1988)。
当测试化合物包含核酸序列时,此类核酸可以为化学合成的或重组表达的。重组表达技术是本领域那些技术人员所公知的(例如参见Sambrook,et al.,1989,supra)。核酸可以为DNA或RNA,并且可以为单链或双链的。类似地,此类核酸可以使用本领域的标准的技术,通过人工或自动化反应来化学或酶合成。如果如果核酸是化学合成的或通过体外酶合成的,则可以纯化该核酸,然后引入至细胞中。例如可以通过溶剂或树脂的提取、沉淀、电泳、层析或它们的组合由混合物中纯化核酸。备选地,可以在未进行纯化或少量纯化下使用核酸,以避免由于样品处理而导致的损失。
当测试化合物包含除了多肽、抗体或核酸以外的化合物时,可以通过用于实施有机化学合成领域中多种方法的任意一种方法来制备此类化合物。
实施例
对腺病毒纤维球结构域与桥粒芯糖蛋白2的相互作用的结构和功能研究
摘要
人类腺病毒(Ad)血清型Ad3,Ad7,Ad11,Ad14,以及近来出现的新毒株Ad14(Ad14p1)使用了上皮连接蛋白质桥粒芯糖蛋白2(DSG2)作为感染受体。与Ad与CAR和CD46的相互作用不同,Ad结合DSG2的结构详情仍是不清楚的。使用基于随机Ad3和Ad14p1纤维球突变体的E.coli表达文库的方法,我们识别出多个氨基酸残基,当这些残基单独突变时,会消除或减少Ad球与DSG2的结合。这些残基在纤维球极远端的一个沟槽内部形成了3个簇。此外,Ad3纤维球突变体文库还用于识别与DSG2亲和性增加的变体。我们在Ad3球的EF环的内部或附近发现大量的突变,其中所述的Ad3球与野生型Ad3球相比,与DSG2的亲和性高出几个数量级。一个突变体的晶体结构分析显示引入的突变使得EF环更具有挠性,这可能有利于与DSG2的相互作用。我们的发现与癌症的治疗具有实际的相关性。最近,我们报告包含重组蛋白质(JO-1)的Ad3纤维球能够引发上皮癌细胞之间的连接的打开,这转而极大地改善治疗剂的瘤内渗透和效力。在此,我们示出亲和性增强版本的JO-1在一系列的癌症模型中比亲代蛋白质具有更高的治疗有效性。
引言
近来,我们识别出作为一组B腺病毒物种的主要受体的DSG2,其中所述的B腺病毒包含腺病毒血清型3(Ad3),其为广泛分布于人类群体中的血清型(42)。我们发现,DSG2与Ad3内部的结构域(多个)的相互作用是通过多个纤维球而形成的(41)。Ad3-纤维球-DSG2相互作用的这种特定模型提供了高的亲合力,并且与上皮连接的打开具有功能相关性(41,42)。该功能相关性涉及DSG2的聚类以及可以想象的上皮细胞向间充质细胞转化的途径(包含MAP激酶的磷酸化以及连接蛋白质表达的下调节)的活化(6,40,42)。打开上皮连接的能力对于Ad3渗透至气道上皮细胞中并在其中散布而言似乎是重要的(40-42)。在最近的研究中,我们尝试发现赋予与DSG有效结合的Ad3衣壳内的最少部分(41)。我们生成了小的重组蛋白质,其包含Ad3纤维球以及允许三聚体Ad3纤维素(JO-1)自体二聚化的结构域(41)。JO-1可以在E.coli中容易地生产,并且可以通过亲和色谱来纯化。在极化的上皮细胞培养物中,JO-1引发了细胞间连接的打开,同时将JO-1静脉注射至具有上皮肿瘤的小鼠中允许抗癌药品更好地渗透(5,6)。
本研究的第一个目标是进一步描述Ad3纤维球-DSG2相互作用的结构特征。这包含识别Ad3纤维球内与DSG2结合有关的氨基酸残基,并创建与DSG2的结合被减少和消除的JO-1突变体。本研究的第二个目标(其具有翻译相关性)是通过增强与DSG2的亲和性而改善JO-1,从而增加治疗效果。这是通过识别与DSG2的结合增加的突变体来进行的。
这2个目标都是使用Ad3纤维球突变体的E.coli表达文库来实现的。我们识别出Ad3纤维球(其与DSG2的结合重要相关)内3个不同簇中的残基。所有残基都位于面对受体的纤维球的极远端的一个沟槽中。然后,我们评估这些突变对纤维球打开上皮连接的能力(通过体外测量极化上皮细胞中的跨膜电阻)以及在具有上皮异种移植肿瘤的小鼠中增强化疗药品效力的能力的影响。如所预计的那样,当将与DSG2的亲和性降低的突变引入至JO-1中时,所得的蛋白质很少能够打开上皮连接。另一方面,增加JO-1与DSG2的亲和性的大量突变在打开上皮连接中显示出更强的活性。总之,这些研究显示出Ad3-纤维球与DSG2的亲和性以及随后对上皮连接的作用之间的相关性。
本研究的第三个目标是描绘DSG2与另一种靶向DSG2的Ad血清型的纤维球残基的相互作用,其中所述的另一种靶向DSG2的Ad血清型为新出现的毒株Ad14p1(44),其被认为比亲代毒株(Ad14-deWit)更具有致病性/毒性(10,16,22)。Ad14p1的β折叠的分布与Ad3不同,其可以潜在地得到DSG2结合模型的不同。因此,我们生成了Ad14p1纤维球突变体(用于识别DSG2与Ad14p1的残基相互作用)的E.coli表达文库。
材料和方法
蛋白质:重组人类DSG2蛋白质得自Leinco Technologies,Inc.(St.Louis,MO)。Ad14p1纤维球衍生自Ad14p1病毒(毒株Portland 2971/2007,由the Center for Disease Control and Prevention(Atlanta,GA)提供)(44)。使用pQE30表达载体(Qiagen,Valencia,CA)在具有N-末端6-His标签的E.coli中生产纤维球,并如别处所述通过Ni-NTA琼脂糖层析进行纯化(43)。
细胞系:将293、HeLa和A549细胞保持在补充有10%FBS,100U/ml青霉素,100μg/ml链霉素(P/S),2mM谷氨酰胺(Glu)和1x MEM非必需氨基酸溶液(Invitrogen,Carlsbad,CA)的DMEM中。将结肠癌T84细胞(ATCC CCL-248)在Ham's F12培养基以及DMEM、10%FBS、Glu和P/S的1:1混合物中培养。Ovc316细胞为由卵巢癌活组织检测验收得到的Her2/neu阳性上皮肿瘤细胞(32)。将Ovc316细胞在MEGM(Lonza,Mapleton,IL)中培养,其包含3μg/L hEGF,5μg/L胰岛素,5mg/L氢化可的松,26mg/L牛垂体提取物,25mg/L两性霉素B(Lonza),并补充有1%FBS,100I.U.青霉素,100μg/L链霉素,10mg/L环丙沙星。将MDA-MB-231细胞(一种三阴性乳腺癌细胞系(ATCC-HTB-26))在补充有10%FBS,100I.U.青霉素,100μg/L链霉素的Leibovitz's L-15培养基中培养。TC1-DSG2衍生自TC1细胞,其为表达HPV16E6和E7的C57Bl/6肺癌细胞系(36)。使用表达人类DSG2的VSVG-假型慢病毒载体转导TC1细胞(42)。选择表达在人类肿瘤中可见水平的人类DSG2的克隆用于体内研究。
腺病毒:按照别处所述进行野生型Ad3的传代、甲基-3H胸苷标记、纯化和滴定(37)。Ad3-GFP为野生型Ad3基载体,其包含插入至E3区中的CMV-GFP表达盒(42)。通过在260nm(OD260)下测量光密度而采用风光光度法癌测定病毒颗粒(VP)的浓度。如别处所述,使用293细胞来滴定空斑形成单位(pfu)的效价(29)。对于所有的病毒制备物而言,VP与pfu的比例为20:1。
Ad3球的文库:通过PCR,使用引物P1:5’ATCACGGATCCGGTGGCGGTTCTGGCGGTGGCTCCGGTGGCGGTTCTAACAAACTTTGCAGTAAACTC 3’(SEQ ID NO:35)和P2:5’CTCAGCTAATTAAGCTTAGTCATCTTCTCTAATATAGGA 3’(SEQ ID NO:36)由Ad3DNA获得Ad3球(aa 108-319)(其包含最后2个杆的重复序列)的编码序列,并将其克隆至pQE30(Qiagen,Valencia,CA)中用于在E.coli中表达。所得的质粒称为pQE-Ad3球。基于别处公开的方案实施随机诱变PCR(7,8)。简言之,将20fmoles pQE-Ad3球DNA模板,30pmoles(每种)PCR引物(Pmut1:5’-
CCAATTCTATTGCACTTAAGAATAACACTTTATGGACAGGT-3’(SEQ ID NO:37)和Pmut2:5’-
GTCCAAGCTCAGCTAATTAAGCTTAGTCATCTTC-3’(SEQ ID NO:38),2.5μl、3.5μl、5μl或10μl 10x诱变缓冲剂(70mM MgCl2,500mM KCl,100mM Tris(pH8.3,在25℃),0.1%(w/v)凝胶),10μl 5mM MnCl2,10μl dNTP混合物(2mM dGTP,2mM dATP,10mM dCTP,10mM dTTP)以及5单位Taq聚合酶(Promega,Madison,WI)混合,并且终体积为100μl。PCR条件为94℃,1分钟;45℃,1分钟;以及72℃,1分钟(30个循环)。纯化突变PCR产物(长度为615bp,仅在纤维球头部的阅读框中包含突变),使用合适的酶消化,并克隆至质粒pQE-Ad3球中。对于随机诱变文库的质量控制而言,将连接产物转化至E.coli M15(Qiagen,Valencia,CA)中,平板接种于卡那霉素和氨苄青霉素平板上,并随机挑取50个克隆用于测序。
Ad14文库:通过PCR,使用引物P1:5’CATCACGGATCCGGTGGCGGTTCTGGCGGTGGCTCCGGTGGCGGTTCTAATAAACTTTGTACCAAATTGGGAGAAGG 3’(SEQ ID NO:39)和P2:5’GCTAATTAAGCTTAGTCGTCTTCTCTGATGTAGTAAAAGG 3’(SEQ ID NO:40)由AD14P1DNA获得Ad14p1球(aa 108-323)(其包含最后2个杆的重复序列)的编码序列,并将其克隆至pQE30(Qiagen,Valencia,CA)中用于在E.coli中表达。所得的质粒称为pQE-Ad14p1球。通过使用PCR引物(Pmut1:5’-AACACCCTGTGGACAGGAGTTAACCC-3’和Pmut2:5’-
CTCAGCTAATTAAGCTTAGTCGTC-3’)实施随机诱变PCR。纯化突变PCR产物(长度为594bp,仅在纤维球头部的阅读框中包含突变),使用合适的酶消化,并克隆至质粒pQE-Ad14p1球中。对于随机诱变文库的质量控制而言,将连接产物转化至E.coliM15(Qiagen,Valencia,CA)中,平板接种于卡那霉素和氨苄青霉素平板上,并随机挑取50个克隆用于测序。
集落的检测:将Ad3或Ad14p1球突变质粒文库转化至XL1 Blue或M15 E.coli宿主菌株中,并平板接种于具有合适抗生素的LB平板(即分别为Amp或者Amp+Kan)上。在过夜生长后,将0.45μmDurapore滤膜(Millipore,Billerica,MA)放置在集落的上方。剥离该膜,并在集落朝上的条件下将滤膜放置在2片3MM纸上,该3MM纸浸渍在补充有抗生素和1mM IPTG的LB培养基中。在30℃下,在6个小时内诱导集落的蛋白质的表达,其后将具有集落的滤膜放置在硝酸纤维素滤膜和Whatman 3MM纸(其浸渍在本地裂解缓冲剂{20mM Tris-Cl(pH8),300mM NaCl,50mM MgCl2,0.1mg/ml溶菌酶,0.75mg/ml DNAse I,1/2 complete不含EDTA蛋白酶抑制剂混合物片剂/10ml(Roche,PaloAlto,CA)}中)的上方。将“滤膜夹心”在室温下温育10min,然后在-80℃下10min且30℃下10min进行4次冻-融。除去夹心中的纤维素膜,并使用TBST中3%BSA在4℃下过夜封闭。然后将印迹与0.1ng/ml重组DSG2蛋白质(Leinco,St.Louis,MO)在TBST/BSA中温育,然后与小鼠单克隆抗DSG抗体(Clone 6D8;SeroTec Ltd.,Oxford,UK)和抗小鼠IgG辣根过氧化物酶缀合物温育。挑取未结合DSG2的集落,并在3ml LB培养基中过夜培养。使用1mM IPTG在5小时内诱导蛋白质的表达,然后细菌形成团,再次悬浮于SDS上样缓冲剂中,并冻/融3次。电泳后,将蛋白质转移至硝酸纤维素上并与抗His抗体(MCA1396,Sertec)温育,从而评估Ad球的三聚化。为了筛选与DSG2结合更强的突变体,将Ad3球突变体文库转化至M15 E.coli宿主菌株中。在室温下,仅在20min内诱导集落的蛋白质的表达。挑选显示出最强烈的DSG2结合信号的集落。
Western印迹:使用具有4-15%梯度聚丙烯酰胺的Mini-PROTEAN预制凝胶(BIO-RAD,Hercules,CA)。每个泳道加载与2x上样缓冲剂(10mM Tris-HCl,pH6.8,200mM DTT,4%SDS,20%甘油,0.2%溴酚蓝)混合的总计1g的蛋白质。样品煮沸(B)5min或者加载未煮沸的(UB)。使用以下运行缓冲剂:25mM Tris,pH8.3,0.192M甘氨酸,0.1%SDS。电泳后,将蛋白质转移至硝酸纤维素上,并如之前所述,与重组人类DSG2蛋白质和抗DSG2抗体温育(42)。扫描Western印迹,并使用ImageJ 1.32软件(National Institutes of Health,Bethesda,MD)定量。将JO-1带的强度设定为100%。对于MAP激酶活性的分析而言,在冰上在20mM肝素(pH 7.5),2mM EGTA,10%甘油,1%TritonX100,1mM PMSF,200μMNa3VO4和蛋白酶抑制剂)中溶解极化的T84培养物。在超声处理后,样品形成团,并将包含蛋白质的上清液储存在-80℃下。使用15g总的蛋白质用于Western印迹,其中使用针对磷酸化p44/42 MAPK(Erk1/2)(Thr202/Tyr204)(Cell Signaling Danvers,MA)的mAb或小鼠抗Erk1/2(Cell Signaling)的mAb。
竞争性检测:通过与Versene温育并使用PBS洗涤使HeLa细胞由培养皿上分离。将总计为105细胞/管再次悬浮于50μl包含不同浓度的Ad3纤维球蛋白质的、冰冷的附着缓冲剂(补充有2mMMgCl2,1%FBS,和20mM HEPES的DMEM),并在冰上温育1小时。然后,在附着缓冲剂中,以8000病毒颗粒(vp)/细胞的感染复数(MOI)加入3H-标记的野生型Ad3病毒,至终体积为100μl。在冰上温育1h后,细胞形成团,并使用0.5ml冰冷的PBS将其洗涤2次。在最后一次洗涤后,除去上清液,并通过闪烁计数器测定细胞结合的放射活性。通过使用病毒体特异性放射活性和细胞的数量来计算每个细胞所结合的VP的数量。
表面等离子体共振:在BIAcore 3000仪器上获得所述的表面等离子体共振。在所有的试验中,将补充有2mM CaCl2的HBS-N(GE-Healthcare,Pittsburgh,PA)用作运行缓冲剂,其流速为5μl/min。使用在10mM醋酸盐缓冲剂pH 4.5(在10分钟内,将其注射在乙基(二甲基氨基丙基)碳二亚胺(EDC)/N-羟基琥珀酰亚胺(NHS)活化的流动池上)中稀释的10μg/ml DSG2来实施在CM4传感器芯片(BIAcore)上的固定。对照流动池通过(EDC/NHS)活化,并通过乙醇胺灭活。在3分钟的结合时间内注射不同浓度的Ad3纤维球蛋白质,然后为在2.5分钟的解离时间,并由乙醇胺灭活的EDC-NHS细胞池的背景自动减去信号。使用BIAeval软件计算动力学和亲和性常数。
晶体学:wtAd3和K217E/F224S球突变体的结晶条件使用Hauptman Woodward Medical Research Institute的the High Throughput Screening Lab的服务。对于衍射研究而言,使用悬滴法使wtAd3和K217E/F224S球突变体结晶。使用1.65M MgSO4(7H2O)在TAPS缓冲剂0.1M pH9.0中形成的储存融合以及15mg/ml的蛋白质溶液使晶体生长。使用由85%储存剂和15%甘油(v/v)组成的晶体保护基冷冻晶体。使用EDNA管线,在ESRF的ID14-4上在100K下进行数据收集(19)。使用XDS/XSCALE将数据索引和缩放(20,21),并使用程序PHASER通过分子替代(PDB 1H7Z)解答出结构(25)。建立模型,并分别使用COOT(14)和PHENIX(2)精制模型(表1)。进入“腺病毒3球结构域K217E和F224S突变体的结构”已经分配为RCSB ID编码rcsb080687和PDB ID编码4LIY。
表1.数据收集和精细化统计
Ad3球(K217E/F224S突变体)
最高分辨率的壳的统计示于括号中。
3D结构:使用Pymol软件来分析结构。在紫色的等值面上使用不同的颜色对Ad3球结构域(pdb 1H7Z)中的突变进行染色。在彩色草图中描绘Ad3球突变体K217E/F224S的单体,其中突变呈树枝状的,并且叠放在野生型Ad3纤维球的灰色草图上。
负染色电子显微镜:通过负染色EM来观察重组JO-2蛋白质,从而评估其组装的状态。标准的云母-碳制备物与0.1mg/ml的蛋白质一起使用。使用1%(wt/vol)硅钨酸钠(pH 7.0)染色样品,并在JEOL-1200电子显微镜上在100kV下观察。
渗透性检测:将总计5x105T84细胞接种于12mm Transwell小室(PET膜,孔径为0.4μm(Corning,NY))中并培养>14天,直至跨上皮电阻(TEER)达到稳定。每2-3天更换培养基。将细胞在室温下在附着培养基(DMEM,1%FBS,2mM MgCl2,20mMHEPES)中的DSG2配体(20μg/ml)中暴露15min,并测量TEER,再根据别处所述进行计算(39)。
动物研究:所有涉及动物的试验均是根据the University ofWashington列出的公共机构指导原则来实施的。将小鼠饲养在不含特异性病原体的设备中。免疫缺陷型(CB17)小鼠[鼠种名称:NOD.CB17-Prkdcscid/J]得自the Jackson Laboratory。人类DSG2转基因小鼠包含90kb的人类DSG2基因座,并与人类相似的水平和方式表达hDSG2(40)。
通过将相应的肿瘤细胞注射至CB17小鼠的乳房脂肪垫(与基质胶为1:1)中来建立A549,MDA-MB-231和ovc316异种移植肿瘤。通过将TC1-DSG2细胞皮下注射至DSG2转基因小鼠中来建立TC1-DSG2肿瘤。静脉注射JO-0,JO-1,JO-2,或JO-4,1小时后使用化疗药品:依立替康/CamptosarTM(Pfizer Inc.,Groton,CT),PEG化的脂质体阿霉素/LipodoxTM(Sun Pharmaceuticals IN,India),西妥昔单抗/ErbituxTM(ImClone,Somerville,NJ),纳米颗粒白蛋白缀合的紫杉醇/AbraxaneTM(Abraxis Biosciences,Summit,NJ)。每周3次测量肿瘤体积。每个治疗组由最少5只小鼠组成。处死动物,并且当一个组中的肿瘤达到800mm3的体积或者肿瘤显示溃疡时,终止试验。
抗JO4的抗体:通过ELISA测量人类血清样品中抗JO-4抗体的浓度。使用兔多克隆抗Ad3纤维抗体涂敷平板(42),然后使用重组JO-4、人类血清样品(1:2至1:1000稀释)和抗人类IgG-HRP涂敷平板。由卵巢癌患者得到的血清样品由the Pacific Ovarian Cancer Research Consortium提供。
3D结构:使用Pymol软件来观察Ad3纤维球(MMDB ID:16945,PDB ID:1H7Z(13))的3D结构。
统计学分析:所有结果表达为平均值+/-SD。对于多个测试使用2因子ANOVA。动物数量和p值在图例中示出。
结果
用于DSG2结合的重要的残基:我们首先将我们的工作集中在Ad3上。与DSG2高亲和性地结合以及随后上皮连接打开都需要在病毒体,PtDd,或二聚化的(三聚体)Ad3纤维球(例如JO-1)中存在的空间集群中具有多个三聚体纤维球(41)。具有2个杆基元但不具有二聚化结构域的(“Ad3球单体”)的重组(三聚体)纤维球以低于JO-1几个数量级的亲和性与DSG2结合,不能阻断Ad3感染,并且不能引发连接的打开(37,41,42)。但是,“Ad3球单体”的亲和性足够高,以便在Western印迹中检测结合情况,其中可溶性的DSG2用作探针。因此,我们使用His标签的“Ad3球单体”突变体的E.coli表达文库来识别在Ad3纤维球中对于DSG2结合是重要的氨基酸残基。为了生成该文库,我们在方案中使用诱变PCR(7,8),其中所述的方案平均每个球生成1至2个氨基酸取代。将XL-1蓝E.coli中的Ad3纤维球文库平板接种于琼脂平板上,通过IPTG诱导球的表达,并使用重组DSG2和抗DSG2抗体针对DSG2的结合来筛选集落。针对不与DSG2结合的变体对~10,000个集落进行的第一轮筛选显示出240个候选集落。当针对6x His标签通过Western印迹进行分析时,240个集落中的40个集落显示出表达三聚体纤维球,表明缺乏主要的构象变化。剩余的变体具有截短的纤维球,或者不能形成三聚体。对相应的40个质粒测序。大部分的集落在纤维球内都具有单一的氨基酸取代。如果遇到每个球具有多个氨基酸取代,则合成包含单独的相应的突变的新型Ad3球基因组。对集落的又一轮筛选未发现其他区域,表明已经发现所有的DSG2相互作用的残基。然后,使用总计8个的独立的突变体用于随后的研究(图1A)。对于所有随后的研究而言,我们生成了自体二聚化形式的Ad3纤维突变体(图1B),并使用NTA-Ni通过亲和色谱将其纯化。通过Western印迹,针对DSG2的结合来分析纯化的二聚化的球突变体(图1C-F)。当与JO-1(即包含wtAd3纤维球的二聚化形式)相比,所有突变体在结合中都严重地降低。突变体D261N和F265L几乎完全消除与DSG2的结合,而其他突变体具有不同水平的残基DSG2结合(wtAd3球的3.6%-20%)(表2,“Western印迹”)。所识别的对于Ad3球与DSG2结合重要的残基在Ad3纤维球的CD环/D-β折叠(N186D,V189G,S190P),FG环/G-β折叠(D261N,F265L),和H-β折叠/HI环(L292A,L296R,E299V)的3个不同的区域中(表1A)。在Ad3纤维球(PDB编号1H7Z_A)的3D模型中,所有识别的残基都位于纤维球的顶面,并跟随球中的一个特定的沟槽(图2)。值得注意的是,除了F265L,所有其他的取代都使得相应残基的电荷发生变化。聚丙烯酰胺凝胶的迁移模式的差异(例如D261N)表明取代导致构象变化。我们目前尝试使这些突变体结晶,从而分析它们的3D结构。
为了创建Ad3纤维球以及DSG2的结合最大程度的消除的Ad3病毒,我们将多个突变引入至3个识别的区域中,具体而言,N186D和D261N的组合、D261N和L296R、以及所有3个N186D,D261N,和L296R的组合。如所预计的那样,在所有3个重要的区域中个,突变的组合赋予了最高水平的消除(表2,“Western印迹”,图1F)。
表2:Ad3纤维突变体的分析。第二列显示出相当于Ad3球三聚体的Western印迹带的定量分析。将wtAd3纤维球的强度看作100%。第三列中的数据反映了三聚体Ad3纤维球突变体抑制Ad3-GFP感染的能力(参见图3B)。百分率越高,抑制越强。将JO-1(二聚的wtAd3球)的抑制看作100%。第四列显示Ad3病毒附着的相应的数据。N=3。显示为平均值。标准偏差低于10%。
由于Ad14p1纤维球突变体与最近出现的病原体的相关性,所以我们还生成了(“单体的”)Ad14p1纤维球突变体的文库。针对不与DSG2结合的变体的初步筛选显示~300个候选集落。当通过Western印迹针对6x His标签进行分析时,300个集落中的45个集落显示表达三聚体纤维球。这些变体的测序表明15个独立的突变体与DSG2的结合降低(图1A)。有趣的是,尽管β折叠的分布不同,则对于Ad14p1球结合而言重要的氨基酸残基与在Ad3纤维球中所识别的3个区域相同。由于这些相似性,我们仅使用所选的Ad3纤维球突变体来实施进一步的研究。
功能有效性。在HeLa细胞上实施竞争性研究,其中所述的细胞表达DSG2(42)。在将细胞与三聚体Ad3纤维球预温育后,我们首先研究3H标记的Ad3病毒的附着(图3A)。与JO-1(即在野生型Ad3纤维球中包含二聚的蛋白质)的预温育相比,Ad3病毒的结合降低。将对JO-1的结合的抑制看作100%。突变体L296R,D261N,和F265L阻断Ad3病毒的结合最低(5.1,5.3,和17.6%),其后为突变体S190P,N186D,和E299V(结合分别降低30.9,32.7,和50.7%)(表2,“附着”)。使用相似的检测计划来测量二聚的Ad3球突变体通过Ad3-GFP载体而阻断HeLa细胞的转导的能力。基于GFP的表达来测量转导(图3B)。与我们在附着研究中所见的相似,通过与突变体D261N和F265L预温育使得Ad3-GFP感染降低最低,然后为突变体N186D,S190P,L296R,和V189G。综合考虑DSG2结合(Western印迹)、附着和感染竞争的数据,我们推断包含残基261至265的区域在DSG2的结合中是最重要的区域。此外,在残基186-190周围的区域也有助于结合,同时包含残基299的区域似乎仅稍微涉及到结合。此外,还分析具有组合突变的二聚的Ad3球突变体的、与Ad3病毒竞争地附着(图3C)和感染(图3D)的能力。在所有3个区域(N185,D261,L296)中具有突变的突变体即使在200μg/ml的浓度下均未阻断Ad3的结合或感染,表明与DSG2的结合几乎被消除。显著的是,当在野生型Ad3纤维的Western印迹中使用sCD46作为探针时,未观察到特异性的结合(图4)。这表明Ad3仅无效地结合CD46。
DSG2结合的降低与打开上皮连接的能力减弱之间的相关性。针对二聚的Ad3球突变体的连接打开功能的直接检测是基于测量Transwell小时培养物中的跨上皮电阻(TEER)的。培养上皮癌细胞直至TEER恒定,此时大部分的细胞间连接形成。在1小时内将JO-1加入至Transwell培养物的顶面中使得TEER快速降低,表明连接被打开(图5A)。与突变体D261N温育对TEER没有影响。N186D和E299V具有中等的影响,这与相应的纤维球与DSG2的残余结合有关。在之前的研究中,我们还建立了JO-1会引发异种移植肿瘤的上皮连接的变化,并且增加具有高分子量化疗(例如依立替康)的抗肿瘤效力(依立替康的分子量为586.7Da并且用于治疗结肠癌和肺癌)。我们利用这种影响来评估二聚的Ad3球突变体在体内的功能(图5B)。与我们在体外所观察到的那些相似,JO-1增强了依立替康的治疗,同时与DSG2的结合降低的突变体对依立替康的效力不具有显著的影响。
亲和性增强的二聚的Ad3纤维球:如上文所概括,JO-1与癌症的治疗有关。因此,重要的是更好地理解其与DSG2相互作用的结构详情,并创建与DSG2的亲和性增强的JO-1突变体。亲和性增强的生物制剂可以用于:i)降低其有效的剂量;ii)增加其半衰期;iii)潜在地增加其治疗效果;以及iv)避免患者产生的抗体对生物制剂的不利影响(例如中和或药代动力学的变化)。为了制备亲和性增加的JO-1类似物,我们针对与DSG2结合增加的变体来筛选JO-1内具有随机突变的E.coli表达文库。在平板接种的10000集落中,挑选DSG2信号最强的20个集落,并对质粒DNA测序。识别具有1个或2个氨基酸取代的7个不同的突变体:Y250F,K217E+F224S,N293S,V239D,F224L,E248G+K258E,and L277R+N293D。残基在Ad3纤维球的一级结构和3D结构中的位置示于图6中。显而易见的是,大部分的突变位于EF环内,表明该环涉及稳定Ad3与DSG2之间的相互作用。V239和Y250未暴露于球的表面上,表明球结构的变化,而不涉及与DSG2的直接结合(图6B,右侧面板)。然后,纯化重组的、突变的、二聚的Ad3球蛋白质。为了测量突变体与DSG2的亲和性,我们进行了表面等离子体共振研究。包含二聚化结构域的球的研究结果是复杂的,最可能的是由于这些突变体形成了多聚体复合物的事实。因此,我们对缺乏二聚化结构域(“无DD”)的球蛋白质进行了研究。wtAd3球和所有的球突变体的结合速率常数(ka或kon)、解离速率常数(kd或koff)以及KD示于图7中。与之前的研究一致(41),我们发现不具有二聚化结构域的wtAd3球仅以相对低的亲和性与DSG2结合(KD=10μM)。除了突变体L227R/无DD+N293D/无DD以外,在集落印迹筛选中所识别的所有突变体对DSG2都具有较高的亲和性。显著的是,突变体Y250F/无DD或V239D/无DD的亲和性比wtAd3球/无DD高出885或405倍。不同突变体的高亲和性主要是由于与DSG2更快地结合,而非解离速率的变化。这种趋势的唯一例外是突变体N293S/无DD,对于该突变体而言,当与其他突变体相比时,其结合速率最低。但是,这部分地被较慢的解离速率所补偿。所有这些结果一起表明wtAd3球(noDD)与DSG2的结合主要受到较慢的结合速率的限制,而所述的较慢的结合速率可以通过突变面板来改善。这些突变并未显示出改变了这种相互作用的稳定性,而是改变了结合与解离的平衡,从而得到配体与受体的更高的亲和性。
为了更好地理解会增强与DSG2结合的结构元件,我们使用突变体K217E/F224S进行了更详细的分析。使用乙酸铀酰染色的K217E/F224S纤维球(包含二聚化结构域)的透射电子显微镜显示出具有6个球的颗粒,表示二聚化的三聚体纤维(图8A,粗箭头和图8B)。有趣的是,在这些条件下,纤维球还形成了规则形状的团聚物(直径为~30nm),与塌缩的PtDd类似(图8A,细箭头和图8C)。然后,我们实施x射线晶体照相术而在原子水平上解答K217E/F224S突变体的结构(图8D-H)。如所预计的那样,K217E/F224S突变体形成了纤维球的单三聚体(图8E)。突变体的3D结构叠放在野生型Ad3纤维球的3D结构上(图8F-H)。这表明K217E/F224S突变体中的EF环是完全无序的。该环位于具有纤维杆的连接处的、球结构域的基底处。因此,K217E/F224S突变可以通过增加该环区域的挠性而更容易地结合。
亲和性增加与更强的打开上皮连接的能力之间的相关性。就以下的研究而言,我们使用了包含二聚化结构域的Ad3纤维球形式。为了分析所选的高亲和性突变体,我们进行了Ad3-GFP与亲和性增强的Ad3纤维突变体的二聚的形式对HeLa细胞的竞争感染研究(图9)。根据GFP的表达,除了突变体L277R+N293D以外,所有二聚的突变体比JO-1更明显地抑制了Ad3-GFP感染。显著地,与DSG2亲和性增加的非二聚化形式的Ad3纤维球在转导研究中不能起到竞争剂的作用(图9B)。与DSG2的较高的亲和性在Transwell培养物中使得打开上皮连接的能力增强(图9C)。与JO-1相比,与突变体V250F,V239D,和K217E+F224S温育的培养物的TEER明显更高。
在体内检测中分析亲和性增强版本的JO-1,Y293D和V250F中的2种。我们分别将这些突变体称为JO-2和JO-4。第一个研究是在由A549细胞衍生的异种移植模型中进行的,与图5B所述的研究相似。图10A示出了亲和性增强的突变体JO-2和JO-4比JO-1显著地增加了依立替康的治疗(从第27天开始,p<0.05)。此外,JO-4(Kd=11.4nM)比JO-2(Kd-24.9nM)明显更有效,表明与DSG2的亲和性与治疗作用之间的相关性。在由ovc316细胞衍生的异种移植肿瘤中实施其他的研究(30,32)。Ovc316细胞为由卵巢癌活组织检查衍生的Her2/neu阳性上皮肿瘤细胞。这些细胞在体外和体内的特定条件下可以发生EMT以及可逆的过程(间充质细胞向上皮细胞转化(MET))。Nanog,CD133,和E-cadherin均为阳性的一小部分ovc316细胞被富集用于癌症干细胞,即具有多能潜力和肿瘤形成能力的自体更新细胞(30)。因此,ovc316细胞是在原位肿瘤中所见的异质性和可塑性最接近的模型。在注射PEG化脂质体阿霉素(PLD)(一种广泛用于卵巢癌化疗的药品)之前1小时,静脉注射剂量为2mg/kg的JO-1,会显著地增加治疗的效率(图10B)。重要的是,剂量为0.5mg/kg的JO-4对PLD的治疗具有甚至更高的刺激作用。最后,我们在三阴性乳腺癌(TNBC)模型中测试JO-4。TNBC可表征为缺乏或最少地表达雌激素受体(ER)、孕酮受体(PR),并且缺乏Her2/neu的过表达。TNBC占所有乳腺癌的15%。与具有其他表现型的患者相比,整体生存率较差。TNBC的特征性特征为高水平的DSG2和上皮连接。使用纳米颗粒(单独的白蛋白缀合的紫杉醇(紫杉醇/AbraxaneTM)或与靶向EGFR的mAb西妥昔单抗/ErbituxTM组合的)已经在TNBS的治疗中取得了有前景的临床结果(38)。我们的研究显示在具有原位TNBC肿瘤的小鼠模型中,JO-4会显著地增强紫杉醇/西妥昔单抗的治疗(图10C)。由于它们的治疗相关性,我们在足够的小鼠肿瘤模型中进一步研究JO-4。由于Ad3病毒和Ad3纤维球衍生物不能结合小鼠细胞和组织,所以我们使用在与人类相似的模式和水平下表达人类DSG2的人类转基因小鼠(40)。这些小鼠皮下移植了同系的TC1-hDSG肿瘤。当肿瘤的体积达到~600mm3时,静脉注射JO-1或JO-4用于安全性和效力研究。在注射后的1小时内,JO-1和JO-4血清浓度降低多于1个数量级,而JO-4的降低显著更高(注射后的1hr,p<0.01)(图11A)。在注射后的1小时后,JO-1和JO-4的浓度达到~100ng/ml的平台期。此外,在i.v.注射JO-1和JO-4后,我们还分析了血液学参数。血液化学未显示异常变化。除了淋巴细胞和血小板数量以外,血细胞计数正常,其中淋巴细胞和血小板在注射后的早期降低(图11B)。在p.i.后的24小时,淋巴细胞和血小板计数达到最低,并且对于JO-4而言,所述的计数为明显更低的数量(p<0.01)。有趣的是,与JO-1治疗动物相比,在JO-4注射小鼠中,淋巴细胞和血小板计数更快地返回至正常水平。
JO-1和JO-4是病毒衍生的蛋白质并且是免疫原性的。在免疫活性小鼠中,对抗这些蛋白质的血清IgG抗体可以在注射后的2周通过ELISA来检测(5)。用于治疗蛋白质的亲和性增强的一个理论前提在于其可以避免中和血清抗体。为了检验这个理论前提,我们向具有TC1-hDSG2肿瘤的免疫活性hDSG2小鼠肿瘤模型中重复注射JO-1和JO-4(图11C)。在JO-1和PLD的2轮治疗后,停止治疗,并使肿瘤再生长。第三轮和第四轮的治疗周期分别从第28天和第35天开始。在第三轮治疗周期时,通过ELISA检测血清抗JO-1抗体。重要的是,在这两轮治疗周期(第三轮和第四轮治疗周期)中,JO-1和JO-4对PLD的治疗都具有增强的作用,而JO-4的增强的作用明显更强。
综上,我们针对亲和性增强的二聚的Ad3纤维突变体的功能研究证明了DSG2亲和性与上皮连接打开/治疗作用之间的相关性。
讨论
与Ad3球与DSG2结合有关的残基:与Ad与CAR和CD46的相互作用不同(4,28),关于Ad与DSG2相互作用的结构详情仍是不清楚的。尽管已经弄清了Ad3纤维球用于DSG2的晶体结构,但是仅4个细胞外结构域(ECD)的最远端的3D结构是可利用的(MMDB ID:59843)。但是,我们之前使用针对不同的DSG2结构域的单克隆抗体的竞争研究显示ECD3和4均与AD3的结合有关(42)。在该研究中,我们使用了基于诱变的分析来识别Ad3纤维球内的氨基酸残基(对于与DSG2的结合而言是重要的)。由于当DSG2在E.coli中表达时,该蛋白质不能与Ad3结合,表明需要翻译后加工来创建DSG2内的活性Ad3结合位点,所以DSG2的诱变分析是不可行的(数据未示出)。所识别的对于Ad3球与DSG2结合是重要的残基位于Ad3纤维球的3个不同区域中,并且形成了位于纤维球远端的沟槽中的潜在的结合袋(面对受体)。显著的是,其他Ad血清型与CAR或CD46的结合主要涉及位于相应的纤维球的侧面或底侧的区域(27,43)。我们的数据表明Ad3使用了不同的结合策略。我们目前使用二聚的Ad3纤维球和DSG2来实施结晶学研究。考虑到多聚体Ad3纤维球的簇的多个DSG2分子(41),预计该复合物的3D结构将是复杂的。仍在研究的是对于Ad3纤维球与DSG2结合重要的残基是否还涉及其他B类Ad与DSG2的结合。显著的是,尽管D261,F265,和E299在所有4种与DSG2相互作用的Ad(Ad3,7,11,14)中是保守的,但是其他重要的残基(N186,V189,L296)在这些血清型之间是不同的(图12)。
由于最近的新毒株(Ad14p1)的外观,所以Ad14是重要的研究目标。之前在美国从未有文件记载,Ad14p1首次是在2006年3月和4月在多个美国军事征集训练中心,在例行监测的过程中被报告(26)。在第二年的3月至6月,在Oregon,Washington and Texas的患者中,报告了总计140例额外的被确认的HAdV-B14p1呼吸疾病(3)。这些患者的38%被送入医院治疗,其中包含17%被允许进入加强监护病房;5%的患者死亡。随后,在其他的5个基地和华盛顿(1),俄勒冈州(23),阿拉斯加(15),威斯康星,宾夕法尼亚(10,22)以及加拿大(16),中国(33)和韩国(34)的平民群体中检测到HAdV-B14p1的爆发。在这一点上,Ad14p1的高致病性和/或毒性的分子基础还不清楚。我们尝试描绘Ad14p1与DSG2结合的结构成分。Ad14p1的β折叠的分布与Ad3的β折叠的分布不同(图1A)。因此,与CD46相互作用的血清型相似(11,12),与DSG2相互作用的Ad在它们与DSG2的结合策略中可能不同,这可能得到不同的DSG2结合区域。但是,Ad14p1纤维球突变体文库的筛选不支持这种假说。对于Ad3和Ad14p1纤维球而言,涉及DSG2结合的区域基本是相同的。但是,我们的发现与治疗Ad14p1病毒血症有关(特别是与生产Ad14p1抑制剂或可以引发在血液循环或气道中存在的病毒的调理作用的高亲和性诱饵有关)。
已经报告,除了DSG2以外,Ad3可以使用CD46作为感染细胞的受体(如果DSG2缺乏)(35)。之前,我们发现在极化的正常上皮细胞中DSG2陷入紧密连接中并且不能由顶面接近,而CD46存在于膜的2个面上(42)。因此,我们推测CD46可以作为Ad3的相对无效的进入受体,而重新生产的Ad3和Ad3五面体-十二面体与DSG2相互作用,打开上皮连接,并允许Ad3高效地侧向展开或者渗透至更深的组织层和血液循环中。单独消除分别对于DSG2和CD46结合而言是重要的Ad3球残基的能力可以证明上述假说。
亲和性增强的纤维球:可以增强与DSG2的结合的大部分的突变都位于EF环内,表明该环涉及稳定Ad3与DSG2之间的相互作用。有趣的是,与Ad3、11和14不同,Ad3纤维球在这一区域具有2个额外的残基(VL),其后为脯氨酸。因此,还环可以进一步延伸,并且脯氨酸可以以允许与受体更好地相互作用的方式取向。对这些突变体的任意一种的3D结构在原子水平下的分析支持了上述的结论。这些研究表明引入的突变使得环更具有挠性,这可以能促进与DSG2的相互作用。
识别比wtAd3球具有更好的亲和性的Ad3球涉及Ad3介导的基因治疗。最近,基于Ad3的基因转移载体在临床试验中显示出用于癌症治疗的希望(18)。理论上,亲和性增强的Ad3载体可以在较低的剂量下使用,并且在竞争中超过中和抗体。最近,尝试将高亲和性的配体并入麻疹病毒(17)和Ad5基载体(3,9,45)中,从而增加体内靶细胞感染的效力和特异性。根据我们在该研究中的发现,对于Ad3载体,显著可以追逐相似的策略。
为了改善Ad3载体,亲和性增强版本的JO-1具有翻译相关性。大部分的实体肿瘤都是上皮起源的,并且尽管恶性细胞是去分化的,但是它们在原发性肿瘤和转移性损伤中都保持了细胞间的连接,其为上皮细胞的重要特征(5,31)。这些细胞间的连接代表了宿主免疫系统对抗攻击的保护机制,并且设置了防止瘤内渗透和癌症治疗剂(包含单克隆抗体和化疗药品)的散播的生理屏障(5,31)。当将JO-1静脉注射至具有异种移植或同系的DSG2转基因肿瘤的小鼠中时,JO-1显著增强了多种化疗药品和单克隆抗体的治疗作用(5,6)。在该研究中,我们显示在4种肿瘤模型(A549,ovc316,MDA-MB231,和TC1-DSG2)中,新型的亲和性增强版本的JO-1(例如JO-4)比JO-1(依立替康,紫杉醇,PEG化的脂质体阿霉素,西妥昔单抗)更显著地增强了癌症治疗剂的效力。在具有同系肿瘤的DSG2转基因小鼠的研究显示血清JO-4的水平最可能的是由于与组织上的DSG2结合而快速降低。之前的研究显示出了肿瘤以外,hDSG2转基因表达hDSG2的淋巴细胞和血小板(类似于人和猴)(40,42)。根据这一线索,我们发现注射JO-4使得淋巴细胞和血小板的计数瞬间减少。
尽管事实是大约三分之一的人类具有对抗Ad3的中和抗体(42),但是在近来使用得自卵巢癌患者的血清的研究中,我们发现仅在10%的患者中具有可检测的对抗JO-4的(结合)抗体(N=38)(图13)。但是,可以确定的是对抗静脉给予的JO-4的适应性免疫应答经在人类中发展,特别是在重复注射之后。但是,在这种背景下,在注射至免疫活性小鼠中后生成的显著的抗JO-4抗体似乎不能重要地抑制JO-4的功能。图11C中所示的数据证明即使在可检测的抗体存在下,JO-1和JO-4在多个治疗周期后仍是持续有效的。由于在重复注射JO-4后的治疗作用明显更高,所以我们推测JO-4不仅在连接打开中而且在破坏连接开放剂和血清抗体之间的复合物中都是更有效的。
综上,我们的研究揭示了Ad3和Ad14p1纤维球与DSG2结合的重要的结构详情。其进一步显示出Ad3-纤维球与DSG2的亲和性与随后对上皮连接的作用之间的相关性。最后,生成亲和性增强的重组的二聚的Ad3纤维球涉及癌症的治疗。
参考文献
1.2007.Acute respiratory disease associated with adenovirus serotype 14--four states,2006-2007.MMWR Morb Mortal Wkly Rep 56:1181-1184.
2.Adams,P.D.,P.V.Afonine,G.Bunkoczi,V.B.Chen,I.W.Davis,N.Echols,J.J.Headd,L.W.Hung,G.J.Kapral,R.W.Grosse-Kunstleve,A.J.McCoy,N.W.Moriarty,R.Oeffner,R.J.Read,D.C.Richardson,J.S.Richardson,T.C.Terwilliger,and P.H.Zwart.2010.PHENIX:a comprehensive Python-based system for macromolecular structure solution.Acta Crystallogr D Biol Crystallogr 66:213-221.
3.Belousova,N.,G.Mikheeva,J.Gelovani,and V.Krasnykh.2008.Modification of adenovirus capsid with a designed protein ligand yields a gene vector targeted to a major molecular marker of cancer.Journal of virology 82:630-637.
4.Bewley,M.C.,K.Springer,Y.B.Zhang,P.Freimuth,and J.M.Flanagan.1999.Structural analysis of the mechanism of adenovirus binding to its human cellular receptor,CAR.Science 286:1579-1583.
5.Beyer,I.,H.Cao,J.Persson,H.Song,M.Richter,Q.Feng,R.Yumul,R.van Rensburg,Z.Li,R.Berenson,D.Carter,S.Roffler,C.Drescher,and A.Lieber.2012.Coadministration of epithelial junction opener JO-1 improves the efficacy and safety of chemotherapeutic drugs.Clin Cancer Res 18:3340-3351.
6.Beyer,I.,R.van Rensburg,R.Strauss,Z.Li,H.Wang,J.Persson,R.Yumul,Q.Feng,H.Song,J.Bartek,P.Fender,and A.Lieber.2011.Epithelial junction opener JO-1improves monoclonal antibody therapy of cancer.Cancer Res 71:7080-7090.
7.Cadwell,R.C.,and G.F.Joyce.1994.Mutagenic PCR.PCR Methods Appl3:S136-140.
8.Cadwell,R.C.,and G.F.Joyce.1992.Randomization of genes by PCR mutagenesis.PCR Methods Appl 2:28-33.
9.Campos,S.K.,M.B.Parrott,and M.A.Barry.2004.Avidin-based targeting and purification of a protein IX-modified,metabolically biotinylated adenoviral vector.Mol Ther9:942-954.
10.Carr,M.J.,A.E.Kajon,X.Lu,L.Dunford,P.O'Reilly,P.Holder,C.F.De Gascun,S.Coughlan,J.Connell,D.D.Erdman,and W.W.Hall.2011.Deaths associated with human adenovirus-14p1 infections,Europe,2009-2010.Emerg Infect Dis17:1402-1408.
11.Cupelli,K.,S.Muller,B.D.Persson,M.Jost,N.Arnberg,and T.Stehle.2010.Structure of adenovirus type 21 knob in complex with CD46 reveals key differences in receptor contacts among species B adenoviruses.J Virol 84:3189-3200.
12.Cupelli,K.,and T.Stehle.2011.Viral attachment strategies:the many faces of adenoviruses.Curr Opin Virol 1:84-91.
13.Durmort,C.,C.Stehlin,G.Schoehn,A.Mitraki,E.Drouet,S.Cusack,and W.P.Burmeister.2001.Structure of the fiber head of Ad3,a non-CAR-binding serotype of adenovirus.Virology 285:302-312.
14.Emsley,P.,B.Lohkamp,W.G.Scott,and K.Cowtan.2010.Features and development of Coot.Acta Crystallogr D Biol Crystallogr 66:486-501.
15.Esposito,D.H.,T.J.Gardner,E.Schneider,L.J.Stockman,J.E.Tate,C.A.Panozzo,C.L.Robbins,S.A.Jenkerson,L.Thomas,C.M.Watson,A.T.Curns,D.D.Erdman,X.Lu,T.Cromeans,M.Westcott,C.Humphries,J.Ballantyne,G.E.Fischer,J.B.McLaughlin,G.Armstrong,and L.J.Anderson.2010.Outbreak of pneumonia associated with emergent human adenovirus serotype 14--Southeast Alaska,2008.J Infect Dis202:214-222.
16.Girouard,G.,R.Garceau,L.Thibault,Y.Oussedik,N.Bastien,and Y.Li.2013.Adenovirus serotype 14 infection,New Brunswick,Canada,2011.Emerg Infect Dis19:119-122.
17.Hasegawa,K.,C.Hu,T.Nakamura,J.D.Marks,S.J.Russell,and K.W.Peng.2007.Affinity thresholds for membrane fusion triggering by viral glycoproteins.Journal of virology 81:13149-13157.
18.Hemminki,O.,I.Diaconu,V.Cerullo,S.K.Pesonen,A.Kanerva,T.Joensuu,K.Kairemo,L.Laasonen,K.Partanen,L.Kangasniemi,A.Lieber,S.Pesonen,and A.Hemminki.2012.Ad3-hTERT-E1A,a Fully Serotype 3 Oncolytic Adenovirus,in Patients With Chemotherapy Refractory Cancer.Mol Ther 20:1821-1830.
19.Incardona,M.F.,G.P.Bourenkov,K.Levik,R.A.Pieritz,A.N.Popov,and O.Svensson.2009.EDNA:a framework for plugin-based applications applied to X-ray experiment online data analysis.J Synchrotron Radiat 16:872-879.
20.Kabsch,W.2010.Integration,scaling,space-group assignment and post-refinement.Acta Crystallogr D Biol Crystallogr 66:133-144.
21.Kabsch,W.2010.Xds.Acta Crystallogr D Biol Crystallogr 66:125-132.
22.Kajon,A.E.,X.Lu,D.D.Erdman,J.Louie,D.Schnurr,K.S.George,M.P.Koopmans,T.Allibhai,and D.Metzgar.2010.Molecular epidemiology and brief history of emerging adenovirus 14-associated respiratory disease in the United States.J Infect Dis202:93-103.
23.Lewis,P.F.,M.A.Schmidt,X.Lu,D.D.Erdman,M.Campbell,A.Thomas,P.R.Cieslak,L.D.Grenz,L.Tsaknardis,C.Gleaves,B.Kendall,and D.Gilbert.2009.A community-based outbreak of severe respiratory illness caused by human adenovirus serotype 14.J Infect Dis 199:1427-1434.
24.Louie,J.K.,A.E.Kajon,M.Holodniy,L.Guardia-LaBar,B.Lee,A.M.Petru,J.K.Hacker,and D.P.Schnurr.2008.Severe pneumonia due to adenovirus serotype 14:a new respiratory threat?Clin Infect Dis 46:421-425.
25.McCoy,A.J.,R.W.Grosse-Kunstleve,P.D.Adams,M.D.Winn,L.C.Storoni,and R.J.Read.2007.Phaser crystallographic software.J Appl Crystallogr 40:658-674.
26.Metzgar,D.,M.Osuna,A.E.Kajon,A.W.Hawksworth,M.Irvine,and K.L.Russell.2007.Abrupt emergence of diverse species B adenoviruses at US military recruit training centers.The Journal ofinfectious diseases 196:1465-1473.
27.Pache,L.,S.Venkataraman,G.R.Nemerow,and V.S.Reddy.2008.Conservation of fiber structure and CD46 usage by subgroup B2 adenoviruses.Virology375:573-579.
28.Persson,B.D.,D.M.Reiter,M.Marttila,Y.F.Mei,J.M.Casasnovas,N.Arnberg,and T.Stehle.2007.Adenovirus type 11 binding alters the conformation of its receptor CD46.Nat Struct Mol Biol 14:164-166.
29.Shayakhmetov,D.M.,T.Papayannopoulou,G.Stamatoyannopoulos,and A.Lieber.2000.Efficient gene transfer into human CD34(+)cells by a retargeted adenovirus vector.J Virol 74:2567-2583.
30.Strauss,R.,Z.Y.Li,Y.Liu,I.Beyer,J.Persson,P.Sova,T.Moller,S.Pesonen,A.Hemminki,P.Hamerlik,C.Drescher,N.Urban,J.Bartek,and A.Lieber.2011.Analysis of epithelial and mesenchymal markers in ovarian cancer reveals phenotypic heterogeneity and plasticity.PLoS One 6:e16186.
31.Strauss,R.,and A.Lieber.2009.Anatomical and physical barriers to tumor targeting with oncolytic adenoviruses in vivo.Curr Opin Mol Ther 11:513-522.
32.Strauss,R.,P.Sova,Y.Liu,Z.-Y.Li,S.Tuve,D.Pritchard,P.Brinkkoetter,T.Moller,O.Wildner,S.Pesonen,A.Hemminki,N.Urban,C.Drescher,and A.Lieber.2009.Epithelial phenotype of ovarian cancer mediates resistance to oncolytic adenoviruses.Cancer Research 15:5115-5125.
33.Tang,L.,J.An,Z.Xie,S.Dehghan,D.Seto,W.Xu,and Y.Ji.2013.Genome and Bioinformatic Analysis of a HAdV-B14p1 Virus Isolated from a Baby with Pneumonia in Beijing,China.PLoS One 8:e60345.
34.Trei,J.S.,N.M.Johns,J.L.Garner,L.B.Noel,B.V.Ortman,K.L.Ensz,M.C.Johns,M.L.Bunning,and J.C.Gaydos.2010.Spread of adenovirus to geographically dispersed military installations,May-October 2007.Emerg Infect Dis 16:769-775.
35.Trinh,H.V.,G.Lesage,V.Chennamparampil,B.Vollenweider,C.J.Burckhardt,S.Schauer,M.Havenga,U.F.Greber,and S.Hemmi.2012.Avidity binding of human adenovirus serotypes 3 and 7 to the membrane cofactor CD46 triggers infection.J Virol 86:1623-1637.
36.Tuve,S.,B.M.Chen,Y.Liu,T.L.Cheng,P.Toure,P.S.Sow,Q.Feng,N.Kiviat,R.Strauss,S.Ni,Z.Y.Li,S.R.Roffler,and A.Lieber.2007.Combination of tumor site-located CTL-associated antigen-4 blockade and systemic regulatory T-cell depletion induces tumor-destructive immune responses.Cancer Res 67:5929-5939.
37.Tuve,S.,H.Wang,C.Ware,Y.Liu,A.Gaggar,K.Bernt,D.Shayakhmetov,Z.Li,R.Strauss,D.Stone,and A.Lieber.2006.A new group B adenovirus receptor is expressed at high levels on human stem and tumor cells.J Virol 80:12109-12120.
38.Ueno,N.T.,and D.Zhang.2011.Targeting EGFR in Triple Negative Breast Cancer.J Cancer 2:324-328.
39.Walters,R.W.,P.Freimuth,T.O.Moninger,I.Ganske,J.Zabner,and M.J.Welsh.2002.Adenovirus fiber disrupts CAR-mediated intercellular adhesion allowing virus escape.Cell 110:789-799.
40.Wang,H.,I.Beyer,J.Persson,H.Song,Z.Li,M.Richter,H.Cao,R.van Rensburg,X.Yao,K.Hudkins,R.Yumul,X.B.Zhang,M.Yu,P.Fender,A.Hemminki,and A.Lieber.2012.A new human DSG2-transgenic mouse model for studying the tropism and pathology of human adenoviruses.J Virol 86:6286-6302.
41.Wang,H.,Z.Li,R.Yumul,S.Lara,A.Hemminki,P.Fender,and A.Lieber.2011.Multimerization of adenovirus serotype 3 fiber knob domains is required for efficient binding of virus to desmoglein 2 and subsequent opening of epithelial junctions.J Virol85:6390-6402.
42.Wang,H.,Z.Y.Li,Y.Liu,J.Persson,I.Beyer,T.Moller,D.Koyuncu,M.R.Drescher,R.Strauss,X.B.Zhang,J.K.Wahl,3rd,N.Urban,C.Drescher,A.Hemminki,P.Fender,and A.Lieber.2011.Desmoglein 2 is a receptor for adenovirus serotypes 3,7,11and 14.Nat Med 17:96-104.
43.Wang,H.,Y.C.Liaw,D.Stone,O.Kalyuzhniy,I.Amiraslanov,S.Tuve,C.L.Verlinde,D.Shayakhmetov,T.Stehle,S.Roffler,and A.Lieber.2007.Identification of CD46 binding sites within the adenovirus serotype 35 fiber knob.J Virol 81:12785-12792.
44.Wang,H.,S.Tuve,D.D.Erdman,and A.Lieber.2009.Receptor usage of a newly emergent adenovirus type 14.Virology 387:436-441.
45.Zeng,Y.,M.Pinard,J.Jaime,L.Bourget,P.Uyen Le,M.D.O'Connor-McCourt,R.Gilbert,and B.Massie.2008.A ligand-pseudoreceptor system based on de novo designed peptides for the generation of adenoviral vectors with altered tropism.The journal of gene medicine 10:355-367.
- 还没有人留言评论。精彩留言会获得点赞!