将dsRNA引入植物种子以调节基因表达的方法与流程
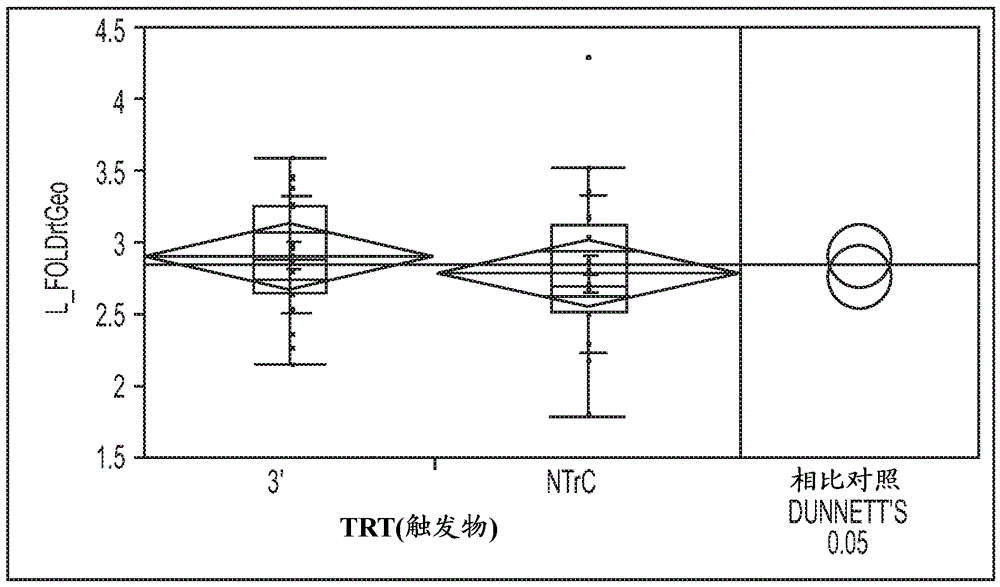
名称为58066P3409812-22-2013_ST25.txt的ASCII文件于2013年12月25日创建,包含109,372字节,与本申请同时提交。发明领域提供了用于改良植物对害虫的抗性的方法和组合物。也提供了用于改良植物对病毒病原体的抗性的方法和组合物。背景随着世界人口不断增加,对食物、燃料和纤维的需求日益增长以及变化万千的气候,农业面临着前所未有的挑战。非常需要研发具有改良性状的植物,其中对农民和种子公司有重大利益的一些主要性状包括改进的非生物胁迫耐受性、肥料使用效率、抗病性、产量等等。植物性状改良通常通过遗传工程或经典育种进行。非常需要通过特定的基因改变用于性状改良的新的方法。这些包括用于基因过量表达或基因沉默的方法。序列特异性基因沉默的一项强大技术是通过RNA干扰(RNAi)。RNAi最早发现于线虫秀丽隐杆线虫(C.elegans)(Fire等人,1998,Nature,391:806-811),是其中可通过将与个别基因同源的双链RNA(dsRNA)引入细胞而使所选基因的表达特异性沉默的一种机制。在细胞内,dsRNA分子被RNA酶III相关酶(Dicer)切割成21-27个核苷酸的较短片段。这些片段,称为小干扰RNA(siRNA),被掺入RNA诱导的沉默复合体(RISC)中。在另外的加工之后,siRNA转化成单链RNA,充当最终切割目标信使RNA的指导序列。通过使用RNAi使相关目标基因特异性沉默,可改变生物体的基本性状。特别对于植物,对可能导致高的胁迫抗性和更好的作物产量的修饰有着不可思议的潜力。在植物中,通常通过产生过量表达经转录产生dsRNA的DNA片段的转基因植物,来进行RNAi。这种dsRNA随后被加工成介导靶基因切割和沉默的siRNA。这种技术的主要技术限制是许多重要的植物作物种难以或不可能转化,阻碍了指导dsRNA产生的构建体的组成型表达。而且,有关抗病毒转基因植物的潜在生态影响的问题迄今为止严重限制了它们的应用[Tepfer,2002,Annu.Rev.Phytopathol.40,467-491]。获取转基因植物的另一个障碍归因于使转化和再生事件发生在同一细胞类型中的难度。因此开发用于获取不依赖于组织培养程序固有方法的转化种子的方法是植物分子生物学研究的前缘。发明概述按照本发明的一些实施方案的方面,提供将裸dsRNA引入种子的方法,所述方法包括在允许dsRNA穿透入种子的条件下使种子与裸dsRNA接触,从而将dsRNA引入种子。按照本发明的一些实施方案的方面,提供包含外源裸dsRNA的分离的种子,其中所述种子缺乏驱动dsRNA在植物中表达的异源启动子。按照本发明的一些实施方案的方面,提供包含外源裸dsRNA3的分离的种子。按照本发明的一些实施方案的方面,提供植物或植物部分,其包含外源裸dsRNA并缺乏驱动dsRNA在植物中表达的异源启动子。按照本发明的一些实施方案的方面,提供包含大量种子的含种子装置。按照本发明的一些实施方案的方面,提供包含大量种子的播种田(sownfield)。按照本发明的一些实施方案的方面,提供产生植物的方法,所述方法包括:(a)提供种子;和(b)使种子萌发以产生植物。按照本发明的一些实施方案的方面,提供调节基因表达的方法,所述方法包括:(a)在允许dsRNA穿透入种子的条件下使植物种子与裸dsRNA接触,从而将dsRNA引入种子;和任选地(b)产生种子的植物。按照本发明的一些实施方案,设计裸dsRNA用于下调植物基因的表达。按照本发明的一些实施方案,设计裸dsRNA用于下调植物病原体基因的表达。按照本发明的一些实施方案,穿透是进入种子的胚乳并且备选地或另外地进入种子的胚中。按照本发明的一些实施方案,裸dsRNA不整合到种子的基因组。按照本发明的一些实施方案,所述条件导致在萌发后dsRNA存在于植物中至少10天。按照本发明的一些实施方案的方面,提供抑制植物病原性生物的靶基因的表达的方法,所述方法包括向植物病原性生物提供植物或植物部分,从而抑制植物病原性生物的靶基因的表达。按照本发明的一些实施方案,所述植物病原性生物选自真菌、线虫和昆虫。按照本发明的一些实施方案,所述方法进一步包括在提供后观察所述植物病原体的死亡或生长抑制。按照本发明的一些实施方案的方面,提供将裸dsRNA引入种子的试剂盒,其包括:(i)裸dsRNA;和(ii)引发溶液(primingsolution)。按照本发明的一些实施方案,裸dsRNA和引发溶液装在分开的容器中。按照本发明的一些实施方案,dsRNA包含siRNA。按照本发明的一些实施方案,dsRNA包含siRNA和dsRNA。按照本发明的一些实施方案,接触是通过用dsRNA接种种子来实行。按照本发明的一些实施方案,所述方法进一步包括在接触前引发种子。按照本发明的一些实施方案,所述引发如下实行:(i)在所述接触前洗涤种子;和(ii)在步骤(i)后干燥种子。按照本发明的一些实施方案,在双重去离子水存在下实行洗涤。按照本发明的一些实施方案,实行洗涤2-6小时。按照本发明的一些实施方案,洗涤在4-28℃下实行。按照本发明的一些实施方案,干燥在25-30℃下实行10-16小时。按照本发明的一些实施方案,在终浓度为0.1-100μg/μl的裸dsRNA存在下实行接触。按照本发明的一些实施方案,在终浓度为0.1-0.5μg/μl的裸dsRNA存在下实行接触。按照本发明的一些实施方案,所述方法进一步包括在接触后用作用剂处理种子,所述作用剂选自杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂。按照本发明的一些实施方案,所述处理包括用作用剂涂布种子。按照本发明的一些实施方案,种子不含选自杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂的作用剂。按照本发明的一些实施方案,dsRNA用于下调编码基因的表达。按照本发明的一些实施方案,dsRNA用于下调非编码基因的表达。按照本发明的一些实施方案,种子是绿色植物界(Viridiplantae)总科的。按照本发明的一些实施方案,所述条件允许dsRNA在种子的胚乳中蓄积以及备选地或另外地在种子的胚中蓄积。按照本发明的一些实施方案,按照选自以下的参数调节裸dsRNA的浓度:种子大小、种子重量、种子体积、种子表面积、种子密度和种子透性。按照本发明的一些实施方案,接触在打破种子休眠和胚出现之前实行。按照本发明的一些实施方案,种子是经引发的种子。按照本发明的一些实施方案,种子或植物包含扩大dsRNA表达的RNA依赖性RNA聚合酶活性。按照本发明的一些实施方案,种子是杂种种子。按照一些实施方案,提供包含核酸序列的分离的dsRNA,所述核酸序列:(i)与植物基因具有足以在包含它们的植物细胞中诱导dsRNA的次级siRNA产物的扩增的同源性水平并且其中所述dsRNA对植物基因的下调基本上不影响所述植物的任何生物量、生长势或产量;和(ii)与植物病原性生物基因具有足以诱导所述植物病原性生物的所述基因降解的同源性水平,其中所述植物病原性生物的生长依赖于所述植物并且其中所述降解诱导所述植物病原性生物的生长停滞或死亡。按照一些实施方案,所述核酸序列的长度为至少25bp。按照一些实施方案,所述核酸序列的长度为25-70bp。按照一些实施方案,所述dsRNA其中所述核酸序列与所述植物基因具有至少80%同一性。按照一些实施方案,所述核酸序列大于70bp。按照一些实施方案,所述核酸序列包含与所述植物基因具有至少65%同一性的长度至少70bp的核酸区段,和/或与所述植物基因具有至少85%同一性的长度至少17bp的第二核酸区段。按照一些实施方案,第一核酸区段和第二核酸区段重叠。按照一些实施方案,第一核酸区段和第二核酸区段不重叠。按照一些实施方案,所述植物基因在大部分植物器官中自萌发开始表达。按照本发明的一些实施方案,分离的dsRNA与所述植物病原体的基因具有至少80%同源性。若干实施方案涉及提供具有改良的害虫抗性的植物的方法,包括:自种子长出植物,其中所述种子已经接触包含以下序列的外源dsRNA分子:所述序列与害虫基因或自所述基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中相比对照植物,所述植物表现出改良的害虫抗性,其中所述对照植物是自未接触所述外源dsRNA分子的种子长出。在某些实施方案中,所述植物是玉米、大豆、水稻、小麦、番茄、黄瓜、莴苣、棉花或油菜。在某些实施方案中,所述害虫是棉贪夜蛾(Spodopteralittoralis)、玉米幼芽根叶甲(Diabroticavirgiferavirgifera)或马铃薯甲虫(Leptinotarsadecemlineata)。在某些实施方案中,所述害虫基因选自ATP酶、NADPH细胞色素P450氧化还原酶、IAP、壳多糖合酶、EF1α和β-肌动蛋白。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:21-26、31、34、37、38、131-133、144或145的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:146-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的核酸序列:其与内源植物基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述种子进一步用选自杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂的作用剂处理。若干实施方案涉及通过包括以下的方法提供的植物:自种子长出植物,其中所述种子已经接触包含以下序列的外源dsRNA分子:所述序列与害虫基因或自所述基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中相比对照植物,所述植物表现出改良的害虫抗性,其中所述对照植物是自未接触所述外源dsRNA分子的种子长出。在某些实施方案中,所述植物是玉米、大豆、水稻、小麦、番茄、黄瓜、莴苣、棉花或油菜。在某些实施方案中,所述害虫是棉贪夜蛾、玉米幼芽根叶甲或马铃薯甲虫。在某些实施方案中,所述害虫基因选自ATP酶、NADPH细胞色素P450氧化还原酶、IAP、壳多糖合酶、EF1α和β-肌动蛋白。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:21-26、31、34、37、38、131-133、144或145的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:146-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的核酸序列:其与内源植物基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述种子进一步用选自杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂的作用剂处理。在某些实施方案中,所述植物不包含可检测水平的外源dsRNA分子。若干实施方案涉及提供具有改良的害虫抗性的植物的方法,包括:自种子长出植物,其中所述种子含有包含以下序列的外源dsRNA分子:所述序列与害虫基因或自所述基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中所述种子缺乏驱动外源dsRNA分子表达的异源启动子,和其中相比对照植物,所述植物表现出改良的害虫抗性,其中所述对照植物是自不包含所述外源dsRNA分子的种子长出。在某些实施方案中,所述植物是玉米、大豆、水稻、小麦、番茄、黄瓜、莴苣、棉花或油菜。在某些实施方案中,所述害虫是棉贪夜蛾、玉米幼芽根叶甲或马铃薯甲虫。在某些实施方案中,所述害虫基因选自ATP酶、NADPH细胞色素P450氧化还原酶、IAP、壳多糖合酶、EF1α和β-肌动蛋白。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:21-26、31、34、37、38、131-133、144或145的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:146-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的核酸序列:其与内源植物基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述种子进一步用选自杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂的作用剂处理。若干实施方案涉及通过包括以下的方法提供的植物:自种子长出植物,其中所述种子含有包含以下序列的外源dsRNA分子:所述序列与害虫基因或自所述基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中所述种子缺乏驱动外源dsRNA分子表达的异源启动子,和其中相比对照植物,所述植物表现出改良的害虫抗性,其中所述对照植物是自不包含所述外源dsRNA分子的种子长出。在某些实施方案中,所述植物是玉米、大豆、水稻、小麦、番茄、黄瓜、莴苣、棉花或油菜。在某些实施方案中,所述害虫是棉贪夜蛾、玉米幼芽根叶甲或马铃薯甲虫。在某些实施方案中,所述害虫基因选自ATP酶、NADPH细胞色素P450氧化还原酶、IAP、壳多糖合酶、EF1α和β-肌动蛋白。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:21-26、31、34、37、38、131-133、144或145的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:146-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的核酸序列:其与内源植物基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述种子进一步用选自杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂的作用剂处理。在某些实施方案中,所述植物不包含可检测水平的外源dsRNA分子。若干实施方案涉及用于产生具有昆虫抗性的植物的方法,所述方法包括:a)将不可转录的触发物分子引入未萌发的种子,所述触发物分子含有包含呈反义或有义方向的害虫基因的18或更多个连续核苷酸的至少一个区段的至少一个多核苷酸链,和b)使种子萌发以产生在从所述种子中显现后表现出昆虫抗性的植物。在某些实施方案中,在自种子显现后所述植物不包含可检测水平的所述触发物分子。在某些实施方案中,所述不可转录的触发物分子是dsRNA。在某些实施方案中,所述害虫基因选自ATP酶、NADPH细胞色素P450氧化还原酶、IAP、壳多糖合酶、EF1α和β-肌动蛋白。在某些实施方案中,所述植物对棉贪夜蛾、玉米幼芽根叶甲或马铃薯甲虫侵染具有抗性。在某些实施方案中,所述不可转录的触发物分子包含这样的序列:所述序列与SEQIDNo.:21-26、31、34、37、38、131-133、144或145的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述不可转录的触发物分子包含这样的序列:所述序列与SEQIDNo.:146-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述不可转录的触发物分子与内源植物基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,在引入不可转录的触发物分子之前引发种子。在某些实施方案中,所述引发如下实行:(i)在所述接触之前洗涤种子;和(ii)在步骤(i)之后干燥种子。若干实施方案涉及处理种子以改良自种子长出的植物的昆虫抗性的方法,所述方法包括:将包含以下序列的外源dsRNA分子引入种子:所述序列与害虫基因或自所述害虫基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中相比对照植物,所述自种子长出的植物表现出改良的昆虫抗性。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:21-26、31、34、37、38、131-133、144或145的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:146-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,在引入外源dsRNA分子之前引发种子。在某些实施方案中,所述引发如下实行:(i)在所述接触之前洗涤种子;和(ii)在步骤(i)之后干燥种子。在某些实施方案中,种子在双重去离子水中洗涤。在某些实施方案中,洗涤种子达2-6小时。在某些实施方案中,种子在4-28ºC洗涤。在某些实施方案中,种子在25-30℃干燥10-16小时。在某些实施方案中,以20-150µg/ml的浓度将dsRNA分子提供给种子。在某些实施方案中,在包含0.1mMEDTA的溶液中将dsRNA分子提供给种子。在某些实施方案中,在物理作用剂存在下将dsRNA分子提供给种子。在某些实施方案中,所述物理作用剂是PEG-修饰的碳纳米管。若干实施方案涉及通过包括以下的方法提供的种子:将包含以下序列的外源dsRNA分子引入种子:所述序列与害虫基因或自所述害虫基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中相比对照植物,所述自种子长出的植物表现出改良的昆虫抗性。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:21-26、31、34、37、38、131-133、144或145的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:146-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,在引入外源dsRNA分子之前引发种子。在某些实施方案中,所述引发如下实行:(i)在所述接触之前洗涤种子;和(ii)在步骤(i)之后干燥种子。在某些实施方案中,种子在双重去离子水中洗涤。在某些实施方案中,洗涤种子达2-6小时。在某些实施方案中,种子在4-28℃洗涤。在某些实施方案中,种子在25-30℃干燥10-16小时。在某些实施方案中,以20-150µg/ml的浓度将dsRNA分子提供给种子。在某些实施方案中,在包含0.1mMEDTA的溶液中将dsRNA分子提供给种子。在某些实施方案中,在物理作用剂存在下将dsRNA分子提供给种子。在某些实施方案中,所述物理作用剂是PEG-修饰的碳纳米管。若干实施方案涉及含种子装置,其包含一个或多个种子。若干实施方案涉及包含大量种子的播种田。若干实施方案涉及含有包含以下序列的外源dsRNA分子的种子:所述序列与害虫基因或自所述害虫基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中所述种子缺乏驱动所述dsRNA分子的表达的异源启动子并且其中外源dsRNA不整合到种子的基因组。在某些实施方案中,所述外源dsRNA分子存在于种子的胚乳中。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:21-26、31、34、37、38、131-133、144或145的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:146-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子存在于种子的胚中。在某些实施方案中,所述外源dsRNA分子以相似浓度存在于种子的胚和胚乳中。在某些实施方案中,所述外源dsRNA分子在种子的胚乳中存在的浓度高于在种子的胚中存在的浓度。在某些实施方案中,所述害虫基因选自ATP酶、NADPH细胞色素P450氧化还原酶、IAP、壳多糖合酶、EF1α和β-肌动蛋白。在某些实施方案中,所述害虫是棉贪夜蛾、玉米幼芽根叶甲或马铃薯甲虫。在某些实施方案中,所述外源dsRNA分子包含这样的核酸序列:其与种子的内源基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述种子用选自杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂的作用剂处理。在某些实施方案中,所述种子是经引发的种子。若干实施方案涉及含种子装置,其包含一个或多个种子。若干实施方案涉及包含大量种子的播种田。若干实施方案涉及自种子显现后表现出昆虫抗性的植物,其中将不可转录的触发物分子引入产生所述植物的未萌发的种子,所述触发物分子含有包含呈反义或有义方向的害虫基因的18或更多个连续核苷酸的至少一个区段的至少一个多核苷酸链。在某些实施方案中,所述植物选自玉米、大豆、水稻、小麦、番茄、黄瓜、莴苣、棉花和油菜。在某些实施方案中,所述植物不包含可检测水平的不可转录的触发物分子。在某些实施方案中,所述害虫基因选自ATP酶、NADPH细胞色素P450氧化还原酶、IAP、壳多糖合酶、EF1α和β-肌动蛋白。在某些实施方案中,所述不可转录的触发物分子包含这样的序列:所述序列与SEQIDNo.:21-26、31、34、37、38、131-133、144或145的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述不可转录的触发物分子包含这样的序列:所述序列与SEQIDNo.:146-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述不可转录的触发物分子包含这样的核酸序列:其与种子的内源基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述不可转录的触发物分子包含这样的核酸序列:其长度至少17bp并且与种子的内源基因具有至少85%同一性。在某些实施方案中,所述不可转录的触发物分子包含这样的核酸序列:其长度至少70bp并且与种子的内源基因具有至少65%同一性。若干实施方案涉及包含用于抑制害虫基因的核酸分子的植物,其中所述核酸分子不整合到植物染色体,其中所述核酸分子不从整合到植物染色体的异源转基因转录,和其中通过将触发物分子引入产生所述植物的未萌发的种子而抑制所述害虫基因,所述触发物分子含有包含呈反义或有义方向的害虫基因的18或更多个连续核苷酸的至少一个区段的至少一个多核苷酸链。在某些实施方案中,所述植物选自玉米、大豆、水稻、小麦、番茄、黄瓜、莴苣、棉花和油菜。在某些实施方案中,所述触发物分子是dsRNA。在某些实施方案中,所述害虫基因选自ATP酶、NADPH细胞色素P450氧化还原酶、IAP、壳多糖合酶、EF1α和β-肌动蛋白。在某些实施方案中,所述触发物分子包含这样的序列:所述序列与SEQIDNo.:21-26、31、34、37、38、131-133、144或145的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述触发物分子包含这样的序列:所述序列与SEQIDNo.:146-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述触发物分子包含这样的核酸序列:其与产生所述植物的种子的内源基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述触发物分子包含这样的核酸序列:其长度至少17bp并且与产生所述植物的种子的内源基因具有至少85%同一性。在某些实施方案中,所述触发物分子包含这样的核酸序列:其长度至少70bp并且与产生所述植物的种子的内源基因具有至少65%同一性。在某些实施方案中,所述植物不包含可检测水平的所述触发物分子。若干实施方案涉及降低玉米根虫对玉米植物的压力的方法,所述方法包括:a)将触发物分子引入未萌发的玉米种子,所述触发物分子含有包含呈反义或有义方向的玉米根虫基因的18或更多个连续核苷酸的至少一个区段的至少一个多核苷酸链,和b)使所述玉米种子萌发以产生玉米植物。在某些实施方案中,所述触发物分子是dsRNA。在某些实施方案中,所述触发物分子包含SEQIDNo.144的18或更多个连续核苷酸的至少一个区段。在某些实施方案中,所述触发物分子包含SEQIDNo.:146-190的18或更多个连续核苷酸的至少一个区段。在某些实施方案中,在引入所述触发物分子之前引发未萌发的玉米种子。在某些实施方案中,种子通过以下而引发:(i)在所述接触之前洗涤种子;和(ii)在步骤(i)之后干燥种子。在某些实施方案中,种子在双重去离子水中洗涤。若干实施方案涉及提供具有改良的病毒抗性的植物的方法,包括:自种子长出植物,其中所述种子已经接触包含以下序列的外源dsRNA分子:所述序列与病毒基因或自所述基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中相比对照植物,所述植物表现出改良的病毒抗性,其中所述对照植物是自未接触外源dsRNA分子的种子长出。在某些实施方案中,所述植物是玉米、大豆、水稻、小麦、番茄、黄瓜、莴苣、棉花或油菜。在某些实施方案中,所述病毒是番茄金色斑驳病毒(ToGMoV)、黄瓜花叶病毒(CMV)或番茄斑萎病毒(TSWV)。在某些实施方案中,所述病毒基因选自ToGMoV基因、CMV基因和TSWV基因。在某些实施方案中,所述病毒基因选自核壳(N)基因、复制酶基因、外壳基因和AC1基因。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:8、11或185-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的核酸序列:其与内源植物基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述种子进一步用选自杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂的作用剂处理。若干实施方案涉及通过包括以下的方法提供的植物:自种子长出植物,其中所述种子已经接触包含以下序列的外源dsRNA分子:所述序列与病毒基因或自所述基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中相比对照植物,所述植物表现出改良的病毒抗性,其中所述对照植物是自未接触外源dsRNA分子的种子长出。在某些实施方案中,所述植物是玉米、大豆、水稻、小麦、番茄、黄瓜、莴苣、棉花或油菜。在某些实施方案中,所述病毒是番茄金色斑驳病毒(ToGMoV)、黄瓜花叶病毒(CMV)或番茄斑萎病毒(TSWV)。在某些实施方案中,所述病毒基因选自ToGMoV基因、CMV基因和TSWV基因。在某些实施方案中,所述病毒基因选自核壳(N)基因、复制酶基因、外壳基因和AC1基因。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:8、11或185-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的核酸序列:其与内源植物基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述种子进一步用选自杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂的作用剂处理。在某些实施方案中,所述植物不包含可检测水平的外源dsRNA分子。若干实施方案涉及提供具有改良的病毒抗性的植物的方法,包括自种子长出植物,其中所述种子含有包含以下序列的外源dsRNA分子:所述序列与病毒基因或自所述基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中所述种子缺乏驱动外源dsRNA分子表达的异源启动子,和其中相比对照植物,所述植物表现出改良的病毒抗性,其中所述对照植物是自不包含外源dsRNA分子的种子长出。在某些实施方案中,所述病毒是番茄金色斑驳病毒(ToGMoV)、黄瓜花叶病毒(CMV)或番茄斑萎病毒(TSWV)。在某些实施方案中,所述病毒基因选自ToGMoV基因、CMV基因和TSWV基因。在某些实施方案中,所述病毒基因选自核壳(N)基因、复制酶基因、外壳基因和AC1基因。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:8、11或185-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的核酸序列:其与内源植物基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述种子进一步用选自杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂的作用剂处理。若干实施方案涉及通过包括以下的方法提供的植物:自种子长出植物,其中所述种子含有包含以下序列的外源dsRNA分子:所述序列与病毒基因或自所述基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中所述种子缺乏驱动外源dsRNA分子表达的异源启动子,和其中相比对照植物,所述植物表现出改良的病毒抗性,其中所述对照植物是自不包含外源dsRNA分子的种子长出。在某些实施方案中,所述植物是玉米、大豆、水稻、小麦、番茄、黄瓜、莴苣、棉花或油菜。在某些实施方案中,所述病毒是番茄金色斑驳病毒(ToGMoV)、黄瓜花叶病毒(CMV)或番茄斑萎病毒(TSWV)。在某些实施方案中,所述病毒基因选自ToGMoV基因、CMV基因和TSWV基因。在某些实施方案中,所述病毒基因选自核壳(N)基因、复制酶基因、外壳基因和AC1基因。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:8、11或185-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的核酸序列:其与内源植物基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述种子进一步用选自杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂的作用剂处理。在某些实施方案中,所述植物不包含可检测水平的外源dsRNA分子。若干实施方案涉及产生具有病毒抗性的植物的方法,所述方法包括:a)将不可转录的触发物分子引入未萌发的种子,所述触发物分子含有包含呈反义或有义方向的病毒基因的18或更多个连续核苷酸的至少一个区段的至少一个多核苷酸链,和b)使种子萌发以产生在自种子显现后表现出病毒抗性的植物。在某些实施方案中,在自种子显现后所述植物不包含可检测水平的所述触发物分子。在某些实施方案中,所述不可转录的触发物分子是dsRNA。在某些实施方案中,所述病毒是番茄金色斑驳病毒(ToGMoV)、黄瓜花叶病毒(CMV)或番茄斑萎病毒(TSWV)。在某些实施方案中,所述病毒基因选自ToGMoV基因、CMV基因和TSWV基因。在某些实施方案中,所述病毒基因选自核壳(N)基因、复制酶基因、外壳基因和AC1基因。在某些实施方案中,所述不可转录的触发物分子包含这样的序列:所述序列与SEQIDNo.:8、11或185-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述不可转录的触发物分子与内源植物基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,在引入不可转录的触发物分子之前引发种子。在某些实施方案中,所述引发如下实行:(i)在所述接触之前洗涤种子;和(ii)在步骤(i)之后干燥种子。若干实施方案涉及处理种子以改良自种子长出的植物的病毒抗性的方法,所述方法包括:将包含以下序列的外源dsRNA分子引入种子:所述序列与病毒基因或自所述病毒基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中相比对照植物,所述自种子长出的植物表现出改良的病毒抗性。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:8、11或185-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,在引入外源dsRNA分子之前引发种子。在某些实施方案中,所述引发如下实行:(i)在所述接触之前洗涤种子;和(ii)在步骤(i)之后干燥种子。在某些实施方案中,种子在双重去离子水中洗涤。在某些实施方案中,洗涤种子达2-6小时。在某些实施方案中,在4-28℃洗涤种子。在某些实施方案中,种子在25-30℃干燥10-16小时。在某些实施方案中,以20-150µg/ml的浓度将dsRNA分子提供给种子。在某些实施方案中,在包含0.1mMEDTA的溶液中将dsRNA分子提供给种子。在某些实施方案中,在物理作用剂存在下将dsRNA分子提供给种子。在某些实施方案中,所述物理作用剂是PEG-修饰的碳纳米管。若干实施方案涉及通过包括以下的方法提供的种子:将包含以下序列的外源dsRNA分子引入种子:所述序列与病毒基因或自所述病毒基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中相比对照植物,所述自种子长出的植物表现出改良的病毒抗性。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:8、11或185-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,在引入外源dsRNA分子之前引发种子。在某些实施方案中,所述引发如下实行:(i)在所述接触之前洗涤种子;和(ii)在步骤(i)之后干燥种子。在某些实施方案中,种子在双重去离子水中洗涤。在某些实施方案中,洗涤种子达2-6小时。在某些实施方案中,种子在4-28℃洗涤。在某些实施方案中,种子在25-30℃干燥10-16小时。在某些实施方案中,以20-150µg/ml的浓度将dsRNA分子提供给种子。在某些实施方案中,在包含0.1mMEDTA的溶液中将dsRNA分子提供给种子。在某些实施方案中,在物理作用剂存在下将dsRNA分子提供给种子。在某些实施方案中,所述物理作用剂是PEG-修饰的碳纳米管。若干实施方案涉及含种子装置,其包含一个或多个种子。若干实施方案涉及包含大量种子的播种田。若干实施方案涉及含有包含以下序列的外源dsRNA分子的种子:所述序列与病毒基因或自所述病毒基因转录的RNA序列的至少18个连续核苷酸基本相同或与其基本互补,其中所述种子缺乏驱动所述dsRNA分子的表达的异源启动子和其中外源dsRNA不整合到种子的基因组。在某些实施方案中,所述外源dsRNA分子存在于种子的胚乳中。在某些实施方案中,所述外源dsRNA分子存在于种子的胚中。在某些实施方案中,所述外源dsRNA分子以相似浓度存在于种子的胚和胚乳中。在某些实施方案中,所述外源dsRNA分子在种子的胚乳中存在的浓度高于在种子的胚中存在的浓度。在某些实施方案中,所述病毒是番茄金色斑驳病毒(ToGMoV)、黄瓜花叶病毒(CMV)或番茄斑萎病毒(TSWV)。在某些实施方案中,所述病毒基因选自ToGMoV基因、CMV基因和TSWV基因。在某些实施方案中,所述病毒基因选自核壳(N)基因、复制酶基因、外壳基因和AC1基因。在某些实施方案中,所述外源dsRNA分子包含这样的序列:所述序列与SEQIDNo.:8、11或185-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述外源dsRNA分子包含这样的核酸序列:其与种子的内源基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述种子用选自杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂的作用剂处理。在某些实施方案中,所述种子是经引发的种子。若干实施方案涉及含种子装置,其包含一个或多个种子。若干实施方案涉及包含大量种子的播种田。若干实施方案涉及在自种子显现后表现出病毒抗性的植物,其中将不可转录的触发物分子引入产生所述植物的未萌发的种子,所述触发物分子含有包含呈反义或有义方向的病毒基因的18或更多个连续核苷酸的至少一个区段的至少一个多核苷酸链。在某些实施方案中,所述植物选自玉米、大豆、水稻、小麦、番茄、黄瓜、莴苣、棉花和油菜。在某些实施方案中,所述植物不包含可检测水平的所述不可转录的触发物分子。在某些实施方案中,所述病毒是番茄金色斑驳病毒(ToGMoV)、黄瓜花叶病毒(CMV)或番茄斑萎病毒(TSWV)。在某些实施方案中,所述病毒基因选自ToGMoV基因、CMV基因和TSWV基因。在某些实施方案中,所述病毒基因选自核壳(N)基因、复制酶基因、外壳基因和AC1基因。在某些实施方案中,所述不可转录的触发物分子包含这样的序列:所述序列与SEQIDNo.:8、11或185-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述不可转录的触发物分子包含这样的核酸序列:其与种子的内源基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述不可转录的触发物分子包含这样的核酸序列:其长度至少17bp并且与种子的内源基因具有至少85%同一性。在某些实施方案中,所述不可转录的触发物分子包含这样的核酸序列:其长度至少70bp并且与种子的内源基因具有至少65%同一性。若干实施方案涉及包含用于抑制病毒基因的核酸分子的植物,其中所述核酸分子不整合到植物染色体,其中所述核酸分子不从整合到植物染色体的异源转基因转录,和其中通过将触发物分子引入产生所述植物的未萌发的种子而抑制所述病毒基因,所述触发物分子含有包含呈反义或有义方向的病毒基因的18或更多个连续核苷酸的至少一个区段的至少一个多核苷酸链。在某些实施方案中,所述植物选自玉米、大豆、水稻、小麦、番茄、黄瓜、莴苣、棉花和油菜。在某些实施方案中,所述触发物分子是dsRNA。在某些实施方案中,所述病毒是番茄金色斑驳病毒(ToGMoV)、黄瓜花叶病毒(CMV)或番茄斑萎病毒(TSWV)。在某些实施方案中,所述病毒基因选自ToGMoV基因、CMV基因和TSWV基因。在某些实施方案中,所述病毒基因选自核壳(N)基因、复制酶基因、外壳基因和AC1基因。在某些实施方案中,所述触发物分子包含这样的序列:所述序列与SEQIDNo.:8、11或185-190的至少18个连续核苷酸基本相同或与其基本互补。在某些实施方案中,所述触发物分子包含这样的核酸序列:其与产生所述植物的种子的内源基因在至少25个连续bp上具有至少80%同一性。在某些实施方案中,所述触发物分子包含这样的核酸序列:其长度至少17bp并且与产生所述植物的种子的内源基因具有至少85%同一性。在某些实施方案中,所述触发物分子包含这样的核酸序列:其长度至少70bp并且与产生所述植物的种子的内源基因具有至少65%同一性。在某些实施方案中,所述植物不包含可检测水平的所述触发物分子。除非另有说明,否则本文所用的所有技术和/或科学术语都具有本发明所属领域普通技术人员通常所理解的相同含义。虽然类似或等同于本文所述方法和材料的方法和材料可用于本发明实施方案的实践或测试,但下面描述了方法和/或材料的实例。万一有冲突,则以本专利说明书,包括定义为准。另外,材料、方法和实施例只是说明性的,不意图必然是限制性的。附图简述本文参照附图仅举例说明描述了本发明的一些实施方案。现具体参照详细的附图,要强调的是所显示的细节是举例说明并用于说明性论述本发明实施方案的目的。在这一方面,与附图一起的描述使本领域技术人员明白如何可实施本发明的实施方案。图1显示对水稻种子的时程siGLO-处理结果。测试了与siGLOdsRNA的孵育时间对荧光强度的影响,指示dsRNA穿透的数量和质量。对未经处理的对照种子(1),以及用siGLOdsRNA以如下4个不同孵育时间处理的种子成像:10min(2)、3.5小时(3)、5.5小时(4)和24小时(5)。图2A-B显示通过dsRNA/siRNA混合物使水稻中的PDS-1基因沉默。图2A–处理后5天的萌发的水稻种子图,对照在左边。图2B–处理后7天的萌发的水稻种子图,对照在底部。图3A-C显示经实时PCR测定的PDS-1表达水平。图3A是处理后7天的萌发的水稻种子图,对照在底部。图3B–处理后5周的种植的水稻种子图,对照植物在左边并且相比PDS-1沉默的植物具有更暗的绿色。图3C-自对照和PDS-1沉默的植物中提取RNA并通过实时PCR检查PDS-1表达水平。UBQ5表达水平充当归一化子,对照植物的PDS-1表达水平充当校准子,给予1的值。图4A-B显示接种后55天的对照和NFYdsRNA-处理的番茄植物的高度分布。图4A显示对照植物的高度分布(蓝色棒)和图4B显示经处理的植物的高度分布(黄色棒)。图5A-D显示对照(蓝色棒)以及处理后55(图5A)、62(图5B)和72天(图5C)的ARF8dsRNA-处理的(栗色棒)番茄植物的高度的具体分布。图5D显示与处理后62天的经处理的植物的高度相比的对照植物的平均高度。图6A-B显示在萌发后9周,对照和FW2.2dsRNA处理的番茄植物的叶所提取的RNA的RT-PCR结果。图6A显示在对照(显示为红色棒)和dsRNA-处理的(显示为蓝色棒)植物中的FW2.2表达的倍数变化,这对每株植物作图以显示在2个植物组中的FW2.2基因的表达水平的差异。图6B显示对照(红色棒)相比经处理的植物(蓝色棒)的FW2.2的平均表达。相比对照植物,在经处理的植物中的FW2.2基因表达水平的下调是明显的。图7A-B显示,相比对照植物(图7A),自针对Della基因而处理的水稻种子长出的水稻幼苗的更长和更发达的根系(图7B)。图8A-B显示,当幼苗在无氮生长培养基中生长时,相比对照植物(图8A),自针对NRR基因而处理的水稻种子长出的水稻幼苗的更长和更发达的根系和茎系(图8B)。图9A-C显示用于种子处理的棉贪夜蛾基因与玉米基因组之间的同源性。图9A–NADPH基因、序列1(上图面,SEQIDNO:14和22)和序列2(下图面,SEQIDNO:23和24)分别在71个核苷酸上显示82%同一性和在35个核苷酸上显示89%同一性,图9B–ATP酶(SEQIDNo:25和26)在484个核苷酸上显示72%同一性,和图9C–IAP,序列1(上图面,SEQIDNO:27和28)和序列2(下图面,SEQIDNO:29和30)分别在36个核苷酸上显示81%同一性和在31个核苷酸上显示87%同一性。“查询(Query)”代表棉贪夜蛾序列,“对象(Subject)”代表玉米序列。图10A-C显示用于种子处理的棉贪夜蛾基因与番茄基因组的同源性。图10A–NADPH基因,序列1(上图面,SEQIDNO:31和32)分别在30个核苷酸上显示93%同一性和在25个核苷酸上显示88%同一性,和序列2(下图面,SEQIDNO:33和34)图10B–ATP酶(SEQIDNo.35和36)在359个核苷酸上显示73%同一性,和图10C–IAP(SEQIDNo.37和38)在28个核苷酸上显示93%同一性。“查询”代表棉贪夜蛾序列,“对象”代表番茄序列。图11A-D是柱状图,显示活的棉贪夜蛾幼虫的死亡率和平均重量。图11A显示饲喂3株43日龄ATP酶dsRNA触发物-处理的和对照玉米植物8天后的死虫百分率。图11B显示在相同时间点的活的棉贪夜蛾幼虫的平均重量。图11C是柱状图,显示饲喂85日龄ATP酶-处理的和对照玉米植物3天后的死棉贪夜蛾幼虫百分率。图11D是柱状图,显示饲喂91日龄ATP酶dsRNA触发物-处理的和对照玉米植物7天后的死棉贪夜蛾幼虫百分率。图12是柱状图,显示饲喂67日龄dsRNA触发物处理的(NADPH、IAP和ATP酶)和对照(EDTA)玉米植物7天后的死棉贪夜蛾幼虫百分率。图13A-B:图13A是柱状图,显示饲喂43日龄EF1αdsRNA触发物-处理的和对照(EDTA)玉米植物8天后的活的棉贪夜蛾幼虫的平均重量。图13B是柱状图,显示饲喂87日龄EF1αdsRNA触发物-处理的和对照(EDTA)玉米植物5天后的死棉贪夜蛾幼虫百分率。图14是柱状图,显示饲喂43日龄β-肌动蛋白dsRNA触发物-处理的和对照(EDTA)玉米植物8天后的活的棉贪夜蛾幼虫的平均重量。图15A-B:图15A是柱状图,显示饲喂43日龄NADPHdsRNA触发物-处理的和对照(EDTA)玉米植物8天后的活的棉贪夜蛾幼虫的平均重量。图15B是柱状图,显示饲喂91日龄NADPHdsRNA触发物-处理的和对照(EDTA)玉米植物7天后的死棉贪夜蛾幼虫百分率。图16A-B是柱状图,显示相比对照(EDTA)植物饲喂27日龄dsRNA触发物-处理的(IAP或MIX(IAP、NADPH和ATP酶))植物6天后的活的棉贪夜蛾幼虫的平均重量。图16A显示每一重复的平均重量,图16B显示每次处理的平均重量。图17A-B是柱状图,显示饲喂EF1αdsRNA触发物-处理的玉米植物后的活的棉贪夜蛾幼虫的平均重量。图17A显示饲喂35日龄植物9天后的平均重量。误差条代表每次处理的标准差。图17B显示饲喂36日龄植物5天后的平均重量。误差条代表每一植物的标准差。图18A-B:图18A是柱状图,显示饲喂56日龄ATP酶dsRNA触发物-处理的和对照(GUS)玉米植物12天后的死棉贪夜蛾幼虫百分率。图18B是柱状图,显示饲喂57日龄ATP酶dsRNA触发物-处理的和对照(GUS)玉米植物4天后的死棉贪夜蛾幼虫百分率。图19A-B:图19A是柱状图,显示饲喂24日龄dsRNA触发物-处理的和对照(EDTA、EDTA/CNTP和GFP)玉米植物10天后的活的棉贪夜蛾幼虫的平均重量。误差条代表每一植物的标准差。图19B是柱状图,显示饲喂25日龄dsRNA触发物-处理的和对照(EDTA、EDTA/CNTP和GFP/CNTP)玉米植物10天后的活的棉贪夜蛾幼虫的平均重量。误差条代表每一植物的标准差。图20A-B是柱状图,显示饲喂8日龄dsRNA触发物-处理的(EF1α和EF1α/CNTP)和对照(GUS和GUS/CNTP)玉米植物4天后的棉贪夜蛾幼虫的平均重量。图20A显示每一植物的棉贪夜蛾幼虫的平均重量,图20B显示每次处理的棉贪夜蛾幼虫的平均重量。误差条代表数据的标准差。图21是柱状图,显示饲喂48日龄dsRNA触发物-处理的(NADPH、IAP和MIX(IAP、ATP酶和NADPH))和对照(EDTA)番茄植物3天和7天后的活的棉贪夜蛾幼虫的平均重量。图22是柱状图,显示饲喂42日龄dsRNA触发物-处理的(β-肌动蛋白、ATP酶和NADPH)和对照(EDTA)番茄植物4天后的活的棉贪夜蛾幼虫的平均重量。图23A-B:图23A是柱状图,显示相比于它们在饲喂前的起始重量而言饲喂85日龄ATP酶dsRNA触发物-处理的和对照(EDTA)番茄植物6天后的棉贪夜蛾幼虫的重量。图23B是柱状图,显示饲喂88日龄ATP酶dsRNA触发物-处理的和对照(EDTA)番茄植物5天后的活的棉贪夜蛾幼虫的平均重量。图24A-B:图24A是柱状图,显示饲喂95日龄NADPHdsRNA触发物-处理的和对照(EDTA)番茄植物4天后的棉贪夜蛾幼虫的平均重量。图24B是柱状图,显示饲喂95日龄NADPHdsRNA触发物-处理的和对照(ARF8)番茄植物7天后的棉贪夜蛾幼虫的平均重量。图25A-F:图25A和C是柱状图,显示分别饲喂31日龄dsRNA触发物-处理的(EF1α#1、EF1α#2、ATP酶和NADPH)和对照(EDTA和GFP)玉米植物8天和10天后每一植物的死棉贪夜蛾幼虫的百分率。图25B和D是柱状图,将图25A和C中所示的数据合并处理。图25E是柱状图,显示饲喂处理的和对照玉米植物11天后的活的棉贪夜蛾幼虫的平均重量。误差条代表数据的标准差。图25F是柱状图,显示饲喂32日龄的处理的和对照玉米植物8天和9天后的活的棉贪夜蛾幼虫的平均重量。8天后记录的重量用暗色显示,9天后记录的重量用亮色显示。误差条代表数据的标准差。图26A-C是柱状图,显示饲喂自用0ppm(Null对照)、50ppm或500ppmMON104454处理的种子长出的玉米植物或表达靶向WCRSnf7的RNA抑制构建体的转基因玉米植物(阳性对照)的玉米幼芽根叶甲(WCR)的幼虫回收率和重量。图26A是柱状图,显示在4周后幼虫回收的百分率。图26B是柱状图,显示在4周后回收的WCR幼虫的总重量。图26C是柱状图,显示在4周后回收的WCR幼虫的平均重量。图27A-C是柱状图,显示在自用T6593、缓冲液(“制剂”)或GFPdsRNA触发物处理的种子长出的番茄植物上的科罗拉多马铃薯甲虫(CPB)侵染测定的结果。图27A显示由CPB所致的T6593处理的和对照(制剂和GFP)番茄植物的平均落叶。图27B显示回收的CPB幼虫的百分率。图27C显示自处理的植物回收的WCR幼虫的平均重量。图28A-B:图28显示在种子用dsRNA多核苷酸序列吸涨后,对用番茄金色斑驳病毒(ToGMoV)处理的植物的Quantigene分析结果。图28A显示相比于GUS处理的对照(NTrC)而言用5’AC1dsRNA多核苷酸(5’)处理后的结果。图28B显示相比于GUS处理的对照(NTrC)而言用3’AC1dsRNA多核苷酸(3’)处理后的结果。图29A-B:图29显示在种子用dsRNA多核苷酸序列吸涨后,对用黄瓜花叶病毒(CMV)处理的植物的Quantigene分析结果。图29A显示相比于GUS处理的对照(NTrC)而言用5’NCdsRNA多核苷酸(5’)处理后的结果。图29B显示相比于GUS对照(NTrC)而言用3’NCdsRNA多核苷酸(3’)处理后的结果。图30显示相比于GUS处理的对照(NTrC)而言对用番茄斑萎病毒(TSWV)3’NdsRNA多核苷酸序列(3’)处理的植物的Quantigene分析结果。图31A-B显示用于种子处理的棉贪夜蛾EF1α基因和玉米基因组之间的同源性。图31A–EF1α基因,序列1在400个核苷酸上显示75%同一性。图31B–EF1α基因,序列2在446个核苷酸上显示75%同一性。“查询”代表棉贪夜蛾序列,“对象”代表玉米序列。图32A-C是柱状图,显示在自用50μg/mldsRNA处理4小时的种子萌发而来的20日龄和48日龄玉米植物中的玉米EF1αmRNA表达的实时PCR分析。图32A显示在用棉贪夜蛾EF1αdsRNA处理后的玉米EF1αmRNA表达上的倍数变化,其中GFPdsRNA处理用作对照基线。将每个单独植物的表达值归一化到用GFPdsRNA处理的所有植物的中位表达。相比对照组的表达差异的p-值为0.016。图32B显示在用与图32A中相同的dsRNA和PEG-修饰的碳纳米管(CNTP)的混合物处理后,玉米EF1αmRNA表达的倍数变化。将每个单独植物的表达值归一化到用GFPdsRNA\CNTP处理的所有植物的中位表达。相比对照组的表达差异的p-值为0.003。图32C显示在种子处理后48天在相同玉米植物中的倍数变化。将每个单独植物的表达值归一化到用GFPdsRNA\CNTP处理的所有植物的中位表达。相比对照组的表达差异的p-值为0.07。图33是柱状图,显示在自用132μg/ml衍生自棉贪夜蛾序列的dsRNA处理的种子萌发而来的9周龄玉米植物中的玉米EF1αmRNA表达的实时PCR分析。将每个单独植物的表达值归一化到所有对照植物的中位表达。相比对照组的表达差异的p-值为0.12。图34A-B是柱状图,显示在自用160μg/mldsRNA处理7小时的种子萌发而来的6日龄玉米植物中的玉米EF1αmRNA表达的实时PCR分析。图34A显示对于GUSdsRNA处理而言的玉米EF1αmRNA表达的倍数变化。图34B显示对于用EF1αdsRNA(dsRNA#1和#2两者,有和无CNTP)、GUSdsRNA(有和无CNTP)和EDTA(有和无CNTP)处理的所有植物,玉米EF1αmRNA表达的平均倍数变化。误差条代表数据的标准差。图35A-C是柱状图,显示在自用160μg/mldsRNA处理2小时的种子萌发而来的27日龄玉米植物中的玉米ATP酶和NADPHmRNA表达的实时PCR分析。图35A显示玉米ATP酶mRNA表达的平均倍数变化。图35B和35C显示玉米NADPHmRNA表达的平均倍数变化。将表达值归一化到用GFPdsRNA处理的植物的平均表达(图35A和35B)或归一化到EDTA-处理的对照植物的平均表达(图35C)。误差条代表数据的标准差。发明详述除非另有说明,否则当从左到右阅读时,以5'至3'方向给出本说明书文本中的核酸序列。按照指定,核酸序列可以提供为DNA或RNA;一者的公开内容必定限定另一者,正如本领域普通技术人员已知的。此外,核酸序列的公开内容公开了其相反互补物序列,正如一者必定限定另一者,正如本领域普通技术人员已知的。当术语以单数形式提供时,本发明人也预期该术语的复数所描述的本发明的方面。在详细解释本发明的实施方案之前,应当知道,本发明不必将其应用限制于以下描述陈述或通过实施例举例说明的细节。本发明能够以其它实施方案进行或能够以不同方式得以实施或进行。随着世界人口大量增加以及植物生长和栽培的有限生境,迫切需要在这些改变的条件下改良植物产量。RNAi作为调节基因表达的一个强大的工具而出现,其可用于产生具有改良的胁迫耐受性的植物。在植物中,通常通过产生包含经转录产生dsRNA的DNA片段的转基因植物,来进行RNAi。这种dsRNA然后被加工成siRNA,siRNA通常通过经由RNA诱导的沉默复合体(RISC)靶向靶基因的切割或通过翻译阻遏,来介导靶基因的沉默。这种技术的主要技术限制是许多重要的植物作物种难以或不可能转化,阻碍了指导dsRNA产生的构建体的组成型表达。此外,有关抗病毒转基因植物的潜在生态影响的问题迄今为止严重限制了它们的应用(Tepfer,2002,Annu.Rev.Phytopathol.40,467–491)。本发明的实施方案包括将外源不可转录的多核苷酸触发物分子例如dsRNA分子引入植物种子,用于在自种子长出的植物中和/或在摄食或感染自处理的种子长出的植物的植物病原性生物中调节基因表达的方法。若干实施方案涉及将外源不可转录的多核苷酸触发物引入植物种子,用于控制自种子长出的植物的害虫侵染和/或病毒感染的方法。摄食了自用按照本发明实施方案的外源不可转录的多核苷酸触发物分子例如dsRNA分子处理的种子而产生的植物材料,导致植物病原体的摄食、生长、发育、繁殖、侵染性的停止,并最终可导致其死亡。在某些实施方案中,所述外源不可转录的多核苷酸触发物被设计为使害虫或病毒病原体的靶基因沉默。多核苷酸触发物可以是单链或双链RNA或单链或双链DNA或双链DNA/RNA杂合体或其修饰的类似物,并且可以呈寡核苷酸长度或更长。若干实施方案涉及将dsRNA引入植物种子以调节基因表达的方法。本发明人现在已经设计了新的技术,用于将外源不可转录的多核苷酸触发物例如dsRNA分子直接引入植物种子。这些不可转录的多核苷酸触发物例如dsRNA分子进入种子并开始在植物的生命周期内持续的沉默过程,产生具有改良的目标性状的植物。被引入的多核苷酸触发物是裸露的,因此没有外源转录调节元件被引入植物中,因此减少了与转基因植物相关的环境顾虑。在某些实施方案中,被引入的多核苷酸触发物是裸dsRNA,因此没有外源转录调节元件被引入植物中。另外,修饰的种子可萌发生成植物而不需要进行费力和繁重的组织培养再生步骤。本发明的实施方案部分地提供递送系统,用于通过使害虫暴露给含有植物材料的食物而将害虫控制剂递送给害虫,所述植物材料是自用按照本发明实施方案的外源不可转录的多核苷酸触发物例如dsRNA分子处理的种子产生的。如下文和接下来的实施例部分中所描述的,本发明的实施方案包括设置将外源不可转录的多核苷酸触发物例如裸dsRNA引入种子所必需的条件(参见例如实施例1)。外源不可转录的多核苷酸触发物例如裸dsRNA,不整合到基因组并且在植物和在溶液中高度稳定(参见实施例2-4)。外源不可转录的多核苷酸触发物例如裸dsRNA,通过单子叶和双子叶植物的种子外皮(种皮)穿透并在胚乳和种子胚中分布(实施例5-6)。一方面,本发明的实施方案包括改变内源基因的表达(实施例8-15)。在某些实施方案中,其表达被改变的内源基因是靶向害虫基因的直向同源物。另一方面,本发明的实施方案包括将针对外源基因(例如,害虫基因或病毒基因)的外源不可转录的多核苷酸触发物例如dsRNA引入种子中。这些结果在单子叶植物和双子叶植物组两者中的许多植物中再现。又一方面,本发明的实施方案包括以宽范围的剂量和动力学,将针对害虫或病毒病原体的必需基因的外源不可转录的多核苷酸触发物例如dsRNA引入种子中,这导致基因表达显著改变。有趣的是,按照本发明的实施方案引入的dsRNA能够下调在摄食或感染自处理的种子长出的植物的植物病原体(例如,棉贪夜蛾,实施例7)中的必需基因。因此,本发明的结果足以表明本发明的教导提供有成本效益的植物种子的处理以获得所需的农业和园艺表型,例如针对害虫和病毒病原体的抗性。本文提供的是通过将多核苷酸触发物分子施用到植物种子用于在植物或植物病原体中诱导靶基因的系统调节(例如,系统阻遏或沉默)的组合物和方法,所述触发物分子在核苷酸序列中具有与靶基因或自所述靶基因转录的RNA的18个或更多个连续核苷酸的序列基本相同或与之基本互补的区段,藉此所述组合物穿透植物种子内部并在自种子长出的植物中或在自种子长出的植物的植物病原体中诱导靶基因的系统调节。多核苷酸触发物分子可以是具有单个这类区段、多个这类区段、多个不同的这类区段或其组合的一种或多种多核苷酸分子。不受具体理论的束缚,认为新提出的转化形式和基因表达的调节与以下有关:(i)将外源不可转录的多核苷酸触发物分子例如裸dsRNA引入种子内部(与仅种子外皮相对)。通过将种子浸泡在包含外源不可转录的多核苷酸触发物例如dsRNA的溶液中使得外源不可转录的多核苷酸触发物通过种皮穿透,或者通过浸渍使得外源不可转录的多核苷酸触发物涂布种子并在播种后通过种皮渗入,来实行引入;(ii)由外源不可转录的多核苷酸触发物例如dsRNA产生的信号扩增;和(iii)信号扩散在整株植物中。第一步骤只在最初的种子处理期间和种子处理后不久发生一次,而第二步骤和第三步骤以重复回路发生,只要沉默信号在植物中保持活性。不受理论的束缚,对于所述发明提出的未束缚的作用方式是基于以下各个步骤:将外源不可转录的多核苷酸触发物例如dsRNA引入种子。典型的成熟种子由包裹在母本种子外皮(种皮)内的胚和胚与种子外皮之间大量的胚乳组织层组成。胚乳在种子发育、萌发和幼苗建植期间用作胚的营养源。种子萌发通常始于将种子暴露于水中,水被胚和胚乳吸收。然后胚乳的体积膨大,一些植物种的胚乳能够生长到其最初体积的数倍。休眠直到该阶段的胚,此时从休眠中解除,开始细胞分裂、增殖和分化。胚乳为发育中的胚提供养分,直到它发育到足以开始光合作用和自养生长。根据这些种子萌发的已知机制,提出了“将外源不可转录的多核苷酸触发物例如dsRNA引入种子”的初始步骤的两种可能的作用方式:外源不可转录的多核苷酸触发物例如dsRNA分子被用于种子处理的基于水的溶液携带直接进入胚中。外源不可转录的多核苷酸触发物例如dsRNA分子作为胚乳吸水过程的一部分进入胚乳。这些分子随后在萌发和种子发育期间,在胚发育时作为来自胚乳的养分流的一部分供给胚。根据图7-13所述结果,估计发生两种选择的组合。也就是说,dsRNA中的一些直接进入胚中,一些保留在胚乳中,并在种子萌发期间供给发育中的胚。信号的扩增一旦dsRNA分子进入胚中,则被RNA酶III样酶例如Dicer或Dicer样(DCL)酶识别和加工。DCL酶将长的dsRNA分子加工成短的双链RNA(称为siRNA或shRNA),其通常为21-24个核苷酸(nt)长。siRNA链之一通常快速降解,第二链可掺入RISC(RNA诱导的沉默复合体)蛋白质复合体中,所述复合体含有Argonaute(AGO)蛋白。AGO蛋白含有结合siRNA的PIWI结构域和具有RNA酶活性的PAZ结构域。随后,siRNA/AGO复合体识别与siRNA互补的mRNA分子,并通过切割或翻译阻遏导致其沉默。siRNA然后从RISC复合体中释放,此时可用作RNA依赖性RNA聚合酶(RDRP)的引物,所述酶是植物界特有的酶,可通过产生新的dsRNA分子(第二siRNA),来产生扩增的沉默信号。这些新合成的dsRNA可再次如上文所述加工,因此维持和扩增沉默信号。沉默信号的扩散沉默扩散在植物中是已知的和被充分认识的现象。不希望受到具体理论的束缚,短距离的细胞到细胞的扩散被认为是通过胞间连丝而发生。这个过程被认为由21nt长的作为DCL酶的产物的siRNA介导。此外,通过穿过整株植物的韧皮部从源到库(sink)实现系统扩散。不受具体理论的束缚,认为在所述方法中,一旦沉默信号开始并如上所述扩增,则发生沉默信号的扩散。这可包括通过各种siRNA信号分子的短距离扩散和系统扩散两者。按照一个实施方案,提供将外源不可转录的多核苷酸触发物例如裸露的双链RNA(dsRNA)引入种子的方法,所述方法包括在允许外源不可转录的多核苷酸触发物例如裸dsRNA穿透入种子的条件下使种子与外源不可转录的多核苷酸触发物例如裸dsRNA接触,从而将dsRNA引入种子中。本文所述的若干实施方案涉及产生具有所需表型的植物的方法,包括:a)在允许外源不可转录的多核苷酸触发物分子穿透入种子的条件下,使未萌发的种子接触所述触发物分子,和b)使所述种子萌发以产生在从所述种子中显现后表现出所需表型的植物。在某些实施方案中,所需表型是昆虫抗性。在某些实施方案中,所需表型是病毒抗性。本文使用的术语“触发物”或“触发物多核苷酸”是指这样的生物活性多核苷酸分子:其与靶基因或自所述靶基因表达的RNA或它们的片段的多核苷酸序列基本同源或与之互补并且起到抑制靶基因的表达或产生敲减表型的功能。触发物多核苷酸通常相对于其“靶序列”而描述。触发物多核苷酸可以是单链DNA(ssDNA)、单链RNA(ssRNA)、双链RNA(dsRNA)、双链DNA(dsDNA)、或双链DNA/RNA杂合体。触发物多核苷酸可包含天然存在的核苷酸、修饰的核苷酸、核苷酸类似物或其任何组合。在某些实施方案中,触发物多核苷酸可被掺入较大的多核苷酸中,例如pri-miRNA分子中。在某些实施方案中,触发物多核苷酸可被加工为小干扰RNA(siRNA)。本文使用的术语“靶序列”是指在触发物多核苷酸所针对的基因或基因产物中存在的核苷酸序列。在这种背景中,术语“基因”意指基因组序列的可定位区,相当于遗传单元,其包括调节区,例如启动子、增强子、5’非翻译区、内含子区、3’非翻译区、转录区、和植物基因组中可作为天然基因或转基因存在的其它功能序列区。根据情况,术语靶序列可指为了抑制而靶向的基因或基因产物的全长核苷酸序列或者为了抑制而靶向的基因或基因产物的一部分的核苷酸序列。本文使用的术语“衍生自”是指指定的核苷酸序列,其可得自具体指定的来源或物种,虽然不一定直接来自所指定的来源或物种。本文使用的术语“序列”、“核苷酸序列”或“多核苷酸序列”是指DNA分子、RNA分子或其部分的核苷酸序列。术语“多核苷酸”是指通过核苷酸间键连接的单核苷酸的任何聚合物。多核苷酸可由天然存在的核糖核苷酸、天然存在的脱氧核糖核苷酸、天然存在的核苷酸的类似物(例如,天然存在的核苷酸的对映体形式)、或其任何组合组成。当多核苷酸是单链时,其长度可以用核苷酸数量的方式来描述。当多核苷酸是双链时,其长度可以用碱基对数量的方式来描述。本文使用的术语“不可转录的多核苷酸”是指不包含完整聚合酶II转录单元的多核苷酸。术语“基因表达”是指将基因组DNA中编码的遗传信息通过经由RNA聚合酶的酶促作用的基因转录转化为RNA(例如,mRNA、rRNA、tRNA或snRNA),以及通过mRNA的翻译而转化为蛋白质的过程。在该过程中的多个阶段可调节基因表达。本文使用的短语“基因表达的抑制”或“基因抑制”或“使靶基因沉默”和类似术语和短语是指没有自靶基因产生的蛋白和/或mRNA产物或者自靶基因产生的蛋白和/或mRNA产物水平的可见的减少。可通过检查细胞或生物体的外部特性或通过生化技术来证实抑制、抑制或沉默的结果。本文使用的术语“序列同一性”、“序列相似性”或“同源性”用于描述两个或更多个核苷酸序列之间的相似性程度。两个序列之间“序列同一性”的百分比通过在比较窗口内比较两个最佳比对的序列而确定,其中比较窗口中的序列部分与用于两个序列的最佳比对的参考序列(其不包含添加或缺失)相比可以包含添加或缺失(空位)。该百分比通过确定两个序列中存在的相同核酸碱基或氨基酸残基的位置数目以获得匹配位置的数目,将匹配位置的数目除以比较窗口中总的位置数目并将其结果乘以100以产生序列同一性的百分比而计算。与参考序列相比在每一位置相同的序列可以说与参考序列相同,反之亦然。可使用任何合适的计算机程序进行两个或更多个序列的比对。例如,用于进行序列比对的一个被广泛使用和接受的计算机程序是CLUSTALWv1.6(Thompson,等人,Nucl.AcidsRes.,22:4673-4680,1994)。“基本相同”或“基本互补”意指在生理条件下,生物活性多核苷酸触发物(或双链多核苷酸的至少一条链或其部分、或单链多核苷酸的一部分)与内源基因、自其转录的RNA、或其片段杂交,以实行对内源基因的调节或抑制。例如,在某些实施方案中,当与靶基因或自所述靶基因转录的RNA的10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60或更多个连续核苷酸的序列相比,生物活性多核苷酸触发物具有100%序列同一性或至少大约83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、或99%序列同一性。在某些实施方案中,当与靶基因或自所述靶基因转录的RNA的10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60或更多个连续核苷酸的序列相比,生物活性多核苷酸触发物具有100%序列互补性或至少大约83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、或99%序列互补性。在某些实施方案中,生物活性多核苷酸触发物与给定靶基因(基因的编码或非编码序列)的一个等位基因或一个家族成员具有100%序列同一性或互补性。在某些实施方案中,生物活性多核苷酸触发物与给定靶基因的多个等位基因或家族成员具有至少大约83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、或99%序列同一性或互补性。在某些实施方案中,生物活性多核苷酸触发物与给定靶基因的多个等位基因或家族成员具有100%序列同一性或互补性。如本文使用的,当从5'至3'阅读的序列之一的每个核苷酸与从3'至5'阅读时的另一序列的每个核苷酸是互补的时,认为核酸序列分子表现出“完全互补性”。与参考核苷酸序列完全互补的核苷酸序列将表现出与参考核苷酸序列的反向互补序列相同的序列。同源序列包括直系同源序列和旁系同源序列。术语“旁系同源”涉及物种的基因组内的基因重复,导致旁系同源基因。术语“直系同源”涉及在不同生物中的因祖先关系所致的同源基因。本文使用的术语“外源多核苷酸”和“外源核酸分子”对于生物体而言,是指并非在该生物体例如植物中天然表达的异源核酸序列。外源核酸分子可包含与生物体的内源核酸序列相同或部分同源的核酸序列。本文使用的术语“内源多核苷酸”和“内源核酸”是指在生物体细胞中发现的核酸序列。在某些方面,内源核酸可以是核基因组或质体基因组的一部分。如本文使用的,内源核酸不包括病毒、寄生虫或病原体核酸,例如endovirus序列。本文使用的短语“裸dsRNA”是指在植物细胞中不可转录的dsRNA核酸分子。因此,裸dsRNA分子不包含在核酸表达构建体(例如病毒载体)中。按照本发明的一些实施方案,裸dsRNA分子不衍生自病毒载体。按照一些实施方案,dsRNA不是天然病原体或病毒感染的产物。按照一些实施方案,裸dsRNA可包含用于体外转录的调节元件,例如T7启动子。按照本发明的一些实施方案,裸dsRNA可被修饰例如化学修饰以赋予较高的生物利用度、穿透入种子中和/或改进的保存期限。本文所用术语“dsRNA”涉及通过碱基配对保持在一起的反向平行的多核糖核酸的二条链。dsRNA分子可以通过分子内杂交或分子间杂交而形成。在某些实施方案中,dsRNA可包含单链RNA,其自我杂交形成具有至少部分双链结构的发夹结构,其包含与来自为了抑制而靶向的基因转录的RNA杂交的至少一个区段。在某些实施方案中,dsRNA可包含两个单独的RNA链,其通过互补碱基对杂交。RNA链可以或可以不被聚腺苷酸化;RNA链可以能够或可以不能够被细胞翻译器翻译为多肽。两条链可以是相同长度或不同长度,前体是在两条链之间有足够的序列同源性以在全长内以至少80%、90%、95%或100%互补性形成双链结构。按照本发明的实施方案,dsRNA分子没有突出端。按照本发明的另一个实施方案,dsRNA分子包含突出端。按照其它的实施方案,使链对齐,使得不对齐的(即相对链上不存在互补的碱基)的链的末端有至少1、2或3个碱基,使得当链退火时,双链体的一端或两端存在1、2或3个残基的突出端。正如本领域普通技术人员将会知道的,本公开内容的dsRNA分子可以指反向平行核酸的任一链。也正如本领域普通技术人员将会知道的,本公开内容的dsRNA分子包括‘有义’和‘反义’链两者并且有义和反义链在碱基配对区是彼此的反向互补物。本文使用的用于调节目标靶基因的dsRNA分子的序列以相对于目标靶基因‘有义’方向而提供。如本文使用的,“用于调节目标靶基因的dsRNA分子的反向互补物”是指呈‘反义’方向的核酸序列。正如所述,任何dsRNA分子可按照本发明的教导使用。在某些实施方案中,用于本申请的dsRNA经过RNA-依赖性RNA聚合酶(RDRP)的扩增。不受限制的情况下,dsRNA可以是siRNA、shRNA、pre-miRNA、或pri-miRNA。本领域技术人员可通过化学或酶学方式,通过手工或自动化反应或在另一生物体体内产生本发明实施方案的多核苷酸、DNA、RNA、dsRNA、siRNA、shRNA、pre-miRNA、pri-miRNA或miRNA。也可通过部分或完全有机合成来产生RNA;可通过体外酶促或有机合成引入任何修饰的核糖核苷酸。可通过细胞RNA聚合酶或噬菌体RNA聚合酶(例如,T3、T7、SP6)合成RNA。表达构建体的使用和产生是本领域已知的(参见例如WO97/32016;美国专利号5,593,874,5,698,425,5,712,135,5,789,214和5,804,693)。如果经化学合成或体外酶促合成,可在引入种子前将RNA纯化。例如,可通过用溶剂或树脂提取、沉淀、电泳、色谱、或其组合,从混合物中纯化RNA。或者,可不经纯化或最少纯化而使用RNA,以避免因样品处理所致的损失。可将RNA干燥而贮存或溶于水溶液中。溶液可含有缓冲液或盐类,以促进双链体链的退火和/或稳定。本发明的教导涉及不同长度的dsRNA,其中较短的形式即x短于或等于50bp(例如17-50),被称为siRNA或miRNA。51-600或大于600bp的较长dsRNA分子在本文被称为dsRNA,其可针对siRNA分子被进一步加工。在一个实施方案中,本申请中的dsRNA为介于20和100bp之间,介于25和90bp之间,介于30和80bp之间,介于30和70bp之间,介于30和60bp之间,或介于30和50bp之间。在另一个实施方案中,本申请中的dsRNA为大约50bp。在又一实施方案中,dsRNA在一端或两端包含1碱基、2碱基或3碱基的5'-突出端。在另一个实施方案中,dsRNA在一端或两端不包含1碱基、2碱基或3碱基的5'-突出端。在又一实施方案中,dsRNA在一端或两端包含1碱基、2碱基或3碱基的3'-突出端。在另一个实施方案中,dsRNA在一端或两端不包含1碱基、2碱基或3碱基的3'-突出端。在另一个实施方案中,本申请中的dsRNA为介于100和1,000bp之间,介于200和900bp之间,介于300和800bp之间,介于400和700bp之间,介于400和600bp之间,或介于400和500bp之间。在另一个实施方案中,本申请中的dsRNA为大约450bp。在另一个实施方案中,本申请中的dsRNA为大约550bp。在另一个实施方案中,本申请中的dsRNA为大约650bp。在另一个实施方案中,本申请中的dsRNA为大约750bp。在另一个实施方案中,本申请中的dsRNA为大约850bp。在又一实施方案中,dsRNA在一端或两端包含1碱基、2碱基或3碱基的5'-突出端。在另一个实施方案中,dsRNA在一端或两端不包含1碱基、2碱基或3碱基的5'-突出端。在又一实施方案中,dsRNA在一端或两端包含1碱基、2碱基或3碱基的3'-突出端。在另一个实施方案中,dsRNA在一端或两端不包含1碱基、2碱基或3碱基的3'-突出端。在一个实施方案中,本申请中的dsRNA为介于15和500bp之间,介于15和450bp之间,介于15和400bp之间,介于15和350bp之间,介于15和300bp之间,介于15和250bp之间,介于15和200bp之间,介于15和150bp之间,介于15和100bp之间,介于15和90bp之间,介于15和80bp之间,介于15和70bp之间,介于15和60bp之间,介于15和50bp之间,介于15和40bp之间,介于15和35bp之间,介于15和30bp之间,或介于15和25bp之间。在另一个实施方案中,本申请中的dsRNA长度至少大约20、25、30、35、40、45、50、75、100、150、200、250、300、350、400、500、600、800、900、1000bp。在又一实施方案中,本申请中的dsRNA为介于100和1000bp之间,介于200和1000bp之间,介于300和1000bp之间,介于400和1000bp之间,介于500和1000bp之间,介于600和1000bp之间,介于700和1000bp之间,介于800和1000bp之间,或介于900和1000bp之间。术语“siRNA”是指诱导RNA干扰(RNAi)途径的小的抑制性RNA双链体(通常介于17-30个碱基对之间,但也有较长的碱基对例如31-50bp)。通常,siRNA以化学方法合成作为21聚体,其具有中心19bp双链体区和末端上对称的2碱基3'-突出端,尽管最近描述了与在相同位置的21聚体相比,长为25-30个碱基的化学合成的RNA双链体的功效可增加多达100倍。据推理,在触发RNAi中使用较长RNA所获得的实测功效的增加产生于给Dicer提供底物(27聚体)而不是产物(21聚体),而且这提高了siRNA双链体进入RISC的速率或效率。已发现,3'-突出端的位置影响siRNA的功效,且在反义链上具有3'-突出端的不对称双链体一般比有义链上具有3'-突出端的那些更有效(Rose等人,2005)。这可归因于加载入RISC的不对称链,因为当靶向反义转录物时,观察到相反的功效模式。双链干扰RNA(例如siRNA)的链可连接形成发夹或茎环结构(例如shRNA)。因此,如所提及的,本发明的一些实施方案的RNA沉默剂也可为短发夹RNA(shRNA)。本文所用术语“shRNA”是指这样的RNA剂,即具有茎环结构,包含互补序列的第一和第二区域,区域的互补程度和取向足够使得区域之间发生碱基配对,第一区域和第二区域通过环区域连接,环因环区域内核苷酸(或核苷酸类似物)之间缺乏碱基配对所引起。环中核苷酸的数目介于3-23、或5-15、或7-13、或4-9、或9-11之间并包括3、23或5、15或7、13或4、9或9、11。环中的一些核苷酸可参与与环中其它核苷酸的碱基对的相互作用。可用来形成环的寡核苷酸序列的实例包括5'-UUCAAGAGA-3'(Brummelkamp,T.R.等人(2002)Science296:550)和5'-UUUGUGUAG-3'(Castanotto,D.等人(2002)RNA8:1454)。本领域技术人员应认识到,所得的单链寡核苷酸形成包含能够与RNAi机器相互作用的双链区域的茎-环或发夹结构。本文所用的短语“微小RNA(本文亦可互换称为“miRNA”或“miR”)或其前体”是指用作转录后调节物的微小RNA(miRNA)分子。通常,miRNA分子是长度约20-22个核苷酸的RNA分子,其可加载至RISC复合体中,并且直接切割另一种RNA分子,其中其它RNA分子包含与miRNA分子的核苷酸序列基本互补的核苷酸序列。通常,miRNA分子自“pre-miRNA”或如本文所述的pre-miRNA分子的前体被存在于任何植物细胞中的蛋白质(例如DCL蛋白)加工,并加载至RISC复合体中,在所述复合体中可指导靶RNA分子的切割。Pre-微小RNA分子通常自pri-微小RNA分子(初级转录物)加工。侧接pre-微小RNA的单链RNA区段对于pri-miRNA加工成pre-miRNA是重要的。切割位点似乎取决于距茎-ssRNA连接点的距离(Han等人,2006,Cell125,887-901,887-901)。本文所用的“pre-miRNA”分子是可呈二级结构的约100至约200个核苷酸,优选约100至约130个核苷酸的RNA分子,该二级结构包含不完整的双链RNA茎和单链RNA环(亦称为“发夹”),并且还包含双链RNA茎中miRNA(及其互补序列)的核苷酸序列。根据一个具体的实施方案,miRNA及其互补序列位于距miRNA双链RNA茎的游离端约10至约20个核苷酸。单链环区域的长度和序列不是决定性的,可相当大地在长度例如30和50nt之间变化。miRNA与其互补序列之间的互补性不必是完全的,可容许约1-3个不配对核苷酸的凸出。可通过本领域的常规计算机算法(例如mFOLD)预测RNA分子所采取的二级结构。来自被DCL活性释放并加载至RISC复合体中的pre-miRNA的双链RNA茎的特定链取决于5′端的互补程度,籍此在该链(其在5′端上最少参与被切割的dsRNA茎的不同链的核苷酸之间的氢键结合)被加载至RISC复合体中,并决定靶RNA分子降解的序列特异性。然而,如果来自特定合成的pre-miRNA分子的miRNA分子凭经验不是功能性的(因为“错误”链加载至RISC复合体中),则可通过交换pre-miRNA分子的dsRNA茎各个链上的miRNA分子及其互补序列的位置来解决这个问题,这将是很显然的。如本领域已知,涉及两个氢键结合的A和U或涉及两个氢键结合的G和U之间的结合没有涉及3个氢键结合的G和C之间的结合强。下表3、4、6、7、13、18、26、27、28、34、35、36和37提供发夹序列的实例。天然存在的miRNA分子可包含在其天然存在的pre-miRNA分子中,但也可通过交换自所述现有pre-miRNA分子正常加工的miRNA分子的核苷酸序列为另一目标miRNA的核苷酸序列,将它们引入现有的pre-miRNA分子支架。pre-miRNA的支架也可以是完全合成的。同样,合成miRNA分子可包含在现有的pre-miRNA分子支架或合成的pre-miRNA支架内,并自其加工。对于其正确加工成设计的微小RNA的效率,特别是当作为嵌合基因(其中除pre-微小RNA以外其它DNA区域例如非翻译前导序列或转录终止和聚腺苷酸化区域被掺入初级转录物中)表达时,相对于其它pre-miRNA支架,一些pre-miRNA支架可能是优选的。根据本发明的教导,dsRNA分子可以是天然存在的或合成的。dsRNA可以是长和短dsRNA分子的混合物,例如dsRNA、siRNA、siRNA+dsRNA、siRNA+miRNA或所述这些的任意组合。根据一个具体的实施方案,dsRNA是siRNA(100%)。根据一个具体的实施方案,dsRNA是不同比率的siRNA+dsRNA组合。任何dsRNA与siRNA的比率都可用于siRNA+dsRNA组合。例如1:1的比率:在RNA酶III处理后,一种dsRNA与相同序列混合。按照另一个实施方案,dsRNA与siRNA的比率为2:1、1.5:1、1.3:1、1:0.01、1:0.05或1:0.1。按照另一个实施方案,dsRNA与siRNA的比率为2:1至1:0.1。根据一个具体的实施方案,dsRNA是纯化的dsRNA(100%)。按照另一个实施方案,dsRNA与siRNA的比率是1:2、1:5、1:10、1:20、或1:50。按照再一个实施方案,dsRNA是纯化的siRNA(100%)。可设计dsRNA分子用于特异性靶向目标靶基因。在某些实施方案中,所述靶基因是害虫的必需基因。在某些实施方案中,所述靶基因是病毒基因。可以理解,dsRNA可用于下调一个或多个靶基因。如果靶向多个靶基因,则使用包含靶向许多靶基因的多个dsRNA分子的异质组合物。或者,将所述多个dsRNA分子分别施用于种子(但不是作为单一组合物)。根据一个具体的实施方案,使用用于单一靶的多种不同dsRNA分子,其可单独或同时(例如共制剂)施用。按照一个实施方案,靶基因是植物内源性的。下调所述基因通常对于赋予植物改良的农业、园艺、营养性状是重要的(“改良”或“提高”在下文中进一步定义)。应认识到,用dsRNA处理可导致靶基因的上调(其遵循下文提供的建议机制),然而,所述上调可能是瞬时的。按照另一实施方案,靶基因是植物外源性的。在某些实施方案中,靶基因是害虫基因。在某些实施方案中,靶基因是病毒基因。应当还理解,用dsRNA处理可导致靶基因的植物直向同源物上调。本文所述的若干实施方案涉及用于在植物病原体中有效RNA沉默的不可转录的多核苷酸触发物例如dsRNA分子的设计和选择的指导方针,所述植物病原体的生长/繁殖和/或存活是靠植物滋养或依赖于植物。不希望受到具体理论的束缚,与内源植物基因具有足够同源性水平的不可转录的多核苷酸触发物例如dsRNA分子允许初级siRNA(通过Dicer加工而触发的那些)的降解和扩增以产生由DICER-样4(DCL4)形成的次级siRNA。可以选择对植物生长和生存力具有最低影响的这样的不可转录的多核苷酸触发物例如dsRNA分子。在某些实施方案中,次级siRNA与植物病原体基因具有足够同源性,从而允许通过RNA干扰方式使所靶向的植物病原体基因的降解。在某些实施方案中,提供有自用本文所述的不可转录的多核苷酸触发物例如dsRNA分子处理的种子长出的植物材料的植物病原体,将因生长停滞或死亡的诱导而失去生存力。认为这样的不可转录的多核苷酸触发物例如dsRNA分子是有价值的杀虫剂并可在农业和园艺上具有广泛应用。不受具体理论的束缚,认为基因表达的调节的一种模式与以下有关:(i)将不可转录的多核苷酸触发物分子例如dsRNA分子引入种子内部(与仅种子外皮相对);(ii)由不可转录的多核苷酸触发物例如dsRNA分子的引入而产生的信号的扩增;和信号扩散在整株植物中。第一步骤只在最初的种子处理期间和种子处理后不久发生一次,而第二步骤和第三步骤以重复回路发生,只要沉默信号在植物中保持活性。正如所述,本发明组合物的引入也可使用常规递送方法例如粒子轰击、嫁接、浸泡、局部施用转移剂等,对植物的其它器官/细胞进行(与种子相对)。因此,如上定义的步骤(i)和(ii),也由该给予模式共享。摄食或感染以下植物的植物病原体将表现出生长停滞或死亡,从而减少其对植物或植物产物的有害影响:所述植物包含靶向植物病原体的必需基因的任何dsRNA、初级siRNA或次级siRNA。在某些实施方案中,提供将裸双链RNA(dsRNA)引入种子的方法,所述方法包括在允许核酸序列穿透的条件下使种子与裸dsRNA接触,所述核酸序列:与植物病原性生物基因具有足以诱导所述植物病原性生物的所述基因降解的同源性水平,其中所述植物病原性生物的生长依赖于所述植物和其中所述降解诱导所述植物病原性生物的生长停滞或死亡。在某些实施方案中,所述dsRNA靶向这样的基因:所述基因含有在各植物病原性生物之间、或在植物病原性生物和宿主植物之间保守性差的区域。在某些实施方案中,可能需要靶向植物病原性生物中的这样的基因:所述基因在其它生物例如宿主植物中无已知同源性。在某些实施方案中,选择与植物基因具有足以在RNA干扰介导的功能中介导其降解的同源性的不可转录的多核苷酸触发物例如dsRNA分子。按照一个实施方案,提供将裸双链RNA(dsRNA)引入种子的方法,所述方法包括在允许核酸序列穿透的条件下使种子与裸dsRNA接触,所述核酸序列:(i)与植物基因具有足以在包含它们的植物细胞中诱导所述dsRNA的次级siRNA产物的扩增的同源性水平并且其中所述dsRNA对植物基因表达的修饰基本上不影响所述植物的任何生物量、生长势或产量;和(ii)与植物病原性生物基因具有足以诱导所述植物病原性生物的所述基因降解的同源性水平,其中所述植物病原性生物的生长依赖于所述植物并且其中所述降解诱导所述植物病原性生物的生长停滞或死亡。在某些实施方案中,dsRNA与植物基因具有足以在包含所述dsRNA的植物细胞中诱导所述dsRNA的次级siRNA产物的扩增的同源性水平并且其中所述dsRNA对植物基因表达的改变基本上不影响所述植物的任何生物量、生长势或产量。所述植物基因可以是在植物中天然表达(内源)或作为遗传转化的结果(转基因植物)。在某些实施方案中,所述dsRNA与以下植物基因具有同源性水平,所述植物基因:(i)在所有或大部分植物器官中自萌发开始表达;(ii)是非必需基因,使得其下调或上调不影响植物的任何植物生物量、产量、生长势;和/或(iii)与非生物胁迫或生物胁迫的耐受性无关。可以选择具有至少一个以上特性即(i)、(ii)或(iii)的植物基因。或者,植物基因满足两个标准例如(i)和(ii)、(i)和(iii)或(ii)和(iii)。或者所有三个标准都具有,即(i)、(ii)和(iii)。在某些实施方案中,所述dsRNA与以下植物基因具有同源性水平,所述植物基因当采取措施使植物在最佳/正常条件或对于最佳生长、生长势、生物量和/或产量而言不需要该基因功能的条件下生长时,不影响植物的生物量、产量和/或生长势。本文使用的短语“基本不影响”是指与相同发育期和生长条件的同基因植物的相同特性相比无影响。或者,所述特性仅被轻微影响达不超过10%、8%、7%、6%、5%、4%、3%、2%或1%。按照一些实施方案,选择不可转录的多核苷酸触发物例如dsRNA分子的核酸序列,以便表现出足够同源性,以募集RDR6系统和产生次级siRNA转录物。这样的同源性水平典型地是与内源植物基因在至少25个连续bp上具有至少80%同一性。按照备选实施方案,不可转录的多核苷酸触发物例如dsRNA分子的同源性水平是与植物基因在至少25个连续bp上具有至少85%同一性。按照备选实施方案,不可转录的多核苷酸触发物例如dsRNA分子的同源性水平是与植物基因在至少25个连续bp上具有至少88%同一性。按照备选实施方案,不可转录的多核苷酸触发物例如dsRNA分子的同源性水平是与植物基因在靶基因的至少25个连续bp上具有至少90%同一性。按照备选实施方案,不可转录的多核苷酸触发物例如dsRNA分子的同源性水平是与植物基因在至少25个连续bp上具有至少92%同一性。按照备选实施方案,不可转录的多核苷酸触发物例如dsRNA分子的同源性水平是与植物基因在至少25个连续bp上具有至少95%同一性。按照备选实施方案,不可转录的多核苷酸触发物例如dsRNA分子的同源性水平是至少25个连续bp。按照一些实施方案,不可转录的多核苷酸触发物例如dsRNA分子为至少70bp或更长,如70-700、70-600、70-500、70-400、70-300、70-200、70-100bp。按照一些实施方案,不可转录的多核苷酸触发物例如dsRNA分子包含长度至少70bp的核酸区段,其与植物基因具有至少65%同一性。按照具体的实施方案,所述核酸序列包含长度至少70bp的核酸区段,其与植物基因具有至少70%同一性(在整个序列上)。按照具体的实施方案,所述核酸序列包含长度至少70bp的核酸区段,其与植物基因具有至少75%同一性(在整个序列上)。按照具体的实施方案,所述核酸序列包含长度至少70bp的核酸区段,其与植物基因具有至少80%同一性(在整个序列上)。按照具体的实施方案,所述核酸序列包含长度至少70bp的核酸区段,其与植物基因具有至少85%同一性(在整个序列上)。按照具体的实施方案,所述核酸序列包含长度至少70bp的核酸区段,其与植物基因具有至少90%同一性(在整个序列上)。按照具体的实施方案,所述核酸序列包含长度至少70bp的核酸区段,其与植物基因具有至少95%同一性(在整个序列上)。按照具体的实施方案,所述核酸序列包含长度至少70bp的核酸区段,其与植物基因具有100%同一性(在整个序列上)。在某些实施方案中,不可转录的多核苷酸触发物例如dsRNA分子的核酸序列包含长度至少17bp的第二核酸区段(在至少17个连续bp上),其与植物基因具有至少85%同一性。按照具体的实施方案,不可转录的多核苷酸触发物例如dsRNA分子的核酸序列包含长度至少17bp的第二核酸区段(在至少17个连续bp上),其与植物基因具有至少90%同一性。按照具体的实施方案,不可转录的多核苷酸触发物例如dsRNA分子的核酸序列包含长度至少17bp的第二核酸区段(在至少17个连续bp上),其与植物基因具有至少95%同一性。按照具体的实施方案,不可转录的多核苷酸触发物例如dsRNA分子的核酸序列包含长度至少17bp的第二核酸区段(在至少17个连续bp上),其与植物基因具有100%同一性。按照具体的实施方案,第一核酸区段和第二核酸区段重叠(达至少5%、10%、20%、40%、50%或更高)。按照具体的实施方案,重叠达5-99%、5-95%、5-90%、5-80%、5-70%、5-60%。按照具体的实施方案,第一核酸区段和第二核酸区段无重叠。在某些实施方案中,选择不可转录的多核苷酸触发物例如dsRNA分子的核酸序列,其与植物病原性生物基因具有足以诱导所述植物病原性生物的基因降解的同源性水平,其中所述植物病原性生物的生长依赖于所述植物并且其中所述降解诱导所述植物病原性生物的生长停滞或死亡。因此,不可转录的多核苷酸触发物例如dsRNA分子表现出与植物病原体的基因具有至少80%、85%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或甚至100%同一性。在某些实施方案中,可以设计不可转录的多核苷酸触发物例如dsRNA分子,用于特异性靶向目标靶基因。可以理解,不可转录的多核苷酸触发物例如dsRNA分子可用于下调植物病原体或植物(在后一种情况下增加扩增)的一个或多个靶基因。如果靶向多个靶基因,则使用包含靶向多个靶基因的多个不可转录的多核苷酸触发物例如dsRNA分子的异质组合物。或者,将所述多个不可转录的多核苷酸触发物例如dsRNA分子分别施用于种子(但不是作为单一组合物)。靶基因的下调对于赋予改良的对由植物病原体诱导的生物胁迫的耐受性而言可能是重要的。生物胁迫可影响任何植物生物量、生长势或产量、以及对生物胁迫的耐受性和氮利用效率。靶基因(植物病原体的植物)可包含转录为编码多肽的mRNA的核酸序列。本文所用的术语“内源的”是指其表达(mRNA或蛋白质)发生在植物中的基因。通常,内源基因在植物中天然表达或来源于植物。因此,植物可以是野生型植物。然而,植物还可以是遗传修饰的植物(转基因)。本文所用的术语“分离的”是指从天然生理环境中分离。在dsRNA的情况下,从细胞器例如细胞溶质或细胞核分离。在种子的情况下,从植物的其它部分例如果实中分离。按照具体的实施方案,分离的dsRNA分子呈裸RNA形式。靶基因的下调对于赋予改良的以下一个或至少一个(例如两个或更多个)性状而言可能是重要的:生物量、生长势、产量、非生物胁迫耐受性、生物胁迫耐受性或改良的氮利用效率。靶基因的实例包括但不限于酶、结构蛋白、植物调节蛋白、miRNA靶基因或非编码RNA例如植物miRNA。WO2011067745、WO2009125401和WO2012056401提供表达可被沉默以改进植物性状的miRNA序列或miRNA的靶的实例(分别例如mRNA167、miRNA156、miR164及其靶NFY、SPL17和NAC)。随后实施例部分中描述了可按照本发明的教导进行调节的靶基因的其它实例。靶基因可包含转录为编码多肽的mRNA的核酸序列。或者,靶基因可以是非编码基因例如miRNA或siRNA。例如,为了使目标mRNA的表达沉默,可如下选择适于与本发明的一些实施方案一起使用的dsRNA的合成。第一,扫描mRNA序列,包括3'UTR和5'UTR。第二,应用任何序列比对软件,例如可获自NCBI服务器的BLAST软件(wwwdotncbidotnlmdotnihdotgov/BLAST/),将mRNA序列与合适的基因组数据库进行比较。滤出显示与其它编码序列有明显同源性的mRNA序列的推定区域。选择合格的靶序列作为dsRNA合成的模板。优选的序列是与基因组中的其它基因几乎没有同源性的那些序列以降低“脱靶”作用。在一个实施方案中,dsRNA可包含在靶基因的内含子、外显子、3’UTR、5’UTR、或调节元件或其组合中的靶序列。在一个实施方案中,本申请的dsRNA可包含位于启动子中的靶位点。可以理解,本发明一些实施方案的RNA沉默剂不必限制在仅含RNA的那些分子,而是进一步包括经化学修饰的核苷酸和非核苷酸。可使用本领域任何已知方法,包括酶促合成或固相合成,合成dsRNA。在含或不含上述修饰的短多核苷酸序列的情况下,这些尤其有用。用于执行固相合成的装置和试剂是市售的,可获自例如AppliedBiosystems。也可采用用于所述合成的任何其它方法;寡核苷酸的实际合成尽在本领域技术人员的能力范围内,并可通过详述于以下文献的已确立方法,应用固相化学,例如氰基乙基亚磷酰胺接着脱保护、脱盐和通过例如自动化trityl-on方法或HPLC进行的纯化来完成:例如Sambrook,J.和Russell,D.W.(2001),“MolecularCloning:ALaboratoryManual”;Ausubel,R.M.等人,编辑.(1994,1989),“CurrentProtocolsinMolecularBiology,”第I-III卷,JohnWiley&Sons,Baltimore,Maryland;Perbal,B.(1988),“APracticalGuidetoMolecularCloning,”JohnWiley&Sons,NewYork;和Gait,M.J.,编辑(1984),“OligonucleotideSynthesis”。正如所述,使裸dsRNA分子与种子直接接触。种子可以是任何植物的种子,例如绿色植物界总科包括单子叶植物和双子叶植物的种子。下文中列举了其它植物。按照本发明的实施方案,植物的细胞包含RNA依赖性RNA聚合酶活性和dsRNA的靶RNA分子以确保dsRNA的扩增。本文所用术语“植物”包括整株植物、植物的祖代和子代及植物部分,包括种子、嫩枝、茎、根(包括块茎)和分离的植物细胞、组织和器官。植物可呈现任何形式,包括悬浮培养物、胚、分生组织区、愈伤组织、叶、配子体、孢子体、花粉和小孢子。应认识到,植物或其种子可以是转基因植物。本文所用的短语“植物细胞”是指衍生自并分离自破碎的植物细胞组织或植物细胞培养物的植物细胞。植物细胞可以是生殖细胞(即来自直接促成植物有性生殖的组织的细胞)或非生殖细胞(即来自不参与植物有性生殖的组织的细胞)。植物细胞可以是能够再生成完整植物的细胞或不能再生成完整植物的细胞,例如无核的成熟筛管细胞。本文所用的短语“植物细胞培养物”是指任何类型的天然(天然存在的)植物细胞、植物细胞系和遗传修饰的植物细胞,其不装配形成完整植物,使得植物的至少一个生物结构不存在。任选本发明这个方面的植物细胞培养物可包含特定类型的植物细胞或多种不同类型的植物细胞。应注意,任选特征是特定类型的植物细胞的植物培养物最初可衍生自多个不同类型的所述植物细胞。按照本发明的一些实施方案,预期任何有市场或科学价值的植物。特别可用于本发明方法的植物包括属于总科绿色植物界的所有植物,特别是包含饲料或豆科饲料、观赏植物、粮食作物、乔木或灌木的单子叶植物和双子叶植物,其选自:金合欢属物种(Acaciaspp.)、槭属物种(Acerspp.)、猕猴桃属物种(Actinidiaspp.)、七叶树属物种(Aesculusspp.)、澳洲贝壳杉(Agathisaustralis)、Albiziaamara、Alsophilatricolor、须芒草属物种(Andropogonspp.)、落花生属物种(Arachisspp)、槟榔(Arecacatechu)、Asteliafragrans、鹰嘴紫云英(Astragaluscicer)、红苏木(Baikiaeaplurijuga)、桦木属物种(Betulaspp.)、芸苔属物种(Brassicaspp.)、木榄(Bruguieragymnorrhiza)、Burkeaafricana、Buteafrondosa、Cadabafarinosa、朱樱花属物种(Calliandraspp)、茶(Camelliasinensis)、美人蕉(Cannaindica)、辣椒属物种(Capsicumspp.)、决明属物种(Cassiaspp.)、Centroemapubescens、Chacoomelesspp.、肉桂(Cinnamomumcassia)、咖啡树(Coffeaarabica)、Colophospermummopane、多变小冠花(Coronilliavaria)、沙栒子(Cotoneasterserotina)、山楂属物种(Crataegusspp.)、黄瓜属物种(Cucumisspp.)、柏木属物种(Cupressusspp.)、银蕨(Cyatheadealbata)、榅桲(Cydoniaoblonga)、日本柳杉(Cryptomeriajaponica)、香茅属物种(Cymbopogonspp.)、Cyntheadealbata、榅桲、Dalbergiamonetaria、Davalliadivaricata、山蚂蝗属物种(Desmodiumspp.)、粗糙蚌贝蕨(Dicksoniasquarosa)、Dibeteropogonamplectens、Diocleaspp、扁豆属物种(Dolichosspp.)、Dorycniumrectum、锥形稗(Echinochloapyramidalis)、Ehraffiaspp.、Eleusinecoracana、画眉草属物种(Eragrestisspp.)、刺桐属物种(Erythrinaspp.)、桉树属物种(Eucalyptusspp.)、Eucleaschimperi、Eulaliavi/losa、Pagopyrumspp.、Feijoasellowlana、草莓属物种(Fragariaspp.)、千斤拔属物种(Flemingiaspp)、Freycinetiabanksli、童氏老鹳草(Geraniumthunbergii)、银杏(GinAgobiloba)、Glycinejavanica、Gliricidiaspp、陆地棉(Gossypiumhirsutum)、银桦属物种(Grevilleaspp.)、Guibourtiacoleosperma、岩黄耆属物种(Hedysarumspp.)、牛鞭草(Hemaffhiaaltissima)、Heteropogoncontoffus、大麦(Hordeumvulgare)、红苞茅(Hyparrheniarufa)、小连翘(Hypericumerectum)、Hypeffheliadissolute、Indigoincamata、鸢尾属物种(Irisspp.)、Leptarrhenapyrolifolia、胡枝子属物种(Lespedizaspp.)、莴苣属物种(Lettucaspp.)、银合欢(Leucaenaleucocephala)、Loudetiasimplex、Lotonusbainesli、百脉根属物种(Lotusspp.)、Macrotylomaaxillare、苹果属物种(Malusspp.)、木薯(Manihotesculenta)、紫花苜蓿(Medicagosaliva)、水杉(Metasequoiaglyptostroboides)、大蕉(Musasapientum)、烟草属物种(Nicotianumspp.)、Onobrychisspp.、Ornithopusspp.、水稻属物种(Oryzaspp.)、Peltophorumafricanum、狼尾草属物种(Pennisetumspp.)、鳄梨(Perseagratissima)、牵牛花属物种(Petuniaspp.)、菜豆属物种(Phaseolusspp.)、加拿利海枣(Phoenixcanariensis)、Phormiumcookianum、石楠属物种(Photiniaspp.)、白云杉(Piceaglauca)、松属物种(Pinusspp.)、豌豆(Pisumsativam)、桃柘罗汉松(Podocarpustotara)、Pogonarthriafleckii、Pogonaffhriasquarrosa、杨属物种(Populusspp.)、Prosopiscineraria、花旗松(Pseudotsugamenziesii)、Pterolobiumstellatum、西洋梨(Pyruscommunis)、栎属物种(Quercusspp.)、Rhaphiolepsisumbellata、Rhopalostylissapida、Rhusnatalensis、Ribesgrossularia、Ribesspp.、刺槐(Robiniapseudoacacia)、蔷薇属物种(Rosaspp.)、悬钩子属物种(Rubusspp.)、柳属物种(Salixspp.)、Schyzachyriumsanguineum、金松(Sciadopitysvefficillata)、北美红杉(Sequoiasempervirens)、巨杉(Sequoiadendrongiganteum)、高粱(Sorghumbicolor)、菠菜属物种(Spinaciaspp.)、Sporobolusfmbriatus、Stiburusalopecuroides、矮柱花草(Stylosanthoshumilis)、葫芦茶属物种(Tadehagispp)、落羽杉(Taxodiumdistichum)、Themedatriandra、车轴草属物种(Trifoliumspp.)、小麦属物种(Triticumspp.)、异叶铁杉(Tsugaheterophylla)、越桔属物种(Vacciniumspp.)、蚕豆属物种(Viciaspp.)、葡萄(Vitisvinifera)、Watsoniapyramidata、马蹄莲(Zantedeschiaaethiopica)、玉米(Zeamays)、苋、洋蓟、芦笋、花椰菜、抱子甘蓝、甘蓝、低芥酸油菜(canola)、胡萝卜、花椰菜、芹菜、绿叶羽衣甘蓝(collardgreens)、亚麻、羽衣甘蓝、小扁豆、油籽油菜、黄秋葵、洋葱、马铃薯、水稻、大豆、水稻草、糖甜菜、甘蔗、向日葵、番茄、南瓜、茶、玉米、小麦、大麦、黑麦、燕麦、花生、豌豆、小扁豆和苜蓿、棉花、油菜、低芥酸油菜、胡椒、向日葵、烟草、茄子、桉树、乔木、观赏植物、多年生草本和饲料作物。或者,藻和其它非绿色植物界可用于本发明的方法。按照本发明的一些实施方案,本发明方法使用的植物是作物植物,包括但不限于棉花、芸苔属植物、油菜、芝麻、橄榄树、棕榈油、香蕉、小麦、玉米(corn或maize)、大麦、苜蓿、花生、向日葵、水稻、燕麦、甘蔗、大豆、草皮草、大麦、黑麦、高粱、甘蔗、菊苣、莴苣、番茄、西葫芦、甜椒、茄子、黄瓜、甜瓜、西瓜、菜豆、木槿、黄秋葵、苹果、玫瑰、草莓、红辣椒、大蒜、豌豆、小扁豆、低芥酸油菜、菊花、拟南芥、花椰菜、甘蓝、甜菜、昆诺阿藜、菠菜、南瓜、洋葱、韭葱、烟草、马铃薯、甜菜、番木瓜、菠萝、芒果、拟南芥(Arabidopsisthaliana)和还用于园艺、花卉栽培或林业的植物,例如但不限于杨树、冷杉、桉树、松树、观赏植物、多年生草和饲料作物、松柏类植物、藓类、藻,以及列于WorldWideWeb(dot)nationmaster(dot)com/encyclopedia/Plantae的其它植物。根据具体的实施方案,植物选自玉米、水稻、小麦、番茄、棉花和高粱。按照具体的实施方案,种子是没有经过化学/物理处理的未涂布的或新鲜的种子。在某些实施方案中,种子的洗涤实行30分钟至4小时。洗涤范围的其它实例为1分钟至10分钟、10分钟至30分钟。按照一些实施方案,种子的洗涤可以是短至5、10、20、30、45、或60秒。洗涤溶液可包括弱洗涤剂例如Tween-20。洗涤剂的浓度可为0.01-0.2%或0.2-1%。按照另一实施方案,洗涤剂浓度可以是大约0.001%、0.005%、0.01%、0.05%、0.1%、0.5%、1%或更高。种子在与dsRNA接触之前可进行引发或洗涤。本文所用的术语“引发”是指控制种子内的水合水平使得萌发所需的代谢活性可出现,但防止胚根出现。种子内不同的生理活性可以不同的水分水平存在(Leopold和Vertucci,1989;Taylor,1997)。萌发过程中最后的生理活性是胚根出现。胚根出现的开始需要高的种子含水量。通过限制种子含水量,可发生萌发所需的所有代谢步骤而无胚根出现的不可逆行为。在胚根出现之前,种子被认为是耐干燥的,因此可通过干燥降低经引发的种子的含湿量。在干燥后,经引发的种子可保存到播种的时候。商业上使用数种不同的引发方法。其中,液体或渗透引发和固体基质引发似乎具有最多追随者(Khan等人,1991)。按照本发明的一个实施方案,引发在盐、螯合剂、聚乙二醇或其组合(例如螯合剂和盐)存在下实行。或者,引发在水(例如去离子水或双重去离子水)存在下实行。根据一个具体的实施方案,引发在100%ddW存在下实行。通常使用几种类型的种子引发:渗透引发(渗透调节)—是标准引发技术。将种子在具有低水势的充分充气的溶液中孵育,然后洗涤并干燥。可通过加入渗压剂例如甘露醇、聚乙二醇(PEG)或盐如KCl实现溶液的低水势。水引发(滚筒引发)—通过将有限量的水持续或相继地加入种子中来实现。滚筒被用于这个目的,并且也可通过湿空气施加水分。“田间浸渍”是一项价廉有用的技术,通过将种子(谷类、豆类)在温水中孵育有限时间来实施。基质引发(基质调节)—是将种子孵育在含有限量的水的固体不溶性基质(蛭石、硅藻土、交联高吸水性聚合物)中。该方法提供慢的吸涨作用。预萌发种子—仅对少数物种是可行的。与正常引发形成对比,允许种子进行胚根突出。这之后是针对特定阶段分选、再诱导耐干燥性的处理以及干燥。预萌发种子的使用引起快速均匀的幼苗发育。因此,按照一个实施方案,种子是经引发的种子。值得注意的是,在与dsRNA接触前将种子用水(双蒸水,ddW)处理而不引起种子的任何引发是可能的。例如,用水处理片刻(例如30秒钟至1小时、30秒钟至0.5小时、30秒钟至10分钟、30秒钟至5分钟或45秒钟至5分钟)。按照一些实施方案,用水处理可以短至5、10、20、或30秒。可以理解,不可转录的多核苷酸触发物例如dsRNA分子可包含在水(例如自来水、蒸馏水或双蒸水)中,即没有任何上述引发有效浓度的盐、螯合剂、聚乙二醇或其组合(例如螯合剂和盐)。在某些实施方案中,在缓冲溶液例如EDTA中将不可转录的多核苷酸触发物例如dsRNA分子提供给种子。在某些实施方案中,种子是未经引发的种子。实施例1中提供了将dsRNA引入种子中的一种非限制性方法,其被视为本说明书的组成部分。在洗涤/引发和干燥步骤时的温度可相同或不同。按照一个实施方案,洗涤/引发在4-28℃下实行。按照一个实施方案,引发/洗涤溶液或含dsRNA的溶液缺乏固体载体。按照一个实施方案,引发/洗涤溶液或含dsRNA的溶液缺乏转移剂,例如表面活性剂或盐。按照本发明的另一个实施方案,对与dsRNA分子进行接触的种子进行洗涤,以除去种子曾接触过的作用剂,例如杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂。因此,按照一个实施方案,种子(在用dsRNA处理前)基本上不含(即不含有效量的)杀虫剂、杀真菌剂、杀昆虫剂、肥料、涂布剂和着色剂。然后对种子进行干燥。在某些实施方案中,干燥是任选的。按照一个实施方案,干燥在20-37℃、20-30℃、22-37℃、15-22℃或20-25℃下实行10-20小时、10-16小时或甚至2-5小时。当计算接触溶液中dsRNA的浓度时,要考虑各种因素。这些取决于以下至少一种:种子大小、种子重量、种子体积、种子表面积、种子密度和种子透性。例如,就种子大小、重量、体积和表面积而言,估计玉米种子比拟南芥和番茄种子需要较长处理。至于透性和密度,估计小麦种子比番茄种子需要在较高浓度下的较长处理。处理溶液中dsRNA的浓度的实例包括但不限于0.01-0.3µg/µl、0.01-0.15µg/µl、0.04-0.15µg/µl、0.1-100µg/µl;0.1-50µg/µl、0.1-10µg/µl、0.1-5µg/µl、0.1-1µg/µl、0.1-0.5µg/µl、0.15-0.5µg/µl、0.1-0.3µg/µl、0.01-0.1µg/µl、0.01-0.05µg/µl、0.02-0.04µg/µl、0.001-0.02µg/µl。按照具体的实施方案,处理溶液中dsRNA的浓度为0.01-0.15或0.04-0.15µg/µl。在一个实施方案中,处理溶液中dsRNA的浓度为0.01-0.3µg/ml、0.01-0.15µg/ml、0.04-0.15µg/ml、0.1-100µg/ml;0.1-50µg/ml、0.1-10µg/ml、0.1-5µg/ml、0.1-1µg/ml、0.1-0.5µg/ml、0.15-0.5µg/ml、0.1-0.3µg/ml、0.01-0.1µg/ml、0.01-0.05µg/ml、0.02-0.04µg/ml、或0.001-0.02µg/ml。在另一个实施方案中,处理溶液中dsRNA的浓度为大约5-10µg/ml、10-15µg/ml、15-20µg/ml、20-25µg/ml;25-30µg/ml、30-35µg/ml、35-40µg/ml、40-45µg/ml、45-50µg/ml、50-55µg/ml、55-60µg/ml、60-65µg/ml、65-70µg/ml、70-75µg/ml、75-80µg/ml、80-85µg/ml、85-90µg/ml、90-95µg/ml、95-100µg/ml、100-105µg/ml、105-110µg/ml、110-115µg/ml、115-120µg/ml、120-125µg/ml;125-130µg/ml、130-135µg/ml、135-140µg/ml、140-145µg/ml、145-150µg/ml、150-155µg/ml、155-160µg/ml、160-165µg/ml、165-170µg/ml、170-175µg/ml、175-180µg/ml、180-185µg/ml、185-190µg/ml、190-195µg/ml、195-200µg/ml、200-210µg/ml、210-220µg/ml、220-230µg/ml、230-240µg/ml、240-250µg/ml、250-260µg/ml、260-270µg/ml、270-280µg/ml、280-290µg/ml、290-300µg/ml、300-310µg/ml、310-320µg/ml、320-330µg/ml、330-340µg/ml、340-350µg/ml、350-360µg/ml、360-370µg/ml、370-380µg/ml、380-390µg/ml、390-400µg/ml、400-410µg/ml、410-420µg/ml、420-430µg/ml、430-440µg/ml、440-450µg/ml、450-460µg/ml、460-470µg/ml、470-480µg/ml、480-490µg/ml、或大约490-500µg/ml。在另一个实施方案中,处理溶液中dsRNA的浓度为0.0001-3µg/µl、0.0001-2.5µg/µl、0.0001-2µg/µl、0.0001-1.5µg/µl、0.0001-1µg/µl、0.0001-0.9µg/µl、0.0001-0.8µg/µl、0.0001-0.7µg/µl、0.0001-0.6µg/µl、0.0001-0.5µg/µl、0.0001-0.4µg/µl、0.0001-0.3µg/µl、0.0001-0.2µg/µl、0.0001-0.1µg/µl、0.0001-0.05µg/µl、0.0001-0.02µg/µl、0.0001-0.01µg/µl、0.0001-0.005µg/µl、0.0001-0.001µg/µl、或0.0001-0.0005µg/µl。在另一个实施方案中,处理溶液中dsRNA的浓度为0.0001-3µg/µl、0.0005-3µg/µl、0.001-3µg/µl、0.005-3µg/µl、0.01-3µg/µl、0.05-3µg/µl、0.1-3µg/µl、0.2-3µg/µl、0.3-3µg/µl、0.4-3µg/µl、0.5-3µg/µl、0.6-3µg/µl、0.7-3µg/µl、0.8-3µg/µl、0.9-3µg/µl、1-3µg/µl、或2-3µg/µl。在另一个实施方案中,处理溶液中dsRNA的浓度为0.0001-3µg/µl、0.0005-2.5µg/µl、0.001-2µg/µl、0.005-1.5µg/µl、0.01-1µg/µl、0.05-0.5µg/µl、0.1-0.4µg/µl、或0.2-0.3µg/µl。按照具体的实施方案,与dsRNA的接触在螯合剂例如EDTA或另一种螯合剂例如DTPA(0.01-0.1mM)存在下实行。在某些实施方案中,处理溶液可包含转移剂例如表面活性剂或盐。这类转移剂的实例包括但不限于盐例如脂肪酸的钠盐或锂盐(例如动物脂或牛油脂肪胺或磷脂lipofectamine或lipofectin(1-20nM或0.1-1nM))以及有机硅表面活性剂。其它有用的表面活性剂包括有机硅表面活性剂,包括非离子型有机硅表面活性剂,例如乙氧基化三硅氧烷表面活性剂或硅氧烷聚醚共聚物例如聚环氧烷改性七甲基三硅氧烷和烯丙氧基聚丙二醇甲基醚的共聚物(以SilwetTML-77表面活性剂市售可获得,CAS编号27306-78-1和EPA编号:CAL.REG.NO.5905-50073-AA,现可获自MomentivePerformanceMaterials,Albany,N.Y.)。在某些实施方案中,处理溶液可包含物理作用剂。物理作用剂的实例包括:(a)研磨剂,例如金刚砂、刚玉、沙、方解石、浮石、石榴石等,(b)纳米粒,例如碳纳米管,和(c)物理力。碳纳米管公开于Kam等人(2004)J.Am.Chem.Soc.,126(22):6850-6851;Liu等如(2009)NanoLett.,9(3):1007-1010;及Khodakovskaya等人(2009)ACSNano,3(10):3221-3227。物理力作用剂可包括加热、冷却、施加正压或超声处理。用于植物被多核苷酸渗透入的实验室调节的作用剂包括例如施加化学试剂、酶处理、加热或冷却、用正压或负压处理或超声处理。在田间用于调节植物的作用剂包括化学试剂,例如表面活性剂和盐。种子与dsRNA的接触可采用本领域已知的任何方法实行,只要有效量的dsRNA进入种子。这些实例包括但不限于浸湿、喷撒或用粉末、乳液、混悬液或溶液涂布;同样,通过任何合适的方法将多核苷酸分子施于植物,例如喷撒或擦拭溶液、乳液或混悬液。本文所用的“有效量”是指足以下调靶基因达至少20%、30%、40%、50%或更高、比如说60%、70%、80%、90%或更高甚至100%的dsRNA的量。有效量可以是在植物或植物病原体中扩增形成的结果。按照具体的实施方案,接触可通过浸湿(即接种)实行,使得种子用处理溶液振荡可提高穿透和浸透,因此缩短处理时间。振荡通常在50-150RPM下实行,并取决于处理溶液的体积。振荡可实行4-24小时(1-4小时、10分钟至1小时或30秒钟至10分钟)。本文的教导还设想短的孵育时间例如至多10分钟。实例包括但不限于30秒钟至7分钟、30秒钟至5分钟、30秒钟至3分钟、30秒钟至2分钟、30秒钟至1分钟,1分钟至10分钟或1分钟至5分钟。在一个实施方案中,孵育时间可以是介于1和60秒之间,介于2和60秒之间,介于5和60秒之间,介于10和60秒之间,介于20和60秒之间,介于30和60秒之间,介于40和60秒之间,介于50和60秒之间,介于1和50秒之间,介于1和40秒之间,介于1和30秒之间,介于1和20秒之间,介于1和10秒之间,介于1和5秒之间,介于5和50秒之间,介于10和40秒之间,和介于20和30秒之间。在另一个实施方案中,孵育时间可以是介于1和60分钟之间,介于2和60分钟之间,介于5和60分钟之间,介于10和60分钟之间,介于20和60分钟之间,介于30和60分钟之间,介于40和60分钟之间,介于50和60分钟之间,介于1和50分钟之间,介于1和40分钟之间,介于1和30分钟之间,介于1和20分钟之间,介于1和10分钟之间,介于1和5分钟之间,介于5和50分钟之间,介于10和40分钟之间,和介于20和30分钟之间。在本发明的实施方案的范围下也考虑了浸渍。因此,将种子在dsRNA溶液浸渍若干秒,例如1-10秒、1-5秒、1-3秒或1-2秒。在此期间,dsRNA可以吸附在种子表面。吸附的dsRNA包裹着种子,在萌发期间可以穿透种子或幼苗。孵育在4-28℃或15-22℃(例如8-15℃、4-8℃、22-28℃)下在暗处发生。在一个实施方案中,浸渍时间可以是介于1和60分钟之间,介于2和60分钟之间,介于5和60分钟之间,介于10和60分钟之间,介于20和60分钟之间,介于30和60分钟之间,介于40和60分钟之间,介于50和60分钟之间,介于1和50分钟之间,介于1和40分钟之间,介于1和30分钟之间,介于1和20分钟之间,介于1和10分钟之间,介于1和5分钟之间,介于5和50分钟之间,介于10和40分钟之间,和介于20和30分钟之间。在一个实施方案中,浸渍时间可以是介于1和60秒之间,介于2和60秒之间,介于5和60秒之间,介于10和60秒之间,介于20和60秒之间,介于30和60秒之间,介于40和60秒之间,介于50和60秒之间,介于1和50秒之间,介于1和40秒之间,介于1和30秒之间,介于1和20秒之间,介于1和10秒之间,介于1和5秒之间,介于5和50秒之间,介于10和40秒之间,和介于20和30秒之间。按照具体的实施方案,接触发生在种子休眠中断和胚出现之前。在接触之后,优选在种子休眠中断和胚出现之前,可用上述作用剂(例如杀虫剂、杀真菌剂等)对种子进行处理(例如涂布)。实行接触,使得dsRNA进入胚、胚乳、种皮(coat)或这三者的组合中。在与处理溶液接触之后,可在25-37℃下对种子进行干燥达30小时。例如,在30℃下将种子干燥16小时。根据具体的实施方案,种子(例如分离的种子)包含外源裸dsRNA,且其中至少10或20个分子的dsRNA进入分离种子的胚乳中。本文所用的术语“分离的”是指从天然生理环境中分离。在种子的情况下,分离的种子从植物的其它部分分离。在核酸分子(例如dsRNA)的情况下从胞质分离。按照具体的实施方案,dsRNA不是从植物基因组中表达,因此不是基因组的组成部分。按照具体的实施方案,提供包含在种子的胚和胚乳中以类似浓度(例如约1:1、2:1或1:2)存在的外源dsRNA的分离的种子。提出了与当dsRNA从核酸表达构建体表达时所观察到的相比,将裸dsRNA直接引入种子中导致胚乳中较高浓度的dsRNA。按照具体的实施方案,提供包含空间上分布在植物种子的胚和胚乳中的外源dsRNA的分离的种子,其空间分布不同于衍生自重组表达外源dsRNA的转基因植物的种子中的所述外源dsRNA的空间分布。测量RNA分子在种子中的定位的方法是本领域众所周知的。实施例部分中所述siGlo的使用就是这种方法的一个实例。按照备选的或额外的实施方案,提供包含外源dsRNA的分离的种子,其中与重组表达所述外源dsRNA的转基因种子相比,所述外源dsRNA与由其成熟的siRNA的浓度比例在种子中较高。本文所用的术语“较高”是指高至少约3%、5%、7%、10%、15%、20%、25%、30%、50%、60%、70%、80%、90%或甚至几倍。按照备选的或额外的实施方案,提供包含外源dsRNA的分离的种子,其中植物种子缺乏用于驱动所述外源dsRNA表达的异源启动子,其中与重组表达所述外源dsRNA的转基因种子相比,所述外源dsRNA和/或由其成熟的siRNA在种子中的空间分布改变。术语“重组表达”是指自核酸构建体表达。按照另一个实施方案,提供通过本文所述的任何方法可获得(或获得)的植物种子。确定成功引入dsRNA的方法包括但不限于RT-PCR(例如定量测定靶基因或裸dsRNA的水平)、表型分析例如生物量、生长势、产量和胁迫耐受性、根结构、叶尺寸、籽粒大小和重量、含油量、纤维素以及细胞生物学技术。按照一些实施方案,观察到通过本文所述的种子处理所靶向的害虫基因的植物直向同源物的表达水平的改变。参见例如接下来的实施例部分的实施例45和46。在栽种之前,可将种子贮存1天至若干个月(例如,在4-10℃)。得到的种子可以在暗处萌发以产生植物。因此提供包含外源裸dsRNA并缺乏驱动dsRNA在植物中表达的异源启动子的植物或植物部分。本文所用的“缺乏驱动dsRNA表达的异源启动子”意指植物或植物细胞不包括在植物中转录dsRNA的顺式作用调节序列(例如异源序列)。本文所用的术语“异源的”是指外源的、非天然存在于天然植物细胞内的(例如通过整合的位置或是非天然存在于植物细胞内的)。因此分离种子在驱动dsRNA在植物中表达的异源启动子序列不存在时,包含植物不可转录的dsRNA的同基因(在扩增前)或异基因(次级siRNA,在扩增后)群。本发明方法可用于例如在植物中调节基因表达,所述方法包括:(a)在允许dsRNA穿透种子的条件下使植物的种子与裸dsRNA接触,从而将dsRNA引入种子中;和任选(b)产生种子的植物。当用于下调植物基因时,应用本领域众所周知的生物信息工具(例如BLAST),设计所需特异性的裸dsRNA。该方法可用于自基本研究(例如为了评价基因功能)开始直到产生具有有价值的商业用途的性状改变的植物为止的各种应用。这样的植物可显示农业有益性状,包括形态学改变、开花改变、胁迫耐受性(即生物胁迫和/或非生物胁迫)改变、生物量生长势和/或产量的改变等。本文所用的短语“非生物胁迫”是指对植物的代谢、生长、生存力和/或生殖的任何不良作用。非生物胁迫可通过以下任何亚最适环境生长条件诱导:例如缺水或干旱、洪涝、冰冻、低温或高温、大风、重金属毒性、缺氧生活、高或低养分水平(例如养分缺乏)、高或低盐水平(例如盐分)、大气污染、高或低光强度(例如光线不足)或UV照射。非生物胁迫可以是短期作用(例如急性作用,例如持续约一周),或者可以是持续的(例如慢性作用,例如持续例如10天以上)。本发明考虑其中存在单一非生物胁迫条件的情况,或者出现两种或更多种非生物胁迫的情况。按照一个实施方案,非生物胁迫是指盐分。按照另一实施方案,非生物胁迫是指干旱。按照另一实施方案,非生物胁迫是指温度胁迫。本文所用短语“非生物胁迫耐受性”是指植物耐受非生物胁迫而不显示可观的生理或物理损害(例如植物代谢、生长、生存力和/或繁殖力的改变)的能力。本文所用短语“氮利用效率(NUE)”是指每单位氮肥输入的作物产量的度量。肥料使用效率(FUE)是NUE的度量。作物产量可通过生物量、生长势或产量测量。植物的氮利用效率通常是被植物吸收的氮的摄取、扩散、吸收、蓄积、再分配(在植物内)和利用的至少一种改变的结果。改进的NUE是就相同物种和相同发育阶段并生长在相同条件下的非转基因植物(即缺乏转基因植物的转基因)而言。本文所用短语“氮限制条件”是指包括所施加的低于最适植物代谢、生长、繁殖和/或生存力所需水平的氮(例如铵或硝酸盐)的水平(例如浓度)的生长条件。本文所用的术语/短语“生物量”、“植物的生物量”或“植物生物量”是指从生长季节中的植物产生组织的量(例如以风干组织的克数测量)。植物生物量的增加可以是整株植物或其部分例如地上(例如可收获)部分、营养生物量、根和/或种子或其内容物(例如油、淀粉等)的增加。本文所用的术语/短语“生长势”、“植物的生长势”或“植物生长势”是指在规定时间内由植物产生的组织的量(例如通过重量测量)。生长势提高可决定或影响植物产量或每生长时间或生长面积的产量。另外,早期生长势(例如种子和/或幼苗)导致场林分(fieldstand)改进。本文所用的术语/短语“产量”、“植物的产量”或“植物产量”是指每株植物或每个生长季节所产生的组织或器官量(例如通过重量或大小测量)或数量(例如数目)。植物产量增加可能影响在某一生长面积和/或生长时间内可从植物中获得的经济利益。按照一个实施方案,产量通过纤维素含量、含油量、淀粉含量等测量。按照另一实施方案,产量通过含油量测量。按照另一实施方案,产量通过蛋白质含量测量。按照另一实施方案,产量通过每株植物或其部分(例如种仁、豆)的种子数、种子重量、果实数或果实重量测量。植物产量可受不同参数的影响,包括但不限于植物生物量;植物生长势;植物生长速率;种子产量;种子或籽粒数量;种子或籽粒品质;油产量;收获器官(例如植物的种子或营养部分)的油、淀粉和/或蛋白质含量;每个圆锥花序的花(例如小花)的数目(例如表示为饱满种子的数目相对于主要圆锥花序的数目的比率);收获指数;每面积生长的植物的数目;每株植物和每面积收获器官的数目和大小;每生长面积的植物数目(例如密度);田间收获器官的数目;总的叶面积;碳同化和碳分配(例如植物内碳的分布/配置);耐荫性;每个豆荚的可收获器官(例如种子)、种子的数目、每个种子的重量;和改进的体系结构[例如增加茎直径、厚度或改进物理性质(例如弹性)]。改进的植物NUE在田间被解释成在施用较少肥料的同时收获类似数量的产量,或施用相同水平的肥料获得增加的产量。因此,改进的NUE或FUE对田间的植物产量有直接作用。本文所用的“生物胁迫”是指作为由其它活的生物体对植物造成损害的结果而发生的胁迫,所述其它活的生物体例如细菌、病毒、真菌、寄生虫、有益和有害昆虫、杂草、以及栽培或天然植物。下面的实施例部分的实施例7和20-38,描述了针对赋予针对棉贪夜蛾的抗性实行本发明的教导。下面的实施例部分的实施例38和39,描述了针对赋予针对鞘翅目(Coleopteran)害虫的抗性实行本发明的教导。下面的实施例部分的实施例40-52,描述了针对赋予针对病毒感染的抗性实行本发明的教导。本文所用术语“改进”或“提高”是指与天然或野生型植物[即本发明的实施方案的同基因植物(不是自用dsRNA处理的种子长出)]相比,植物的NUE、胁迫耐受性、产量、生物量或生长势提高至少约2%、至少约3%、至少约4%、至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或更高。在某些实施方案中,dsRNA的靶基因可以不是内源植物基因而是植物的外源基因,例如以植物为食或依赖于植物而生长/复制(例如,细菌或病毒)和/或存活的植物病原性生物的基因。在某些实施方案中,靶基因是害虫的必需基因。在某些实施方案中,靶基因是病毒基因。本文使用的术语“植物病原体”是指得益于与植物的相互作用并对该植物具有负面影响的生物体。术语“植物病原体”包括昆虫、蛛形类、甲壳类、真菌、细菌、病毒、线虫、扁虫、蛔虫、蛲虫、钩虫、绦虫、锥虫、裂体吸虫、马蝇、蚤、蜱、螨和虱等,其可摄食或接触植物产生的一个或多个细胞、组织或液体。本文所述的方法可用于产生对一种或多种植物病原体具有抗性的植物。在某些实施方案中,所述植物病原体是害虫。当昆虫是本发明的目标害虫时,这样的害虫包括但不限于:来自鳞翅目(Lepidoptera),例如长翅卷蛾属物种(Aclerisspp.)、褐带卷蛾属物种(Adoxophyesspp.)、透翅蛾属物种(Aegeriaspp.)、地夜蛾属物种(Agrotisspp.)、棉叶波纹夜蛾(Alabamaargillaceae)、Amyloisspp.、大豆夜蛾(Anticarsiagemmatalis)、黄卷蛾属物种(Archipsspp)、带卷蛾属物种(Argyrotaeniaspp.)、丫纹夜蛾属物种(Autographaspp.)、玉米干夜蛾(Busseolafusca)、干果斑螟(Cadracautella)、桃蛀果蛾(Carposinanipponensis)、禾草螟属物种(Chilospp.)、色卷蛾属物种(Choristoneuraspp.)、葡萄果蠹蛾(Clysiaambiguella)、纵卷叶野螟属物种(Cnaphalocrocisspp.)、云卷蛾属物种(Cnephasiaspp.)、细卷蛾属物种(Cochylisspp.)、鞘蛾属物种(Coleophoraspp.)、泛非绒毛螟(Crocidolomiabinotalis)、桃异形小卷蛾(Cryptophlebialeucotreta)、小卷蛾属物种(Cydiaspp.)、杆草螟属物种(Diatraeaspp.)、苏丹棉铃虫(Diparopsiscastanea)、钻夜蛾属物种(Eariasspp.)、粉斑螟属物种(Ephestiaspp.)、花小卷蛾属物种(Eucosmaspp.)、女贞细卷蛾(Eupoeciliaambiguella)、黄毒蛾属物种(Euproctisspp.)、切夜蛾属物种(Euxoaspp.)、小食心虫属物种(Grapholitaspp.)、云雾广翅小卷蛾(Hedyanubiferana)、实夜蛾属物种(Heliothisspp.)、菜心野螟(Hellulaundalis)、美国白蛾(Hyphantiriacunea)、番茄茎麦蛾(Keiferialycopersicella)、旋纹潜蛾(Leucopterascitella)、潜叶细蛾属物种(Lithocollethisspp.)、鲜食葡萄小卷蛾(Lobesiabotrana)、毒蛾属物种(Lymantriaspp.)、潜蛾属物种(Lyonetiaspp.)、天幕毛虫属物种(Malacosomaspp.)、甘蓝夜蛾(Mamestrabrassicae)、烟草天蛾(Manducasexta)、秋尺蛾属物种(Operophteraspp.)、欧洲玉米螟(OstriniaNubilalis)、超小卷蛾属物种(Pammenespp.)、褐卷蛾属物种(Pandemisspp.)、小眼夜蛾(Panolisflammea)、红铃麦蛾(Pectinophoragossypiella)、马铃薯麦蛾(Phthorimaeaoperculella)、菜粉蝶(Pierisrapae)、粉蝶属物种(Pierisspp.)、小菜蛾(Plutellaxylostella)、Praysspp.、白禾螟(Scirpophagaspp.)、蛀茎夜蛾属物种(Sesamiaspp.)、长须卷蛾属物种(Sparganothisspp.)、贪夜蛾属物种(Spodopteraspp.)、透翅蛾属物种(Synanthedonspp.)、带蛾属物种(Thaumetopoeaspp.)、卷蛾属物种(Tortrixspp.)、粉斑夜蛾(Trichoplusiani)和巢蛾属物种(Yponomeutaspp.);来自鞘翅目(Coleoptera),例如叩甲属物种(Agriotesspp.)、花象属物种(Anthonomusspp.)、甜菜隐食甲(Atomarialinearis)、蚤凹胫跳甲(Chaetocnematibialis)、根颈象属物种(Cosmopolitesspp.)、象虫属物种(Curculiospp.)、Denrmestesspp.、叶甲属物种(Diabroticaspp.)、食植瓢虫属物种(Epilachnaspp.)、Eremnusspp.、马铃薯甲虫(Leptinotarsadecemlineata)、稻水象属物种(Lissorhoptrusspp.)、鳃金龟属物种(Melolonthaspp.)、锯谷盗属物种(Orycaephilusspp.)、耳象属物种(Otiorhynchusspp.)、斑象属物种(Phlyctinusspp.)、云粉蝶属物种(Popilliaspp.)、蚤跳甲属物种(Psylliodesspp.)、谷蠹属物种(Rhizoperthaspp.)、带叶蝉(Scarabeidae)、米象属物种(Sitophilusspp.)、麦蛾属物种(Sitotrogaspp.)、粉甲属物种(Tenebriospp.)、拟谷盗属物种(Triboliumspp.)和斑皮蠹属物种(Trogodermaspp.);来自直翅目(Orthoptera),例如蜚蠊属物种(Blattaspp.)、小蠊属物种(Blattellaspp.)、蝼蛄属物种(Gryllotalpaspp.)、马德拉蜚蠊(Leucophaeamaderae)、飞蝗属物种(Locustaspp.)、大蠊属物种(Periplanetassp.)和沙漠蝗属物种(Schistocercaspp.);来自等翅目(Isoptera),例如Reticulitemesssp;来自啮虫目(Psocoptera),例如粉啮虫属物种(Liposcelisspp.);来自虱目(Anoplura),例如血虱属物种(Haematopinusspp.)、长颚虱属物种(Linognathusspp.)、人虱属物种(Pediculusspp.)、瘿绵蚜属物种(Pemphigusspp.)和倭蚜属物种(Phylloxeraspp.);来自食毛目(Mallophaga),例如畜虱属物种(Damalineaspp.)和嚼虱属物种(Trichodectesspp).;来自缨翅目(Thysanoptera),例如花蓟马属物种(Franklinellaspp.)、篱蓟马属物种(Hercinothripsspp.)、带蓟马属物种(Taeniothripsspp.)、棕榈蓟马(Thripspalmi)、烟蓟马(Thripstabaci)和橘硬蓟马(Scirtothripsaurantii);来自半翅目(Heteroptera),例如臭虫属物种(Cimexspp.)、可可狄盲蝽(Distantiellatheobroma)、棉红蝽属物种(Dysdercusspp.)、Euchistusspp.、扁盾蝽属物种(Eurygasterspp.)、稻缘蝽属物种(Leptocorisaspp.)、绿蝽属物种(Nezaraspp.)、皮蝽属物种(Piesmaspp.)、红猎蝽属物种(Rhodniusspp.)、可可褐盲蝽(Sahlbergellasingularis)、黑蝽属物种(Scotinopharaspp.)、椎猎蝽属物种(Triatomaspp.)、盲蝽科属物种(Miridaefamilyspp.)例如豆荚草盲蝽(Lygushesperus)和美国牧草盲蝽(Lyguslineoloris)、长蝽科属物种(Lygaeidaefamilyspp.)例如美洲毛谷杆长蝽(Blissusleucopterus)和蝽科属物种(Pentatomidaefamilyspp.);来自同翅目(Homoptera),例如软毛粉虱(Aleurothrixusfloccosus)、芸薹粉虱(Aleyrodesbrassicae)、肾圆盾蚧属物种(Aonidiellaspp.)、蚜科(Aphididae)、蚜属物种(Aphisspp.)、圆盾蚧属物种(Aspidiotusspp.)、甘薯粉虱(Bemisiatabaci)、蜡蚧属物种(Ceroplasterspp.)、黑褐圆盾蚧(Chrysomphalusaonidium)、橙褐圆盾蚧(Chrysomphalusdictyospermi)、广食褐软蚧(Coccushesperidum)、绿小叶蝉属物种(Empoascaspp.)、苹果棉蚜(Eriosomalarigerum)、斑叶蝉属物种(Erythroneuraspp.)、Gascardiaspp.、灰飞虱属物种(Laodelphaxspp.)、Lacaniumcorni、蛎盾蚧属物种(Lepidosaphesspp.)、Macrosiphusspp.、瘤蚜属物种(Myzusspp.)、Nehotettixspp.、褐飞虱属物种(Nilaparvataspp.)、Paratoriaspp.、瘿绵蚜属物种(Pemphigusspp.)、臀纹粉蚧属物种(Planococcusspp.)、白盾蚧属物种(Pseudaulacaspisspp.)、粉蚧属物种(Pseudococcusspp.)、木虱属物种(Psyllassp.)、Pulvinariaaethiopica、笠圆盾蚧属物种(Quadraspidiotusspp.)、缢管蚜属物种(Rhopalosiphumspp.)、黑盔蚧属物种(Saissetiaspp.)、带叶蝉属物种(Scaphoideusspp.)、二叉蚜属物种(Schizaphisspp.)、谷网蚜属物种(Sitobionspp.)、温室粉虱(Trialeurodesvaporariorum)、柑个木虱(Triozaerytreae)和柑橘尖盾蚧(Unaspiscitri);来自膜翅目(Hymenoptera),例如Acromyrmex、切叶蚁属物种(Attaspp.)、茎蜂属物种(Cephusspp.)、松叶蜂属物种(Diprionspp.)、松叶蜂科(Diprionidae)、云杉吉松叶蜂(Gilpiniapolytoma)、实叶蜂属物种(Hoplocampaspp.)、毛蚁属物种(Lasiusspp.)、Monoimoriumpharaonis、新松叶蜂属物种(Neodiprionspp)、Solenopisspp.和胡蜂属物种(Vespassp.);来自双翅目(Diptera),例如伊蚊属物种(Aedesspp.)、Antherigonasoccata、花园毛蚊(Bibiohortulanus)、Calliphoraerythrocephala、小条实蝇属物种(Ceratitisspp.)、金蝇属物种(Chrysomyiaspp.)、库蚊属物种(Culexspp.)、黄蝇属物种(Cuterebraspp.)、寡鬃实蝇属物种(Dacusspp.)、黑腹果蝇(Drosophilamelanogaster)、厕蝇属物种(Fanniaspp.)、Gastrophilusspp.、舌蝇属物种(Glossinaspp.)、皮蝇属物种(Hypodermaspp.)、Hyppoboscaspp.、(Liriomysaspp.)、绿蝇属物种(Luciliaspp.)、黑潜蝇属物种(Melanagromyzaspp.)、家蝇属物种(Muscassp.)、狂蝇属物种(Oestrusspp.)、瘿蚊属物种(Orseoliaspp.)、瑞典麦秆蝇(Oscinellafrit)、菠菜泉蝇(Pegomyiahyoscyami)、草种蝇属物种(Phorbiaspp.)、苹绕实蝇(Rhagoletispomonella)、尖眼蕈蚊属物种(Sciaraspp.)、螫蝇属物种(Stomoxysspp.)、虻属物种(Tabanusspp.)、Tanniaspp.和大蚊属物种(Tipulaspp.);来自蚤目(Siphonaptera),例如角叶蚤属物种(Ceratophyllusspp.)和印鼠客蚤(Xenopsyllacheopis)和来自缨尾目(Thysanura),例如台湾衣鱼(Lepismasaccharina)。因此,按照一个实施方案,提供抑制植物病原性生物的靶基因的表达的方法,所述方法包括向植物病原性生物提供(例如,饲喂或在感染条件下接触)本文所述的植物(至少其包括裸dsRNA的部分),从而抑制植物病原性生物的靶基因的表达。在某些实施方案中,靶基因是“必需基因”。本文使用的术语“必需基因”是指生物体生存或繁殖所必需的基因。在某些实施方案中,靶基因在昆虫肠道中表达,例如V-ATP酶。在某些实施方案中,靶基因参与昆虫的生长、发育和繁殖。这样的基因的实例包括但不限于CHD3基因和β-微管蛋白基因。植物病原性生物是指多细胞生物,例如昆虫、真菌、动物或微生物,其可引起植物疾病,包括病毒、细菌、真菌以及卵菌、壶菌、藻类和线虫。本文提及的“线虫”是指线虫动物门(Nematoda)成员。异皮线虫科(Heteroderidae)成员是定栖的寄生虫,其与靶宿主生物形成复杂的永久性缔合。它们通过专门的口器从被感染生物体的细胞中夺取营养。胞囊线虫(异皮线虫属(Heterodera)和球异皮线虫属(Globodera))和根结线虫属(Meliodogyne)尤其导致植物、特别是作物植物的显著经济损失。胞囊线虫的实例包括燕麦异皮线虫(H.avenae)(谷物胞囊线虫)、大豆异皮线虫(H.glycines)(甜菜胞囊线虫)和马铃薯球异皮线虫(G.pallida)(马铃薯胞囊线虫)等等。根结线虫包括例如爪哇根结线虫(M.javanica)、南方根结线虫(M.incognita)和花生根结线虫(M.arenaria)。这些病原体在植物中通过导致根细胞的形态转化成巨细胞而建立“摄食部位”。因此,线虫“侵染”或“感染”是指侵入和摄食宿主植物的组织。引起显著损害的其它线虫包括损伤线虫例如短体线虫属(Pratylenchus),尤其是穿刺短体线虫(P.penetrans),其感染玉米、水稻和蔬菜;最短尾短体线虫(P.brachyurus),其感染菠萝;和索氏短体线虫(P.thornei),其感染小麦等。若干实施方案涉及抑制害虫的靶基因表达的方法,所述方法包括向害虫提供(例如饲喂)自用如本文所述的外源dsRNA处理的种子长出的植物,从而抑制害虫的靶基因表达。可导致植物损害和疾病的昆虫按其摄食方式属于三类:咀嚼、吮吸和钻孔。主要损害是由咀嚼昆虫导致,其吃掉植物组织,例如叶、花、芽和小枝。来自这一大类昆虫分类的实例包括甲虫及其幼虫(蛆)、结网毛虫、结草虫以及蛾子和叶峰的幼虫(毛虫)。相比之下,吮吸昆虫将其口器插入叶、小枝、分枝、花或果实的组织中并吸出植物汁液。吮吸昆虫的典型实例包括但不限于蚜虫、粉蚧、蓟马和叶蝉。这些害虫导致的损害通常表现为受感染植物的变色、下垂、萎蔫和生长势普遍缺乏。若干实施方案涉及提供对害虫的抗性的方法,所述方法包括自用如本文所述的外源dsRNA处理的种子长出植物。在某些实施方案中,所述害虫选自鞘翅目、鳞翅目、双翅目、直翅目、半翅目、栉头蚤(Ctenophalides)、Arachnidiae和膜翅目。在某些实施方案中,所述害虫是甲虫或幼虫。按照具体的实施方案,所述植物病原体是夜蛾科(Noctuidae)的prodentia,例如,棉贪夜蛾。重要的细菌性植物病原体的实例包括但不限于伯克霍尔德菌(Burkholderia)、变形菌门(Proteobacteria)(黄单胞菌属物种(Xanthomonasspp.)和假单胞菌属属物种(Pseudomonasspp.)、丁香假单胞菌番茄致病变种(Pseudomonassyringaepv.tomato)。许多病毒属是通过土壤携带的游动孢子原生动物而持续和非持续传播。这些原生动物本身并非是植物病原性的,而是寄生性的。当病毒与植物根缔合时便发生病毒的传播。实例包括:禾谷多粘菌(Polymyxagraminis),已显示该菌在谷类作物中传播植物病毒疾病;和甜菜多粘菌(Polymyxabetae),其传播甜菜坏死黄脉病毒。原生质动物(Plasmodiophorid)还在植物根中造成其它病毒可通过其进入的创伤。按照本发明的教导可以靶向的病毒的具体实例包括但不限于:(1)感染植物、尤其烟草和茄科(Solanaceae)的其它成员的烟草花叶病毒(TMV,RNA病毒)。(2)引起代表35个植物科的许多经济上重要的植物(包括双子叶植物和单子叶植物)的严重病害的番茄斑萎病毒(TSWV,RNA病毒)。观赏植物、蔬菜和大田作物的这种广泛的宿主范围是在植物感染性病毒中独有的。属于地中海地区的番茄斑萎病毒影响蔬菜作物,尤其是番茄、胡椒和莴苣(Turina等人,2012,AdvVirusRes84;403-437)。(3)由粉虱传播的番茄黄曲叶病毒(TYLCV)主要影响番茄植物。菜豆金色花叶病毒属(Begomovirus)(包括sweepoviruses和legumoviruses)中的双粒病毒组(DNA病毒)—影响多种栽植作物(包括木薯、甘薯、菜豆、番茄、棉花和籽用豆类)的最具破坏性的病原体(Rey等人,2012,Viruses4;1753-1791)。成员包括上述TYLCV和番茄曲叶病毒(ToLCV)。(4)黄瓜花叶病毒(CMV)—CMV具有广泛的宿主,并侵染种类繁多的蔬菜、观赏植物和其它植物(多至40个科中的191个宿主种)。由黄瓜花叶病毒影响的最重要的蔬菜中有辣椒(CapsicumannuumL.)、葫芦、番茄(LycopersiconesculentumMill.)和香蕉(MusaL.spp.)。其它蔬菜宿主包括:黄瓜、香瓜、南瓜、番茄、菠菜、芹菜、胡椒、水田芥、甜菜、甘薯、芜菁、佛手瓜、小黄瓜、西瓜、南瓜、枸橼、葫芦、利马豆、蚕豆、洋葱、灌木樱、茄子、马铃薯、大黄、胡萝卜、莳萝、茴香、欧洲防风、香芹菜、丝瓜和洋蓟(Chabbouh和Cherif,1990,FAOPlantProt.Bull.38:52-53)。观赏植物宿主包括:翠菊、菊花、翠雀花、鼠尾草、天竺葵、吉莉草、唐菖蒲、天芥菜、风信子、飞燕草、百合、金盏花、牵牛花、旱金莲、长春花、矮牵牛、天蓝绣球、金鱼草、郁金香和百日草(Chupp和Sherf,1960;Agrios,1978)。(5)马铃薯病毒Y(PVY)—影响马铃薯产量的最重要的植物病毒之一。(6)花椰菜花叶病毒(CaMV,DNA病毒(Rothnie等人,1994))。(7)非洲木薯花叶病毒(ACMV)。(8)李痘病毒(PPV)是来自李属(Prunus)的核果的最具破坏性的病毒病。(9)雀麦花叶病毒(BMV)—通常感染无芒雀麦(Bromusinermis)和其它草,可存在于小麦生长的几乎任何地方。(10)马铃薯病毒X(PVX)—这种病毒没有昆虫或真菌传播媒介。该病毒在大多数马铃薯变种引起轻微症状或无症状,但是当马铃薯病毒Y存在时,这两种病毒间的协同作用引起马铃薯的严重症状。其它病毒:柑桔速衰病毒(CTV)—对柑桔造成最大经济损害的病害,包括酸橙(Citrusaurantium)和嫁接到酸橙根茎上的任何柑桔属种、甜橙(C.sinensis)、葡萄柚(C.paradisi)、来檬和塞维利亚柑橘(C.aurantifolia)和桔(C.reticulata)。还已知CTV感染Aeglopsischevalieri、Afraeglepaniculata、Pamburusmissionis和细柱西番莲(Passifloragracilis)。CTV分布在全世界,凡柑桔树生长的任何地方都可发现。大麦黄矮病毒(BYDV)—最广泛分布的谷类病毒病。它影响经济上重要的作物种大麦、燕麦、小麦、玉米、小黑麦和水稻。马铃薯卷叶病毒(PLRV)感染马铃薯和茄科的其它成员。番茄丛矮病毒(TBSV),RNA病毒,番茄丛矮病毒属(Tombusvirus)的成员,主要影响番茄和茄子。其它综述:Hamilton等人,1981,JGenVirol54;223-241–提及TMV、PVX、PVY、CMV、CaMV。其它科学论文:Makkouk等人,2012,AdvVirusRes84;367-402-影响豌豆和菜豆的具有狭窄(蚕豆坏死黄化病毒(FBNYN))和宽泛(苜蓿花叶病毒(AMV)和CMV)宿主范围的病毒。导致植物病害的害虫包括来自例如以下科的那些:蜜蜂科(Apidae)、象鼻虫科(Curculionidae)、金龟子科(Scarabaeidae)、实蝇科(Tephritidae)、卷蛾科(Tortricidae)等等。植物病原性生物的靶基因编码对病原体的生存力和/或感染性必不可少的产物,因此其下调(通过裸dsRNA)导致病原体存活和感染宿主细胞的能力下降。因此,这种下调导致对维持植物病原体的生存力和/或感染性的“有害作用”,因为其妨碍或降低病原体从衍生自宿主细胞的养分摄食和从中存活的能力。由于植物病原体生存力和/或感染性的这种降低,因此促进了植物细胞中对被病原体感染的抗性和/或提高的耐受性。可在成熟(成体)期、未成熟(幼小)期或胚期靶向病原体中的基因。本文提供了病原体的生存力和/或感染性所必需的基因的实例。这样的基因可包括参与发育和繁殖的基因,例如转录因子(参见例如Xue等人,1993;Finney等人,1988)、细胞周期调节因子,例如wee-1和ncc-1蛋白质(参见例如Wilson等人,1999;Boxem等人,1999)和胚-致死突变体(参见例如Schnabel等人,1991);建模所需的蛋白质例如胶原、ChR3和LRP-1(参见例如Yochem等人,1999;Kostrouchova等人,1998;Ray等人,1989);编码参与运动/神经系统的蛋白质的基因,例如乙酰胆碱酯酶(参见例如Piotee等人,1999;Talesa等人,1995;Arpagaus等人,1998),利阿诺定(ryanodine)受体例如unc-68(参见例如Maryon等人,1998;Maryon等人,1996)和谷氨酸门控的氯离子通道或avermeetin受体(参见例如Cully等人,1994;Vassilatis等人,1997;Dent等人,1997);获取宿主养分所需的水解酶,例如丝氨酸蛋白酶,例如HGSP-1和HGSP-III(参见例如Lilley等人,1997);编码入侵和建立摄食部位所需的蛋白质的寄生基因,例如纤维素酶(参见例如deBoer等人,1999;Rosso等人,1999)和编码指导产生花柱或头感器分泌物的蛋白质的基因,例如sec-1蛋白(参见例如Ray等人,1994;Ding等人,1998);编码性别或雌性决定所需的蛋白质的基因,例如tra-1、tra-2和egl-1,ced9的一种阻遏物(参见例如Hodgkin,1980;Hodgkin,1977;Hodgkin,1999;Gumienny等人,1999;Zarkower等人,1992);和编码维持正常代谢功能和稳态所需的蛋白质的基因,例如甾醇代谢、胚致死突变体(参见例如Schnabel等人,1991)和反式剪接的前导序列(参见例如Ferguson等人,1996),pos-1,胞质Zn指蛋白;pie-1,胞质Zn指蛋白;mei-1,ATP酶;dif-1,线粒体能量转移蛋白;rba-2,染色质装配因子;skn-1,转录因子;plk-1,激酶;gpb-1,G-蛋白B亚基;par-1,激酶;bir-1,细胞凋亡抑制剂;mex-3,RNA-结合蛋白,unc-37,G-蛋白B亚基;hlh-2,转录因子;par-2,dnc-1,动力蛋白激活蛋白(dynactin);par-6,dhc-1,动力蛋白重链;和pal-1,同源框。已经自寄生线虫例如Meliodogyne和异皮线虫属物种中克隆了这样的基因,或者本领域技术人员可使用来自克隆的秀丽隐杆线虫(C.elegans)直向同源物的序列信息来鉴定这样的基因(秀丽隐杆线虫基因组已被测序并且是可用的,参见秀丽隐杆线虫测序协会(TheC.elegansSequencingConsortium)(1998))。若干实施方案涉及将病原体抗性赋予植物的方法,所述方法包括使种子接触包含以下序列的外源dsRNA分子:所述序列与植物病原性生物的基因的至少18个连续核苷酸基本相同或与其基本互补,和自种子长出植物。本文使用的“病原体抗性”性状是引起植物宿主对病原体攻击具有抗性的植物特征,所述病原体通常能够对植物造成损害或损失。不希望受到具体理论的束缚,一旦向植物病原体提供自包含裸dsRNA的种子产生的植物材料后,就抑制靶病原体内的基因表达,并且对靶病原体的基因表达的抑制导致植物对该病原体的抗性。在本文所述的实施方案中,靶基因可编码必需蛋白或转录非编码RNA,其预测功能例如选自离子调节和转运、酶合成、保持细胞膜电位、氨基酸生物合成、氨基酸降解、发育和分化、感染、穿透、附着胞或吸器的发育、菌丝体生长、黑色素合成、毒素合成、铁载体合成、孢子形成、子实体合成、细胞分裂、能量代谢、呼吸、和细胞凋亡等等。按照具体的实施方案,所述植物病原性生物选自真菌、线虫、病毒、细菌和昆虫。为了证实抗害虫活性,本发明的教导也预期在所述提供之后观察死亡或生长抑制和宿主症状的程度。为了提高抗植物病原体活性,本发明的实施方案进一步提供含有两种或更多种分别对同一植物病原性微生物有毒的不同作用剂的组合物,所述作用剂中的至少一种包含本文所述的dsRNA。在某些实施方案中,第二作用剂可为选自以下的作用剂:参与氨基酸或碳水化合物合成的代谢酶的抑制剂;细胞分裂的抑制剂;细胞壁合成抑制剂;DNA或RNA合成抑制剂、促旋酶抑制剂、微管蛋白装配抑制剂、ATP合成抑制剂;氧化磷酸化解偶联剂;蛋白质合成抑制剂;MAP激酶抑制剂;脂质合成或氧化抑制剂;甾醇合成抑制剂和黑色素合成抑制剂。在某些实施方案中,将包含本文所述的外源dsRNA的种子用非多核苷酸杀虫剂处理。据信,作为用外源dsRNA处理种子的结果而表现出针对靶害虫的生物活性的植物(该植物自所述种子长出)以及用某些化学或蛋白杀虫剂处理种子的组合,为经这类处理的种子提供了意外的协同优势,包括保护所得植物免遭靶害虫损害的意外的优良功效。本发明的实施方案的种子据信具有降低杀虫剂使用成本的性能,因为与不用本创新的组合物和方法的情况相比较少的杀虫剂就可用于得到所需的保护量。此外,因为使用较少杀虫剂,据信与常规方法相比,主题方法因此对操作者和对环境而言更安全,并且可能更便宜。当说某些作用是“协同的”,意指包括自用dsRNA处理的种子长出的植物的生物活性和杀虫剂的组合对杀虫活性(或功效)的组合的协同效应。然而,并非意指这样的协同效应限制在杀虫活性上,而是它们也应包括诸如下列等意外优势:增加活性范围,相对于损害减少的种类和量而言的有利的活性谱,降低杀虫剂和应用的成本,减少杀虫剂在环境的分布,减少生产、处理和种植种子的人员对杀虫剂的暴露,以及本领域技术人员已知的其它优势。另外,按照本发明实施方案的教导产生的植物或其部分可显示营养或治疗功效改变,因此可应用于食物或饲料和药物工业。同样地,按照本发明实施方案的教导产生的植物或其部分可显示油或纤维素含量改变,因此可在建筑业或油工业中实施。可将本发明的种子包装在包含大量种子的含种子装置中,其中至少一些种子(例如5%、10%或更高)含有外源裸dsRNA,其中种子缺乏驱动dsRNA表达的异源启动子。含种子装置可以是袋、塑料袋、纸袋、软壳容器或硬壳容器。本文所述的若干实施方案涉及处理种子的溶液,其含有包含以下序列的不可转录的多核苷酸触发物例如dsRNA分子:所述序列与靶基因的至少18个连续核苷酸基本互补或与其基本相同。在某些实施方案中,溶液可以进一步包含缓冲剂,例如EDTA。本文使用的“溶液”是指均匀混合物和非均匀混合物,例如混悬液、胶体、胶束和乳液。在某些实施方案中,溶液可以在试剂盒中提供。在某些实施方案中,试剂盒可进一步包含以下的一种或多种:种子、容器、引发溶液和种子生长培养基。可将本发明的试剂包装在试剂盒中,所述试剂盒包括不可转录的多核苷酸触发物例如dsRNA分子、将不可转录的多核苷酸触发物例如dsRNA分子引入种子中的说明书和任选引发溶液。如有需要,本发明一些实施方案的组合物可以包装或分配装置提供,所述包装或分配装置可装有含有活性成分的一个或多个剂型。例如,包装可包含金属箔或塑料箔,例如泡罩包装。包装或分配装置可附有用于引入到种子中的说明书。按照一个实施方案,不可转录的多核苷酸触发物例如dsRNA分子和引发溶液装在单独的容器中。本文所用术语“约”是指±10%。术语“包含”、“含”、“包括”、“装有”、“具有”及其变化形式意指“包括但不限于”。术语“由……组成”意指“包括并限于”。术语“基本由……组成”意指组合物、方法或结构可包括额外的成分、步骤和/或部分,但只有该额外的成分、步骤和/或部分不实质性地改变所要求保护的组合物、方法或结构的基本的和新的特性才如此。本文所用的单数形式“一个”、“一种”和“该”包括复数对象,除非文中另有明确规定。例如,术语“一种化合物”或“至少一种化合物”可包括多种化合物,包括其混合物。在整个申请书中,本发明的不同实施方案可以范围格式提供。应理解,范围格式中的描述只是出于方便和简明,不应解释为对本发明范围的不可变更的限制。因此,范围的描述应视为明确公开了所有可能的亚范围以及该范围内的各个数值。例如,范围的描述例如1-6应视为明确公开了亚范围,例如1-3、1-4、1-5、2-4、2-6、3-6等,以及该范围内的各个数字,例如1、2、3、4、5和6。不论范围宽度这都适用。每当本文规定数字范围时,意指包括规定范围内的任何引用的数字(分数或整数)。短语“介于”第一标示数值和第二标示数值“之间的范围”和“从”第一标示数值“到”第二标示数值“之间的范围”在本文中可互换使用,意指包括第一和第二标示的数值和其间的所有分数和整数。本文所用术语“方法”是指完成指定任务的方式、手段、技术和程序,包括但不限于农艺学、化学、药理学、生物学、生物化学和医学领域从业人员已知的或农艺学、化学、药理学、生物学、生物化学和医学领域从业人员自已知的方式、手段、技术和程序容易开发的方式、手段、技术和程序。要认识到,为清楚起见而在单独的实施方案的情况下描述的本发明的某些特征,也可在单一实施方案中组合提供。相反,为简明起见而在单一实施方案的情况下描述的本发明的各种特征,也可单独或以任何合适的亚组合或合适时以本发明的任何其它所述实施方案提供。在不同实施方案的情况下描述的某些特征不应视为所述实施方案的必需特征,除非没有所述要素时实施方案无法实施。在下面的实施例中提供对上文描述的和随附权利要求书中所要求保护的本发明的不同实施方案和方面的实验支持。以下实施例为说明的目的而给出,不应理解为限制。实施例现参照以下实施例,其连同上文描述以非限制性方式对本发明进行说明。通常,本文所用命名法和用于本发明的实验室程序包括分子、生物化学、微生物学和重组DNA技术。在文献中详尽解释了所述技术。参见例如,“MolecularCloning:AlaboratoryManual”Sambrook等人,(1989);“CurrentProtocolsinMolecularBiology”第I-III卷Ausubel,R.M.编辑(1994);Ausubel等人,“CurrentProtocolsinMolecularBiology”,JohnWiley和Sons,Baltimore,Maryland(1989);Perbal,“APracticalGuidetoMolecularCloning”,JohnWiley&Sons,NewYork(1988);Watson等人,“RecombinantDNA”,ScientificAmericanBooks,NewYork;Birren等人(编辑)“GenomeAnalysis:ALaboratoryManualSeries”,第1-4卷,ColdSpringHarborLaboratoryPress,NewYork(1998);美国专利号4,666,828;4,683,202;4,801,531;5,192,659和5,272,057提供的方法;“CellBiology:ALaboratoryHandbook”,第I-III卷,Cellis,J.E.编辑(1994);Freshney的“CultureofAnimalCells-AManualofBasic技术”,Wiley-Liss,N.Y.(1994),第三版;“CurrentProtocolsinImmunology”第I-III卷,ColiganJ.E.,编辑(1994);Stites等人(编辑),“BasicandClinicalImmunology”(第8版),Appleton&Lange,Norwalk,CT(1994);Mishell和Shiigi(编辑),“SelectedMethodsinCellularImmunology”,W.H.Freeman和Co.,NewYork(1980);可获得的免疫测定法广泛描述于专利和科技文献,参见例如美国专利号3,791,932;3,839,153;3,850,752;3,850,578;3,853,987;3,867,517;3,879,262;3,901,654;3,935,074;3,984,533;3,996,345;4,034,074;4,098,876;4,879,219;5,011,771和5,281,521;“OligonucleotideSynthesis”Gait,M.J.编辑(1984);“NucleicAcidHybridization”Hames,B.D.和HigginsS.J.,编辑.(1985);“TranscriptionandTranslation”Hames,B.D.和HigginsS.J.,编辑.(1984);“AnimalCellCulture”Freshney,R.I.编辑(1986);“ImmobilizedCellsandEnzymes”IRLPress,(1986);“APracticalGuidetoMolecularCloning”Perbal,B.,(1984)和“MethodsinEnzymology”第1-317卷,AcademicPress;“PCRProtocols:AGuideToMethodsandApplications”,AcademicPress,SanDiego,CA(1990);Marshak等人,“StrategiesforProteinPurificationandCharacterization-ALaboratoryCourseManual”CSHLPress(1996);所有文献都通过引入并入就像在本文全部提供一样。本文件全文中提供了其它通用参考文献。其中的程序被认为是本领域众所周知的,出于为了读者方便而提供。其中所含全部信息通过引用结合到本文中。实施例1:用于dsRNA产生和种子处理的方案产生dsRNA/siRNA序列采用PCR产物的体外转录,定制各基因的dsRNA序列。使用在任一侧含有T7启动子序列的基因特异性引物,PCR扩增mRNA的部分,包括用于dsRNA产生的ORF、3'UTR或5'UTR。使用市售试剂盒例如MaxiScriptdsRNA试剂盒(LifeTechnologies)或T7高产量RNA合成试剂盒(NEB),将该产物用作dsRNA产生的模板。接下来,在37℃下将样品用DNA酶Turbo处理15-30分钟,接着苯酚处理和核酸沉淀。接下来,进行了两个不同的反应之一:(1)dsRNA备好待用,或(2)dsRNA用Dicer(ShortcutRNA酶III(NEB))加工以产生小干扰RNA(siRNA)。如下所述将dsRNA或dsRNA和siRNA的组合用于种子处理。使用dsRNA/siRNA混合物的基因沉默的通用种子处理方案。无涂层的有机玉米种子来自变种“popcorn”,无涂层的有机整粒水稻种子、有机大豆和小麦种子购自NitsatHaduvdevan(以色列)。新鲜番茄种子采自内部繁殖的M82番茄果实。在处理之前,将无涂层的或新鲜植物种子用双蒸水(DDW)洗涤4小时。接下来,将种子在30℃下干燥10-16小时。在干燥步骤后,种子用含有dsRNA制剂的溶液处理,该溶液由含终浓度为40-150μg/ml的dsRNA的0.1mMEDTA制成。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达24小时,来进行处理。最后,短暂洗涤种子2次,种植在土壤中,或干燥0-30小时和在无光生长室中在25℃下萌发并种植在土壤中,或直接种植在土壤中。以类似方式,用没有dsRNA或具有非特异性dsRNA的制剂处理对照种子。实施例2:水稻、番茄和高粱幼苗中DSRNA的稳定性作为植物中不存在/不表达的外源基因的实例,采用实施例1所述方案,将编码CGMMV(检索号AF417242)的复制酶和外被蛋白的ORF用作植物种子dsRNA处理的靶标。将水稻、番茄和高粱种子在20℃下洗涤4小时,将番茄和高粱在30℃下干燥,水稻在20℃下干燥过夜。对于水稻,将种子在15℃下用132.7μg/mldsRNA(终浓度)直接处理39小时;对于番茄用93.8μg/mldsRNA(终浓度)处理48小时;对于高粱用75μg/mldsRNA(终浓度)处理40小时。简单地说,用在其5’含有T7序列(5’-TAATACGACTCACTATAGGG-3’,SEQIDNO:1)的特别设计的正向和反向引物,通过PCR扩增病毒衍生的ORF(参见下表1)。PCR产物用琼脂糖凝胶纯化,因为它们在两端携带T7启动子,因此用作T7依赖性体外转录的模板,产生CGMMV基因的dsRNA产物。对持家基因微管蛋白的PCR用作阳性对照(正向引物5’-GGTGCTCTGAACGTGGATG-3’(SEQIDNO:2)和反向引物5’-CATCATCGCCATCCTCATTCTC-3’(SEQIDNO:3))。表1:用作体外转录的模板和CGMMV和CGMMVdsRNA产物的检测的PCR引物。与绿斑驳花叶病毒同源的dsRNA在水稻幼苗中是稳定的。水稻种子在15℃用132.7µg/mldsRNA(终浓度)处理39小时并检测dsRNA。在萌发后一周,在10株幼苗中有9株可检测到dsRNA。微管蛋白cDNA的检测用作cDNA质量的阳性对照。萌发后两周,在10株幼苗中有10株可检测到dsRNA。在萌发后三周,在水稻幼苗的5个样品中有5个检测到与绿斑驳花叶病毒同源的dsRNA。番茄种子在15℃用93.8µg/mldsRNA(终浓度)处理48小时,高粱种子用5µg/mldsRNA(终浓度)处理40小时。通过RT-PCR,在萌发后10天测试的13株番茄幼苗中有5株检测到CGMMVdsRNA,在萌发后4周,在4株高粱幼苗中有3株检测到CGMMVdsRNA。发现外源dsRNA在水稻幼苗中稳定达至少3周,在番茄幼苗中稳定达至少10天,在高粱植物中稳定达4周。实施例3:dsRNA不整合至水稻的基因组中同实施例2一样,将水稻种子用外源dsRNA处理。植物萌发并生长5周,提取DNA,进行PCR反应以证实dsRNA不整合至水稻的基因组中。使用当检查RNA水平时给出阳性反应的两组引物,第1组(参见表2)引物是用于扩增模板(全部dsRNA序列)的引物组。第2组(参见表3)是用于以上PCR的引物。水稻内源持家基因(微管蛋白)用作PCR反应的阳性对照(参见表2)。对用dsRNA处理的和未经处理的植物进行三个不同的DNAPCR反应。在任何经处理或未经处理的植物中都未检测到对应于CGMMV的扩增DNA。表2:用于PCR扩增的微管蛋白引物。引物名称和方向引物序列/(SEQIDNO:)引物长度osa_TubA1_736FGGTGCTCTGAACGTGGATG(SEQIDNO:12)19osa_TubA1_1342RCATCATCGCCATCCTCATTCTC(SEQIDNO:13)22实施例4:外源dsRNA分子在溶液中是非常稳定的且不掺入到经处理植物的基因组中采用实施例1所述方案处理玉米种子,在20℃下洗涤种子4小时,在30℃下干燥过夜,立即在15℃下用针对β-葡糖醛酸糖苷酶(GUS)报道基因的40μg/mldsRNA(终浓度)处理60小时,干燥并使之萌发。在萌发后7和15天,从对照和dsGUS处理的植物收获叶和根。从收获的组织提取RNA,用特异性GUS引物运行RT-PCR(表3)。另外,玉米内源持家基因(遍在蛋白)用作PCR反应的阳性对照。发现GUSdsRNA分子在处理的种子中极其稳定,并且在种子萌发后7和15天,可在玉米植物中检出。按照本公开内容的一方面,在萌发后7和15天,可通过RT-PCR在玉米幼苗中检测GUSdsRNA。在一周,在所测的11株玉米幼苗中有9株的嫩枝中检测到GUSdsRNA。在未经处理的植物中未检测到GUSdsRNA。在萌发后1周,在5株经处理的玉米幼苗的根中有5株检测到GUSdsRNA。在萌发后15天,在玉米幼苗的根中检测到GUSdsRNA。经对GUS序列的DNAPCR反应物的琼脂糖凝胶电泳测定,在萌发后1周,GUSdsRNA分子不掺入到经处理的玉米植物的基因组中。表3:用于GUS和遍在蛋白基因PCR扩增的引物和GUSdsRNA产物。实施例5:各种植物种子中siRNA序列的荧光显微术植物种子按照实施例1所述方案处理。在20℃下洗涤种子4小时,在25℃下干燥,立即在15℃下用荧光siRNA(siGLO,2μM终浓度,ThermoScientific)处理24小时。在施加到植物种子之前,通过凝胶电泳分析验证siGLO的质量。检测到对应于20-24bp预期大小的荧光siRNA分子的条带C。处理后24-48小时,使用Olympus显微镜在最低物镜放大倍数下(5X用于较大种子例如水稻和番茄种子,10X用于较小的种子例如拟南芥种子),拍摄种子的荧光照片。为了消除非特异性自发荧光的可能性,将dsRNA处理的种子与未经处理的对照种子比较。在用siRNA以2µM终浓度在拟南芥种子、水稻种子和番茄种子中处理种子后24小时,观察到荧光siRNA分子穿透入植物种子。在用siGLOdsRNA处理后24小时观察到荧光siRNA分子穿透入水稻种子。为了评价种子内荧光siRNA的分布效率,在处理后48小时,将不同的植物种子切成片,用荧光显微镜成像。对各处理的种子与对照未处理种子放在一起成像。在施用于水稻、番茄、黄瓜、菜豆、高粱和小麦种子样品时,拍摄光图像和荧光图像。在用siGLOdsRNA处理后48小时观察到荧光siRNA分子穿透入水稻种子。将siGLO-处理的和对照水稻种子切成片,用荧光显微镜观察荧光dsRNA的内部分布并在经处理的种子中检测到荧光siRNA分子。在胚乳和胚中检测到荧光siGLORNA。在用siGLOdsRNA处理后48小时观察到荧光siRNA分子穿透入番茄种子。将siGLO-处理的和对照番茄种子切成片,用荧光显微镜观察荧光dsRNA的内部分布。在胚乳和胚中检测到荧光siGLORNA。在用siGLOdsRNA处理后48小时观察到荧光siRNA分子穿透入黄瓜种子。将siGLO-处理的和对照黄瓜种子切成片,用荧光显微镜观察荧光dsRNA的内部分布。在胚乳和胚中检测到荧光siGLORNA。在用siGLOdsRNA处理后48小时,在不同植物物种的切片种子中检测到荧光siRNA分子的穿透,所述植物物种包括菜豆、番茄、高粱和小麦。将siGLO-处理的和对照种子切成片,用荧光显微镜观察荧光dsRNA的内部分布。对于每个种子也拍摄光图像并与种子的荧光图像一起显示用于参考。图1显示在24小时时间中siGLO-处理的水稻种子的荧光图像。测试了与siGLOdsRNA的孵育时间对荧光强度的影响,荧光强度指示dsRNA穿透的数量和质量。对未经处理的对照种子(1)以及用siGLOdsRNA以如下4个不同孵育时间处理的种子一起成像:10分钟(2)、3.5小时(3)、5.5小时(4)和24小时(5)。显然siRNA以不同水平分布在胚和胚乳之间。因此,dsRNA分子直接进入胚中。尽管不受任何具体理论限制,dsRNA分子被用于种子处理的基于水的溶液携带。dsRNA分子作为胚乳吸水过程的一部分进入胚乳。这些分子随后在萌发和种子发育期间,在胚发育时作为胚乳至胚的养分流的一部分转移至胚。这些本发明的发现表明,用来处理的种子的RNA分子穿透胚且在胚发育时在胚中起作用,而且还穿透胚乳,并在萌发后供给至胚。实施例6:用siGLO处理的时程实验对水稻种子进行了时程实验以监测在种子处理后siGLO穿透入种子的动力学(图1)。结果表明采用实施例1所述方案,siRNA有效地穿透入植物种子中。实施例7:针对棉贪夜蛾基因的种子处理棉贪夜蛾(或棉花近尺蠖夜蛾Prodenialittoralis),也称为非洲棉叶虫或埃及棉叶虫,是在非洲和地中海欧洲广泛存在的蛾子。它是蔬菜、果实、花和其它作物上的常见害虫。自棉贪夜蛾幼虫提取RNA用于产生dsRNA,并且从0.5μg总RNA中制备cDNA文库。选择若干基因(ATP酶、NADPH细胞色素P450氧化还原酶(在本文称为NADPH)、细胞凋亡抑制剂(IAP)和壳多糖合酶),以测试用植物喂养棉贪夜蛾的效应,所述植物自用针对这些基因的dsRNA处理的种子长出(参见表4)。将玉米种子洗涤4小时,在30℃干燥并立即用dsRNA分子以终浓度40μg/ml(对于IAP和ATP酶)、80μg/ml(对于NADPH,40μg/ml对于各dsRNA序列,参见表4)、或含有所有三种基因(20μg/ml对于4种dsRNA序列的每一种)的混合溶液(80μg/ml最终)处理24小时。新鲜番茄种子不经洗涤,直接用dsRNA分子以终浓度66μg/ml(对于IAP)、133μg/ml(对于NADPH)、或含有靶向这两个基因的dsRNA的混合溶液(80μg/ml最终)处理48小时。经处理的种子萌发并长成植物。不用针对棉贪夜蛾基因的dsRNA处理但与不含dsRNA或含针对无关基因例如GUS的dsRNA的类似溶液一起孵育的对照种子,与经处理的植物一起萌发并生长。将经处理的和对照植物的叶放入培养皿并用作棉贪夜蛾的唯一食物来源(典型地,大约5条毛虫/板)。每次实验开始时记录毛虫总体重并全程跟踪。按需要补充新叶并也记录其重量。计算毛虫的体重增加并用作其健康和生存力的指示器。表4。用于下调的棉贪夜蛾基因的序列和用于dsRNA分子产生的引物。基因名称生物SEQIDNONADPH棉贪夜蛾NADPH细胞色素P450氧化还原酶mRNA,完整cds(JX310073.1)21ATP酶棉贪夜蛾H(+)-ATP酶B亚基mRNA,部分cds(AY169409.1)22IAP棉贪夜蛾mRNA对于细胞凋亡抑制剂(iap基因)(AM709785.1)23壳多糖合酶贪夜蛾(Spodopteraexigua)壳多糖合酶AmRNA,完整cds(DQ062153)24NADPHdsRNA#1棉贪夜蛾25NADPHdsRNA#2棉贪夜蛾26NADPHdsRNA#1frwd棉贪夜蛾27NADPHdsRNA#1rev棉贪夜蛾28NADPHdsRNA#2frwd棉贪夜蛾29NADPHdsRNA#2rev棉贪夜蛾30ATP酶dsRNA#1棉贪夜蛾31ATP酶dsRNA#1frwd棉贪夜蛾32ATP酶dsRNA#1rev棉贪夜蛾33IAPdsRNA#1棉贪夜蛾34IAPdsRNA#1frwd棉贪夜蛾35IAPdsRNA#1rev棉贪夜蛾36壳多糖合酶dsRNA#1贪夜蛾37壳多糖合酶dsRNA#2贪夜蛾38壳多糖合酶dsRNA#1frwd贪夜蛾39壳多糖合酶dsRNA#2frwd贪夜蛾40壳多糖合酶dsRNA#2rev贪夜蛾41壳多糖合酶dsRNA#1rev贪夜蛾42实验1将棉贪夜蛾叶虫放入具有来自萌发的对照或dsRNA-处理的种子的玉米叶的培养皿中并每天监测叶的消耗和体重增加。24小时、48小时和5天后的棉贪夜蛾体重增加数据分别见表5。注意到相比饲喂未经处理的对照叶的虫子而言对于饲喂任何dsRNA-处理的叶的虫子的体重增加的负面效应。将饲喂对照叶的棉贪夜蛾的体重增加归一化到数值“1”。实验2在本实验中,用于使棉贪夜蛾NADPH或IAP基因沉默的dsRNA分子用来处理玉米种子。自这些种子长出的幼苗的叶以及对照叶用作单个培养皿中的5条棉贪夜蛾叶虫的食物来源(对于每次处理而言两个板)。对照叶用针对GUS基因的dsRNA处理。从实验开始就记录对照和经处理组的体重增加48小时(表5)。在饲喂NADPH-dsRNA处理的叶的虫子中观察到对体重增加的最强效应。将饲喂对照叶的棉贪夜蛾的体重增加归一化到数值“1”。实验3在本实验中,用于使棉贪夜蛾NADPH或IAP基因沉默的dsRNA分子用来处理番茄种子。也包括额外处理,其中种子用含有靶向这两个基因的dsRNA分子的混合溶液处理。自这些种子长出的幼苗的叶以及对照叶用作单个培养皿中的5条棉贪夜蛾叶虫的食物来源。在处理后记录对照和经处理组的体重增加72小时,见表5。将饲喂对照叶的棉贪夜蛾的体重增加归一化到数值“1”。实验4在本实验中,用于使棉贪夜蛾NADPH、IAP或ATP酶基因沉默的dsRNA分子用来处理玉米种子。也包括额外处理,其中种子用含有靶向所有这三个基因的dsRNA分子的混合溶液处理。自这些种子长出的幼苗的叶以及对照叶用作单个培养皿中的5条棉贪夜蛾叶虫的食物来源。在第4天,将经处理的玉米叶替换为未经处理的莴苣叶作为唯一食物来源。记录对照和经处理组的体重增加达多至8天。在24小时时所有虫子的体重用作参考点,将饲喂对照叶的棉贪夜蛾的体重增加归一化到数值“1”。饲喂对照或经处理的玉米叶的虫子的相对体重增加的数据见表5。表5:在dsRNA处理的叶上24小时后棉贪夜蛾的体重增加实验时间对照NADPHIAP混合物ATP酶gus24小时1.00.640.38n/a0.8n/a148小时1.00.690.57n/a0.7n/a15天1.00.360.84na/0.94n/a248小时1.00.550.91.0348小时10.550.9372小时10.950.910.9045天11.00.760.730.991.1147天21.00.880.870.890.9148天31.00.90.780.971.121经处理的玉米4天和莴苣1天;2经处理的玉米4天和莴苣3天;3经处理的玉米4天和莴苣4天。实施例8:通过dsRNA/siRNA混合物使水稻中的PDS-1基因沉默将水稻种子在20℃下在洗涤溶液中洗涤4小时,在25℃下干燥,立即用总浓度为5μg/ml的dsRNA/siRNA的混合物在15℃下处理。使种子在室温下萌发几天,并监测种子发育。用PDS和dsRNA/siRNA混合物处理的种子显示发育受阻和延缓,如通过幼苗较小和生根减少所见到的。出于效率考虑因素和为了增加所观察效应的可能性,将PDS-1基因的两种产物合并(参见表6)。表6:被dsRNA/siRNA混合物沉默的两种PDS-1基因产物。序列名称生物NCBI检索号SEQIDNO八氢番茄红素去饱和酶PDS1dsRNA1玉米(Zeamays)BT084155.143八氢番茄红素去饱和酶PDS1dsRNA2玉米BT084155.144实验在3个生物学重复中进行,结果见图2A-B。实施例9:PDS沉默后的叶绿素漂白和生长抑制水稻种子如实施例8所述处理,监测其随后的发育和幼苗生长。在PDS-1沉默处理后30天,记录2个植物组(对照和PDS沉默)的总体表型。据报告,PDS沉默引起叶绿素漂白和生长抑制(Peretz等人,2007,PlantPhysiol145:1251-1263),这与本发明的PDS沉默的植物的表型相关联。相比对照植物,在30天后经处理的水稻植物看起来尺寸较小,颜色较浅。实施例10:通过实时PCR检测两种PDS-1基因产物在如实施例8所述用dsRNA/siRNA混合物(比率1:1)处理后,使用以下特别设计的引物,通过实时PCR测定PDS-1基因产物的表达水平:正向:GATTGCTGGAGCAGGATTAGSEQIDNO:45;反向:CCCTTGCCTCAAGCAATATG,SEQIDNO:46。为了归一化目的,还使用以下引物测定了UBQ5表达:正向–ACCACTTCGACCGCCACTACT,SEQIDNO:47;反向-ACGCCTAAGCCTGCTGGTT,SEQIDNO:48。结果见图3A-C。实施例11:HAP2E靶基因沉默水稻种子采用实施例1所述方案处理。将种子在室温下洗涤4小时,在25℃下干燥过夜,立即用152μg/ml的Hap2edsRNA浓度在15℃下处理41小时(对于Hap2edsRNA序列参见表7)。处理后5天萌发的对照和Hap2edsRNA处理的水稻种子在其根发育中没有显示任何差异。在萌发后5和7天,从萌发种子的嫩枝提取RNA,并运行RT-PCR。在测试3个位于dsRNA分子的不同区域(表8,显示相对于对照的倍数变化)的不同引物组(参见表7)后,使用最佳引物组(引物组3)评价dsRNA处理植物中相对于对照(未经处理)植物的内源Hap2e表达水平。与对照植物相比,在经处理的植物中实现Hap2emRNA表达以超过50%沉默水平下调,其效率为31.25%(表9)。其它水稻种子在相同条件下用145.7μg/ml的Hap2edsRNA浓度处理42小时。使用随机引物+寡dT对萌发后18天从幼苗中提取的RNA的RT-PCR,也显示在dsRNA处理的植物中Hap2emRNA下调(表10),其以50%效率达到与对照相比超过25%的下调。表7:用于Hap2edsRNA分子的RT-PCR的引物。表8:用Hap2edsRNA(mir169的靶)处理水稻种子,引物评价。对照EM47766EM47767EM47769EM47772EM47773引物组11.00.870.7-0.810.62引物组21.00.990.82-0.890.44引物组31.00.760.73-0.780.4相对于未经处理对照的倍数变化(对照=1.0)表9:7天时用Hap2edsRNA(mir169的靶)处理的水稻种子对照EM47796EM47798EM47799EM47803EM47804EM47769相对倍数变化1.00.410.770.520.470.830.0相对于未经处理对照的倍数变化(对照=1.0)表10:18天时用Hap2edsRNA(mir169的靶)处理的水稻种子对照EM49050EM49051EM49052EM49053EM49054EM49056EM49047EM49060EM49061EM49063EM490641.00.330.410.930.540.650.540.730.730.900.640.96相对于未经处理对照的倍数变化(对照=1.0)实施例12:玉米种子中的NFY靶基因沉默玉米种子采用实施例1所述方案处理,将种子在室温下洗涤4小时,在30℃下干燥过夜,立即用56μg/ml的NFYdsRNA浓度在15℃下处理40小时(对于NFYdsRNA序列参见表11)。在萌发后10天,对从对照和NFYdsRNA处理的玉米种子中提取的RNA进行了RT-PCR,以测定NFY靶基因的表达水平(参见表11)。如表12所示成功实现了该基因的下调。表11:用于萌发后3、10天玉米种子中NFYAdsRNA分子的RT-PCR的引物。引物名称和方向引物序列SEQIDNo.:zma-NFYA3_345F3TCGGAAGCCGTACCTTCGTG55zma-NFYA3_442R3CCTGGAGCTGCTGCTTTGTG56zma-NFYA3_457F4TACCAGGCGTCGAGTGGTTC57zma-NFY-A3_542R4GAAGAGGGCGTGCAAATGGG58表12:用NFYdsRNA(mir169的靶)处理玉米种子。对照EM48006EM48007EM48009EM48010EM48011EM48012EM48013EM480141.00.510.620.670.330.500.760.850.11相对于未经处理对照的倍数变化(对照=1.0)实施例10:番茄种子中的NFY靶基因沉默番茄种子采用实施例1所述方案处理。未经洗涤的种子用200μg/ml的NFYdsRNA浓度在15℃下处理24小时,将种子短暂洗涤两次,在不干燥的情况下立即种植在土壤中。在萌发后3周,对从对照和NFYdsRNA处理的番茄种子中提取的RNA进行RT-PCR,以测定NFY靶基因的表达水平(参见表13)。如表14所示成功实现了基因的下调。将用NFYdsRNA分子处理后55天的番茄植物与同龄对照植物进行比较。在比较时主要表型差异是明显的,最值得注意的是高度的改变,其中经处理的植物显得比未经处理的对照植物明显更矮(图4)。表13:用于番茄中NFYAdsRNA分子的RT-PCR的引物和NFYdsRNA产物。表14:在3周时用NFYdsRNA(mir169的靶)处理的番茄种子。植物EM49778EM49812EM49816EM49818EM49819EM49826EM49827EM49829相对倍数变化1.00.80.90.50.60.90.80.6植物EM49832EM49833EM49834EM49835EM49836EM49837EM49838EM49839相对倍数变化0.70.80.90.50.90.50.50.8相对于未经处理对照的倍数变化(对照=1.0)实施例11:玉米种子中的NAC靶基因沉默玉米种子采用实施例1所述方案处理,将种子在室温下洗涤4小时,在30℃下干燥过夜,立即用90μg/ml的NACdsRNA浓度在15℃下处理40小时并立即萌发(对于NACdsRNA序列参见表15)。在萌发后10天对从对照和NACdsRNA处理的玉米种子中提取的RNA进行了RT-PCR,以测定NAC靶基因的表达水平(参见表15)。如表16所示成功实现了基因的下调。表15:用于玉米中NACdsRNA分子的RT-PCR的引物。引物名称和方向引物序列SEQIDNo.:zmaNAC5_267F3CGAGTCGGGATACTGGAAGG63zmaNAC5_342R3CTTCTTCATGCCGACGAGGG64zmaNAC5_187F4ACGATGGGCGAGAAGGAGTG65zmaNAC5_250R4TCAGTCCCGTCGGGTACTTG66表16:在萌发后10天用NACdsRNA(mir164的靶)处理的玉米种子。植物对照1234567相对倍数变化1.00.220.140.220.200.430.160.55植物891011121314相对倍数变化0.000.090.130.210.260.260.18相对于未经处理对照的倍数变化(对照=1.0)实施例12:水稻种子中的ARF-8靶基因沉默水稻种子采用实施例1所述方案处理,将种子洗涤4小时,在20℃下干燥过夜,并立即用66.2μg/ml的ARF-8dsRNA浓度在15℃下处理42小时。在萌发后18天,对从对照和ARF-8dsRNA处理的水稻种子中提取的RNA进行RT-PCR,以测定ARF-8靶基因的表达水平(参见表17)。如表18和表19所示成功实现了基因的下调。表17:用于玉米中ARF-8dsRNA分子的RT-PCR的引物和ARF-8dsRNA产物表18:在萌发后18天用ARF-8dsRNA(mir167的靶)处理的水稻种子。相对于未经处理对照的倍数变化(对照=1.0)表19:在萌发后18天用ARF-8dsRNA(mir167的靶)处理的水稻种子植物对照EM49194EM49196EM49198EM49200EM49201EM493203EM49204EM49206EM49209倍数变化1.00.440.880.450.220.260.120.060.310.92相对于未经处理对照的倍数变化(对照=1.0)实施例13:水稻种子中的SPL17靶基因沉默水稻种子采用实施例1所述方案处理,将种子洗涤4小时,在20℃下干燥过夜,并立即用200μg/ml的SPL17dsRNA浓度在15℃下处理41小时(对于SPL17dsRNA序列参见表20)。在处理后5天萌发的对照和SPL17dsRNA处理的水稻种子不显示任何可见的差异。从这些萌发种子的5日龄嫩枝中提取RNA,运行RT-PCR,以测定对照和经处理植物组中的SPL17表达水平。测试了位于dsRNA分子不同区域的两个不同的引物组(参见表20)(表21)。当对从14周龄植物中提取的RNA运行RT-PCR时,与对照植物相比,以高效率实现处理植物中SPL17mRNA表达的下调(表22)。表20:用于萌发后5天水稻种子中的SPL17dsRNA分子的RT-PCR的引物。表21:在萌发后5天用SPL17dsRNA(mir156的靶)处理的水稻种子。植物对照EM47708EM47709EM47710EM47711EM47712引物组111.423.1411.972.339.01引物组21.76.921.69.84相对于未经处理对照的倍数变化(对照=1.0)表22:在萌发后14周用SPL17dsRNA(mir156的靶)处理的水稻种子植物对照EM49502EM49503EM49511EM49513EM49515EM49517EM49519倍数变化1.00.0850.1410.270.3370.2750.1290.321相对于未经处理对照的倍数变化(对照=1.0)实施例15:用互补dsRNA/siRNA对微小RNA靶基因的沉默通过靶基因特异性dsRNA的转录后基因沉默的高特异性和效率已成为产生优选表型真核生物的优选方法,其中一种或多种基因的表达降低或失活。设计使玉米(Zeamays)和水稻(Oryzasative)微小RNA靶基因沉默的特定dsRNA序列。具体地说,将使用显示与非生物胁迫耐受性改进有关的微小RNA。下表23提供采用PCR扩增产生的靶基因序列的几个实例,以测试其各自的dsRNA/siRNA混合物的基因沉默能力。然后将使用这些dsRNA分子以敲减选定靶基因的内源水平。表23:靶基因序列和PCR的引物。序列名称生物SEQIDNOmiR169/NFY-A3玉米76miR169/NFY-A3frwd人工序列77miR169/NFY-A3rev人工序列78miR169/NFY-A3frwd人工序列79miR169/NFY-A3rev人工序列80HAP2水稻81HAP2frwd人工序列82HAP2rev人工序列83HAP2frwd人工序列84HAP2rev人工序列85miR156/SPL17水稻86miR156/SPL17frwd人工序列87miR156/SPL17rev人工序列88miR156/SPL17frwd人工序列89miR156/SPL17rev人工序列90miR156/SBP-A3HQ858696.1玉米91miR156/SBP-A3frwd人工序列92miR156/SBP-A3rev人工序列93miR156/SBP-A3frwd人工序列94miR156/SBP-A3rev人工序列95miR164/NACNM_001064881.1水稻96miR164/NACfrwd人工序列97mir164/NACrev人工序列98miR164/NACfrwd人工序列99mir164/NACrev人工序列100NAC5NM_001154298.1玉米101NAC5frwd人工序列102NAC5rev人工序列103NAC5frwd人工序列104NAC5rev人工序列105实施例16:番茄种子中的ARF-8基因沉默番茄种子采用实施例1所述方案处理,未经洗涤的种子用200μg/ml的ARF-8dsRNA浓度在15℃下处理24小时,并立即种植在土壤中。在处理后3和8周,采用RT-PCR检查基因的表达水平(参见表25)。处理后3周,在dsRNA处理的植物中实现了表达的变化(表24)。表24:在萌发后3周和8周用ARF-8dsRNA(mir167的靶)处理的番茄种子。植物对照EM49933EM49950EM49951EM499523周1.00.60.60.50.8植物EM49953EM49954EM49955EM499573周0.80.50.60.9植物对照EM50374EM50377EM50378EM503798周1.00.970.680.980.68植物EM50381EM50383EM50398EM50399EM504028周0.600.690.470.990.47相对于未经处理对照的倍数变化(对照=1.0)与对照植物相比,用对ARF8基因特异的dsRNA分子处理的植物显示表型差异。在不同的时间点(55、62和72天)观察到这种表型差异,并通过高度降低来证实(图5A-C)。虽然对照植物的平均高度约为36cm,但dsRNA处理的植物平均高度为约30cm(图5D)。除了其高度降低(垂直发育延迟)以外,与对照植物相比,dsRNA处理的植物似乎具有较多分枝(水平发育提高)。因此,在处理后55和72天,相对于其对照对应物,用对ARF8有特异性的dsRNA处理的植物显得较矮和较多分枝。表25:用于番茄中ARF-8dsRNA分子的RT-PCR的引物和ARF-8dsRNA产物。实施例17:番茄种子中的FW2.2基因沉默番茄种子采用实施例1所述方案处理,未洗涤的种子用100μg/ml的FW2.2dsRNA浓度在15℃下处理24小时,并立即种植在土壤中。在萌发后9周,采用RT-PCR检查基因的表达水平(引物列于表26中)。与对照植物相比,在dsRNA处理植物中检出FW2.2的表达水平降低将近2倍(图6)。虽然如此,与对照植物相比,用对FW2.2基因有特异性的dsRNA分子处理的植物不显示表型差异,排除了毒性作用作为在实施例15中观察到的表型作用的备选解释。在处理后72天,植物呈现类似的高度和外观。表26:用于番茄中FW2.2dsRNA分子的RT-PCR的引物和FW2.2dsRNA产物。实施例17:水稻中的DELLA基因下调导致萌发种子的根较发达水稻种子采用实施例1所述方案处理,将种子洗涤4小时,在室温下干燥24小时,并立即用66μg/ml的DELLAdsRNA浓度在15℃下直接36小时。水稻种子用针对Della基因的dsRNA处理(参见表28),Della基因是已知的植物生长阻遏物。具有突变型Della基因的拟南芥幼苗较大,具有较长的根系(Josse,E.M.,Gan,Y.,Bou-Torrent,J.,Stewart,K.L.,Gilday,A.D.,Jeffree,C.E.,Vaistij,F.E.,Martínez-García,J.F.,Nagy,F.,Graham,I.A.和Halliday,K.J.(2011),ADELLAindisguise:SPATULArestrainsthegrowthofthedevelopingArabidopsisseedling(伪装中的DELLA:SPATULA抑制发育中的拟南芥幼苗的生长).PlantCell23:1337-1351)。图7显示使用dsRNA种子处理的拟南芥表型的活象,与对照幼苗相比,经处理的幼苗较大,根较长。实施例18:水稻中的NRR基因下调导致萌发种子的根和嫩枝较发达水稻种子采用实施例1所述方案处理,将种子洗涤4小时,在室温下干燥24小时,并立即用约4μg/ml的NRRdsRNA浓度在15℃下处理36小时。水稻种子用针对NRR基因的dsRNA处理,发现NRR基因因响应水稻中的大量营养素而调节根生长(Zhang等人,2012,MolPlant5(1):63-72)。具有使用RNAi降低的NRR水平的转基因水稻幼苗显示当在氮限制条件下生长时具有较长的根。图8显示使用dsRNA种子处理的该表型的活象,与对照幼苗相比,所得的经处理的幼苗较大,并具有较长的根。表27:水稻中NRRdsRNA分子的产物。实施例19:3种内源基因的同时沉默在本实施例中,测试了同时使3种基因沉默的作用。水稻种子采用实施例1所述方案处理,将种子洗涤4小时,在室温下干燥过夜,立即用含有针对以下3种基因的dsRNA的混合物(152.3μg/ml终浓度)的溶液在15℃下处理42小时:Hap2e(59.9μg/ml,参见表28)、Della(44μg/ml,参见下表28)和SQS(48.4μg/ml,参见下表28)。在萌发后18天,从萌发种子的嫩枝中提取RNA,对3种基因的每一种运行RT-PCR(参见下表28)。如表29可见,所有3种基因的下调是非常有效的,经处理的植物显示每个单独基因表达的不同量的降低,范围从最小降低10%到基因完全沉默(等于100%下调)。表28:用于Hap2e、Della和SQS基因的表达水平的RT-PCR分析的引物和dsRNA产物。表29:在萌发后18天,水稻种子中表达的同时敲减。RNA对照EM49174EM49175EM49177EM49178EM49179EM49180Hap2e1.00.190.200.530.880.280.14Della1.00.140.100.471.000.420.10SQS1.00.150.010.230.710.420.27RNAEM49181EM49183EM49184EM49185EM49186EM49187EM49188Hap2e0.060.270.920.240.270.290.37Della0.010.140.600.270.290.370.16SQS0.560.080.870.490.090.130.10相对于未经处理对照的倍数变化(对照=1.0)实施例20:用于使植物病原体靶基因沉默的dsRNA分子的产生。使用BLAST搜索,用以下参数,针对玉米和番茄基因组(分别是图9和10)分析编码棉贪夜蛾基因的dsRNA:期望阈值–10;字长–11;匹配/错配分值2,-3;空位成本:存在:5延伸:2;查询范围中的最大匹配:0。针对满足本发明教导的玉米(Zeamays-taxid:4577)和番茄(Solanumlycopersicumtaxid:4081)序列的数据库进行BLAST搜索。实施例21:针对棉贪夜蛾NADPH基因的种子处理按照实施例1所述方案,将玉米种子(变种01DKD2)用dsRNA分子(SEQIDNo.26)处理,所述dsRNA分子具有与棉贪夜蛾NADPH基因的至少18个连续核苷酸基本相同或与其基本互补的核苷酸序列。使用用0.1mMEDTA稀释的终浓度80µg/mldsRNA。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达3.5小时,来进行处理。处理后,将种子种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用GFPdsRNA(SEQIDNo.124)或用不含dsRNA的类似溶液(EDTA对照)处理的种子,与经处理的植物一起萌发和生长,作为对照。种子处理后28天,将经处理的和对照植物的叶放入培养皿并用作棉贪夜蛾的唯一食物来源。对于每一植物,用15条幼虫(5条幼虫/板,三个板/植物)。测试来自各种子处理(NADPH、GFP和EDTA)的5个植物。按需要补充新叶。开始饲喂后12天记录每条幼虫的体重并用作其健康和生存力的指示器。相比饲喂对照植物的幼虫,观察到对饲喂NADPHdsRNA-处理的植物的幼虫体重的显著(单侧ANOVA,p-值=8.36x10-5)负面作用。参见表30。饲喂NADPH-处理的植物的幼虫的平均重量比分别饲喂GFP和EDTA-处理的植物的幼虫的平均重量低23%和20%。表30:饲喂经处理的植物12天后棉贪夜蛾的平均重量(mg)。样品12345平均标准差EDTA40.846.745.338.947.143.83.7GFP42.94147.348.949.245.93.7sI-NADPH#138.526.832.535.243.235.26.2种子处理后73天,将经处理的和对照植物的叶再次用作棉贪夜蛾的唯一食物来源。饲喂实验中包括来自各组的5个植物。将各植物的叶放入5个培养皿中,每皿含有5条幼虫,每一植物共25条幼虫,每组共125条幼虫。进入实验7天时,在EDTA对照组发现不寻常的大量幼虫死亡。因为对照组中的大量死亡,所以dsRN种子处理后73天收集的饲喂植物组织对棉贪夜蛾健康和生存力的作用未做进一步分析。测定了饲喂自用靶向NADPH或GFP的dsRNA分子处理的种子长出的植物(种子处理后28天)的幼虫亚组的NADPH表达水平。表31:从中提取RNA的幼虫。自幼虫提取总RNA并使用寡-dT引物制备cDNA,并通过用SYBRGreen(QuantaBioSciences)的实时PCR(RT-PCR),使用持家基因肌动蛋白和EF1α作为归一化子,在经处理的和对照幼虫中测定棉贪夜蛾NADPHmRNA表达水平。RT-PCR分析中使用的引物序列见表32。表32:用于对NADPH表达水平的RT-PCR分析的引物。引物名称和方向引物序列SEQIDNo.NADPH_FATGGCTGTTGACGTAAGG125NADPH_RTGCAGCTTCAGCTTCTGTG126EF1α_FACCGTCGTACTGGTAAATCC127EF1α_RTGGCGGCATCTCCAGATTTG128肌动蛋白_FCTGGTCGTACCACCGGTAT129肌动蛋白_RGCAGAGCGTAACCTTCGTAG130通过RT-PCR分析,在饲喂自用靶向NADPH或GFP的dsRNA分子处理的种子长出的植物(种子处理后28天)的幼虫中,未观察到NADPH表达水平的显著改变(Wilcoxon秩和检验,p-值>0.05)。实施例22:针对棉贪夜蛾ATP酶基因的种子处理按照实施例1所述方案,将玉米种子用dsRNA分子处理,所述dsRNA分子与棉贪夜蛾ATP酶基因(SEQIDNo.31)的至少18个连续核苷酸基本相同或与其基本互补的核苷酸序列。简而言之,在处理之前,将种子用双蒸水(DDW)洗涤4小时。接下来,将种子在30℃干燥过夜。在干燥步骤后,使用用0.1mMEDTA稀释的终浓度为53µg/ml的dsRNA。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达26小时,来进行处理。处理后,将种子在湿纸上萌发7天,然后种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用不含dsRNA的类似溶液处理的种子与经处理的植物一起萌发和生长,作为对照(EDTA对照)。种子处理后43天,将经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。植物编号1用作放入130x170mm盒的20条幼虫的食物来源。植物编号2用作放入124x95mm盒的15条幼虫的食物来源。植物编号3用作放入培养皿的8条幼虫的食物来源。所有盒和板表面都覆盖蛭石,并按需要补充新叶。实验全程跟踪幼虫的死亡率和体重。图11A显示死亡率,图11B显示开始饲喂后8天的活的棉贪夜蛾幼虫的平均重量。尽管饲喂自ATP酶dsRNA处理的种子长出的植物1和3的幼虫得到可比重量并显示出类似于对照组的死亡率,但饲喂自ATP酶dsRNA处理的种子长出的植物编号2的幼虫几乎为对照组大小的1/3小,其具有更高死亡率。为了测试dsRNA种子处理的作用的持久性,种子处理后85天收集植物编号2的叶并用作棉贪夜蛾的唯一食物来源。在3个培养皿中使用总共15条幼虫,所述培养皿各含有5条幼虫。图11C显示开始实验后3天的死幼虫的百分率。在ATP酶dsRNA-处理的组中,15条幼虫中有12条死亡,而在对照组中未见死幼虫。进一步测试dsRNA种子处理的作用的持久性,这通过在种子处理后91天收集植物编号1和2的叶,并使用所述叶作为棉贪夜蛾的唯一食物来源来进行。给在3个培养皿(各含有5条幼虫)中的总共15条幼虫饲喂每种植物。实验进入4天时,两组也都饲喂植物编号3。图11D显示与对照组相比开始饲喂后7天的死幼虫百分率。实施例23:针对棉贪夜蛾ATP酶、IAP和NADPH基因的种子处理描述于本实施例的植物用具有以下核苷酸序列的dsRNA分子处理,并且是实施例7中所述的相同植物,所述核苷酸序列与棉贪夜蛾ATP酶、IAP或NADPH基因的至少18个连续核苷酸基本相同或与其基本互补。种子处理后67天,实施例7所述的经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。来自每一处理的一个植物用作放入培养皿的10条幼虫的食物来源。板的表面用蛭石覆盖。图12显示饲喂7天后的死幼虫的百分率。实施例24:针对棉贪夜蛾EF1α基因的种子处理按照实施例1所述方案,将玉米种子用具有以下核苷酸序列的dsRNA分子处理,所述核苷酸序列与棉贪夜蛾EF1α基因的至少18个连续核苷酸基本相同或与其基本互补(表33)。简而言之,在处理之前,将玉米种子用双蒸水(DDW)洗涤4小时。接下来,将种子在30℃干燥过夜。在干燥步骤后,使用用0.1mMEDTA稀释的终浓度为132µg/ml的dsRNA。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达26小时,来进行处理。处理后,将种子在湿纸上萌发7天,然后种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用不含dsRNA的类似溶液处理的种子与经处理的植物一起萌发和生长,作为对照(EDTA对照)。表33:衍生自棉贪夜蛾EF1α基因的dsRNA。种子处理后43天,将经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。植物编号1用作放入130x170mm盒的20条幼虫的食物来源。植物编号2用作放入124x95mm盒的15条幼虫的食物来源。植物编号3用作放入培养皿的8条幼虫的食物来源。所有盒和板表面都覆盖蛭石,并按需要补充新叶。实验全程跟踪幼虫的死亡率和体重。饲喂实验开始后8天,在EF1α处理组中发现43条幼虫中有8条死亡,在对照组中43条幼虫有3条死亡。图13A显示开始饲喂后8天的活的棉贪夜蛾幼虫的平均重量。种子处理后87天,植物编号2和3的叶第二次用作棉贪夜蛾的唯一食物来源。总共15条幼虫,在3个培养皿中(各含有5条幼虫),饲喂每个EF1α-处理的植物,并饲喂2个对照植物(植物编号3和6)。图13B显示实验开始后5天的死幼虫的百分率。实施例25:针对棉贪夜蛾β肌动蛋白基因的种子处理按照实施例1所述方案,将玉米种子用具有以下核苷酸序列的dsRNA分子处理,所述核苷酸序列与棉贪夜蛾β肌动蛋白基因的至少18个连续核苷酸基本相同或与其基本互补(表34)。在处理之前,将种子用双蒸水(DDW)洗涤4小时。接下来,将种子在30℃干燥过夜。在干燥步骤后,使用用0.1mMEDTA稀释的终浓度为76µg/ml的dsRNA。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达26小时,来进行处理。处理后,将种子在湿纸上萌发7天,然后种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用不含dsRNA的类似溶液处理的种子与经处理的植物一起萌发和生长,作为对照(EDTA对照)。表34:衍生自棉贪夜蛾β肌动蛋白基因的dsRNA。种子处理后43天,将经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。植物编号1用作放入130x170mm盒的20条幼虫的食物来源。植物编号2用作放入124x95mm盒的15条幼虫的食物来源。植物编号3用作放入培养皿的8条幼虫的食物来源。所有盒和板表面都覆盖蛭石和按需要补充新叶。实验全程跟踪毛虫的死亡率和体重。饲喂实验开始后8天,在β-肌动蛋白处理组和对照组中均发现43条幼虫中有3条死亡。图14显示开始饲喂后8天的活的棉贪夜蛾幼虫的平均重量。实施例26:针对棉贪夜蛾NADPH基因的种子处理按照实施例1所述方案,将玉米种子用具有以下核苷酸序列的dsRNA分子(SEQIDNo.26)处理,所述核苷酸序列与棉贪夜蛾NADPH基因的至少18个连续核苷酸基本相同或与其基本互补。简而言之,在处理之前,将种子用双蒸水(DDW)洗涤4小时。接下来,将种子在30℃干燥过夜。在干燥步骤后,使用用0.1mMEDTA稀释的终浓度为154µg/ml的dsRNA。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达26小时,来进行处理。处理后,将种子在湿纸上萌发7天,然后种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用不含dsRNA的类似溶液处理的种子与经处理的植物一起萌发和生长,作为对照(EDTA对照)。种子处理后43天,将经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。植物编号1用作放入130x170mm盒的20条幼虫的食物来源。植物编号2用作放入124x95mm盒的15条幼虫的食物来源。植物编号3用作放入培养皿的8条幼虫的食物来源。所有盒和板表面都覆盖蛭石,并按需要补充新叶。实验全程跟踪幼虫的死亡率和体重。饲喂实验开始后8天,在NADPH处理组和对照组中均发现43条幼虫中有3条死亡。图15A显示开始饲喂后8天的活的棉贪夜蛾幼虫的平均重量。种子处理后91天,植物编号2的叶第二次用作棉贪夜蛾的唯一食物来源。总共15条幼虫,在3个培养皿中(各含有5条幼虫),饲喂NADPH-处理的植物。额外的15条幼虫,在3个培养皿中(各含有5条幼虫),饲喂对照植物。图15B显示实验开始后7天的死幼虫的百分率。在NADPH-处理组中,15条幼虫中有9条死亡,而在对照组中,15条幼虫中有2条死亡。实施例27:针对棉贪夜蛾IAP、ATP酶和NADPH基因的种子处理按照实施例1所述方案,将玉米种子用具有以下核苷酸序列的dsRNA分子(SEQIDNo.34)处理,所述核苷酸序列与棉贪夜蛾IAP基因的至少18个连续核苷酸基本相同或与其基本互补;或将玉米种子用含有具有以下核苷酸序列的dsRNA混合物(SEQIDNo.34、25、26和31)的溶液处理,所述核苷酸序列与棉贪夜蛾IAP、NADPH和ATP酶基因的至少18个连续核苷酸基本相同或与其基本互补。这两种溶液先用于实施例7所述的种子处理,然后再用于在此所述的实验中。在处理之前,将种子用双蒸水(DDW)洗涤4小时。接下来,将种子在30℃干燥过夜。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达24小时,来进行处理。处理后,将种子在30℃干燥过夜,种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用不含dsRNA的类似溶液(EDTA)处理的种子与经处理的植物一起萌发和生长,作为对照。种子处理后27天,将经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。总共24条幼虫,在3个培养皿中(各含有8条幼虫),用于每一处理。来自IAP处理的一个重复含有9条幼虫。每个重复饲喂一个植物,并且实验进入3天时,将来自相同处理的第二植物加入板中。实验全程跟踪毛虫的死亡率和体重。图16A-B显示饲喂实验开始后6天的活的棉贪夜蛾幼虫的平均重量。实施例28:针对棉贪夜蛾EF1α基因的种子处理按照实施例1所述方案,将玉米种子用具有以下核苷酸序列的两种dsRNA分子处理,所述核苷酸序列与棉贪夜蛾EF1α基因的至少18个连续核苷酸基本相同或与其基本互补(表33)。简而言之,在处理之前,将种子用双蒸水(DDW)洗涤4小时。接下来,将种子在30℃干燥过夜。两种dsRNA序列(SEQIDNo.131和SEQIDNo.132)分别用于两种不同的种子处理;各自以用0.1mMEDTA稀释的终浓度67µg/mldsRNA使用。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达24小时,来进行处理。处理后,将种子在30℃干燥过夜,然后种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。用具有与玉米DWF1基因的至少18个连续核苷酸基本相同或与其基本互补的核苷酸序列(表35)的dsRNA分子(44µg/ml对于DWF1#1(SEQIDNo.134)和51µg/ml对于DWF1#2(SEQIDNo.135))处理的种子,与经处理的植物一起萌发和生长,作为两种单独的对照。表35:衍生自玉米DWF基因的对照dsRNA。种子处理后35天,将经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。饲喂实验中包括来自每一处理和来自DWF1#1对照的2种植物。将各植物的叶放入2个培养皿中,每皿含有10条幼虫,共有40条幼虫饲喂各种子处理。实验全程跟踪幼虫的死亡率和体重。饲喂实验开始后9天,在EF1α#2处理组和在对照组中发现40条幼虫中有4个死亡。在EF1α#1处理组中发现40条幼虫中有6个死亡。图17A显示饲喂实验开始后9天的活的棉贪夜蛾幼虫的平均重量。种子处理后36天,将来自相同EF1α#1和DWF1#1种子处理的其它植物用作棉贪夜蛾的唯一食物来源。饲喂实验中包括来自处理的15个植物。将各植物的叶放入3个培养皿中,每皿含有5条幼虫,每一植物共15条幼虫,总共225条幼虫。实验进入2天时,植物编号15替换为植物编号8。饲喂实验中包括来自对照组的2个植物。将各对照植物的叶放入3个培养皿中,每皿含有5条幼虫,每一植物共15条幼虫,总共30条幼虫。实验全程跟踪幼虫的体重。图17B显示饲喂5天后棉贪夜蛾幼虫的平均重量。种子处理后71天,将EF1α#2处理的和DWF1#2对照植物的叶用作棉贪夜蛾的唯一食物来源。饲喂实验中包括来自处理的10个植物,其中第二次测试2个植物(参见图17A)和第一次测试8个植物。将各植物的叶放入3个培养皿中,每皿含有5条幼虫,每一植物共15条幼虫,总共150条幼虫。饲喂实验中包括先前未测试的来自对照组的2个植物。将各对照植物的叶放入3个培养皿中,每皿含有5条幼虫,每一植物共15条幼虫,总共30条幼虫。实验进入8天时,在处理和对照组均发现不寻常的大量幼虫死亡。因此,对该时间点未做进一步分析。实施例29:针对棉贪夜蛾ATP酶基因的种子处理按照实施例1所述方案,将玉米种子用具有以下核苷酸序列的dsRNA分子(SEQIDNo.31)处理,所述核苷酸序列与棉贪夜蛾ATP酶基因的至少18个连续核苷酸基本相同或与其基本互补。简而言之,在处理之前,将种子用双蒸水(DDW)洗涤4小时。接下来,将种子在30℃干燥过夜。在干燥步骤后,使用用0.1mMEDTA稀释的终浓度为145µg/ml的dsRNA。dsRNA溶液含有如实施例1所述的未经处理的dsRNA分子和苯酚处理的dsRNA分子的混合物。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达24小时,来进行处理。处理后,将种子在30℃干燥过夜,然后种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用衍生自GUS序列的67µg/mldsRNA(SEQIDNo.20)处理的种子与经处理的植物一起萌发和生长,作为对照。种子处理后56天,将经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。饲喂实验中包括来自处理的10个植物。将各植物的叶放入3个培养皿中,每皿含有5条幼虫,除了将植物编号3和14一起放入同一板中之外。测试每一植物的共15条幼虫,总共135条幼虫。饲喂实验中包括来自对照组的2个植物。将各对照植物的叶放入3个培养皿中,每皿含有5条幼虫,每一植物共15条幼虫,总共30条幼虫。饲喂12天后,在ATP酶处理组中发现135条幼虫中有12条死亡,在对照组中30条幼虫有21条死亡。图18A显示开始实验后12天的死幼虫的百分率。种子处理后57天,将来自相同处理的和对照组的其它植物用作棉贪夜蛾的唯一食物来源。饲喂实验中包括来自处理的14个植物。将各植物的叶放入3个培养皿中,每皿含有5条幼虫,但将植物编号13和4一起放入同一板中,并将植物编号10和19一起放入同一板中(第二次分析植物4和10,参见图18A)。测试每一植物的共15条幼虫,总共180条幼虫。饲喂实验中包括来自对照组的2个植物。将各对照植物的叶放入3个培养皿中,每皿含有5条幼虫,每一植物共15条幼虫,总共30条幼虫。开始饲喂后4天,在ATP酶处理组中发现180条幼虫中有29条死亡,在对照组中30条幼虫有29条死亡。图18B显示开始实验后4天的死幼虫的百分率。实施例30:针对棉贪夜蛾EF1α基因的种子处理按照实施例1所述方案,将玉米种子(变种Vivani)用具有以下核苷酸序列的dsRNA分子(SEQIDNo.131和132)处理,所述核苷酸序列与棉贪夜蛾EF1α基因的至少18个连续核苷酸基本相同或与其基本互补。使用两种dsRNA各25µg/ml的混合物。dsRNA或单用0.1mMEDTA稀释,或用额外与40µg/mlPEG-修饰的碳纳米管(CNTP)混合的0.1mMEDTA稀释。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达4小时,来进行处理。处理后,将种子种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用衍生自GFP序列的50µg/mldsRNA(SEQIDNo.124)、或用不含dsRNA(有或无40µg/mlPEG-修饰的碳纳米管)的类似溶液处理的种子,与经处理的植物一起萌发和生长,作为对照。种子处理后24天,将经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。饲喂实验中包括来自EF1α处理组的10个植物,来自GFP对照的2个植物,来自EDTA对照的1个和来自EDTA/CNTP对照的1个植物。将各植物的叶放入3个培养皿中,每皿含有5条幼虫,每一植物共15条幼虫,150条幼虫用于EF1α处理,30条幼虫用于GFP对照,和15条用于两个EDTA对照)。图19A显示饲喂10天后的棉贪夜蛾幼虫的平均重量。种子处理后25天,将经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。饲喂实验中包括来自EF1α/CNTP处理组的13个植物,来自GFP/CNTP对照的2个植物,来自EDTA/CNTP对照的1个植物和来自EDTA对照的1个植物。将各植物的叶放入3个培养皿中,每皿含有5条幼虫,每一植物共15条幼虫,但EF1α/CNTP组中的植物9除外,其中仅分析了2个板。测试了总共190条幼虫(对于EF1α/CNTP处理),30条幼虫(对于GFP/CNTP对照),和15条幼虫(对于两个EDTA对照)。饲喂实验进入7天时,EF1α/CNTP组的植物1替换为相同组的植物6。图19B显示饲喂10天后的棉贪夜蛾幼虫的平均重量。为了测定饲喂经处理植物10天后的幼虫中的EF1α表达水平,将5条幼虫的每一重复(板)合并在一起,提取总RNA。使用寡-dT引物(SEQIDNo.136-143)制备cDNA,并通过使用SYBRGreen(QuantaBioSciences)的实时PCR,使用肌动蛋白和ATP酶作为归一化子,在经处理的和对照幼虫中测定棉贪夜蛾EF1αmRNA表达水平。未观察到EF1α表达水平的显著改变(Wilcoxon秩和检验,p-值>0.05)。种子处理后61天,将经处理的和对照植物的叶再次用作棉贪夜蛾的唯一食物来源。饲喂实验中包括来自EF1α/CNTP处理组的13个植物和来自GFP/CNTP对照的3个植物。第一次测试了来自EF1α/CNTP组的一些植物并对一些第二次测试(参见图19B)。。第一次测试了来自GFP/CNTP对照的3个植物。将各植物的叶放入3个培养皿中,每皿含有5条幼虫,每一植物共15条幼虫,但EF1α/CNTP组中的植物8除外,其中仅分析了2个板。测试了总共190条幼虫(对于EF1α/CNTP处理)和45条幼虫(对于GFP/CNTP对照)。实验进入12天时,在处理和对照组均发现不寻常的大量幼虫死亡。因此,对该时间点不做进一步分析。实施例31:针对棉贪夜蛾EF1α基因的种子处理按照实施例1所述方案,将玉米种子(变种01DKD2)用具有以下核苷酸序列的dsRNA分子(SEQIDNo.131和132)处理,所述核苷酸序列与棉贪夜蛾EF1α基因的至少18个连续核苷酸基本相同或与其基本互补。使用两种dsRNA各25µg/ml的混合物。dsRNA或单用0.1mMEDTA稀释,或用额外与40µg/mlPEG-修饰的碳纳米管(CNTP)混合的0.1mMEDTA稀释。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达4小时,来进行处理。处理后,将种子种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用衍生自GUS序列的50µg/mldsRNA(SEQIDNo.20)(有或无40µg/mlPEG-修饰的碳纳米管)处理的种子,与经处理的植物一起萌发和生长,作为对照。种子处理后8天,将经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。饲喂实验中包括来自EF1α处理的13个植物,来自EF1α/CNTP的13个植物,来自GUS对照的10个植物,和来自GUS/CNTP对照的4个植物。将各植物的叶放入覆盖有1%琼脂的2个培养皿中。每板含有3条幼虫,每一植物共6条幼虫,78条幼虫用于EF1α和EF1α/CNTP处理,60条幼虫用于GFP对照和24条用于GUS/CNTP对照。饲喂4天后记录幼虫体重。图20A-B显示对照和处理组中的棉贪夜蛾幼虫的平均重量。实施例32:针对棉贪夜蛾IAP、ATP酶和NADPH基因的种子处理对于棉贪夜蛾对照,进一步检查自实施例7所述的番茄种子长出的番茄植物,所述种子用具有以下核苷酸序列的dsRNA分子(SEQIDNo.34、35、25和26)处理,所述核苷酸序列与棉贪夜蛾IAP基因、ATP酶基因或NADPH基因的至少18个连续核苷酸基本相同或与其基本互补。种子处理后48天,将经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。来自各处理的一个植物用作放入培养皿的7条幼虫的食物来源。所有板表面用蛭石覆盖。实验全程跟踪幼虫的死亡率和体重。实验进入3天时,在IAP处理组中发现一条幼虫死亡,在MIX处理组中发现2条幼虫死亡。接下来几天直到第7天,没有发生更多死亡。图21显示饲喂3天和7天后的活的棉贪夜蛾幼虫的平均重量。实施例33:针对棉贪夜蛾β肌动蛋白、ATP酶和NADPH基因的种子处理按照实施例1所述方案,将番茄种子用具有以下核苷酸序列的dsRNA分子(SEQIDNo.133、31、25和26)处理,所述核苷酸序列与棉贪夜蛾β肌动蛋白基因(参见表34)、ATP酶基因或NADPH基因的至少18个连续核苷酸基本相同或与其基本互补。使用用0.1mMEDTA稀释的终浓度96µg/mldsRNA(对于β肌动蛋白),73µg/mldsRNA(对于ATP酶)和164µg/mldsRNA(对于NADPH)。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达26小时,来进行处理。处理后,让种子在土壤中萌发并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用不含dsRNA的类似溶液(EDTA)处理的种子与经处理的植物一起萌发和生长,作为对照。种子处理后42天,将经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。使用来自β肌动蛋白和ATP酶处理的植物编号1和2,和来自NADPH处理的植物编号21和23。将各处理的植物用作放入培养皿的5条幼虫的食物来源。所有板的表面用蛭石覆盖。实验全程跟踪幼虫的体重。图22显示饲喂4天后的棉贪夜蛾幼虫的平均重量。实施例34:针对棉贪夜蛾ATP酶基因的种子处理本实施例所述的番茄植物起源于用以上实施例33所述的ATP酶dsRNA处理的种子。种子处理后85天,将实施例33所述的经处理的和对照植物的叶再次用作棉贪夜蛾的唯一食物来源。使用来自ATP酶处理的1个植物和来自对照的1个植物。将来自这些植物的叶放入3个培养皿中,各培养皿含有5条幼虫。实验进入3天时,将来自处理的另一植物和来自对照的另一植物加入其各自的板中。实验全程跟踪幼虫体重。因为在饲喂实验开始时,饲喂对照组的幼虫比饲喂处理的幼虫小30%,记录相对于其起始重量的幼虫重量。图23A显示饲喂6天后的棉贪夜蛾幼虫的相对重量。种子处理后88天,来自相同种子处理的其它植物用作棉贪夜蛾的唯一食物来源。使用来自ATP酶处理的3个植物和来自对照的2个植物。将来自这些植物的叶放入3个培养皿中,各培养皿含有5条幼虫。实验全程跟踪幼虫的死亡率和体重。饲喂5天后,在ATP酶和对照组中分别发现15条虫子中有4条和15条虫子中有1条死亡。图23B显示饲喂5天后的活的棉贪夜蛾幼虫的平均重量。实施例35:针对棉贪夜蛾NADPH基因的种子处理本实施例所述的番茄植物起源于用以上实施例33所述的NADPHdsRNA处理的种子。种子处理后95天,将经处理的和对照植物的叶用作棉贪夜蛾的唯一食物来源。使用来自NADPH处理的2个植物(先前未测试)和来自对照的一组植物。将来自这些植物的叶放入3个培养皿中,各培养皿含有5条幼虫。实验全程跟踪毛虫的体重。图24A显示饲喂4天后的棉贪夜蛾幼虫的平均重量。在第4天,将对照植物替换为自针对番茄基因AFR8而处理的种子萌发的植物。将这些种子用两种dsRNA序列(SEQIDNo.25和26)的混合物以终浓度200µg/ml(每种dsRNA各100µg/ml处理24小时。在第6天,将另一植物加入到2种NADPH处理的植物的每一种中。图24B显示在饲喂开始后7天的棉贪夜蛾幼虫的平均重量。实施例36:针对非棉贪夜蛾基因的种子处理本实施例所述的玉米植物起源于实施例28(DWF1dsRNA#2,SEQIDNO135)和实施例29(GUS,SEQIDNO20)所述的种子处理。种子处理后69天,将萌发植物的叶用作棉贪夜蛾的唯一食物来源。饲喂实验中包括来自DWF1dsRNA#2处理的2个植物和来自GUS处理的5个植物。将各植物的叶放入3个培养皿中,每皿各含有5条幼虫,每一植物共15条幼虫,30条幼虫用于DWF1dsRNA#2处理和75条幼虫用于GUS处理。实验进入10天时,在两种处理中都发现不寻常的大量幼虫死亡。因为两个处理组中的大量死亡,所以对该实验时间点不做进一步分析。种子处理后70天,将来自相同处理的其它植物用作棉贪夜蛾的唯一食物来源。饲喂实验中包括来自DWF1dsRNA#2处理的2个植物和来自GUS处理的16个植物。将各植物的叶放入3个培养皿中,每皿各含有5条幼虫,每一植物共15条幼虫,30条幼虫用于DWF1dsRNA#2处理和240条幼虫用于GUS处理。实验进入9天时,在两种处理中都发现不寻常的大量幼虫死亡。因为两个处理组中的大量死亡,所以对该实验时间点不做进一步分析。实施例37:针对棉贪夜蛾ATP酶、EF1α和NADPH基因的种子处理按照实施例1所述方案,没有处理前洗涤的情况下,将玉米种子(变种Vivani)用具有以下核苷酸序列的dsRNA分子(SEQIDNo.131、132、31、25和26)处理,所述核苷酸序列与棉贪夜蛾EF1α基因、ATP酶基因或NADPH基因的至少18个连续核苷酸基本相同或与其基本互补。分别使用两种EFIαdsRNA。使用用0.1mMEDTA稀释的终浓度为160µg/ml的dsRNA。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达2小时,来进行处理。处理后,将种子用DDW短暂洗涤,种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用衍生自GFP序列的160µg/mldsRNA(SEQIDNo.124)、或用不含dsRNA的类似溶液(EDTA)处理的种子与经处理的植物一起萌发和生长,作为对照。种子处理后31天,萌发的植物的叶用作棉贪夜蛾的唯一食物来源。用于本实验的幼虫至多5小时龄(即孵化后至多5小时)。饲喂实验中包括来自每一处理的6个植物。将各植物的叶放入24-孔板的16个孔中,每孔含有1条幼虫,每一植物共有16条幼虫,每一处理有96条幼虫。孔表面覆盖有1%琼脂糖。开始饲喂后8天,在ATP酶处理组中发现57条幼虫死亡,在NADPH处理组中发现42条幼虫死亡。其它组的死亡幼虫数量范围在13-23之间。在6个ATP酶处理的植物中的平均死亡幼虫数量显著高于6个GFP对照植物的平均死亡幼虫数量,p-值为0.03(t-检验)。同样,在NADPH处理植物中的平均死亡幼虫数量高于GFP对照植物中的平均死亡幼虫数量(t-检验,p-值=0.07)。图25A和B显示开始饲喂后8天的死幼虫的百分率。图25C和D显示开始饲喂后10天的死幼虫的百分率。图25E显示开始饲喂实验后11天的活的棉贪夜蛾幼虫的平均重量。种子处理后32天,将来自相同种子处理的其它植物用作棉贪夜蛾的唯一食物来源。用于本实验的幼虫至多24小时龄。饲喂实验中包括来自每一处理的5-7个植物。将各植物的叶放入24-孔板的16个孔中,每孔含有1条幼虫,每一植物共有16条幼虫,80条幼虫用于EDTA,96条幼虫用于GFP和ATP酶和112条幼虫用于NADPH和用于2种EF1α处理。孔表面覆盖有1%琼脂糖。开始饲喂后8和9天,记录幼虫体重;在第8天记录饲喂植物亚组的一些幼虫,在第9天记录剩余的幼虫。图25F显示每一植物的活的棉贪夜蛾幼虫的平均重量。实施例38:靶向鞘翅目害虫的种子处理本实施例说明了提供对鞘翅目害虫具有改良的抗性的植物的方法的非限制性实施方案,所述方法包括以下步骤:自种子长出植物,所述种子已经接触外源不可转录的dsRNA,其中相对于自未接触所述dsRNA的种子长出的植物,所述植物表现出对所述鞘翅目害虫的改良的抗性。更具体地讲,本实施例说明了提供对玉米根虫(叶甲属物种)具有改良的抗性的玉米植物的方法,所述方法包括以下步骤:自玉米种子长出玉米植物,所述种子已经接触经设计用于使玉米根虫内源靶基因沉默的至少一种dsRNA,其中自所述玉米种子萌发的玉米植物相对于自未接触所述dsRNA的玉米种子长出的玉米植物,表现出对玉米根虫的改良的抗性。在玉米根虫侵染测定中,在自萌发前接触dsRNA触发物的玉米种子长出的玉米植物中,测试了228bpdsRNA触发物,所述触发物具有以下有义链序列:GGCTGATAGCACTTAAGGAGCTTCCTAATCACGAAAGAATTCTGCAGGATTTAGTTATGGACATACTGAGAGTACTCTCTGCTCCTGACTTAGAAGTCCGCAAGAAGACTTTAAGTCTAGCCCTTGAATTAGTCTCTTCACGGAACATAGAAGAAATGGTATTAGTATTAACAAAGGAAGTGAGTAAAACGGTAGACAGTGAACATGAGGATACAGGAAAGTACAGGC(MON104454,SEQIDNo.:144)。将玉米种子(70个种子,变种LH244)放入50毫升Falcon管中,所述管中含有35毫升的在缓冲液中的dsRNA触发物溶液(0.1毫摩尔EDTA,自0.5摩尔pH8储备液稀释而来)或35毫升的仅仅缓冲液(作为空白对照),并在无光15℃处孵育并轻轻搅拌8小时。表达靶向DvSnf7的RNA抑制构建体并对玉米根虫具有抗性的转基因玉米植物的种子用于转基因阳性对照,和在萌发前类似地孵育在35毫升的仅仅缓冲液中。DvSnf7是来自玉米幼芽根叶甲(玉米幼芽根叶甲,WCR)的Snf7直向同源物并且是ESCRT-III复合体(转运所需的内体分拣复合体)的成分;参见Bolognesi等人(2012)PLoSONE7(10):e47534,doi:10.1371/journal.pone.0047534。翌日,在足够填充Falcon管的水中将种子洗涤3次(1分钟/洗涤并轻轻搅拌)。将经洗涤的种子以0.5英寸的深度种植在填充Metromix200土的6”闭合底部聚乙烯盆中。在所有处理中有大于85%的种子萌发。在V2/V3时期(种植后大约2周),将50个新生的玉米幼芽根叶甲幼虫加入到每个盆中(进行12–15个重复)。作为转基因阳性对照,使用表达重组Snf7转基因和同样用玉米幼芽根叶甲幼虫挑战的玉米植物。大约4周后,使用伯利斯漏斗(Berlesefunnel)分离幼虫,计数和称重。计算幼虫回收率和重量。结果见图26。在饲喂自用dsRNA触发物以50ppm(微克/毫升)处理的种子长出的玉米植物的幼虫和饲喂对照植物的幼虫之间,每一植物的幼虫回收率的差异不显著(图26A),但是相比饲喂对照植物的幼虫,在饲喂自用dsRNA触发物以50ppm(微克/毫升)处理的种子长出的玉米植物的幼虫中,总幼虫重量(图26B)和平均幼虫重量(图26C)明显减少。自用dsRNA触发物以500ppm处理的种子长出的植物表现出植物生长和根生长受阻,其可影响所观察的结果;然而,相比饲喂对照植物的幼虫,在饲喂自用dsRNA触发物以500ppm(微克/毫升)处理的种子长出的玉米植物的幼虫中,每一植物的幼虫回收率明显减少(图26A),和总幼虫重量(图26B)和平均幼虫重量(图26C)明显减少。在自用dsRNA触发物以500ppm处理的种子长出的玉米植物的叶或根组织中,Quantigene测定没有检测显著量的MON104454RNA。在自下列种子长出的番茄植物中进行类似实验,所述种子在萌发前通过在100ppm(微克/毫升)279bp平端dsRNA触发物中孵育过夜而进行处理并进行马铃薯甲虫(科罗拉多马铃薯甲虫,CPB)侵染测定;所述触发物具有以下有义链序列:TACCTGTGGCTCTCACAGGCAGCGAAGATGGTACCGTTAGAGTTTGGCATACGAATACACACAGATTAGAGAATTGTTTGAATTATGGGTTCGAGAGAGTGTGGACCATTTGTTGCTTGAAGGGTTCGAATAATGTTTCTCTGGGGTATGACGAGGGCAGTATATTAGTGAAAGTTGGAAGAGAAGAACCGGCAGTTAGTATGGATGCCAGTGGCGGTAAAATAATTTGGGCAAGGCACTCGGATTACAACAAGCTAATTTGAAGGCGCTGCCAGAAGG(T6593,SEQIDNo.:145)。对照植物用缓冲液(“制剂”)或绿色荧光蛋白(GFP)的dsRNA触发物处理。萌发率>90%和相比对照植物,对于经处理的植物未观察到对植物生长的明显影响。相比对照植物,对于用T6593dsRNA或GFPdsRNA处理的植物,未观察到对番茄植物落叶率(图27A)或活的幼虫回收率(图27B)或平均幼虫重量(图27C)的显著影响。在自用T6593dsRNA触发物以500ppm处理的种子长出的番茄植物的所分析的组织(嫩叶、老叶、子叶、根)中,Quantigene测定没有检测到显著量的T6593RNA。实施例39:靶向必需鞘翅目基因的种子处理本实施例说明了提供对鞘翅目害虫具有改良的抗性的植物的方法的非限制性实施方案,所述方法包括以下步骤:自种子长出植物,所述种子已经接触外源不可转录的dsRNA,其中相对于自未接触所述dsRNA的种子长出的植物,所述植物表现出对所述鞘翅目害虫的改良的抗性。更具体地讲,本实施例说明了提供对玉米根虫(叶甲属物种)具有改良的抗性的玉米植物的方法,所述方法包括以下步骤:自玉米种子长出玉米植物,所述种子已经接触经设计用于使玉米根虫内源靶基因沉默的至少一种多核苷酸触发物,其中自所述玉米种子萌发的玉米植物相对于自未接触多核苷酸触发物的玉米种子长出的玉米植物,表现出对玉米根虫的改良的抗性。产生对于表36中鉴定的靶基因的双链RNA(dsRNA)触发物。合适的触发物的长度是21-1,000个碱基对,在某些实施方案中,长度是21-50、50-100、100-200、200-500、500-700、或700-1,000个碱基对。表36中提供的触发物的长度介于173–504个碱基对之间,但更短或更长的触发物都可用于本文公开的方法。在用玉米幼芽根叶甲(玉米幼芽根叶甲,WCR)的食物生物测定中,测定了表36中提供的所有dsRNA触发物在10ppm和在0.1ppm时引起显著的幼虫萎缩和死亡率,所述生物测定如美国专利申请公布号2009/0307803的工作实施例中所述,其通过引用结合到本文中,其中将dsRNA触发物作为覆盖物递送到在96孔板中的固体昆虫食物表面上。表36:dsRNA触发物。触发物ID触发物长度(bp)靶基因靶基因的SEQIDNO.T33514501Croquemort146T33515502预测的:类似于ENSANGP00000020392147T33516500组织弹性酶L-样蛋白酶148T33519501未表征的保守蛋白149T30147502真核翻译起始因子3亚基,推定的150T30502501切割和聚腺苷酸化特异性因子亚基6151T32275502切割和聚腺苷酸化特异性因子亚基6152T32328504切割和聚腺苷酸化特异性因子亚基6153T30501501无脑回-1同源物154T30145502Wd-重复蛋白155T33520501钠依赖性磷酸转运蛋白156T30139502T-复合体蛋白1亚基δ157T30137502推定的未表征的蛋白158T32250502溶质载体家族2,促进葡萄糖转运蛋白成员6159T3013350126S蛋白酶体非ATP酶调节亚基,推定的160T30471501含WD重复的蛋白75161T30132501THO复合体亚基5样蛋白162T30469502另一转录单元蛋白163T30467502CG8315164T30466374推定的未表征的蛋白165T33522500E3遍在蛋白-蛋白连接酶UBR2166T30463502TMEM9域家族成员B167T30462501真核翻译起始因子2亚基1168T32319500真核翻译起始因子2亚基1169T30126502前mRNA-加工因子6170T32320496δ-氨基乙酰丙酸脱水酶171T30456502StAR-相关的脂质转运蛋白7172T3231649626S蛋白酶体非ATP酶调节亚基,推定的173T30117502推定的未表征的蛋白174T30112502通用转录因子IIF亚基2175T30423501增殖细胞核抗原176T32201502增殖细胞核抗原177T30420501仙人掌素178T30417501囊泡-运输蛋白SEC22b179T30106482推定的未表征的蛋白180T33528501Anon-15Ab181T30411502ATP-依赖性RNA解旋酶SUV3,线粒体182T33531501ATP-结合盒转运蛋白183T30371490核孔复合体蛋白Nup107184**(+)与水处理的对照相比显著萎缩或死亡率;(-)与水处理的对照相比无显著萎缩或死亡率;NT=(1)未检测该触发物,或(2)在该测试中发生了以下两者:样品未提供显著萎缩/死亡率和阳性对照未提供显著萎缩/死亡率。用于该测定的阳性对照是dsRNA,其具有先前在美国专利号7,943,819中公开为SEQIDNO.880的序列。对于表36提供的每一触发物序列,合成平端双链RNA(dsRNA)触发物并在玉米根虫侵染测定中,使用玉米幼芽根叶甲幼虫在自玉米种子长出的玉米植物中进行测定,所述种子在萌发前接触如上文实施例38所述的单个dsRNA触发物,其中测定了因接触或摄食多核苷酸触发物所致的幼虫死亡率或萎缩。对于经发现能有效导致幼虫萎缩或死亡率或这两者的触发物,进行进一步测试。预期当相比单用多核苷酸触发物或单用非多核苷酸杀虫剂所达到的效果时,使用本发明实施方案的某些多核苷酸触发物(例如本文所述的dsRNA触发物)与一种或多种非多核苷酸杀虫剂的组合的方法将在预防或控制昆虫侵染上导致协同的改进。在一个实施方案中,对玉米根虫侵染具有改良的抗性的玉米植物自种子长出,所述种子在其基因组具有编码非多核苷酸杀虫剂的重组DNA序列,其中所述种子在萌发前接触有效量的多核苷酸触发物。生物测定法例如本文所述的玉米根虫侵染测定法可用于定义使用本发明实施方案的多核苷酸触发物和一种或多种非多核苷酸杀虫剂(例如,马铃薯糖蛋白、植物凝集素、植物蜕皮甾醇、苏云金芽孢杆菌(Bacillusthuringiensis)杀虫蛋白、致病杆菌(Xenorhabdus)杀虫蛋白、发光杆菌(Photorhabdus)杀虫蛋白、Bacilluslaterosporous杀虫蛋白和球状芽孢杆菌(Bacillussphearicus)杀虫蛋白)的组合对幼虫死亡率或生长抑制的剂量反应。本领域技术人员可以在常规生物测定法中测试多核苷酸触发物和非多核苷酸杀虫剂组合,以鉴定具有协同作用并有望用于保护植物免遭昆虫侵染的生物活性物组合。实施例40:用靶向番茄金色斑驳病毒(ToGMoV)的dsRNA多核苷酸的种子处理以下实施例说明了提供具有改良的病毒病原体抗性的植物的方法,所述方法包括以下步骤:自种子长出植物,所述种子吸收了包含以下序列的外源不可转录的dsRNA多核苷酸:所述序列与病毒病原体基因的至少18个连续核苷酸基本相同或与其基本互补。在本实验中,每个处理用于40个种子。将包含与表37所述的番茄金色斑驳病毒(ToGMoV)的AC1(复制酶-相关蛋白)基因的5’或3’序列同源的序列的dsRNA多核苷酸触发物,在0.1mMEDTApH8.0中稀释至100µg/ml,终体积为0.6ml。对于各dsRNA多核苷酸触发物,将40个番茄种子(番茄变种HP375)放入2mlEppendorf管中并让其在dsRNA多核苷酸溶液中孵育。将额外的一组40个番茄种子在含有靶向大肠杆菌β-葡萄糖醛酸酶(GUS)基因序列的dsRNA多核苷酸的溶液中孵育,作为阴性对照。在无光处在15℃下通过轻轻搅拌24小时,来进行孵育。表37:用于种子处理实验的ToGMoV序列SEQIDNO靶基因物种185ToGMoVAC1/Rep1(5’)番茄金色斑驳病毒186ToGMoVAC1/Rep1(3’)番茄金色斑驳病毒翌日,在足够填充Eppendorf管的水中将种子洗涤3次(1分钟/洗涤并轻轻搅拌)。将经洗涤的种子以0.5英寸的深度种植在填充Metromix200土的6”聚乙烯盆中并在标准生长室条件下孵育:白天25℃,夜晚22℃;白天12小时;光强度~15000勒克斯。种植后大约2周,经由农杆菌接种法,对形成中的子叶接种ToGMoV。基本上按照以下文件所述进行番茄植物的农杆菌感染:GrimsleyN,HohnT,DaviesJW,HohnB(1987)Agrobacterium-mediateddeliveryofinfectiousMaizestreakvirusintomaizeplants(农杆菌介导的感染性玉米条斑病毒向玉米植物的递送).Nature325:177-179。简而言之,ToGMoV的DNA-A和DNA-B组分的农杆菌感染的克隆生长在Luria肉汤培养基中,所述培养基中补充有选择性抗生素壮观霉素(针对由双元载体所赋予的抗性)。将培养物在28℃在振荡培养箱中生长至OD600为0.4-0.5。对每一植物进行2次农杆菌感染。将农杆菌感染的植物维持在生长室条件下并监测病毒感染的迹象,同时未接种植物在相同生长室中一起生长。病毒接种后14天,为Quantigene分析而收获和制备植物叶,大约226mm2,相当于2个标准叶打孔(standardleafpunch)。如图28A可见到,用番茄金色斑驳病毒(ToGMoV)5’AC1(SEQIDNO.185)dsRNA触发物处理的植物积累病毒(通过AC1基因的RNA水平来测定)的水平明显不同于对照组。相反,用番茄金色斑驳病毒(ToGMoV)3’AC1(SEQIDNO186)dsRNA触发物处理的植物相比GUS-处理的对照组在ToGMoV病毒水平的积累上显示出统计学显著性降低,显著性在α下为0.05。参见图28B。实施例41:用靶向黄瓜花叶病毒(CMV)的DSRNA多核苷酸的种子处理以下实施例说明了提供具有改良的病毒病原体抗性的植物的方法,所述方法包括以下步骤:自种子长出植物,所述种子吸收了包含以下序列的外源不可转录的dsRNA多核苷酸:所述序列与黄瓜花叶病毒(CMV)基因的至少18个连续核苷酸基本相同或与其基本互补。在本实验中,每个处理用于40个种子。将包含与表38所述的CMV的3b核壳(NC)基因的5’或3’序列同源的序列的dsRNA多核苷酸触发物,在0.1mMEDTApH8.0中稀释至100µg/ml,终体积为0.6ml。对于各dsRNA多核苷酸触发物,将40个番茄种子(番茄变种HP375)放入2mlEppendorf管中并让其在dsRNA多核苷酸溶液中孵育。将额外的一组40个番茄种子在靶向大肠杆菌β-葡萄糖醛酸酶(GUS)基因序列的dsRNA多核苷酸存在下孵育,作为阴性对照。在无光处在15℃下通过轻轻搅拌24小时,来进行孵育。表38:用于种子处理实验的CMV序列SEQIDNO靶基因物种1873b-核壳(NC)黄瓜花叶病毒1883b-核壳(NC)黄瓜花叶病毒翌日,在足够填充Eppendorf管的水中将种子洗涤3次(1分钟/洗涤并轻轻搅拌)。再将经洗涤的种子以0.5英寸的深度种植在填充Metromix200土的6”聚乙烯盆中并在标准温室条件下孵育:白天28℃,夜晚21℃;16小时白天周期。种植后大约2周,使用文献中已知的标准方案(RogerHull:MechanicalInoculationofPlantViruses;CurrentProtocolsinMicrobiology,2005,13:16B6.1-16B6.4)经由摩擦感染,对正在形成的子叶接种CMV。简而言之,用无菌研钵和研杵,在25ml冰冷的0.1M磷酸盐缓冲液(pH7.8)中将来自已知CMV-感染植物的1克有症状的叶组织碾碎。将该接种缓冲液在撒有金刚砂粉的植物子叶上轻轻摩擦。接种后,将植物保留在温室条件下并监测感染的迹象。病毒接种后14天,为Quantigene分析而收获和制备植物叶,大约226mm2,相当于2个标准叶打孔。如图29A可见到,用黄瓜花叶病毒(CMV)5’3bdsRNA多核苷酸触发物(SEQIDNO.187)处理的植物积累病毒(通过3b-NC基因的RNA水平来测定)的水平明显不同于对照组,虽然有轻微下降趋势。在用黄瓜花叶病毒(CMV)5’3bdsRNA多核苷酸触发物(SEQIDNO.188)处理的植物上观察到类似结果。参见图29B。实施例42:用靶向番茄斑萎病毒(TSWV)的DSRNA多核苷酸的种子处理以下实施例说明了提供具有改良的病毒病原体抗性的植物的方法,所述方法包括以下步骤:自种子长出植物,所述种子吸收了包含以下序列的外源不可转录的dsRNA多核苷酸:所述序列与番茄斑萎病毒(TSWV)基因的至少18个连续核苷酸基本相同或与其基本互补。将包含与TSWV的核壳(N)基因的3’序列同源的序列的dsRNA多核苷酸触发物(SEQIDNO.190),在0.1mMEDTApH8.0中稀释至100µg/ml,终体积为0.6ml。将40个番茄种子(番茄变种HP375)放入2mlEppendorf管中并让其在dsRNA多核苷酸溶液中孵育。将额外的一组40个番茄种子在靶向大肠杆菌β-葡萄糖醛酸酶(GUS)基因序列的dsRNA多核苷酸存在下孵育,作为阴性对照。在无光处在15℃下通过轻轻搅拌24小时,来进行孵育。翌日,在足够填充Eppendorf管的水中将种子洗涤3次(1分钟/洗涤并轻轻搅拌)。将经洗涤的种子以0.5英寸的深度种植在填充Metromix200土的6”聚乙烯盆中并在标准温室条件下孵育:白天28℃,夜晚21℃;16小时白天周期。种植后大约2周,使用文献所述的标准方案(RogerHull:MechanicalInoculationofPlantViruses;CurrentProtocolsinMicrobiology,2005,13:16B6.1-16B6.4)经由摩擦感染,对正在形成的子叶接种TSWV。简而言之,用无菌研钵和研杵,在25ml冰冷的0.1M磷酸盐缓冲液(pH7.8)中将来自已知TSWV-感染植物的1克有症状的叶组织碾碎。将该接种缓冲液在撒有金刚砂粉的植物子叶上轻轻摩擦。接种后,将植物保留在温室条件下并监测感染的迹象。病毒接种后14天,为Quantigene分析而收获和制备植物叶,大约226mm2,相当于2个标准叶打孔。如图30可见到,用番茄斑萎病毒(TSWV)3’NdsRNA多核苷酸(SEQIDNO.190)处理的植物积累病毒(通过3b-NC基因的RNA水平来测定)的水平明显不同于对照组。实施例43:用靶向番茄斑萎病毒(TSWV)的dsRNA多核苷酸的种子处理以下实施例说明了提供具有改良的病毒病原体抗性的植物的方法,所述方法包括以下步骤:自种子长出植物,所述种子吸收了包含以下序列的外源不可转录的dsRNA多核苷酸:所述序列与番茄斑萎病毒(TSWV)基因的至少18个连续核苷酸基本相同或与其基本互补。将包含与TSWV的核壳(N)基因的5’序列同源的序列的dsRNA多核苷酸触发物(SEQIDNO.189)在0.1mMEDTApH8.0中稀释至100µg/ml,终体积为0.6ml。将40个番茄种子(番茄变种HP375)放入含有dsRNA多核苷酸溶液的2mlEppendorf管中。将额外的一组40个番茄种子在靶向大肠杆菌β-葡萄糖醛酸酶(GUS,SEQIDNo.20)基因序列的dsRNA多核苷酸存在下孵育,作为阴性对照。在无光处在15℃下通过轻轻搅拌24小时,来进行孵育。翌日,在足够填充Eppendorf管的水中将种子洗涤3次(1分钟/洗涤并轻轻搅拌)。再将经洗涤的种子以0.5英寸的深度种植在填充Metromix200土的6”聚乙烯盆中并在标准温室条件下孵育:白天28℃,夜晚21℃;16小时白天周期。种植后大约2周,使用文献所述的标准方案(RogerHull:MechanicalInoculationofPlantViruses;CurrentProtocolsinMicrobiology,2005,13:16B6.1-16B6.4),经由摩擦感染,对正在形成的子叶接种TSWV。简而言之,用无菌研钵和研杵,在25ml冰冷的0.1M磷酸盐缓冲液(pH7.8)中将来自已知TSWV-感染植物的1克有症状的叶组织碾碎。将该接种缓冲液在撒有金刚砂粉的植物子叶上轻轻摩擦。接种后,将植物保留在温室条件下并监测感染的迹象。病毒接种后14天,为Quantigene分析而收获和制备植物叶,大约226mm2,相当于2个标准叶打孔。预期用TSWV5’NdsRNA多核苷酸(SEQIDNO.189)处理的植物积累病毒(通过3b-NC基因的RNA水平来测定)的水平低于对照组。实施例44:用于使棉贪夜蛾EF1α基因沉默的dsRNA分子的产生使用如实施例7所述的相同的BLAST参数,针对玉米基因组(Zeamays-taxid:4577,图31)分析衍生自棉贪夜蛾EF1α基因的dsRNA多核苷酸触发物。选择靶向棉贪夜蛾EF1α且对玉米基因具有同源性的dsRNA。实施例45:用棉贪夜蛾dsRNA处理种子后改变的玉米EF1α表达按照实施例1所述方案,将玉米种子(变种Vivani)用衍生自棉贪夜蛾EF1α基因序列的外源不可转录的dsRNA触发物分子(SEQIDNo.131和132)处理,处理前后未进行洗涤。使用每种dsRNA各25µg/ml的混合物。dsRNA或用0.1mMEDTA稀释,或用0.1mMEDTA与40µg/mlPEG-修饰的碳纳米管(CNTP)混合物稀释。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达4小时,来进行处理。处理后,将种子种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用衍生自GFP序列的50µg/mldsRNA处理的种子,与经EF1αdsRNA处理的植物一起萌发和生长,作为对照。处理后20天,从萌发的种子的叶中提取总RNA。使用寡-dT引物制备cDNA,并通过使用SYBRGreen(QuantaBioSciences)的实时PCR,在经处理的和对照植物中测定玉米EF1αmRNA表达水平。使用持家基因GPM120和NFE101作为内源对照基因,以对输入量归一化。设计引物,以便不扩增dsRNA触发物并因此仅检测玉米衍生的EF1αmRNA。表39:用于EF1α表达水平的RT-PCR分析的引物。靶基因正向/反向引物序列SEQIDNo.EF1α正向GCAACCACTCCCAAATACTC191EF1α反向CAGGGTTGTACCCAACTTTC192GPM120正向AGGCTTTCGCTGCGTGTT193GPM120反向TGGCCCATCCAAACTCAGA194NFE101正向GCTCAAGTTCTTCGGATGAC195NFE101反向ACTTCTTCCAGCAGACTAGC196该分析显示玉米EF1αmRNA的显著上调(Wilcoxon秩和检验,p-值<0.05)。在用棉贪夜蛾dsRNA处理的植物中EF1α的中位表达水平为用GFPdsRNA(有或无PEG-修饰的碳纳米管)处理的对照植物各自的2.12和1.68倍高。参见图32A和B。在处理后48天,对于EF1α表达水平,再次分析用dsRNA/CNTP处理的植物。该分析显示玉米EF1αmRNA上调。在用棉贪夜蛾dsRNA处理的植物中EF1α的中位表达水平为用GFPdsRNA处理的对照植物的1.66倍高。参见图32C。实施例46:用棉贪夜蛾dsRNA处理种子后的玉米EF1α、β肌动蛋白、ATP酶和NADPH表达按照实施例1所述方案,将玉米种子用衍生自棉贪夜蛾基因的外源不可转录的dsRNA触发物分子处理。在处理之前,将种子用双蒸水(DDW)洗涤4小时。接下来,将种子在30℃干燥过夜。在干燥步骤后,使用都用0.1mMEDTA稀释的终浓度为132µg/mldsRNA(对于EF1α)(以大致相等的浓度的dsRNA#1(SEQIDNo.131)和dsRNA#2(SEQIDNo.132)的混合物)、53µg/mldsRNA(对于ATP酶)(SEQIDNo.31)、76µg/mldsRNA(对于β肌动蛋白)(SEQIDNo.133)和154µg/mldsRNA(对于NADPH)(SEQIDNo.25和26)。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达26小时,来进行处理。处理后,种子用DDW短暂洗涤,然后放在湿纸上萌发,无需干燥步骤。萌发后7天,将幼苗种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用不含dsRNA的类似溶液(EDTA)处理的种子与经处理的植物一起萌发和生长,作为对照。处理后9周,从萌发的种子的叶中提取总RNA。使用寡-dT和随机引物制备cDNA,并在经处理的和对照植物中测定玉米EF1α、β肌动蛋白、ATP酶和NADPH的表达水平。分析的植物数量对于EF1α、β肌动蛋白、ATP酶、NADPH和对照分别是3、4、3、3和7。将持家基因FKBP用作内源对照基因,以对输入量归一化。设计引物,以便不扩增dsRNA触发物并因此仅检测玉米衍生的mRNA。表40:用于EF1α、β肌动蛋白、ATP酶和NADPH的表达水平的RT-PCR分析的引物。靶基因正向/反向引物序列SEQIDNo.EF1α正向GCAACCACTCCCAAATACTC197EF1α反向CAGGGTTGTACCCAACTTTC198β肌动蛋白正向TCTGGCATCACACCTTCTAC199β肌动蛋白反向TTCTCACGGTTAGCCTTTGG200ATP酶正向1TGTCCTGCCATCTCTATCTC201ATP酶反向1ACATCCGAATGGTCTCTACG202ATP酶正向2CACAACCGTGCAGTTTACAG203ATP酶反向2AAATGCGCCCAAGCATATCG204NADPH正向CAGAGGACGAGGAATATGAG205NADPH反向CTAGCAGCATTGTCAGTAGG206FKBP正向CGGTGTTCGACAGCAGCTAC207FKBP反向CTTCGCCGCCAACAATACCC208因为小的组大小,该分析显示这些基因的表达无显著差异(Wilcoxon秩和检验,p-值>0.05),但EF1α的表达显示出上调趋势。在用棉贪夜蛾EF1αdsRNA处理的植物中EF1α的中位表达水平为对照植物的2.28倍高(图33)。实施例47:用棉贪夜蛾dsRNA处理种子后的玉米EF1α和ATP酶表达按照实施例1所述方案,将玉米种子用衍生自棉贪夜蛾EF1α和ATP酶基因的外源不可转录的dsRNA触发物分子处理。在处理之前,将种子用双蒸水(DDW)洗涤4小时并在30℃干燥过夜。在两种不同种子处理中分别使用两种EF1αdsRNA序列(dsRNA#1(SEQIDNo.131)和#2(SEQIDNo.132));各自的终浓度为67µg/mldsRNA。以145µg/ml终浓度使用ATP酶dsRNA(SEQIDNo.31)。所有dsRNA都用0.1mMEDTA稀释。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达24小时,来进行处理。处理后,将种子在30℃干燥过夜,然后种植在土壤中并以16小时光周期在大约25℃生长。根据需要用自来水浇灌植物。将用衍生自GUS序列的67µg/mldsRNA(SEQIDNo.20)处理的种子与经处理的植物一起萌发和生长,作为对照。处理后7天,从萌发的种子的叶中提取总RNA并如以上实施例2所述在经处理的和对照植物中测定玉米EF1α和ATP酶的表达水平。持家基因GPM120用作内源对照基因,以对输入量归一化。设计引物,以便不扩增dsRNA触发物并因此仅检测玉米衍生的mRNA。表41:用于EF1α和ATP酶的表达水平的RT-PCR分析的引物。靶基因正向/反向引物序列SEQIDNo.EF1α正向GCAACCACTCCCAAATACTC191EF1α反向CAGGGTTGTACCCAACTTTC192ATP酶正向GCGCAAGTTTTTCGTAGATGAC209ATP酶反向ACCATAGTCCACAGATGACAC210GMP120正向GCTGCGTGTTGTGCGTTCTG211GMP120反向TCGTCGCGTGCTGTCTGTTC212未观察到这些基因的表达上的显著差异。实施例48:用棉贪夜蛾dsRNA处理种子后的玉米NADPH表达按照实施例45所述方案,将玉米种子(变种01DKD2)用衍生自棉贪夜蛾NADPH基因的外源不可转录的dsRNA触发物分子(SEQIDNo.26)处理。使用用0.1mMEDTA稀释的终浓度为80µg/mldsRNA。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达3.5小时,来进行处理。处理后,将种子种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用GFPdsRNA、或用不含dsRNA的类似溶液处理的种子与经处理的植物一起萌发和生长,作为对照。处理后20天,从萌发的种子的叶中提取总RNA并如以上实施例45所述在经处理的和对照植物中测定玉米NADPH的表达水平。持家基因GPM120和NFE101用作内源对照基因,以对输入量归一化。设计引物,以便不扩增dsRNA触发物并因此仅检测玉米衍生的mRNA。表42:用于NADPH表达水平的RT-PCR分析的引物。靶基因正向/反向引物序列SEQIDNo.NADPH正向CAGAGGACGAGGAATATGAG205NADPH反向CTAGCAGCATTGTCAGTAGG206GPM120正向AGGCTTTCGCTGCGTGTT213GMP120反向TGGCCCATCCAAACTCAGA214NFE101正向GCTCAAGTTCTTCGGATGAC215NFE101反向ACTTCTTCCAGCAGACTAGC216未观察到NADPH的表达上的显著差异。实施例49:用棉贪夜蛾dsRNA处理种子后的玉米EF1α表达按照实施例45所述方案,将玉米种子(变种01DKD2)用衍生自棉贪夜蛾EF1α基因的外源不可转录的dsRNA触发物分子(SEQIDNo.131)处理。使用两种dsRNA各25µg/ml的混合物。dsRNA或单用0.1mMEDTA稀释,或用与40µg/mlPEG-修饰的碳纳米管(CNTP)额外混合的0.1mMEDTA稀释。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达4小时,来进行处理。处理后,将种子种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用衍生自GUS序列的50µg/mldsRNA(有或无40µg/mlPEG-修饰的碳纳米管)处理的种子,与经处理的植物一起萌发和生长,作为对照。处理后20天,从萌发的种子的叶中提取总RNA并如实施例45所述在经处理的和对照植物中测定玉米EF1αmRNA表达水平。持家基因GPM120、NFE101和Expressed用作内源对照基因,以对输入量归一化。设计引物,以便不扩增dsRNA触发物并因此仅检测玉米衍生的mRNA。表43:用于EF1α表达水平的RT-PCR分析的引物。靶基因正向/反向引物序列SEQIDNo.EF1α正向GCAACCACTCCCAAATACTC198EF1α反向CAGGGTTGTACCCAACTTTC199GPM120正向AGGCTTTCGCTGCGTGTT193GMP120反向TGGCCCATCCAAACTCAGA194NFE101正向GCTCAAGTTCTTCGGATGAC215Expressed正向GGATGCTACTCGCCAGACA217Expressed反向GTGGTCAGCCTGCTTCAAC218未见EF1α的表达上的显著差异。实施例50:用棉贪夜蛾dsRNA处理种子后的玉米EF1α表达按照实施例1所述方案,无需处理前洗涤,将玉米种子(变种Vivani)用衍生自棉贪夜蛾EF1α基因的外源不可转录的dsRNA触发物分子(SEQIDNo.131和132)处理。使用两种dsRNA各25µg/ml的混合物。dsRNA或单用0.1mMEDTA稀释,或用与40µg/mlPEG-修饰的碳纳米管(CNTP)额外混合的0.1mMEDTA稀释。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达4小时,来进行处理。处理后,将种子用DDW短暂洗涤并在土壤中直接萌发,无需干燥步骤。植物以16小时光周期在约25℃下生长,根据需要用自来水浇灌植物。将用不含dsRNA的类似溶液、或用衍生自GFP序列的50µg/mldsRNA(有或无40µg/mlPEG-修饰的碳纳米管)处理的种子,与经处理的植物一起萌发和生长,作为对照。处理后14天,从萌发的种子的叶中提取总RNA并如以上实施例45所述在经处理的和对照植物中测定玉米EF1α表达水平。持家基因NFE101和Expressed用作内源对照基因,以对输入量归一化。设计引物,以便不扩增dsRNA触发物并因此仅检测玉米衍生的mRNA。表44:用于EF1α表达水平的RT-PCR分析的引物。靶基因正向/反向引物序列SEQIDNo.EF1α正向GCAACCACTCCCAAATACTC197EF1α反向CAGGGTTGTACCCAACTTTC198NFE101正向GCTCAAGTTCTTCGGATGAC215Expressed正向GGATGCTACTCGCCAGACA217Expressed反向GTGGTCAGCCTGCTTCAAC218未见EF1α的表达上的显著差异。实施例51:用棉贪夜蛾dsRNA处理种子后的玉米EF1α表达按照实施例1所述方案,无需处理前洗涤,将玉米种子(变种Vivani)用衍生自棉贪夜蛾EF1α基因的外源不可转录的dsRNA触发物分子(SEQIDNo.131和132)处理。分开使用两种dsRNA,终浓度各为160µg/ml。dsRNA或单用IDT缓冲液(30mMHEPES,pH7.5,100mM乙酸钾)稀释,或用与40µg/mlPEG-修饰的碳纳米管(CNTP)额外混合的IDT缓冲液稀释。在无光生长室中在25℃下,通过在溶液中轻轻振荡种子达7小时,来进行处理。处理后,将种子用DDW短暂洗涤并在土壤中直接萌发,无需干燥步骤。植物以16小时光周期在约25℃下生长,根据需要用自来水浇灌植物。将用不含dsRNA的类似溶液、或用衍生自GFP序列的160µg/mldsRNA(有或无40µg/mlPEG-修饰的碳纳米管)处理的种子,与经处理的植物一起萌发和生长,作为对照。处理后6天,从萌发的种子的叶中提取总RNA并如以上实施例45所述在经处理的和对照植物中测定玉米EF1α表达水平。持家基因GPM120和Expressed用作内源对照基因,以对输入量归一化。设计引物,以便不扩增dsRNA触发物并因此仅检测玉米衍生的mRNA。表45:用于EF1α表达水平的RT-PCR分析的引物。靶基因正向/反向引物序列SEQIDNo.EF1α正向1GCAACCACTCCCAAATACTC197EF1α反向1CAGGGTTGTACCCAACTTTC198EF1α正向2CCCAGGTCATCATCATGAAC191EF1α反向2GAGCTCAGCAAACTTGACAG192GPM120正向GCTGCGTGTTGTGCGTTCTG211Expressed正向GGATGCTACTCGCCAGACA217Expressed反向GTGGTCAGCCTGCTTCAAC218该分析结果见图34。在用EF1αdsRNA#1处理后的植物中观察到玉米EF1αmRNA的显著上调(t-检验,p-值=0.004)。在用该dsRNA处理的植物中EF1α的平均表达水平为用GUSdsRNA处理的对照植物的1.8倍高。当将用EF1αdsRNA(dsRNA#1和#2两者,有和无CNTP)处理的所有植物分组并与用GUSdsRNA(有和无CNTP)处理的所有植物比较时,观察到玉米EF1αmRNA的显著上调。参见图34B。在用EF1αdsRNA处理的植物中EF1α平均表达水平为用GUSdsRNA处理的对照植物的1.73倍高(t-检验,p-值=0.005)。实施例52:用棉贪夜蛾dsRNA处理种子后的玉米ATP酶和NADPH表达按照实施例1所述方案,无需处理前洗涤,将玉米种子(变种Vivani)用衍生自棉贪夜蛾ATP酶和NADPH基因的外源不可转录的dsRNA触发物分子(SEQIDNo.31和26)处理。使用用0.1mMEDTA稀释的终浓度160µg/ml的dsRNA。在无光生长室中在15℃下,通过在溶液中轻轻振荡种子达2小时,来进行处理。处理后,将种子用DDW短暂洗涤,种植在土壤中并以16小时光周期在约25℃下生长。根据需要用自来水浇灌植物。将用衍生自GFP序列的160µg/mldsRNA(SEQIDNo.124)、或用不含dsRNA的类似溶液(EDTA)处理的种子,与经处理的植物一起萌发和生长,作为对照。处理后27天,从萌发的种子的叶中提取总RNA并如以上实施例45所述在经处理的和对照植物中测定玉米ATP酶和NADPH的表达水平。持家基因Expressed用作内源对照基因,以对输入量归一化。设计引物,以便不扩增dsRNA触发物并因此仅检测玉米衍生的mRNA。表46:用于ATP酶和NADPH的表达水平的RT-PCR分析的引物。靶基因正向/反向引物序列SEQIDNo.ATP酶正向GCGCAAGTTTTTCGTAGATGAC219ATP酶反向ACCATAGTCCACAGATGACAC220NADPH正向CAGAGGACGAGGAATATGAG205NADPH反向CTAGCAGCATTGTCAGTAGG206Expressed正向GGATGCTACTCGCCAGACA217Expressed反向GTGGTCAGCCTGCTTCAAC218该分析结果见图35A(ATP酶表达)和35B和C(NADPH表达)。在用棉贪夜蛾ATP酶dsRNA处理后,未检测到玉米ATP酶表达水平上的差异。然而,在用NADPHdsRNA触发物处理后的植物中观察到玉米NADPHmRNA的下调趋势。用该dsRNA触发物处理的植物的NADPH平均表达水平为用GFPdsRNA触发物处理的对照植物的1/1.37(t-检验,p-值=0.11)。当将所有对照植物(用GFPdsRNA处理的那些和用EDTA处理的那些)分组并与用NADPHdsRNA触发物处理的植物比较时,观察到玉米NADPHmRNA的显著下调,在用NADPHdsRNA处理后的NADPH表达水平平均下降至1/1.67(t-检验,p-值=0.02)。虽然结合其具体实施方案描述了本发明,但是要明白,许多备选方案、修改和变化对于本领域技术人员而言应是显而易见的。因此,意欲包括落入随附权利要求书的精神和宽范围内的所有这样的备选方案、修改和变化。本说明书中所提及的所有出版物、专利和专利申请在本文均通过引用以其整体结合到本说明书中,其程度就像每个单独的出版物、专利或专利申请具体而单独指明通过引用结合到本文一样。另外,本申请的任何参考文献的引用或确认不应解释为承认所述文献可作为本发明的先有技术而获得。就使用章节标题而言,它们不应解释为必然限制性的。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1