2β,3α,5α‑三羟基‑雄甾‑6‑酮及其制备方法与用途与流程
2β,3α,5α-三羟基-雄甾-6-酮及其制备方法与用途相关申请交叉引用本申请要求2013年3月28日提交的中国发明专利申请201310104162.5号的优先权利益,其全部公开内容通过引用合并至本文中。技术领域本发明涉及一种多羟基甾酮,具体为2β,3α,5α-三羟基-雄甾-6-酮,以及其制备方法和医学应用。
背景技术:
多羟基甾酮是自然界广泛存在的一类重要化合物,许多从海洋生物和陆生植物里提取的多羟基甾酮具有抗肿瘤、提高免疫力等重要生理功能,例如,蜕皮甾酮类和油菜甾醇类化合物具有促进植物生长的功能。但是,天然的多羟基甾酮在植物体内的含量极低,提纯步骤繁琐且耗时较长,此外,由于结构方面的原因(例如具有较长和较复杂的侧链),大多不能人工合成,这限制了该类物质的使用。如果能够对天然产物的结构进行优化,使之既能够基本上维持天然的药学功能,又具有相对天然产物较为简单的结构而便于人工合成,那么对于扩大该类物质的应用范围将具有非常重要的意义。
技术实现要素:
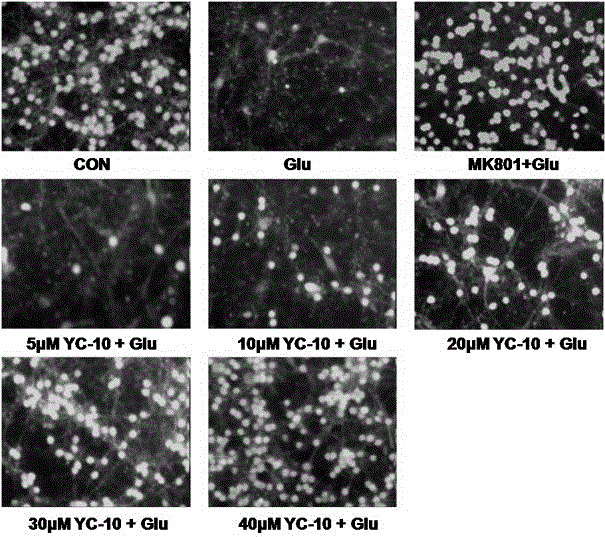
本发明提供一种新的多羟基甾酮类物质,即2β,3α,5α-三羟基-雄甾-6-酮(下文有时称“YC-10”、“化合物(I)”、“化合物I”,并在本文可互换使用),其结构式为下式(I),式(I)。化学式(I)的化合物不是天然存在的,而是本申请发明人通过人工合成方法获得的。该多羟基甾酮相对天然存在的多羟基甾酮类物质具有较为简单的结构,例如,不具有长的或复杂的侧链,因此便于人工合成。此外,因分子量减小和空间立体结构简单化,便于药物递送。侧链的消失同时还降低了与其他物质发生相互作用的可能性。另外,化合物(I)的17-位不具有侧链,可能增加化合物在体内的生物利用度,消除其激素样作用。此外,独特的立体构型有可能提高其立体选择性,具有更好的生物活性。同时,式(I)的化合物被证明仍然具有特定的药理学作用,具有潜在的药物用途。在本发明中,试验证实该化合物具有抗肿瘤用途,以及保护神经细胞(尤其是视神经节细胞)的用途。因此,本发明另一个方面提供一种药物组合物,其包含治疗有效量的式(I)的化合物,以及药学上可接受的载体。“治疗有效量”是指当施用于个体用于治疗疾病时化合物的量足以对疾病的治疗有效。“治疗有效量”可根据化合物、疾病及其严重程度、所治疗个体的年龄、体重等变化。“药学上可接受的载体”是指可与本发明化合物一起施用的稀释剂、佐剂、赋形剂等。本发明另一个方面提供一种药物组合物,其包含治疗有效量的式(I)的化合物,以及第二种神经细胞保护剂。所述第二种神经细胞保护剂不同于本发明的化合物,可与本发明的化合物联用,用于实现神经细胞保护。在优选的实施方式中,所述第二种神经细胞保护剂为视神经节细胞保护剂。本发明的又一个方面提供一种药物组合物,其包含治疗有效量的式(I)的化合物,以及第二种抗肿瘤药物。所述第二种神经细胞保护剂不同于本发明的化合物,可与本发明的化合物联用,用于实现抗肿瘤应用。本文所用的术语“肿瘤”表示皮肤或机体器官中细胞的恶性或良性生长,所述的器官为例如但不限于乳房、前列腺、肺、肾、胰、胃或肠。恶性肿瘤易于侵入相邻的组织并且扩散(转移)到较远的器官,例如骨、肝、肺或脑。本文所用的术语肿瘤包括转移肿瘤细胞型,例如但不限于黑素瘤、淋巴瘤、白血病、纤维肉瘤、横纹肌肉瘤和肥大细胞瘤,以及组织癌类型,例如但不限于结肠直肠癌、前列腺癌、小细胞肺癌和非小细胞肺癌、乳癌、胰腺癌、膀胱癌、肾癌、胃癌、胶质母细胞瘤、原发性肝癌、卵巢癌、前列腺癌和子宫平滑肌肉瘤。本发明的再一个方面提供式(I)的化合物在制备神经细胞保护药物或抗肿瘤药物中的应用。本发明的式(I)的化合物经试验证实具有抑制肿瘤细胞生长的作用,且抑瘤率成剂量依赖性,同时其也具有明显的神经细胞保护作用。本发明的再一个方面提供治疗或缓解疾病或病症的方法,该疾病或病症例如是多种疾病因素导致的视网膜神经损伤或中枢神经系统神经元损伤相关疾病,例如视网膜缺血、外伤以及急性和慢性青光眼导致的视神经损伤、高血压和糖尿病导致高血压性视网膜病变和糖尿病视网膜损伤、视网膜色素变性以及黄斑病变等眼科疾病,或者中风、脑损伤、脊柱损伤、帕金森病(Parkinson’sdisease,PD)、阿尔茨海默病(Alzheimer’sdisease,AD)、亨廷顿病(Huntingtondisease,HD)、肌萎缩侧索硬化症(amyotrophiclateralsclerosis,ALS)等中枢神经系统疾病。该方法包括将治疗有效量的本发明提供的式(I)的化合物或其前药、溶剂化物、或将本发明提供的药物组合物施用至个体。在本发明中,“前药”表示具有可裂解的基团并且通过水解或在生理条件下变成在体内有药物活性的本发明式(I)化合物的化合物,包括本发明化合物的衍生物。此类实例包括但不限于胆碱酯衍生物等、N-烷基吗啉酯等。“溶剂化物”表示通常通过溶剂解反应与溶剂缔合的化合物形式。这种物理的缔合包括氢键。常规的溶剂包括水、乙醇、乙酸等。本发明化合物可以制备成例如结晶形式并且可以溶剂化或水化。适合的溶剂化物包括药学上可接受的溶剂化物,例如水合物,并且还包括化学计量的溶剂化物和非化学计量的溶剂化物。在某些情况中,溶剂化物能够分离,例如当一个或多个溶剂分子掺入结晶固体的晶格中时。“溶剂化物”包括溶液相和可分离的溶剂化物。代表性的溶剂化物包括水合物、乙醇化物和甲醇化物。本发明的再一个方面提供制备上述本发明的式(I)化合物的方法,所述方法以雄甾-5-烯-3-醇为原料,经反应制得化合物VI,即3β-对甲苯磺酰氧基-5α-羟基-雄甾-6-酮,经消去反应得到化合物IX,即5α-羟基-雄甾-2-烯-6-酮,再经2-位双键经氧化、水解反应得到化合物I。在上述方法中,其中化合物VI可通过多种方式制得,例如:(1)以雄甾-5-烯-3-醇为原料,经H2O2/甲酸体系氧化、碱解、NBS氧化及对甲苯磺酰氯保护制备化合物VI。具体而言,该方式包括(1a)在反应瓶中按比例加入化合物雄甾-5-烯-3-醇和甲酸,低温下滴加双氧水,反应1~2h,加热,加入水充分搅拌分散,抽滤、干燥得白色固体化合物II,其化合物雄甾-5-烯-3-醇:甲酸:双氧水为:1:10~30:0.5~3(w:v:v);(1b)在反应瓶中加入碱性甲醇液,按比例加入化合物,加热回流1~2h,反应液倒入水中分散,抽滤、干燥得白色固体化合物,其中碱性甲醇溶液为:氢氧化钾、氢氧化钠及甲醇钠的甲醇溶液中的任何一种,所述反应液的碱浓度为:2~10%;(1c)在反应瓶中,加入化合物III及适量的二氧六环和水,分批加入NBS,反应2~4h后,加入亚硫酸钠,滤饼抽滤、水洗至中性、干燥得白色固体化合物V;(1d)在反应瓶中,加入适量吡啶、化合物V及对甲苯磺酰氯,室温搅拌24~36h,加入到冰盐酸水溶液中,滤饼抽滤、洗涤至中性、干燥得白色固体化合物VI。(2)以雄甾-5-烯-3-醇为原料,经间氯过氧苯甲酸氧化、酸解反应、NBS氧化及对甲苯磺酰氯保护制备化合物VI。具体而言,该方法包括:(2a)在反应瓶中加入化合物雄甾-5-烯-3-醇及CH2Cl2,搅拌下分批加入适量间氯过氧苯甲酸,冰浴下搅拌2~5h,反应结束后依次用Na2CO3溶液、Na2SO3溶液及水洗涤,干燥,浓缩得化合物IV;(2b)将反应瓶中按比例加入化合物IV及酸性丙酮水溶液,室温下搅拌反应数小时,反应结束后用Na2CO3溶液将反应液调节至中性,除去丙酮,浓缩液用乙酸乙酯萃取,有机相干燥,浓缩得化合物III,其中丙酮的酸性溶液中的酸为:硫酸和高碘酸,化合物IV:丙酮:1N的酸为1:20~30:5~10(w:v:v);(2c)在反应瓶中,加入化合物III及适量的二氧六环和水,分批加入NBS,反应2~4h后,加入亚硫酸钠,滤饼抽滤、水洗至中性、干燥得白色固体化合物V;(2d)在反应瓶中,加入适量吡啶、化合物V及对甲苯磺酰氯,室温搅拌24~36h,加入到冰盐酸水溶液中,滤饼抽滤、洗涤至中性、干燥得白色固体化合物VI。(3)以雄甾-5-烯-3-醇为原料,经对甲苯磺酰氯保护、间氯过氧苯甲酸氧化及琼斯试剂氧化制备化合物VI。具体而言,该方法包括:(3a)在反应瓶中,加入化合物雄甾-5-烯-3-醇、无水吡啶及对甲苯磺酰氯,室温搅拌,反应结束后倒入至冰盐酸水溶液中,搅拌,抽滤,滤饼用水洗至中性,干燥得白色固体化合物VII;(3b)在反应瓶中加入化合物VII和二氯甲烷,搅拌下分批加入间氯过氧苯甲酸,冰浴下搅拌,反应结束后,反应液依次用饱和亚硫酸钠溶液、碳酸钠溶液及蒸馏水洗涤,有机层干燥,浓缩,硅胶柱层析提纯得白色固体化合物VIII;(3c)在反应瓶中加入化合物VIII和丙酮,搅拌下加入琼斯试剂,室温反应数小时,反应结束后,用异丙醇停止反应,反应液调至中性,减压浓缩除去丙酮,浓缩液用乙酸乙酯萃取,经洗涤,干燥,浓缩得淡绿色固体,硅胶柱层析提纯得白色固体化合物VI。在本发明的方法中,化合物IX例如是通过以下步骤反应得到的:在反应瓶中加入适量化合物VI、DMF、Li2CO3及LiBr,加热回流,反应液倒入冰盐酸水溶液中,搅拌,抽滤,滤饼洗涤至中性,干燥得白色固体化合物IX。优选地,化合物VI:DMF为1:3~15(w:v);化合物VI:Li2CO3:LiBr为:1:4~12:4~12(M:M:M)。在本发明的方法中,化合物I可通过化合物IX通过同种方式制得,例如:(1)化合物IX经H2O2/甲酸体系氧化、碱解制备式(I)的化合物。具体而言,该方法包括:(1a)在反应瓶中按比例加入化合物IX和甲酸,低温下滴加双氧水,反应1~2h,加热,加入水充分搅拌分散,抽滤得到白色滤饼,干燥得白色固体化合物X,其中化合物IX:甲酸:双氧水为:1:10~30:0.5~3(w:v:v);(1b)在反应瓶中加入碱性甲醇溶液,按比例加入化合物X,加热回流1~2h,反应液倒入水中分散,抽滤,干燥得白色固体的式(I)化合物,其中碱性甲醇溶液为:氢氧化钾、氢氧化钠及甲醇钠的甲醇溶液中的任何一种;所述反应液的碱浓度为:2~10%。(2)化合物IX经间氯过氧苯甲酸氧化、酸解反应制备式(I)的化合物。具体而言,该方法包括:(2a)在反应瓶中按比例加入化合物IX及CH2Cl2,搅拌下分批加入间氯过氧苯甲酸,冰浴下搅拌2~5h,反应结束后依次用Na2CO3溶液、Na2SO3溶液及水洗涤,干燥,浓缩得化合物XI;(2b)在反应瓶中按比例加入化合物XI及丙酮的酸性溶液,室温下搅拌反应数小时,反应结束后用Na2CO3溶液将反应液调节至中性,除去丙酮,浓缩液用乙酸乙酯萃取,有机相干燥,浓缩得式(I)化合物,其中丙酮的酸性溶液中的酸为:硫酸和高碘酸,化合物XI:丙酮:1N的酸为1:20~30:5~10(w:v:v)。附图说明图1显示本发明的化合物I对LN18和DBTRG-50MG细胞的生长抑制作用(n=3*,p<0.05)。图2显示化合物I对谷氨酸介导的小脑颗粒神经元损伤具有保护作用。图3显示化合物I呈浓度依赖性地保护小脑颗粒神经元的存活。图4显示化合物I对低钾诱导的小脑颗粒神经元死亡的保护作用。图5显示视神经夹闭损伤模型中RGC明显减少,而化合物I能明显阻止RGC减少。图6为视神经夹闭损伤模型中各组样本的RGC数量统计数据。图7显示高压缺血模型中RGC明显减少,而化合物I能减少高压缺血造成的RGC丢失。图8为高压缺血模型中各组样本的RGC数量统计数据。具体实施方式以下实施例仅用于解释本发明,但本发明的保护范围并不仅限以下实施例。在以下实施例中:化合物:2β,3α,5α-三羟基-雄甾-6-酮;化合物:3β,6β-二甲酰氧基-5α-雄甾-5-醇;化合物:雄甾-3β,5α,6β-三醇;化合物:3β-羟基-雄甾-5β,6β-环氧;化合物:3β,5α-二羟基-雄甾-6-酮;化合物:3β-对甲苯磺酰氧基-5α-羟基-雄甾-6-酮;化合物:3β-对甲苯磺酰氧基-雄甾-5-烯;化合物:3β-对甲苯磺酰氧基-雄甾-5β,6β-环氧;化合物:5α-羟基-雄甾-2-烯-6-酮;化合物:2β,3α-二甲酰氧基-5α-羟基-雄甾-6-酮;化合物:2β,3β-环氧-5α-羟基-雄甾-6-酮。化合物I的制备实施例1(1)在2L的反应瓶中按比例加入54.5g化合物雄甾-5-烯-3-醇和1L甲酸(市售88%),降温至25℃以下,缓慢滴加82.5mL双氧水(市售30%),经TLC确认无原料,加热至75℃破坏多余的双氧水。加入1L水充分搅拌分散。抽滤得到白色滤饼,滤饼用饱和NaHCO3溶液浸泡,抽滤,滤饼水洗至中性,干燥得62.4g白色固体化合物。(2)在2L的反应瓶中加入45g氢氧化钾、1500甲醇、300mL水及60g化合物,加热回流,经TLC确认无化合物,反应液降至室温,倒入3L水中分散。加入浓盐酸调pH=7,静置分层,抽滤,滤饼水洗涤至中性,干燥得49.6g白色固体化合物。(3)在1L的反应瓶中,加入49g化合物,600mL二氧六环和200mL水,待固体全部溶解,分批四批共加入42.5gN-溴代丁二酰亚胺,经TLC确认无化合物,停止反应。加11g亚硫酸钠还原多余的氧化剂,反应液分散到4L水中分散,抽滤,滤饼水洗中性,干燥得47.8g白色固体化合物。(4)在500mL的反应瓶中,加入135mL吡啶、44.3g化合物及45g对甲苯磺酰氯,室温搅拌,经TLC确认无化合物,停止反应。加入到300mL1:1(V:V)冰盐酸水溶液中,搅拌,抽滤,滤饼用水洗至pH=7,抽滤,滤饼洗涤至中性,干燥得61.7g白色固体化合物。(5)在1L的反应瓶中,加入325mLN,N-二甲基甲酰胺、54g化合物、52.1gLi2CO3及60.5gLiBr,加热回流,经TLC确认无化合物,停止反应。加入到2L的1:1(V:V)的冰盐酸水溶液中,搅拌,抽滤,滤饼用水中性,干燥得32g白色固体化合物。(6)在500mL的反应瓶中按比例加入30g化合物和600mL甲酸(市售88%),升温固体样品溶解,降温至25℃以下,缓慢滴加24mL双氧水(市售30%),经TLC确认无化合物,加热至75℃维持10分钟,破坏多余的双氧水。倒入3L水充分搅拌分散。抽滤得到白色滤饼,用饱和NaHCO3溶液浸泡至无气泡,抽滤,滤饼水洗至中性,干燥得26g白色固体化合物。(7)在500mL的反应瓶中加入27g氢氧化钾,600甲醇,72mL水及23.4g化合物,加热回流,经TLC确认无化合物,反应液降至室温,倒入3L水中分散。加入盐酸调pH=7,静置分层,抽滤,滤饼洗涤至中性,丙酮重结晶,干燥得16g白色固体化合物。m.p:197~201℃;比旋光度:-50º(2mg/mL,无水乙醇);1HNMR(CDCl3,400MHz)δ:0.65(s,3H,18-CH3),0.87(s,3H,19-CH3),3.76~3.83(d,J=28Hz,2H,2-CH和3-CH);13CNMR(CDCl3,400MHz)δ:15.52(CH3),17.27(CH3),19.94(CH2),20.53(CH2),24.68(CH2),26.90(CH2),33.02(CH2),36.45(CH),39.72(CH2),40.92(C),41.26(CH2),42.54(C),44.99(CH),54.04(CH),68.94(CH),70.19(CH),79.71(C),210.65(C);IR(KBr,cm-1)v:3296,2937,1726,1064;MS(APCI)m/z:319(M-3)。化合物I的制备实施例2(1)在2L的反应瓶中按比例加入70g化合物雄甾-5-烯-3-醇,加入1200mLCH2Cl2中,搅拌下分批加入105g间氯过氧苯甲酸(mCPBA),冰浴下搅拌5h。反应结束后,反应液依次用饱和亚硫酸钠溶液、碳酸钠溶液及蒸馏水洗涤,有机层干燥,浓缩得62g黄色固体化合物。(2)将60g化合物溶于3L丙酮中,加入400mL1NH2SO4溶液,室温下搅拌反应3h。反应结束后用Na2CO3溶液将反应液调节至中性,减压浓缩除去丙酮,浓缩液用乙酸乙酯萃取,有机相用无水硫酸钠干燥,浓缩得48g黄色固体,丙酮重结晶得30.5g化合物。步骤(3)~(7)与实施例1中(3)~(7)相同。m.p:197~201℃;比旋光度:-50º(2mg/mL,无水乙醇);1HNMR(CDCl3,400MHz)δ:0.65(s,3H,18-CH3),0.87(s,3H,19-CH3),3.76~3.83(d,J=28Hz,2H,2-CH和3-CH);13CNMR(CDCl3,400MHz)δ:15.52(CH3),17.27(CH3),19.94(CH2),20.53(CH2),24.68(CH2),26.90(CH2),33.02(CH2),36.45(CH),39.72(CH2),40.92(C),41.26(CH2),42.54(C),44.99(CH),54.04(CH),68.94(CH),70.19(CH),79.71(C),210.65(C);IR(KBr,cm-1)v:3296,2937,1726,1064;MS(APCI)m/z:319(M-3)。化合物I的制备实施例3步骤(1)~(5)与实施例1中(1)~(5)相同。(6)在500mL的反应瓶中将23g化合物溶于600mLCH2Cl2中,搅拌下分批加入34.6g间氯过氧苯甲酸(mCPBA),冰浴下搅拌5h。反应结束后,反应液依次用饱和亚硫酸钠溶液、碳酸钠溶液及蒸馏水洗涤,有机层干燥,浓缩得20.7g黄色固体化合物。(7)在2L的反应瓶中将17.4g化合物,溶于900mL丙酮中,加入180mL1NH2SO4溶液,室温下搅拌反应3h。反应结束后用Na2CO3溶液将反应液调节至中性,减压浓缩除去丙酮,浓缩液用乙酸乙酯萃取,有机相用无水硫酸钠干燥,浓缩得14.4g黄色固体。丙酮重结晶,干燥得白色固体化合物。m.p:197~201℃;比旋光度:-50º(2mg/mL,无水乙醇);1HNMR(CDCl3,400MHz)δ:0.65(s,3H,18-CH3),0.87(s,3H,19-CH3),3.76~3.83(d,J=28Hz,2H,2-CH和3-CH);13CNMR(CDCl3,400MHz)δ:15.52(CH3),17.27(CH3),19.94(CH2),20.53(CH2),24.68(CH2),26.90(CH2),33.02(CH2),36.45(CH),39.72(CH2),40.92(C),41.26(CH2),42.54(C),44.99(CH),54.04(CH),68.94(CH),70.19(CH),79.71(C),210.65(C);IR(KBr,cm-1)v:3296,2937,1726,1064;MS(APCI)m/z:319(M-3)。化合物I的制备实施例4(1)在250mL反应瓶中加入14.64g雄甾-5-烯-3-醇及125mL无水吡啶,搅拌下分批加入26.05g对甲苯磺酰氯,室温反应24h。TLC检测无原料后,停止反应,剧烈搅拌下将反应物缓慢倒入2000mL17%HCl的冰水溶液中,抽滤,水洗至中性,真空干燥,得22.48g白色固体化合物。(2)在250mL反应瓶中加入15.00g化合物化合物和200mLCH2Cl2,搅拌下分批加入15.12g间氯过氧苯甲酸(mCPBA),冰浴下搅拌5h。TLC检测反应完全后,停止搅拌,反应液依次用饱和亚硫酸钠溶液、碳酸钠溶液及蒸馏水洗涤。取有机相,无水硫酸钠干燥,蒸除有机溶剂,真空干燥,得14.07g粗品,硅胶柱层析提纯得12.3g白色固体化合物。(3)在1000mL反应瓶中加入14.07g化合物和750mL丙酮,搅拌下加入30mLJones试剂,室温反应2h。经TLC检测反应完全后,用异丙醇停止反应,反应液用Na2CO3溶液调至中性,减压浓缩除去丙酮,浓缩液用乙酸乙酯萃取,有机相用蒸馏水洗涤数次后,无水硫酸钠干燥,浓缩得淡绿色固体。硅胶柱层析提纯得12.89g白色固体化合物。步骤(4)~(6)与实施例1中(5)~(7)相同。m.p:197~201℃;比旋光度:-50º(2mg/mL,无水乙醇);1HNMR(CDCl3,400MHz)δ:0.65(s,3H,18-CH3),0.87(s,3H,19-CH3),3.76~3.83(d,J=28Hz,2H,2-CH和3-CH);13CNMR(CDCl3,400MHz)δ:15.52(CH3),17.27(CH3),19.94(CH2),20.53(CH2),24.68(CH2),26.90(CH2),33.02(CH2),36.45(CH),39.72(CH2),40.92(C),41.26(CH2),42.54(C),44.99(CH),54.04(CH),68.94(CH),70.19(CH),79.71(C),210.65(C);IR(KBr,cm-1)v:3296,2937,1726,1064;MS(APCI)m/z:319(M-3)。化合物I的制备实施例5步骤(1)~(4)与实施例1中(1)~(4)相同。(5)在1L的反应瓶中,加入325mL无水N,N-二甲基甲酰胺、54g化合物、干燥的69.5gLi2CO3及80.6gLiBr,加热回流,经TLC确认无化合物,停止反应。加入到2L的1:1(V:V)的冰盐酸水溶液中,搅拌,抽滤,滤饼用水中性,干燥得32.5g白色固体化合物。步骤(6)~(7)与实施例1(6)~(7)相同。m.p:197~201℃;比旋光度:-50º(2mg/mL,无水乙醇);1HNMR(CDCl3,400MHz)δ:0.65(s,3H,18-CH3),0.87(s,3H,19-CH3),3.76~3.83(d,J=28Hz,2H,2-CH和3-CH);13CNMR(CDCl3,400MHz)δ:15.52(CH3),17.27(CH3),19.94(CH2),20.53(CH2),24.68(CH2),26.90(CH2),33.02(CH2),36.45(CH),39.72(CH2),40.92(C),41.26(CH2),42.54(C),44.99(CH),54.04(CH),68.94(CH),70.19(CH),79.71(C),210.65(C);IR(KBr,cm-1)v:3296,2937,1726,1064;MS(APCI)m/z:319(M-3)。化合物I的制备实施例6步骤(1)~(4)与实施例1中(1)~(4)相同。(5)在1L的反应瓶中,加入325mL无水N,N-二甲基甲酰胺、54g化合物、干燥的34.7gLi2CO3及40.3gLiBr,加热回流,经TLC确认无化合物,停止反应。加入到2L的1:1(V:V)的冰盐酸水溶液中,搅拌,抽滤,滤饼用水中性,干燥得30.2g白色固体化合物。步骤(6)~(7)与实施例3(6)~(7)相同。m.p:197~201℃;比旋光度:-50º(2mg/mL,无水乙醇);1HNMR(CDCl3,400MHz)δ:0.65(s,3H,18-CH3),0.87(s,3H,19-CH3),3.76~3.83(d,J=28Hz,2H,2-CH和3-CH);13CNMR(CDCl3,400MHz)δ:15.52(CH3),17.27(CH3),19.94(CH2),20.53(CH2),24.68(CH2),26.90(CH2),33.02(CH2),36.45(CH),39.72(CH2),40.92(C),41.26(CH2),42.54(C),44.99(CH),54.04(CH),68.94(CH),70.19(CH),79.71(C),210.65(C);IR(KBr,cm-1)v:3296,2937,1726,1064;MS(APCI)m/z:319(M-3)。化合物I的制备实施例7步骤(1)~(4)与实施例1(1)~(4)相同。(5)在1L的反应瓶中,加入432mL无水N,N-二甲基甲酰胺、54g化合物、干燥的52.1gLi2CO3及60.5gLiBr,加热回流,经TLC确认无化合物,停止反应。加入到2L的1:1(V:V)的冰盐酸水溶液中,搅拌,抽滤,滤饼用水中性,干燥得30.5g白色固体化合物。(6)在500mL的反应瓶中按比例加入30g化合物和600mL甲酸(市售88%),升温固体样品溶解,降温至25℃以下,缓慢滴加20mL双氧水(市售30%),经TLC确认无化合物,加热至75℃维持10分钟,破坏多余的双氧水。倒入3L水充分搅拌分散。抽滤得到白色滤饼,用饱和NaHCO3溶液浸泡至无气泡,抽滤,滤饼水洗至中性,干燥得28g白色固体化合物。(7)在500mL的反应瓶中加入18g氢氧化钾,600甲醇,72mL水及25g化合物,加热回流,经TLC确认无化合物,反应液降至室温,倒入3L水中分散。加入盐酸调pH=7,静置分层,抽滤,滤饼洗涤至中性,丙酮重结晶,干燥得8.8g白色固体化合物。m.p:197~201℃;比旋光度:-50º(2mg/mL,无水乙醇);1HNMR(CDCl3,400MHz)δ:0.65(s,3H,18-CH3),0.87(s,3H,19-CH3),3.76~3.83(d,J=28Hz,2H,2-CH和3-CH);13CNMR(CDCl3,400MHz)δ:15.52(CH3),17.27(CH3),19.94(CH2),20.53(CH2),24.68(CH2),26.90(CH2),33.02(CH2),36.45(CH),39.72(CH2),40.92(C),41.26(CH2),42.54(C),44.99(CH),54.04(CH),68.94(CH),70.19(CH),79.71(C),210.65(C);IR(KBr,cm-1)v:3296,2937,1726,1064;MS(APCI)m/z:319(M-3)。化合物I的制备实施例8步骤(1)~(5)与实施例7(1)~(5)相同。(6)在500mL的反应瓶中按比例加入30g化合物和600mL甲酸(市售88%),升温固体样品溶解,降温至25℃以下,缓慢滴加36mL双氧水(市售30%),经TLC确认无化合物,加热至75℃维持10分钟,破坏多余的双氧水。倒入3L水充分搅拌分散。抽滤得到白色滤饼,用饱和NaHCO3溶液浸泡至无气泡,抽滤,滤饼水洗至中性,干燥得24g白色固体化合物。步骤(7)与实施例7(7)相同。m.p:197~201℃;比旋光度:-50º(2mg/mL,无水乙醇);1HNMR(CDCl3,400MHz)δ:0.65(s,3H,18-CH3),0.87(s,3H,19-CH3),3.76~3.83(d,J=28Hz,2H,2-CH和3-CH);13CNMR(CDCl3,400MHz)δ:15.52(CH3),17.27(CH3),19.94(CH2),20.53(CH2),24.68(CH2),26.90(CH2),33.02(CH2),36.45(CH),39.72(CH2),40.92(C),41.26(CH2),42.54(C),44.99(CH),54.04(CH),68.94(CH),70.19(CH),79.71(C),210.65(C);IR(KBr,cm-1)v:3296,2937,1726,1064;MS(APCI)m/z:319(M-3)。化合物I的制备实施例9步骤(1)~(5)与实施例7(1)~(5)相同。(6)在500mL的反应瓶中按比例加入30g化合物和600mL甲酸(市售88%),升温固体样品溶解,降温至25℃以下,缓慢滴加45mL双氧水(市售30%),经TLC确认无化合物,加热至75℃维持10分钟,破坏多余的双氧水。倒入3L水充分搅拌分散。抽滤得到白色滤饼,用饱和NaHCO3溶液浸泡至无气泡,抽滤,滤饼水洗至中性,干燥得23g白色固体化合物。(7)在500mL的反应瓶中加入27g氢氧化钾,300甲醇,36mL水及12.5g化合物,加热回流,经TLC确认无化合物,反应液降至室温,倒入3L水中分散。加入盐酸调pH=7,静置分层,抽滤,滤饼洗涤至中性,丙酮重结晶,干燥得8.0白色固体化合物。m.p:197~201℃;比旋光度:-50º(2mg/mL,无水乙醇);1HNMR(CDCl3,400MHz)δ:0.65(s,3H,18-CH3),0.87(s,3H,19-CH3),3.76~3.83(d,J=28Hz,2H,2-CH和3-CH);13CNMR(CDCl3,400MHz)δ:15.52(CH3),17.27(CH3),19.94(CH2),20.53(CH2),24.68(CH2),26.90(CH2),33.02(CH2),36.45(CH),39.72(CH2),40.92(C),41.26(CH2),42.54(C),44.99(CH),54.04(CH),68.94(CH),70.19(CH),79.71(C),210.65(C);IR(KBr,cm-1)v:3296,2937,1726,1064;MS(APCI)m/z:319(M-3)。化合物I的抑瘤效果(1)接种细胞、给药处理:选择对数生长期LN18细胞和DBTRG-50MG细胞,用完全培养液调制成细胞悬液,以每孔100μl、3×104/ml的密度接种在96孔培养板内。12h后见细胞完全贴壁,加入YC-10,使YC-10终浓度分别为250、500、1000μM,每组浓度均设5个复孔。(2)MTT与细胞内的琥珀酸脱氢酶反应:培养至24h时,每孔加入MTT10μl(5mg/ml),继续孵育4h,此时镜检可观察到活细胞内形成的颗粒状蓝紫色甲臜结晶。(3)溶解甲臜颗粒:小心吸去上清,加DMSO100μl/孔溶解形成的结晶,在微型振荡器上震荡5min,然后在酶联检测仪上用波长570nm检测各孔的光密度(OD值)。每组实验重复3次。细胞生存率=药物处理组OD值/对照组OD值×100%。所有数据用均数士标准差表示,运用SPSS13.0统计软件包,采用one-WayANOVA方差分析以及t-test检验,使用Sigmaplot软件得到图1。由图1可知,分别用250、500、1000μM的YC-10处理24h后,给药组生存率与对照组生存率比较都是有统计学意义的(P<0.05)。YC-10成剂量依赖性的杀伤肿瘤细胞。化合物I的神经保护作用为了探讨YC-10是否具有神经保护的作用以及开发为临床药物的潜力,针对YC-10的毒性和药效开展各项体外体内研究。研究结果显示,摄取大剂量的YC-10(250mg/kg)的小鼠,在摄药后的14天内无明显异常;体外培养的原代小脑颗粒神经元谷氨酸模型和低钾模型的研究结果显示,YC-10具有明显的保护小脑颗粒神经元存活的作用;视神经损伤和视网膜缺血的动物模型研究结果显示,在视神经轴突损伤和视网膜缺血的情况下,YC-10都具有明显的保护视神经节细胞存活的作用。以上研究结果说明,YC-10无明显的毒副作用,且具有神经保护作用。1毒理研究结果最大耐受量试验:用40%羟丙环糊精配制浓度为25mg/ml的YC-10注射液,对30只(雌雄各半)体重为18-22g的昆明小鼠进行尾静脉注射(0.1ml/10g)。持续对小鼠进行观察,所有小鼠活动、进食如常,毛色光亮,皮毛无疏松,口、眼、鼻、耳无异常分泌物,大小便正常;体重有所增长,全部小鼠无一死亡。观察14天后处死动物,解剖并肉眼检查心、肝、脾、肺、肾、胃肠等重要脏器,结果均未见异常改变。结果显示,250mg/kg的YC-10对小鼠无毒性。2药理研究结果2.1YC-10对谷氨酸介导的小脑颗粒神经元损伤的保护作用体外培养第8天的大鼠小脑颗粒神经元,给药组预先给予MK801或不同浓度的YC-10进行预孵30min,然后模型组和所有给药组换成无Mg2+的Locke缓冲液,同时给予终浓度为100μM谷氨酸、10μM甘氨酸和相应浓度的药物,置于37℃培养箱孵育30min后换回正常培养基,继续培养24h后进行FDA染色。如图2所示,镜下观察发现,谷氨酸可以诱导小脑颗粒神经元的损伤死亡,MK801能够阻止谷氨酸对小脑颗粒神经元造成的损伤,而YC-10同样可浓度依赖性地阻止谷氨酸介导的神经元兴奋性毒性损伤。结果显示,YC-10对谷氨酸介导的小脑颗粒神经元损伤具有保护作用,并且呈浓度依赖性(图3)。2.2YC-10对低钾诱导的小脑颗粒神经元死亡的保护作用体外培养第8天的大鼠小脑颗粒神经元,给药组预先给予不同浓度的YC-10孵育30min,然后模型组和给药组换成5K(即5mMKCl)的BME培养基(对照组为25K),同时给予相应浓度的YC-10,置于37℃培养箱继续培养,24h后进行FDA染色。如图4所示,镜下观察发现,低钾培养基可以诱导小脑颗粒神经元的死亡,而较高浓度(50μM)的YC-10可阻止低钾培养基诱导的神经元死亡。结果显示,YC-10对低钾诱导的小脑颗粒神经元死亡具有保护作用。2.3YC-10对视神经夹闭损伤引起的视神经节细胞死亡的保护作用10%水合氯醛麻醉大鼠,术前20min尾静脉给予YC-10(20mg/kg)或溶剂,然后眼部局部麻醉,用角膜剪和显微镊沿角膜缘剪开结膜,钝性分离外直肌,充分暴露视神经,用反向夹持镊于眼球后约2mm处钳夹视神经5秒后松开,术后涂抹抗生素眼膏防止感染。术后2小时、第二天和第三天再次给药,7天后取眼球进行病理检查。如图5所示,病理结果显示,视神经夹闭损伤能引起视网膜视神经节细胞(RGC)的死亡消失,而YC-10能减缓或防止视神经节细胞在夹闭损伤下的死亡消失,说明YC-10对视神经夹闭损伤引起的视神经节细胞死亡具有保护作用。视神经夹闭损伤模型中各组样本的RGC数量统计数据如图6所示。2.4YC-10对眼球高压缺血引起的视神经节细胞死亡的的保护作用10%水合氯醛麻醉大鼠,眼部局部麻醉,安放好灌流装置,使灌流液面距离大鼠眼球水平面176cm(可增加约130mmHg眼内压),管口连接30G1/2针头,小心插入眼前房,此时可见眼球明显变白并记录缺血起始时间。1小时后迅速将针头拔出,用抗生素眼药水护理后放回笼中饲养。溶剂组和YC-10组(20mg/kg)在造模前20min尾静脉给药,造模结束后2小时、第二天和第三天再次尾静脉给药。造模7天后取眼球进行病理检查。如图7所示,病理结果显示,眼球高压缺血能引起视网膜视神经节细胞(RGC)的死亡消失,而YC-10能减少或减缓视神经节细胞在缺血损伤下的死亡消失,说明YC-10对眼球高压缺血引起的视神经节细胞死亡具有保护作用。高压缺血模型中各组样本的RGC数量统计数据如图8所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1