一种重组人尿激酶原的纯化方法与流程
本发明属于生物技术领域,尤其是涉及一种重组人尿激酶原的纯化方法。
背景技术:
尿激酶原(Prourokinase,简称pro-UK)是一类丝氨酸蛋白酶,可以激活体内的纤溶酶原转变成有活性的纤溶酶,从而溶解血栓中的纤维蛋白,因此在溶血栓的治疗方面有着广泛的应用。pro-UK中Lys158-Ile159间肽键容易被纤溶酶及其他一些酶类水解,生成尿激酶(urokinase,简称UK)。UK由A链和B链两条肽链组成,靠链间二硫键连接。和UK相比,pro-UK和纤维蛋白的亲和力较高,激活纤溶系统的部位常在血栓形成的部位,因而引起全身出血倾向的副作用要比尿激酶小,是一种更优越的纤溶酶原激活剂。Pro-UK和UK之间往往只有一个多肽键的差异,两者在分子表面特性、抗原性以及分子量方面非常相似,pro-UK也极易转化为UK,常规层析方法难以将其分离,所以细胞表达的发酵液纯化一方面要除去培养基和细胞正常代谢产物,另一方面要去除UK,因此pro-UK下游纯化非常困难。
中国专利CN1680550A公开了一种重组人尿激酶原的纯化方法,包括如下4步:A、用阳离子交换Streamline-SP扩张床色谱从工程细胞培养上清中回收重组人尿激酶原;B、用Sephacryl S-200凝胶色谱进一步纯化上述A收集的尿激酶原粗品;C、用对氨基苯甲脒-Sepharose Fast Flow亲和色谱法除去粗产品中的尿激酶;D、用DEAE-Sepharose Fast Flow阴离子交换色谱除去重组人尿激酶原中残留细胞的DNA。其中,为了达到更好地实验效果,在步骤C和D之间还可包括步骤E:用阳离子交换Streamline-SP固定床色谱浓缩尿激酶原,浓缩可达10~15倍左右,以方便后续操作。
然而,该方法仍然存在蛋白纯度不高、会存在DNA、宿主细胞残留蛋白及病毒等外源性污染的问题。CN1680550A的方法安全性不高,主要原因是完成D步骤后是产品原液,原液将作为注射用重组人尿激酶原的原料进行制剂,但D步骤中所采用的Tris-HCl缓冲液将会进入到成品,直接通过静脉注射进入人体。Tris-HCl缓冲液一般只用于研究,对人体具有一定的刺激性,直接进入人体会对人体产生一定的危害,因此不适宜作为原液的缓冲体系。
为了适应临床研究,提供一种临床安全有效、副作用小、高纯度的重组人尿激酶原纯化方法是急需要解决的事情。
技术实现要素:
为了解决上述技术问题,本发明提供了一种新的CHO细胞表达的重组人尿激酶原的蛋白纯化方法,该方法得到蛋白纯度不低于98%,且有效清除了Tris-HCl缓冲液的残留,降低了临床使用风险。
本发明是通过以下技术方案实现的:
本发明以CHO细胞表达的重组人尿激酶原发酵液为起始原料,通过纯化步骤得到一种高纯度重组人尿激酶原。
本发明的重组人尿激酶原的纯化方法,包括如下步骤:
步骤(1)蛋白捕获:尿激酶原发酵液选用阳离子交换层析法得到纯化中间体1;
步骤(2)凝胶层析:中间体1通过凝胶层析法获得纯化中间体2;
步骤(3)阳离子交换层析:中间体2通过阳离子交换层析法获得纯化中间体3;
步骤(4)亲和层析:中间体3通过亲和层析法获得纯化中间体4;
步骤(5)阴离子交换层析:中间体4通过阴离子交换层析法获得纯化中间体5;
步骤(6)阳离子交换层析:中间体5通过阳离子交换层析法获得尿激酶原原液。
其中,所述步骤(1)蛋白捕获:方法如下:发酵液过滤,取上清液调节pH值至5.5~6.5后阳离子交换层柱法上样(优选pH值至6.0),采用0.005~0.015mol/L(优选0.008~0.01mol/L)磷酸盐缓冲液洗脱,根据UV 280紫外吸收曲线收集洗脱蛋白峰,即为纯化中间体1。
所述的重组人尿激酶原发酵液属于现有技术,可以通过CN 1062016、CN1178244(说明书第5页7-9的方法)、公开的方法制备得到。
所述的阳离子交换层析柱填料包括但不限于Streamline SP、SP Sepharose F.F.,优选Streamline SP为介质的阳离子填料。所述的磷酸盐缓冲液为含NaCl的磷酸盐溶液,优选pH6.0±0.5含0.05~0.7mol/L NaCl。
为达到更好的洗脱效果,优选先用磷酸盐缓冲液平衡层析柱后再上样洗脱,所述平衡层析柱的磷酸盐缓冲液含NaCl的浓度低于洗脱时磷酸盐缓冲液含NaCl的浓度,也就是说低盐磷酸盐缓冲液平衡层析柱,再用高盐磷酸盐缓冲液洗脱层析柱。目的是通过缓冲液平衡使目标蛋白带正电荷,吸附在填料上,再通过缓冲液使目标蛋白带负电荷洗脱下来。缓冲液的pH值可以改变目标蛋白的电荷性质,盐离子(NaCl)浓度调节电荷强度。平衡层析柱时的磷酸盐缓冲液中加入低浓度的NaCl可增加目标蛋白的电荷强度,从而增强阳离子填料对目标蛋白的捕获能力。接下来通过高盐(NaCl的浓度高于平衡时NaCl浓度)缓冲液洗脱使目标蛋白 的离子强度降低,降低其与目标蛋白的结合能力。如果洗脱时的缓冲液盐离子浓度过高(>0.7mol/L NaCl)会将吸附在填料上的其它杂蛋白一并洗脱下来进入纯化中间体1。因此本发明的洗脱时磷酸缓冲液的浓度pH6.0±0.5含0.3-0.7mol/L NaCl。
具体为,
步骤(1)以Streamline SP阳离子填料为介质进行交换层析。层析柱采用0.005~0.015mol/L磷酸盐缓冲液(pH6.0±0.5含0.05~0.15mol/L NaCl)进行平衡,发酵液取上清液调节pH值至5.5~6.5后上样,采用0.005~0.015mol/L磷酸盐缓冲液(pH6.0±0.5含0.3-0.7mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集洗脱蛋白峰,即为纯化中间体1。
其中,所述步骤(2)凝胶层析:方法如下:中间体1上凝胶层析柱后,采用0.005~0.015mol/L磷酸盐缓冲液洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰即为纯化中间体2。
所述的凝胶层析柱的填料包括但不限于Sephacryl S-200HR、Sephadex G-50,优选Sephacryl S-200HR凝胶分子筛。所述的磷酸盐缓冲液为含NaCl的磷酸盐溶液,优选(pH6.0±0.5含0.05~0.12mol/L NaCl)。
为达到更好的洗脱效果,优选先用磷酸盐缓冲液层析柱后再上样洗脱,平衡时磷酸盐缓冲液浓度与洗脱时磷酸盐缓冲液相同。
具体为,
以Sephacryl S-200HR凝胶分子筛填料为介质进行凝胶层析。层析柱采用0.005~0.015mol/L磷酸盐平衡缓冲液(pH6.0±0.5含0.05~0.12mol/L NaCl)进行平衡,将纯化中间体1直接上样,采用0.005~0.015mol/L磷酸盐洗脱缓冲液(pH6.0±0.5含0.05~0.12mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化中间体2。
其中,所述步骤(3)阳离子交换层析:方法如下:中间体2调节pH值至6.0±0.5后阳离子交换层析柱上样,用0.005~0.015mol/L磷酸盐缓冲液洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化中间体3。
所述的阳离子交换层析柱填料包括但不限于SP Sepharose F.F.、SP Sephadex C-50,优选SP Sepharose F.F.阳离子填料。所述的磷酸盐缓冲液为含NaCl溶液,优选pH5.5~7.5含0.05~0.35mol/L NaCl。
为达到更好的洗脱效果,优选先用磷酸盐缓冲液平衡层析柱后再上样洗脱。所述平衡层 析柱的磷酸盐缓冲液含NaCl浓度低于洗脱时磷酸盐缓冲液含NaCl浓度,也就是说低盐磷酸盐缓冲液平衡层析柱,再用高盐磷酸盐缓冲液洗脱层析柱。优选(pH6.0±0.5含0.05~0.15mol/L NaCl)进行平衡。所述的磷酸盐缓冲液洗脱时,采用从低盐到高盐两步梯度洗脱,优选pH5.5~7.5含0.20~0.35mol/L NaCl。第一次用低盐的缓冲液洗脱,洗脱杂质蛋白,第二次用高盐的缓冲液洗脱,收集目标蛋白,同时可以将纯化中间体3进行浓缩。这样获得的纯化3中间体的杂蛋白更少,目标蛋白量不变,但体积更小了,便于生产贮存。
具体为:
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.005~0.015mol/L磷酸盐缓冲液(pH6.0±0.5含0.05~0.15mol/L NaCl)进行平衡,将纯化中间体2调节pH值至6.0±0.5后上样,采用0.005~0.015mol/L磷酸盐低盐缓冲液(pH6.0±0.5含0.20~0.26mol/L NaCl)洗脱杂质,0.005~0.015mol/L磷酸盐高盐缓冲液(pH7.0±0.5含0.28~0.35mol/L NaCl)洗脱目标蛋白,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化中间体3。
纯化中间体3可于-20℃以下冷冻储存。待需要下一步操作时可提前取出复融混合,并进行第4步操作。
该步骤(3)能够更好的分离杂质蛋白及目标蛋白,浓缩得到高纯度的中间体3。
其中,所述步骤(4)亲和层析:方法如下:纯化中间体3pH值至7.0±0.5后亲和层析柱上样,采用0.005~0.015mol/L磷酸盐洗脱缓冲液进行洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化中间体4。
所述的亲和层析柱填料包括但不限于Benzamidine Sepharose 4FF H-sub、Arginine Sepharose 4B,优选BenzamidineSepharose 4FF H-sub亲和填料。所述的磷酸盐缓冲液为含NaCl溶液,优选pH7.0±0.5含0.3~0.5mol/L NaCl。
优选先用磷酸盐缓冲液层析柱后再上样洗脱,平衡时磷酸盐缓冲液浓度与洗脱时磷酸盐缓冲液相同。
步骤(4)主要目的是出去UK,具体为,
以BenzamidineSepharose 4FF H-sub亲和填料为介质进行亲和层析。层析柱采用0.005~0.015mol/L磷酸盐缓冲液(pH7.0±0.5含0.3~0.5mol/L NaCl)进行平衡。根据制剂所需蛋白量要求取多批纯化3中间体的冷冻蛋白溶液复融及混合,混合溶液调节pH值至7.0±0.5 后上样。采用0.005~0.015mol/L磷酸盐缓冲液(pH7.0±0.5含0.3~0.5mol/L NaCl)进行洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化4中间体。
其中,所述步骤(5)阴离子交换层析:方法如下:纯化中间体4与0.02~0.035mol/L Tris-HCl缓冲液(pH8.0±0.5)按1:1.5~3体积比混合(优选1:2),调节pH值至8.0±0.5后阴离子交换柱上样,用0.015~0.025mol/L Tris-HCl缓冲液洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化中间体5。
所述的阴离子交换柱填料包括但不限于Streamline DEAE、DEAE Sephacel DE-52,优选Streamline DEAE阴离子填料。所述的Tris-HCl缓冲液为含盐或不含盐的Tris-HCl缓冲液,优选pH8.0±0.5含0~0.20mol/L NaCl,进一步优选中间体4与不含盐Tris-HCl缓冲液混合。优选先用Tris-HCl含盐缓冲液平衡层析柱后再上样洗脱,平衡时Tris-HCl缓冲液含盐浓度高于洗脱时Tris-HCl缓冲液含盐浓度。优选平衡时Tris-HCl缓冲液液pH8.0±0.5含0.05~0.20mol/L NaCl,洗脱时Tris-HCl洗脱缓冲液(pH8.0±0.5含0.05~0.15mol/L NaCl)。
具体,本发明第5步阴离子层析的原理是,通过阴离子填料吸附带负电荷的DNA、宿主细胞残留蛋白及病毒等。在Tris-HCl缓冲液基础上增加NaCl,增强杂质的负电荷强度,从而增加阴离子填料对DNA等杂质的吸附。
以Streamline DEAE阴离子填料为介质进行交换层析。层析柱采用0.015~0.025mol/L Tris-HCl平衡缓冲液(pH8.0±0.5含0.05~0.20mol/L NaCl)进行平衡。纯化中间体4与0.02~0.035mol/L Tris-HCl缓冲液(pH8.0±0.5)按1:2体积比混合,调节pH值至8.0±0.5后上样,用0.015~0.025mol/L Tris-HCl洗脱缓冲液(pH8.0±0.5含0.05~0.15mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化5中间体。
其中,所述步骤(6)阳离子交换层析:方法如下:纯化中间体5调节pH值至6.0±0.5后阳离子交换层析柱上样,采用0.005~0.015mol/L磷酸盐缓冲液洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为本发明所要得到的尿激酶原。
所述的阳离子交换层析柱填料包括但不限于SP Sepharose F.F.、SP Sephadex C-50,优选SP Sepharose F.F.阳离子填料,本发明所述的磷酸盐缓冲液为含NaCl溶液,优选pH5.5~7.5含0.05~0.5mol/L NaCl。
为了更好的洗脱,优选先用磷酸盐缓冲液层析柱后再上样洗脱,所述平衡层析柱的磷酸盐缓冲液含NaCl浓度低于洗脱时磷酸盐缓冲液含NaCl浓度,也就是说低盐磷酸盐缓冲液平 衡层析柱,再用高盐磷酸盐缓冲液洗脱层析柱。优选(pH6.0±0.5含0.05~0.15mol/L NaCl)进行平衡,用(pH7.0±0.5含0.3~0.5mol/L NaCl)洗脱。
该步骤(6)用磷酸盐缓冲液洗脱纯化中间体5,替换了Tris-HCl缓冲液体系,减少刺激性,提高了对人体的安全性,还除去了病毒。
具体为:
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.005~0.015mol/L磷酸盐缓冲液(pH6.0±0.5含0.05~0.15mol/L NaCl)进行平衡。纯化中间体5调节pH值至6.0±0.5后上样,采用0.005~0.015mol/L磷酸盐缓冲液(pH7.0±0.5含0.3~0.5mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为本发明所要得到的尿激酶原。
本发明步骤(1)~(6)中所述的缓冲液流速优选0.008~0.01mol/L。
本发明的有益效果
为了说明本发明的有益效果,通过下述试验例来阐述
试验例一,本发明的方法与现有技术的比较
现有技术:CN1680550A
本发明方法:实施例1
(一)、增加纯化第3步阳离子交换层析
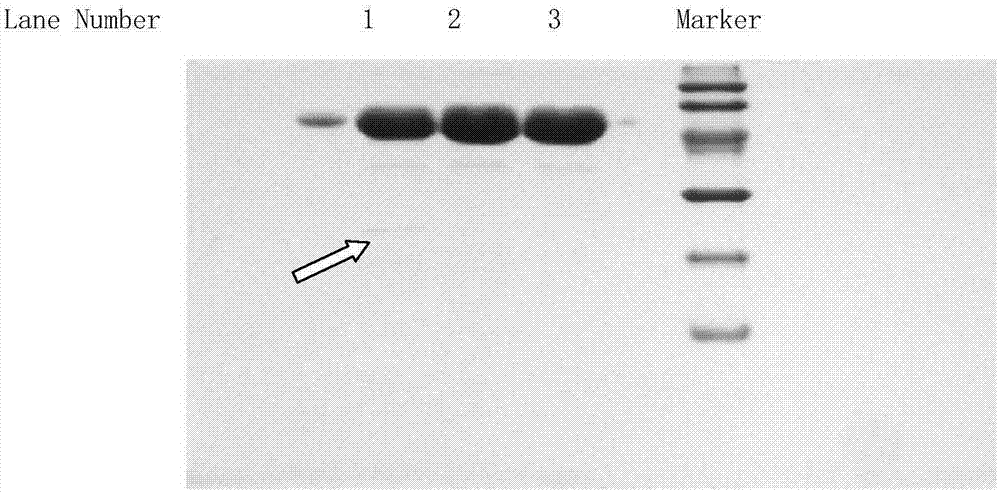
试验方法:细胞发酵液分别按照CN1680550A中的方法和本发明方法进行纯化前2步和前3步的操作。按照CN1680550A中的方法经过纯化第1步和第2步后,收集纯化中间体2,本发明方法收集纯化中间体3,分别进行SDS-PAGE电泳。
试验结果:经过图1比较,按照CN1680550A中的方法,在进行第二步凝胶层析后直接将重组人尿激酶原纯化2中间体进行上样,可见含有一条20KD左右的杂质蛋白条带(件条带1);而在本发明的方法中,加入SP Sepharose F.F.阳离子交换层析的步骤,并分别采用0.005~0.015mol/L磷酸盐高盐洗脱缓冲液(pH7.0±0.5含0.28~0.35mol/L NaCl)(见条带2)和0.005~0.015mol/L磷酸盐低盐洗脱缓冲液(pH6.0±0.5含0.20~0.26mol/L NaCl)(见条带3)的洗脱液进行洗脱,发现均可将20KD左右的杂质蛋白除去。
由于用0.005~0.015mol/L磷酸盐低盐洗脱缓冲液(pH6.0±0.5含0.20~0.26mol/L NaCl)洗脱目标蛋白时,洗脱体积较大,所以最终选择0.005~0.015mol/L磷酸盐低盐洗脱缓冲液(pH6.0±0.5含0.20~0.26mol/L NaCl)与0.005~0.015mol/L磷酸盐高盐洗脱缓冲液(pH7.0±0.5含0.28~0.35mol/L NaCl)共同作为生产过程中最终洗脱目标蛋白缓冲液较为合适。
表1纯度比较
表1可见,在CN1680550A的纯化方法中,没有SP Sepharose F.F.阳离子交换层析的步骤,
在进行凝胶层析之后,直接进行亲和层析,导致蛋白纯度不高,仅为90.660%~96.627%。而在本发明的方法中,增加SP Sepharose F.F.阳离子交换层析的步骤,可使蛋白纯度提高至98.3%~99.8%。
(二)优化纯化第2步凝胶层析缓冲体系中的pH值和盐浓度
1、试验方法:降低CN1680550A中的方法纯化第2步的缓体液的PH值和盐浓度,将纯化1中间体进行纯化第2步时,以吸收峰的最高点为分界线,分别进行吸收,分为前半峰和后半峰,将收到的两个样品分别进行第3步,然后对第3步收到的纯化3中间体进行宿主蛋白残留量(用酶联免疫法检测,按试剂盒使用说明书进行测定。)和SDS-PAGE的检验(药典方法)。
1.1降低纯化第2步凝胶层析缓冲体系中的pH值和盐浓度的电泳图比较
CN1680550A方法:将纯化1中间体进行第2步凝胶层析;
本发明:以Sephacryl S-200HR凝胶分子筛填料为介质进行凝胶层析,层析柱采用0.005~0.015mol/L磷酸盐平衡缓冲液(pH6.0±0.5含0.05~0.12mol/L NaCl)进行平衡,将纯化中间体1直接上样,采用0.005~0.015mol/L磷酸盐洗脱缓冲液(pH6.0±0.5含0.05~0.12mol/L NaCl)洗脱。
1.2降低纯化第2步凝胶层析的缓冲体系中的pH值和盐浓度前后纯化2中间体,分别通过第三步SP Sepharose F.F.阳离子交换层析后的纯化3中间体的电泳图比较。
CN1680550A方法:进行第二步凝胶层析后按本发明纯化第3步进行纯化后,将纯化3中 间体直接上样;
本发明的方法:以Sephacryl S-200HR凝胶分子筛填料为介质进行凝胶层析。层析柱采用0.005~0.015mol/L磷酸盐平衡缓冲液(pH6.0±0.5含0.05~0.12mol/L NaCl)进行平衡,将纯化中间体1直接上样,采用0.005~0.015mol/L磷酸盐洗脱缓冲液(pH6.0±0.5含0.05~0.12mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰得到纯化中间体2;采用0.005~0.015mol/L磷酸盐高盐洗脱缓冲液(pH7.0±0.5含0.28~0.35mol/L NaCl)进行洗脱;
本发明的方法:采用0.005~0.015mol/L磷酸盐低盐洗脱缓冲液(pH6.0±0.5含0.20~0.26mol/L NaCl)进行洗脱得到纯化3中间体进行上样。
2、试验结果:
2.1图2可见,通过降低纯化第2步凝胶层析的缓冲体系中的pH值和盐浓度,使得凝胶填料对蛋白产生非特异性吸附,延迟目标蛋白峰(峰2)的出峰位置,扩大凝胶的第二杂质峰和主峰之间的间距,分离度大于CN1680550A,从而提高蛋白纯度。
2.2本发明获得的纯化3中间体宿主细胞蛋白残留量远低于CN1680550A中获得的纯化3中间体,优化后去除宿主细胞蛋白能力提高2倍~5倍。见表2。
表2纯化中间体3宿主蛋白残留量(%)
2.3见图3,通过降低纯化第2步凝胶层析的缓冲体系中的pH值和盐浓度前后纯化2中间体,分别通过第三步SP Sepharose F.F.阳离子交换层析后的纯化3中间体,可以去除CN1680550A方法不能去除的28KD和32KD的杂蛋白,从而提高了目标蛋白纯度。纯化3中间体SDS-PAGE电泳纯度数据见表3。
表3 SDS-PAGE电泳纯度(%)
综上所述,本发明对CN1680550A中的工艺进行了优化和改进,增加步骤(3)并通过对纯化第2步过程中缓冲液及盐离子浓度的调整,大大降低了杂蛋白的量,提高了目标蛋白纯度,同时大幅降低了DAN、宿主细胞残留蛋白及病毒等外源性污染。并通过第6步采用磷酸盐缓冲液替换Tris-HCl缓冲液,提高了产品的安全性,降低了制剂的临床应用风险,为制剂产品的产业化打下了良好的基础。
附图说明
图1:增加SP Sepharose F.F.阳离子交换层析前后的样品电泳对比图,其中
条带1、CN1680550A方法中,在进行第二步凝胶层析后纯化中间体2直接上样,
条带2、本发明的方法中,采用0.005~0.015mol/L磷酸盐高盐洗脱缓冲液(pH7.0±0.5含0.28~0.35mol/L NaCl)进行洗脱;
条带3、本发明的方法中,采用0.005~0.015mol/L磷酸盐低盐洗脱缓冲液(pH6.0±0.5含0.20~0.26mol/L NaCl)进行洗脱。
图2:降低纯化第2步凝胶层析的缓冲体系中的pH值和盐浓度前后纯化中间体2,分别通过
第三步SP Sepharose F.F.阳离子交换层析后的纯化中间体3电泳图。
色谱峰1:CN1680550A凝胶层析图谱目标蛋白峰
色谱峰2:本发明凝胶层析图谱目标蛋白峰
图3、降低纯化第2步凝胶层析的缓冲体系中的pH值和盐浓度前后纯化2中间体,其中
条带1:纯化第2步凝胶层析上样前样品
条带2:本发明凝胶层析前半峰
条带3:本发明凝胶层析后半峰
条带4:CN1680550A凝胶层析前半峰
条带5:CN1680550A凝胶层析后半峰
具体实施方式
实施例1
纯化第1步:蛋白捕获
以Streamline SP阳离子填料为介质进行交换层析。层析柱采用0.01mol/L磷酸盐缓冲液(pH6.0含0.1mol/L NaCl)进行平衡,发酵液取上清液调节pH值至6.0后上样,采用0.01mol/L磷酸盐缓冲液(pH6.0含0.5mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集洗脱蛋白峰,即为纯化1中间体。
纯化第2步:凝胶层析
以Sephacryl S-200HR凝胶分子筛填料为介质进行凝胶层析。层析柱采用0.01mol/L磷酸盐缓冲液(pH6.0含0.09mol/L NaCl)进行平衡,将纯化1中间体直接上样,采用0.01mol/L磷酸盐缓冲液(pH6.0含0.09mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化2中间体。
纯化第3步:阳离子交换层析
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.01mol/L磷酸盐缓冲液(pH6.0含0.1mol/L NaCl)进行平衡,将纯化2中间体调节pH值至6.0后上样,采用0.01mol/L磷酸盐低盐缓冲液(pH6.0含0.25mol/L NaCl)洗脱杂质,0.01mol/L磷酸盐高盐缓冲液(pH7.0含0.3mol/L NaCl)洗脱目标蛋白,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化3中间体。于-20℃以下冷冻储存。
纯化第4步:亲和层析
以BenzamidineSepharose 4FF H-sub亲和填料为介质进行亲和层析。层析柱采用0.01mol/L磷酸盐缓冲液(pH7.0含0.4mol/L NaCl)进行平衡。根据制剂所需蛋白量要求取多批纯化3中间体的冷冻蛋白溶液复融及混合,混合溶液调节pH值至7.0后上样。采用0.01mol/L磷酸盐缓冲液(pH7.0含0.4mol/L NaCl)进行洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化4中间体。
纯化第5步:阴离子交换层析
以Streamline DEAE阴离子填料为介质进行交换层析。层析柱采用0.02mol/L Tris-HCl缓冲液(pH8.0含0.1mol/L NaCl)进行平衡。纯化4中间体与0.03mol/L Tris-HCl缓冲液(pH8.0)按1:2体积比混合,调节pH值至8.0后上样,用0.02mol/L Tris-HCl缓冲液(pH8.0含0.1mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化5中间体。
纯化第6步:阳离子交换层析
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.01mol/L磷酸盐缓冲液(pH6.0含0.1mol/L NaCl)进行平衡。纯化5中间体调节pH值至6.0后上样,采用0.01mol/L磷酸盐缓冲液(pH7.0含0.4mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为本发明所要得到的尿激酶原。
实施例2
纯化第1步:蛋白捕获
以Streamline SP阳离子填料为介质进行交换层析。层析柱采用0.005mol/L磷酸盐缓冲液(pH5.5含0.05mol/L NaCl)进行平衡,发酵液取上清液调节pH值至5.5后上样,采用0.005mol/L磷酸盐缓冲液(pH5.5含0.3mol/L NaCl洗脱,根据UV 280紫外吸收曲线收集洗脱蛋白峰,即为纯化1中间体。
纯化第2步:凝胶层析
以Sephacryl S-200HR凝胶分子筛填料为介质进行凝胶层析。层析柱采用0.005mol/L磷酸盐缓冲液(pH5.5含0.05mol/L NaCl)进行平衡,将纯化1中间体直接上样,采用0.005mol/L磷酸盐缓冲液(pH5.5含0.05mol/LNaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化2中间体。
纯化第3步:阳离子交换层析
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.005mol/L磷酸盐缓冲液(pH5.5含0.05mol/L NaCl)进行平衡,将纯化2中间体调节pH值至5.5后上样,采用0.005mol/L磷酸盐低盐缓冲液(pH5.5含0.20mol/L NaCl)洗脱杂质,0.005mol/L磷酸盐高盐缓冲液(pH6.5含0.28mol/L NaCl)洗脱目标蛋白,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化3中间体。于-20℃以下冷冻储存。
纯化第4步:亲和层析
以BenzamidineSepharose 4FF H-sub亲和填料为介质进行亲和层析。层析柱采用0.005mol/L磷酸盐缓冲液(pH6.5含0.3mol/L NaCl)进行平衡。根据制剂所需蛋白量要求取多批纯化3中间体的冷冻蛋白溶液复融及混合,混合溶液调节pH值至6.5后上样。采用0.005mol/L磷 酸盐缓冲液(pH6.5含0.3mol/L NaCl)进行洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化4中间体。
纯化第5步:阴离子交换层析
以Streamline DEAE阴离子填料为介质进行交换层析。层析柱采用0.015mol/L Tris-HCl缓冲液(pH7.5含0.05mol/L NaCl)进行平衡。纯化4中间体与0.02mol/L Tris-HCl缓冲液(pH7.5)按1:2体积比混合,调节pH值至7.5后上样,用0.015mol/L Tris-HCl缓冲液(pH7.5含0.05mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化5中间体。
纯化第6步:阳离子交换层析
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.005mol/L磷酸盐缓冲液(pH5.5含0.05mol/L NaCl)进行平衡。纯化5中间体调节pH值至5.5后上样,采用0.005mol/L磷酸盐缓冲液(pH6.5含0.3mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为本发明所要得到的尿激酶原。
实施例3
纯化第1步:蛋白捕获
以Streamline SP阳离子填料为介质进行交换层析。层析柱采用0.015mol/L磷酸盐缓冲液(pH6.5含0.15mol/L NaCl)进行平衡,发酵液取上清液调节pH值至6.5后上样,采用0.015mol/L磷酸盐缓冲液(pH6.5含0.7mol/LNaCl洗脱,根据UV 280紫外吸收曲线收集洗脱蛋白峰,即为纯化1中间体。
纯化第2步:凝胶层析
以Sephacryl S-200HR凝胶分子筛填料为介质进行凝胶层析。层析柱采用0.015mol/L磷酸盐缓冲液(pH6.5含0.12mol/L NaCl)进行平衡,将纯化1中间体直接上样,采用0.015mol/L磷酸盐缓冲液(pH6.5含0.12mol/L)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化2中间体。
纯化第3步:阳离子交换层析
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.015mol/L磷酸盐缓冲液(pH6.5含0.15mol/L NaCl)进行平衡,将纯化2中间体调节pH值至6.5后上样,采用0.015mol/L磷酸盐低盐缓冲液(pH6.5含0.26mol/L NaCl)洗脱杂质,0.015mol/L磷酸盐高盐缓冲液(pH7.5含0.35mol/L NaCl)洗脱目标蛋白,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化3中间体。于-20℃以下冷冻储存。
纯化第4步:亲和层析
以BenzamidineSepharose 4FF H-sub亲和填料为介质进行亲和层析。层析柱采用0.015mol/L磷酸盐缓冲液(pH7.5含0.5mol/L NaCl)进行平衡。根据制剂所需蛋白量要求取多批纯化3中间体的冷冻蛋白溶液复融及混合,混合溶液调节pH值至7.5后上样。采用0.015mol/L磷酸盐缓冲液(pH7.5含0.5mol/L NaCl)进行洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化4中间体。
纯化第5步:阴离子交换层析
以Streamline DEAE阴离子填料为介质进行交换层析。层析柱采用0.025mol/L Tris-HCl缓冲液(pH8.5含0.20mol/L NaCl)进行平衡。纯化4中间体与0.035mol/L Tris-HCl缓冲液(pH8.5)按1:2体积比混合,调节pH值至8.5后上样,用0.025mol/L Tris-HCl缓冲液(pH8.5含0.15mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化5中间体。
纯化第6步:阳离子交换层析
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.015mol/L磷酸盐缓冲液(pH6.5含0.15mol/L NaCl)进行平衡。纯化5中间体调节pH值至6.5后上样,采用0.015mol/L磷酸盐缓冲液(pH7.5含0.5mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为本发明所要得到的尿激酶原。
实施例4
纯化第1步:蛋白捕获
以Streamline SP阳离子填料为介质进行交换层析。层析柱采用0.008mol/L磷酸盐缓冲液(pH6.0含0.12mol/L NaCl)进行平衡,发酵液取上清液调节pH值至6.0后上样,采用 0.008mol/L磷酸盐缓冲液(pH6.0含0.4mol/L洗脱,根据UV 280紫外吸收曲线收集洗脱蛋白峰,即为纯化1中间体。
纯化第2步:凝胶层析
以Sephacryl S-200HR凝胶分子筛填料为介质进行凝胶层析。层析柱采用0.01mol/L磷酸盐缓冲液(pH6.0含0.07mol/L NaCl)进行平衡,将纯化1中间体直接上样,采用0.01mol/L磷酸盐缓冲液(pH6.0含0.07mol/LNaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化2中间体。
纯化第3步:阳离子交换层析
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.012mol/L磷酸盐缓冲液(pH6.0含0.012mol/L NaCl)进行平衡,将纯化2中间体调节pH值至6.0后上样,采用0.012mol/L磷酸盐低盐缓冲液(pH6.0含0.25mol/L NaCl)洗脱杂质,0.012mol/L磷酸盐高盐缓冲液(pH7.0含0.3mol/L NaCl)洗脱目标蛋白,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化3中间体。于-20℃以下冷冻储存。
纯化第4步:亲和层析
以BenzamidineSepharose 4FF H-sub亲和填料为介质进行亲和层析。层析柱采用0.008mol/L磷酸盐缓冲液(pH7.5含0.4mol/L NaCl)进行平衡。根据制剂所需蛋白量要求取多批纯化3中间体的冷冻蛋白溶液复融及混合,混合溶液调节pH值至7.5后上样。采用0.008mol/L磷酸盐缓冲液(pH7.5含0.4mol/L NaCl)进行洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化4中间体。
纯化第5步:阴离子交换层析
以Streamline DEAE阴离子填料为介质进行交换层析。层析柱采用0.01mol/L Tris-HCl缓冲液(pH8.0含0.15mol/L NaCl)进行平衡。纯化4中间体与0.03mol/L Tris-HCl缓冲液(pH8.0)按1:2体积比混合,调节pH值至8.0后上样,用0.02mol/L Tris-HCl缓冲液(pH8.0含0.1mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化5中间体。
纯化第6步:阳离子交换层析
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.009mol/L磷酸盐缓冲 液(pH6.5含0.11mol/L NaCl)进行平衡。纯化5中间体调节pH值至6.5后上样,采用0.009mol/L磷酸盐缓冲液(pH7.5含0.4mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为本发明所要得到的尿激酶原。
实施例5
纯化第1步:蛋白捕获
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.01mol/L磷酸盐缓冲液(pH6.0含0.1mol/L NaCl)进行平衡,发酵液取上清液调节pH值至6.0后上样,采用0.01mol/L磷酸盐缓冲液(pH6.0含0.5mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集洗脱蛋白峰,即为纯化1中间体。
纯化第2步:凝胶层析
以Sephadex G-50凝胶分子筛填料为介质进行凝胶层析。层析柱采用0.01mol/L磷酸盐缓冲液(pH6.0含0.09mol/L NaCl)进行平衡,将纯化1中间体直接上样,采用0.01mol/L磷酸盐缓冲液(pH6.0含0.09mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化2中间体。
纯化第3步:阳离子交换层析
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.01mol/L磷酸盐缓冲液(pH6.0含0.1mol/L NaCl)进行平衡,将纯化2中间体调节pH值至6.0后上样,采用0.01mol/L磷酸盐低盐缓冲液(pH6.0含0.25mol/L NaCl)洗脱杂质,0.01mol/L磷酸盐高盐缓冲液(pH7.0含0.3mol/L NaCl)洗脱目标蛋白,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化3中间体。于-20℃以下冷冻储存。
纯化第4步:亲和层析
以BenzamidineSepharose 4FF H-sub亲和填料为介质进行亲和层析。层析柱采用0.01mol/L磷酸盐缓冲液(pH7.0含0.4mol/L NaCl)进行平衡。根据制剂所需蛋白量要求取多批纯化3中间体的冷冻蛋白溶液复融及混合,混合溶液调节pH值至7.0后上样。采用0.01mol/L磷酸盐缓冲液(pH7.0含0.4mol/L NaCl)进行洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化4中间体。
纯化第5步:阴离子交换层析
以Streamline DEAE阴离子填料为介质进行交换层析。层析柱采用0.02mol/L Tris-HCl缓冲液(pH8.0含0.1mol/L NaCl)进行平衡。纯化4中间体与0.03mol/L Tris-HCl缓冲液(pH8.0)按1:2体积比混合,调节pH值至8.0后上样,用0.02mol/L Tris-HCl缓冲液(pH8.0含0.1mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化5中间体。
纯化第6步:阳离子交换层析
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.01mol/L磷酸盐缓冲液(pH6.0含0.1mol/L NaCl)进行平衡。纯化5中间体调节pH值至6.0后上样,采用0.01mol/L磷酸盐缓冲液(pH7.0含0.4mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为本发明所要得到的尿激酶原。
实施例6
纯化第1步:蛋白捕获
以Streamline SP阳离子填料为介质进行交换层析。层析柱采用0.005mol/L磷酸盐缓冲液(pH5.5含0.05mol/L NaCl)进行平衡,发酵液取上清液调节pH值至5.5后上样,采用0.005mol/L磷酸盐缓冲液(pH5.5含0.3mol/L NaCl洗脱,根据UV 280紫外吸收曲线收集洗脱蛋白峰,即为纯化1中间体。
纯化第2步:凝胶层析
以Sephacryl S-200HR凝胶分子筛填料为介质进行凝胶层析。层析柱采用0.005mol/L磷酸盐缓冲液(pH5.5含0.05mol/L NaCl)进行平衡,将纯化1中间体直接上样,采用0.005mol/L磷酸盐缓冲液(pH5.5含0.05mol/LNaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化2中间体。
纯化第3步:阳离子交换层析
以SP Sephadex C-50阳离子填料为介质进行交换层析。层析柱采用0.005mol/L磷酸盐缓冲液(pH5.5含0.05mol/L NaCl)进行平衡,将纯化2中间体调节pH值至5.5后上样,采用0.005mol/L磷酸盐低盐缓冲液(pH5.5含0.20mol/L NaCl)洗脱杂质,0.005mol/L磷酸盐高盐缓冲液(pH6.5含0.28mol/L NaCl)洗脱目标蛋白,根据UV 280紫外吸收曲线收集目标蛋 白峰,即为纯化3中间体。于-20℃以下冷冻储存。
纯化第4步:亲和层析
以Arginine Sepharose 4B亲和填料为介质进行亲和层析。层析柱采用0.005mol/L磷酸盐缓冲液(pH6.5含0.3mol/L NaCl)进行平衡。根据制剂所需蛋白量要求取多批纯化3中间体的冷冻蛋白溶液复融及混合,混合溶液调节pH值至6.5后上样。采用0.005mol/L磷酸盐缓冲液(pH6.5含0.3mol/L NaCl)进行洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化4中间体。
纯化第5步:阴离子交换层析
以DEAE Sephacel DE-52阴离子填料为介质进行交换层析。层析柱采用0.015mol/L Tris-HCl缓冲液(pH7.5含0.05mol/L NaCl)进行平衡。纯化4中间体与0.02mol/L Tris-HCl缓冲液(pH7.5)按1:2体积比混合,调节pH值至7.5后上样,用0.015mol/L Tris-HCl缓冲液(pH7.5含0.05mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化5中间体。
纯化第6步:阳离子交换层析
以SP Sepharose F.F.阳离子填料为介质进行交换层析。层析柱采用0.005mol/L磷酸盐缓冲液(pH5.5含0.05mol/L NaCl)进行平衡。纯化5中间体调节pH值至5.5后上样,采用0.005mol/L磷酸盐缓冲液(pH6.5含0.3mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为本发明所要得到的尿激酶原。
实施例7
纯化第1步:蛋白捕获
以Sephadex G-50阳离子填料为介质进行交换层析。层析柱采用0.015mol/L磷酸盐缓冲液(pH6.5含0.15mol/L NaCl)进行平衡,发酵液取上清液调节pH值至6.5后上样,采用0.015mol/L磷酸盐缓冲液(pH6.5含0.7mol/LNaCl洗脱,根据UV 280紫外吸收曲线收集洗脱蛋白峰,即为纯化1中间体。
纯化第2步:凝胶层析
以Sephacryl S-200HR凝胶分子筛填料为介质进行凝胶层析。层析柱采用0.015mol/L磷酸盐缓冲液(pH6.5含0.12mol/L NaCl)进行平衡,将纯化1中间体直接上样,采用0.015mol/L磷酸盐缓冲液(pH6.5含0.12mol/L)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化2中间体。
纯化第3步:阳离子交换层析
以SP Sephadex C-50阳离子填料为介质进行交换层析。层析柱采用0.015mol/L磷酸盐缓冲液(pH6.5含0.15mol/L NaCl)进行平衡,将纯化2中间体调节pH值至6.5后上样,采用0.015mol/L磷酸盐低盐缓冲液(pH6.5含0.26mol/L NaCl)洗脱杂质,0.015mol/L磷酸盐高盐缓冲液(pH7.5含0.35mol/L NaCl)洗脱目标蛋白,根据UV 280紫外吸收曲线收集目标蛋白峰,即为纯化3中间体。于-20℃以下冷冻储存。
纯化第4步:亲和层析
以BenzamidineSepharose 4FF H-sub亲和填料为介质进行亲和层析。层析柱采用0.015mol/L磷酸盐缓冲液(pH7.5含0.5mol/L NaCl)进行平衡。根据制剂所需蛋白量要求取多批纯化3中间体的冷冻蛋白溶液复融及混合,混合溶液调节pH值至7.5后上样。采用0.015mol/L磷酸盐缓冲液(pH7.5含0.5mol/L NaCl)进行洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化4中间体。
纯化第5步:阴离子交换层析
以Streamline DEAE阴离子填料为介质进行交换层析。层析柱采用0.025mol/L Tris-HCl缓冲液(pH8.5含0.20mol/L NaCl)进行平衡。纯化4中间体与0.035mol/L Tris-HCl缓冲液(pH8.5)按1:2体积比混合,调节pH值至8.5后上样,用0.025mol/L Tris-HCl缓冲液(pH8.5含0.15mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集穿透液中的蛋白峰,即为纯化5中间体。
纯化第6步:阳离子交换层析
以SP Sephadex C-50阳离子填料为介质进行交换层析。层析柱采用0.015mol/L磷酸盐缓冲液(pH6.5含0.15mol/L NaCl)进行平衡。纯化5中间体调节pH值至6.5后上样,采用0.015mol/L磷酸盐缓冲液(pH7.5含0.5mol/L NaCl)洗脱,根据UV 280紫外吸收曲线收集目标蛋白峰,即为本发明所要得到的尿激酶原。
- 还没有人留言评论。精彩留言会获得点赞!