TAFI和PAI‑1的双重靶向的制作方法
本发明一般涉及,通过对纤溶酶原活化物抑制剂1(PAI-1)和凝血酶活化性纤维蛋白溶解抑制剂(TAFI)的双重抑制,对血栓性疾病(例如中风和血栓栓塞)的治疗和预防。所述双重抑制可通过结合至这两种靶标的双特异性抗体衍生物介导。
背景
发生急性心血管意外之后,目前对堵塞的血管进行管道重接术的仅有疗法是全身性递送高剂量的纤溶酶原(plasminogen)活化物。尽管在事件后短期内给予是有效的,纤溶酶原活化物仍会造成令人虚弱的副作用,例如颅内出血和神经毒性。此外,并不能确保血流的成功恢复,这归因于低重通和高再闭塞率,甚至在给予高剂量纤溶酶原活化物时也是如此[Saver JL.等.(2011)J Thromb Haemost.9Suppl 1,333-343]。因此,本领域中仍需要对于堵塞血管的有效疗法,例如,通过促进纤维蛋白溶解或血栓溶解。
溶栓失败的原因之一是存在纤维蛋白溶解的循环抑制剂,例如凝血酶活化性纤维蛋白溶解抑制剂(TAFI)和纤溶酶原活化物抑制剂1(PAI-1)[Fernandez-Cadenas I等.(2007)J Thromb Haemost.5,1862-1868]。尽管通过不同的机理,但这两种分子均会减缓组织型-纤溶酶原活化物(tPA)介导的纤溶酶形成,所述纤溶酶是纤维蛋白溶解中关键的酶(综述参见Rijken DC和Lijnen HR(2009)J Thromb Haemost.7,4-13)。TAFI,一种血浆水平为4-15μg/ml的56kDa的酶原,可被凝血酶,单独或与血栓调节素或纤溶酶配合,活化成TAFIa。通过其羧肽酶活性,TAFIa能够切下部分降解的纤维蛋白上暴露的C末端Lys残基,其作为辅助因子作用于通过tPA介导将纤溶酶原活化成纤溶酶。PAI-1(血浆水平为5-50ng/ml且血小板内浓度为200ng/ml的45kDa糖蛋白)是tPA的主要抑制剂,并且属于丝氨酸蛋白酶抑制剂(丝氨酸蛋白酶抑制蛋白)超家族。PAI-1的活性形式能够通过形成1:1化学计量共价复合物来可逆地中和tPA的活性,这伴随着丝氨酸蛋白酶的催化三联体的形变。
鉴于其在抑制纤维蛋白溶解中的互补作用,一种促进纤维蛋白溶解的方式是对TAFI和PAI-1的双重抑制。已有数项研究试图对TAFI和PAI-1进行同时靶向。然而,结果并没有一致地指示对于TAFI和PAI-1的双重抑制相比单一抑制改善了血栓溶解。在一项研究中,在TAFI、PAI-1和/或α2-AP的抑制剂存在或不存在的情况下,在tPA诱导的血栓溶解试验中,表征了TAFI和PAI-1,以及第三分子α2-AP的互补作用[Mutch NJ.等.(2007)J Thromb Haemost.5,812-817]。取决于血栓类型,上述试验指示了全部三种分子的作用或者α2-AP与TAFI的实质性贡献,其中PAI-1的贡献较小。类似地,小鼠中的单敲出和双敲出研究表明,某些试验中的溶血栓作用归因于对TAFI而非PAI-1的抑制[Vercauteren E等.(2012)J Thromb Haemost.10,2555-2562]。
特别地,基于双特异性抗体衍生物(双功能抗体)的双重靶向策略已显示出前景。基于结合TAFI和PAI-1的单克隆抗体的双功能抗体T12D11x33H1F7,显示对纤维蛋白溶解具有刺激作用,其超过了单独测试其组分单克隆抗体(MA)时所观察到的作用。此外,针对TAFI和PAI-1的新单克隆抗体显示独特的特征。MA-RT36A3F5和MA-TCK26D6均抑制小鼠和大鼠TAFI,其中,各MA通过不同机理作用:前者使TAFIa失稳,而后者影响纤溶酶介导的TAFI活化并且也干扰纤维蛋白上TAFIa的相互作用[Hillmayer K等.J(2008)Thromb Haemost.6,1892-1899;Vercauteren E等.(2011)Blood 117,4615-4622;Semeraro F等.(2013)J Thromb Haemost.11,2137-2147]。MA-33H1F7和MA-MP2D2通过将tPA切割的PAI-1从活性形式转化成底物形式来抑制小鼠和大鼠PAI-1[Debrock S.和Declerck PJ.(1997)Biochim Biophys Acta.1337,257-266;Van De Craen B.等.(2011)Thromb Res.128,68-76]。体内研究已显示,上述抗体对于血栓栓塞攻击之后的小鼠存活率和瘫痪的有益作用[Vercauteren(2011)如上引用,Van De Craen如上引用]。近期,特异性识别对应的人抗原的MA抗体MA-33H1F7和MA-TCK26D6经适应以制备双特异性抗体衍生物Db-TCK26D6x33H1F7,并且体外显示了该双功能抗体的强纤溶酶原效果[Wyseure T等.(2013)J Thromb Haemost.11,2069-2071]。然而,迄今尚无双重靶向研究来确凿地证明抑制剂或双功能抗体在体内治疗特定血栓性疾病中的作用。此外,尚无研究对基于纤维蛋白溶解或血栓溶解的抑制剂(作为纤溶酶原活化物的替代物)的用于血栓性疾病的可行的治疗提供证据。
技术实现要素:
本文所述的是用于治疗血栓性疾病(例如中风和血栓栓塞)的双功能抗体Db-TCK26D6x33H1F7。Db-TCK26D6x33H1F7可在血栓性疾病发作之前或之后给予,此外,其可于存在或不存在纤溶酶原活化物(例如tPA)的情况下给予。
本发明涉及用于治疗患者中的急性血栓性疾病的双特异性抗体衍生物,其包含第一靶向结构域和第二靶向结构域,所述第一靶向结构域结合至凝血酶活化性纤维蛋白溶解抑制剂(TAFI),并且包含由与如下各序列至少80%相同的氨基酸序列表示的互补决定区(CDR):SEQ ID NO:1的CDR1H、SEQ ID NO:2的CDR2H、SEQ ID NO:3的CDR3H、SEQ ID NO:4的CDR1L、SEQ ID NO:5的CDR2L,和SEQ ID NO:6的CDR3L;所述第二靶向结构域结合至纤溶酶原活化物抑制剂-1(PAI-1),并且包含由与如下各序列至少80%相同的氨基酸序列表示的互补决定区(CDR):SEQ ID NO:7的CDR1H、SEQ ID NO:8的CDR2H、SEQ ID NO:9的CDR3H、SEQ ID NO:10的CDR1L、SEQ ID NO:11的CDR2L,和SEQ ID NO:12的CDR3L,其中,所述双特异性抗体衍生物在所述急性血栓性疾病发作之后给予。
在一些实施方式中,所述双特异性抗体衍生物中的氨基酸序列与SEQ ID NO:1-18中公开的氨基酸序列至少80%、85%、90%、95%、99%或100%相同。在一些实施方式中,所述双特异性抗体衍生物用于下述至少一种急性血栓性疾病:急性缺血性中风(AIS)、大脑中动脉闭塞(MCAo)、血栓栓塞、深静脉血栓症、心肌梗塞(MI)、肺栓塞、外周动脉疾病、肝和/或肾的血栓症,或导管阻塞。例如,急性血栓性疾病可以是AIS。所述急性血栓性疾病可以是MCAo。
在某些实施方式中,双特异性抗体衍生物在急性血栓性疾病症状发作后0-15小时给予。在一些实施方式中,双特异性抗体衍生物在急性血栓性疾病症状发作后长达3小时给予。在一些实施方式中,双特异性抗体衍生物在急性血栓性疾病症状发作后长达4.5小时给予。在一些实施方式中,双特异性抗体衍生物在急性血栓性疾病症状发作后长达12小时给予。
所述双特异性抗体衍生物可不伴随tPA给予。在一些实施方式中,在急性血栓性疾病发作后长达90分钟的时间段(例如,发作后0-90分钟)内给予双特异性抗体衍生物,不伴随tPA。
在一些实施方式中,双特异性抗体衍生物伴随tPA给予。例如,所述双特异性抗体衍生物可在给予tPA后1小时给予。
在一些实施方式中,双特异性抗体衍生物用于以存在富含纤维蛋白的血凝块为特征的急性血栓性疾病。所述急性血栓性疾病可以存在富含血小板的血凝块为特征。
在某些实施方式中,所述双特异性抗体衍生物是人源化的。
本发明的另一方面涉及用于治疗患者中的急性血栓性疾病的一种双特异性抗体衍生物,其包含第一靶向结构域和第二靶向结构域,所述第一靶向结构域结合至凝血酶活化性纤维蛋白溶解抑制剂(TAFI),并且包含由与SEQ ID NO:13至少80%相同的氨基酸序列表示的VH区和由与SEQ ID NO:14至少80%相同的氨基酸序列表示的VL区;所述第二靶向结构域结合至纤溶酶原活化物抑制剂-1(PAI-1),并且包含由与SEQ ID NO:15至少80%相同的氨基酸序列表示的VH区和由与SEQ ID NO:16至少80%相同的氨基酸序列表示的VL区,其中,所述双特异性抗体衍生物在所述急性血栓性疾病发作之后给予。在一些实施方式中,双特异性抗体衍生物用于治疗患者中的急性血栓性疾病,其包含第一结构域,其由与SEQ ID NO:17至少80%相同的氨基酸序列表示;和第二结构域,其由与SEQ ID NO:18至少80%相同的氨基酸序列表示,其中,所述双特异性抗体衍生物在所述急性血栓性疾病发作之后给予。
本发明的另一方面涉及用于治疗患者中的急性血栓性疾病的双特异性抗体衍生物,其包含第一靶向结构域和第二靶向结构域,所述第一靶向结构域结合至凝血酶活化性纤维蛋白溶解抑制剂(TAFI),并且包含由与如下各序列至少80%相同的氨基酸序列表示的互补决定区(CDR):SEQ ID NO:1的CDR1H、SEQ ID NO:2的CDR2H、SEQ ID NO:3的CDR3H、SEQ ID NO:4的CDR1L、SEQ ID NO:5的CDR2L,和SEQ ID NO:6的CDR3L;所述第二靶向结构域结合至纤溶酶原活化物抑制剂-1(PAI-1),并且包含由与如下各序列至少80%相同的氨基酸序列表示的互补决定区(CDR):SEQ ID NO:7的CDR1H、SEQ ID NO:8的CDR2H、SEQ ID NO:9的CDR3H、SEQ ID NO:10的CDR1L、SEQ ID NO:11的CDR2L,和SEQ ID NO:12的CDR3L,其中,所述双特异性抗体衍生物在所述急性血栓性疾病发作之后给予,并且不伴随tPA给予。在一些实施方式中,所述双特异性抗体衍生物不伴随tPA给予,并且在急性血栓性疾病发作时起不超过90分钟的时间段中给予。
本发明的一方面涉及用于治疗或预防患者中的急性血栓性疾病的双特异性抗体。所述抗体包含第一靶向结构域和第二靶向结构域,所述第一靶向结构域特异性结合至凝血酶活化性纤维蛋白溶解抑制剂(TAFI),并且包含由氨基酸序列SEQ ID NO:1的CDR1H、SEQ ID NO:2的CDR2H、SEQ ID NO:3的CDR3H、SEQ ID NO:4的CDR1L、SEQ ID NO:5的CDR2L,和SEQ ID NO:6的CDR3L表示的互补决定区(CDR);且,所述第二靶向结构域特异性结合至纤溶酶原活化物抑制剂-1(PAI-1),并且包含由SEQ ID NO:7的CDR1H、SEQ ID NO:8的CDR2H、SEQ ID NO:9的CDR3H、SEQ ID NO:10的CDR1L、SEQ ID NO:11的CDR2L和SEQ ID NO:12的CDR3L表示的互补决定区(CDR)。
其实施方式包括这样的双特异性抗体:其中,第一靶向结构域结合至凝血酶活化性纤维蛋白溶解抑制剂(TAFI),且包含由与SEQ ID NO:13至少80%相同的氨基酸序列表示的VH区和由与SEQ ID NO:14至少80%相同的氨基酸序列表示的VL区;并且,第二靶向结构域结合至纤溶酶原活化物抑制剂-1(PAI-1),且包含由与SEQ ID NO:15至少80%相同的氨基酸序列表示的VH区和由与SEQ ID NO:16至少80%相同的氨基酸序列表示的VL区。
其实施方式是人源化的双特异性抗体。
在特定实施方式中,这些双特异性抗体用于治疗或预防由急性血栓性疾病造成的脑损伤。
在特定实施方式中,所述急性血栓性疾病选自下组:急性外周动脉闭塞、大脑中动脉闭塞(MCAO),和血栓栓塞,例如深静脉血栓栓塞和肺栓塞。
在某些实施方式中,所述双特异性抗体与采用tPA的治疗联合用于治疗或预防患者中的急性血栓性疾病。
在其它实施方式中,所述双特异性抗体用于治疗或预防患者中的急性血栓性疾病,其中所述治疗在给予所述双特异性抗体之前、同时或之后不伴随tPA的给予进行。
在特定实施方式中,上述急性血栓性疾病以存在富含血小板的血凝块为特征。
本发明的另一方面涉及用于治疗或预防患者中的急性血栓性疾病的方法,其包括如下步骤:给予针对TAFI和PAI的双特异性抗体。本文中,所述抗体包含第一靶向结构域和第二靶向结构域,所述第一靶向结构域特异性结合至凝血酶活化性纤维蛋白溶解抑制剂(TAFI),并且包含由氨基酸序列SEQ ID NO:1的CDR1H、SEQ ID NO:2的CDR2H、SEQ ID NO:3的CDR3H、SEQ ID NO:4的CDR1L、SEQ ID NO:5的CDR2L,和SEQ ID NO:6的CDR3L表示的互补决定区(CDR);且,所述第二靶向结构域特异性结合至纤溶酶原活化物抑制剂-1(PAI-1),并且包含由SEQ ID NO:7的CDR1H、SEQ ID NO:8的CDR2H、SEQ ID NO:9的CDR3H、SEQ ID NO:10的CDR1L、SEQ ID NO:11的CDR2L和SEQ ID NO:12的CDR3L表示的互补决定区(CDR)。
本发明的方法相较于现有疗法提供数种优势。
相较于tPA,其中采用针对TAFI和PAI-1的双功能抗体的本发明的方法在造成颅内出血和神经毒性方面具有低风险。本发明的双功能抗体用于减小具有脑损伤的患者中的病灶大小。脑损伤可由血栓性疾病导致,例如中风、急性缺血性中风(AIS)和/或大脑中动脉闭塞(MCAo)。
相较于给予后活性较短(约15分钟)的tPA,双功能抗体能够与其靶标结合长得多的时间段。
高剂量的tPA可导致不希望的纤溶酶酶促活性。高剂量的双功能抗体应用较不重要。不结合PAI-1或TAFI的抗体没有副作用。
相较于tPA,所述双功能抗体显示出血时间的缩短。因此,本发明的双功能抗体具有降低不希望的出血(例如颅内出血)风险的有利性质。
附图的简要说明
图1显示CDR枝接的scFv的表达水平。A.scFv-4D5构架中的MA-RT36A3F5(圆圈)的CDR的建模结构。B.免疫印迹显示包含CDR枝接的scFv-RT36A3F5-4D5(泳道1)、scFv-T12D11作为对照(泳道2)、scFv-RT36A3F5-T12D11(泳道3)和scFv-RT36A3F5-4D5DM(泳道4)的周质提取物,通过抗His-标签多克隆抗体检测。
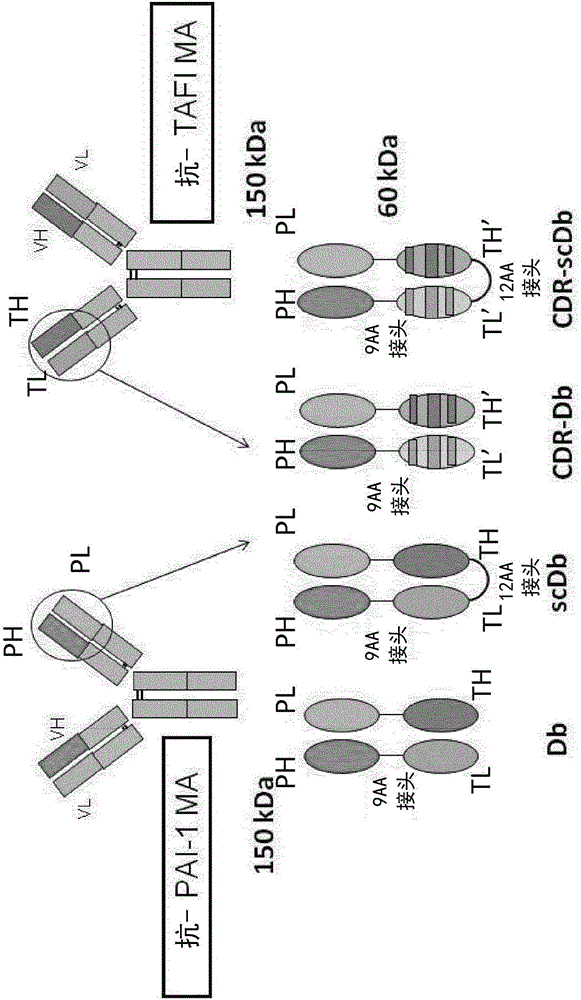
图2显示双特异性抑制剂:Db-RT36A3F5x33H1F7(Db)、Db-RT36A3F5-4D5x33H1F7(CDR枝接的Db)、scDb-33H1F7xRT36A3F5(scDb)和scDb-33H1F7xRT36A3F5-4D5(CDR枝接的scDb)的示意图。
PH:可变区重链抗PAI-1抗体;PL:可变区轻链抗PAI-1抗体;TH:可变区重链抗TAFI抗体;TL:可变区轻链抗TAFI抗体;TH':人源化的可变区重链抗TAFI抗体;TL':人源化的可变区轻链抗TAFI抗体。
图3显示体外凝块溶解过程中的血浆稳定性和纤溶酶原作用。A.该图表示稳定性,由基于ELISA的试验测定,以同时检测对于TAFI和PAI-1的剩余结合能力。10μg/ml的(sc)Db-变体(Db-RT36A3F5x33H1F7(Db)、Db-RT36A3F5-4D5x33H1F7(CDR枝接的Db)、scDb-33H1F7xRT36A3F5(scDb)和scDb-33H1F7xRT36A3F5-4D5(CDR枝接的scDb))在含柠檬酸的大鼠血浆中于37℃孵育。对照Db是Db-T12D11x33H1F7]。在时间点0、1小时和3小时,分析等份,并且结合的蛋白质以针对时间点0时的方式相对地表示(剩余结合%,平均值±SEM,n=3-9)。B.该图表示在大鼠血浆中的凝块溶解过程中,相对于8倍摩尔过量于TAFI的(sc)Db-变体的稳定性(37℃血浆中3小时之后的%剩余结合,平均值±SEM,n=3-9)对比纤溶酶原性质(表示为相对溶解(平均值±SEM,n=3),相对于4倍摩尔过量于TAFI的MA-RT36A3F5)。
图4显示,在采用人血液(A)来自内毒素血症小鼠的血液(B)的血栓弹性检测过程中,MA(单独或联合添加MA-TCK26D6与MA-33H1F7)和Db-TCK26D6x33H1F7的纤溶酶原效果。图显示,在MA-33H1F7、MA-TCK26D6、联合添加的MA或双功能抗体的存在下,(A)溶解程度(ΔL45,%;平均值±SEM;n=6-12)和(B)相对ΔAUC(平均值±SEM,n=3-6)。统计学显著性由星号指示(*p<0.05;**p<0.01;***p<0.001)。
图5显示,由全身性给予促凝血酶原激酶诱导的血栓栓塞模型中的MA的体内评价。图表示,用盐水、5mg/kg的MA-TCK26D6或1mg/kg的MA-33H1F7注射的肺中的纤维蛋白含量(平均值±SEM,n=5-7)。基线水平通过从无血栓攻击的小鼠分离肺来获得(平均值±SEM,n=5)。统计学显著性由星号指示(*p<0.05;**p<0.01;***p<0.001)。
图6显示,采用内毒素血症小鼠的血栓栓塞模型中的MA和Db的体内评价。图表示,来自用(A.)载剂、10mg/kg的MA-33H1F7、5mg/kg的MA-TCK26D6、5mg/kg的MA-TCK26D6+10mg/kg的MA-33H1F7,或(B.)载剂、1mg/kg的MA-33H1F7、1mg/kg的MA-TCK26D6、1mg/kg的MA-TCK26D6+1mg/kg的MA-33H1F7、0.8mg/kg的Db-TCK26D6x33H1F7注射的内毒素血症小鼠的肺中的纤维蛋白含量(平均值±SEM,n=5-10)。基线水平通过从无血栓攻击的健康小鼠分离肺来获得(平均值±SEM,n=5)。统计学显著性相对于载剂指示(*p<0.05;**p<0.01;***p<0.001)。
图7显示瞬时机械性MCAo的小鼠模型中MA的体内评价。图7A和7D显示病灶大小(mm3),图7B和7E显示贝德森(Bederson)评分(0-5),图7C和7F显示抓握测试评分(0-5),在用载剂(PBS)、阴性对照IgG、6mg/kg的MA-TCK26D6和25mg/kg的MA-TCK26D6(图7A-7C,平均值±SEM,n=8-12)和载剂(PBS),阴性对照IgG和6mg/kg的MA-33H1F7(图7D-7F,平均值±SEM,n=14-16)处理的小鼠中于阻塞后24小时检测。图7G显示脑同侧中的纤维蛋白原含量(倍数增长对比对侧),在用载剂(PBS)、阴性对照IgG、6mg/kg的MA-33H1F7和25mg/kg的MA-TCK26D6处理的小鼠中于阻塞后24小时检测(平均值±SEM,n=4-5)。统计学显著性如下指示:*p<0.05;**p<0.01;***p<0.001。(对照MA是MA-T30E5)
图8显示瞬时机械性MCAo的小鼠模型中MA和Db的体内评价。图8A显示病灶大小(mm3),图8B显示贝德森评分(0-5),图8C显示抓握测试评分(0-5),在用载剂(PBS)、阴性对照IgG、1mg/kg的MA-33H1F7、1mg/kg的MA-TCK26D6、1mg/kg的MA-TCK26D6+1mg/kg的MA-33H1F7或0.8mg/kg的Db处理的小鼠中于阻塞后24小时检测(平均值±SEM,n=10-12)。图8D显示脑同侧中的纤维蛋白原含量(倍数增长对比对侧),在用载剂(PBS)、阴性对照IgG、1mg/kg的MA-TCK26D6+1mg/kg的MA-33H1F7或0.8mg/kg的Db处理的小鼠中于阻塞后24小时检测(平均值±SEM,n=3-4)。统计学显著性如下指示:*p<0.05;**p<0.01;***p<0.001。(对照MA是MA-NB27B3)
图9显示作为凝血酶诱导的MCAo的小鼠模型中的单一疗法或溶血栓治疗的佐剂的双功能抗体的体内评价。图表显示在用PBS、tPA(10mg/kg)、0.8mg/kg的双功能抗体(Db-TCK26D6x33H1F7)和组合疗法(双功能抗体0.8mg/kg+tPA10mg/kg)处理的小鼠中于凝块发作后24小时检测的如下参数:(A)病灶大小(mm3)(B)血管造影术评分(0-2)和(C)%脑血流(CBF)的减少,平均值±SEM,n=6-8)。统计学显著性相对于PBS指示(*p<0.05;**p<0.01;***p<0.001)。
凝血酶诱导的阻塞之后的其它时间点示于图9D、9E和9F。在阻塞后20分钟(图9D,n=6-8),阻塞后90分钟(图9E,n=9-10)和阻塞后240分钟(图9F,n=7-9)用载剂、tPA(10mg/kg)、Db(0.8mg/kg)或Db(0.8mg/kg)和tPA(10mg/kg)的组合处理的小鼠的阻塞后24小时的病灶体积(mm3)(上图)和阻塞后24小时的代表性T2-加权的图像(下图)。虚线描述中风病灶。数据表示为平均值±SEM。*,p<0.05;**,p<0.01;ns=不显著。tPA指示重组组织型纤溶酶原活化物;Db,双功能抗体。
图10显示FeCl3诱导的MCAo的小鼠模型中的双功能抗体的体内评价。图表显示用PBS、10mg/kg的tPA和1.6mg/kg与3.6mg/kg的双功能抗体(Db-TCK26D6x33H1F7)(平均值±SEM,n=8-15)处理的小鼠中的:(A)阻塞后1小时的脑血流(CBF)差异,(B)病灶大小(mm3),(C)血管造影术评分(0-2)和(D)阻塞后24小时的CBF减少%。统计学显著性相对于PBS指示(*p<0.05;**p<0.01;***p<0.001)。
图11显示针对TAFI和PAI-1的scDb的体外和体内表达。图表比较一系列scDb及其变体的如下性质:(A)在条件培养基中以分泌的蛋白质表达的体外生成,(B)血浆在37℃下长达72小时的体外稳定性,以剩余结合(%)表达,和(C)肌内DNA注射和电穿孔后的体内表达。
图12显示静脉内注射之后,双功能抗体的全身性药代动力学。图表显示在6只小鼠中IV注射0.8mg/kg的双功能抗体之后,相对于时间(分钟)作图的血浆水平(μg/ml,平均值±SEM)(红色箭头指示循环半衰期=121分钟)。图12A和12B显示tPA和/或双功能抗体对出血时间和血红蛋白水平的影响。
图13显示,在用载剂(PBS);1和10mg/kg的tPA;0.8mg/kg和3.6mg/kg的双功能抗体;和Db(0.8mg/kg)+tPA(10mg/kg)处理的小鼠中,多至60分钟的尾出血时间和累积出血。图13A显示在小鼠中监测的直至尾出血的初始中止的时间(以分钟计),和(B)至多60分钟的累积出血(血红蛋白损失),检测为血红蛋白(g/dL)(中值,n=9-16只小鼠/组;*,p<0.05;**p<0.01;***p<0.005)。tPA指示重组组织型纤溶酶原活化物;Db,双功能抗体。_
图14显示对于双功能抗体(Db)对具有或不具有NMDA诱导的兴奋性中毒的皮质神经元死亡的作用的评价。在图14A中,将皮层神经元暴露至NMDA(作为完全杀伤条件(FK);500μmol/L)或双功能抗体(0.5-50μg/ml);在图14B中,将皮层神经元暴露至NMDA(500μmol/L(完全杀伤,FK)或12.5μmol/L)、Db(5μg/ml)或rtPA(20μg/ml),单独或联合,在神经元死亡检测前24小时过程中(N=2种独立培养物,n=2-4,*p<0.05;ns=不显著)。tPA指示重组组织型纤溶酶原活化物;Db,双功能抗体;NMDA,N-甲基-D-天冬氨酸。
发明详述
本发明涉及双特异性抗体衍生物在治疗血栓性疾病中的应用。所述双特异性抗体衍生物靶向TAFI和PAI-1并以双重靶向策略抑制这两种蛋白质。在一些实施方式中,所述双特异性抗体衍生物是已知称为Db-TCK26D6x33H1F7的双功能抗体,并且可用于治疗急性血栓性疾病。在一些实施方式中,所述双特异性抗体衍生物在所述急性血栓性疾病发作之后给予。在某些实施方式中,将所述双特异性抗体衍生物给予具有发展血栓性疾病,急性或慢性血栓性疾病的风险的患者。
双特异性抗体衍生物或其部分的示例性序列在本文中描述(SEQ ID NO:1-18)。此外,本发明的双特异性抗体衍生物可与本文所述的示例性序列相同、基本相同、同源,或相似。
"序列相同性"指当采用本领域中已知的序列比较算法,或通过手工比对和肉眼检视,在比较窗(window of comparison)中或指定区域中比较出或对比出最大对应性时,两个氨基酸序列或亚序列相同,或具有特定百分比的相同的氨基酸残基(例如,60%或65%相同性,优选70%-95%相同性,更优选>95%相同性)。在某些实施方式中,所述相同性存在于长度为至少约5~10个氨基酸的区域。
本发明内容中,特定的"指定区域"是CDR区或本发明。这些CDR区通常是保守的(与参照序列相比具有100%序列相同性),尽管在一个或多个CDR中可允许一个或多个实质等同变化(substation),只要保持参照抗体的功能性质即可。CDR区范围在5~近乎20个氨基酸,抗体序列的经修饰的CDR的典型实施方式与参照CDR序列在CDR区中的序列相同性是至少75、80、85、90、92、94、95%。
在CDR区以外,可变重或轻链的序列可较少地受限,但仍保持所述抗体的功能。因此,可变链可与可变链的参照序列至少75、80、85、90、92、95、97、98或99%相同,尽管一个、两个或全部三个CDR序列与对应的参照CDR序列具有一个氨基酸差异,或者其中所有CDR区与参照序列的那些相同。
某一位置处的差异可能会造成变成其它19种氨基酸中的任何一种的变化,或可以是所谓的"保守替换"。
根据蛋白质化学的公认原理,可在蛋白质中频繁进行所述“保守氨基酸替换”而不会改变所述蛋白质的构象或功能。这类变化包括用异亮氨酸(I)、缬氨酸(V)和亮氨酸(L)中的任一种取代这些疏水性氨基酸中的任何其它氨基酸;天冬氨酸(D)取代谷氨酸(E)且反之亦然;谷氨酰胺(Q)取代天冬胺酰(N)且反之亦然;以及丝氨酸(S)取代苏氨酸(T)且反之亦然。用色氨酸(W)、酪氨酸(Y)和苯丙氨酸(F)中的任一种取代任何这些芳族氨基酸中的其它类型,且反之亦然。其它取代也可视为保守性取代,这取决于特定氨基酸的环境和其在蛋白质三维结构中的作用。例如,甘氨酸(G)和丙氨酸(A)经常可互换,丙氨酸和缬氨酸(V)也可如此。甲硫氨酸(M)相对疏水,可经常与亮氨酸和异亮氨酸互换且有时可与缬氨酸互换。赖氨酸(K)和精氨酸(R)经常在氨基酸残基的显著特性是其电荷而这两种氨基酸残基间的pK差异不重要的位置处可互换。"双特异性抗体"指一种基于抗体的构建体,其能够同时结合至两种不同抗原。在本发明内容中,这意味着特异性结合至TAFI且特异性结合至PAI-1。
"双功能抗体"指特定类型的双特异性抗体,其在相同多肽链(VH-VL)上包含与一种抗体的轻链可变结构域(VL)连接的另一抗体的重链可变结构域(VH)。使用长度过短以至于无法在同一条链的两个结构域之间形成配对的接头时,迫使各结构域与另一条链的互补结构域配对,产生两个抗原-结合位点。在双功能抗体中,抗原结合位点指向相反方向。
通常,这些是ScFv构建体的复合物。有可能是不同构型。可能的构型是两种多肽的复合物,即:
-抗TAFI抗体的VH区和抗PIA-1抗体的VL区的融合蛋白,与
-抗TAFI抗体的VL区和抗PIA-1抗体的VH区的融合蛋白。其它示例是:具有两个VH和两个VL区的单一肽链,其产生串联scFv'。或具有对于两种可变区而言太短以无法一起折叠的接头肽的(约五个氨基酸)的scFv',迫使scFv二聚化。
"靶向结构域"指获得与所述抗原中的一种的特异性抗原结合(抗原结合结构域)所需的双特异性抗体的部分。
"纤维蛋白溶解"指血凝块中纤维蛋白的降解。
"血栓溶解"指血凝块的降解,尤其是通过纤维蛋白线丝和形成凝块的其它结构元件的崩解来实现。
TAFI(凝血酶活化性纤维蛋白溶解抑制剂)也称为羧肽酶B2(CPB2)、羧肽酶U(CPU)或血浆羧肽酶B(pCPB)。TAFI是通过移除纤维蛋白C末端残基来减少纤维蛋白溶解的酶,所述纤维蛋白C末端残基对于纤溶酶原的结合和活化而言是重要的。
PAI-1(纤溶酶原活化物抑制剂-1(PAI-1),也称为内皮纤溶酶原活化物抑制剂或丝氨酸蛋白酶抑制蛋白E1。PAI-是丝氨酸蛋白酶抑制剂,其组织纤溶酶原活化物(tPA)和尿激酶(uPA)。
血栓指寿命期间在心血管系统中由血液组分形成的凝块。凝块可以是阻塞性的,或粘附性的(其附着至血管或心脏壁且不造成阻碍)。血栓的示例性类型是由纤维蛋白的沉降以及主要包含血小板的白色或灰白色凝块形成的纤维蛋白凝块。
"tPA"(组织纤溶酶原活化物)指的是野生型蛋白质,但也涵盖称为瑞替普酶(reteplase)、替奈普酶(tenecteplase)的经修饰形式。
"血栓症"是以在血管内形成血凝块为特征的病症,并且认为是由血凝过快、内皮损伤/功能障碍和血流停滞和涡流形成的血流动力学(一起称为魏克氏三联征(Virchow’s triad))中的一种或多种的异常所致。血栓症可导致凝块形成的位置处的血管阻塞,或导致远离发生位点(即,栓塞)处的血管阻塞。在这两种情况中,血管的阻碍干扰了通过血管向组织的供氧,导致低氧、缺氧,和梗塞。因此,由血栓症能引起许多病理情况,其范围从深静脉血栓症到肺栓塞到动脉血栓症,其导致心脏病和中风,等等。
本文中所用的“血栓性疾病”包括但不限于:深静脉血栓症(DVT)、肺栓塞(PE)、冠状动脉疾病(CAD)和急性冠状动脉综合征(ACS)、视网膜中央动脉阻塞(CRAO)、年龄相关的黄斑变性(AMD)和血栓性神经失调,包括中风、急性缺血性中风(AIS)、大脑中动脉闭塞(MCAo)、急性外周动脉闭塞(APAO)等。
紊乱也可以是血栓性神经失调,其包含直接或间接影响对象的神经系统的正常功能和解剖学的疾病、紊乱或病症,包括但不限于,脑血管机能不全、脑缺血或脑梗塞(例如中风)、视网膜缺血(糖尿病性或其它原因)、青光眼、视网膜变性、多发性硬化、缺血性视神经病、急性脑缺血后的再灌注、围产期缺氧-缺血性损伤,或任何类型的颅内出血(包括但不限于,硬膜外、硬膜下、蛛网膜下或脑出血)。
在某些实施方式中,所述血栓性疾病源于遗传。在某些实施方式中,血栓性疾病是获得性的。所述血栓性疾病可以是急性、慢性和/或复发性的。在某些实施方式中,所述血栓性疾病是急性的,并且是急性缺血性中风(AIS)、大脑中动脉闭塞(MCAo)、血栓栓塞、深静脉血栓症、心肌梗塞(MI)、肺栓塞、外周动脉疾病、肝和/或肾的血栓症,或导管阻塞中的至少一种。所述血栓性疾病可以是脑血管系统中的闭塞综合征,例如,因中风或缺血性中风而造成脑梗塞。在一些实施方式中,所述急性血栓性疾病是AIS。在某些实施方式中,所述急性血栓性疾病是MCAo。
用于治疗血栓性疾病的双特异性抗体衍生物。
当由两种IgG'开始以允许进入血凝块的足够的穿透时,双特异性抗体衍生物代表目前可用以实现双特异性的最小形式。双特异性提供对TAFI和PAI-1的同时、相同定位和相同浓度的抑制,其导致相似的药代动力学特征和生物分布。在一些实施方式中,用于治疗血栓性疾病的双特异性抗体衍生物基于单克隆抗体(MA)。例如,靶向TAFI的示例性的MA是MA-RT36A3F5和MA-TCK26D6[6,7][Hillmayer等.如上所引;Vercauteren(2011)如上所引],而靶向PAI-1的示例性MA是MA-33H1F7和MA-MP2D2[De Brock,如上所引,Van De Craen,如上所引]。一种示例性双特异性抗体衍生物是DbTCK26D6x33H1F7[Wyseure T等.(2013)J Thromb Haemost.11,2069-2071]。在某些实施方式中,双特异性抗体衍生物的功效优于仅给予MA的情况。
在一些实施方式中,所述双特异性抗体衍生物包含第一靶向结构域,其结合至凝血酶活化性纤维蛋白溶解抑制剂(TAFI),且包含互补决定区(CDR),其由与SEQ ID NO:1的CDR1H、SEQ ID NO:2的CDR2H、SEQ ID NO:3的CDR3H、SEQ ID NO:4的CDR1L、SEQ ID NO:5的CDR2L和SEQ ID NO:6的CDR3L中的各序列至少80%相同的氨基酸序列表示;和第二靶向结构域,其结合至纤溶酶原活化物抑制剂-1(PAI-1),且包含互补决定区(CDR),其由与SEQ ID NO:7的CDR1H、SEQ ID NO:8的CDR2H、SEQ ID NO:9的CDR3H、SEQ ID NO:10的CDR1L、SEQ ID NO:11的CDR2L和SEQ ID NO:12的CDR3L中的各序列至少80%相同的氨基酸序列表示。
例如,所述双特异性抗体衍生物可包含第一靶向结构域,其结合至凝血酶活化性纤维蛋白溶解抑制剂(TAFI),并且包含由与SEQ ID NO:13至少80%相同的氨基酸序列表示的VH区和由与各SEQ ID NO:14至少80%相同的氨基酸序列表示的VL区;和第二靶向结构域,其结合至纤溶酶原活化物抑制剂-1(PAI-1),并且包含由与SEQ ID NO:15至少80%相同的氨基酸序列表示的VH区和由与SEQ ID NO:16至少80%相同的氨基酸序列表示的VL区。
在某些实施方式中,双特异性抗体衍生物包含第一结构域,其包含与SEQ ID NO:17至少80%相同的氨基酸序列;和第二结构域,其包含与SEQ ID NO:18至少80%相同的氨基酸序列。
SEQ ID NO:17在N末端侧包含具有SEQ ID NO:13的序列,且在C末端侧包含SEQ ID NO 16的序列。
SEQ ID NO:18在N末端侧包含具有SEQ ID NO:15的序列,且在C末端侧包含SEQ ID NO 14的序列。
在一些实施方式中,所述双特异性抗体衍生物中的氨基酸序列与SEQ ID NO:1-18中公开的氨基酸序列至少80%、85%、90%、95%、99%或100%相同。例如,在SEQ ID NO:2中,第二氨基残基(标为“X”)可以是Val或Ile(且对应地,在SEQ ID NO:13中,第五十一个氨基酸残基(标为“X”)可以是Val或Ile。在某些实施方式中,双特异性抗体衍生物中的氨基酸序列具有氨基酸残基变化,其不显著影响所述双特异性抗体衍生物对其靶标的结合性质。在一些实施方式中,氨基酸残基的变化可能会影响所述双特异性抗体衍生物的稳定性。
在一些实施方式中,所述双特异性抗体衍生物,例如,如本文中所述,是人源化的。
本文公开的双特异性抗体可与tPA相反而不具有神经毒性,并且可用于减小具有脑损伤的患者中的病灶大小。脑损伤可由血栓性疾病导致,例如中风、急性缺血性中风(AIS)和/或大脑中动脉闭塞(MCAo)。具有血栓性疾病的患者中的血栓-炎症可通过所述双特异性抗体而减少。
溶血栓治疗的危险副作用是升高的出血风险,例如来自颅内出血。本文所述的双特异性抗体可用于降低出血和/或出血风险或使其最小化,因为它们没有延长出血风险动物模型中的出血,与tPA相反。此外,该双特异性抗体的相对短的半衰期可使采用所述双特异性抗体治疗的患者中的副作用例如颅内出血最小化。
血栓性疾病(例如中风、急性缺血性中风(AIS)和/或大脑中动脉闭塞(MCAo))的另一后果是神经功能缺损。在一些实施方式中,本文公开的双特异性抗体可用于治疗神经功能缺损,例如运动、感觉和/或认知缺损。肢体屈曲、侧推、抓握等中的缺损和/或限制可采用本文公开的双特异性抗体来治疗。
给药
溶血栓治疗的时机是关键的。在急性血栓性疾病(例如急性心肌梗塞、急性缺血性中风,或急性大块肺栓塞)的情况中,通常在中风15小时(例如,在中风症状发作后越快越好,在0-6小时,或在4.5小时)内给予tPA以崩解凝块。类似地,在一些实施方式中,本文所述的双特异性抗体衍生物在血栓性疾病症状发作之后0-15小时之间给予。所述血栓性疾病可以是急性血栓性疾病,例如中风,例如,AIS或MCAo。在某些实施方式中,所述双特异性抗体在血栓性疾病症状发作后0.5小时、1小时、1.5小时、3小时、4小时、4.5小时或更多小时给予,例如,在症状发作后4.5小时。在一些实施方式中,所述双特异性抗体衍生物在血栓性疾病的症状发作后12小时给予。所述双特异性抗体衍生物可静脉内给予,或直接给予进入血凝块。
迄今,纤溶酶原活化物例如tPA是美国FDA批准的唯一溶血栓试剂,并且纤溶酶原活化物例如tPA仍是用于急性血栓性疾病的主要一线疗法。然而,一些患者不响应tPA治疗,并且需要进一步的介入。因此,在一些实施方式中,所述双特异性抗体衍生物与纤溶酶原活化物(例如,tPA)一起给予。例如,所述双特异性抗体衍生物可与tPA同时给予,作为联合治疗。所述双特异性抗体衍生物也可在首先给予tPA之后给予。在一些实施方式中,所述双特异性抗体衍生物在给予tPA后1小时给予。如果患者在1小时内不响应tPA,可给予所述双特异性抗体衍生物作为进一步介入。
本发明的惊人且预料之外的效果是,当在阻塞后长达90分钟给予时,在tPA存在或不存在的情况下,双特异性抗体衍生物均等同地有效。此外,双特异性抗体衍生物的溶血栓作用优于tPA。因此,本文公开的双特异性抗体衍生物可用作替代纤溶酶原活化物例如tPA的溶血栓试剂。本发明的一方面涉及本文公开的双特异性抗体衍生物用于治疗急性血栓性疾病的应用,其中,所述双特异性抗体衍生物的给予不伴随tPA。在某些实施方式中,所述急性血栓性疾病的特征是存在富含纤维蛋白的血凝块。在一些实施方式中,所述急性血栓性疾病的特征是存在富含血小板的血凝块。在一些实施方式中,在急性血栓性疾病发作后长达90分钟的时间段(例如,发作后0-90分钟)内给予双特异性抗体衍生物,不伴随tPA。因此,所述双特异性抗体衍生物可在急性血栓性疾病发作后0、10、15、20、30、40、45、50、60、70、80,或90分钟给予。
在一些实施方式中,当在急性血栓性疾病发作至少90分钟时给予针对该急性血栓性疾病的治疗时,所述双特异性抗体衍生物与tPA一起给予。双特异性抗体衍生物和tPA的组合可在发作后90分钟,或发作后2小时、2.5小时、3小时、3.5小时、4小时、4.5小时、5小时、5.5小时、6小时或更久给予。在某些实施方式中,给予所述双功能抗体不导致有害的神经毒性作用。当与tPA联合给予时,所述双特异性抗体衍生物可加强tPA的溶血栓作用,而不增强仅采用tPA时观察到的不良副作用。本文公开的双特异性抗体衍生物还可与如下治疗联合:抗血小板治疗(例如阿司匹林、氯吡格雷和双嘧达莫);抗凝治疗(例如肝素、华法林和达比加群);和/或手术介入(例如血管重建、颈动脉内膜切除手术、颈动脉血管成形术、动脉内血栓溶解和脑缺血(MERCI)中的机械性血栓清除)。
本发明的双功能抗体可以一个团注(bolus)形式递送,或可在较长时间段中给予。
给予患者的双功能抗体的总量范围可以是0.1、0.5、1或kg体重至多至2或5mg/kg体重。
鉴于过量抗体的给予没有有害副作用,可给予总剂量10、20、40、80或100mg的双功能抗体,无关患者体重。
预防
血栓性疾病在老年群体和/或先前受过血栓性疾病影响的患者中尤其常见。血栓性疾病可以是急性或慢性的。中风(例如AIS和/或MCAo)的其它风险因素包括高龄、饮酒、动脉粥样硬化、心房颤动、避孕药服用、糖尿病、不良饮食、中风家族史、肌纤维发育不良、高血压、高胆固醇、血凝过快(遗传性或获得性)、炎症、低出生体重、偏头痛、肥胖、卵圆孔未闭、体能活动不足、绝经后激素治疗、先前中风、某些种族/族群、镰状细胞疾病、睡眠呼吸暂停、瞬时脑缺血发作、吸烟等。静脉血栓症(例如常造成肺栓塞的深静脉血栓症(DVT))的风险因素包括但不限于高龄、大手术、矫形外科、癌症、固定化、妊娠、抗磷脂综合征、创伤、腿部轻伤、先前静脉血栓症、口服避孕药、激素替代治疗、中心静脉导管、炎性疾病或自身免疫疾病、肾病综合征、肥胖、感染、HIV、真性红细胞增多症和化疗,以及遗传性风险因素,包括但不限于抗凝血酶缺陷、蛋白质C缺陷、蛋白质S缺陷、莱登因子V(Factor V Leiden)、凝血酶原G20210A、纤维蛋白原缺乏血液病,和非O型血。其它风险因素包括但不限于,低水平的蛋白质S、活化的蛋白质C抵抗、高因子VIII水平、高同型半胱氨酸血症,和/或高水平的纤维蛋白原、因子IX和/或因子XI。
本发明的另一方面涉及双特异性抗体,其用于具有发展急性或慢性血栓性疾病风险的患者,其包含第一靶向结构域,其结合至凝血酶活化性纤维蛋白溶解抑制剂(TAFI),并且包含互补决定区(CDR),其由与SEQ ID NO:1的CDR1H、SEQ ID NO:2的CDR2H、SEQ ID NO:3的CDR3H、SEQ ID NO:4的CDR1L、SEQ ID NO:5的CDR2L和SEQ ID NO:6的CDR3L中的各序列至少80%相同的氨基酸序列表示;和第二靶向结构域,其结合至纤溶酶原活化物抑制剂-1(PAI-1),并且包含互补决定区(CDR),其由与SEQ ID NO:7的CDR1H、SEQ ID NO:8的CDR2H、SEQ ID NO:9的CDR3H、SEQ ID NO:10的CDR1L、SEQ ID NO:11的CDR2L和SEQ ID NO:12的CDR3L中的各序列至少80%相同的氨基酸序列表示,其中,所述双特异性抗体衍生物在所述急性或慢性血栓性疾病发作前给予。在某些实施方式中,所述急性或慢性血栓性疾病是血栓栓塞。
例如,所述双特异性抗体衍生物可包含第一靶向结构域,其结合至凝血酶活化性纤维蛋白溶解抑制剂(TAFI),并且包含由与SEQ ID NO:13至少80%相同的氨基酸序列表示的VH区和由与SEQ ID NO:14至少80%相同的氨基酸序列表示的VL区;和第二靶向结构域,其结合至纤溶酶原活化物抑制剂-1(PAI-1),并且包含由与SEQ ID NO:15至少80%相同的氨基酸序列表示的VH区和由与SEQ ID NO:16至少80%相同的氨基酸序列表示的VL区。
在某些实施方式中,双特异性抗体衍生物包含第一结构域,其包含与SEQ ID NO:17至少80%相同的氨基酸序列;和第二结构域,其包含与SEQ ID NO:18至少80%相同的氨基酸序列。
在一些实施方式中,所述双特异性抗体衍生物中的氨基酸序列与SEQ ID NO:1-18中公开的氨基酸序列至少80%、85%、90%、95%、99%或100%相同。例如,在SEQ ID NO:2中,第二氨基残基(标为“X”)可以是Val或Ile(且对应地,在SEQ ID NO:13中,第五十一个氨基酸残基(标为“X”)可以是Val或Ile。
通过引用纳入
本文提到的所有发表物和专利在此通过引用全文纳入,就好像各个单独发表物或专利特定和单独地表明是通过引用纳入。在抵触的情况下,以本申请(包括任何定义在内)为准。
等同形式
尽管讨论了本发明的具体实施方式,但以上说明书仅为说明性而非限制性的。本领域的技术人员阅读了本说明书和下面权利要求后将清楚了解本发明的许多变化。本发明的全部范围应该通过参考所附权利要求书连同其等同物的全部范围,以及说明书连同此类变化来确定。
实施例
在提供了上述一般公开内容之后,采用下述实施例辅助性地说明上述一般公开内容。这些特定的实施例仅意在说明所述公开内容的某些方面和实施方式,并且,它们不意在限制任何方面。然而,实施例中所述的某些通用原理对于本公开内容的其它方面或实施方式一般是可用的。
实施例1.通过抗体工程改造来改善针对TAFI和PAI-1的不稳定双特异性抑制剂(Db-RT36A3F5x33H1F7)的表达和功效
A.对于工程改造稳定可变区的CDR-移接
在先前的研究中,生成了scFv-RT36A3F5,但其无法由细菌产生,并且发现对应的Db-RT36A3F5x33H1F7是不稳定的,导致对于凝块溶解的作用减小。因此,通过将互补决定区(CDR)-移接至scFv-4D5的稳定支架上对MA-RT36A3F5的可变结构域进行最优化(图1A)[Jung S.和Plückthun A.(1997)Protein Eng.10,959-966。该论文公开了用于CDR移接的4D5人源化抗体]。进行了两种方式:(i)scFv-RT36A3F5和scFv-4D5的基于结构比对的策略,产生scFv-RT36A3F5-4D5DM(联合Marc Demaeyer教授)和(ii)基于证据的策略,产生scFv-RT36A3F5-4D5[Ewert S.等(2004)Methods.34,184-199]。对于scFv-T12D11的稳定支架(一种抗TAFI抗体,公开于de Develter等.2008J Thromb Haemost.6,1884-1889)也进行了后一种方式,产生scFv-RT36A3F5-T12D11。Western印迹分析揭示,仅scFv-RT36A3F5-4D5被正确表达和分泌(图1B,泳道1),因此,在对应的(sc)Db构建体中采用这些CDR枝接的可变结构域。
B.从MA-RT36A3F5和MA-33H1F7产生基于双特异性抗体的抑制剂
从MA-RT36A3F5和MA-33H1F7形成四种双特异性抑制剂:Db-RT36A3F5x33H1F7(Db)、Db-RT36A3F5-4D5x33H1F7(CDR枝接的Db)、scDb-33H1F7xRT36A3F5(在MA-RT36A3F5的可变结构域之间具有额外柔性接头的scDb)和scDb-33H1F7xRT36A3F5-4D5(CDR枝接的scDb)(图2)。作为CDR-移接的结果,Db和scDb的细菌和真核表达分别提高(对于CDR枝接的Db,约1.5mg/L培养物,对应于2倍增长,对比Db,以及对于CDR枝接的scDb,11±1mg/L培养基,对应于10倍增长,对比scDb)。
C.双特异性抑制剂的抑制性质
通过功能试验证实,在Db、CDR枝接的Db和CDR枝接的scDb中保存了亲代抗体的抑制性质。因其生成量不足,未能评价scDb的抑制性质。
D.含柠檬酸(citrated)的大鼠血浆中双功能抗体的稳定性和纤溶酶原性质
在所有构建体中,仅CDR枝接的scDb显示与对照双功能抗体Db-T12D11x33H1F7相似的稳定性(37℃下三小时后,88±13%剩余结合活性;图3A)。CDR枝接的scDb的相对纤溶酶原作用为0.81±0.23,相比MA-RT36A3F5,其也是最为有力的构建体(图3B)。未能在基于血浆的试验系统中评价PAI-1抑制部分的作用的贡献,这归因于PAI-1的低基线血浆水平。
总之,我们对于提高不稳定的针对大鼠TAFI和PAI-1的基于双特异性抗体的抑制剂的血浆稳定性的工作获得了CDR枝接的scDb,其显示7倍增长的稳定性和纤溶酶原作用。该抗体衍生物与小鼠TAFI和小鼠PAI-1交叉反应,允许在小鼠和大鼠中进行进一步的体内评价。
实施例2.针对TAFI和PAI-1的新型双特异性抑制剂的纤溶酶原性质的体外评价
A. Db-TCK26D6x33H1F7的生成
基于成功地生成了具有保留下来的相应亲代抗体(MA-TCK26D6和MA-33H1F7)抑制能力的稳定scFvs,产生了Db-TCK26D6x33H1F7。该双功能抗体包含图2左下方所示的两个多肽链。第一个是抗TAFI抗体的VH链和抗PAI-1抗体的VL链的融合蛋白。第二个是抗TAFI抗体的VL链和抗PAI-1抗体的VH链的融合蛋白。
Db-TCK26D6x33H1F7的生成水平大约是2mg/L培养物。
B.针对TAFI和PAI-1的抑制作用的表征
通过功能试验证实,针对人和小鼠TAFI和PAI-1的亲代抗体的抑制性质在Db-TCK26D6x33H1F7中保留了下来。此外,Db-TCK26D6x33H1F7在人、小鼠和大鼠血浆中37℃孵育8小时后保持稳定。
C. Db-TCK26D6x33H1F7在全血中的血栓弹性分析过程中的作用
为评价归因于TAFI和PAI-1抑制的纤溶酶原作用,Db-TCK26D6x33H1F7在来自四个个体的人全血中孵育,并且通过血栓弹性测定法分析其作用[Wyseure T.等.(2013)J.Thromb.Haemost.11,2069-2071]。两种MA的联合添加以及双功能抗体的添加促进达到极其显著程度的纤维蛋白溶解(p<0.001),而单一MA的添加仅造成中等作用(图4A)。
还在来自小鼠的全血中评价了Db-TCK26D6x33H1F7的作用。鉴于小鼠中的PAI-1水平极低(血清水平,平均值±SD,n=4,3.0±0.3ng/ml(对于小鼠)对比267±114ng/ml(对于人)),来自小鼠的血液中的血栓弹性分析对于PAI-1不敏感。为了提高小鼠血液中的PAI-1水平,我们通过腹膜内注射LPS(0.5mg/kg)诱导了实验内毒素血症,然后收集血液用于血栓弹性分析。两种MA的联合添加以及双功能抗体的添加促进纤维蛋白溶解达到极其显著程度(p<0.05),而单一MA的添加没有获得显著效果(图4B)。
因此,Db-TCK26D6x33H1F7显示体外强纤溶酶原性质。
实施例3.针对TAFI和PAI-1的双特异性抑制剂的纤溶酶原性质的体内评价
1.全身性血栓攻击之后双重TAFI/PAI-1抑制的互补作用
通过全身性给予促凝血酶原激酶,使采用靶向所有循环抗原的MA-TCK26D6或MA-33H1F7剂量进行预处理的小鼠经历血栓栓塞。给予TAFI抑制剂之后,肺中的纤维蛋白沉积仅降低至基线水平(图5)。鉴于小鼠中的PAI-1水平极低,没有检测到PAI-1抑制的作用。
为评价TAFI和PAI-1在该模型中的同时抑制,诱导内毒素血症以上调血浆中的PAI-1水平。通过采用MA-TCK26D6(5mg/kg)的TAFI抑制或通过采用MA-33H1F7(10mg/kg)的PAI-1抑制减少了肺中的纤维蛋白沉积。然而,该减少未达到最大程度。给予MA-TCK26D6(5mg/kg)和MA-33H1F7(10mg/kg)的混合物之后,肺中的纤维蛋白水平回到基线(图6A)。当将MA的剂量降低至1mg/kg时,该最大作用消失(图6B)。在采用双功能抗体(0.8mg/kg的Db-TCK26D6x33H1F7,即靶向采用各1mg/kg的MA联合实现的相同量的TAFI和PAI-1的剂量)处理后,获得了最大的肺纤维蛋白清除作用。
显示TAFI和PAI-1的同时抑制导致对于血栓栓塞模型中纤维蛋白去除的叠加作用,这通过Db-TCK26D6x33H1F7最为有效。
2.急性缺血性中风的小鼠模型中Db-TCK26D6x33H1F7的作用
i.单丝介导的MCAo
瞬时阻塞通过将单丝推进MCA来完成。采用该模型来评估TAFI和/或PAI-1抑制对于脑缺血/再灌注损伤的作用。该模型在具有可检测的神经学/运动缺陷的未经处理的小鼠中典型地产生大病灶体积。除病灶大小以外,中风的临床前评价中最重要的是评估神经学参数。有趣的是,在该模型中,tPA在病灶性脑缺血之后通过使神经元损伤恶化而具有已经成熟描述的有害作用[Wang YF等.(1998)Nat Med.4,228-231]。采用25mg/kg的MA-TCK26D6或6mg/kg的MA-33H1F7的治疗造成减少的脑损伤(图7A,7D)和阻塞后24小时的伴随的神经学与运动恢复(图7B-C,7E-F)。此外,相较于对照小鼠的那些(图7G),处理的小鼠的脑在同侧包含较少的纤维蛋白(原)。对照IgG中的对照IgG是图7中的MA-T30E5和图8中的MA-NB27B3。采用1mg/kg的任一亲代抗体的治疗均未改变阻塞后24小时的病灶大小或的神经学/运动评分(图8A-C)。然而,联合给予抗体使脑损伤显著减少了1.9倍(图8A)。此外,对应剂量的双功能抗体造成了病灶大小的相似减小(2.3倍),但神经学和运动评分随之得到改善(图8A-C)。病灶大小是76±11mm3(采用载剂),81±11mm3(采用对照IgG),43±8mm3(采用MA的组合),和35±8mm3(采用双功能抗体)。此外,western印迹分析显示,亲代抗体的组合或双功能抗体将通过再灌注损伤诱导的大块纤维蛋白沉积有效地减少了至少2倍(图8D;p<0.05;n=3-4只小鼠/组)。
ii.凝血酶介导的MCAo
采用通过凝血酶注射获得的血栓栓塞中风模型,其中凝块富含纤维蛋白,因而易被tPA血栓溶解。将双功能抗体的功效与tPA(现有溶血栓试剂)做比较。为了模拟血栓溶解的临床过程,tPA通过如下方式给予:初始10%体积团注,然后在40分钟内进行90%输注,由于循环tPA的短半衰期(约5分钟)[Chandler WL等.(1997)Circulation.96,761-768]。阻塞后24小时,在所有组中出现了动脉腔的完全重通(包括载剂组)(中值血管造影术评分=2,图9B)。在相同时间点,散斑衬比成像显示在远离载剂组阻塞的MCA范围中的组织灌注的40%减少(图9C)。有趣的是,通过双功能抗体和tPA的联合实质上恢复了脑灌注(图9C;p<0.05对比载剂;n=6-8只小鼠/组),而单独的双功能抗体或tPA未显著增加灌注。病灶体积通过给予tPA而减少,然而该减少并不是统计学显著的(37±13mm3对比26±12mm3;图9A;p=0.203;n=6-8只小鼠/组)。相反,阻塞后20分钟的早期双功能抗体给予(0.8mg/kg),无论是否共同给予tPA,在24小时显著减少了病灶体积(15±4mm3(对于双功能抗体)和15±8mm3(对于双功能抗体+tPA);对比载剂,分别是p<0.01和p<0.05;n=6-8只小鼠/组,图9A)。[图9A和9D显示相同条件]。处理也延迟至临床上更相关的时间点,例如,阻塞后90分钟(中间时间点)[Hacke W.等.(2004)Lancet 363,768-774],在所有治疗组中于阻塞后24小时观察到完全重通(中值血管造影术评分=2)。中等延迟的双功能抗体给予和tPA输注均对病灶体积无任何有益作用(25±3mm3(载剂)对比24±3mm3(tPA)对比21±4mm3(Db);图9E;n=9-10只小鼠/组)。然而,在相同治疗时间点,在tPA输注之前给予双功能抗体导致病灶体积显著减小(15±2mm3(Db+tPA);p<0.05对比载剂;n=10只小鼠/组;图9E)。
当在阻塞后240分钟给予时,这些处理对该模型中的病灶大小均没有产生作用(晚时间点,图9F)。
在中风发作后90分钟并向前,tPA处理并不总是导致有益结果,猜测是因为凝块稳定性增加(即血块回缩)导致溶血栓抗性,tPA对于逐渐损伤的脑的神经毒性,和/或出血性转化的提高的风险。在本实施例中,阻塞后90分钟时的tPA处理和双功能抗体处理均没有减少病灶体积。然而,双功能抗体和tPA的联合处理导致显著减少的病灶体积,这强调了添加双功能抗体至现有溶血栓治疗的潜在临床益处。在阻塞后4小时的更晚的治疗时间点,观察到单独或联合双功能抗体的tPA处理之后的病灶体积增加的趋势(图9F)。对应于体外神经毒性数据(图14),双功能抗体在体内也不具有有害作用。
iii. FeCl3介导的MCAo
富含血小板的凝块对于采用tPA的治疗更具抗性[Kim EY等.(2006)Neurology 67,1846-1848]。因此,采用FeCl3诱导的MCAo模型,其中凝块富含血小板,由此模拟该临床相关问题。如同预期,tPA在如下方面均不有效:(i)阻塞后1小时增加CBF(激光多普勒追踪;图10A),(ii)阻塞后24小时改善血管造影术评分(图10C),(iii)阻塞后24小时减小病灶体积(图10C),或(iv)阻塞后24小时增加脑再灌注(散斑衬比成像,图10D)。以1.6mg/kg给予的双功能抗体显著增加了阻塞后1小时的CBF(图10A;p<0.05对比载剂;n=8-15只小鼠/组)和阻塞后24小时的血管造影术评分(图10C;p<0.05对比载剂;n=8-15只小鼠/组),然而阻塞后24小时没有观察到脑灌注或病灶体积的改善(图10B,D)。相反,以3.6mg/kg给予的双功能抗体显著增加了阻塞后1小时的CBF(图10A;p<0.05对比载剂;n-8-15只小鼠/组),其导致血管造影术评分的显著增加(图10C;p<0.05;n=8-15只小鼠/组)、减少的病灶体积(图10B;p<0.05对比载剂;n=8-15只小鼠/组),和增加的脑灌注(图10D;p<0.05对比载剂;n=8-14只小鼠/组)(24小时)。
总之,称为Db-TCK26D6x33H1F7的强的溶纤维蛋白增强剂在一组中风小鼠模型中显示出强健的体内性能。
实施例4.针对TAFI和PAI-1的双特异性抑制剂的体内表达
scDb在体内表达,因为它们能够在真核细胞中有效地生成。产生针对TAFI和PAI-1的如下构建体,并且将其克隆到pcDNA3.1.中:scDb-33H1F7xRT36A3F5、scDb-TCK26D6x33H1F7和scDb-TCK26D6xMP2D2。HEK293T细胞中的体外表达水平范围是0.6-1.1μg/ml(图11A)。scDb-33H1F7xRT36A3F5通过CDR-移接而进一步优化成scDb-33H1F7xRT36A3F5-4D5,其导致高出10倍的表达和7倍增长的血浆稳定性(37℃下孵育三小时后)。小鼠中,对于第3天时的scDb-33H1F7xRT36A3F5-4D5和第6天时的scDb-TCK26D6x33H1F7,基因转移后的峰值血浆水平分别是584±79ng/ml(n=6)和188±19ng/ml(n=4),然而没有检测到scDb-TCK26D6xMP2D2表达(图11C)。因为获得的血浆水平太低以无法进行药理学评价,scDb的药代动力学经改变以延长循环半衰期。为此,将一亲和力-工程改造的白蛋白结合结构域[Jonsson A等.(2008)Protein Eng Des Sel.21,515-527]融合至scDb-TCK26D6x33H1F7和scDb-TCK26D6xMP2D2的C末端,这是在37℃下于血浆中孵育长达三天的过程中唯一保持稳定的构建体(图11B)。白蛋白结合构建体称为scDb-TCK26D6x33H1F7xABDH和scDb-TCK26D6xMP2D2xABDH。不幸的是,对于这些构建体,在体外观察到2-4倍的表达减少(图11A)。然而,对于scDb-TCK26D6x33H1F7的白蛋白结合变体,体内表达水平在第9天增长2倍(287±28ng/ml,n=5),而无法检测到scDb-TCK26D6xMP2D2的白蛋白结合变体的表达(图11C)。
实施例6.出血和药代动力学的评估
进行额外尾出血实验,以比较两种不同剂量的tPA的IV注射的效果:与用于人的临床实践(1mg/kg)等同的剂量和通常用于小鼠中的剂量(10mg/kg)。双功能抗体(Db-TCK26D6x33H1F7)以0.8mg/kg和3.6mg/kg注射。IV给予双功能抗体至多3.6mg/kg未改变尾出血时间或60分钟尾孵育之后的积累性血红蛋白损失,而两种剂量的tPA均延长了出血时间并增加了血红蛋白损失(图12A和图12B;n=9-16只小鼠/组)。双功能抗体(0.8mg/kg)和tPA(10mg/kg)的共同给予,在凝血酶介导的MCAo模型中测试的治疗方案,相较于单独tPA给予并未进一步增加尾出血时间或血红蛋白损失。
或者,在任何治疗后,于机械或血栓性MCAo中风模型中均未观察到脑溢血。
在小鼠中IV给予后的双功能抗体的循环半衰期是121分钟(图13),这允许作为急性治疗的团注。
材料与方法
双功能抗体(Db)和单链双功能抗体(scDb)的产生
抗体衍生物通过克隆来自产生单克隆抗体的杂交瘤细胞系的可变结构域(VH,VL)来生成。包含Db或scDb的DNA片段经设计分别用于细菌生产(通过周质分泌)和真核生产(通过胞外分泌)。DNA片段合以合成方式产生并进一步克隆到pSKID2中用于在大肠杆菌RV308中产生Db,和克隆到pcDNA3.1中用于采用HEK293T细胞产生scDb。带有His6标签的抗体衍生物在Ni++-柱上纯化,并在体内评价之前通过阴离子交换色谱去除内毒素。
(sc)Db的定量
(sc)Db通过ELISA基于对PAI-1和TAFI的同时结合而定量。简言之,采用使用小鼠PAI-1被覆的微量滴定板来结合(sc)Db,并且通过如下方式进行检测:用小鼠TAFI进行后续孵育,随后添加针对TAFI的MA-TCK32G12-HRP,随后采用邻苯二胺作为显色底物来显色。
TAFI中和试验
抗体衍生物抑制TAFI的能力通过采用发色试验来定量,以检测剩余TAFIa活性,并将其与亲代单克隆抗体(MA)的抑制性质做比较。TAFI与MA或sc(Db)以TAFI 0.06-8倍摩尔比的浓度孵育,在通过凝血酶/血栓调节素或纤溶酶活化之前或之后进行,取决于MA的工作机理。剩余TAFIa活性采用马尿酰-Arg作为底物,随后进行比色反应来测定。
PAI-1中和试验
抗体衍生物抑制活性PAI-1的能力通过采用纤溶酶原偶联的发色方法来定量,并且与亲代MA的抑制性质做比较。PAI-1与MA或(sc)Db以PAI-1 0.06-32倍摩尔比的浓度预孵育(2小时,室温)。与tPA(15'37℃)连续孵育之后,添加纤溶酶原,并且通过显色底物来定量纤溶酶的转化程度。
体外血浆凝块溶解试验
汇集的大鼠含柠檬酸的血浆与MA或sc(Db)预孵育(10’,37℃),然后添加CaCl2和t-PA。然后,通过微量滴定板读取仪进行浊度(OD405nm)检测来监测随时间变化的凝块溶解。纤维蛋白溶解的程度表示为180分钟的时间范围内的曲线下面积。所得数据针对在MA(浓度对应于与sc(Db)等同数量的对于对应抗原的结合位点)的存在下获得的值进行标准化。
转动血栓弹性测定法
来自4位健康供者或来自(健康或通过在实验开始之前6小时腹膜内注射LPS(0.5mg/kg)而具有内毒素血症的)小鼠的含柠檬酸的全血与MA或Db(以产生与对应抗原等同数量的结合位点的浓度)预孵育。通过促凝血酶原激酶、CaCl2和tPA起始凝块和后续的纤维蛋白溶解。对于人血,纤维蛋白溶解通过相对最大幅度的初始凝块后45分钟的幅度减小来测定(L(%)=[(A最大-A45)/A最大]*100)。各轮检测中,基线溶解(Lwo)采用相同血液样品(不含MA或Db(Lwo不超过12%))来测定。然后,特异性抑制剂增强的溶解测定为ΔL(%)=L抑制剂-Lwo。对于小鼠血液,特异性抑制剂增强的纤维蛋白溶解测定为相对于AUCwo的盐水(AUCwo)和处理的条件(AUC抑制剂)之间的曲线下面积的差异(从凝固时间到凝固时间+120分钟的AUC)(相对ΔAUC=[(AUCwo-AUC抑制剂)/AUCwo]*100。
体内模型
血栓栓塞模型
MA、双功能抗体或盐水(0.9%NaCl)通过静脉内注射(IV)进入禁食过夜的非麻醉的SWISS小鼠(健康或通过在实验起始之前三小时腹膜内注射LPS(0.5mg/kg)而具有内毒素血症)。五分钟后,血栓栓塞通过IV注射促凝血酶原激酶来诱导。小鼠用戊巴比妥(60mg/kg腹膜内)麻醉,并且在血栓攻击后15分钟用10IU/ml肝素灌注肺。然后,肺经分离并均质化。经清洗的(左)肺均质物与2μM微纤溶酶孵育,以将纤维蛋白转化成溶解的纤维蛋白降解产物,供于采用针对小鼠纤维蛋白原的交叉反应性ELISA进行的纤维蛋白降解产物的后续定量。肺中的纤维蛋白含量表示为纤维蛋白原当量(μg/ml)。
凝血酶介导的和FeCl3介导的MCAo模型
麻醉的SWISS小鼠(通过吸入2%异氟烷/氧混合物)被置于立体定位装置,以通过颅骨切除术暴露右侧大脑中动脉(MCA)。通过激光多普勒血流仪证实的原位阻塞,通过微注射鼠α凝血酶进入MCA来进行[Orset C等.(2007)Stroke.38,2771-2778]或通过施加用20%FeCl3饱和的滤纸来进行[Karatas H等.(2011)J Cereb Blood Flow Metab.231,1452-1460]。凝块发生后15分钟IV注射Db或PBS(载剂)。五分钟后,tPA(10mg/kg)或盐水通过尾静脉导管给予(10%以团注形式,且90%通过输注40分钟)。初始阻塞后24小时,通过将颅骨暴露至Speckle对比成像仪(Moor FLPI-2,摩尔仪器公司(Moor instruments))来将脑血流与同侧和对侧相对映。血流的减少相对于对侧表达。脑损伤体积通过T2-加权的MRI来测定,以MCA进行的血管造影术评分(0=阻塞,1=部分重通和2=完全重通)通过MR血管造影术测定,并且采用T2*-加权的MRI来排除溢血的发生。
为了评估凝血酶介导的模型中的不同处理时间点,双功能抗体(Db)或载剂(PBS)在阻塞后某些时间点通过尾静脉导管IV注射:早期(15分钟)、中间(90分钟)或晚期(240分钟)时间点。双功能抗体或载剂给予后五分钟,IV给予tPA(10mg/kg)或盐水(10%以团注形式,且90%在40分钟内输注)。脑损伤体积通过T2-加权的MRI来测定,并且以MCA进行的血管造影术评分(0=阻塞,1=部分重通和2=完全重通)通过MR血管造影术测定,并且采用T2*-加权的MRI来排除溢血的发生。
单丝介导的MCAo模型
麻醉的C57BL/6小鼠(通过吸入2%异氟烷/氧混合物)的颈部进行中线皮肤切开术之后,结扎近端颈总动脉和外部颈动脉。右侧MCA的来源通过右内颈动脉插入标准化的硅橡胶(被覆有6.0尼龙单丝)来堵塞。原位阻塞60分钟后,取出管腔内单丝,并在再灌注后5分钟,IV注射MA或PBS。初始阻塞后24小时,小鼠经历功能测试:经修改的贝德森测试和抓握测试,以分别评估神经学和运动功能。然后,将小鼠处死,并获取脑以确定病灶体积(通过2,3,5-三苯基-氯化四唑染色)。
神经学测试
阻塞后24小时(MCAo模型),小鼠经历经修改的贝德森测试和抓握测试,以分别评估总体神经学功能和运动功能。该经修改的贝德森测试采用如下评分系统:0,无不足;1,前肢体屈曲;2,减少的侧推抗性;3,单向绕圈;4,纵向旋转;5,无移动。
进行抓握测试,其中将小鼠置于木棍上(3mm直径,40cm长),该木棍连接至平面上方40cm的2个垂直支持物。当将小鼠置于支持物之间的棍上时,根据如下系统对实验评分:0,落下;1,2只前爪挂在棍上;2,与1相同,但试图爬上棍;3,2只前爪+1或2只后爪挂在棍上;4,全部4只爪子挂在棍上+尾巴绕棍;5,逃脱(小鼠能够碰到支持物之一)。盲法进行评估。
病灶定量
阻塞后24小时(MCAo模型),处死小鼠。快速收获脑并采用小鼠脑切分矩阵(slice matrix)将其切成2-mm厚的冠状切片。视检评估脑溢血的存在。切片用PBS中的2%2,3,5-三苯基-氯化四唑(西格玛奥德里奇(Sigma-Aldrich),密苏里州圣路易斯)染色,以区分健康组织和未染色的梗塞。染色的切片采用数码尼康D70相机拍照,并且采用Image J软件(国立卫生研究院,马里兰州贝塞斯达)盲法检测梗塞区域(白色)。
蛋白质提取和Western印迹分析
缺血性组织(包括皮质和基底神经节)从福尔马林固定的TTC染色的脑切片切出,并如先前所述并稍加修改,在含0.1%SDS和0.25%蛋白酶抑制剂混合物(罗氏(Roche))的RIPA缓冲剂(25mmol/L Tris pH 7.4,150mmol/L NaCl,1%NP40)中均质化。39个样品采用CLI12混合器均质化,然后在4℃孵育20分钟,随后在冰上进行超声处理。然后,组织裂解物15,000xg在4℃离心20分钟,取上清液如下进行Western印迹分析。上样30μg总蛋白质,在SDS-聚丙烯酰胺凝胶上进行电泳,并转移至硝酸纤维素膜。用封闭缓冲剂(5%脱脂牛奶,50mmol/L Tris-HCl pH 7.5,150mmol/L NaCl,0.05%吐温-20)封闭1小时后,膜分别用抗纤维蛋白原多克隆抗体(AP00766PU-N,阿克里斯(Acris);稀释度1:500)或抗肌动蛋白MA(MAB1501,密理博(Millipore);稀释度1:500)于4℃孵育过夜或孵育1小时。然后,膜经冲洗,随后用HRP偶联的山羊抗兔IgG(杰克森免疫研究公司(Jackson ImmunoResearch);稀释度1:14000)(纤维蛋白原)或山羊抗小鼠IgG(达科(Dako);稀释度1:2000)(肌动蛋白)室温孵育60分钟。印迹采用SuperSignal West Pico化学发光底物(赛默科学公司(Thermo Scientific))显色,并用LAS-4000迷你成像仪(GE医疗集团(GE Healthcare))检测信号。
尾出血试验
小鼠尾静脉出血时间采用剪尾试验测定,如前所述。通过近端尾静脉注射,对小鼠给予单一给予形式的PBS、双功能抗体、tPA,或在tPA前5分钟共同给予双功能抗体。五分钟注射后,剪下远端3mm区段的尾部,并将截下的尾立即浸入37℃下的0.9%等张盐水。监测出血时间直至出血的初始中止(即30秒内没有再出血)。对于多个处理,盲法进行实验。测定剪尾后60分钟期间的积累性血红蛋白损失。离心(2000×g 10分钟)后,血细胞在1mL等张盐水中重悬,并且在Cell-Dyn 3500R计数器上检测血红蛋白含量(雅培(Abbott),比利时迪更)。
循环半衰期的测定
Db-TCK26D6x33H1F7(0.8mg/kg)通过尾静脉注射IV给予小鼠(n=6)。实验前,抽血于0.38%柠檬酸三钠上(=预样品)。注射后,在若干时间点抽血于0.38%柠檬酸三钠上:5分钟、45分钟、3小时、6小时和24小时。对应血浆样品中的双功能抗体浓度通过基于针对PAI-1和TAFI的双功能抗体的同时结合的ELISA来测定。聚苯乙烯微量滴定板的孔用PBS中的200μl重组小鼠PAI-1(pH 7.4;4μg/ml)在4℃孵育72小时,倒空并用补充有1%(m/v)牛血清白蛋白的PBS处理2小时。清洗后,连续两倍稀释(180μl)的血浆样品添加至孔并在4℃孵育过夜。然后,孔经清洗并用170μl小鼠TAFI(0.1μg/ml)室温孵育2小时。随后,板经清洗并向孔添加160μl HRP偶联的MA-TCK32G12(针对TAFI),然后室温孵育2小时。所有清洗步骤采用含吐温80(0.002%)的PBS进行,并且在含吐温80(0.002%)和牛血清白蛋白(0.1%m/v)的PBS中制备稀释物。ELISA采用150μl的0.1mol/L柠檬酸盐-0.2mol/L磷酸钠缓冲剂(pH 5.0,包含300μg/mL邻苯二胺和0.01%过氧化氢)显色。室温30分钟后,过氧化物酶反应采用50μl 4mol/L H2SO4停止。在492nm读出吸光度。Db-TCK26D6x33H1F7用作校准物。
通过体内电穿孔的基因转移
麻醉的SWISS小鼠(通过吸入2%异氟烷/氧混合物)经历预放血。在注射质粒DNA(pcDNA3.1.,包含scDb)之前三小时,两块四头肌接受注射透明质酸酶,然后进行电穿孔。小鼠通过眼球后穿刺放血,以制备含柠檬酸的血浆,以测定表达水平(cfr.3.2)至多至DNA注射后15天。
神经毒性
神经元培养物从Swiss小鼠胚胎(胎龄第14天)制备。切下皮质并在DMEM中解离,然后铺于被覆有多聚-D-赖氨酸(0.1mg/ml)和层粘连蛋白(0.02mg/ml)的24孔板上。细胞在补充有5%胎牛血清、5%马血清(均来自英杰公司(Invitrogen),法国蓬多瓦兹)和2mM谷氨酰胺的DMEM中孵育。培养物维持在37℃下的湿润5%CO2气氛下。为了抑制神经胶质增殖,在3天体外(DIV)后向皮质培养物添加胞嘧啶β-D-阿拉伯糖苷(10μM)。
通过暴露至补充有10μM的甘氨酸的无血清DMEM中的NMDA(10μM)24小时,以12-13DIV诱导兴奋性中毒。NMDA单独施加或与rtPA(20μg/ml)和/或双功能抗体(5μg/ml)一同施加。作为对照,在不存在NMDA的情况下,以12-13DIV以若干浓度(0.5μg/ml–50μg/ml)向神经元培养物添加双功能抗体。24小时后,通过检测损毁细胞释放至周围培养基中的乳糖脱氢酶(LDH)的活性来定量神经元死亡(罗氏诊断(Roche Diagnostics),德国曼海姆)。在暴露至500μM NMDA的同类培养物中测定对应于最大神经元死亡(完全杀伤,FK)的LDH水平。测定经历对照清洗物的同类培养物中的背景LDH水平。实验值经如下处理,减去LDH最小,然后针对LDH最大-LDH最小进行标准化以将结果表达为神经元死亡百分比。
统计学分析
所有定量数据以平均值和平均值的标准误差(SEM)表示。双功能抗体的循环半衰期在对血浆水平针对时间的非线性拟合之后获得(Graphpad Prism第5版,GraphPad软件公司,美国加利福尼亚州圣迭戈)。统计学分析采用GraphPad Prism第5版(GraphPad软件公司)进行。来自血栓弹性测定法的曲线(获自导出工具(Export tool))用GraphPad Prism 5整合。进行卡方检验以比较来自不同处理组的血管造影术评分。通过进行格拉布斯检验来排除离群值。在统计学分析之前,采用达戈斯蒂诺和皮尔森正态性检验来检查数据分布。采用利用邦费罗尼多重比较检验的单向ANOVA来进行FeCl3诱导的MCAo之后的病灶体积和散斑衬比成像数据的统计学比较,并且采用不成对的斯氏t检验来对机械tMCAo后的病灶体积进行统计学比较。采用利用图氏多重比较检验的克鲁斯卡尔-沃利斯ANOVA来进行如下项目的统计学比较:(i))裂解的血栓弹性参数、ΔL和相对ΔAUC,(ii)静脉血栓栓塞模型中的肺纤维蛋白原当量;(iii)IIa诱导的MCAo模型中的病灶体积和散斑衬比成像数据;(iv)FeCl3诱导的MCAo模型中的激光多普勒数据,和(v)尾出血时间与血红蛋白含量。进行曼-惠特尼检验来对神经学/运动数据、机械tMCAo后的纤维蛋白原水平和体外神经毒性数据进行统计学分析。P值<0.05被认为具有显著性。
本申请中公开的序列。
下划线字:CDR序列
SEQ ID 17和18中的N末端Met Ala残基来自PelB信号肽
粗体字:合成的接头和标签
- 还没有人留言评论。精彩留言会获得点赞!