一种用于检测人源性GRP78基因表达水平的引物组合物及其应用的制作方法
本发明属基因
技术领域:
,具体涉及一种用于检测人源性grp78基因表达水平的引物组合物及其应用。
背景技术:
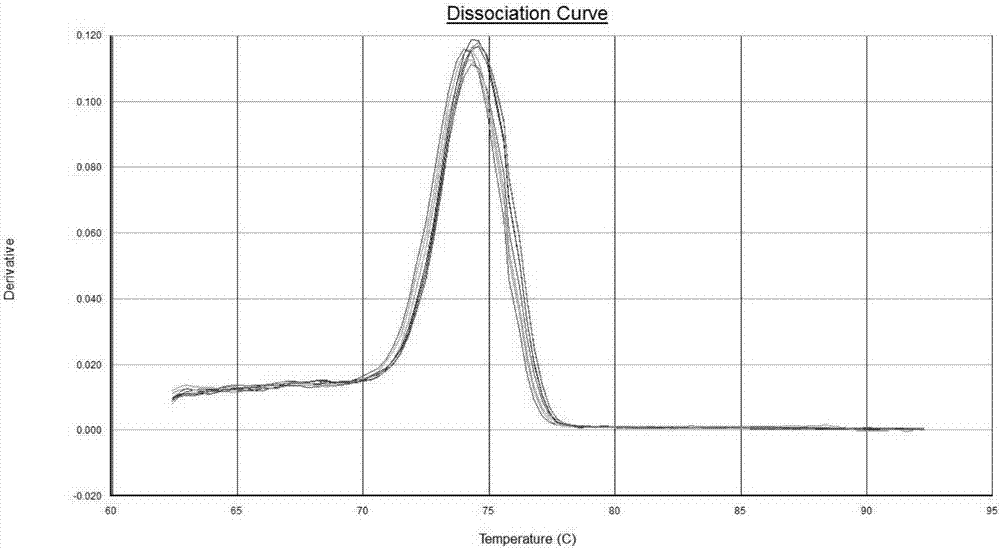
:葡萄糖调节蛋白78(grp78)又称免疫球蛋白重链结合蛋白(bip),是1977年发现的一种分子伴侣蛋白,该蛋白是热休克蛋白hsp70家族的成员之一。grp78作为定位在内质网上的内质网驻留蛋白,主要生物学功能是辅助内质网新合成的未折叠肽保持可溶构象,为下一步的折叠和修饰做准备,阻止蛋白在内质网堆积。当内质网出现错误折叠蛋白堆积时,内质网稳态失衡产生内质网应激,迅速启动未折叠蛋白反应(unfoldedproteinresponse,upr),包括蛋白合成暂停、内质网分子伴侣grp78等和折叠酶表达上调、内质网相关性降解在内的一系列综合反应,以减轻内质网负担,促进细胞存活,因此内质网应激是细胞的一种适应性保护机制。grp78是内质网应激的重要指标,参与upr的调控,持续的内质网应激最终诱导细胞凋亡。grp78对内质网内环境的细微改变都极度敏感,病毒感染或其他外在干扰等病理生理因素都会产生内质网应激导致grp78的表达升高,例如grp78在暴露于重金属环境中的星型胶质细胞内质网上大量表达,对敏感神经元具有保护作用。内质网应激还与许多疾病的发生密切相关,比如在神经退行性疾病阿尔茨海默氏病(ad)中grp78的表达水平下降,细胞保护作用减弱。一些对疾病的干预和治疗措施也可影响grp78的表达,因此通过对grp78表达水平的研究有助于明确疾病的发病机制和药物的药效机制。对grp78表达水平的研究除采用免疫组化和western免疫印迹等方法从蛋白水平进行研究外,也可从mrna水平研究grp78的表达水平,包括半定量反转录pcr和荧光定量pcr方法等。以蛋白为检测目标的方法通常操作比较繁琐,耗时。半定量反转录pcr需要电泳检测,准确度不够高。荧光定量pcr方法是 一种高灵敏度、简便快捷的检测方法,操作简单,可应用sybrgreen染料法检测,无需使用荧光探针,设计简单,采用荧光定量pcr相对定量方法通过与表达水平相对稳定的管家基因比较来反映目的基因的表达水平,能很好的辅助grp78表达水平的研究,整个pcr反应过程只需1.5小时即可完成。细胞管家基因需选择维持细胞最低限度功能所不可少的基因,在所有细胞中均要表达的一类基因,且表达水平受环境因素影响较小。有研究表明比较常用的actin管家基因受内质网应激影响,表达量会减少,不适宜用于内质网应激的参考基因。核糖体蛋白基因产物例如rpl19是维持细胞生命活动所必须的,表达于所有细胞中,其表达只受启动序列或启动子与rna聚合酶相互作用的影响,而不受其他机制调节,可用作内质网应激的参考基因。技术实现要素:本发明的一个目的是提供一种用于检测人源性grp78基因表达水平的引物组合物。本发明所提供的用于检测人源性grp78基因表达水平的引物组合物,由引物组1和引物组2组成;所述引物组1用于grp78基因检测,所述引物组2用于rpl19内参基因检测;所述引物组1由序列为seqidno:1和seqidno:2所示的引物组组成;所述引物组2由序列为seqidno:3和seqidno:4所示的引物组组成。优选地,上述引物组1的上游和下游引物的浓度均为0.1-0.5μm。优选地,上述引物组2的上游和下游引物的浓度均为0.1-0.5μm。本发明的另一个目的是上述的引物组合物在制备用于检测人源性grp78基因表达水平的试剂中的应用。本发明的第三个目的是提供一种检测人源性grp78基因表达水平的试剂盒,该试剂盒包括权利要求1-3中所述的引物组合物和荧光染料。优选地,上述荧光染料是sybrgreen荧光染料。本发明的第四个目的是提供一种非诊断治疗目的的用于检测人源性grp78基因表达水平的方法,包括如下步骤:步骤1:提取样品中rna;步骤2:将步骤1中提取出来的rna反转录成cdna;步骤3:以权利要求1中所述的引物组为引物,用荧光定量pcr法检测grp78基因以及rpl19内参基因表达水平。优选地,上述荧光定量pcr反应条件为95℃预变性5min;95℃变性10s,60℃退火40s运行40个循环;最后40℃10s结束反应。本发明的第五个目的是提供一种上述引物组合物在rna干扰序列方法中的应用,采用2-△△ct相对定量方法计算不同rna干扰序列样品的grp78基因表达水平,筛选出表达水平最低的rna干扰序列。本发明采用上述技术方案,与现有技术相比,具有如下技术效果:(1)特异性强本发明设计grp78基因和rpl19基因的引物,通过比对分析设计的引物之间的二聚体、发夹结构等,最终设计出了2对引物组,能够特异性的检测grp78基因的表达水平,避免了同源性基因的干扰,通过对grp78的表达水平进行研究有助于明确疾病的发病机制和药物的疗效判断。(2)检测敏感性高常规对grp78表达水平的研究,通常采用免疫组化和western免疫印迹等方法从蛋白水平进行研究,以蛋白为检测目标的方法通常操作比较繁琐,耗时。此外,也可以检测grp78的mrna量,但通常半定量反转录pcr需要电泳检测,准确度不够高。本发明建立的sybrgreen实时荧光定量rt-pcr方法对样品中的grp78表达水平进行定量,其检测的灵敏度非常高,用该技术建立的试剂盒可用于特异性的检测grp78的表达水平。(3)操作方便简单本发明采用染料法检测,无需使用荧光探针,设计简单,采用荧光定量pcr相对定量方法通过与表达水平相对稳定的管家基因比较来反映目的基因的表达水平,能很好的辅助grp78表达水平的研究。(4)准确度更高常用的actin管家基因受内质网应激影响,表达量会减少,不适宜用于内质网应激的参考基因,本发明以不受内质网应激影响的rpl19作为内参,提高了人源性grp78基因表达水平的检测准确性,检测过程简单、高效。(5)检测时间短本发明建立的sybrgreen实时荧光定量rt-pcr方法无需进行电泳,可直接通过电脑来观察反应结果,整个pcr反应过程只需1.5小时即可完成。而常规的rt-pcr方法至少需要3.5个小时来完成扩增反应,然后还需要花2个小时进行凝胶电泳来观察结果。附图说明图1为不同rna干扰序列下的grp78基因表达水平。图2为grp78基因引物扩增的熔解曲线。图3为rpl19基因引物扩增的熔解曲线。图4为manf蛋白对pd细胞模型grp78基因表达水平的影响。具体实施方式下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于本发明而不用于限制本发明的范围。实施例1本实施例为引物组合物的使用方法,具体包括以下步骤:步骤1:组织或细胞rna提取用商品化试剂盒来提取细胞rna,紫外分光光度计测定rna浓度,并控制提取质量,od260/280测定值为2.0。本实施例用天根总rna提取试剂盒来提取细胞rna,具体操作按说明书进行。步骤2:cdna反转录取大约500ngrna,用takara商品化试剂盒primescripttmrtmastermix(perfectrealtime)来进行cdna的反转录,具体操作按说明书进行。步骤3:荧光定量pcr反应实验中每种模板分别加入两种荧光定量pcr反应体系,分别进行grp78和rpl19基因检测,一种反应体系包含组分如下:另一种反应体系包含组分如下:2×acetaqsybrsupermix12.5μl上游引物(f-rpl)各0.1~0.5μm下游引物(r-rpl)各0.1~0.5μm模板(1:5稀释的cdna)5μl总体积25μl荧光定量pcr反应条件为95℃预变性5min;95℃变性10s,60℃退火40s运行40个循环;最后40℃10s结束反应。退火时检测荧光信号。可在运行结束后进行熔解曲线分析,检测引物扩增的特异性。本发明实施例中采用诺唯赞的acetaqsybrsupermix,采用25微升反应体系。荧光定量pcr仪采用abi7500。步骤4:检测并分析结果根据系统自动基线和对数期阈值设置获得各个反应的ct值。计算2-△△ct值,即实验组grp78基因mrna表达水平与对照组比较的倍数。△△ct=(ctgrp78(实验组)-ctrpl19(实验组))-(ctgrp78(对照组)-ctrpl19(对照组))实施例2本实施例根据grp78基因表达水平来筛选rna干扰序列,具体步骤如下:步骤1:将grp78基因4种不同的rna干扰序列(u1~u4)分别克隆至慢病毒质粒载体中,采用瞬时转导的方法转导293t细胞:a.用含10%fbs的高糖dmem培养基培养293t细胞,将细胞放置于37℃,5%co2的细胞培养箱中培养。转导前1天消化293t细胞,计数,将细胞接种至35mm培养皿内,每个培养皿接种6×105个细胞;b.次日用不含fbs的dmem培养基分别配制钙转试剂和rna干扰质粒,每84μl培养基内加入16μl钙转试剂,每100μl培养基内加入4μg质粒,分别混匀后 将钙转溶液和质粒溶液轻轻混匀,室温静置10分钟,逐滴加入培养皿内,在37℃,5%co2培养箱内培养24h,更换新鲜的含10%fbs的高糖dmem培养基继续培养48h。步骤2:收集细胞,提取细胞rna,反转录cdna,采用荧光定量pcr法检测grp78基因的表达水平:a.分别取500ngrna反转录cdna,采用荧光定量pcr法检测grp78基因的表达水平,以rpl19基因作为内参,荧光定量pcr所采用的引物序列见seqidno:1和seqidno:2;b.用2-△△ct相对定量方法计算不同rna干扰序列样品的grp78基因表达水平。筛选出表达水平最低的rna干扰序列。检测结果(见图1)表明u4序列的grp78基因表达水平最低,说明u4序列的rna干扰效果最好。并且grp78和rpl19引物扩增的熔解曲线均只出现单一的熔解峰(见图2和图3),说明引物特异性较好,无非特异性扩增。进一步说明了本发明设计grp78基因和rpl19基因的引物,通过比对分析设计的引物之间的二聚体、发夹结构等,最终设计出了2对引物组,能够特异性的检测grp78基因的表达水平,避免了同源性基因的干扰,通过对grp78的表达水平进行研究有助于明确疾病的发病机制和药物的疗效判断。实施例3本实施例对慢病毒感染细胞中人源性grp78基因表达水平进行分析,具体步骤如下:步骤1:将含有grp78基因干扰序列的包装慢病毒体外感染293t细胞。24孔板中接种293t细胞,接种密度3*105/ml。培养24h后细胞密度约为50%-60%,按moi2:1比例进行慢病毒感染,并设不加病毒阴性对照组。在37℃,5%co2培养箱内培养24h;步骤2:更换新鲜的含10%fbs的高糖dmem培养基继续培养24h,吸去上清,pbs清洗三遍,收集细胞,提取细胞rna。分别取500ngrna反转录cdna,采用荧光定量pcr法检测grp78基因的表达水平,以rpl19作为内参,并与未加病毒感染的细胞组进行比较。检测结果(见表3)表明,慢病毒感染细胞grp78基因表达水平只是对照 组细胞的59.87%。表3.慢病毒感染细胞与对照细胞grp78表达水平的比较实施例4本实施例通过检测grp78的表达水平研究manf蛋白对细胞的保护作用,具体步骤如下:采用6-羟基多巴胺(6-ohda)制作sh-sy5y细胞损伤的帕金森病细胞模型检测manf蛋白的保护作用,实验分为对照(dmem)组、6-ohda(50μmol/l)组以及6-ohda(50μmol/l)+manf(4μg/ml)组。预先给予manf蛋白4h后加入6-ohda作用6h和16h后分别收集细胞,提取rna,反转录后采用荧光定量pcr测定grp78基因的表达水平。通过与对照组比较,计算出各组grp78的相对表达水平(见图4),结果表明在manf蛋白存在情况下经过6h,细胞grp78表达水较6-ohda组明显升高,经过16h表达水平仍高于6-ohda组,说明manf蛋白对6-ohda诱导的sh-sy5y细胞损伤的保护作用可通过grp78表达水平的升高来实现。通过上述实验结果可以得出,本发明的特异性引物组合及相应的方法,可以特异性检测人源性grp78基因的表达水平,避免同源性基因的干扰,并以不受内质网应激影响的rpl19作为内参,提高了人源性grp78基因表达水平的检测准确性,检测过程简单、高效。以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1