一种可控制液体环流路径的核酸扩增反应管的制作方法
本发明属于分子生物学领域,特别是核酸扩增领域。具体而言,本发明涉及一种核酸扩增反应管,特别是一种可控制液体环流路径的核酸扩增反应管。此外,本发明还涉及一种扩增核酸的方法,其包括使用本发明的可控制液体环流路径的核酸扩增反应管。此外,本发明还涉及一种包含所述反应管的核酸扩增反应装置。此外,本发明还涉及包含所述反应管的试剂盒,以及所述反应管用于制备试剂盒的用途。
背景技术:
聚合酶链式反应(Polymerase Chain Reaction,PCR)技术,是一种体外快速扩增DNA的技术,每个循环包括变性、退火和延伸三个过程。首先,在大约95℃的高温下加热双链DNA样品,双链间的氢键会断裂,使得DNA热分解成两条互补的单链DNA分子,这一过程称为高温解链反应;然后,温度迅速降到大约50-65℃的范围内,在这个温度下单链DNA与引物按碱基互补配对原则结合,这一过程称为低温退火反应;退火反应结束后,温度要迅速升高到72℃左右进行延伸反应,在DNA聚合酶以及适当镁离子浓度的条件下,从引物的3’端开始结合单核苷酸,从而形成一条新的DNA。经过一个这样的过程,原来的一个DNA双链分子就形成了两个DNA分子,数量增加了一倍。每经过一个循环,目的核酸分子的数目扩增一倍,并且这些新形成的双链又可以作为下次循环的模板,经过30-40个循环,目的核酸分子数目扩增到原来的近109倍。PCR是体外大量获得目的DNA片段的方法,便于对核酸分子做进一步的分析和检验。
目前,主流的PCR扩增技术的反应装置一般以温控金属块加热塑料制成的PCR反应管,通过金属块的加热、冷却,达到平衡温度后将 热量通过反应管传递至PCR反应液。这种装置的缺陷是:反应体积较大,即系统通常具有较大的体积和热容,常规PCR完成30个循环一般需要2-3小时,其中大部分时间消耗于加热和冷却过程,即将金属块达到平衡温度并将热通过反应管传递至PCR反应液,因此,PCR难以实现快速高效。
2002年Madhavi Krishnan等人报导的雷诺本纳德(Rayleigh-Benard)PCR(简称RB-PCR)方法,基于热传导及热对流原理,利用上下两个恒温热源建立具自下而上温度梯度的封闭反应内腔,并因此使腔内的PCR试剂发生自发的对流运动反复流经不同温度区域从而完成扩增。该方法扩增速度快、仪器较传统PCR仪简单,但扩增试剂须充满整个封闭腔,造成上样难度大、易泄漏、易污染等问题。
台湾大学Chou等在RB-PCR技术的基础上做了改进,将封闭的反应内腔变成开放式的具特定规格的反应试管,并利用单一恒温热源加热试管底部驱动管内试剂自发循环,从而完成扩增。该方法解决了RB-PCR易泄漏、污染的问题。
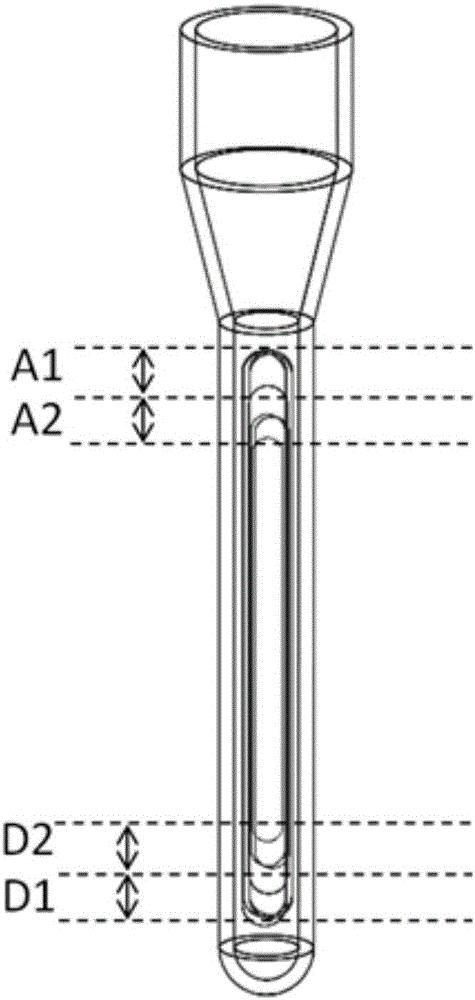
但现有的对流PCR扩增方法均存在共同的缺陷,即管内液体流动路径复杂。管内流路为近同心椭圆型的多层流路(图1a),这种多层次的复杂流路在扩增中存在以下问题:
1.扩增效率偏低:
(a)变性的效率:如图1a所示,从不低于模板或扩增子所需的变性温度的D1区经过的模板或扩增子,可发生有效的变性;而从位置高于D1区的D2区经过的模板或扩增子,则无法发生有效的变性反应,导致总体变性效率偏低;
(b)退火的效率:如图1a所示,从不高于模板或扩增子所需的退火温度的A1区经过的单链模板及引物,才有可能发生有效的退火反应;而从位置低于A1区的A2区经过的单链模板及引物,则无法发生有效的退火反应,导致总体退火效率偏低。
2.扩增的特异性不好:
在对流PCR中,因没有固定温度的退火区域及时段,因此通常会 通过温度场及流场的控制进而使得反应管上端的温度低于引物的退火温度,用以保障引物能够尽可能充分的退火。但当单链模板和(/或)引物在环流中经过过低的温度区域时,会导致退火的特异性降低,容易形成引物内部或引物间或引物与模板(/扩增子)之间的非特异性的配对,并进而发生延伸反应,形成非特异性扩增产物。
3.平行反应在扩增中可能存在管间差异:
(a)终点定性检测,在结果上主要表现为扩增效率及产物组成的差异:上述第2点中描述的非特异性扩增产物经变性后,又会变成下一轮非特异性扩增的模板,从而使得非特异性扩增不断放大,并与正确的扩增竞争引物、酶、dNTP等反应组分,使得正确扩增受到抑制,反应效率降低。而这种非特异性反应是否发生、发生的早晚、发生的比例都是不受控制的,即存在一定的随机性,这就会导致发生了此类非特异性扩增的反应管的扩增效率的不一致。非特异性扩增发生的较早、发生比例较高的反应管,其效率低于非特异性扩增发生的较晚、发生比例较低的反应管,并均低于未发生非特异性扩增的反应管。同样的,非特异性扩增发生的较早、发生比例较高的反应管,其管内产物组成中有较高比例的非特异性产物,非特异性扩增发生的较晚、发生比例较低的反应管,其管内产物组成中有较低比例的非特异性产物,未发生非特异性扩增的,其管内产物均为正确扩增产物。
(b)实时定量检测,在结果上主要表现为单位时间内有效扩增效率的差异:也就是说,无法进行实时定量检测。同上述1、2两点的描述,当对流PCR反应起始,双链模板能否经过有效地变性区域、单链模板和引物能否经过有效地退火区域、以及退火中是否发生了非特异性的反应,都是不受控制的,因此在反应起始就有可能造成不同管的产物组成存在差异,这些差异不仅会导致上述3(a)中描述的问题,还使得单位时间内,不同反应管的产物(模板)数量存在差异,进入指数扩增期的时间点就会不同,因此无法用传统的实时监测方法进行模板的定量。
技术实现要素:
本发明的目的是提供一种新型的核酸扩增反应管以及核酸扩增方法,以解决现有的对流PCR技术中存在的扩增效率偏低、特异性不好、管间差异大、定量不准确等问题。
本发明的第一方面提供一种核酸扩增反应管,包括一端封闭的管体,所述管体包括储液区以及位于储液区下方的核酸扩增区,其特征在于,所述核酸扩增区内设置有上下悬空的插片。当反应管内注入试剂时,通过插片的物理阻隔,使得反应管内试剂在外力或内力的作用下,形成围绕插片上方及下方的环流路径。
优选地,所述插片沿管体的中轴线设置,并且插片的两侧与核酸扩增区的内壁连接。插片沿管体的中轴线方向将核酸扩增区分隔成第一区域和第二区域,第一区域和第二区域在核酸扩增区的上部和下部连通。
优选地,所述插片下端与管体底部之间的距离大于0mm(例如大于等于1mm)并且小于核酸扩增区高度的1/2;更优选地,所述插片下端与管体底部之间的距离大于0mm(例如大于等于1mm)并且小于核酸扩增区高度的1/3;进一步优选地,所述插片下端与管体底部之间的距离大于0mm(例如大于等于1mm)并且小于等于4mm。
优选地,所述插片上端与核酸扩增区上端之间的距离大于0mm(例如大于等于1mm)并且小于核酸扩增区高度的1/2;更优选地,所述插片上端与核酸扩增区上端之间的距离大于0mm(例如大于等于1mm)并且小于核酸扩增区高度的1/3;进一步优选地,所述插片上端与核酸扩增区上端之间的距离大于0mm(例如大于等于1mm)并且小于等于3mm。
优选地,所述管体的底部通过与管体相互配合的底塞实现一端封闭。优选地,所述管体与底塞之间通过旋转螺纹结构,或环状卡口结构,或凸点锁扣结构相互密闭连接,也可以采用现有技术中其它的密闭连接方式。
优选地,所述管体还包括与其配合的管盖。优选地,所述管体与管盖之间通过旋转螺纹结构,或环状卡口结构,或凸点锁扣结构相互 密闭连接,当然也可以采用现有技术中其它的密闭连接方式。
优选地,所述核酸扩增区的高度/内径的比值为3~12,更优选地,所述核酸扩增区的高度/内径的比值为6~9。
优选地,所述核酸扩增区的容积为30~200μl,更优选地,所述核酸扩增区的容积为40~150μl。
优选地,所述管体和插片由耐热材料制成,所述耐热材料例如选自玻璃、聚碳酸酯、聚丙烯、聚醚砜和聚砜。
此外,优选地,所述管体的内壁可通过牛血清白蛋白(BSA)或硅烷化试剂等做钝化处理,从而降低对核酸及反应试剂中某些成分的吸附。
在一个优选的实施方案中,所述核酸扩增区的内腔为上下内径相等的柱状中空结构,也可以为横截面上宽下窄的锥状中空结构或多层梯形中空结构,核酸的扩增、RNA的转录、实时检测信号的采集均位于此区域。
在另一个优选的实施方案中,所述核酸扩增区上可设有可见的体积刻度标识。
本发明的另一方面提供一种核酸扩增反应装置,其包括本发明第一方面任一项的反应管和一个或多个可提供或移走热量的温度控制装置,所述温度控制装置设置于所述反应管的外部或内部。
本发明的还一方面提供一种试剂盒,其包含本发明第一方面任一项的反应管。
本发明的还一方面提供一种扩增样品中目的核酸的方法,其包括使用本发明第一方面任一项的反应管或本发明任一项的核酸扩增反应装置,
优选地,所述核酸是DNA或RNA;
优选地,所述扩增是PCR反应或逆转录反应。
优选地,所述方法包括以下步骤:
1)将核酸扩增反应试剂注入本发明第一方面任一项的反应管中;
2)通过震动、离心或其他方式,使反应试剂完全填充核酸扩增区;任选地,还包括用不易挥发的物质(例如石蜡油或低熔点的蜡)覆盖 于试剂表面或用管盖封闭反应管的步骤;
3)用温度控制装置对所述反应管的特定部位提供或移走热量,以完成RNA逆转录和/或DNA扩增反应;
4)任选地,在进行核酸扩增的同时或扩增结束后,还包括对扩增产物进行检测的步骤。
本发明还提供本发明第一方面任一项的反应管或本发明任一项的核酸扩增反应装置用于核酸扩增的用途。
本发明还提供本发明第一方面任一项的反应管用于制备试剂盒的用途,所述试剂盒用于进行核酸扩增。
发明的有益效果
本发明通过插片的物理阻隔,使得管内试剂在外力或内力驱动的运动中,仅能从插片的下方及上方经过,并通过一个或多个设于所述反应管的外部或内部的温度控制装置,对反应管的特定区域进行加热,使得环流从插片下方一定区域经过时,均可发生变性反应,环流从插片上方区域经过时,均可发生退火反应。该种环流运动路径及温度控制方式对PCR反应带来的好处是:
1.提高扩增效率:(a)提高变性的效率:如图1b所示,受到插片2的物理阻隔,环流运动到反应管下端时,仅能从插片2的下方的D1区经过,而该区域在所述温度控制装置的作用下,可维持高于变性所需的温度,因此,环流从反应管插片2下方的D1区经过时,均可发生有效的变性反应;(b)提高退火的效率:如图1b所示,受到插片2的物理阻隔,环流运动到反应管上端时,仅能从插片2上方的A1区经过,而该区域在所述温度控制装置的作用下,可维持满足特定引物退火所需的温度,因此,环流从反应管插片2上方经过时,均可发生有效的退火反应。
2.保障扩增的特异性:如图1b所示,受到插片2的物理阻隔,环流运动到反应管上端后,仅能从插片2上方的A1区经过,而插片2上方区域在所述温度控制装置的作用下,可维持正好满足特定引物退火所 需的温度,而不会过低于特定引物的退火温度,因此,环流从该区域经过时,引物内部或引物间或引物与模板(/扩增子)之间不会形成非特异性的配对,并造成非特异性扩增。
3.提高管间的一致性:
(a)通过提高特异性,保障扩增的一致性:如上段第2点所述,因不会再随机的形成非特异性产物,并与正确扩增竞争引物、酶、dNTP等反应组分,因此,正确扩增的效率不会受到非特异性扩增的影响,因而可提高管间在单位时间内扩增的一致性;(b)通过提高扩增效率,保障扩增的一致性:对流PCR反应起始后,受到反应管内插片2的物理阻隔作用及所述温度控制装置控制,管内的双链模板均能经过有效地变性区域发生解链反应,且环流运动到反应管上端时,单链模板和引物均能经过有效地退火区域发生退火反应,不会再因随机的环流路径而造成无效循环(即环流运动至下方时,未从满足变性条件的温度区域经过,和(/或)环流运动至上方时,未从满足退火条件的温度区域经过),从而保障管间在单位时间内扩增的一致性。(c)扩增的一致性得到了保障,因而可提高平行反应中,终点检测时扩增产物的一致性;及平行反应中,单位时间内扩增的一致性,并进而使得对流PCR扩增也可通过实时荧光检测的方法实现对初始模板的定量。
下面将结合附图和实施例对本发明的实施方案进行详细描述,但是本领域技术人员将理解,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。根据附图和优选实施方案的下列详细描述,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
附图说明
图1a示意了自然对流状态下的环流轨迹;
图1b示意了通过本发明的反应管控制后的液体环流轨迹;
图2a所示为一种可控制液体自发环流路径的反应管的正视图;
图2b所示为一种可控制液体自发环流路径的反应管的侧视图;
图2c所示为一种可控制液体自发环流路径的反应管的正视分解图;
图2d所示为一种可控制液体自发环流路径的反应管的俯视图;
图3示意了一种对可控制液体自发环流路径的反应管进行加热及荧光检测的装置图;
图4所示为应用本发明的反应管对DNA模板进行扩增后产物进行琼脂糖凝胶电泳检测的结果;
图5所示为应用本发明的反应管对RNA模板进行扩增后产物进行琼脂糖凝胶电泳检测的结果;
图6a所示为使用一种可控制液体自发环流路径的反应管进行核酸扩增后,产物进行琼脂糖凝胶电泳检测的结果;
图6b所示为使用无环流控制功能反应管进行核酸扩增后,产物进行琼脂糖凝胶电泳检测的结果;
图7a所示为不同扩增时间下,使用一种可控制液体自发环流路径的反应管进行核酸扩增后,产物进行琼脂糖凝胶电泳检测的结果;
图7b所示为不同扩增时间下,使用无环流控制功能反应管进行核酸扩增后,产物进行琼脂糖凝胶电泳检测的结果;
图8a所示为使用一种可控制液体自发环流路径的反应管进行核酸扩增并同时进行实时荧光检测的结果;
图8b所示为使用无环流控制功能反应管进行核酸扩增,并同时进行实时荧光检测的结果。
具体实施方式
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的分子遗传学、核酸化学、免疫学实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
如本文中所使用的,术语“扩增”应从广义上来理解,其包括从 RNA或DNA获得DNA的过程,并且包括但不限于PCR反应,逆转录反应,以及其各种变型(例如实时PCR反应)。
如本文中所使用的,术语“核酸”包括核糖核酸(RNA)和脱氧核糖核酸(RNA)。
图1a所示意的即为在自然对流状态下,反应管内环流的运动轨迹。反应管内只需在特定区间内形成一定的温度差异,即可形成对流。因此,在反应管的空间中,环流轨迹并非是单一的,而是呈现多层次、多方向的特点。那么,在这种多层环流中,(1)从不低于模板或扩增子所需的变性温度的D1区经过的模板或扩增子,可发生有效的变性;而从位置高于D1区的D2区经过的模板或扩增子,则无法发生有效的变性反应,导致总体变性效率偏低;(2)从不高于模板或扩增子所需的退火温度的A1区经过的单链模板及引物,才有可能发生有效的退火反应;而从位置低于A1区的A2区经过的单链模板及引物,则无法发生有效的退火反应,导致总体退火效率偏低;(3)当单链模板和(/或)引物在环流中经过过低的温度区域时,会导致退火的特异性降低,容易形成引物内部或引物间或引物与模板(/扩增子)之间的非特异性的配对,并进而发生延伸反应,形成非特异性扩增产物;(4)上述非特异性扩增产物经变性后,又会变成下一轮非特异性扩增的模板,从而使得非特异性扩增不断放大,并与正确的扩增竞争引物、酶、dNTP等反应组分,使得正确扩增受到抑制,反应效率降低。而这种非特异性反应是否发生、发生的早晚、发生的比例都是不受控制的,即存在一定的随机性,这就会导致发生了此类非特异性扩增的反应管的扩增效率的不一致;(5)上述扩增的不一致,在实时定量检测中将表现为单位时间内有效扩增效率的差异,从而导致无法应用传统荧光定量PCR方法制作标准曲线对核酸模板进行相对定量。
图1b所示的环流轨迹,为在自然对流的基础之上,通过物理阻隔使环流路径得到控制,而形成的单方向、相对集中、规则的环流轨迹。在该种可控制液体环流路径的反应管中,因反应管内的插片2的物理性 阻隔,环流运动到反应管下端时,仅能从插片2的下方经过,而该区域在温度控制装置的作用下,可维持高于变性所需的温度,因此,环流从反应管插片2下方经过时,均可发生有效的变性反应;同样因反应管内的插片2的物理性阻隔,环流运动到反应管上端时,仅能从插片2的上方经过,而该区域在温度控制装置的作用下,可维持满足特定引物退火所需的温度,因此,环流从反应管内的插片2上方经过时,均可发生有效的退火反应。
参见图2a、图2b、图2c、图2d,为实践上述方法,本发明首先提供一种可实践的可控制液体环流路径的核酸扩增反应管的优选实施例,包括一端封闭的管体1,所述管体1包括储液区4以及位于储液区下方的核酸扩增区3;所述核酸扩增区3内设置有上下悬空的插片2,当反应管内注入试剂时,通过插片2的物理阻隔,使得反应管内试剂在外力或内力的作用下,形成围绕插片上方及下方的环流路径。
优选地,所述插片2沿管体1的中轴线设置,并且插片的两侧a和b与核酸扩增区3的内壁连接;进一步优选地,插片的两侧a和b与核酸扩增区3的内壁密封连接。插片2沿管体1的中轴线方向将核酸扩增区3分隔成第一区域3-1和第二区域3-2,第一区域3-1和第二区域3-2在核酸扩增区3的上部3-A和下部3-B连通。
优选地,所述插片2下端d与管体1底部之间的距离(即,核酸扩增区3的下部3-B的高度)大于0mm(例如大于等于1mm)并且小于核酸扩增区3高度的1/2;更优选地,所述插片2下端d与管体1底部之间的距离大于0mm(例如大于等于1mm)并且小于核酸扩增区3高度的1/3;进一步优选地,所述插片2下端d与管体1底部之间的距离大于0mm(例如大于等于1mm)并且小于等于4mm。
优选地,所述插片2上端c与核酸扩增区3上端之间的距离(即,核酸扩增区3的上部3-A的高度)大于0mm(例如大于等于1mm)并且小于核酸扩增区3高度的1/2;更优选地,所述插片2上端c与核酸扩增区3上端之间的距离大于0mm(例如大于等于1mm)并且小于核酸扩增区3高度的1/3;进一步优选地,所述插片2上端c与核酸 扩增区3上端之间的距离大于0mm(例如大于等于1mm)并且小于等于3mm。
优选地,所述管体1的底部通过与管体1相互配合的底塞1-1实现一端封闭。例如,所述管体与底塞之间通过旋转螺纹结构,或环状卡口结构,或凸点锁扣结构相互密闭连接,也可以采用现有技术中其它的密闭连接方式。
优选地,所述管体1还包括与其配合的管盖。所述管体1与管盖之间通过旋转螺纹结构,或环状卡口结构,或凸点锁扣结构相互密闭连接,当然也可以采用现有技术中其它的密闭连接方式。
优选地,所述核酸扩增区3的高度/内径的比值为3~12,更优选地,所述核酸扩增区3的高度/内径的比值为6~9,例如为7~8。进一步优选地,所述核酸扩增区3的内径小于等于10mm,例如小于等于5mm,且所述核酸扩增区3的内径小于所述储液区4的内径。本发明的此种尺寸及比例结构,能够有效地保障和促进反应管的管内液体自发地形成连续而稳定的对流。在本发明中,管体1上方内径较大的区域作为储液区4,因为核酸扩增区3的内径相对较小,不方便将移液尖插入底部,也无法让液体自流至底部,所以反应试剂可先暂时贮存于储液区4中,然后再通过离心、震荡或其它方式使上方储液区4的反应试剂进入下方的核酸扩增区3,在核酸扩增区3完成扩增反应或荧光信号采集等。且储液区4相对于核酸扩增区3具有较大的直径,更容易握、拿,因此为操作者在配液中提供了极大的便利性。
优选地,所述核酸扩增区3的容积为30~200μl,更优选地,所述核酸扩增区3的容积为40~150μl。
进一步地,所述核酸扩增区3的内腔为横截面上宽下窄的锥状中空结构或多层梯形中空结构,核酸的扩增、RNA的转录、实时检测信号的采集均位于此区域。本发明核酸扩增区3内腔上宽下窄的内径设计优点为:当试剂因建立的上下温度梯度而发生对流时,反应管上方较宽内径的区域会增加试剂在该温度区域的路径,即相当于增加PCR反应中“延伸”步骤的时间,有利于长片段的扩增。当然,为了制造方 便,所述核酸扩增区3的内腔也可以为上下内径相等的柱状中空结构。
优选地,所述管体1和插片2由耐热材料制成,所述耐热材料例如选自玻璃(glass)、聚碳酸酯(PC)、聚丙烯(PE)、聚醚砜(PES)和聚砜(PSF)。
此外,优选地,所述管体1的内壁可通过牛血清白蛋白(BSA)或硅烷化试剂等做钝化处理,从而降低对核酸及反应试剂中某些成分的吸附。
在上述的反应管中可以含有:待检样本核酸、DNA聚合酶、三磷酸腺嘌呤脱氧核苷酸、三磷酸胞嘧啶脱氧核苷酸、三磷酸鸟嘧啶脱氧核苷酸、三磷酸胸腺嘧啶脱氧核苷酸、反应缓冲液、二价镁离子、非主要成分的PCR添加剂(如:甜菜碱、牛血清白蛋白、DMSO等)和至少两条与待检核酸序列特异互补的寡核苷酸引物,以及任选地与双链DNA结合的荧光染料或特异性荧光探针等。其后,用低密度的不易挥发物质(如石蜡油或者各种低熔点的蜡)覆盖于试剂表面或采用管盖封闭反应管以防止蒸发。
同时本发明还提供一种核酸扩增反应装置,其包括本发明任一项的反应管和一个或多个可提供或移走热量的温度控制装置,所述温度控制装置设置于所述反应管的外部或内部。该温度控制装置的作用是,基于雷诺本纳德(Rayleigh-Benard)原理,建立反应管内试剂的温度梯度及密度梯度,从而驱动反应试剂在反应管内的自发循环流动;控制反应管及管内试剂特定部位的温度;并进而通过试剂的自发循环及温度控制,实现聚合酶链式反应等核酸扩增反应。能够建立反应管内试剂的温度梯度及密度梯度的温度控制装置为本领域所公知,例如可参考发明专利CN103173434A,CN1571849A,CN101983236A。
本发明温度控制装置的优选实施例如图3所示,优选装置含有上加热模块4和下加热模块5,分别用于对反应管的底部与上部提供或移走热量,并通过这种温度控制,对上述可通过控制液体环流路径实现PCR高效扩增的反应管的底部提供合适的变性温度,以保障从插片下方的流经的试剂可高效的发生变性反应;对反应管的上部提供合适的退火温度, 以保障从插片上方流经的试剂可高效的发生退火反应。此外,在上、下两个金属加热模块中间,构造一块热传导系数较低的模块6,用于包裹反应管的非直接加热区域,可避免该区域因暴露在外界空气中而受到干扰,还可避免因多通量模块中部与外部散热能力差异较大而导致不同孔中反应管内温度场分布的差异。
优选地,本装置还含有实时荧光信号检测模组。该模组是由激发光源7、滤光片8及感光检测装置9组成的有机整体,能在毫秒级时间内完成多个标本快速均衡扫描检测。
本发明不局限于图2与图3所描述的反应管与检测装置,加热方式的改变与容器形状的改变皆属本发明的范畴。
图4出示了应用本发明的一种可控制液体自发环流路径的核酸扩增反应管对DNA模板进行扩增后的琼脂糖凝胶电泳检测结果。应用时,在反应管中含有:待检DNA模板、DNA聚合酶、三磷酸腺嘌呤脱氧核苷酸、三磷酸胞嘧啶脱氧核苷酸、三磷酸鸟嘧啶脱氧核苷酸、三磷酸胸腺嘧啶脱氧核苷酸、反应缓冲液、二价镁离子、非主要成分的PCR添加剂(如:甜菜碱、牛血清白蛋白、DMSO等)和至少两条与待检核酸序列特异互补的寡核苷酸引物。并用低密度的不易挥发物质(如石蜡油或者各种低熔点的蜡)覆盖于试剂表面或用管盖封闭反应管,以防止蒸发。扩增时,反应管置于加热装置中,位于反应管底部的加热模块设置为95℃,位于反应管上部的加热模块设置为60℃,反应时间设置为30分钟。反应管内试剂将在该温差的驱动下连续流动,并在反应管中插片的物理阻隔下,仅从插片的底部与上方经过,并在流经插片底部时发生变性反应,在流经插片上方时,发生退火反应,并在聚合酶活性温度区间内进行延伸反应。扩增结束后,从管内取5μl产物进行琼脂糖凝胶电泳分析。泳道1与泳道2为阳性样本扩增结果,泳道3与泳道4为阴性对照(DEPC水)扩增结果。从结果中可以看出,本发明可实现对DNA模板的扩增。
图5出示了应用本发明的一种可控制液体自发环流路径的核酸扩增反应管对RNA模板进行扩增后的琼脂糖凝胶电泳检测结果。与DNA扩 增不同的是:反应管内除含有上述DNA扩增所需试剂外,还含有反转录酶,用于实现以RNA为模板的cDNA合成。此外,反应模块的温度设置也有所不同:位于反应管底部的加热模块首先被设置为60℃,维持20分钟后,再升温至95℃,维持30分钟;位于反应管上部的加热模块仍设置为恒温60℃,50分钟。同样的,扩增结束后,从管内取5μl产物进行琼脂糖凝胶电泳分析。泳道1与泳道2为阳性样本扩增结果,泳道3与泳道4为阴性对照(DEPC水)扩增结果。从电泳图中可以看出,本发明还可实现对RNA模板的扩增。
图6说明应用本发明的一种可控制液体自发环流路径的核酸扩增反应管相对于先前对流PCR方法可提高不同管间扩增的一致性与特异性。用相同加热装置分别在本发明的一种控制液体自发环流路径的反应管与无环流控制功能反应管中,对4管重复的巨细胞病毒(CMV)阳性样本的提取模板(CMV DNA浓度为103copies/tube)及4管CMV阴性的HBV阳性样本的提取模板(HBV DNA浓度为106copies/tube)进行扩增。应用本发明的一种控制液体自发环流路径的反应管扩增的结果如图6a所示,应用无环流控制功能反应管扩增的结果如图6b所示。泳道1-4为4管相同CMV核酸阳性样本的重复扩增结果,泳道5-8为CMV核酸阴性HBV核酸阳性样本的对照。结果显示,应用本发明进行4组阳性样本的平行检测,其终点检测结果的一致性(图6a,泳道1-4)明显优于应用无环流控制功能反应管进行扩增的结果(图6b,泳道1-4)。说明本发明的一种控制液体自发环流路径的反应管可提高不同管间扩增的一致性。此外,应用本发明进行4组阴性样本的平行扩增,其终点检测结果(图6a,泳道5-8)中,非特异性扩增(如引物二聚体)较无环流控制功能反应管结果(图6b,泳道5-8)有极大的改善,说明本发明的一种控制液体自发环流路径的反应管可提高扩增的特异性。
图7说明应用本发明的一种可控制液体自发环流路径的核酸扩增反应管相对于先前对流PCR方法可提高扩增的速率。用相同加热装置分别在本发明的一种控制液体自发环流路径的反应管与无环流控制功能反应管中,对浓度为103copies/ml的CMV DNA进行3组扩增(每组4 个重复样本及1个模板为DEPC水的阴性对照),3组扩增时间分别设定为15分钟,20分钟,25分钟。应用本发明的一种控制液体自发环流路径的反应管扩增的结果如图7a所示,应用无环流控制功能反应管扩增的结果如图7b所示。结果显示,应用本发明的扩增,在扩增20分钟后,阳性管即可观察到弱条带,在扩增25分钟后,阳性管即可观察到强条带;而应用无环流控制功能的反应管,则需扩增25分钟,阳性反应管才可观察到弱条带。该结果说明应用本发明的一种可控制液体自发环流路径的核酸扩增反应管相对于先前对流PCR方法可提高扩增的效率。
图8说明应用本发明的一种可控制液体自发环流路径的核酸扩增反应管相对于先前对流PCR方法可提高定量检测的准确性。用相同加热装置分别在本发明的一种控制液体自发环流路径的反应管与无环流控制功能反应管中,对浓度为106copies/tube、105copies/tube的人巨细胞病毒(CMV)DNA及阴性样本(DEPC水)进行扩增,并用taqman水解探针对扩增进行实时检测。结果显示,应用本发明的检测,其相同浓度样本的重复性明显高于用无环流控制功能的反应管。
实施例
现参照下列意在举例说明本发明(而非限定本发明)的实施例来描述本发明。
除非特别指明,本发明中所使用的分子生物学实验方法和免疫检测法,基本上参照J.Sambrook等人,分子克隆:实验室手册,第2版,冷泉港实验室出版社,1989,以及F.M.Ausubel等人,精编分子生物学实验指南,第3版,John Wiley&Sons,Inc.,1995中所述的方法进行;酶的使用依照产品制造商推荐的条件。本领域技术人员知晓,实施例以举例方式描述本发明,且不意欲限制本发明所要求保护的范围。
实施例1:一种控制液体自发环流路径的反应管
如图2a、2b、2c、2d所示,本发明的一种可控制液体环流路径的核酸扩增反应管包括一端封闭的管体1,所述管体1包括储液区4以及位于储液区下方的核酸扩增区3,所述核酸扩增区3内设置有上下悬空的插片2,当反应管内注入试剂时,通过插片2的物理阻隔,使得反应管内试剂在外力或内力的作用下,形成围绕插片上方及下方的环流路径。
优选地,所述插片2沿管体1的中轴线设置,并且插片的两侧a和b与核酸扩增区3的内壁连接。插片2沿管体1的中轴线方向将核酸扩增区3分隔成第一区域3-1和第二区域3-2,第一区域3-1和第二区域3-2在核酸扩增区3的上部3-A和下部3-B连通。
优选地,所述插片2下端d与管体1底部之间的距离(即,核酸扩增区3的下部3-B的高度)大于0mm(例如大于等于1mm)并且小于核酸扩增区高度的1/2,例如小于1/3,例如小于等于4mm。
优选地,所述插片2上端c与核酸扩增区3上端之间的距离(即,核酸扩增区3的上部3-A的高度)大于0mm(例如大于等于1mm)并且小于核酸扩增区3高度的1/2,例如小于1/3,例如小于等于3mm。
优选地,所述管体1的底部通过与管体1相互配合的底塞1-1实现一端封闭。所述管体与底塞之间可通过旋转螺纹结构,或环状卡口结构,或凸点锁扣结构相互密闭连接,也可以采用现有技术中其它的密闭连接方式。
优选地,所述核酸扩增区3的高度/内径的比值为3~12,进一步优选为6~9。
优选地,所述核酸扩增区3的容积为30~200μl,进一步优选为40~150μl。
优选地,所述核酸扩增区3的内腔可以为横截面上宽下窄的锥状中空结构或多层梯形中空结构,也可以为上下内径基本相等的柱状中空结构。核酸的扩增、RNA的转录、实时检测信号的采集均位于此区域。
所述管体1和插片2可以由耐热材料制成,所述耐热材料例如选 自玻璃(glass)、聚碳酸酯(PC)、聚丙烯(PE)、聚醚砜(PES)和聚砜(PSF)。
此外,优选地,所述管体1的内壁可通过牛血清白蛋白(BSA)或硅烷化试剂等做钝化处理,从而降低对核酸及反应试剂中某些成分的吸附。
在上述反应管中含有:待检样本核酸、DNA聚合酶、三磷酸腺嘌呤脱氧核苷酸、三磷酸胞嘧啶脱氧核苷酸、三磷酸鸟嘧啶脱氧核苷酸、三磷酸胸腺嘧啶脱氧核苷酸、反应缓冲液、二价镁离子、非主要成分的PCR添加剂(如:甜菜碱、牛血清白蛋白、DMSO等)和至少两条与待检核酸序列特异互补的寡核苷酸引物,以及任选地与双链DNA结合的荧光染料或特异性荧光探针等。其后,用低密度的不易挥发物质(如石蜡油或者各种低熔点的蜡)覆盖于试剂表面或用管盖封闭反应管,以防止蒸发。
实施例2:应用实施例1的一种可控制液体环流路径的核酸扩增反应管进行的、以DNA为模板的扩增与检测
1、实验材料
化学试剂:SpeedSTAR HS DNA polymerase(TaKaRa),10×Fast Buffer I(Mg2+plus)(TaKaRa),dNTP(TaKaRa),DEPC水,石蜡油,6×DNA上样缓冲液(含Sybr Green)
仪器耗材:自制核酸扩增仪(参见申请CN201110456811.9);实施例1的一种可控制液体环流路径的核酸扩增反应管、凝胶电泳仪、凝胶成像仪(Bio-Rad)
引物:JxbUL54F1:GTGCGCCTTGACACTGTAC(SEQ ID NO.1)
JxbUL54R11:CGACAAGTACTTTGAGCAGG(SEQ ID NO.2)
检测模板1:CMV病毒DNA提取物,浓度为103copies/mL
检测模板2:DEPC水
2、实验方法:
(1)扩增试剂的配制:3.2mM dNTP,4μL 10×Fast Buffer I(Mg2+plus),1U SpeedSTAR HS DNA polymerase,0.4μL 10μM JxbUL54F1,0.4μL 10μM JxbUL54R11,5μl检测模板,总体积40μl,剩余体积用DEPC水补足。
(2)核酸扩增:a.将配制好的扩增试剂注入本发明的一种可控制液体环流路径的核酸扩增反应管,滴加10μl石蜡油,并通过离心、振动或其他方式,使扩增试剂充满反应容器;b.设置自制核酸扩增仪底部温度为95℃,上部温度为60℃,扩增时间设置为30分钟。将装有核酸扩增试剂的反应管插入核酸扩增仪中,开启程序,程序运行结束后取出反应管。
(3)扩增结果电泳检测:从反应管中取出5μl扩增产物,与1μl上样缓冲液混合后,使用3%的琼脂糖凝胶电泳检测扩增产物。
3、实验结果:如图4所示,泳道1与泳道2为阳性样本扩增结果,泳道3与泳道4为阴性对照(DEPC水)扩增结果。从结果中可以看出,本发明可实现以DNA为模板的扩增,阴性对照正常说明无非特异性扩增。
实施例3:应用实施例1的一种可控制液体环流路径的核酸扩增反应管进行的、以RNA为模板的扩增与检测
1、实验材料
化学试剂:SpeedSTAR HS DNA polymerase(TaKaRa),反转录酶MMLV(Transgen),10×Fast Buffer I(Mg2+plus)(TaKaRa),dNTP(TaKaRa),DEPC水,石蜡油,6×DNA上样缓冲液(含Sybr Green)
仪器耗材:自制核酸扩增仪(参见申请CN201110456811.9);实施例1的一种可控制液体环流路径的核酸扩增反应管、凝胶电泳仪、凝胶成像仪(Bio-Rad)
引物:CA16-WJ-F6-1:CAAGTAYTACCYACRGCTGCCAA(SEQ ID NO.3)
CA16-WJ-R6-1:CAACACACAYCTMGTCTCAATGAG(SEQ ID NO.4)
检测模板1:柯萨奇病毒A16型(CA16病毒)RNA提取物,浓度为103copies/mL
检测模板2:DEPC水
2、实验方法:
(1)扩增试剂的配制:
3.2mM dNTP,4μL 10×Fast Buffer I(Mg2+plus),1U SpeedSTAR HS DNA polymerase,0.4U MMLV,0.4μL 10μM JxbUL54F1,0.4μL 10μM JxbUL54R11,5μl检测模板,总体积40μl,剩余体积用DEPC水补足。
(2)核酸扩增:a.将配制好的扩增试剂注入本发明的一种可控制液体环流路径的核酸扩增反应管,滴加10μl石蜡油,并通过离心、振动或其他方式,使扩增试剂充满反应容器;b.仪器底部加热模块程序为60℃20分钟,95℃30分钟;仪器上部加热模块设置为恒温60℃,50分钟。将装有核酸扩增试剂的反应管插入仪器中,开启程序,程序运行结束后取出反应管。
(3)扩增结果电泳检测:从反应管中取出5μl扩增产物,与1μl上样缓冲液混合后,使用3%的琼脂糖凝胶电泳检测扩增产物。
3、实验结果:如图5所示,泳道1与泳道2为阳性样本扩增结果,泳道3与泳道4为阴性对照(DEPC水)扩增结果。从结果中可以看出,本发明可实现以RNA为模板的扩增,阴性对照正常说明无非特异性扩增。
实施例4:有、无环流控制功能反应管的扩增的均一性与特异性比较
1、实验材料
化学试剂:SpeedSTAR HS DNA polymerase(TaKaRa),10×Fast Buffer I(Mg2+plus)(TaKaRa),dNTP(TaKaRa),DEPC水,石 蜡油,6×DNA上样缓冲液(含Sybr Green)
仪器耗材:自制核酸扩增仪;实施例1的一种可控制液体环流路径的核酸扩增反应管、无环流控制功能的反应管(参见申请201110360350.5)、凝胶电泳仪、凝胶成像仪(Bio-Rad)
引物:JxbUL54F1:GTGCGCCTTGACACTGTAC(SEQ ID NO.1)
JxbUL54R11:CGACAAGTACTTTGAGCAGG(SEQ ID NO.2)
检测模板1:CMV病毒DNA提取物,浓度为103copies/mL
检测模板2:DEPC水
2、实验方法:
(1)扩增试剂的配制:3.2mM dNTP,4μL 10×Fast Buffer I(Mg2+plus),1U SpeedSTAR HS DNA polymerase,0.4μL 10μM JxbUL54F1,0.4μL 10μM JxbUL54R11,5μl检测模板,总体积40μl,剩余体积用DEPC水补足。
(2)核酸扩增:a.将配制好的扩增试剂分别注入本发明的一种可控制液体环流路径的核酸扩增反应管、及无环流控制功能的反应管,滴加10μl石蜡油,并通过离心、振动或其他方式,使扩增试剂充满反应容器;b.设置自制核酸扩增仪底部温度为95℃,上部温度为60℃,扩增时间设置为30分钟。将上述两种装有核酸扩增试剂的反应管插入仪器中,开启程序,程序运行结束后取出反应管。
(3)扩增结果电泳检测:从反应管中取出5μl扩增产物,与1μl上样缓冲液混合后,使用3%的琼脂糖凝胶电泳检测扩增产物。
3、实验结果:阳性扩增如图6泳道1-4所示,用本发明的一种可控制液体环流路径的核酸扩增反应管扩增的结果(图6a),4管条带的强度明显优于用无环流控制功能的反应容器扩增的结果(图6b)。阴性扩增如图6泳道5-8所示,用本发明的一种可通过控制液体环流路径实现PCR高效扩增的反应管扩增的结果(图6a),背景干净,没有引物二聚体等非特异性扩增,而用无环流控制功能的反应管扩增的结果(图6b),有明显的引物二聚体。上述结果说明本发明的一种控制液体自发环流路 径的反应管具有提高不同管间扩增的一致性与特异性的作用。
实施例5:有、无环流控制功能反应管的扩增效率比较
1、实验材料
化学试剂:SpeedSTAR HS DNA polymerase(TaKaRa),10×Fast Buffer I(Mg2+plus)(TaKaRa),dNTP(TaKaRa),DEPC水,石蜡油,6×DNA上样缓冲液(含Sybr Green)
仪器耗材:自制核酸扩增仪;实施例1的一种可控制液体环流路径的核酸扩增反应管、无环流控制功能的反应管(参见申请201110360350.5)、凝胶电泳仪、凝胶成像仪(Bio-Rad)
引物:JxbUL54F1:GTGCGCCTTGACACTGTAC(SEQ ID NO.1)
JxbUL54R11:CGACAAGTACTTTGAGCAGG(SEQ ID NO.2)
检测模板1:CMV病毒DNA提取模板,浓度为103copies/ml
检测模板2:DEPC水
2、实验方法:
(1)扩增试剂的配制:3.2mM dNTP,4μL 10×Fast Buffer I(Mg2+plus),1U SpeedSTAR HS DNA polymerase,0.4μL 10μM JxbUL54F1,0.4μL 10μM JxbUL54R11,5μl检测模板,总体积40μl,剩余体积用DEPC水补足。
(2)核酸扩增:a.将配制好的扩增试剂分别注入本发明的一种可控制液体环流路径的核酸扩增反应管、及无环流控制功能的反应管,滴加10μl石蜡油,并通过离心、振动或其他方式,使扩增试剂充满反应管;b.设置自制核酸扩增仪底部温度为95℃,上部温度为60℃,扩增时间分别设定为15分钟,20分钟,25分钟。将上述两种装有核酸扩增试剂的反应管插入仪器中,开启程序,程序运行结束后取出反应管。
(3)扩增结果电泳检测:从反应管中取出5μl扩增产物,与1μl上样缓冲液混合后,使用3%的琼脂糖凝胶电泳检测扩增产物。
3、实验结果:
应用本发明的一种可控制液体自发环流路径的核酸扩增反应管扩增的结果如图7a所示,应用无环流控制功能反应管扩增的结果如图7b所示。结果显示,应用本发明的扩增,在扩增20分钟后,阳性管即可观察到弱条带,在扩增25分钟后,阳性管即可观察到强条带;而应用无环流控制功能的反应管,则需扩增25分钟,阳性反应管才可观察到弱条带。该结果说明应用本发明相对于先前对流PCR方法可提高扩增的效率。
实施例6:有、无环流控制功能反应管的实时荧光检测比较
1、实验材料
化学试剂:SpeedSTAR HS DNA polymerase(TaKaRa),10×Fast Buffer I(Mg2+plus)(TaKaRa),dNTP(TaKaRa),DEPC水,石蜡油
仪器耗材:自制核酸扩增与实时荧光检测仪(参见申请CN201110456811.9);实施例1的一种可控制液体环流路径的核酸扩增反应管、无环流控制功能的反应管(参见申请201110360350.5)、
引物:JxbUL54F1:GTGCGCCTTGACACTGTAC(SEQ ID NO.1)
JxbUL54R11:CGACAAGTACTTTGAGCAGG(SEQ ID NO.2)
探针:JxbUL54P1:FAM-AGCCGGCTCCAAGTGCAAG-BHQ-1(SEQ ID NO.5)
检测模板1:CMV病毒DNA提取模板,浓度为106copies/ml
检测模板2:CMV病毒DNA提取模板,浓度为105copies/ml
检测模板3:DEPC水
2、实验方法:
(1)扩增试剂的配制:3.2mM dNTP,4μL 10×Fast Buffer I(Mg2+plus),1U SpeedSTAR HS DNA polymerase,0.4μL 10μM JxbUL54F1,0.4μL 10μM JxbUL54R11,0.2μL 10μM JxbUL54P1,5μl检测模板,总体积40μl,剩余体积用DEPC水补足。
(2)核酸扩增:a.将配制好的扩增试剂分别注入本发明的一种可控制液体环流路径的核酸扩增反应管、及无环流控制功能的反应管,滴加10μl石蜡油,并通过离心、振动或其他方式,使扩增试剂充满反应容器;b.设置自制核酸扩增仪底部温度为95℃,上部温度为60℃,扩增时间设定为30分钟。将上述两种装有核酸扩增试剂的反应管插入自制核酸扩增与实时荧光检测仪中,开启程序,程序运行结束后取出反应管,并分析数据。
3、实验结果:
应用本发明的一种可控制液体自发环流路径的反应管扩增的结果如图8a所示,应用无环流控制功能反应管扩增的结果如图8b所示。结果显示,应用本发明的扩增,其相同浓度样本扩增曲线的重复性明显优于无环流控制功能的反应管,从而提示应用本发明的一种可控制液体环流路径的核酸扩增反应管可进行核酸样本的定量检测。
尽管本发明的具体实施方式已经得到详细的描述,本领域技术人员将会理解。根据已经公开的所有教导,可以对那些细节进行各种修改和替换,这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
- 还没有人留言评论。精彩留言会获得点赞!