一种用于富集微生物的方法及其应用与流程
本发明属于生物技术领域,尤其涉及微生物培养检测中富集微生物的方法。
背景技术:
微生物污染一直以来都是食品污染以及水源污染的重要来源。我国每6.5人中就有1人患有食源性疾病,其中50%都是由食源性致病菌引起。食源性致病菌包括大肠杆菌、金黄色葡萄球菌、沙门氏菌以及单增李斯特菌等致病微生物已经成为危害严重的污染源。根据国家风险评估中心的报告显示,微生物污染的程度不亚于化学污染程度。
微生物污染的检测也越来越受到重视。由于微生物污染的特殊性,微生物污染尤其是食源性或者水源性致病菌的污染呈现微量但是危害重大的特性,致病菌的污染起始量很低,但是在合适条件下会迅速扩增,进而引起严重的后果。
目前对于微生物的检测有各种不同的检测手段,从依赖于免疫学的快检技术胶体金层析技术,酶联免疫吸附技术到依赖仪器的流式细胞仪技术,荧光定量PCR技术都有采用。最为经典的致病菌检测技术是培养法。根据食源性致病菌的国标检测方法GB04789.01-40-2008.培养法还是检测微生物,尤其是细菌的金标准。
目前微生物检测遇到的一个最大的困难还是在于微生物的含量太低,以食源性致病菌为例,食品中污染的沙门氏菌和金黄色葡萄球菌限量分别为1000PFU/g和 100PFU/g。也就是说每克食品中的沙门氏菌含量不超过1000个,而金黄色葡萄球菌不超过100个。 如此微量的微生物很难检出。因此无论是对于经典的培养法还是对于高灵敏的荧光定量PCR技术。极低的微生物含量都是微生物检测的限制因素。
为了解决微生物尤其是细菌含量太低无法检测的问题,目前常用的方法是培养法或者预增菌的方法。培养法通常为棉拭子沾取或者擦拭待检样本后在合适的培养基中培养。预增菌的方法通常为将样品粉碎后加入缓冲液洗涤溶解,然后取一部分溶液加入培养基,在合适的培养条件下培养。令细菌生长,在培养一段时间,通常为48小时到176小时。取出培养后的培养液用免疫学方法或者其它方法检测。
上述方法的缺点在于,如果用棉拭子擦取。只能取到样本中一部分的细菌作为培养材料。如果粉碎样品后加入缓冲液洗涤,再吸取一部分进行增菌培养。同样也只有很少一部分原始的细菌被取到。由于起始培养浓度太低因而严重的影响了增菌的时间和检出效果。
本发明充分的解决了这一问题,利用带有微生物特异性抗体的琼脂糖凝胶去吸附和捕获待检样本中的细菌。从而将样本中的细菌充分的富集到琼脂糖凝胶上。富集有待检细菌的琼脂糖凝胶就可以作为一个很好的培养材料或者检测材料。
为了收集吸附了待检细菌的琼脂糖凝胶,本发明还包含了一个微量离心柱。通过瞬时的离心,可以将待检样本中的液体去除,而留下富集了待检细菌的琼脂糖凝胶。这一离心柱可以几十倍的浓缩待检样本,从而提高了检出效率。
技术实现要素:
为了克服现有技术的不足,本发明的目的在于提供一个富集微生物的方法及相关应用。本发明包括一套偶联有特异性抗体的琼脂糖凝胶,离心柱组件,以及配套试剂。
该发明包含偶联有特异性抗体的琼脂糖凝胶、离心柱组件以及配套试剂。
本发明所描述的离心柱组件,其特征在于包含有离心柱和离心柱套管。
本发明所描述的离心柱组件,其特征在于离心柱柱管包括柱体、上盖、筛板和密封圈。
本发明所描述的离心柱,离心柱柱管材料包括但不限于聚丙烯,聚苯乙烯,高密度聚乙烯等。其中优选聚丙烯材料。
本发明所描述的离心柱筛板,其筛板材料包括但不限于聚丙烯,混合纤维或者超高分子量聚乙烯。其中优选超高分子量聚乙烯。
本发明所描述的离心柱筛板,其特征在于筛板孔径在1-200μm之间,其中优选5-100μm。
本发明所描述的密封圈,其特征在于密封圈外径与离心柱柱体内径一致,或稍大于柱体内径,以保证密封效果。
本发明所描述的离心柱上盖,其特征在于上盖与柱体连为一体,且上盖规格与柱体进液口相匹配。盖上上盖后不会有液体漏出。
本发明所描述的离心柱组件,离心柱套管的材质包括但不限于聚丙烯,聚苯乙烯,高密度聚乙烯等,其中优选聚丙烯。
本发明所描述的离心柱组件,离心柱套管的内径小于柱体最粗处的外径,以保证离心时,离心柱不会陷入离心柱套管内。
本发明所描述的偶联有抗体的琼脂糖凝胶,其特征在于抗体是针对待富集微生物的特异性抗体。
本发明所描述的抗体,其特征在于,抗体可以是单克隆抗体,也可以是多克隆抗体。
本发明所描述的偶联有抗体的琼脂糖凝胶,其特征在于琼脂糖凝胶可以是单体凝胶也可以是交联的琼脂糖凝胶。包括但不限于琼脂糖凝胶4B、6B、4FF以及6FF。
本发明所描述的偶联有抗体的琼脂糖凝胶,其特征在于抗体通过偶联连接到琼脂糖凝胶上。偶联方式可以是吸附、离子键以及共价偶联等业内常用的偶联方式。
本发明所描述的配套试剂,其特征在于试剂为富集缓冲液。富集缓冲液可以是磷酸缓冲液、中性的Tris缓冲液等常用的抗原抗体反应缓冲液。
本发明所描述的应用,其特征在于,该试剂盒可以从液体中富集微生物,包括细菌,真菌等。
本发明所描述的的应用,其特征在于,该试剂盒富集后的微生物可以用于培养、检测以及鉴定。
本发明所描述的富集微生物的方法,如果应用于富集液体样本中的微生物。其应用方式包括下面几个步骤:
a取一定量的待检液体样本,如5毫升;
b加入本发明所描述的偶联有特异性抗体的琼脂糖凝胶,例如,想检测水中的沙门氏菌感染,可以加入偶联有沙门氏菌抗体的琼脂糖凝胶。并充分混匀。在室温放置10分钟;
c将孵育过后的液体样本放入离心柱中,12000*g 5秒钟,离心去除液体;
d加入50ul的富集缓冲液将琼脂糖凝胶重悬;
e重悬后的琼脂糖凝胶可用于做增菌培养,也可以做检测。
本发明所描述的富集微生物的方法,如果应用于富集固体样本中的微生物。其应用方式包括下面几个步骤:
a取一定量的固体样本,如5g生鲜猪肉样本;
b将样本匀浆粉碎;
c加入富集缓冲液,如10毫升。充分混匀;
d将富集缓冲液倒入一无菌的干净离心管中;
e加入偶联有特异性抗体的琼脂糖凝胶,充分混匀,室温孵育10分钟;
f将孵育过后的液体样本放入离心柱中,12000*g 5秒钟,离心去除液体;
g加入50ul的富集缓冲液将琼脂糖凝胶重悬;
h重悬后的琼脂糖凝胶可用于做增菌培养,也可以做检测。
本发明的有益效果包括:
a在本发明中,包括偶联有特异性抗体的琼脂糖凝胶。特异性的抗体识别某一微生物。如带有沙门氏菌抗体的琼脂糖凝胶可以识别沙门氏菌。而带有大肠杆菌的琼脂糖凝胶可以识别大肠杆菌。在使用时,只需要根据拟富集的微生物选择合适的抗体偶联琼脂糖凝胶即可;
b在本发明中,包含了一个离心柱组件,离心柱中增加了一块筛板,筛板的孔径小于抗体偶联的琼脂糖凝胶颗粒的粒径。因此在离心的过程中。琼脂糖凝胶被截留在离心柱内部,而反应的废液或者洗涤液被离心分离;
c在本发明所描述的离心柱组件中包括一个离心管和一个套管,在反应结束离心的过程中,反应废液或者洗涤液被离心收集到外面的套管中,方便使用;
d本发明所描述的方法中,拟富集的微生物通过抗体和抗原的特异性识别,被吸附于琼脂糖凝胶中。形成一个高微生物密度的琼脂糖凝胶。利用此琼脂糖凝胶做增菌培养时,由于其起始浓度很高,可以大幅度缩短增菌时间。利用此琼脂糖凝胶做检测时,由于凝胶上的微生物浓度很高,因此可以大幅度提高检测灵敏度;
e本发明所描述的方法中,利用了带有特异性抗体的琼脂糖凝胶,此琼脂糖凝胶中吸附的微生物具有高特异性,在样本中的杂菌被分离出去。此琼脂糖凝胶如果用于培养,则由于没有杂菌的生长,目的微生物生长率高。如果用于检测,由于目的微生物浓度高,检测灵敏度更高。
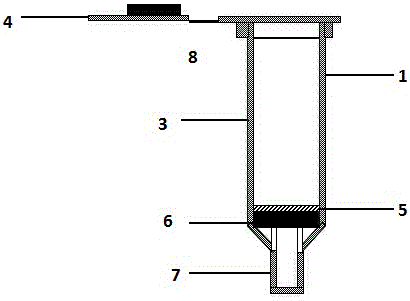
图1用于微生物富集的离心柱组件模式图图2 离心柱部件细节
图3 离心柱俯视图
图4 用本发明的离心柱进行微生物富集的模式图
图例
1.用于免疫沉淀的离心柱;
2.用于免疫沉淀的离心柱套管
3.离心柱柱体
4.离心柱上盖
5.离心柱密封圈
6.离心柱筛板
7.离心柱出液口
8.离心柱连接臂
9.进行抗体偶联琼脂糖-拟分离的微生物反应混合物
10.胶体金检测实验组
11.胶体金检测对照组。
本发明的具体实施方式
本发明所指的偶联有抗体的琼脂糖凝胶,抗体包括单克隆抗体或者多克隆抗体。其中琼脂糖凝胶可以是氨基修饰,羧基修饰,BrCN修饰,环氧基修饰等。可以通过通用的方式偶联到琼脂糖凝胶上;
本发明所指的用于免疫沉淀的离心柱组件包括一个离心柱1和配套的离心柱套管2,其中离心柱套管的内径小于离心柱的外径,保证离心时离心柱不会掉到套管中;
离心柱包括一个带有上盖4的离心柱柱体3,上盖通过一个连接臂9与柱体相连。离心柱内装有一块筛板6,筛板的孔径低于200μm,既保证反应废液能顺利的流出又防止琼脂糖凝胶漏过发生损失。筛板上方装有一个圆圈状的密封圈5,主要功能是密封筛板边缘,防止筛板在离心柱柱体内移动甚至掉出离心柱外。
实施例1 利用溴化氰活化的琼脂糖凝胶偶联单核细胞增生李斯特细菌抗体
【材料与试剂】
抗体:单核细胞增生性李斯特细菌的单克隆抗体;琼脂糖凝胶:溴化氰活化的琼脂糖凝胶4B(CNBr-Agarose 4B);偶联缓冲液:0.1M NaHCO3 0.5M NaCl pH8.3;封闭缓冲液:0.1M Tris .Cl PH8.0
【实验步骤】
CNBr-琼脂糖凝胶用纯化水洗涤3次;
抗体用偶联缓冲液配制成浓度为5mg/ml;
将CNBr-琼脂糖凝胶加入到抗体中,室温偶联2小时;
洗涤凝胶,加入封闭缓冲液,室温封闭2小时;
洗涤,将凝胶转移到玻璃试剂瓶中,用20%乙醇保存。
实施例2 利用本发明的方法富集污水中的单核细胞增生李斯特细菌
【材料与试剂】
污水来源:下水道污水;
琼脂糖凝胶:偶联有单核细胞增生性李斯特细菌的单克隆抗体的琼脂糖凝胶4B;
富集缓冲液: PBS缓冲液, NaCl 137mmol/L,KCl 2.7mmol/L,Na2HPO4 4.3mmol/L, KH2PO4 1.4mmol/L PH7.4;
离心柱 本发明所示的离心柱组件
【实验步骤】
a用注射器吸取污水水样5毫升放入一无菌的50毫升离心管中;
b在该离心管中加入500ul偶联有单核细胞增生李斯特细菌抗体的琼脂糖凝胶。混匀,室温孵育10分钟;
c将反应完后的污水样本吸入到本发明所示的离心柱中,12000*g 离心5秒钟;
d重复离心步骤,直至将所有污水样本去除;
e在离心柱中加入500ul富集缓冲液,洗涤琼脂糖凝胶。12000*g 离心5秒钟,去掉离心出来的液体;
f重复洗涤3次;
g加入500ul富集缓冲液,将琼脂糖凝胶重悬;
h将琼脂糖凝胶吸入到含有培养基的培养瓶中培养。
实施例3 用本发明的方法富集生鲜猪肉样本上的单核细胞增生李斯特菌
【材料与试剂】
样本来源:
生鲜猪肉 来源于某菜市场
琼脂糖凝胶:单增李斯特菌单克隆抗体偶联的琼脂糖凝胶4B
富集缓冲液: PBS缓冲液, NaCl 137mmol/L,KCl 2.7mmol/L,Na2HPO4 4.3mmol/L, KH2PO4 1.4mmol/L PH7.4
离心柱: 本发明所示的免疫沉淀离心柱组件
【实验操作】
a准确称取1g生鲜猪肉,取样时验证暴露在空气中的鲜肉表面取样。禁止全部切除表面,单独从内部取样;
b用无菌的研钵将样本磨碎,加入5ml富集缓冲液充分洗涤;
c将磨碎的样本及洗涤液一起全部转入无菌的离心管中,5000*g离心10分钟。将上清液转入另一个无菌管中;
d在装有上清的无菌管中加入500ul偶联有单增李斯特菌单抗的琼脂糖凝胶4B。充分混匀后,室温放置10分钟。期间混匀3-5次;
e将离心管中的液体全部分次转入本发明所示的离心柱中,12000*g,离心5秒钟。每次离心得到的琼脂糖凝胶用500ul富集缓冲液重悬;
f重悬后的富集有单增李斯特菌的琼脂糖凝胶转入一个无菌管中;
g富集后的琼脂糖凝胶可以用于细菌培养,也可以用于检测。
实施例4用本发明的方法富集单核细胞增生李斯特菌后做细菌培养以及与传统培养方法的比较
【目的】
用本发明方法富集单核细胞增生李斯特菌,并比较使用本发明方法与传统培养法的培养效果
【材料与试剂】
细菌:单核细胞增生李斯特菌CMCC 54003 (Listeria monocytogenesCMCC 54003)
培养基:TSA-YE培养基,含0.6% 酵母浸膏的胰酪胨大豆琼脂
,TSB-YE培养基:含0.6% 酵母浸膏的胰酪胨大豆肉汤
琼脂糖凝胶:单核细胞增生李斯特菌偶联的琼脂糖凝胶4B
富集缓冲液:磷酸盐缓冲液 PBS缓冲液, NaCl 137mmol/L,KCl 2.7mmol/L,Na2HPO4 4.3mmol/L, KH2PO4 1.4mmol/L PH7.4
离心柱组件: 本发明所示的离心柱组件
【实验操作】
a用接种环挑取单增李斯特细菌菌种CMCC54003至TSB-YE培养基,37℃震荡培养至菌浓度达1×108 CFU/ml,作为菌悬液备用;
b将菌悬液稀释至1×105 CFU/ml,取2份各10毫升菌悬液作为试验用;
c对照组,吸取500ul菌悬液作为菌种,加入100ml TSB-YE培养基,37℃震荡过夜培养;
实验组在10毫升菌悬液中加入500ul偶联有单增李斯特菌抗体的琼脂糖凝胶,室温孵育10分钟;
d将孵育后的悬液转入本发明的离心柱中,12000*g离心5秒钟,丢弃滤过液;
e将所有琼脂糖凝胶用500ul富集缓冲液重悬,全部加入100ml TSB-YE培养基,37℃震荡过夜培养;
f过夜培养后的实验组与对照组检测其菌落浓度
【实验结果】
对照组培养后菌落浓度为1×1010 CFU/ml,实验组菌落浓度为1×108CFU/ml
【实验结论】
应用本方法富集细菌后,可以提供更高的细菌培养起始量,在相同条件下能够培养得到更多的待检细菌。
实施例4 利用本发明的方法富集样本中的单增李斯特菌后
用胶体金层析方法检测
【目的】
实验本发明的方法富集目的细菌后检测的可行性
【材料与试剂】
细菌:单核细胞增生李斯特菌CMCC 54003 (Listeria monocytogenesCMCC 54003)
培养基: TSB-YE培养基:含0.6% 酵母浸膏的胰酪胨大豆肉汤
琼脂糖凝胶:单核细胞增生李斯特菌偶联的琼脂糖凝胶4B
抗体:抗单增李斯特细菌的多克隆抗体(检测线),羊抗鼠二抗(质控线)
胶体金标记抗体:胶体金标记的鼠IgG抗体,胶体金标记的抗单增李斯特细菌单抗
富集缓冲液:磷酸盐缓冲液 PBS缓冲液, NaCl 137mmol/L,KCl 2.7mmol/L,Na2HPO4 4.3mmol/L, KH2PO4 1.4mmol/L PH7.4
离心柱组件: 本发明所示的离心柱组件
【实验步骤】
a用胶体金标记单增李斯特细菌的单克隆抗体和鼠IgG抗体,其中金标的李斯特抗体作为检测系统,与待检样本反应。金标的鼠IgG抗体作为质控系统,监控检测过程的可靠性;
b试纸条的组装是在聚氯乙烯(PVC)板上顺次相互搭接样品垫、硝酸纤维素包被膜和吸水纸,然后用切条机切割成4 mm 宽的试纸条。包被膜上用喷膜机喷一定浓度的抗单增李斯特菌多克隆抗体和羊抗鼠二抗分别作为检测线(T线)和质控线(C 线);
c用接种环挑取单增李斯特细菌菌种CMCC54003至TSB-YE培养基,37℃震荡培养至菌浓度达1×108 CFU/ml,作为菌悬液备用;
d将菌悬液稀释至1×106 CFU/ml,取2份各5毫升菌悬液作为试验用;
e 实验组在5毫升菌悬液中加入100ul偶联有单增李斯特菌抗体的琼脂糖凝胶,室温孵育10分钟;
f将孵育后的悬液转入本发明的离心柱中,12000*g离心5秒钟,丢弃滤过液;
g将所有琼脂糖凝胶用100ul富集缓冲液重悬,加入胶体金检测卡的样品垫上;
h对照组直接吸取100ul菌液加入到胶体金检测卡的样品垫上;
i 室温反应10分钟,观察检测结果;
【实验结果】
如图5所示
【实验结论】
用本发明所示方法富集的细菌能用于后续的检测。
- 还没有人留言评论。精彩留言会获得点赞!