一种(甲基)丙烯酸4‑苯基苄基酯的制备方法与流程
本发明属于化学合成
技术领域:
,涉及一种光固化树脂合成工艺,具体涉及一种(甲基)丙烯酸4-苯基苄基酯的制备方法。
背景技术:
:近年来,液晶显示器(Liquidcrystaldisplay,LCD)广泛应用于液晶电视、笔记本电脑、平板终端、智能手机等各个领域。液晶面板本身并不发光,通常需要在液晶面板背面设置背光模组,以提供画面显示所需要的光线。背光模组的功能在于供应充足亮度与分布均匀的光源,使其能正常显示影像。棱镜片也称增亮膜,将其组装在背光源前面,将光源发出的光,向显示设备使用者聚集,可很大程度提高正面亮度,而且视角外未被利用的光,根据光的再反射效应被循环利用,并以适当的角度向使用者聚集。制造棱镜片需要用高折射率、高透光率和低粘度的光固化树脂体系。目前,现有的技术制备的高折射率树脂的粘度都较大。近年来,含有芴骨架的树脂已成为众所周知的高折率的树脂,例如含有芴骨架的二丙烯酸酯化物等,但是这一类材料的粘度很大,有些常温下甚至为固体,在使用时,需要添加大量的活性稀释剂来降低粘度,而大量的活性稀释剂又会使树脂体系的折射率大大下降。目前,邻苯基苯氧乙基丙烯酸酯(OPPEA)是制备棱镜片常用的高折射率、低粘度的活性稀释剂,折射率为1.575-1.576,粘度为140-150cps。但是,OPPEA的加入量较少时,并不能充分的稀释含有芴骨架的二丙烯酸酯化物,加入量较大时又会大大降低折射率。因此需要折射率更高、粘度比OPPEA更低的活性稀释剂。研究发现,(甲基)丙烯酸苯基苄基酯具有较高的折射率和很低的粘度,既可以提供较高的折射率,又可以充分的稀释含有芴骨架的二丙烯酸酯化物。其中,又以(甲基)丙烯酸4-苯基苄基酯的折射率最高,具有广泛的应用前景。申请号201280010056.4的专利提出两种(甲基)丙烯酸苯基苄基酯的制备方法,第一种是通过卤代甲基联苯与(甲基)丙烯酸的钾、钠等金属盐反应得到(甲基)丙烯酸苯基苄基酯,但是该方法使用的原料卤代甲基联苯价格昂贵,生产成本很高。第二种方法是酰氯酯化法,以苯基苄醇与丙烯酰氯为原料,用三乙胺做缚酸剂,酯化得到(甲基)丙烯酸苯基苄基酯,但是该方法在反应中产生大量的黄色的三乙胺盐酸盐,粘附在反应釜壁上,需要大量的水洗涤,产生大量的废水,污染环境,而且后处理复杂,需要多次中和、洗涤,得到的产品的产率较低,产品往往为棕色或橙色,产品色度深,需要进一步过柱子纯化,无法工业化生产;而且三乙胺易挥发、在空气中微发烟、易燃易爆,有刺激性气味、危害健康、价格较贵,很多公司已限制三乙胺的使用。也有研究报道,在酰氯酯化法中采用固体无机碱做缚酸剂,如固体碳酸钾或固体碳酸钠,可以得到颜色较浅的产物。但通过实验表明,碳酸钾和碳酸钠属于无机物颗粒,在反应液中不能很好的与有机相混溶,因此缚酸效果很差,导致反应不能顺利进行,得到的产物的纯度很低。以上所述方法中,采用价格昂贵的原料或采用有毒有害的三乙胺为缚酸剂或采用固体无机碱做缚酸剂,所得产物颜色较深、后处理复杂、环境污染严重且产品纯度和产率均较低。技术实现要素:本发明的主要目的在于克服现有技术的不足,提供了一种(甲基)丙烯酸4-苯基苄基酯的制备方法。该方法工艺简单,反应条件温和,经济环保,且所制备的产物颜色浅、纯度和收率均较高,易于工业生产。为了实现上述目的,本发明采用如下技术方案:一种(甲基)丙烯酸4-苯基苄基酯的制备方法,包括如下步骤:1)将4-苯基苄醇、有机溶剂、相转移催化剂混合均匀,滴加(甲基)丙烯酰氯和第一阻聚剂的混合溶解液,反应得到中间产物;2)在步骤1)所得中间产物中滴加缚酸剂无机碱溶液,继续催化反应,得到反应产物溶液;3)将反应产物溶液依次进行水洗、盐洗、脱溶、过滤,得到(甲基)丙烯酸4-苯基苄基酯。进一步地,步骤1)中滴加混合溶解液的温度为0~10℃,滴加时间为1~3h;滴加完毕后反应温度为20~30℃,反应时间为1~3h。进一步地,步骤1)中的(甲基)丙烯酰氯与4-苯基苄醇的摩尔比为2:1~1:1;有机溶剂的用量是4-苯基苄醇质量的1~5倍;相转移催化剂的用量为4-苯基苄醇与(甲基)丙烯酰氯质量总和的10~20%;第一阻聚剂的用量为(甲基)丙烯酰氯质量的1.0~3.0%。进一步地,步骤1)中有机溶剂为甲苯、丙酮、4-甲基-2-戊酮、二氯甲烷中的任意一种。进一步地,步骤1)中相转移催化剂为季铵盐类化合物。进一步地,步骤1)中第一阻聚剂为对羟基苯甲醚、2,6-二叔丁基对甲酚中的任意一种。进一步地,步骤2)中缚酸剂无机碱溶液的滴加时间为0.5~1h,继续催化反应的温度为60~80℃,反应时间为1~3h。进一步地,步骤2)中缚酸剂无机碱溶液与(甲基)丙烯酰氯等摩尔比。进一步地,步骤2)中缚酸剂无机碱溶液为质量分数20~50%碳酸钾溶液、质量分数20~50%碳酸钠溶液、质量分数20~50%氢氧化钠溶液中的任意一种。进一步地,步骤3)将反应产物溶液水洗、盐洗后,还包括将盐洗后的反应产物溶液与第二阻聚剂混合,负压条件下脱出盐洗后的反应产物溶液中的有机溶剂。进一步地,第二阻聚剂为对羟基苯甲醚、2,6-二叔丁基对甲酚中的任意一种。进一步地,第二阻聚剂的用量为(甲基)丙烯酸4-苯基苄基酯质量的0.5~1.0%。与现有技术相比,本发明具有如下有益效果:1、本发明提供的制备方法,在4-苯基苄醇和(甲基)丙烯酰氯的酯化反应中,不使用三乙胺等有毒、有臭味的、价格较贵的有机碱,而是采用价格便宜而且无毒、无气味的无机碱溶液做缚酸剂,反应过程中不会产生大量的三乙胺盐酸盐,制备方法经济、清洁、环保,后处理简单,只需经过简单的水洗和盐洗,产生的废水少,对环境的污染小,而且不需要过柱子纯化就可以得到淡黄色的(甲基)丙烯酸4-苯基苄基酯,产品的颜色浅。2、本发明采用无机碱的水溶液做缚酸剂,解决了固体无机碱与有机相相容性差、缚酸效果较差的问题,并使用季铵盐类做相转移催化剂,促进反应进行,可以得到高纯度的(甲基)丙烯酸4-苯基苄基酯。3、本发明采用两步法反应,先让4-苯基苄醇和(甲基)丙烯酰氯在相转移催化剂的作用下反应一段时间生成中间产物,然后再加入缚酸剂无机碱溶液,生成(甲基)丙烯酸4-苯基苄基酯。可以避免一步法制备过程中酰氯与无机碱水溶液中的水反应,因而可以促进反应的进行,同时减少了酰氯的用量,节约了成本,所得产物纯度和产率均在90%以上。附图说明图1为本发明实施例1制备得到的丙烯酸4-苯基苄基酯的红外谱图;图2为本发明实施例1制备得到的丙烯酸4-苯基苄基酯的1H-NMR谱图;图3为本发明实施例1制备得到的丙烯酸4-苯基苄基酯的HPLC谱图;图4为本发明实施例2制备得到的丙烯酸4-苯基苄基酯的HPLC谱图;图5为本发明实施例3制备得到的丙烯酸4-苯基苄基酯的HPLC谱图;图6为本发明实施例4制备得到的丙烯酸4-苯基苄基酯的HPLC谱图;图7为本发明实施例5制备得到的甲基丙烯酸4-苯基苄基酯的HPLC谱图;图8为本发明对比例1制备得到的丙烯酸4-苯基苄基酯的HPLC谱图;图9为本发明对比例2制备得到的丙烯酸4-苯基苄基酯的HPLC谱图;图10为本发明对比例3制备得到的丙烯酸4-苯基苄基酯的HPLC谱图。具体实施方式为了使本
技术领域:
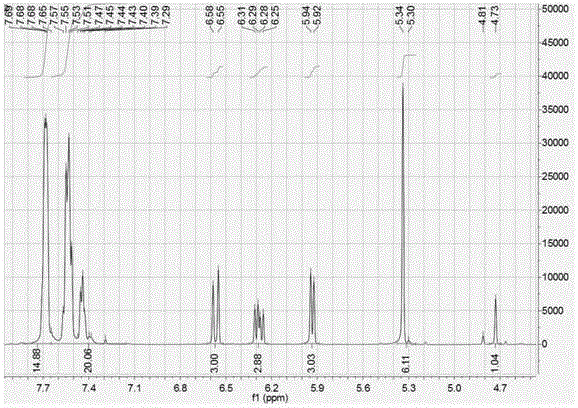
的人员更好地理解本发明方案,并使本发明的上述优点能够更加明显易懂,下面将结合具体实施例对本发明作进一步详细说明。本发明提出了一种(甲基)丙烯酸4-苯基苄基酯的制备方法,采用两步法反应,先让4-苯基苄醇和(甲基)丙烯酰氯在相转移催化剂的作用下反应一段时间,然后再加入缚酸剂无机碱溶液,促使生成(甲基)丙烯酸4-苯基苄基酯。具体包括如下步骤:1)将4-苯基苄醇、有机溶剂、相转移催化剂混合均匀,滴加(甲基)丙烯酰氯和第一阻聚剂的混合溶解液,反应得到中间产物;2)在步骤1)所得中间产物中滴加缚酸剂无机碱溶液,继续催化反应,得到反应产物溶液;3)将反应产物溶液依次进行水洗、盐洗、脱溶、过滤,得到(甲基)丙烯酸4-苯基苄基酯。在本发明的实施例中,步骤1)在反应釜中,加入4-苯基苄醇、有机溶剂、相转移催化剂,开动搅拌,使其溶解,得到淡黄色透明溶液,然后将反应釜置于0~10℃冰水浴中。将(甲基)丙烯酰氯、第一阻聚剂的混合溶解液在1~3h内缓慢滴入反应釜中,待混合溶解液滴加完毕后,移去冰水浴,将反应釜置于20~30℃温水浴中继续反应1~3h。上述步骤中,(甲基)丙烯酰氯与4-苯基苄醇的摩尔比为2:1~1:1,优选为1.5:1~1.2:1;有机溶剂的用量为4-苯基苄醇质量的1~5倍,优选为2~3倍;相转移催化剂的用量为4-苯基苄醇与(甲基)丙烯酰氯质量总和的10~20%;第一阻聚剂用量为(甲基)丙烯酰氯质量的1.0~3.0%,优选为2.0~3.0%。所述的相转移催化剂为季铵盐类化合物,例如可以是四丁基溴化铵,四甲基溴化铵、苄基三乙基氯化铵中的任意一种。在本发明的实施例中,步骤2)中将缚酸剂无机碱溶液在0.5~1h内滴加到反应釜中,滴加完后升温至60~80℃,继续反应1~3h,得到反应产物溶液。本发明的实施例中,步骤3)中的水洗可以采用去离子水,搅拌时间为10~20min,水洗结束后静置1~3h,放出下层废水。其中,去离子水的加入量可以为反应产物溶液总质量的10~30%。然后再向水洗釜中加入质量分数10%的盐溶液进行盐洗,搅拌10~20min后静置1~3h,放出下层废水。所采用的盐溶液可以为质量分数10%的氯化钠溶液、质量分数10%的氯化钾溶液、质量分数10%的硫酸铵溶液中的任意一种,所述盐溶液的加入量为反应产物溶液总质量的10~30%。本发明的优选实施例中,步骤3)中将反应产物溶液水洗、盐洗后,还包括将盐洗后的反应产物溶液与第二阻聚剂混合,负压条件下脱出盐洗后的反应产物溶液中的有机溶剂。上述第二阻聚剂为对羟基苯甲醚、2,6-二叔丁基对甲酚中的任意一种,第二阻聚剂的用量为(甲基)丙烯酸4-苯基苄基酯的0.5~1.0%,优选为0.5~0.8%。负压条件下脱溶剂时的温度为60~80℃,直至有机溶剂的含量小于500ppm,然后过滤得到淡黄色透明的(甲基)丙烯酸4-苯基苄基酯。以下将结合实施例和对比例,进一步说明本发明的有益效果。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例1在反应釜中,加入184g4-苯基苄醇、350g甲苯、29.2g四丁基溴化铵,开动搅拌,使其溶解,得到淡黄色透明溶液,将反应釜置于0-10℃冰水浴中。将108.6g丙烯酰氯、1g对羟基苯甲醚的混合溶解液在1.5h内缓慢滴入反应釜中,待混合溶解液滴加完毕后,移去冰水浴,将反应釜置于25℃温水浴中继续反应2h。然后在1h内滴加350g40%的碳酸钾溶液,滴加完后升温至60℃,继续反应2h,得到反应产物溶液。将反应产物溶液倒入水洗釜中,加入200g去离子水,搅拌10min后静置1h,放出下层废水。再加入200g质量分数10%的氯化钠溶液,搅拌10min后静置1h,放出下层废水。将水洗后的反应产物溶液转移到反应釜中,加入0.2g对羟基苯甲醚,控制温度为65℃,减压脱除带水剂,直至带水剂的含量小于500ppm,然后过滤得到淡黄色透明的丙烯酸4-苯基苄基酯。对实施例1的产品进行红外光谱测试,结果如图1所示,由图1可知,1633cm-1为C=C双键伸缩振动吸收峰,3032cm-1、1404cm-1、983cm-1、810cm-1为不饱和C-H键的弯曲振动吸收峰,2954cm-1是亚甲基的伸缩振动吸收峰,1714cm-1为C=O双键的振动吸收峰,以上几个吸收峰说明产物中酯键和C=C双键的存在;3670~3200cm-1附近出现的很小的吸收峰是OH峰,是少量没反应完的原料;1602cm-1、1580cm-1、1489cm-1、1450cm-1这四个峰是芳环的骨架伸缩振动吸收峰,证明了苯环的存在,因此本发明实施例1制备的产品为丙烯酸4-苯基苄基酯。图2为实施例1制备得到的丙烯酸4-苯基苄基酯的1H-NMR谱图,测试结果如下:1HNMR(500MHz,CDCl3)δ7.67(dd,J=12.3,9.1Hz,15H),7.65–7.16(m,20H),6.57(d,J=17.3Hz,3H),6.28(dd,J=17.2,10.5Hz,3H),5.93(d,J=10.4Hz,3H),5.32(d,J=18.5Hz,6H),4.73(s,1H),进一步说明实施例1制备的产品为丙烯酸4-苯基苄基酯。图3为本发明实施例1提供的方法制备得到的丙烯酸4-苯基苄基酯的液相色谱图,保留时间1.722min处是原料4-苯基苄醇的的峰,保留时间3.278min处是产物丙烯酸4-苯基苄基酯的峰。实施例2在反应釜中,加入184g4-苯基苄醇、400g4-甲基-2-戊酮、58.5g四甲基溴化铵,开动搅拌,使其溶解,得到淡黄色透明溶液,然后将反应釜置于0-10℃冰水浴中。将135.7g丙烯酰氯、1g对羟基苯甲醚的混合溶解液在1.5h内缓慢滴入反应釜中,待混合溶解液滴加完毕后,移去冰水浴,将反应釜置于40℃温水浴中继续反应2h。然后在1h内滴加450g20%的氢氧化钠溶液,滴加完后升温至70℃,继续反应2h,得到反应产物溶液。将反应产物溶液倒入水洗釜中,加入250g去离子水,搅拌10min后静置1h,放出下层废水。再加入200g质量分数10%的氯化钾溶液,搅拌10min后静置1h,放出下层废水。将水洗后的反应产物溶液转移到反应釜中,加入0.2g2,6-二叔丁基对甲酚,控制温度为75℃,减压脱除带水剂,直至带水剂的含量小于500ppm,然后过滤得到淡黄色透明的丙烯酸4-苯基苄基酯。图4为本发明实施例2提供的方法制备得到的丙烯酸4-苯基苄基酯的液相色谱图,保留时间1.717min处是原料4-苯基苄醇的的峰,保留时间3.267min处是产物丙烯酸4-苯基苄基酯的峰。实施例3在反应釜中,加入184g4-苯基苄醇、500g甲苯、58.5g苄基三乙基氯化铵,开动搅拌,使其溶解,得到淡黄色透明溶液,然后将反应釜置于0-10℃冰水浴中。将117.6g丙烯酰氯、1g对羟基苯甲醚的混合溶解液在1.5h内缓慢滴入反应釜中,待混合溶解液滴加完毕后,移去冰水浴,将反应釜置于40℃温水浴中继续反应2h。然后在1h内滴加400g40%的碳酸钠溶液,滴加完后升温至80℃,继续反应2h,得到反应产物溶液。将反应产物溶液倒入水洗釜中,加入200g去离子水,搅拌10min后静置1h,放出下层废水。再加入200g质量分数10%的氯化钾溶液,搅拌10min后静置1h,放出下层废水。将水洗后的反应产物溶液转移到反应釜中,加入0.2g对羟基苯甲醚,控制温度为65℃,减压脱除带水剂,直至带水剂的含量小于500ppm,然后过滤得到淡黄色透明的丙烯酸4-苯基苄基酯。图5为本发明实施例3提供的方法制备得到的丙烯酸4-苯基苄基酯的液相色谱图,保留时间1.778min处是原料4-苯基苄醇的的峰,保留时间3.465min处是产物丙烯酸4-苯基苄基酯的峰。实施例4在反应釜中,加入184g4-苯基苄醇、400g4-甲基-2-戊酮、29.2g四丁基溴化铵,开动搅拌,使其溶解,得到淡黄色透明溶液,然后将反应釜置于0-10℃冰水浴中。将126.7g丙烯酰氯、1g4,6-二叔丁基对甲酚的混合溶解液在1.5h内缓慢滴入反应釜中,待混合溶解液滴加完毕后,移去冰水浴,将反应釜置于30℃温水浴中继续反应2h。然后在1h内滴加500g25%的碳酸钾溶液,滴加完后升温至65℃,继续反应2h,得到反应产物溶液。将反应产物溶液倒入水洗釜中,加入250g去离子水,搅拌10min后静置1h,放出下层废水。再加入200g质量分数10%的硫酸铵溶液,搅拌10min后静置1h,放出下层废水。将水洗后的反应产物溶液转移到反应釜中,加入0.2g4,6-二叔丁基对甲酚,控制温度为70℃,减压脱除带水剂,直至带水剂的含量小于500ppm,然后过滤得到淡黄色透明的丙烯酸4-苯基苄基酯。图6为本发明实施例4提供的方法制备得到的丙烯酸4-苯基苄基酯的液相色谱图,保留时间1.800min处是原料4-苯基苄醇的的峰,保留时间3.529min处是产物丙烯酸4-苯基苄基酯的峰。实施例5在反应釜中,加入184g4-苯基苄醇、380g4-甲基-2-戊酮、58.5g四甲基溴化铵,开动搅拌,使其溶解,得到淡黄色透明溶液,然后将反应釜置于0-10℃冰水浴中。将154g甲基丙烯酰氯、1g对羟基苯甲醚的混合溶解液在1.5h内缓慢滴入反应釜中,待混合溶解液滴加完毕后,移去冰水浴,将反应釜置于40℃温水浴中继续反应2h。然后在1h内滴加450g20%的氢氧化钠溶液,滴加完后升温至65℃,继续反应2h,得到反应产物溶液。将反应产物溶液倒入水洗釜中,加入250g去离子水,搅拌10min后静置1h,放出下层废水。再加入200g质量分数10%的氯化钾溶液,搅拌10min后静置1h,放出下层废水。将水洗后的反应产物溶液转移到反应釜中,加入0.2g对羟基苯甲醚,控制温度为80℃,减压脱除带水剂,直至带水剂的含量小于500ppm,然后过滤得到淡黄色透明的甲基丙烯酸4-苯基苄基酯。图7为本发明实施例5提供的方法制备得到的甲基丙烯酸4-苯基苄基酯的液相色谱图,保留时间1.720min处是原料4-苯基苄醇的的峰,保留时间3.271min处是产物甲基丙烯酸4-苯基苄基酯的峰。对比例1在反应釜中,加入184g4-苯基苄醇、350g甲苯、202g三乙胺,开动搅拌,使其溶解,得到淡黄色透明溶液,然后将反应釜置于0-10℃冰水浴中。将181g丙烯酰氯、1g对羟基苯甲醚的混合溶解液在1.5h内缓慢滴入反应釜中,待混合溶解液滴加完毕后,移去冰水浴,将反应釜置于25℃温水浴中继续反应4h,得到反应产物溶液。将反应产物溶液倒入水洗釜中,加入400g去离子水搅拌10min后静置1h,放出下层废水,再加入200g去离子水搅拌10min后静置1h,放出下层废水,最后加入200g质量分数10%的氯化钠溶液,搅拌10min后静置1h,放出下层废水。将水洗后的反应产物溶液转移到反应釜中,加入0.2g对羟基苯甲醚,控制温度为65℃,减压脱除带水剂,直至带水剂的含量小于500ppm,然后过滤得到深黄褐色透明的丙烯酸4-苯基苄基酯。图8为本发明对比例1提供的方法制备得到的丙烯酸4-苯基苄基酯的液相色谱图,保留时间1.760min处是原料4-苯基苄醇的的峰,保留时间3.391min处是产物丙烯酸4-苯基苄基酯的峰。对比例2在反应釜中,加入184g4-苯基苄醇、350g甲苯、276g粉末碳酸钾,开动搅拌,然后将反应釜置于0-10℃冰水浴中。将181g丙烯酰氯、1g对羟基苯甲醚的混合溶解液在1.5h内缓慢滴入反应釜中,待混合溶解液滴加完毕后,移去冰水浴,将反应釜置于25℃温水浴中继续反应4h,得到反应产物溶液。将反应产物溶液倒入水洗釜中,加入400g去离子水搅拌10min后静置1h,放出下层废水,再加入200g质量分数10%的氯化钠溶液,搅拌10min后静置1h,放出下层废水。将水洗后的反应产物溶液转移到反应釜中,加入0.2g对羟基苯甲醚,控制温度为65℃,减压脱除带水剂,直至带水剂的含量小于500ppm,然后过滤得到淡黄色透明的丙烯酸4-苯基苄基酯。图9为本发明对比例2提供的方法制备得到的丙烯酸4-苯基苄基酯的液相色谱图,保留时间1.744min处是原料4-苯基苄醇的的峰,保留时间3.344min处是产物丙烯酸4-苯基苄基酯的峰。对比例3在反应釜中,加入184g4-苯基苄醇、350g甲苯、29.2g四丁基溴化铵,350g40%碳酸钾水溶液,开动搅拌,然后将反应釜置于0-10℃冰水浴中。将181g丙烯酰氯、1g对羟基苯甲醚的混合溶解液在1.5h内缓慢滴入反应釜中,待混合溶解液滴加完毕后,移去冰水浴,将反应釜置于25℃温水浴中继续反应6h,得到反应产物溶液。将反应产物溶液倒入水洗釜中,加入400g去离子水搅拌10min后静置1h,放出下层废水,再加入200g质量分数10%的氯化钠溶液,搅拌10min后静置1h,放出下层废水。将水洗后的反应产物溶液转移到反应釜中,加入0.2g对羟基苯甲醚,控制温度为65℃,减压脱除带水剂,直至带水剂的含量小于500ppm,然后过滤得到淡黄色透明的丙烯酸4-苯基苄基酯。图10为本发明对比例3提供的方法制备得到的丙烯酸4-苯基苄基酯的液相色谱图,保留时间1.687min处是原料4-苯基苄醇的的峰,保留时间3.161min处是产物丙烯酸4-苯基苄基酯的峰。将本发明实施例制备的产物进行红外光谱测试(厂家:岛津,型号:IRTracer-100)和核磁共振氢谱测试(厂家:Bruker,型号:AVANCEIII),根据测试结果可知,本发明提供的方法能够制备得到(甲基)丙烯酸4-苯基苄基酯。将本发明实施例和对比例制备的产物进行测试,采用目视法测试外观,采用阿贝折光仪在25℃条件下测试其折射率,采用椎板粘度计(厂家:BROOKFIELD,型号:DV-II+Pro,测试条件:25℃)测试其粘度,采用高效液相色谱仪(厂家:Agilent,型号:1260)测试纯度,按照实际产量与理论产量的比值计算其产率,所测试结果如表1所示:表1本发明各实施例和对比例提供的方法制备得到的(甲基)丙烯酸4-苯基苄基酯的外观、折射率、粘度、纯度和产率的测试结果外观折射率(25℃)粘度/cps(25℃)纯度产率实施例1浅黄透明1.5922594.2%95%实施例2浅黄透明1.5922792.1%93%实施例3浅黄透明1.5922792.5%96%实施例4浅黄透明1.5922491.2%93%实施例5浅黄透明1.5912091.5%93%对比例1深黄褐色透明1.5922583.7%82%对比例2浅黄透明1.5963056.9%91%对比例3浅黄透明1.5942681.5%89%由表1可知,实施例1~5采用无机碱溶液做缚酸剂,制备的(甲基)丙烯酸4-苯基苄基酯的色度低,纯度和产率较高,均在90%以上。对比例1采用三乙胺做缚酸剂,得到的丙烯酸4-苯基苄基酯的颜色很深,为深黄褐色,而且纯度和产率稍低,这是由于后处理过程中,经过多次洗涤,带走了较多的产品。而对比例2采用固体碳酸钾做缚酸剂,得到的丙烯酸4-苯基苄基酯的纯度非常低,只有56.9%,说明还有大量的原料未反应,大量的原料存在导致产品的折射率偏高。对比例3采用无机碱溶液做缚酸剂,一步法反应,得到的丙烯酸4-苯基苄基酯的纯度和产率较低,这是由于反应开始后,丙烯酰氯与无机碱溶液中的水反应,丙烯酰氯的量减少,导致反应变慢,反应不完全。由上描述可知,本发明提供了一种(甲基)丙烯酸4-苯基苄基酯的制备方法,采用两步法反应,无机碱溶液为缚酸剂,不仅可以得到高纯度、高产率的(甲基)丙烯酸4-苯基苄基酯,产品的色度低,不需要过柱子纯化,而且后处理工艺简单,产生的废水少,对环境的污染较小。需要注意的是,具体实施方式仅仅是对本发明技术方案的解释说明,不应将其理解为对本发明技术方案的限定,任何采用本发明实质
发明内容而仅作局部改变的,仍应落入本发明的保护范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1