扫描实时微流体热循环仪和用于同步的热循环和扫描光学检测的方法与流程
相关申请的交叉引用本申请要求2011年4月15日提交的名称为“使热循环和扫描光学检测同步的软件控制过程”的共同未决的美国临时专利申请系列号61/476,175和2011年4月15日提交的名称为“6色扫描实时微流体(microfluidic)热循环仪”的共同未决的美国临时专利申请系列号61/476,167的35U.S.C.章节119(e)下的权益,其申请以其全部通过引用被并入本文。
技术领域:
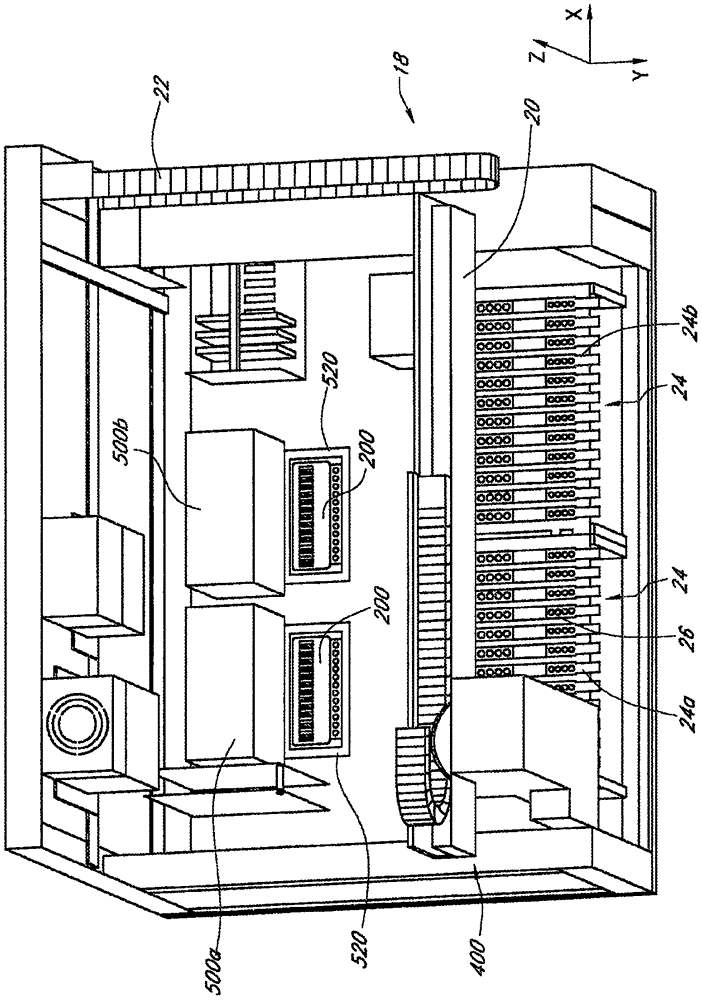
本文公开的系统和方法总体上涉及在微流体盒中在多个微流体反应室中核酸扩增测定,如聚合酶链反应(PCR),和在一些情况中实时PCR的自动化执行。该系统可随后检测每个反应室内的靶核酸,例如,靶扩增子。发明背景医学诊断学产业是目前保健基础设施的关键要素。然而,目前,体外诊断分析,无论多常规,都已变成患者医疗护理中的瓶颈。对此存在几个原因。首先,许多诊断分析只可用高度专门的设备进行,该设备既昂贵又仅由受过培训的临床医生操作。这样的设备可仅在少数场所——常常在任何给定的市区里仅一个。这需要医院将样品送出到这些场所进行分析,由此引起装运成本和运输延迟,和可能甚至样品丢失或误操作。其次,该设备通常在“需要时”不可用,而是成批运行,由此延迟许多样品的处理时间,因为在它们被运行之前必须等机器达到容量。应当理解,对生物样品的诊断测定可分解成几个主要步骤,常常期望使一个或多个步骤自动化。例如,生物样品,如获自患者的那些样品,可用于核酸扩增测定以扩增感兴趣的靶核酸(例如,DNA、RNA等等)。一旦扩增,可检测靶核酸的存在,或靶核酸(例如,靶扩增子)反应器的扩增产物,其中靶核酸和/或靶扩增子的存在用于鉴定和/或定量靶(例如,靶微生物等)的存在。通常,核酸扩增测定包括多个步骤,其可包括核酸提取、核酸扩增和检测。期望使这些过程中的某些步骤自动化。存在对平行进行多个样品的分子诊断测定——具有或没有靶核酸扩增,和对制备的生物样品检测的方法和装置的需要。可配置系统用于高通量,和在商业的参考实验室或在护理点操作,由此消除将样品送出到专门机构的需要。发明概述本文公开的实施方式涉及用于同时测试多个样品的方法和设备。某些实施方式考虑进行实时核酸扩增和检测的装置。该装置可包括检测器头,其包括多个光检测器和光源对。可将检测器头安装到导轨上,其中将检测器和光源对在第一排和第二排中排列。装置可包括微流体盒的容器,其具有多个在第一排和第二排相邻的列中排列的独立反应室。装置还可包括孔板,其被配置以当盒存在于容器中时位于微流体盒之上。孔板可包括多个孔,当容器容纳微流体盒时,这些孔每个排列在多个反应室中每个之上。检测器头可位于孔板之上,并沿着导轨可移动,以便可将第一排中多个光检测器和光源对中的每个安置在孔板第一排中每个孔之上,和可将第二排中多个光检测器和光源对中的每个安置在孔板第二排中每个孔之上。在一些实施方式中,装置还包括第二检测器头,其具有多个排列到第一排和第二排中的光检测器和光源对。可将第二检测器头安装在导轨上。装置还可包括微流体盒的第二容器,其包括多个在第一排和第二排相邻的列中排列的独立反应室。装置还可包括第二孔板,其被配置以当第二盒存在于第二容器中时位于第二微流体盒之上,并且第二孔板可包括多个孔,当第二容器容纳第二微流体盒时,这些孔每个排列在第二微流体盒的多个反应室中每个之上。第二检测器头可位于孔板之上,并沿着导轨可移动,以便可将第二检测器头的第一排中多个光检测器和光源对中的每个安置在第二孔板第一排中每个孔之上,和可将第二检测器头的第二排中多个光检测器和光源对中的每个安置在第二排孔板的第二排中每个孔之上。在一些实施方式中,光检测器和光源对可包括至少六个不同的光检测器和光源对,其以六个不同的波长操作。在一些实施方式中,六个不同的波长包括发射绿色光的光源、发射黄色光的光源、发射橙色光的光源、发射红色光的光源和发射深红色光的光源。在一些实施方式中,检测器头包括至少N排光检测器和光源对,并配置检测器以在包括M排孔的孔板之上移动到至少M+N-1个位置。在一些实施方式中,孔板包括钢、铝、镍或其组合。在一些实施方式中,孔板可具有大约.25英寸的厚度。在一些实施方式中,将至少部分孔板电化学地氧化以比当孔板未被电化学地氧化时更黑。在一些实施方式中,当盒存在于容器中时,孔板提供通过(across)微流体盒区域的基本上均匀的压力。在一些实施方式中,孔板包括铝、锌或镍中至少一个,孔板进一步包括着色剂。在一些实施方式中,装置进一步包括加热器板,其中当盒存在于容器中时将加热器板安置于微流体盒下面。在一些实施方式中,加热器板包括玻璃或石英中至少一个。在一些实施方式中,当盒存在于容器中时,孔板提供通过微流体盒区域的基本上均匀的压力。基本上均匀的压力可促进微流体反应室和加热器板之间基本上均匀的热接触。像这样,在一些实施方式中,孔板提供均匀的压力,其可保证微流体盒中多个反应室或反应器中的每个与位于加热器板内多个加热元件的各个均匀地热接触或联系。在一些实施方式中,装置进一步包括光检测器,光检测器位于孔板之上,其中配置微流体室以相对于光检测器在掠射角从光源接收光。在一些实施方式中,加热器板包括多个加热元件,其中安置多个加热元件中的每个,以便当微流体盒存在于容器中时,多个加热元件分别与多个反应室中的每个热连通。某些实施方式考虑在一个或多个计算机处理器上执行的用于优化协议(protocols),如聚合酶链反应(PCR)协议等,同时进行多个热循环反应的方法,其中每个热循环反应包括一个或多个检测步骤,和其中热循环反应在多个反应器中进行。该方法可包括以下步骤:测定或提供或访问多个反应器中每个的检测循环时间;接收或访问协议步骤,该步骤与步骤持续时间相关,该步骤包括检测时间;和测定对步骤的第一调节以便步骤持续时间是多倍检测循环时间。在一些实施方式中,该方法进一步包括测定对步骤的第二调节,其中当步骤由第一调节和由第二调节来调节时,检测时间是多倍检测循环时间。在一些实施方式中,该方法进一步包括基于与协议相关的反应室的位置测定起始偏移调节(startingoffsetadjustment)。在一些实施方式中,检测循环时间包括检测器头对反应器进行预设的多个检测所需要的时间量。在一些实施方式中,检测循环时间包括检测器头运动到多个反应器中的每个和检测器头运动到起始位置所需要的时间。在一些实施方式中,该方法进一步包括启动该协议。某些实施方式考虑包括指令的永久性计算机可读介质,配置该指令以引起一个或多个处理器进行以下步骤:测定或提供或访问检测循环时间;接收或访问协议步骤,其中该步骤与步骤持续时间相关,并且其中步骤包括检测时间;和测定对步骤的第一调节以便步骤持续时间是多倍检测循环时间。在一些实施方式中,协议步骤与来自多个协议的协议相关。多个协议中的每个可与多个热循环反应,如聚合酶链反应(PCR)协议中至少一个相关,其中每个热循环反应包括一个或多个检测步骤,并且当多个协议中的两个或多个同时运行时,其中测定第一调节至少部分基于一个或多个与多个协议中至少两个或多个的热循环反应相关的检测步骤的计时。在一些实施方式中,该方法还包括测定对步骤的第二调节的步骤,其中当步骤由第一调节和由第二调节来调节时,检测时间是多倍的检测循环时间。在一些实施方式中,该方法还包括基于与协议相关的反应室的位置测定起始偏移调节的步骤。在一些实施方式中,检测循环时间包括检测器头对反应室进行预设的多个检测所需要的时间量。在一些实施方式中,检测循环时间还包括检测器头运动到多个反应室检测位置中的每个和检测器头运动到起始位置所需要的时间。在一些实施方式中,该方法进一步包括启动该协议。某些实施方式考虑优化针对多个反应室的协议的系统。该系统可包括处理器,其被配置以进行以下操作:测定或提供或访问检测循环时间;接收或访问协议步骤,其中该步骤可与步骤持续时间相关,和其中该步骤包括检测时间;和测定对步骤的第一调节以便步骤持续时间是多倍检测循环时间。在一些实施方式中,协议步骤与来自多个协议的协议相关。多个协议中的每个可与多个热循环反应,如聚合酶链反应(PCR)协议中至少一个相关,其中每个热循环反应包括一个或多个检测步骤,并且其中当多个协议中的两个或多个同时运行时,测定第一调节至少部分基于一个或多个与多个协议中至少两个或多个的热循环反应相关的检测步骤的计时。在一些实施方式中,还配置处理器以测定对步骤的第二调节,其中当步骤由第一调节和由第二调节来调节时,检测时间是多倍检测循环时间。在一些实施方式中,还配置处理器以基于与协议相关的反应室的位置测定起始偏移调节。在一些实施方式中,检测循环时间包括检测器头对反应室进行预设的多个检测所需要的时间量。在一些实施方式中,检测循环时间还包括检测器头运动到多个反应室检测位置中的每个和检测器头运动到起始位置所需要的时间。在一些实施方式中,该处理器被进一步配置以启动该协议。某些实施方式考虑在多个PCR反应室中同时进行实时PCR的方法,包括:(a)提供足以让检测器组合件进行扫描循环的扫描时间,在该时间内其可针对至少一个可检测的信号扫描多个PCR反应室中的每个和变为准备重复扫描;(b)为PCR反应室中的每个提供反应协议,其包括多个循环,每个循环包括循环时间,循环时间包括至少一个加热步骤、至少一个冷却步骤和至少一个温度平稳时期,该温度平稳时期包括读取循环时期,检测器组合件在该期间将针对至少一个可检测的信号而扫描反应室;(c)利用处理器测定是否该反应室的循环时间与扫描时间相同或是扫描时间的整数倍,如果不是,则调节扫描时间或循环时间以便循环时间与扫描时间相同或是扫描时间的整数倍;(d)针对多个PCR反应室中每个的反应协议进行至少步骤(b)和(c),以便每个反应协议的循环时间与扫描时间相同或是扫描时间的整数倍;和(e)在处理器的指导下,在每个反应室上利用每个反应室的反应协议进行实时PCR,包括用检测器组合件进行多扫描循环,其中每个PCR反应室在该反应室的每个读取循环时期期间由检测器组合件来扫描。在一些实施方式中,该方法进一步包括调节至少一个反应室的反应协议循环时间的阶段。在一些实施方式中,至少一个所述反应协议与另一个所述反应协议不同。在一些实施方式中,一个反应协议中至少一个循环时间与另一个反应协议中的循环时间不同。附图简述图1A是用于某些实施方式的诊断装置的前平面图。图1B是显示某些装置的内部部件的图1A的诊断装置的顶部透视图。图2显示图1A和1B的诊断装置的内部图。图3A显示本文描述的微流体盒的某些实施方式内一个可能的微流体排列的顶部平面图。图3B显示与某些实施方式的反应室有关的加热器基底的布置图。图4A显示包括本文描述的某些实施方式的检测器头的光学模块的外部图。图4B显示侧盖去除的图4A的光学模块的图。图4C显示图4A的光学模块的底视图。图5显示在某些实施方式的光学模块内使用的沿着图4B的线13的检测器头。图6描述用于本文公开的检测器头的某些实施方式的光源和光学检测器的布置图。图7是利用在本文描述的某些实施方式的装置中进行的靶核酸实时PCR的荧光对时间的图。图8是在本文描述的某些实施方式中发现的某些室、孔和加热层的概括描述。图9A-H显示孔板的一个实施方式的各个透视图。图10显示图9A-H的孔板的透视图的各个尺度。图11是某些实施方式中执行的可能协议的部分热廓线(thermalprofile)的图。图12是描述测定协议持续时间、偏移和检测次数以优化和管理检测器效率的过程的流程图。图13显示选择某些协议步骤和子步骤的持续时间和测定伴随的内循环调节的用户界面部分。图14是包括中间循环调节的热廓线的图。图15A-C绘制某些实施方式中执行的多个协议的多个热廓线。图15A和15B显示起始偏移调节之前协议廓线的特征。图15C显示应用起始偏移调节之后相对于彼此的多个协议廓线。图16是如在某些实施方式中执行的在有效冷却下的热廊线的图。详细描述某些本实施方式考虑装置,本文称作热循环仪,其可连贯地加热和分析微流体室。多核苷酸扩增,如通过实时PCR,可在微流体室内进行。在一些实施方式中,可配置热循环仪以在微流体盒内多个微流体反应室中进行个别的(individual)热循环和检测协议。热循环可用于在微流体反应室内,例如,通过实时PCR或本文描述的其它核酸扩增协议来扩增核酸,例如,DNA、RNA等。热循环仪可包括检测器头,其包括多个检测器对,例如,六个或更多检测器头对,其中每个检测器对包括发光源,例如,LED等,和同种的光电二极管。在一些实施方式中,配置每个个别检测器对以产生和检测从荧光部分,例如,荧光探针发射的光,以指示靶多核苷酸的存在。如本文所用,术语“微流体”指小于1ml,优选小于0.9ml,例如,0.8ml、0.7ml、0.6ml、0.5ml、0.4ml、0.3ml、0.2ml、0.1ml、90μl、80μl、70μl、60μl、50μl、40μl、30μl、20μl、10μl、5μl、4μl、3μl、2μl、1μl或更小或两者之间任何量的体积。应当理解,除非相反地特别解释,术语PCR用于本文的地方,意欲包括PCR——包括但不限于实时和定量PCR——和任何其它形式的多核苷酸扩增的任何变体。用于该测定的检测过程还可以是多种多样的以允许同时在多个反应上进行多个同时发生的测量。在一些实施方式中,这些测量可从分开的反应室进行。这些实施方式中的某些在单个PCR反应室中同时进行多个PCR反应,例如,多重PCR。PCR协议可包括在检测之前对在反应室中进行多核苷酸的连续退火和变性的指导。这样的指导——包括用于加热室的时间廓线——可被称作“协议”。公开的实施方式中的某些促进通过多个进行PCR的反应室连贯的加热和/或冷却,同时利用传感器阵列促进检测。在某些实施方式中,装置可包括孔板,其通过将压力施加给含有多个PCR反应室的盒而促进反应室连贯的加热和冷却。处理多核苷酸的某些细节和方法可在,例如,美国专利申请公开2009-0131650和美国专利申请公开2010-0009351中找到,其通过引用被并入本文。技术人员将理解本文公开的实施方式用于多种类型的核酸扩增反应。例如,核酸扩增方法连同本文公开的实施方式可包括,但不限于:聚合酶链反应(PCR)、链置换扩增(SDA)例如多重置换扩增(MDA)、环介导的等温扩增(LAMP)、连接酶链反应(LCR)、免疫-扩增和许多种基于转录的扩增操作,包括转录-介导的扩增(TMA)、基于核酸序列的扩增(NASBA)、自持续的序列复制(3SR)和滚环扩增。参见,例如,Mullis,“扩增、检测和/或克隆核酸序列的方法”,美国专利号4,683,195;Walker,“链置换扩增”,美国专利号5,455,166;Deanetal,“多重置换扩增”,美国专利号6,977,148;Notomietal.,“合成核酸的方法”,美国专利号6,410,278;Landegrenetal.美国专利号4,988,617,“检测核酸中核苷酸变化的方法”;Birkenmeyer,“利用空位填补连接酶链反应的靶核酸扩增”,美国专利号5,427,930;Cashman,“阻断的聚合酶多核苷酸免疫测定法和试剂盒”,美国专利号5,849,478;Kacianetal.,“核酸序列扩增方法,”美国专利号5,399,491;Maleketal.,“增强的核酸扩增方法”,美国专利号5,130,238;Lizardietal.,BioTechnology,6:1197(1988);Lizardietal.,美国专利号5,854,033“滚环复制报道基因系统”。在本文公开的一些实施方式中,利用寡核苷酸探针可检测靶核酸,例如,靶扩增子。优选,探针包括一个或多个可检测的部分——其可由本文公开的系统检测。技术人员将理解几种探针技术用于本文描述的实施方式。通过实例,本文公开的实施方式可与探针、分子信标探针、SCORPIONTM探针等等一起使用。测定是用于检测多核苷酸的同源测定(参见美国专利号5,723,591)。在测定中,两个PCR引物位于中央探针寡核苷酸两侧。探针寡核苷酸含有荧光团和猝灭剂。PCR过程的聚合步骤期间,聚合酶的5′核酸酶活性切割探针寡核苷酸,引起荧光团部分变得与猝灭剂物理分离,这增加荧光发射。随着更多PCR产物产生,在新的波长的发射强度增加。分子信标是用于检测多核苷酸的探针的替代物,并在,例如,美国专利号6,277,607;6,150,097;和6,037,130中被描述。分子信标是寡核苷酸发夹,其在结合到完全匹配的模板之后经历构象变化。寡核苷酸的构象变化增加存在于寡核苷酸上的荧光团部分和猝灭剂部分之间的物理距离。物理距离的这种增加引起猝灭剂的作用被减小,因此增加来自荧光团的信号。邻近的探针方法通过聚合酶链反应在存在两个与靶序列的邻近区域杂交的核酸探针的情况下扩增靶序列,探针之一用受体荧光团标记,另一个探针用荧光能量转移对的供体荧光团标记。两个探针与靶序列杂交之后,供体荧光团与受体荧光团相互作用,产生可检测的信号。然后用在供体荧光团吸收的波长的光刺激样品,和检测来自荧光能量转移对的荧光发射用于靶总量的测定。美国专利号6,174,670公开这样的方法。日出引物(Sunriseprimer)利用与分子信标相似但连接到充当引物的靶结合序列的发夹结构。当合成引物的互补链时,发夹结构断裂,由此消除淬灭。这些引物检测扩增的产物和不需要使用具有5′外切核酸酶活性的聚合酶。日出引物由Nazarenkoetal.描述(NucleicAcidsRes.25:2516-21(1997)和在美国专利号5,866,336中被描述。SCORPIONTM探针将引物与加入的与日出引物相似的发夹结构结合。然而,SCORPIONTM探针的发夹结构不被互补链的合成打开,但是由发夹结构部分与靶的部分的杂交打开,该靶位于与引物杂交的部分的下游。DzyNA-PCR包括含有DNA酶的反义序列的引物、能切割特异的RNA磷酸二酯键的寡核苷酸。引物结合靶序列和驱动产生扩增子的扩增反应,扩增子含有活性DNA酶。活性DNA酶然后在反应混合物中切割通用报道基因底物。报道基因底物含有荧光团-猝灭剂对,并且底物的切割产生荧光信号,荧光信号随着靶序列的扩增而增加。DNAzy-PCR在Toddetal.,Clin.Chem.46:625-30(2000)和美国专利号6,140,055中被描述。Fiandacaetal.描述利用猝灭剂标记的肽核酸(Q-PNA)探针和荧光团标记的寡核苷酸引物的PCR分析的荧光方法。Fiandacaetal.GenomeResearch.11:609-613(2001)。Q-PNA在引物的5′末端杂交到标签序列。Lietal.描述在相对的寡核苷酸链上具有猝灭剂和荧光团的双链探针。Lietal.NucleicAcidsResearch.30(2):e5,1-9(2002)。当未结合靶时,链互相杂交和探针被淬灭。然而,当靶存在时,至少一条链与靶杂交,产生荧光信号。用于本文公开的实施方式的荧光团标记和部分包括,但不限于,荧光素家族、羧基罗丹明家族、花青家族和罗丹明家族的染料。可用于本发明的其它家族的染料包括,例如,聚卤荧光素-家族染料、六氯荧光素-家族染料、香豆素-家族染料、嗪-家族染料、噻嗪-家族染料、方酸-家族染料、螯合的镧系元素-家族染料、在贸易名称AlexaFluorJ——来自MolecularProbes——下可获得的染料家族和在贸易名称AlexaBodipyJ——来自Invitrogen(Carlsbad,Calif)——下可获得的染料家族。荧光素家族的染料包括,例如,6-羧基荧光素(FAM)、2′,4,1,4,-四氯荧光素(TET)、2′,4′,5′,7′,1,4-六氯荧光素(HEX)、2′,7′-二甲氧基-4′,5′-二氯-6-羧基罗丹明(JOE)、2′-氯-5′-氟-7′,8′-稠合的苯基-1,4-二氯-6-羧基荧光素(NED)、2′-氯-7′-苯基-1,4-二氯-6-羧基荧光素(VIC)、6-羧基-X-罗丹明(ROX)和2′,4′,5′,7′-四氯-5-羧基-荧光素(ZOE)。羧基罗丹明家族染料包括四甲基-6-羧基罗丹明(TAMRA)、四丙醇-6-羧基罗丹明(ROX)、德克萨斯红、R110和R6G。花青家族染料包括Cy2、Cy3、Cy3.5、Cy5、Cy5.5和Cy7。荧光团容易商业上获自,例如,Perkin-Elmer(FosterCity,Calif.),MolecularProbes,Inc.(Eugene,Oreg.)和AmershamGEHealthcare(Piscataway,N.J.)。如上面所讨论的,在一些实施方式中,用于本文公开的实施方式的探针可包括猝灭剂。猝灭剂可以是荧光猝灭剂或非荧光猝灭剂。荧光猝灭剂包括,但不限于,TAMRA、ROX、DABCYL、DABSYL,花青染料——包括硝基噻唑蓝(NTB)、蒽醌、孔雀绿、硝基噻唑和硝基噻唑化合物。消散从荧光团吸收的能量的示例性非荧光猝灭剂包括在贸易名称BlackHoleTM——来自BiosearchTechnologies,Inc.(Novato,Calif)——下可获得的那些猝灭剂、在贸易名称EclipseTM.Dark——来自EpochBiosciences(Bothell,Wash.)——下可获得的那些猝灭剂、在贸易名称QxlJ——来自Anaspec,Inc.(SanJose,Calif.)——下可获得的那些猝灭剂和在贸易名称IowaBlackTM——来自IntegratedDNATechnologies(Coralville,Iowa)——下可获得的那些猝灭剂。在上面讨论的一些实施方式中,荧光团和猝灭剂一起使用,和可以在相同或不同的寡核苷酸上。当一起配对时,荧光团和荧光猝灭剂可被分别称作供体荧光团和受体荧光团。许多方便的荧光团/猝灭剂对在本领域已知(参见,例如,Glazeretal,CurrentOpinioninBiotechnology,1997;8:94-102;Tyagietal.,1998,Nat.Biotechnol.,16:49-53)和容易地商业上获自,例如,MolecularProbes(JunctionCity,Oreg.)和AppliedBiosystems(FosterCity,Calif.)。可与多种受体荧光团一起使用的供体荧光团的实例包括,但不限于,荧光素、萤光黄、B-藻红蛋白、9-吖啶异硫氰酸盐、萤光黄VS、4-乙酰胺基-4′-异硫-氰酰均二苯乙烯-2,2′-二磺酸、7-二乙氨基-3-(4′-异硫氰酰苯基)-4-甲基香豆素、琥珀酰亚胺1-芘丁酸盐和4-乙酰氨基-4′-异硫氰酰均二苯乙烯-2-,2′-二磺酸衍生物。受体荧光团通常取决于使用的供体荧光团。受体荧光团的实例包括,但不限于,LC-Red640、LC-Red705、Cy5、Cy5.5、丽丝胺罗丹明B磺酰氯、四甲基罗丹明异硫氰酸盐、罗丹明x异硫氰酸盐、赤藓红异硫氰酸盐、荧光素、二乙撑三胺戊乙酸酯或镧系元素离子(例如,铕或铽)的其它螯合物。供体和受体荧光团容易商业上获自,例如,MolecularProbes或SigmaChemicalCo.(St.Louis,Mo.)。用于本文公开的组合物和方法的荧光团/猝灭剂对在本领域熟知和可在,S.Marras,“用于荧光核酸杂交探针的荧光团和猝灭剂对的选择”——在万维网站molecular-beacons.org/download/marras,mmb06%28335%293.pdf可获得(截至2012年4月11日)——中找到,例如,所描述。用于本文公开的测定的检测方法有利地允许多个可检测的部分的多个同时的测量,例如,多个含有不同的可检测的部分的探针等。在一些实施方式中,这些测量可从微流体盒内单独的反应室——例如,包括室层(室层在本文指含有反应室的微流体盒的部分)——进行。这些实施方式中的某些在单个反应室中同时进行多个扩增反应,例如,多重PCR。PCR协议可包括在检测之前对在反应室中进行多核苷酸的连续退火和变性的指导。在某些实施方式中,配置装置以促进通过多个反应室的连贯的加热和/或冷却以进行核酸扩增,以促进个别反应室中靶扩增子的检测,例如,通过利用传感器阵列检测荧光发射。在某些实施方式中,装置可包括孔板,其通过多个独立的光学对将压力施加给含有多个反应室的盒来促进反应室的连贯的加热和冷却。优选配置孔板以能够和促进多个独立反应室内来自探针的荧光信号的产生和检测。在一些实施方式中,配置孔板以便微流体盒中存在个别的孔(或窗),其位于个别反应室中的每个之上。诊断装置图1A和1B显示本实施方式中的某些的诊断装置10。在图1A中显示的实施方式中,诊断装置包括装置外壳30。外壳30可保证用于微流体样品处理和防止不期望的光进入检测空间的受控环境。外壳30可包括盖16,其包括把手14和半透明的窗12。当诊断装置10运行时,可将盖16可落下以关闭诊断装置10前面的开口。如图1A和1B的实施方式中所看到的,诊断装置10可在诊断装置10的前部容纳两个样本架24a、24b。然而,技术人员将理解,图1A和1B中的诊断装置的描述只是示例性的,并且在一些实施方式中,可配置装置以容纳超过两个样本架,例如,三、四、五、六、七、八、九、十或更多个样本架。优选,配置装置以容纳与微流体盒相同数目的样本架,例如,两个。在一些实施方式中,每个样本架24a、24b可包括多个支架26。支架26可包括装诊断试剂,如用于核酸扩增的试剂,例如,PCR试剂等的容器。架24还可包括用于制备诊断待命样品,如扩增待命样品的样本管(未显示)和混合管(未显示)。装置可在架24a、24b中利用分配器400制备期望的试剂。多种流体分配器的进一步描述可在,例如,通过引用并入本文的美国专利申请公开2009-0130719和美国专利申请公开2009-0155123中找到。在一些实施方式中,微流体盒(或多个)内的反应室包括核酸扩增测定中使用的一个或多个试剂、缓冲剂等。例如,在一些实施方式中,微流体盒的反应室可包括,例如,扩增引物、探针、核苷酸、酶如聚合酶、缓冲剂等。通过实例,在一些实施方式中,反应室可包括冻干试剂,将处理的生物样品(例如,提取的核酸溶液)加入其中。然后可将制备的液体转移至微流体盒和插入加热器/光学模块500a、500b用于处理和分析。图1A是某些实施方式的诊断装置10的前面平面图。如图1A所看到的,诊断装置10可包括流体分配器400——安装在侧面导轨20上。侧面导轨20可以是电动机驱动的构台18的部分,构台18还可包括前-后导轨22(未显示)。可将前-后导轨22与侧面导轨20连接和垂直地安装到诊断装置10中的侧面导轨20。图1A进一步显示加热器/光学模块500a、500b之上的盖28。接收托盘520a和520b可位于加热器/光学模块500a、500b的外壳下面或之内。显示接收托盘520a处于打开的位置,使其可接收微流体盒200。显示接收托盘520b处于关闭的位置。关闭托盘不但将试剂放置在合适的位置用于处理,而且进一步保护加热器/光学模块的内部不接收任何不需要的杂散光。如果杂散光引入到检测区域,那么系统可识别来自不是从反应室发射的光的错误的荧光水平。图1B是诊断装置10显示某些实施方式中内部部件中某些的诊断装置10的透视图。为了更好地显示某些部件,已将图1A中的装置外壳30、盖16和加热器/光学盖28从图1B的图中去除。图1B显示构台18,包括侧面导轨20前-后导轨22。可将流体分配器400安装在侧面导轨20上和可沿着长的侧面导轨20侧面地滑动。可将侧面导轨20与前-后导轨22连接,前-后导轨22可以以前-后运动。以该方式,流体分配器400可遍及诊断设备10以X、Y方向运动。如下面所描述的,流体分配器400还可在侧面导轨20上在z平面中上下运动,由此给予分配器400遍及诊断设备10以三个方向的度运动的能力。图1B还显示加热器/光学模块500a、500b,去除了图1A的加热器/光学模块的盖28。描述接收托盘520a和520b处于打开的位置和每个装有盒200。在一些实施方式中,接收托盘可每个包括微流体盒200中的每个下面的加热器基底600(未显示)。加热器/光学模块500a、500b还可每个包括检测器头700——下面被更详细地描述。如下面将更详细地描述的,诊断装置10能够对一个或多个样品进行实时诊断。首先可将待检测的样品放置在架24a或24b上的样本管(未显示)中。可诊断试剂可位于诊断装置10内架24a上的支架26中。流体分配器400可混合和制备样品用于诊断测试和然后可将制备的样品递送到微流体盒200用于加热器/光学模块500a、500b中的热循环和分析物检测。可选地,流体分配器400可将核酸样品递送到微流体盒的反应室,其中微流体盒的反应室已经含有扩增反应的试剂。图2显示诊断装置10的内部视图,显示容纳许多样品管32和试剂支架26的架24a,和位于接收托盘520a中的盒200。接收托盘520a处于打开的位置——从具有连接的盖28的加热器/光学模块500a延伸。接收托盘520b处于关闭的位置。有利地,在一些实施方式中,接收托盘520a、b可允许用户或自动装填设备容易地放置微流体盒200。这样的设计还可利用机器人流体分配器400提供样品的多路复用(multiplexed)移液。接收托盘如图2所显示的,凹面板524可以是接收托盘520的部分,其被配置以选择性地接收微流体盒200。例如,凹面板524和微流体盒200可具有边缘526,其在形状上互补以便微流体盒200以,例如,单个定向而被选择性地接收。例如,微流体盒200可具有定位(registration)部件202,其适合凹面板的互补特征。定位部件202可以是,例如,盒200边缘上的切掉部分(如图3A所示)或一个或多个在一个或多个侧面上形成的凹口。技术人员将容易理解,利用其它合适的排列,例如,在孔内适合的标杆或突出,盒和接收板之间的互补性可容易获得。通过选择性地接收盒200,凹面板524可帮助用户放置盒200以便光学模块502可在盒200上正确地运行。以该方式,可获得盒200的无误差排列。可排列接收托盘520以便安置可在微流体盒200上运行的装置的各个部件(如,热源、检测器、力部件等)以在微流体盒200正确地运行,同时将盒200接收在接收托盘520的凹面板524中。例如,可将加热器基底600上的接触热源安置在凹面板524中,以便热源可热连接到接收托盘520中接收的微流体盒200上的不同位置。微流体盒某些实施方式考虑微流体盒,该微流体盒被配置以对来自一个或多个样品的一个或多个多核苷酸进行扩增,如通过PCR。盒指整体或部分地用后可弃或可重复使用的单元,和可被配置以与一些其它装置——已被合适和互补地配置以在(如将能量递送给)盒上接收和运行——一起使用的单元。如本文所用,微流体指样品、和/或试剂、和/或扩增的多核苷酸的体积是约0.1μl至约999μl,如1-100μl,或2-25μl,如上面所定义的。相似地,当应用到盒时,术语微流体指盒的各个部件和通道,如本文所进一步描述的,被配置以接受、和/或保留、和/或促进样品、试剂或扩增的多核苷酸的微流体体积的通过。本文的某些实施方式还可用纳升体积(在10-500纳升的范围,如100纳升)起作用。图3A是微流体盒200的顶部平面图。盒200可包括多个样品泳道1706a-c。泳道可通往位于盒的“左”和“右”侧(即,排)的PCR室1703。如图3a中所指出的,泳道可在接近用户的方便位置提供入口1705。然而,与口连接的泳道然后可采取独立的路径以分离室1703a-c。在图3a的实施方式中,例如,第一泳道1706a与左侧的第一室1703a相通,第二泳道1706b与右侧1703b的第一室相通,第三泳道1706c与左侧的第二室1703c相通,等等。每个微流体泳道还可包括微流体阀1702、1704,微流体门和微流体通道。这些门和阀可,例如,通过热致动,被配置以促进盒200的泳道1706内某些流体的定时释放和受控扩散。该实施方式的盒可包括通风孔1701,其防止空气阻塞盒内的液体通道。各个盒部件如阀的进一步描述可在,例如,通过引用并入本文的美国专利申请公开2009-0130719中找到。微流体盒200可包括定位部件202,例如,线路中断器(cutout),其对应加热器/光学模块500a、500b的接收托盘520a、b的凹面板524中互补的边缘。定位部件202和互补的边缘526可允许接收托盘520a、b中的微流体盒200的安全和正确的放置。在各种实施方式中,盒200的样品泳道1706中微流体网络的部件可在加热器基底600中通过用加热器热耦合它们而被加热。加热器基底600可被配置以加热样品混合物——包括扩增试剂和扩增待命的多核苷酸样品——和使其经历适合从扩增待命的样品产生扩增子的热循环条件。在一些实施方式中,加热器基底600可位于盒200上或在凹面板524中。每个泳道中的微流体网络可被配置以对扩增待命的样品,如含有从样品提取的核酸的扩增待命的样品进行核酸扩增,如通过PCR。扩增待命的样品可包括扩增试剂和提取的多核苷酸样品的混合物。混合物可适合经受热循环条件以从提取的多核苷酸样品产生扩增子。例如,扩增待命的样品,如PCR待命的样品,可包括PCR试剂混合物,其包括聚合酶、阳性对照核酸、对阳性对照核酸的至少部分选择性的荧光杂交探针和多个核苷酸,和对靶多核苷酸序列选择性的至少一个探针。微流体网络可被配置将来自外部热源的热与包括PCR试剂和提取的多核苷酸样品的混合物在适合从提取的多核苷酸样品产生PCR扩增子的热循环条件下结合。在各个实施方式中,试剂混合物可包括荧光标记或其它光学上可检测的标记用于期望的扩增子的产生的检测。在一些实施方式中,多组引物和多个标记可用于多重测定形式,例如,多重PCR,其中多个不同的扩增子中的每个可在单个反应室中被检测,如果存在的话。例如,一个测定室可包括来自测试样品的模板核酸、阳性对照模板核酸、一个或多个用于特定靶序列扩增的引物、一个或多个用于靶扩增子检测的探针、和用于阳性对照扩增子检测的一个或多个引物对和探针。另外,技术人员将理解,在一些实施方式中,微流体盒提供阴性对照多核苷酸,其将不用用于扩增靶序列或阳性对照序列的引物对产生扩增子。在显示的实施方式中的某些中,分别与多泳道盒200的每个泳道1706a-c连接的室1703a-c可进行独立的扩增反应。前两个泳道(1706a、1706b)的第一列室(1703a、1703b)的反应结果然后可利用包括“左”和“右”光源-光检测器对的检测器头同时和独立地测量。即每个泳道1706a-b的每个室1703a-b可接收来自单独光源的光和由单独光检测器同时观察。以该方式,许多种反应组合可在盒中有效地进行。例如,在一些实施方式中,用于多个靶核酸检测的多个扩增测定可在一个泳道中进行,阳性对照和阴性对照在两个其它泳道中进行;或用于一个或多个靶核酸的检测的一个或多个扩增测定分别连同内部阳性对照在一个泳道中进行,阴性对照在单独的泳道中。在一个具体实施方式中,2、3、4、5、6或更多个测定在单个泳道中多重进行,反应室中具有至少该数目的荧光性不同的荧光团。微流体盒200可由许多层构成。相应地,本技术的一个方面涉及微流体盒,其包括第一、第二、第三、第四和第五层,其中一个或多个层限定多个微流体网络,每个网络具有多个部件——其被配置以对样品进行PCR,其中一个或多个多核苷酸的存在或缺乏将被测定。在另一个实施方式中,微流体盒200可包括多个泳道,每个包括反应室——其在单个平面如在模塑基底中被蚀刻或塑造,每个泳道由盖层如粘性塑料薄膜层关闭。考虑具有每个盒8、10、12、14、16、18、20、22、24、28、30或更多个泳道的实施方式。例如,一个合适的设计是具有24个反应室的单个盒200,24个反应室分两排排列,每排12个反应室,任选地具有相对对齐的入口。各种盒和它们的部件的进一步描述可在,例如,通过引入并入本文的美国专利申请公开2008-0182301和美国专利申请公开2009-0130719中找到。加热器基底图3B显示加热器基底600的某些实施方式的顶部平面图。可使用任何类型的加热器,包括加热电阻丝、珀尔加热器或动液(moving-fluid)加热器,考虑被动或主动冷却。许多可能的实施方式之一包括多个与每个反应室热接触的加热电阻丝,优选还包括一个或多个温度传感器。因为加热电阻丝还显示一些热敏电阻作用,即,它们的电阻随着温度而变化,加热电阻丝自身可兼作温度传感器,允许每个反应室的精确的温度控制同时简化产物设计。虽然加热器可被彼此一致地控制,但是在一些实施方式中,每个反应室可具有一个或多个与此热接触的个别的加热器,以便加热器是分别可控的和每个反应室可与其他反应室被独立地加热和允许冷却。这允许在多个反应室中的每个中同时进行不同的测定。与个别反应室一起使用的一个具体的加热电阻丝部件显示在图3B中。在图3B显示的实施方式中,顶部传感器加热器/传感器1604、底部加热器/传感器1603、侧面加热器/传感器1601和中央加热器/传感器1602的任何组合可用于加热位于上面的反应室。为了容易理解,将某些实施方式的PCR室1703的轮廓覆盖在加热器基底上。在某些实施方式中,加热器基底600中的加热器可以是接触加热器。这样的接触加热器可包括(例如)加热电阻丝(或其网络)、散热器、流体热交换器和珀尔(Peltier)设备。接触热源可被配置在凹面板524中以被热耦合到接收托盘520a、b中接收的微流体盒200中的一个或多个不同位置,借此不同位置被选择性地加热。接触热源可每个被配置在加热器基底600中以被独立地热耦合到接收托盘520a、b中接收的微流体盒200的不同位置,借此不同位置被独立地加热。接触热源可有利地被配置以与接收托盘520a、b中接收的微流体盒200中的不同位置直接的物理接触。在各个实施方式中,每个接触源加热器可被配置以加热具有约1毫米(mm)至约15mm(通常约1mm至约10mm)的2维平均直径的不同位置,或具有约1mm约225mm之间(在一些实施方式中,约1mm和约100mm之间,或在一些实施方式中,约5mm和约50mm之间)的表面面积的不同位置。可将加热器基底600构成“泳道”1605a、b——平行盒200的泳道1706a-c的结构。在一些实施方式中,加热器基底600可包括24个加热器泳道1605a、1605b——对应盒200的样品泳道1706。当将微流体盒200放置在接收托盘520a、b的凹面板524中时,可将盒200的部件邻近加热器基底600中相应的加热器和在加热器基底600中相应的加热器之上排列。当将微流体盒200放置在凹面板524中时,可将加热器与各自的部件物理接触。在一些实施方式中,加热器保持热耦合到它们各自的部件,例如,通过一个或多个中间层或材料,尽管不是直接的物理接触。泳道的进一步描述可在例如,通过引用并入本文的美国专利申请公开2009-0130719中找到。在一些实施方式中,多个加热器可被配置以同时和均匀地激活从而加热微流体盒200中微流体网络的各自邻近的盒部件。每个加热器可以由处理器和/或与本文描述的装置一起使用的控制电路独立地控制。通常,微流体盒200中微流体部件(门、阀、室等)的加热通过使电流通过合适配置的微制造的加热器来控制。在合适的电路控制下,多泳道盒的泳道1706然后可被彼此独立地加热,和由此被独立地控制。此外,如下面更详细地描述,个别加热器1601-1604可被彼此独立地加热,和由此被独立地控制。这可导致更大的能效和对装置的控制,因为不是所有的加热器在同一时间被加热,并且给定的加热器正接收电流持续仅当它需要加热时的时间部分。加热器基底600还可包括一个或多个热传感器。为了减少控制加热器泳道1605a、1605b中的加热器所需要的传感器或加热器的数目,加热器可用于传感温度以及热,和由此排除每个加热器都具有单独的专用传感器的需要。例如,一些材料的阻抗和/或电阻随着周围温度而变化。相应地,加热器/传感器1601-1604的电阻可用作当传感器没有正被主动加热时的温度指示。在一些实施方式中,加热器基底600中的加热器可被设计具有足够的瓦特数以允许加将热器串联或并联聚集以减少电子可控的元件的数目,由此减少连接的电子电路的负荷。以该方式集合的加热器将在同步和基本上同时控制下运行。在一些实施方式中,第二阶段加热器对侧上的反应室加热器可被聚集和配置以在同步的控制下运行。例如,在一些实施方式中,PCR/扩增加热器1601-1602可被聚集和配置以在同步的控制下运行。可选的聚集和配置可应用到PCR/扩增加热器1601-1604的其它加热器组。PCR/扩增加热器1601-1604可被配置以个别地和独立地运行或它们可被配置以两个(成对)、三个、四个、五个或六个的组来运行。在一些实施方式中,加热可通过用不同的脉冲宽度调制(PWM)周期性地接通和断开到各自加热器的电流来控制,其中脉冲宽度调制指电路的接通持续时间/停止时间比。电流可通过将微制(microfabricated)加热器连接到高压源(例如,30V)而供应,这可由PWM信号选通。在一些实施方式中,该设备可包括48个PWM信号发生器。在一些实施方式中,将存在两个与每个反应室连接的PWM信号发生器。PWM发生器的运行可包括产生具有选择的、可编程的时期(结束计数(theendcount))和粒度的信号。例如,信号可以是具有1us粒度的4000us(微秒),在这种情况中PWM发生器可保持当它返回到零时在零开始和以1us的增量前进直到它达到4000us的计数器。因此,产生的热的量可通过调节结束计数来调节。高的结束计数对应更大长度的时间,在该时间期间微制加热器接收电流和因此产生的更大量的热。在各个实施方式中,除了前面提到的结束计数和粒度,PWM发生器的运行还可包括可编程的起始计数。在这样的实施方式中,多个PWM发生器可产生这样的信号,其可选择性地非重叠(例如,通过加倍各个加热器的接通持续时间)以便不超过高压电源的电流容量。多个加热器可由具有变化的起始和结束计数的不同的PWM信号发生器控制。加热器可被分成组,借此组限定一组具有相同起始计数的加热器。某些实施方式中加热元件,和冷却元件——如果存在的话——的控制在下面被进一步详细地讨论。光学模块图4A-C显示某些实施方式中提供的检测装置10的加热器/光学模块500。加热器/光学模块500可包括光学模块502和接收托盘520或接收托盘的部分。图4A显示封入的光学模块502的一个实施方式,该光学模块502具有与其外部连接的电动机504用于驱动检测器头700的运动。可将检测器头700放置在光学模块502内部。图4A显示接收托盘520,其与光学模块502的底面506连接。接收托盘520可接收包括样品的盒200,对样品将进行检测。接收样品之后,可将接收托盘520在导轨522上运动(例如,机械地或手动地)到光学模块502下面的位置。在下面被更详细地描述的一些实施方式中,接收托盘可包括自动装载设备,一旦位于光学模块502下面,该自动装载设备自动地排列盒。在一些实施方式中,接收托盘520的凹面板524可含有加热器基底600。在一些实施方式中,接收托盘可随后被升高以将盒与光学模块502接触,如与在光学模块502基底的孔板540接触而放置。图4B显示光学模块502的实施方式,前面板508被去除以显示光学模块502的内部。图4B显示检测器头700。如下面更详细地描述的,检测器头700的运动可由电动机504驱动以穿过光学模块502的内部侧向运动,以当盒200安置于接收托盘520中光学模块502下面时提供对盒200的光学扫描和检测。图4B显示孔板540,其位于光学模块502的底面506上。图4C提供光学模块502的底部平面图。图4C显示孔板540,规格化装置板(normalizerplate)546与光学模块502的底部506连接。规格化装置板可用于校准检测器头的光源-光检测器对。规格化装置板546优选包括一个或多个具有已知、标准化的光学特性的部件,和被配置以校准、标准化或证实检测器头700和连接的电路的正确操作。规格化装置板546可延伸进光学模块,并可将检测器头700位于规格化装置板之上。在一些实施方式中,在盒光学测量开始之前,利用规格化装置板546的已知性质校准检测器头700。如果检测器头700没有正确地工作,那么可采取校正活动,如包括测量中的偏移或通知用户该错误。在一些实施方式中,规格化装置板可由光学上透明的材料制成,如混合有高度荧光染料的聚碳酸酯或其它标准化的生色团或荧光团。在一个实施方式中,规格化装置板包括针对检测器头700中每个通道或颜色的标准化的生色团或荧光团。如图4C所示,孔板540含有孔557。孔557的尺度是这样的,当将检测器运动到光学模块502内的多个位置时,检测器的光源和光检测器可接近(光学地激发或观察)盒200的反应室中的内容物。即,当检测器的光源-光检测器对位于特定孔之上的位置时,光可从光源运行和通过孔557达到室反应器。反应室中的发荧光试剂然后可通过孔557对光检测器可见。检测器头图5显示沿着图4B的线13取得的检测器头700的横断面。检测器头700可被配置以光学地激发和/或监测从一个或多个存在于反应室1703的多核苷酸发射的荧光连同检测一个或多个存在于反应室1703的多核苷酸。注意,阳性结果(靶扩增子的存在)可由增加的荧光或减少的荧光指示,取决于测定设计。例如,当测定包括荧光团和猝灭剂时,当靶存在时猝灭剂可淬灭荧光,或在其它测定设计中,当缺乏靶时。该系统可包括,例如,多个检测器对,例如,3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或更多,如检测器对726。每个检测器对726可由光源726a,如发光二极管(LED),和相应的光检测器726b,如光电二极管构成。光源726a可选择性地在荧光探针的吸收谱带发射光。光检测器726b可选择性地在荧光探针的发射谱带检测光,其中荧光探针对应多核苷酸探针或其片段。在某些实施方式中,光源726a可包括带通过滤的二极管,其选择性地在荧光探针的吸收谱带发射光。光检测器726b可包括带通过滤的光电二极管,其选择性地在荧光部分的发射谱带——例如,荧光探针的发射——检测光。在某些实施方式中,滤波器726al,如带通滤波器可被应用到光源726a的光。来自光源726a的光在通过微流体通道中的样品(在某些实施方式中300g深)之前通过滤波器。在某些实施方式中,从反应室到光检测器726b的光的光路长度可以非常小。来自光源726a的入射光在反应室中产生荧光。来自反应室的光然后传播到光检测器726b。某些实施方式寻求减轻任何不期望的光进入检测器和由此不利地影响来自反应室的光信号。在一些实施方式中,多个检测器对中的每一个可沿着检测器头700的长度成排排列。即,图5中显示的对726和727后面可以是以相似或相同定向的另一列对。为了说明,将沿着盒的长度的盒或检测器对的集合称作“排”,和将沿着宽度的那些称作“列”。因此,图3A和6中的垂直方向指示“列”和水平的方向为“排”。某些实施方式考虑这样的检测器对的六或更多个列。在这些实施方式中,将存在总共12个检测器对(两排,每排六个),每列两个检测器对,允许12分开和同时检测。每个光源,如例如光源726a,可被配置以产生对与,例如,反应室中含有的探针关联的特定荧光部分特异的波长的光。每个光检测器,如例如726b,可被配置以检测与检测器对中的光发射器产生的光关联的荧光探针发射的光。检测器对可被配置以独立地检测多个荧光部分,例如,不同的荧光探针,具有不同的荧光发射光谱,其中在每个反应室中,来自每个荧光探针的发射指示一个特定的靶多核苷酸或其片段的存在或不存在。虽然可利用折叠光路,但是一个实施方式利用这样的检测器和发射器对,其中每个与反应室直接光学接触,优选同时这样的接触。任选地,将一对检测器和发射器与反应室沿着在反应室以锐角基本相交的线排列。该角可以是,例如,约5和70度之间,优选约8和60度之间,更优选约10和50度之间。在一些实施方式中,当存在于装置中时,检测器头包括两排光检测器和光源对,其对应微流体盒的两排反应室。例如,检测器头可包括第一排或顶排六个光检测器和光源对,和第二排或底排光检测器和光源对,其被配置以分别查询微流体盒内的第一和第二排反应室。图6显示检测器的某些实施方式中执行的一个可能的光检测器和光源布置图。第一列包括ROX光发射器201a、201b和对应的检测器207a、207b。第二列包括HRM光发射器201c、201d和对应的检测器207c、207d。第三列包括CY5光发射器201e、201f和对应的检测器207e,207f。第四列包括FAM光发射器201g、201h和对应的检测器207g、207h。第五列包括Q705光发射器201i、201j和对应的检测器207i、207j。第六列包括VIC光发射器201k、201l和对应的检测器207k、207l。在一些实例中,参考将用于测定的特定荧光团来选择检测器和发射器。在图6中显示的实施方式中,第一排或顶排检测器和光源对包括多个光检测器和光源对,例如发射器201a、201c、201e、201g、201i和201k和检测器207a、207c、207e、207g、207i和207k。第二排或底排检测器和光源对包括多个光检测器和光源对,例如发射器201b、201d、201f、201h、201j和201l和检测器207b、207d、207f、207h、207j和207l。示例的发射器和检测器的性质概括显示在下面的表1中。表1颜色(样本)染料(测定)波长名称(Ex/Em)软件CT#绿色FAM470/510FAM4黄色TET,VIC530/555VIC6橙色TexasRed,ROX585/610CalRed/ROX1红色Cy5625/660Cy53深红色Cy5.5680/715Cy5.55紫外线空值紫外线HRM2图6中描述的光检测器和光源的示例的排列可抑制检测列之间的串扰。即,每个发射器检测器对的波长范围可被选择以具有与邻近的发射器-检测器对的最小重叠。因此,例如,其中CT#指6-列检测器头中特定的发射器-检测器对的列,Ex是荧光团的激发波长,和Em是发射波长,显然,邻近的发射波长在检测器头中彼此不邻近。排HRM的染料是空值仅仅指示可使用许多种染料——不是该特定实例所需要的。在一些实施方式中,HRM指“高分辨率熔解”,该光检测器的对应的光源可包括在紫外线光谱中操作的LED。人们将认识到,列可以以可选的变化被排列,发光源和检测器的可选的选择可被显示的那些替代。每个列的光-发射器和光检测器对可利用规格化装置板来校准。校准之后,检测器头可被移动到一位置以便第一列光-发射器和光检测器对位于第一组泳道之上,以便每个光-发射器和光检测器对接近泳道的反应室。第一组泳道中的反应室的检测然后将利用第一列发射器/检测器来进行。然后,检测器头可被移动到第二位置以便第一列在第二组泳道之上,和第二列在第一组泳道之上。第二组泳道中反应室的检测然后将利用第一列发射器/检测器来进行,和第一组泳道中反应室的检测然后将利用第二列发射器/检测器来进行。该过程可继续直到每列已经过每个泳道。因此,对于N列检测器和M列室,检测器将在至少M+N-1个位置进行检测。例如,在图11的实施方式中有6列。对于包括12个泳道的盒,检测器将需要在至少17个位置(如果考虑校准位置,则是18)之间运动。图7描述某些实施方式操作之后的最后结果。绘制与单个泳道连接的单个反应室(或反应器)的每个光发射器-光检测器对801-805随着时间的检测的荧光水平。退火和变性协议的足够数目的重复(在该实例中大约30)之后,检测器识别反应器内渐增水平的荧光。室板本实施方式的某些涉及电镀——包围和包括室层。特别地,某些实施方式考虑孔层的制造,该孔层包括有利地促进通过加热/检测模块试验的一致结果的特性,如下面所进一步详细讨论的。图8显示扫描热循环仪的光学模块和连接的接收托盘和盒的某些实施方式中的电镀排列。当将盒带到光学模块500a的孔层540的附近中时,可安置热层600、室层200(其可包括室基底)和孔层540,如图8的实施方式中所描述。如上面所讨论的,室层200可包括多个反应室1703a-d,其可被安置以被彼此分开地或成组地热控制。热层600可包括多个热单元1605a、1605b、1605c。图8是以上描述的简化的、概括的图,微流体路径的某些部件未显示。在某些实施方式中,热单元可机械地和热地彼此分离(如图4中它们的物理分离所显示的)。然而,在其它实施方式中,热单元均可被置于相同的基底材料内,但是间隔开以便它们保持热分离,如上面所讨论的。因此,热单元可能被热分离,但不是机械地分离。以该方式,可将每个热单元与一个或多个反应室1703a-d连接,与其余的反应室分开。按照针对每个反应室指定的协议,热单元可适当地连续加热和/或冷却它们对应的室。例如,热单元1605c可冷却和/或加热室1703a,以便室1703a的温度基本上独立于室1703a的冷却和热态。虽然加热可通过运行电流通过微流体或电子电路来实现,但是冷却可以是“被动的”,因为只有微流体室之间的对流和用于降低室的温度。热单元1605a、1605b、1605c可利用闭环控制系统来控制。在一些实施方式中,孔板540可位于室层200之上和可给该室层200提供压力以通过热层600促进微流体盒,例如,室层的加热和冷却。孔板可包括多个孔557a-d以促进个别反应室1703a-d的每个光检测器的726b观察。在缺少孔板540,和依赖热层600和室层200的配置的情况下,室层200可“翘曲”和/或充分地易弯曲,室和各自的热单元之间的热传播不一致。不一致的加热和冷却可导致协议较不准确的执行和较不精确和准确的结果。如上所述,显著的翘曲可限制光学头的侧面运动。因此,必须适当地选择孔板的厚度以促进每个反应室和光源和光检测器之间适当的光路,同时仍然确保室层的适当加热和冷却。如果孔层太厚,则光检测器726b到室的距离可太大,不期望的减少来自反应室的荧光读数。除了增加到反应室的距离,太厚或太重的孔层540将给反应室太多的压力,使对流太大。相反,如果孔层540太薄,则它不能防止室层200弯曲和翘曲,并且孔层540可使其自身弯曲和翘曲。孔557a-d或室1703a-d的翘曲可使来自光源726a的光偏离和妨碍光检测器726b的准确读数。相应地,本文描述的实施方式提供孔层,其有利地避免上面描述的缺点。在某些实施方式中,孔层540至少部分由钢制成。在这些实施方式中,钢提供适当的强度、密度和操作需要的对偏离的抵抗力。此外,钢可提供低的自身荧光和因此不太可能不利地影响光检测器726b的读数。钢还可被电化学地处理以减少其自身荧光和由此不太可能不利地影响光检测器的读数。在某些实施方式中,孔层可改为包括黑镍(Ni),即,着色剂加入其中以减少自身荧光的Ni。某些实施方式考虑这些不同的材料的组合和电化学处理。在某些实施方式中,孔层540由铝制成和当由邻接的支撑板500、506和546固定时,提供适当的强度。可将铝用阳极氧化物涂饰剂,例如,黑色着色剂——加入以减少自身荧光——电化学地电镀。可设计照明光学以便落在反应室或反应器上的激发光沿着与反应器形状相似的形状的区域是入射的。由于反应器可以是长的和窄的,所以照明点还可以是长的和窄的,即,也是伸长的。因此可既考虑下面的反应室的尺度,又考虑对应的光发射器和光检测器的相对位置来设计孔557a-d的形状。点的长度可通过改变许多因素来调节,包括:光检测器726b所置于的孔的直径(装有滤波器和透镜的管可具有孔径效应);从PCR反应器起的光检测器726b的距离;和光检测器726b中适当的透镜的使用。力部件在某些实施方式中,接收托盘520将室层200置于热层600或孔层540的附近,但没有机械地连接和/或由此彼此接触地放置这些层。以该方式,室层200可被热地,但不是机械地连接到热层600。在其它实施方式中,接收托盘放置热层600,与室层200机械的和热接触,室层与孔层540机械的接触。在各个实施方式中,装置可包括一个或多个力部件(未显示),其被配置以将压力施加给接收托盘520以将热源与位于接收托盘520中的微流体盒200热耦合。压力的施加对确保加热器基底和微流体盒200中反应室、门和阀等之间的连贯的热接触可以是重要的。当接收托盘520处于关闭的位置时,由此位于光学模块502的孔板540下面,力部件,如电动机组合件,在接收托盘520下面可开始向上朝着光学模块502移动,由此使接收托盘520更接近光学模块502。当接收托盘520向上朝着光学模块502移动时,盒200可开始与孔板540的底面接触。盒200可继续向上移动直到足够的压力在盒200上被接收。如上面所讨论的,孔板540可通过盒200的底部所有的点施加相等的压力和因此,用均匀的压力将盒200对着加热器基底600按压。如所讨论的,可选择孔层以具有促进该操作的性质。例如,当对着其按压时,孔板540的材料选择可提供盒200的非常小的偏离。对着加热器基底600,对盒200施加均匀压力可允许当期望时,盒部件中的每个均匀的加热。虽然均匀的压力和接触可在加热器基底600中的加热器和盒200中微流体网络的部件(阀、门、室等)之间获得,但是加热器不必同时激活,如上面所讨论的。在某些实施方式中,均匀压力的施加不必然导致盒200的不同部件的相等的加热。在一些实施方式中,加热器基底600中特定加热器的激活连同孔板540施加到盒200的压力激活盒200的特定部件。图9A-H是孔板的一个可能的实施方式的尺度的图。在该实施方式中,可施加化学转化涂层以调节孔层的反射性质。可选择一些部分9002以不接收化学转化涂层。涂层可被施加到板540的表面或遍及其材料放置。在一些实施方式中,板540的材料可包括钢。在其它实施方式中,板540可包括铝。仍然在其它实施方式中,板540的材料可包括镍。在一些实施方式中,板的材料可以是两种或多种材料——包括例如,铝、镍或钢——的组合。在图9A-H中显示的实施方式中,已选择了板的尺度以满足对上面讨论的检测器对关于室压力和光路的限制。板540的材料厚度在0.3125英寸开始和用机器向下加工到期望的厚度。如所指出的,板的大部分包括大约0.25英寸的厚度。然而该厚度可以改变,例如,孔开口557之上的厚度可以是0.19英寸。如上面所讨论的,孔开口厚度促进光检测器和光源之间未受阻碍的光路的到反应室的内容物。一般而言,选择孔板540的尺度以便结合组成孔板540的材料的性质,板540对下面的室板提供足够的压力以促进适当的加热和冷却以及足够的刚性以防止室板翘曲或变性。这样的变性可导致阻碍光源和光检测器光路到反应室。同时,板的尺度不应强加通过孔557从室层的反应室到光源和光检测器对的不利的距离。孔板的尺度540也不应阻挡从光源和光检测器对到室反应器内容物的光路。在一些实施方式中,可将规格化装置板546通过在位置9001插入螺丝或通过孔的其它固定方法与孔板连接。在其它实施方式中,这些位置较关于其余的孔,通过规格化装置板之上的孔可促进更宽的校准技术。图10显示图9A-H的孔板的透视图的各个尺度。如上面所讨论的,在该实施方式中,化学转化涂层可被首先施加以防止基底材料,例如,铝、镍或钢氧化,同时还为正确的电子学操作提供增强电子接地。然后只有可被暴露于光学操作的表面可选择性地用黑色阳极化涂布。诊断分析一致性本实施方式中的某些考虑确保通过相同加热器/检测器内和通过不同加热器/检测器的试验的一致诊断分析的方法。特别地,公开测定多个PCR协议的持续时间和偏移以使其间的检测同步的系统和方法的实施方式。另外,讨论调节反应器冷却时间以确保更一致结果的方法。图11是经历特定协议2000的反应室的温度廓线。如上面所显示的,操作中的系统可包括在不同反应室中同时运行的许多不同持续时间的许多不同协议。协议2000包括多个相同的加热/冷却循环,其中每个循环包括变性平稳时期2000B和退火平稳时期2000D,其中温度被保持恒定持续一段时间。非周期的协议循环可在这些循环之前,如温育时期。在某些实施方式中,协议可被指定为温度和时期的集合。即,协议可最初仅指定:室将保持在95℃B持续时间和然后保持在61℃D持续时间。某些实施方式考虑将这些段分成“步骤”和“子步骤”以促进用户和自动化控制。例如,加热和冷却循环2000B和D可被称作“步骤”,在95℃的持续时间B和在61℃的持续时间D被称作“子步骤”。在某些实施方式中,用户可指定子步骤的持续时间。在其它实施方式中,这些持续时间可从数据库取回。通常,这些时间从标准协议或通过用户输入,有时利用建立的温度和平稳时期的“菜谱”来确立。除了这些子步骤,协议的温度廓线还将包括过渡,如从61℃至95℃的过渡2000A和从95℃至61℃的过渡2000C。这些过渡的持续时间可以是反应室周围的材料和环境及利用的加热元件的性质的结果。在某些实施方式中,可在运行开始之前针对反应的完整性确定加热和冷却的热轨迹。在一些系统中,在反应自始至终监测和调节温度对时间的轮廓以最小化过渡温度,考虑不同加热元件的效率变化。换言之,一些系统利用反馈控制环路来达到靶温度,其中温度时间关系的实际轮廓可在循环之间变化。这样的调节可导致不同的总反应时间,和更重要地,不同的总反应效率。相应地,在一些实施方式中,本文描述的系统和方法有利地提供系统,其中在运行开始之前预设每个独立反应室(或一组室)的完全反应的温度对时间关系的轮廓。这不但有利地允许通过多个不同反应器的多个检测步骤的同步,而且它还赋予对参数的更严格的控制,其最小化作为不同的温度/时间轮廓的结果而发生的反应效率的差异。在一些实施方式中,如果当运行结束时测量的温度与期望值不同,本文提供的系统和方法在反应结束提供误差报告。在协议温度廓线2000中的各个点,用户或菜单可指定检测发生。例如,对于一些协议,可在段2000D结束时需要检测。如果检测在每个协议中被任意指定,那么检测器头将需要以效率低的方式在位置之间运动和可甚至发现不可能在要求的时间进行检测。即,如果多个协议中的每个将同时启动和同时通过盒中每个反应室平行运行,那么,检测器将非常效率低的满足每个协议的检测要求。特别地,一旦完成校准,则检测器将需要首先运动到适合对其针对第一廓线的阵列中每个光源-检测器对进行检测的位置。然而,到检测器完成时,剩余协议中的每个将进入检测将不进行的时期。因此将存在检测器不能进行任何检测和相反必须只是空闲的停下等待进行下一个检测机会的“停止时间”时期。该“停止时间”是无效率的和不必要地延长诊断过程。此外,当将进行连续的检测时,“停止时间”可产生相同室的不规则和不定期的检测,可能引入不一致的读数。本实施方式中的某些考虑对廓线2000的部分的自动化调节以促进通过多个协议的有效检测。这可通过允许用户编辑来实现,或系统可自动编辑段2000B或2000D的长度。应当理解,只要至少最小的平稳时间出现,平稳时间一些较小的延伸就可在大多数扩增协议中提供。该灵活性用于正被同时进行的不同测定的所有有效的供应,同时通过利用扫描检测器头读取各个测定而进行扩增的实时监测。如果检测将在段2000B期间进行,例如,系统或用户可在需要时延长段2000B的持续时间以提供检测器头运动和协调正被同时进行的多个测定的读数。段2000A和2000C的持续时间可利用预设的标准冷却速度从先前的温度来计算和并入分析。一些实施方式不允许用户编辑这些段,并且它们由系统内部地说明。在某些实施方式中,系统测定的协议调节可包括至少三种单独的形式。第一调节可包括“内循环调节”,其中延长协议的平稳时期如2000B和2000D以便全部步骤循环2000A-D达到期望的持续时间,在一些实例中,检测循环时间整数倍。相对于图13来描述该调节。一旦内循环调节完成,系统然后可进行“中间循环调节”。中间循环调节可确保每个循环内的检测事件发生在循环之间彼此分开的期望的持续时间的整数倍(如检测循环时间的整数倍)。相对于图14来讨论这些调节。第三调节可包括“起始偏移调节”,其可仅取决于用于协议执行的泳道。相对于图15A-C来讨论这些调节。协议调节概述图12描述用于公开的实施方式中的某些的过程4000的流程图以确定检测器检测时间和协议廓线的适当的解决方案。过程4000可在软件、硬件或二者的固件组合中执行。例如,该过程可在FPGA、微控制器或计算机处理器上运行的软件中的任意一个中执行。过程的部分可通过通用处理器,如微控制器来进行,而其它部分可通过专用硬件、软件或固件系统来进行。该过程通过测定系统4002的检测循环时间(或利用预设的检测循环时间,例如,已在存储器中)而开始4001。检测循环时间可包括检测器运动到每个检测位置(用图6六列中每列中的检测头中的每个发射器/检测器对的检测)、进行所有必需的检测和返回到初始位置所需要的时间。任选地,用户或系统可被允许对检测过程进行调节以修改检测循环时间。例如,用户可希望仅利用检测器的子集来进行检测。在一些实施方式中,当实施方式包括六列检测器对和使用所有六列时,检测循环时间是大约10秒。在一些实施方式中,该过程可首先对协议4003中的一个或多个确定多个“内循环调节”。如下面关于图13所讨论的,步骤或子步骤的持续时间可包括进行协议内特定步骤或子步骤的时间。循环时间可由用户详细说明和系统识别的限制的组合来确定。在某些实施方式中,系统将要求多个循环时间是检测循环时间整数倍。“内循环调节”可被引入以满足该限制。例如,如果检测循环时间是12.2秒,那么协议步骤的循环时间可以是22.4、33.6、44.8或任何其它N*12.2持续时间,其中N是大于0的整数。在一些实施方式中,当检测将在循环内进行时,仅必需施加该限制。因此,内循环调节保证协议循环是检测循环时间的整数倍。然而,可要求检测在循环内的任何点。如果检测循环时间是10秒,那么最早的检测可在协议启动之后10秒进行。检测然后可在该时间之后的整数倍(20、30、40秒等)进行。因此,进一步的调节,“中间循环”调节4004然后可被确定以保证要求的检测在适当的时间发生。这些“中间循环调节”可作为协议步骤或子步骤之间另外的延迟而被并入协议。不同地表达,一旦经历“内循环”调节,PCR协议可包括“有效的”循环步骤。PCR协议然后可通过将每个步骤拴在一起和在步骤之间加入过渡而产生。“中间循环调节”4004保证在循环已被拴在一起之后检测时间在期望的检测循环时间的整数倍发生。例如,对于具有10秒的检测循环时间的系统,协议可包括在进入循环的18秒具有其第一检测的步骤。循环持续时间(全部步骤的持续时间)可持续30秒(或许在“内循环”调节之后)。因此,虽然就整体而言循环时间适当地与10秒检测循环时间(3×0=30秒)匹配,但是第一检测自身没有适当地与检测匹配(18秒不是10秒的多倍)。系统会将2秒“中间循环”调节加入到第一检测运行,以便第一检测在协议开始之后20秒发生。这可通过“填补调节”延长先前步骤的最后保持温度另外的2秒来完成。如果不存在先前的步骤,那么系统会将在环境温度保持的2秒插入到循环的第一运行的开始。因此,如果系统在T0开始操作,那么第一检测将在T0+20秒发生,第二检测在T0+50秒发生等等。由于中间和内循环调节,协议现在处于这样形式以便检测将仅在检测器头方便运动到进行协议的反应室的时间而需要。假设所有协议在位于盒的第一列中的反应室(和足够数目的存在于检测器头中的检测器)中进行,那么内和中间循环调节单独将足以适当地修改有效检测的协议(这里第一列指泳道如图3A中与室1703a和1703b连接的泳道1706a和1706b的列)。然而,因为协议在盒的不同列中运行,所以另外必需偏移协议的启动以补偿在达到室位置中检测器头的延迟。因此基于协议在其中进行的室的位置将“起始调节偏移”加入协议。相对于图15A-C更详细地描述这些“起始调节偏移”4005。在一些实施方式中,这些调节在运行时间进行和仅依赖执行的泳道的位置。例如,对于在位于室的第一列的泳道中运行的协议,可不需要调节,所以这些泳道的室中运行的协议将具有+0秒的延迟的开始时间。由于检测(在该实施方式中不同时进行的在100毫秒两个检测的每个)和检测器电动机运动需要的时间(200毫秒),泳道的每个随后的列获得其距第一列的距离400毫秒的延迟。在该实例中,具有10秒的检测循环时间,泳道的每个列的第一可能的检测如下:列1具有在10秒的其第一检测,列2具有在10.4秒的其第一检测,列3具有在10.8秒的其第一检测等。通过对特定泳道延迟正确排列的协议的开始必需的时间,可保持期望的排列。虽然该具体实例假定协议已被排列(从调节4003和4004),但是技术人员将容易理解,其它实施方式可测定预期未来调节的偏移。虽然以步骤4003、4005和4004的顺序描述,但是人们将容易认识到,这些步骤可以被排列成任何其它合适的顺序,和都不需要系统连续地进行每个步骤。然而,在一些实施方式中,如上面所描述的,进行内循环调节之后可必需进行中间循环调节,因为中间循环调节依赖内循环修改。相比之下,起始-偏移调节4005可不依赖任何先前的测定。即,在一些实施方式中,起始偏移4005需要在运行时间仅被测定一次,而可对协议中每个循环步骤进行内循环调节4003和中间循环调节4004。在一些实施方式中,一旦协议时间已被适当地调节,过程然后就可以启动协议4006。在一些实施方式中,处理器可通过系统的单独的专用部件——其自身启动每个协议——简单地将偏移置于存储位置用于检索。内循环调节“内循环调节”包括对步骤或子步骤间隔的调节,其可已经由用户指定或从数据库取回,以便从整体而言步骤是预设的持续时间的整数倍。关于图13,在某些实施方式中,利用用户界面或图形用户界面(GUI),用户可指定协议廓线的某些特征,如协议子步骤的期望的时间。在一些实施方式中,系统然后可验证用户的选择。计算每个子步骤的段长度之后,系统软件将验证步骤循环时间和如果需要任何调节就指出。在一些实施方式中,“有效的”步骤循环时间是这样的步骤循环时间,其是检测循环时间的整数倍。如果步骤循环时间不是有效的,那么可促使用户对那个步骤5003b作出调节。如果不需要调节,那么可通知用户该步骤与5003a正确匹配。在图13的实例中,用户已要求温育步骤5001——包括900秒的单个子步骤。用户已要求该步骤5001仅发生一次5010,因此包括单个步骤循环。在该实例中,检测循环包括10秒。用户没有说明任何检测将被进行,因此该步骤是有效的,因为该步骤将不要求调节检测器头的位置。当不需要检测时,系统记录要求的时间间隔,用于以后的偏移考虑,但可以不施加间隔是多个检测时间的任何限制(虽然在测定随后的中间循环调节中可考虑持续时间)。然而,如果,在该实例中用户在该步骤期间已要求检测,如果没有招致其它延迟那么该步骤将仍然是有效的,因为900秒是多个10秒检测循环。在显示的实施方式中的任一个情况中,该系统已确定该步骤是有效的。在图13显示的实例中,步骤PCR5002包括两个子步骤:第一子步骤——其中将室保持在95℃和另一个子步骤——其中将室保持在61℃。用户已要求进行该步骤的45个循环5011。用户已要求第一子步骤持续2秒和第二子步骤持续10.2秒,总共12.2秒。如上面关于图7所讨论的,该系统可还已计算了从95℃至61℃的过渡时间和将该持续时间加入用户要求。在该实例中,从61℃至95℃的加热需要4.25秒和从95℃至61℃的冷却在7.05秒中。这些值可内部地存储在系统的存储器中或基于用户输入而动态地测定。最后,在一些实施方式中,当要求对子步骤5004检测时,由于用户此时已要求,所以系统加入另外的延迟以对该子步骤保持时间。在该实例中,延迟是2.2秒,其解释允许检测器运动和用检测器头中六列光发射器-光检测器对中的每个检测需要的最小时间。即,在该实例中,每种颜色检测需要200毫秒暴露时间和200毫秒以使电动机在列之间运动(5个过渡*200ms+6个检测*200ms=2.2秒)。因此,就整体而言步骤的总持续时间是:4.25(加热)+2.0(变性)+7.05(冷却)+10.2(退火)+2.2(检测)=25.7秒。由于25.7秒不是10秒检测时间的多倍,所以调节将是必需的。如5003b所指出的,系统通知用户它们可从步骤持续时间去除5.7秒或加入另外的4.3秒以达到多倍检测循环时间(即,10秒的多倍)。这些“内循环步骤调节”将在用户的选择之后被并入协议。人们将认识到,当提供给用户调节范围时,该系统可考虑该实例中未提到的多个其它因素。例如,可把对电动机运动或温育准备的另外的延迟作为因素考虑进系统分析。中间循环调节如上面所提到的,“中间循环调节”包括对子步骤的第一循环的调节以在循环步骤之间产生延迟。“中间循环调节”可依赖在前步骤的计时和紧前步骤(如果存在的话)的结束温度。关于图14将描述测定的以获得正确检测时间的“中间循环调节”6005。在一些实施方式中,调节6005通过首先测定将先前步骤结束的温度加热或冷却到下一步骤的第一子步骤温度需要的时间来测定。如果任何另外的时间对排列是必需的,那么可将先前步骤结束的温度保持持续该时间。在75℃的保持步骤的结束温度与95℃的第一子步骤温度之间的排列的实例显示在图14中。温度从点6001b到6001c以8℃/s从75℃爬到95℃,其余的时间是从点6001a到6001b先前步骤结束之后保持在75℃消耗的排列需要的时间。该时期可被称作“中间循环调节”。为了达到步骤之间检测排列的连续,可必需在先前步骤结束之后通过该“中间循环调节”改变(或延迟)步骤循环的开始。然后可计算将先前步骤结束的温度加热或冷却到下一步骤的第一子步骤温度需要的时间。如果排列需要任何另外的时间,那么将先前步骤结束的温度保持持续“中间循环调节”的时间。在一些实施方式中,当通过GUI5000收到用户输入时系统可将这些考虑作为因素包括进去和将它们并入提出的变化5003b。起始偏移调节图15A显示两个单独的协议廓线3001和3005的开始循环。在这些协议的每个中,可以已经进行了中间和内循环调节,但是起始偏移还未被应用。在该实例中,廓线3001包括具有30秒循环时间(从时间0到时间30的间隔)的步骤。检测3020a的时间或检测要求发生30秒。注意依据上面讨论的中间循环调节,就在针对第一检测3020a的排列的第一加热斜坡之前,小的延迟可已被包括进协议3001。如上面所讨论的,中间循环和内循环调节促进在检测循环时间的整数倍做出的检测要求。这里,对于10秒的检测循环时间,要求3020a和3020b发生在整数倍30和60秒。第二协议3005包括与3001的不同的廓线。廓线3005包括持续0至30秒的初始化步骤。然后廓线3005跟随多个50秒循环,在40秒进行第一检测。这些循环代表3-温度PCR,其包括在高温的变性、在低温的退火和检测、和然后在中间温度的延伸。如以前,第一初始化循环可包括在排列的开始小的中间循环延迟。人们将认识到中间循环延迟可在初始化步骤周围的多种位置插入以保证检测排列。图15B显示图15A的两个协议的多个实例。假设可能通过所有室列中的所有泳道同时进行检测,那么图15B中显示的廓线将是合适的。然而,由于检测器头通过具有其检测器对列中每个的室列扫描所需要的时间延迟,必需基于它们被实行的室的位置来偏移协议3001-3007中的每个。为了简单,假设协议3001-3007中的每个在邻近的列运行。如果协议3001在第一室列中运行,那么协议3002在第二室列中运行,3003在第三室列中运行,3004在第四室列中运行,等等。图15C显示协议3001-3007的执行,“起始偏移调节”3010-3015被引入以保证检测排列。起始偏移显示检测器通过盒的泳道的运动和用每个执行的协议需要的检测使该运动的同步化。因此,利用在请求3020a的第一检测器头列,协议3001将请求检测。当检测器头运动以将第二检测器头列与协议3001的室对齐时,第一检测器头列将被排列在3002的室之上,3002的室,有利地、现在也正请求检测3021a。随后,该过程继续进行现在正读取请求3022a的协议3003的检测器头的第一列、读取3002的第二列和读取3001的第三列。人们将认识到,图15C中显示的歪斜不是按比例的(在一些实施方式中,该歪斜可以是大约~400毫秒),和已被显示为仅用于说明的目的而显示。因此,用适当地选择的“起始调节”,系统可保证通过每个反应器连贯的检测时间。如图15C所显示的,当确定的解决方案由检测器系统执行时,沿着线3007a-d做出整齐的和有效的检测。因此,针对特定反应器的检测在循环之间将同时发生。确定这些解决方案的一个实施方式的细节将关于图16更详细地描述。主动的冷却在某些实施方式中,虽然反应器室的加热是主动的,即,将加热器主动地应用于室,但是反应器室的冷却可以是被动的,其中对流单独用于冷却反应器内容物。为了进一步提供连贯的诊断行为,某些实施方式考虑主动的参与反应器的冷却过程以保证连贯的行为。图16显示包括冷却组分的热廓线7001。廓线7001包括上升时间7006、平稳时期7005和冷却时期7002/7003。加热/检测单元位于的位置中的环境温度可以不相同。即,在南亚利桑那州运行的系统可以不经受与在北亚利桑那州运行的系统相同的环境温度。因此,在期望系统将在其中运行的最热的环境温度中,廓线7001可具有冷却曲线7003。在较凉的环境中,可产生冷却廓线7002。为了补偿差异,某些实施方式考虑通过温度传感器——可能是关于图3b讨论的那些——监测反应器冷却廓线。当检测到与最大廓线7003的偏差时,可施加充分的加热以便廓线7002跟随廓线7003。在一些实施方式中,热可在时间7004a-c被周期性地施加,而在其它实施方式中热可被连续施加。以该方式,可获得一致的廓线,而不管热循环仪的地理位置或运行环境温度如何。当应用加热器时,这些实施方式中的某些应用牛顿的冷却定律来测定:T(t)=Ta+(T(0)-Ta)e-rt其中:T(t)是在时间t的温度,T(0)是初始温度,Ta是环境温度参数,r是衰变常数参数,和t是时间。在一些实施方式中,50.2摄氏度和0.098可分别用作环境温度参数和衰变常数参数。在该实施方式中,选择环境温度参数高于任何期望的环境操作温度,因此允许通过在每个冷却循环期间施加至少一些少量热而完全控制冷却循环,不管环境温度如何,以将实际的冷却与每个实例中最大廓线7003的冷却曲线匹配。如本文所用,“输入”可以是,例如,从键盘、滚球、鼠标、声音识别系统或能将信息从用户传递给计算机的其它设备接收的数据。输入设备还可以是与显示器连接的触摸屏,在这种情况中用户通过触摸屏幕响应显示器上的提示。用户可通过输入设备如键盘或触摸屏而进入文本信息。本发明对于许多其它的通用目的或特殊用途的计算系统环境或配置是可操作的。可适合本发明使用的熟知的计算系统、环境和/或配置的实例包括,但不限于,微控制器、个人计算机、服务器计算机、手提式或膝上型计算机设备、多处理器系统、基于微处理器的系统、可编程的消费者电子产品、网络PCs、小型计算机、大型计算机、包括以上系统或设备中任何一个的分布的计算环境。如本文所用,“指令”指用于处理系统中信息的计算机执行的步骤。指令可在软件、固件或硬件中被执行和包括由系统的部件承担的任何类型的程序化步骤。“微处理器”或“处理器”可以是任何常规的通用目的单核或多核微处理器如处理器、CoreTM、8051处理器、处理器或处理器。另外,微处理器可以是任何常规的特殊用途微处理器如数字信号处理器或图形处理器。“处理器”还可指但不限于,微控制器、场可编程门阵列(FPGAs)、特定用途集成电路(ASICs)、复杂可编程逻辑器件(CPLDs)、可编程逻辑阵列(PLAs)、微处理器或其它相似的处理设备。系统由如下面详细讨论的多个模块构成。如本领域技术人员可以理解的,每个模块包括多个子例程、程序、定义性陈述和宏指令。每个模块通常被单独编译和连成单个可执行程序。因此,为了方便,每个模块的以下描述用于描述优选系统的功能性。因此,每个模块经历的过程可被任意地重新分配给其它模块之一,在单个模块中组合在一起或在,例如,可共享的动态链接库中可获得。系统的某些实施方式可以与多种操作系统如SNOWLINUX、UNIX或MICROSOFT或任何其它合适的操作系统一起使用。系统的某些实施方式可以以任何常规的编程语言如汇编语言、C、C++、BASIC、Pascal或Java来写,和在常规的操作系统等,或任何其它合适的编程语言下运行。另外,可将模块或指令存储到一个或多个可编程的存储设备上,如FLASH驱动器、CD-ROMs、硬盘和DVDs。一个实施方式包括将指令存储其上的可编程的存储设备。虽然以上过程和方法被描述包括某些步骤和以特定的顺序描述,但是将认识到这些过程和方法可包括另外的步骤或可省略描述的步骤中的一些。进一步,过程的每个步骤不必需以它被描述的顺序进行。虽然以上描述已显示、描述和指出如应用到各个实施方式的本发明的新的特征,但是将理解,显示的系统或方法的形式和细节的各种省略、替代和改变可由本领域技术人员作出而不背离本发明的精神。如将被认识到的,本发明可在不提供本文列出的所有特征和益处的形式内体现,因为一些特征可以与其它的分开使用或实施。与本文公开的实施方式一起描述的方法或算法的步骤可在处理器执行的硬件、软件模块中或二者的组合中直接体现。软件模块可存在于RAM存储器、闪存器、ROM存储器、EPROM存储器、EEPROM存储器、寄存器、硬盘、可移动的盘、CD-ROM或本领域已知的任何其它形式的存储介质中。示例的存储介质可以与处理器连接,这样的处理器可以从存储介质读取信息和将信息写到存储介质。在可选方案中,存储介质可与处理器集成。处理器和存储介质可存在于ASIC中。ASIC可存在于用户终端。在可选方案中,处理器和存储介质可作为分立元件存在于用户终端中。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1