一种利用一步法实时荧光定量RT‑qPCR检测丙型肝炎病毒核酸的试剂盒的制作方法
本发明涉及一种利用一步法实时荧光定量RT-qPCR技术快速检测丙型肝炎病毒核酸的试剂盒,属于生物医学检测领域。
背景技术:
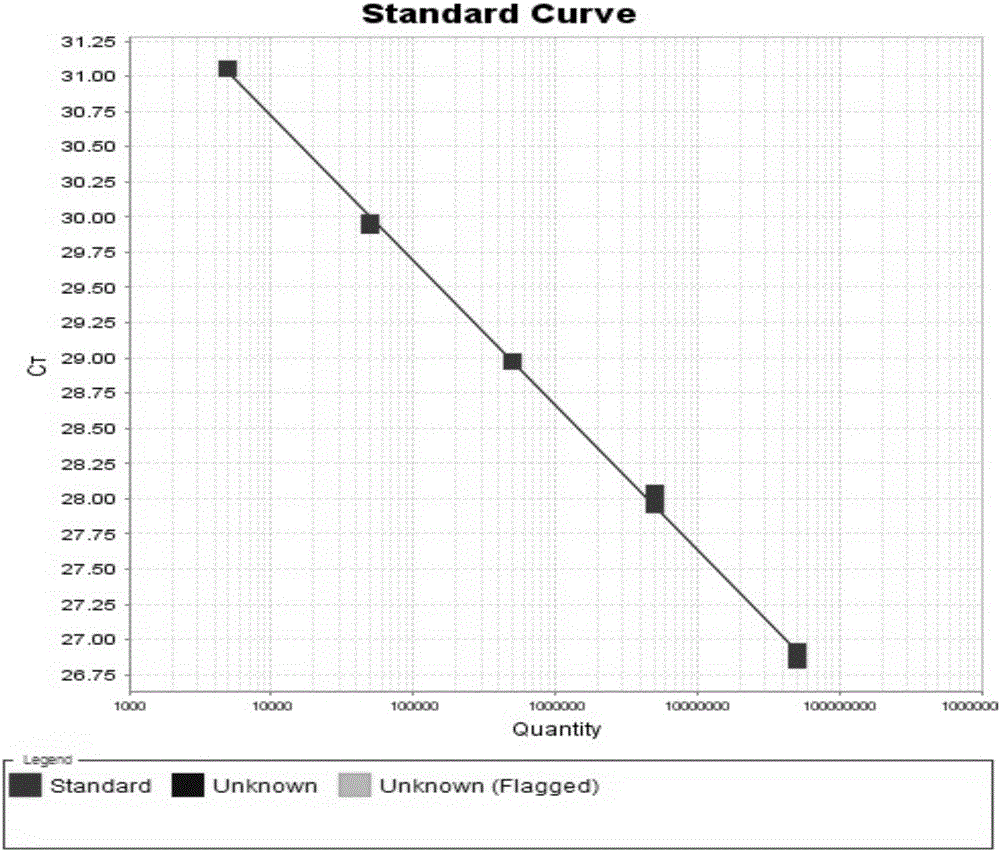
:丙型肝炎病毒(HepatitisCvirus,HCV)是最近十几年才发现的一种单链正股RNA病毒,1991年,国际病毒分类委员会将HCV归类于黄病毒科(Flaviviridae)。丙型肝炎病毒在受感染者血清及肝组织内数量较少,用电镜不易看到。经HCV-cDNA分析,HCV基因组全长9419bp,新近核苷酸序列分析研究证明至少存在6种HCV基因型和90种以上的亚型,我国的HCV基因型主要是II型和III型。与乙型肝炎病毒(HBV)相比,HCV存在许多生物学特性的差别。RNA病毒不如DNA病毒稳定,更易变异,因而更易慢性化。HCV感染者的病毒血症水平比HBV感染者低得多,因而感染力也弱得多。HCV是引起输血后非甲非乙型肝炎的主要病因之一。丙型肝炎呈全球性分布,无明确地理界限。全世界大约有1%的普通人群感染此病,约50%以上慢性肝炎是由HCV感染引起的。在美国,丙型肝炎发病率占急性病毒性肝炎的20~30%:我国由于对献血员筛选方法不够灵敏,输血后乙肝发病率占2/3,其余1/3为丙型肝炎,其中20~30%病人发展为肝硬化。目前临床上常用的HCV检测方法主要有两类:血清学方法(EIA或RIA)测定抗HCV或HCV编码蛋白及PCR法检测血清HCV-RNA。抗HCV酶联免疫(EIA)试剂是目前诊断丙肝的主要手段,普遍应用于检查血源和血液制品。抗HCV出现较慢,一般在发病后2—6月转阳,有的在12个月才出现阳性。自1989年研制了第一代抗HCVEIA试剂,目前已发展到第四代产品,此类试剂已被广泛应用。但由于HCV病毒的分离尚不成功,目前所制备的抗原均为人工合成,其特异性方面仍然存在不足,主要是在低危人群中发现大量的不确定结果;对于某些免疫球蛋白水平高的患者,也可能出现假阳性。试纸条免疫印迹试验(RIBA)现已有第二代试剂,灵敏度和特异性有所提高,主要用于ELISA检测可疑者,能帮助区别特异性HCV抗体和非特异性反应,是一确证试验。尽管HCV抗体检测方法虽然有了改进,但仍然存在局限性——“窗口期”长(50~70天),不利于早期诊断;而且只代表既往感染,可在病毒清除后仍长时间存在,有报道说该时间可长达9年,无法准确判别抗-HCV阳性者是否有病毒血症。鉴于抗体检测的缺陷,申请人已经开发上市了HCV总核心抗原检测试剂盒(将检测“窗口期”缩短到14天),并且正在研发HCV抗原抗体联合检测试剂盒。但HCV总核心抗原酶免检测同样存在抗原制备人工合成,比HCV核酸检测漏检率较多,窗口期仍较长等问题。基于此,更进一步早期诊断HCV感染和减少漏检率利用核酸诊断更为有效。与酶免诊断相比,核酸诊断(nucleicacidtest,简称NAT),具有更高的灵敏度和特异性,大大缩短了检测的窗口期,同时漏检概率极大缩小,有效保障输血安全。可以说,核酸诊断是保证血液安全的最后屏障。血清中的HCV-RNA是病毒复制和肝炎进程的确切标志。所以,检测血清HCV-RNA已成为诊断HCV病毒血症的“金标准”。HCV感染者血清病毒滴度通常很低,常规分子杂交技术难以检出HCV-RNA。近年发展的逆转录PCR(RT-PCR),巢式PCR(nestedPCR)技术将HCV-RNA检测的特异性和灵敏度大大提高,而荧光PCR的出现又将此检测技术推向了另一台阶。通过荧光定量PCR的方法直接检测HCV-RNA,大大提高HCV感染的检测准确性,有利于疾病的早期诊断,对“窗口期”(约12天)感染的筛选和提高输血安全也非常有意义。此外,在抗病毒药物治疗中,HCVRNA是对其疗效评价的指标之一;同时,治疗过程中,HCVRNA的动态监测还可为临床上的用药剂量、时间等提供依据。由于核酸诊断在技术上的优越性能,西方发达国家已经在大规模推广和使用核酸诊断,并且已经拥有多年的使用历史。相比较之下,我国起步晚、使用历史短,但跟随这一趋势是肯定的。经过多年摸索,我国已经具备了大规模推广的技术和市场条件。目前国内企业,如科华生物、湖南圣湘、广州达安等,也已经开发出HCV核酸定量检测产品,但是由于价格昂贵,普及程度尚低。进口核酸检测试剂更加昂贵,走国产化的道路又非常必要。国产核酸检测试剂的研制时间尚不长,在检测工艺、试剂的灵敏度、特异性等方面有待进一步改善。目前,国内上市的HCV核酸定量检测试剂盒中,以广州达安基因的试剂盒为例,灵敏度最低为250IU/mL,远远落后于欧洲肝病研究学会提出的50IU/mL的国际标准,无法为临床预后提供准确依据;上海科华、湖南圣湘的试剂盒虽然灵敏度达到甚至低于50IU/mL,但考虑到病毒核酸极易降解,这些试剂盒对病毒样本的要求极高,有严格的样本采集、运送、保存和处理流程。然而,在不同的地区、环境、人员的因素下,样本不可能达到如此严格的要求,极易发生核酸降解。对于此类不稳定样本,现有的商品化试剂盒的检测效率大大降低,甚至出现假阴性结果,不能准确地反映出病人血液中病毒的原始载量,给临床治疗带来很大误导。基于此,目前临床迫切需要一种丙型肝炎病毒核酸定量检测试剂盒,以实现即使在病毒核酸不稳定时,仍能最大限度地检出患者体内原始的病毒载量(检测出HCV所有已知六个基因型,而不会检测出非HCV病原体),为临床对HCV的诊断、治疗、预后提供准确依据。技术实现要素:针对现有技术的不足,本发明要解决的问题是提供一种利用一步法实时荧光定量RT-qPCR技术快速检测丙型肝炎病毒核酸的试剂盒,以实现完全快速检测出HCV所有已知6个基因型,而不会检测出非HCV病原体。本发明所述的利用一步法实时荧光定量RT-qPCR检测丙型肝炎病毒核酸的试剂盒,包括病毒核酸提取试剂,含检测靶多核苷酸和内对照的探针及用于扩增靶多核苷酸引物的RT-qPCR反应缓冲液,含热启动DNA聚合酶、RevertAidTMM-MLV反转录酶及RiboLockTM核糖核酸酶抑制剂的RT-PCR酶混合物,含假病毒颗粒的定量标准参考品;其特征在于:所述病毒核酸提取试剂由RNA提取溶液I、RNA提取溶液II和RNA提取溶液III组成;其中,RNA提取溶液I的配方为:异硫氰酸胍40~60克/100毫升,乙二胺四乙酸二钠0.74~1.49克/升,尿素0.6~1.5克/升,曲拉通X-1003~5毫升/100毫升,吐温-204~6毫升/100毫升,将所述各组分按比例称重后加入20毫摩尔pH7.0的三羟甲基氨基甲烷-盐酸缓冲液中,终体积为20毫升,其中单独包装200~800微克/毫升的磁珠、5.6~6.2微克/毫升的核酸助沉剂(ployA);RNA提取溶液II的配方为:盐酸胍3~5克/毫升,异丙醇3~5毫升/10毫升,将所述各组分按比例称量后加入DEPC处理超纯水中,终体积为40毫升;RNA提取溶液III的配方为:量取无水乙醇35~40毫升加入DEPC处理超纯水中使终体积为50毫升;所述RT-qPCR反应缓冲液的配方为:10×Buffer成分:三羟甲基氨基甲烷-盐酸(pH8.0at25℃):750毫摩尔硫酸铵:200毫摩尔吐温-20:0.1%(V/V);单独包装用于检测内对照的探针;其中:所述HCV-P为用于靶多核苷酸检测的探针,其核苷酸序列为SEQNo.1所示的序列:CACTCGCAAGCACCCTATCAGGCAG;所述HCV-F为用于扩增靶多核苷酸的上游引物,其核苷酸序列为SEQNo.2所示的序列:TAGCCGAGTAGTGTTGGGTYG;所述HCV-R为用于扩增靶多核苷酸的下游引物,其核苷酸序列为SEQNo.3所示的序列:TGCACGGTCTACGAGACCTC;所述用于检测内对照的探针其核苷酸序列为SEQNo.5所示的序列:TCACTGACGCCCATCCGTCCTACCT;所述RT-PCR酶混合物是按照下列比例混合各组分,然后加入体积比50%甘油混匀制成:所述含假病毒颗粒的定量标准参考品中用于全程监测反应的内对照假病毒颗粒与HCV阳性对照品仅探针结合序列不同,其核苷酸序列为SEQNo.4所示的序列:CGAGACTGCTAGCCGAGTAGTGTTGGGTCGCGAAAGGCCTTGTGGTATCACTGACGCCCATCCGTCCTACCTCCCCGGGAGGTCTCGTAGACCGTGCATC。上述利用一步法实时荧光定量RT-qPCR检测丙型肝炎病毒核酸的试剂盒中:所述RNA提取溶液I的配方优选为:异硫氰酸胍53克/100毫升,乙二胺四乙酸二钠0.74克/毫升,尿素0.6克/毫升,曲拉通X-1005毫升/100毫升,吐温-206毫升/100毫升,将所述各组分按比例称重后加入20毫摩尔pH7.0的三羟甲基氨基甲烷-盐酸缓冲液中,终体积为20毫升;RNA提取溶液II的配方优选为:盐酸胍3.2克/毫升,异丙醇5毫升/10毫升,将所述各组分按比例称量后加入DEPC处理超纯水中,终体积为40毫升;RNA提取溶液III的配方优选为:量取无水乙醇35毫升加入DEPC处理超纯水中使终体积为50毫升。上述利用一步法实时荧光定量RT-qPCR检测丙型肝炎病毒核酸的试剂盒中:所述一步法RT-qPCR反应液中探针引物混合物、RT-PCR反应缓冲液与RT-PCR酶混合物优选按体积比4:68:3的比例混合,反应总体积为20ul。上述利用一步法实时荧光定量RT-qPCR检测丙型肝炎病毒核酸的试剂盒在检测丙型肝炎病毒所有已知六个基因型核酸中的应用。本发明公开了一种利用一步法实时荧光定量RT-qPCR技术快速检测丙型肝炎病毒核酸的试剂盒,该试剂盒采用了一种新的引物探针设计策略,设计的引物和探针避开了HCV5'UTR区的二级结构和酶切位点,并且在保证保守性的基础上使目的片段的长度尽可能短,从而降低模板被酶切降解的几率;因而即使针对核酸不稳定样本,仍能最大限度地检出患者体内原始的病毒载量,具有很好的检出性。应用本发明的试剂盒,可以对血清、血浆等未知样本中的HCVRNA浓度进行快速、准确测定,特异性好,能够检测出所有HCV的六个基因型,可广泛适用于丙型肝炎病毒感染的辅助诊断和丙型肝炎病毒感染者药物治疗的疗效监测。此外,本试剂盒在核酸提取体系中加入了竞争性内对照,竞争PCR则能够有效控制核酸提取和PCR扩增效率的差异,有利于排除假阴性结果。此外,本试剂盒中的定量标准品为噬菌体病毒样颗粒,可以最大程度的模拟天然病毒的特性,可与临床样本一样,实现对核酸提取和扩增的全程质控,确保检测结果的真实可靠,为临床对HCV的诊断、治疗、预后提供了准确依据。综上,本发明的突出效果是:1)、基于HCVRNA的降解机制,设计了一种全新的丙型肝炎病毒靶序列探针和引物,该探针和引物创新性地避开了丙型肝炎病毒5’-UTR区容易引发降解的二级结构和内切酶位点,因此即使在病毒核酸不稳定的情况下,依然能最大限度地反映出其原始病毒载量。2)、公开了一种新的病毒核酸提取试剂和RNA抽提方法,该方法可以从微量样本中高效回收病毒RNA。3)、公开了RT-PCR反应液,该反应液与实施例中的扩增程序,可以使RNA检测灵敏度大大提高,由目前公开现行的500IU/ml提高到20IU/ml。附图说明图1:表示本发明提供的丙型肝炎病毒核酸定量检测试剂盒中定量参考品S1(5.0E+07IU/ml)、S2(5.0E+06IU/ml)、S3(5.0E+05IU/ml)和S4(5.0E+04IU/ml)的扩增曲线图。图2:表示本发明提供的丙型肝炎病毒核酸定量检测试剂盒中定量分析的标准曲线图。图3:表示本发明提供的丙型肝炎病毒核酸定量检测试剂盒检测的20例临床阳性样本和5例阴性样本的扩增曲线图。图4:表示10例正常人血清、5例甲型肝炎病毒抗体阳性血清(抗HAV+)、7例乙型肝炎表面抗原阳性血清(HBsAg+)、3例戊型肝炎病毒抗体阳性血清(抗HEV+)、3例人类免疫缺陷病毒抗体阳性血清(抗HIV+)样本的扩增曲线图。图5:表示本发明提供的丙型肝炎病毒核酸定量检测试剂盒检测20例降解前后丙肝核酸阳性血清样本的扩增曲线图。图6:表示本发明提供的丙型肝炎病毒核酸定量检测试剂盒检测20例降解前后丙肝核酸阳性血清样本检测值的散点图。具体实施方式下列实施例旨在举例说明而不是限制本发明。实施例1本发明所述的检测丙型肝炎病毒核酸的试剂盒的制备本发明所述利用一步法实时荧光定量RT-qPCR检测丙型肝炎病毒核酸的试剂盒,包括病毒核酸提取试剂,含检测靶多核苷酸和内对照的探针及用于扩增靶多核苷酸引物的RT-qPCR反应缓冲液,含热启动DNA聚合酶、RevertAidTMM-MLV反转录酶及RiboLockTM核糖核酸酶抑制剂的RT-PCR酶混合物,含假病毒颗粒的定量标准参考品,其制备方法如下:1.病毒核酸提取试剂的制备a.RNA提取溶液I:异硫氰酸胍40~60克/100毫升,乙二胺四乙酸二钠0.74~1.49克/升,尿素0.6~1.5克/升,曲拉通X-1003~5毫升/100毫升,吐温-204~6毫升/100毫升,将上述各组分按比例称重后加入20毫摩尔pH7.0的三羟甲基氨基甲烷-盐酸缓冲液中,终体积为20毫升。60℃孵育20分钟,期间每隔2分钟上下颠倒混匀(动作要轻避免产生大量泡沫),最后将溶液中置于垂直混匀仪室温混匀1小时。磁珠溶解于DEPC处理超纯水中(加入0.2%的叠氮钠用于抑菌)终浓度40毫克/毫升,单独玻璃瓶包装。核酸助沉剂(ployA)以310微克冻干粉形式储存于单独的冻存管中。优选地,本试剂盒中的RNA提取溶液I配方为:异硫氰酸胍53克/100毫升,乙二胺四乙酸二钠0.74克/毫升,尿素0.6克/毫升,曲拉通X-1005毫升/100毫升,吐温-206毫升/100毫升;b.RNA提取溶液II:盐酸胍3~5克/毫升,异丙醇3~5毫升/10毫升,将上述各组分按比例称量后加入DEPC处理超纯水中(无RNA酶水)使终体积为40毫升,充分振荡混匀30秒。优选地,本试剂盒中的RNA提取溶液II配方为:盐酸胍3.2克/毫升,异丙醇5毫升/10毫升;c.RNA提取溶液III:量取无水乙醇35~40毫升加入DEPC处理超纯水中使终体积为50毫升,充分振荡混匀30秒;优选地,本试剂盒中的RNA提取溶液III配方为:乙醇7毫升/10毫升;本试剂盒所采用的核酸提取液含有核酸助沉剂(ployA),能够有效保护样本核酸被降解,同时可以大大提高样本核酸的回收率,配合使用超顺纳米磁性微球,可以于血清、血浆、乳汁等微量样本中高效实现样本RNA提取和PCR检测。2.RT-qPCR反应液制备本发明提供的试剂盒中的RT-qPCR反应液包含用于靶多核苷酸检测的探针HCV-P,用于扩增靶多核苷酸的上游引物HCV-F和下游引物HCV-R。具体制备步骤如下:探针HCV-P(SEQNo.1:CACTCGCAAGCACCCTATCAGGCAG)由博尚生物上海实验室合成,5’端报告基团用FAM标记,3'端用BHQ1淬灭基团修饰。上游引物HCV-F(SEQNo.2:AGCCGAGTAGTGTTGGGTYG)和下游引物HCV-R(SEQNo.3:TGCACGGTCTACGAGACCTC)由博尚生物上海实验室合成,均采用高效液相色谱(HPLC)纯化。将合成的引物探针用DEPC处理超纯水溶解并使终浓度为10微摩尔,然后按照下述比例将各组分混合,振荡混匀即可。10×Buffer成分:三羟甲基氨基甲烷-盐酸(Tris-HCl缓冲液,pH8.0at25℃):750毫摩尔硫酸铵:200毫摩尔吐温-20:0.1%(V/V)单独包装用于检测内对照的探针,其核苷酸序列为SEQNo.5所示的序列:TCACTGACGCCCATCCGTCCTACCT。3.RT-PCR酶Mix制备RT-PCR酶Mix成份为:热启动DNA聚合酶、RevertAidTMM-MLV反转录酶及RiboLockTM核糖核酸酶抑制剂;优选地,RT-PCR酶Mix按照下列比例混合各组分,然后加入50%甘油混匀制成。4.定量参考标准品的制备本试剂盒标准品为假病毒颗粒,经HCV国家标准品(购自中国食品药品检定研究所)标定赋值。所述假病毒颗粒与HCV阳性对照品仅探针结合序列不同,其核苷酸序列为SEQNo.4所示的序列:CGAGACTGCTAGCCGAGTAGTGTTGGGTCGCGAAAGGCCTTGTGGTATCACTGACGCCCATCCGTCCTACCTCCCCGGGAGGTCTCGTAGACCGTGCATC。具体制作步骤如下:a.经博尚生物上海实验室合成包含MS2噬菌体基因组5’非编码区和基因组成熟酶蛋白、外壳蛋白和pac位点序列的DNA片段,并且使该片段在5’端包含KpnI酶切位点,3’端包含BamHI酶切位点。b.将合成的目的片段和质粒PET32a(购自Novagen)分别进行BamHI和KpnI双酶切,胶回收双酶切的目的片断和pET32a载体。c.将胶回收的目的片断和pET32a进行4℃T4DNA连接酶连接过夜,之后转化大肠杆菌感受态细胞。将转化后细菌培养液涂布于含氨苄青霉素的LB平板上,37℃培养14h,挑取单克隆菌落于LB液体培养基中,混匀后取1μL稀释菌液作模板进行PCR鉴定,反应结束后用琼脂糖凝胶电泳分析筛选出含有阳性重组质粒的单克隆菌。d.提取HCVRNA,用如下所列引物进行RT-PCR扩増,获得HCV5'-UTR区320nt(21~339)RT-PCR-F:AGCTGGATCCGACACTCCACCATGAATCACTCC(BamHI)RT-PCR-R:ATTGCGGCCGCTGCACGGTCTACGAGACCTC(NotI)反应采用大连宝生物OneStepPrimeScriptTMRT-PCRKit,以RNA为模板经一步法RT-PCR扩增得到目的序列,该目的序列片段在5’端包含BamHI酶切位点,3’端包含XhoI酶切位点。e.内含HCV目的片段的载体质粒将扩增获得的核酸片断和上步获得的重组载体加入BamHI和XhoI双酶切。将胶回收产物利用T4DNA连接酶连接。将连接产物转化大肠杆菌感受态细胞,将菌液涂布于氨苄抗性的平板上进行筛选。以菌液作模板进行PCR鉴定,反应结束后用琼脂糖凝胶电泳分析筛选出含有阳性重组质粒的单克隆菌。PCR鉴定的阳性单克隆菌液倒入LB培养基中37℃培养l0小时后提取质粒,抽提质粒采用Takara质粒小提试剂盒进行提取。将提取的质粒进行及BamH1/XhoI双酶切,琼脂糖凝胶电泳观察酶切结果,筛选阳性质粒送公司测序鉴定。f.重组质粒的转化和诱导表达将鉴定为阳性的重组表达质粒转化感受态细胞BL21(DE3),利用抗性筛选含有阳性质粒的表达菌。挑取阳性重组菌的单菌落于氨苄抗性的LB培养基中37℃培养过夜之后1:100稀释到氨苄抗性的LB培养基中,37℃250转/分钟振摇培养至对数生长期(OD600=0.6~0.8);加入终浓度为1毫摩尔/L的异丙基硫代-β-D半乳糖苷(IPTG),37℃250转/分钟振摇诱导培养4~6小时,离心收集菌体,利用裂解液(pH7.5)重悬菌体。g.重组质粒表达产物的初步制备收集诱导表达后的菌体进行超声波裂解,待菌液较清亮时,4℃1,5000转/分钟离心15分钟,收集上清转移到另一干净的离心管中,用0.45μm微孔滤膜过滤,分装得到含病毒样颗粒的表达产物。h.假病毒颗粒的纯化初步制备利用纤维素硫酸盐(Cellufinesulfate)病毒纯化亲和柱,去除了破碎表达产物中混有的其他细菌组分和大部分质粒DNA。将纯化所得洗脱液与HCV核酸国家标准品外标品进行实时荧光RT-PCR检测。将待测标准物质测定的Ct值引入标准曲线线性回归方程,计算获得其核酸拷贝数。选择RNA拷贝数在104-107之间的几管作为标准品,利用上述制备的标准品制作标准曲线,所得的标准曲线线性相关系数R2≥0.99(附图2),线性相关性很好。实施例2利用本发明的丙型肝炎病毒核酸定量检测试剂盒检测临床血清样本中的HCV-RNA浓度本实验中所有的阳性样本均为临床血清样本,收集于山东省立医院、山东省千佛山医院和山东大学齐鲁医院,样本HCV基因分型采用达安基因丙型肝炎病毒(HCV)基因分型检测试剂盒(PCR-荧光探针法)。样本信息见下表:本实验中的阴性样本包括:正常人血清、甲型肝炎病毒抗体阳性血清(抗HAV+)、乙型肝炎表面抗原阳性血清(HBsAg+)、戊型肝炎病毒抗体阳性血清(抗HEV+)、人类免疫缺陷病毒抗体阳性血清(抗HIV+)样本。各样本具体信息见下表:a.准备实验:1)本实验中所有用到的物品均需0.1%的DEPC水室温下搅拌处理24h。2)将处理过的物品,用明火消毒过的镊子转移到相应的盒子里或者架子上24h,包裹好,高温蒸汽灭菌45min,烤干备用。3)DEPC处理水的配置方法为0.1%的DEPC水混匀放置24h,高温蒸汽灭菌45min。b.程序扩增荧光定量PCR反应条件为:c.标本核酸提取1)分别取200μl上述样本及强阳性对照、临界阳性对照和阴性对照及定量参考标准品(样品需平衡至室温)至1.5ml洁净离心管(自备)中,做好标记;2)向离心管中加入50μlProteinaseK;3)向离心管中各加入300μlRNA提取液I和3.2μl内对照溶液,室温震荡孵育5min,然后加入150μl异丙醇,再加入50μlMyOneTMSILANE磁微球,室温上下颠倒混匀10min,简短离心,以收集附着在管壁及管盖的液体。4)将离心管放置于磁力架上静置2min,待磁珠完全吸附时小心去除液体。5)将离心管从磁力架上取下,加入650μlRNA提取液II,使用前先加入异丙醇,振荡混匀30sec。6)将离心管放置于磁力架上静置1min,磁珠完全吸附后,小心吸去液体。7)重复步骤5和6一次8)将离心管从磁力架上取下,加入600μlRNA提取液III,使用前已加入无水乙醇,振荡混匀30sec。9)将离心管放置于磁力架上静置1min,磁珠完全吸附后,小心吸去液体。10)重复步骤8和9一次。11)离心管于磁力架上,室温超净台中开盖晾干5-10min。12)将离心管从磁力架上取下,加入100μl洗脱液,小心混匀后70℃孵育3min,将离心管放置于磁力架上静置1min,磁珠完全吸附后,小心转移上清于一新的离心管中,做好标记。d.荧光定量RT-PCR检测1)配制反应体系准备反应预混合液:取一1.5mlEP管,根据标准品实验wells、对照实验wells和待测样本实验wells的总数n,配置n+1个反应体系,配好后轻轻混匀,每个反应体系的组成如下:准备反应板:准备好实验用8连管支架放于超净工作台中,按照实验设计的位置,把8连管牢牢安放于支架上相应位置。2)加样a)将配置好的反应液,分装与各well(15μl/well)。b)分别加入上步提取到的RNA溶液各5μl。d)取出8连管的caps,轻柔迅速的压在8连管上,用带有手套的手稳重地压下盖紧每个反应管。3)运行实验a)把在8连管中准备好的反应体系连带8连管直接支架一起平稳转移到荧光定量PCR仪的反应模块中。b)点击仪器软件开始设置反应程序。本实验中使用ABI7300Plus实时荧光定量PCR仪,参数设置如下:选择FAM(ReporterDye:FAMQuencherDye:none)ReporterDye2:VICQuencherDye:none参比荧光设置为ROXc)把反应模块轻轻推入仪器。在实验设计的程序右上角,点击标有“STARTRUN”的按钮运行实验。e.实验结果分析从附图3中可以看出所有阳性样本在FAM通道都有典型的S型扩增曲线,均有明显的指数扩增期,可明确判定为阳性;说明本试剂盒可以检出HCV全部6个基因型;各阳性样本的最后定量值见下表,把本试剂盒检测结果和样本原始数据做统计学分析,表明二组数据无显著差异,说明本试剂盒和其他商品化试剂盒结果具有高度一致性。另外,本试剂盒最低可以检出病毒载量为20.17IU/mL的样本,证实本试剂盒灵敏度达到20IU/mL。附图4中可以看出所有阴性样本均没有出现明显的指数扩增,无典型的S型扩增曲线软件,也未得到CT值。说明本试剂盒的特异性良好。各阳性样本的最后定量值见下表样本编号病毒载量IU/mL13.01E+0424.62E+0531.44E+0346.92E+0552.38E+0269.13E+0571.79E+0483.51E+0298.23E+021070.56115.03E+02121821323.69147.53E+04152.16E+061620.32182.85E+03194.66E+05201.94E+03实施例3利用本发明的试剂盒检测20例降解前后丙肝核酸阳性血清样本中HCV-RNA浓度1.样本处理A.稳定的HCVRNA样本的处理将HCV阳性患者的血液采集后立即离心,留取血清,分成两份。一份立即冻存于-80℃,作为稳定的HCVRNA样本。B.不稳定的HCVRNA样本的处理将上述的另一份血清在室温下放置过夜,然后于4℃冰箱放置6h,来模拟从样本采集到保存的不规范操作,作为不稳定的降解HCVRNA样本。2.样本核酸的提取1)取200μl上述各样本及强阳性对照、临界阳性对照和阴性对照及定量参考标准品于1.5ml离心管(自备)中2)向离心管中加入50μlProteinaseK(自备)3)向离心管中各加入300μlRNA提取液I和3.2μl内对照溶液,室温震荡孵育5min,然后加入150μl异丙醇,再加入50μlMyOneTMSILANE磁微球(注意:为了确保磁珠彻底重悬,请在使用前振荡混匀)上下颠倒混匀。37℃震荡孵育10min,简短离心,以收集附着在管壁及管盖的液体。4)将离心管放置于磁力架上静置2min,待磁珠完全吸附时小心去除液体。5)将离心管从磁力架上取下,加入650μlRNA提取液II(使用前请先检查是否已加入异丙醇),振荡混匀30sec。6)将离心管放置于磁力架上静置1min,磁珠完全吸附后,小心吸去液体。7)重复步骤5和6一次8)将离心管从磁力架上取下,加入600μlRNA提取液III(使用前请先检查是否已加入无水乙醇),振荡混匀30sec。9)将离心管放置于磁力架上静置1min,磁珠完全吸附后,小心吸去液体。10)重复步骤8和9一次。11)离心管于磁力架上,室温超净台中开盖晾干5-10min。12)将离心管从磁力架上取下,加入100μl洗脱液,小心混匀后70℃孵育3min,将离心管放置于磁力架上静置1min,磁珠完全吸附后,小心转移上清于一新的离心管中即可,做好标记。3.荧光定量RT-PCR体系配制:按照上述体系将除模板RNA外的其他试剂配制为混合液,振荡混匀后吸取15μl依次加入到96孔板中,然后按顺序加入提取所得的样本核酸5μl,小心地封好膜后短暂离心去除体系中的气泡。4.荧光定量RT-PCR反应将96孔板放入PCR仪样品槽中,点击仪器软件开始设置反应程序。本实验中使用ABI7300Plus实时荧光定量PCR仪,参数设置如下:选择FAM(ReporterDye:FAMQuencherDye:none)ReporterDye2:VICQuencherDye:none参比荧光设置为ROX。扩增温度参数设置如下:5.结果分析检测结果(见附图5):所有样品的FAM检测通路扩增曲线均呈S型扩增曲线,均有明显的指数扩增期,无未检出样本。20例临床样本的统计分析发现,其降解后的曲线与降解前的RNA定量值相差很小,附图6统计分析表明降解前后的检测值没有显著性差异(p>0.05),说明利用本发明试剂盒可使降解后的样本检测值最大限度接近降解前的检测值。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- 一种实时荧光定量PCR检测土壤西瓜枯萎病菌的方法及引物与制造工艺
- 一种基于反射镜的荧光定量PCR的检测系统的制造方法与工艺
- 一种基于荧光定量PCR鉴定啮齿类螺杆菌的引物、试剂盒及鉴定方法与流程
- 一种检测包含潜伏期结核感染的试剂盒及其引物对和探针的制造方法与工艺
- 用于甜瓜果实基因PCR表达分析的内参基因及该内参基因的稳定性验证方法与流程
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺
- TMEM209基因作为内参基因在定量检测稻螟赤眼蜂基因表达量中的应用的制作方法与工艺
- 蝗虫微孢子虫实时荧光定量PCR检测方法及试剂盒与流程
- ZFP基因作为内参基因在定量检测螟黄赤眼蜂基因表达量中的应用的制造方法与工艺
- 一种鸭新型腺病毒Eva Green实时荧光定量PCR检测的引物的制造方法与工艺
- 一种ampC基因的实时荧光定量PCR快速检测系统的制造方法与工艺
- RPS23基因作为内参基因在定量检测螟黄赤眼蜂基因表达量中的应用的制造方法与工艺
- 一种基于实时荧光PCR定量检测肉制品猪源性成分的方法与流程
- 一种用于基因测序的DNA荧光定量分析装置的制造方法
- 一种鲫鱼冠状病毒TaqMan实时荧光定量RT‑PCR检测引物及应用的制造方法与工艺
- 梨果实不同发育时期荧光定量内参基因的筛选及应用的制造方法与工艺