检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制作方法
本发明涉及生物医学领域,尤其是关于一种针对外周血CAR-T细胞的检测技术。
背景技术:
嵌合抗原受体T细胞免疫疗法(Chimeric Antigen Receptor T-Cell Immunotherapy,CAR-T)是近年来迅速发展的肿瘤过继免疫治疗方法。CAR-T治疗已成为治疗恶性肿瘤的一种新策略,特别是在血液肿瘤方面的贡献,主要涉及急性淋巴细胞白血病(ALL)、慢性淋巴细胞白血病(CLL)、B细胞淋巴瘤/白血病、霍奇金淋巴瘤和非霍奇金淋巴瘤。CAR-T疗法主要分4步:一是从肿瘤患者上分离免疫系统的T细胞;二是利用基因工程技术给T细胞加入一个能识别肿瘤细胞、同时激活T细胞杀死肿瘤细胞的嵌合体,成为CAR-T细胞;三是在体外选择、激活和大量扩增CAR-T细胞(一般一个病人需要几十亿乃至上百亿个CAR-T细胞);四是给肿瘤患者输注CAR-T细胞,发挥对肿瘤细胞的杀伤效应。
CAR-T细胞发挥杀伤肿瘤效应取决于患者体内的CAR-T细胞的数量和存活时间。而CAR-T细胞的扩增和存活受到诸多因素的影响,如最初输注的CAR-T细胞数量、输注前是否进行“淋巴细胞清除”以及病人的输注后的个体治疗等。相关研究报道新一代的CAR-T细胞能够在患者体内扩增超过1000倍,并能够到达骨髓,在体内保持较高的CAR功能达6个月。但外周血中CAR-T细胞数,在患者个体间的差异大,CAR-T细胞数量成为临床预后预测,疗效评价的一项重要的参数。
技术实现要素:
本发明提供一种新的外周血CAR-T细胞检测方法。
本发明提供一种检测外周血CAR-T细胞的TaqMan实时荧光定量PCR试剂盒,包括序列分别如SEQ ID NO:5、SEQ ID NO:6和SEQ ID NO:7所示的上游引物、下游引物及探针。
一种TaqMan实时荧光定量PCR试剂盒在外周血CAR-T细胞检测上的应用,所述试剂盒包括序列分别如SEQ ID NO:5、SEQ ID NO:6和SEQ ID NO:7所示的上游引物、下游引物及探针。最低的有效检测浓度为1.2×101copies/μL。
本发明的有益效果是:该TaqMan实时荧光定量PCR试剂盒具有取材量小、操作简便且检测周期短的优点,能够用于外周血CAR-T细胞的检测。
附图说明
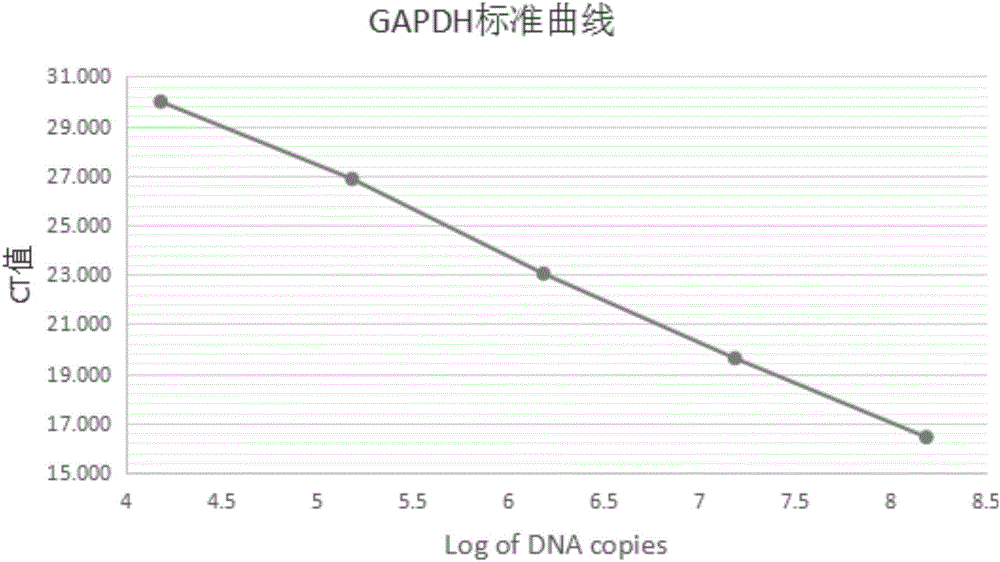
图1是GAPDH标准曲线图;
图2是CAR标准曲线图;
图3是不同样本的扩增曲线图,其中,A-G分别为浓度1.2×107-1.2×101copies/μL样本,即浓度分别为1.2×107copies/μL、1.2×106copies/μL、1.2×105copies/μL、1.2×104copies/μL、1.2×103copies/μL、1.2×102copies/μL和1.2×101copies/μL;H:1.2copies/μL样本;I:ddH2O样本;
图4是反映两例患者体内CAR-T细胞数随时间的变化情况图。
具体实施方式
下面通过具体实施方式结合附图对本发明作进一步详细说明。
1材料和方法
1.1样本、试剂及仪器
样本:选取2015年1月至2016年6月深圳市第二人民医院血液内科收治的进行CAR-T治疗的淋巴系统肿瘤患者,另随机选择来深圳市第二人民医院健康体检者的血液样本为对照组。
试剂:血液基因组DNA提取试剂盒(天根生化科技有限公司),DNA纯化回收试剂盒(天根生化科技有限公司),PCR Master试剂(TaKaRa公司),TaqMan Gene Expression Master Mix试剂(ABI公司),TaqMan Gene Expression Assay(Hs02758991_g1)试剂(ABI公司)。
仪器:ABI7500荧光定量PCR检测仪(ABI公司),Proflex PCR仪(ABI公司),NanoDrop2000c微量核酸蛋白分析仪(THERMO公司)。
1.2方法
1.2.1引物设计与合成
根据引物设计原则,采用Primer5软件完成引物设计,引物委托华大基因生物公司合成。采用Oligo7软件完成CAR基因探针设计,委托英潍捷基(上海)贸易有限公司合成。其中GAPDH基因探针及引物直接购于美国应用生物系统公司。
表1 PCR引物序列
1.2.2常规PCR产物回收及鉴定
参照试剂盒说明书进行操作用血液基因组DNA提取试剂盒提取CAR-T细胞的基因组DNA。
普通PCR方法扩增CAR基因(上下游引物序列分别如SEQ ID NO:1和SEQ ID NO:2所示)和内参GAPDH基因(上下游引物序列分别如SEQ ID NO:3和SEQ ID NO:4所示),分别制备标准品。引物序列如表1所示。反应体系:EmeraLdAmp pcr Master Mix(2×Premix)25μL,模板DNA 5μL,上下游引物(10μmol/L)各1μL,加入ddH2O至总反应体积50μL。进行以下扩增:95℃预变性10min,95℃变性30S,52℃退火60S(GAPDH基因为56℃退火60S),72℃延伸1min,扩增35个循环,72℃反应5min,4℃保存。
所获得扩增产物1.5%琼脂糖凝胶电泳,DNA纯化回收试剂盒回收,送英潍捷基公司测序验证,得到CAR基因和GAPDH基因标准品。
1.2.3TaqMan实时荧光定量PCR反应条件优化
标准品用ddH2O以10倍浓度梯度稀释作为实时荧光定量PCR模板,每个浓度3个复孔,以ddH2O作为阴性对照,进行TaqMan实时荧光定量PCR。
CAR基因检测:引物和探针序列如表1(序列如SEQ ID NO:5~7所示),总反应体系20μL:TaqMan Gene Expression Master Mix(2×)10μL、探针(10μmol/L)2μL、上下游引物(10μmol/L)各1μL、模板DNA 4μL,ddH2O 2μL。反应程序为:第一步,50℃2min;第二步,95℃10min;第三步,变性95℃15s,退火59℃30s,共进行40个循环。
GAPDH基因检测:引物和探针混于TaqMan Gene Expression Assay中。总反应体系20μL:TaqMan Gene Expression Master Mix(2×)10μl、TaqMan Gene Expression Assay(20×)2μL,DNA模板4μL,ddH2O 4μL。反应程序为:第一步,50℃2min;第二步,95℃10min;第三步,变性95℃15s,退火60℃60s,共进行40个循环。
1.2.4制作标准曲线
根据公式DNA拷贝数Y molecules/μL=[(DNA ng/μL)×10-9/基因碱基长度bp×660]×6.022×1023,算出两基因拷贝数为1.2×1010copies/μL(CAR基因)和1.5×1010copies/μL(GAPDH基因)。以DNA拷贝数为横坐标,CT值为纵坐标,制作标准曲线。为提高扩增效率与灵敏度,CAR基因产物选择稀释倍数105~109;GAPDH基因产物则取102~106浓度的产物(如表2所示)。
表2 两基因浓度表
1.2.5重复性实验
采用最优体系,以DNA浓度稀释105、107、109倍的样本进行重复性实验,每个浓度重复5次。测得的CT值进行统计学分析,以变异系数情况确定该反应的重复性。
1.2.6灵敏度实验
选择各个梯度的标准品和ddH2O作为模板进行实时荧光定量PCR,以CT值与水为模板有显著差别且出现较好S型增长曲线的最低浓度,为最低检测灵敏度。
1.2.7临床样本检测
用真空管(含EDTA抗凝剂)采集4名健康人以及2名CAR-T治疗的肿瘤患者各个时间点的外周血2mL。血液样本均由专业人员采集,低温运送至实验室,-80℃保存。每次200μL外周血提取基因组DNA,操作按血液基因组DNA提取试剂盒的步骤。利用已优化的TaqMan实时荧光定量PCR体系分别检测样本中的CAR基因和GAPDH基因。
2结果
2.1标准曲线
荧光定量PCR结果显示随着标准品DNA浓度被连续稀释而等比下降,所获取的荧光信号也近乎成比例地降低。GAPDH基因的回归方程y=-3.4349x+44.439,R2=0.999,扩增效率为95%(如图1所示)。CAR基因的回归方程分别为:y=-3.3682x+38.594,R2=0.999,扩增效率为98%(如图2所示)。
2.2重复性
重复性结果采用变异系数CV(%)评价,3个浓度的样本的5次CT结果都较为接近,变异系数CV均小于4%,说明本方法结果稳定,有良好的重复性(表3)。
表3 重复性实验结果表
2.3灵敏度
结果显示浓度为1.2copies/μL样本和水对应的曲线没有显著差别,两者CT值之差小于1。而1.2×107-1.2×101copies/μL的样本扩增曲线的CT值在36以内,且具有良好的线性关系(如图3所示)。据此,本实验最低有效检测浓度为1.2×101copies/μL,设定检测结果CT值大于36的样本为阴性样本。
2.4样本检测结果及拷贝数分析
2名患者共13例样本,其中12例样本都检测到CAR基因,只有一例没有检测到,怀疑跟输注时间相隔6个多月体内CAR-T细胞已衰耗有关;而4名健康人都未检测到CAR(如表4所示)。GAPDH基因是表达甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase)的管家基因,几乎在所有组织中都高水平表达,且一般保持恒定。理论上CAR基因和GAPDH基因一样在细胞内都以单拷贝形式存在,1个拷贝数代表1个细胞。CAR拷贝数代表CAR-T细胞数,GAPDH拷贝数代表外周血中的有核细胞总数。则CAR拷贝数与GAPDH拷贝数的比值,代表外周血中CAR-T细胞占有核细胞的比例。
表4 样本检测结果表
此外,以输注时间与标本时间的相隔天数为横坐标,以CAR-T细胞占外周血有核细胞比例(1/108)为纵坐标,作趋势图(如图4所示)。反映两例患者体内CAR-T细胞数随时间的变化情况。
3结论
目前常用的检测CAR-T细胞的方法包括免疫印迹法(Western blot)、流式细胞仪检测法、聚合酶链式反应(PCR)检测法等,但都存在不同程度的不足。比如Western blot无法测定具体的细胞量;流式细胞仪检测法是一种相对定量的方法,得到的结果是相对于总细胞的相对比例;而PCR检测法则相对敏感度低且难以定量。TaqMan实时荧光定量PCR技术,是在普通PCR的基础上另外加入一个特异性的荧光探针,该探针只与模板特异性地结合,其结合位点在两条引物之间,具有高度的特异性。
本实验方法血液样本的检测灵敏度为每4μLDNA溶液12个基因组拷贝,敏感度比其它方法高10-1000倍,检测样本用量少,能在尽量减少对患者伤害的情况下,实现准确定量。可望应用于临床上CAR-T治疗患者的治疗指导、疗效评估、病情预测等方面。
以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换。
SEQUENCE LISTING
<110> 深圳市第二人民医院
<120> 检测外周血CAR-T细胞的TaqMan实时荧光定量PCR试剂盒
<130> 16I23205
<160> 7
<170> PatentIn version 3.3
<210> 1
<211> 20
<212> DNA
<213> CAR上游引物
<400> 1
catcctccct gtctgcctct 20
<210> 2
<211> 20
<212> DNA
<213> CAR下游引物
<400> 2
gcctccgcca tcttatcttt 20
<210> 3
<211> 17
<212> DNA
<213> GAPDH上游引物
<400> 3
tgcattcgcc ctcttaa 17
<210> 4
<211> 18
<212> DNA
<213> GAPDH下游引物
<400> 4
catcacgcca cagtttcc 18
<210> 5
<211> 18
<212> DNA
<213> CAR荧光定量上游引物
<400> 5
ggattcgcca gcctccac 18
<210> 6
<211> 21
<212> DNA
<213> CAR荧光定量下游引物
<400> 6
aaacttggct cttggagttg t 21
<210> 7
<211> 21
<212> DNA
<213> CAR荧光定量探针
<400> 7
tcccagccac tccagaccct t 21
- 还没有人留言评论。精彩留言会获得点赞!