一种软骨素合酶突变体及其应用的制作方法
本发明涉及一种软骨素合酶突变体及其应用,属于生物工程技术领域。
背景技术:
软骨素(chondroitin)为糖胺聚糖(GAG)的多糖家族。糖胺聚糖是一类由重复的二糖单元组成的无支链的、带负电荷的多糖链,由于其独特的非柔性的性质和高的负电荷,GAG表现出高度延展的构象,占用大量空间,吸收阳离子和水并在细胞外基质中形成多孔的凝胶,在大多数动物中被发现的GAG帮助水合和扩展组织,并使基质能够承受压力(compressive force)。因此,糖胺聚糖组成了一类具有巨大治疗应用潜力的化合物。软骨素一种构为4-GlcA-β-1,3-GalNAc-β-1(GlcUA:葡糖醛酸,GalNAc:乙酰半乳糖胺)二糖单体以β-1,3键交替连接而成的聚多糖。硫酸软骨素(chondroitin sulfate,CS),是软骨素糖链生成后由磺基转移酶在GalNAc的碳4位或碳6位进行硫酸化。根据其化学组成和结构差异可分为A、B、C、D、E、F、H等多种,通常从哺乳动物组织中提取得到的硫酸软骨素以CS-A、CS-C为主。一般硫酸软骨素约含有50-70个双糖单位,分子量在10000-50000道尔顿之间。
硫酸软骨素是一类重要的生物高分子,具有广泛的生物活性,具有多种药理作用与生理功能。研究发现硫酸软骨素具有抗动脉粥样硬化作用,镇痛抗炎作用,促进成骨细胞增生,诱导新骨形成;抗肿瘤作用,免疫调节作用,抗氧化、清除自由基和廷缓衰老的作用,还具有抗炎、抗病毒、抗过敏和加速伤口愈合的作用,如抗HIV活性。随着对硫酸软骨素生理功能及生化性质的深入研究,在欧、美、日等发达国家,硫酸软骨素作为流行的保健品长期应,用于防治冠心病、心绞痛、心肌梗塞、冠状动脉机能不全、心肌缺血等疾病,无明显的毒副作用,能显著降低冠心病患者的发病率和死亡率,也做为膳食补充用于保护关节。尽管CS已有很多的药效,但小分子的CS药效更为显著。小分子的CS,以硫酸软骨素为主体构成的蛋白聚糖在软骨基质中起着一种“分子弹簧”的作用,具有止痛、促进软骨再生的功效,可从根本改善关节问题。且低分子量的CS,无论口服或者注射用,吸收效果均优于高分子量CS。
硫酸软骨素主要存在于动物的软骨组织中,硫酸软骨素的工业化生产主要是采用酶法与碱法相结合等传统的提取工艺,从气管、鼻中隔、鸡龙骨及鲨鱼软骨等动物软组织中提取硫酸软骨素。传统的提取方法造成软骨素的收率低,成本较高,且碱解产生的大量工业废水易对环境产生较大影响。同时,原材料的短缺和下游纯化工艺的复杂程度限制了该活性成分的全球利用度,因此市场受限于不能满足不断增长的需求。而且,从长远来看,由于不断颁布对动物来源药物的安全性日益严格的管理条例,动物组织提取获得的硫酸软骨素可能将被限制在生药市场之外。为此,采用安全有效的方法制备硫酸软骨素已成为需要首要解决的问题。这就迫切需求人们开始寻求新的替代途径。
自然界中许多真菌和细菌等微生物均能合成低聚合度的硫酸软骨素或其类似物,目前研究发现能产软骨素的微生物主要集中在巴斯德杆菌Pasteurellamultocida、大肠杆菌Escherichia coli K4。但作为工业生产菌株需具备:人畜安全;生长迅速,发酵周期短;遗传背景清楚;能大量合成硫酸软骨素或其类似物等条件。由于上述菌株都存在一定的致病性及大肠杆菌产内毒素及热源物质等,不能满足现在的食品医疗安全要求。因此本发明选用枯草芽孢杆菌这一食品级基因工程菌,具备上述条件。
技术实现要素:
本发明的第一个目的是提供一种软骨素合酶突变体,所述突变体是:(a)或(b)或(c):
(a)在SEQ ID NO.2所示序列基础上,A236-P246区域的氨基酸序列突变为DILDCDMAPYA,D461-D473区域的氨基酸序列突变为DLEVCTSEDGSPD,I600-Y609区域的氨基酸序列由突变为MTNAVDYDVG;
(b)在(a)限定的氨基酸序列中经过取代、缺失或者添加一个或几个氨基酸且具有软骨素合酶活性的由(a)衍生的蛋白质;
(c)与(a)限定的氨基酸序列具有85%及以上同源性且具有软骨素合酶活性的蛋白质。
本发明的第二个目的是提供编码所述软骨素合酶突变体的基因。
本发明的第三个目的是提供含有所述基因的载体或细胞。
本发明的第四个目的是提供获得所述软骨素合酶突变体的方法,所述方法对大肠杆菌K4来源的软骨素合酶A236-P246,D461-D473,G516-E530和I600-Y609区域进行组合突变。
在本发明的一种实施方式中,所述方法通过对大肠杆菌K4来源的软骨素合酶的所述区域中非保守氨基酸进行组合突变,并在枯草芽孢杆菌中异源表达。
在本发明的一种实施方式中,所述方法还包括对软骨素产量提高,分子量降低的突变体的高通量筛选。
本发明的第五个目的是提供一种重组表达所述软骨素合酶突变体的基因工程菌。
在本发明的一种实施方式中,所述基因工程菌以枯草芽孢杆菌Bacillus subtilis 168为宿主,以诱导型启动子PxylA启动编码软骨素合酶突变体的基因的表达。
在本发明的一种实施方式中,所述基因工程菌是利用具有整合于Bacillus subtilis 168上lacA位点的上下游同源臂和红霉素抗性标记的pAX01为表达载体。
本发明还提供了一种应用所述重组菌发酵生产软骨素的方法,是将重组菌接种至发酵培养基中,在37℃下培养54-80h。
在本发明的一种实施方式中,所述发酵培养基以蔗糖作为碳源。
在本发明的一种实施方式中,所述发酵培养基的组成成分为:20g/L酵母粉,50g/L蔗糖,硫酸钾3.9g/L,硫酸镁1.5g/L,50mM磷酸盐缓冲液,pH 7.0。
本发明还提供了所述突变体及含有该突变体的细胞株系在生产软骨素中的应用。
在本发明的一种实施方式中,所述重组枯草芽孢杆菌仅在基因组上整合表达SEQ ID NO.1所示合酶基因kfoC,并共表达SEQ ID NO.3所示半乳糖胺异构酶基因kfoA。
在本发明的一种实施方式中,所述重组枯草芽孢杆菌在基因组上整合表达软骨素合酶基因突变体库VkfoC,并共表达半乳糖胺异构酶基因kfoA,筛选得到1株软骨素产量提高,分子量降低的突变株,其突变后合酶基因为VkfoC1。
有益效果:本发明利用快速进化软骨素合酶在枯草芽孢杆菌中产软骨素,具有较大的应用优势。首先,本发明过程中使用的宿主为食品级,可满足医疗卫生和食品安全的要求,无内毒素和病原感染的风险;其次,经分子改造后的软骨素合酶,合成软骨素的产量有较大幅度的提高,并获得了分子量降低的产物,通过3L罐放大发酵,可以获得进一步提高的软骨素产量,3L罐上产物产量为7.25g/L,产物平均分子量为41.62kDa。基于应用分析,本发明方法在工业上用于制备高产量、低分子的软骨素具有潜在而广泛的价值。
附图说明
图1所示为高通量筛选中获得的产量正向突变株的软骨素产量趋势;
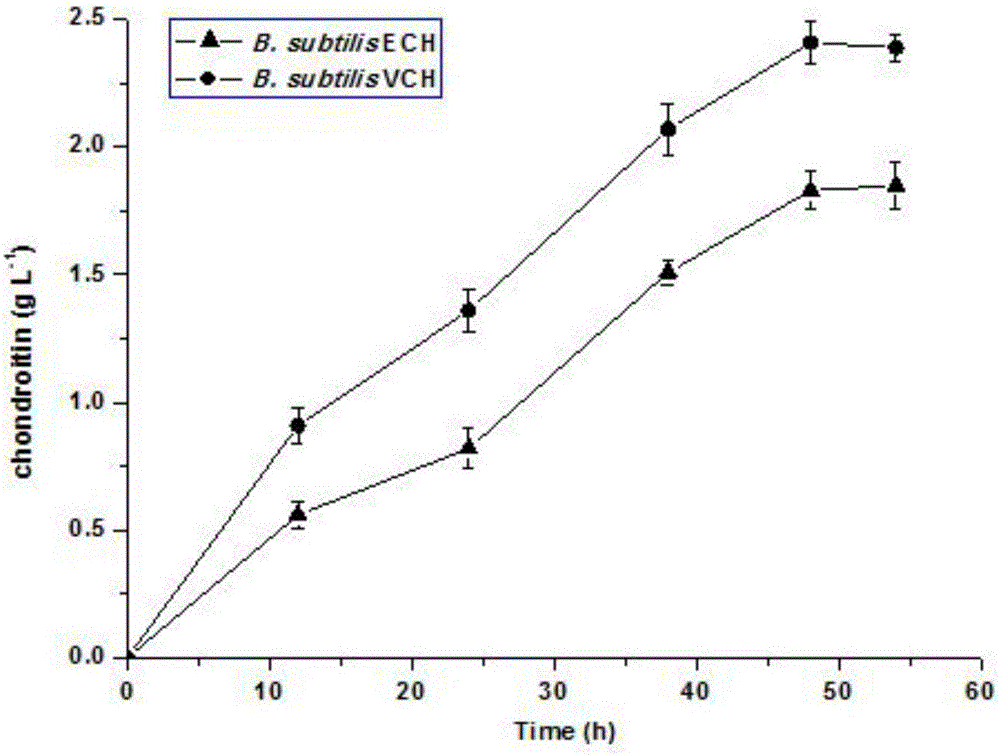
图2所示为摇瓶复筛中获得的1株产量提高、分子量减小的突变株B.subtilis VCH及野生菌株B.subtilis ECH的软骨素产量曲线;
图3所示为3L罐上突变株B.subtilis VCH和野生菌株B.subtilis ECH的细胞生长曲线和软骨素产量曲线。
具体实施方式
软骨素发酵产物分子量检测分析方法:采用高效体积排阻色谱-多角度激光散射进行分析,选择示差折光检测器RI,使用凝胶色谱柱Ultrahydrogel Linear进行分析。流动相选择0.1M硝酸钠进行洗脱,流速为0.5mL/min,柱子温度设定为50摄氏度,进样量为20μL,每个样品洗脱时间为20min,利用软件进行平均分子质量的计算。
实施例涉及的核苷酸序列信息:
(1)SEQ ID NO.1序列信息为来源于大肠杆菌K4(E.coli O5:K4(L):H4,E.coli K4)的软骨素合酶编码基因kfoC编码序列;
(2)SEQ ID NO.2序列信息为来源于大肠杆菌K4(E.coli O5:K4(L):H4,E.coli K4)的软骨素合酶KfoC的氨基酸序列;
(3)SEQ ID NO.3序列信息为来源于大肠杆菌K4(E.coli O5:K4(L):H4,E.coli K4)的半乳糖胺异构酶编码基因kfoA编码序列;
(4)SEQ ID NO.4序列信息为枯草芽孢杆菌诱导型启动子PxylA的基因序列;
实施例1大肠杆菌K4软骨素合酶的突变位点选择及突变体库构建
通过将大肠杆菌K4来源的软骨素合酶氨基酸序列与其它来源的软骨素合酶氨基酸序列进行BLAST比对,找出如下6个相对保守的基序,分别为L238DCDMAP244,D461LEVC465,D231GS-D235,G516QLDSDD522,P526DAVE530,N602AVDYD607。设计将这6个基序附近的非保守氨基酸同时进行突变,而保守位点不变,即选定4段区域A236-P246,D461-D473,G516-E530和I600-Y609进行组合突变。采用“RECODE”突变策略,设计4条简并引物,其中当三联密码子同时突变时应避免终止密码子,比如使用“VNN;V=A,C,G;N=A,T,C,G”,以构建的pAX01-kfoC-kfoA质粒(Efficient biosynthesis of polysaccharides chondroitin and heparosanby metabolically engineered Bacillus subtilis,Carbohydrate Polymers,2016,Jinpeng)为模板,分别扩增突变基因库VkfoC和载体pXYKA,pXYKA包括pAX01表达载体和kfoA基因。
引物序列信息:5’-3’方向
KfoC-F0:GGATCCGAGCTCCCGCGGGCATGTCTATCTTAAATCAAGC
MC-F1:
GCTAAATACAATTACGTCGCNATNCTTGATTGTGATATGGCACCTANCNCACTGTGGGTACAGTCCTAC
MC-F2:
TACAGACTTGGAAGTGTGCANCNGTGANGATGGTTCTNCTGACGACACTTTGCGGATA
MC-F3:
CTATATNGGGCAACTGGACTCTGATGACTTNNTGGNACCTGATGCAGTCGAACTTT
MC-F4:
GAAGGATTTAATGAGTCCATNNCAAACGCCGTGGATTACGATANGNACTTAAAGCTGTCCGAGGTGKfoC-R0:ATGTAAATGCCTCCTTTTTATTACAAATCGTTTTCGATTTTCTC
pXYKA-F:TAAAAAGGAGGCATTTACAT
pXYKA-R:GCCCGCGGGAGCTCGGATCC
RECODE突变时,先将简并引物磷酸化,体系50μL:300pmol各简并引物混合物,1×T4连接液buffer,8U多聚核苷酸激酶。37℃温育30min,75℃使酶失活10min。RECODE反应体系50μL:0.1μM各磷酸化兼并引物和上游锚定引物KfoC-F0,0.2μM反向引物KfoC-R0,0.01pmol DNA模板,1U Phusion DNA聚合酶,5UAmpligase热稳定性DNA连接酶,1×优化RECODE buffer(20mM Tris-HCl,25mM KCl,0.5mM NAD,2mM dNTPs,5mM Mg2+,0.1%Triton X-100,pH 8.3),一步PCR反应程序为:94℃,2min;94℃,30s;50℃,30s;72℃,2min;25个循环;66℃,3min;4℃,保持。PCR扩增获取的VkfoC基因突变体库和载体pXYKA进行Gibson一步组装,体系10μL:(0.01×bp/DNA浓度)μL载体,(0.02×bp/DNA浓度)μL片段,1μL Exnase II,2μL 5×CE buffer。37℃连接30min,冰上放置5min,转化E.coli JM109感受态细胞,收集所有重组质粒突变库,转化至B.subtilis 168细胞,以1μg/mL的红霉素平板进行筛选整合突变重组子,获得重组枯草芽孢杆菌突变库。
实施例2重组枯草芽孢杆菌突变库的高通量筛选与摇瓶复筛
挑取上述获得的1000个枯草芽孢杆菌突变株,单菌落接种于96浅孔板的LB培养基,置于200rpm 37℃过夜培养。按10%的接种量转接于96深孔板的发酵培养基中,并于发酵第2h加入终浓度2%木糖进行诱导,发酵培养基为:20g/L酵母粉,50g/L蔗糖,硫酸钾3.9g/L,硫酸镁1.5g/L,50mM磷酸盐缓冲液,pH 7.0。每个孔装液量不超过孔体积的1/3,且使用透气性良好的板盖,置于200rpm 37℃培养48h。
对于高通量筛选得到的正向突变株,进行摇瓶复筛,同时以原始株B.subtilis ECH作为对照,单克隆接种于5mL LB培养基,并加入2%葡萄糖和2%木糖,置于200rpm 37℃过夜培养。16h后按10%的接种量转接于250ml三角瓶,发酵培养基装液量为50mL,并于发酵第2h加入终浓度2%木糖进行诱导,发酵培养时间为48h,并间隔取样,取样时间为12h,24h,36h,48h,54h。
高通量筛选及摇瓶培养中,软骨素的收集与纯化方法为将96孔板或摇瓶中发酵液10000×g离心5min,上清液转移。向上清液中加入2倍体积的无水乙醇充分混匀,沉淀发酵液中的软骨素。4℃下静置1h,再10000×g下室温离心10min,倒掉上清,向沉淀中加入与发酵液等体积的超纯水充分溶解。
摇瓶发酵过程中各取样时间点的样品的软骨素含量采用Bitter-Muir硫酸咔唑法测定,同时96孔板中第48h发酵液中的软骨素含量也通过Bitter-Muir硫酸咔唑法进行批量测定,但体系按摇瓶发酵样品的测定体系成倍缩小,反应条件不变。摇瓶发酵样品测定方法为,在比色管中加入1ml硼砂硫酸试剂和200μl经一定倍数稀释后的软骨素样品,混匀后在沸水中煮15min后,冷却至室温,再加入50μl咔唑试剂,混匀后再在沸水中煮15min,冷却至室温,并在530nm处测定吸光值。利用标品硫酸软骨素A绘制标准曲线,根据标准曲线计算软骨素产量。在96深孔板筛选的1000株枯草芽孢杆菌突变株中,相比于野生型软骨素合酶KfoC所产软骨素的产量约0.97g/L,有6%的突变株产软骨素的产量明显提高(附图1)。
选出其中8株产量明显提高的突变株进行摇瓶复筛后,淘汰其中产量未见明显提高且分子量未见降低的突变株,获得仅一株突变株B.subtilis VCH所产软骨素产量明显提高,且分子量减小。通过Bitter-Muir硫酸咔唑法检测该突变株与对照株B.subtilis ECH各取样时间点软骨素的含量,并绘制产量随发酵时间变化曲线。同时采用HPSEC-MALLS测定第48h软骨素的质量平均分子量(Mw),数量平均分子量(Mn)和分散系数Ip。附图2显示原始菌B.subtilis ECH摇瓶上最高产量为1.83g/L,所产软骨素的Mw为83.51kDa。而突变株B.subtilis VCH摇瓶上最高产量达到2.41g/L,为原始菌的131.7%,所产软骨素的Mw为50.33kDa,比原始菌的产物分子量降低39.7%。
对突变株B.subtilis VCH中软骨素合酶进行测序,获知设计突变的4段区域中有3段发生了突变,由原来的A236ILDCDMAPNP246变为D236ILDCDMAPYA246;D461LEVCICDDGSTD473变为D461LEVCTSEDGSPD473,I600SNAVDYDMY609变为M600TNAVDYDVG609。由于软骨素合酶目前尚无相关结构分析,如酶晶体结构和拓扑结构分析,因此对于保守区域的讨论也仅停留在非理性层面,推测上述突变区域中氨基酸的改变可能造成了合酶对于底物结合能力的加强或催化能力提高。
实施例3产软骨素枯草芽孢杆菌突变株的3L罐发酵
挑取重组枯草芽孢杆菌菌株B.subtilis VCH,单克隆接种于15mL LB培养基,并加入2%葡萄糖和2%木糖,置于200rpm 37℃过夜培养。16h后按10%的接种量转接于500ml三角瓶,LB培养基装液量为150mL,同时加入2%葡萄糖和2%木糖,继续置于200rpm 37℃过夜培养作为种子液。16h后按10%的接种量转接于3L发酵罐,装液量为1.5L,37℃恒温培养,通气量为2vvm,通过5M NaOH溶液调节pH维持在7.0。前4h搅拌转速为400rpm,之后变为600rpm。第7h待初糖耗尽开始补料,第7-9h补料为10g/L/h,第10-12h补料为15g/L/h,第13-24h补料为8g/L/h,第25h以后至发酵结束补料均为5g/L/h,发酵时间为80h。取样时间为第2h,4h,6h,8h,12h,18h,24h,30h,36h,42h,48h,54h,60h,70h,78h,80h。分别测定各时间点取样样品的细胞密度OD600和软骨素产量,同时测定发酵终点的产物分子量(Mw)。测定细胞密度时,取1ml发酵液,8000×g离心10min,除去上清,将菌体用1ml ddH2O重悬,以ddH2O调零,在600nm处测定细胞密度OD600。软骨素产量按照实施例2中所述实施。从附图3中看出,菌体随时间延长而增加,到24h时菌体量达到最大,OD600约为45。软骨素产量呈持续增加状态,但与菌体生长非偶联,当菌体量恒定时,产量仍继续上升,在第78h时达到最大,为7.25g/L,为原始株B.subtilis ECH产量的139%,此后产量保持稳定,可停止发酵。对发酵结束时期第80h纯化产物的分子量Mw进行测定,结果为41.62kDa,较摇瓶上分子量低,可能因为3L罐发酵时搅拌剪切力的作用使多糖分子链减小。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!