一种C‑Ps单克隆抗体及其制备和应用的制作方法
本发明涉及生物技术技术领域,具体涉及一种可稳定分泌肺炎琏球菌C多糖(C-Ps)单克隆抗体的杂交瘤细胞株、C-Ps单克隆抗体及C-Ps检测试剂盒。
背景技术:
肺炎链球菌(Streptococcus pneumoniae)属革兰氏阳性菌,是引起肺炎、中耳炎、脑膜炎等疾病的常见病原体,严重时可引起非常高的死亡率,到目前为止肺炎球菌已经分离出90多种不同的血清型,其能否致病与荚膜有密切关系,因荚膜能抵抗人体内吞噬细胞的吞噬作用而大量繁殖,引起疾病。有荚膜和无荚膜肺炎球菌半数致死量的试验证明荚膜是肺炎球菌的主要毒力因子。肺炎链球菌C-多糖(C-Ps)是所有肺炎球菌血清型共有的抗原,因此可作为检测不同亚型肺炎球菌的抗原。
专利CN200510084709.5公开了一种采用肺炎链球菌菌株R6的C-多糖抗原亲和纯化的兔抗-肺炎链球菌菌株R6的抗体,并将上述抗体与金颗粒偶联,并以上述抗体制备样品捕获线,以山羊抗-家兔免疫球蛋白(IgG)制备对照线,制备了一种ICT装置用于检测肺炎链球菌抗原,由于采用的标记抗体和捕获抗菌均为多克隆抗体,特异性不高,检测的灵敏度和准确率也不高。
技术实现要素:
为克服现有技术的不足,本发明提供一种杂交瘤细胞株5B3B9,可稳定分泌C-多糖单克隆抗体,该杂交瘤细胞株于2016年7月21日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.12694。
所述的杂交瘤细胞由以下方法制备得到:
(1)抗原制备
采用哥伦比亚培血平板培养肺炎链球菌,用无菌生理盐水冲洗制成菌悬液,灭活;
(2)小鼠免疫
选用4-8周龄Balb/C小鼠,以步骤(1)灭活的肺炎链球菌菌悬液为免疫抗原,免疫剂量为50-200μl/只,免疫2-7次;
(3)细胞融合
取步骤(2)免疫后的小鼠脾细胞,与SP2/0骨髓瘤细胞,按照10:1~1:1的比例混合后,离心,加入PEG溶液,再加入RPMI-1640培养基,终止反应,离心,使用RPMI-1640培养基重悬,培养,次日加入HAT培养基稀释至工作浓度,培养至长出细胞团后测定细胞上清;
(4)杂交瘤细胞筛选
通过间接ELISA法测定步骤(3)的细胞上清中C-Ps抗体,筛选阳性母细胞株,采用有限稀释法进行克隆化确定阳性细胞株5B3B9;
(5)杂交瘤细胞鉴定
培养步骤(4)得到的5B3B9细胞株,吸取细胞上清,通过间接ELISA法,鉴定细胞阳性;
优选的,上述制备方法还包括:(6)杂交瘤细胞保存。
优选的,步骤(1)中,所述的哥伦比亚培血平板为含10%羊血的哥伦比亚培养基;所述的培养时间为18-20h;
优选的,所述的菌悬液浓度为1×107-1×109个细胞/ml,更优选为2×108个细胞/ml;
优选的,步骤(2)中,选用的小鼠为4-6周龄Balb/C雌性小鼠;免疫方式为小鼠腿部肌肉注射免疫抗原;免疫剂量为100μl/只;免疫次数为3次,更优选为每14天免疫1次,同剂量免疫3次;
优选的,步骤(3)中,免疫后的小鼠脾细胞与SP2/0骨髓瘤细胞的混合比例为5:2;所述的PEG溶液为PEG1450溶液;
优选的,步骤(3)和(4)中,所述的融合后的细胞培养条件为37℃、5%CO2培养箱中培养;
优选的,步骤(4)和(5)中,所述的间接ELISA法测定抗体的过程为:以碳酸盐缓冲液为包被液,将包被抗原标准品C-多糖,做倍比稀释包被ELISA板,100μl/孔,4℃过夜包被,次日拍干,洗板两次,37℃封闭1h后拍干;每孔依次加入100μl经倍比稀释的细胞上清,37℃封闭孵1h,PBST洗涤3次;辣根过氧化物酶标记的羊抗兔IgG加入每孔孵育1h,PBST洗涤4次;最后每孔加入100μlTMB显色液,暗处反应15min,终止反应,酶标仪检测波长为450nm处的吸光度值;更优选的,所述的筛选是以融合前小鼠血清100倍稀释作为阳性对照,以空白培养基作为阴性对照,筛选出细胞培养上清的OD450值高于阴性对照2.1倍且OD450值最高的阳性母细胞株。
在本发明的一个实施例中,所述的步骤(3)包括:无菌条件下取步骤(2)免疫后小鼠的脾脏研磨制备细胞悬液,与SP2/0骨髓瘤细胞,按照5:2的比例混合后,600-1000rpm离心5-10min,逐滴加入1ml PEG 1450溶液,再加入RPMI-1640培养基至20ml,终止反应,600-1000rpm离心5-10min,使用含20%胎牛血清的RPMI-1640培养基重悬,培养于96孔细胞培养板,每孔200μl,次日加入HAT培养基稀释至工作浓度,37℃、5%CO2培养箱中培养,待长出细胞团后测定细胞上清。
在本发明的一个实施例中,所述的步骤(4)包括:通过间接ELISA法,以融合前小鼠血清100倍稀释作为阳性对照,以空白培养基作为阴性对照,筛选出OD450值高于阴性对照2.1倍,且OD450值最高的阳性母细胞株,扩大培养至24孔板,培养至长满80%,有限稀释法稀释至每200μl包含1个杂交瘤细胞,37℃、5%CO2培养箱中培养,培养至长满80%-90%待长出细胞团后测定细胞上清;重复上述稀释培养方法三次,确定最终阳性细胞株 5B3B9细胞株。
优选的,步骤(6)中,以10%DMSO+90%胎牛血清作为冻存液,将经过步骤(5)鉴定的杂交瘤细胞做冻存于液氮中。
本发明还提供一种C-Ps单克隆抗体,所述单克隆抗体由上述杂交瘤细胞株5B3B9产生。
所述的C-Ps单克隆抗体由以下方法制备得到:
取上述杂交瘤细胞的悬浮液,腹腔注入Balb/C小鼠,小鼠腹部膨大后,处死小鼠,取其腹水,离心,取上清,纯化得到C-Ps单克隆抗体。
优选的,所述的小鼠腹腔注入杂交瘤细胞的悬浮液的剂量为0.1×106-5×106个细胞;更优选为1×106个细胞;
在本发明的一个实施例中,所述的C-Ps单克隆抗体由以下方法制备得到:
(1)取6-8周龄Balb/C小鼠,注射器吸取福氏不完全佐剂0.5ml于小鼠腹腔内注射;
(2)杂交瘤细胞培养7天左右时间,将培养细胞吹打下来,离心(600-1000r/min,8min),弃去上清,用无血清RPMI-1640培养液悬浮,并将细胞数调至2×106个,腹腔内注入0.5ml/只;
(3)小鼠接种杂交瘤细胞后8-15天,腹部膨大后,立即拉颈处死小鼠,对其腹部皮肤进行酒精棉消毒,无菌环境下用注射器吸取腹水;
(4)将收集的腹水混合,离心(9500r/min,30min)2遍,收集上清;
(5)采用Protein-A亲和层析法纯化上清中的抗体。
本发明还提供一种上述C-Ps单克隆抗体在C-Ps检测分析中的应用。
本发明还提供一种C-Ps的检测试剂盒,所述的试剂盒包括C-Ps单克隆抗体;
所述的C-Ps单克隆抗体可为现有技术中已公开的针对C-Ps的单克隆抗体,也可为本发明上述C-Ps单克隆抗体;优选为上述C-Ps单克隆抗体。
优选的,上述试剂盒还包括C-Ps的多克隆抗体和/或第二抗体,所述的C-Ps多克隆抗体可通过使用抗原免疫动物后从其血清中提纯得到,本领域技术人员可根据多克隆抗体的常规生产方法制备得到,本发明对此不作限定;所述的第二抗体为能与C-Ps单克隆抗体或多克隆抗体特异性结合的抗体,即抗C-Ps抗体的抗体;
优选的,上述试剂盒中的示踪标记物选自:放射性同位素、酶、荧光素、胶体金、化学或生物发光系统,被标记的物质可为抗原或抗体;更优选的优选胶体金为标记物。
在本发明的一个优选实施例中,所述的试剂盒包括胶体金试纸条,所述的试纸条包括样品垫、胶体金垫、层析膜、吸水垫、底板,所述的胶体金垫包覆有胶体金标记的抗体,所述的层析膜包被有检测抗体和质控抗体;所述的标记抗体为C-Ps多克隆抗体,检测抗体为C-Ps单克隆抗体,质控抗体为二抗;或,所述的标记抗体为C-Ps单克隆抗体,检测抗体为C-Ps多克隆抗体,质控抗体为二抗;优选的,所述的标记抗体为C-Ps多克隆抗体,所述的检测抗体为C-Ps单克隆抗体;
优选的,所述的质控抗体为羊抗兔IgG抗体;
优选的,所述的底板为聚氯乙烯(PVC)底板;和/或,所述的胶体金垫为玻璃纤维膜;和/或,所述的层析膜为硝酸纤维素(NC)膜,所述的NC膜上包被有检测线和质控线;和/或,所述的样品垫为玻璃纤维膜;和/或,所述的吸水垫为吸水纸;
优选的,所述的检测线和质控线的间距为2-4mm;
优选的,所述的样品垫、胶体金垫、层析膜、吸水垫依次贴附在底板上;所述的层析膜的非点样面贴附于底板上;和/或,所述的胶体金垫与层析膜之间重叠1-3mm,优选为1mm;和/或,所述的吸水垫与层析膜之间重叠1-3mm,优选为2mm;和/或,所述的样品垫与胶体金垫之间重叠1-3mm,优选为2mm;
优选的,所述的胶体金试纸的宽度为2-6mm,优选为4mm。
在本发明的另一个实施例中,所述试剂盒采用酶作为标记物,可用于C-Ps的定量检测,所述的试剂盒中还包括:固相载体、包被液、洗涤液、封闭液、底物溶液等,本领域技术人员可根据实际需要选择固相载体的形式和材质(形式如微孔板、小试管、微珠或膜等,材质如聚苯乙烯、聚氯乙烯、聚丙烯等)、包被缓冲液(如碳酸盐缓冲液、Tris-HCl缓冲液)、洗涤液(如PBS、PBST)、封闭液(如BSA、明胶、脱脂奶粉、小牛血清、Casein、Tween-20等)的溶质成分、pH、浓度等,及选择和加入其它试剂等,本发明对此不作限定。
本领域技术人员也可采用其他标记方式(如放射标记、荧光标记、化学发光标记等)和免疫检测分析方法利用本发明的C-Ps单克隆抗体制备相应检测试剂盒用于C-Ps的定性和定量检测,所述试剂盒也在本发明的保护范围内。
本发明还提供一种上述C-Ps检测试剂盒在C-Ps检测分析中的应用,所述的检测分析包括定性检测和定量检测。
本发明提供的杂交瘤细胞株5B3B9可稳定分泌C-Ps单克隆抗体,本发明提供的C-Ps单克隆抗体特异性强,制备方法简单,可用于C-Ps的免疫学检测分析,由所述单克隆抗体制备的C-Ps检测试剂盒,特别是胶体金免疫检测体系,使用方便,检测准确率和灵敏度高,稳定性好。
附图说明
图1所示为本发明实施例2的SDS-PAGE电泳图;
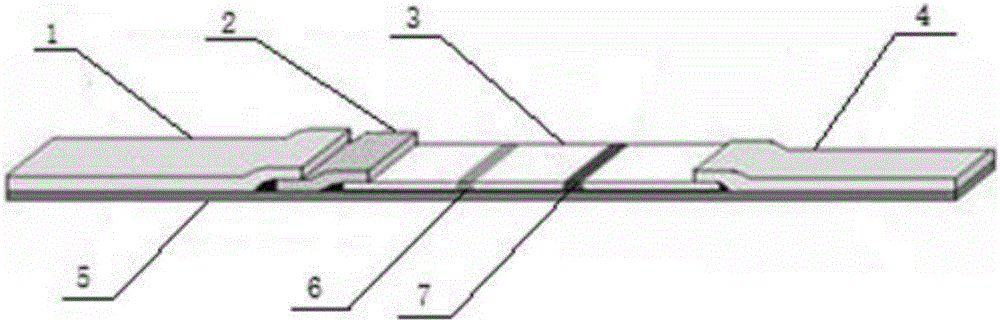
图2所示为本发明实施例4的胶体金免疫试纸条的结构示意图;其中,1-样品垫,2-胶体金垫,3-NC膜,4-吸水垫,5-PVC底板,6-检测线T,7-质控线C。
生物保藏:
杂交瘤细胞株5B3B9,
于2016年7月21日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.12694。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1杂交瘤细胞的制备、筛选和鉴定
1材料和方法
1.1材料
细胞培养基及添加剂:RPMI-1640、新生牛血清、HAT筛选培养基、PEG1450溶液;
试剂:小鼠快速免疫佐剂,标准C-Ps;SDS-PAGE药品;
抗体:辣根过氧化物酶(HRP)标记的羊抗小鼠IgG;
细胞株:SP2/0AG14小鼠骨髓瘤细胞;
器材:CK41倒置相差显微镜;二氧化碳培养箱;96孔聚苯乙烯酶标板;24孔培养板;电泳及免疫印迹设备。
1.2方法
1.2.1抗原的制备
哥伦比亚培血平板(含10%羊血的哥伦比亚培养基)培养肺炎链球菌(ATCC 39938,购自ATCC)18-20h,无菌生理盐水冲洗制成菌悬液,血球计数板调整细菌浓度为2×108个/ml,热灭活。
1.2.2杂交瘤细胞的制备
1.2.2.1Balb/C小鼠免疫
选用4-6周龄Balb/C雌性小鼠,采用上步制备的抗原免疫,免疫剂量为100μl/只。每12-16天免疫一次,同剂量免疫三次。
1.2.2.2SP2/0细胞融合
无菌条件下取上步免疫后小鼠的脾脏研磨制备细胞悬液,与SP2/0细胞按照10:1-10:3的比例(体积)混合后,600-1000rpm离心5-10min,逐滴加入1-2mlPEG1450溶液,再加入RPMI-1640培养基至20ml,终止反应,600-1000rpm离心5-10min,使用含20%胎牛血清的RPMI-1640培养基重悬,培养于96孔细胞培养板,每孔200μl,次日加入HAT培养基稀释至工作浓度,37℃、5%CO2培养箱中培养,待长出细胞团后测定细胞上清中抗体。
1.2.2.3杂交瘤细胞筛选
通过间接ELISA法测定抗体,以碳酸盐缓冲液为包被液,将包被抗原标准品C-多糖,做倍比稀释包被ELISA板,100μl/孔,4℃过夜包被,次日拍干,洗板两次,37℃封闭1h后拍干;每孔依次加入100μl经3倍比稀释的细胞上清(1:100、1:300、1:900、1:2700、1:8100、1:24300、1:72900,1%BSA作为空白对照)、融合前小鼠血清100倍稀释液、空白培养基,37℃封闭孵育1h,PBST洗涤3次;辣根过氧化物酶标记的羊抗兔IgG加入每孔孵育1h,PBST洗涤4次;最后每孔加入100μlTMB显色液,暗处反应15min,终止反应,酶标仪检测波长为450nm处的吸光度值。以融合前小鼠血清100倍稀释作为阳性对照,以空白培养基作为阴性对照,筛选出OD450值高于阴性对照2.1倍且OD450值最高的阳性母细胞株,扩大培养至24孔板,培养至长满80%,有限稀释法稀释至每200μl中包含1个杂交瘤细胞,铺5块96孔板,37℃、5%CO2培养箱中培养,培养至长满80%,待长出细胞团后测定细胞上清抗体。重复上述稀释培养方法三次,确定可稳定分泌C-Ps单克隆抗体的最终阳性细胞株5B3B9细胞株。
1.2.2.4杂交瘤细胞鉴定及冻存
将定株后的5B3B9细胞株培养至长满80%-90%10cm细胞培养皿,吸取 细胞上清,通过间接ELISA法,以融合前小鼠血清100倍稀释作为阳性对照,以空白培养基作为阴性对照,鉴定细胞阳性(参考1.2.2.3杂交瘤细胞筛选过程),并以10%DMSO+90%胎牛血清作为冻存液,将鉴定的杂交瘤细胞冻存于液氮中。
实施例2C-Ps单克隆抗体的制备、纯化及特性分析
1材料和方法
1.1材料
细胞培养基:RPMI-1640、新生牛血清9:1-7:1配比制成杂交瘤细胞完全培养基;
试剂:福氏不完全佐剂;SDS-PAGE药品;
实验动物:严格无菌繁育的6-8周龄Balb/C小白鼠;
抗体:辣根过氧化物酶(HRP)标记的羊抗小鼠IgG;
杂交瘤细胞株:实施例1制备的杂交瘤细胞株5B3B9;
器材:CK41倒置相差显微镜;二氧化碳培养箱;96孔聚苯乙烯酶标板;24孔培养板;电泳及免疫印迹设备。
1.2方法
1.2.1单克隆抗体的制备
1.2.1.1杂交瘤细胞的复苏
将-80℃超低温冰箱中保存的杂交瘤细胞株5B3B9取出,放入37℃水浴锅中迅速解冻,800-1000r/min离心5min后,弃上清,用RPMI-1640完全培养基配成细胞悬液并转入24孔培养板内,于37℃、5%CO2培养箱中培养。次日更换一次培养液,继续培养。待复苏细胞长势良好,形态饱满、透亮、粒圆,2-4d传代培养。
1.2.1.2腹水的制备
(1)取6-8周龄Balb/C小白鼠,注射器吸取福氏不完全佐剂0.5ml于小白鼠腹腔内注射;
(2)杂交瘤细胞培养7天左右时间,将培养细胞吹打下来,离心(800r/min,8min),弃去上清,用无血清RPMI-1640培养液悬浮,并将细胞数调至2×106个/ml,小鼠腹腔内注入0.5ml/只;
(3)小白鼠接种杂交瘤细胞后8-15天,腹部膨大后,立即拉颈处死小鼠,对其腹部皮肤进行酒精棉消毒,无菌环境下用注射器吸取腹水;
(4)将收集的腹水混合,离心(9500r/min,30min)3遍,收集上清,不要吸取离心管最上层的不溶物质,放于-80℃超低温冰箱中冻存备用。
1.2.2腹水的纯化、浓度鉴定
1.2.2.1腹水的纯化鉴定
采用Protein-A亲和层析法纯化抗体。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)法测定纯化后单克隆抗体的纯度,如图1所示,左侧泳道为Marker蛋白,右侧泳道为上述单克隆抗体,在54KD左右处条带清晰,单克隆抗体的浓度较高。
1.2.2.2纯化后单克隆抗体浓度的测定
采用Bradford试剂盒测定多克隆抗体的纯度,按照试剂盒说明书进行操作。
1.2.2.3纯化后单克隆抗体效价的测定
通过间接ELISA法测定纯化后的单克隆抗体效价,以碳酸盐缓冲液为包被液,将包被抗原标准品C-多糖,做倍比稀释包被ELISA板,100μl/孔,4℃过夜包被,次日拍干,洗板两次,37℃封闭1h后拍干;每孔依次加入100μl经3倍比稀释的单克隆抗体(1:100、1:300、1:900、1:2700、1:8100、1:24300、1:72900,1%BSA作为空白对照),37℃封闭孵育1h,PBST洗涤3次;辣根过氧化物酶标记的羊抗兔IgG加入每孔孵育1h,PBST洗涤4次;最后每孔加入100μlTMB显色液,暗处反应15min,终止反应,酶标仪检测波长为450nm处的吸光度值,计算每个孔的P/N值,P/N≥2.1时抗体最大稀释倍数即为单克隆抗体的效价,检测如表1所示。由表1中结 果数据可知,上述单克隆抗体的效价较高,大于1:24300。
表1纯化后单克隆抗体效价的测定结果
实施例3C-Ps多克隆抗体的制备、纯化及特性分析
1材料和方法
1.1材料
培养基:哥伦比亚培养基、羊血;
试剂:快速免疫佐剂、酶标羊抗兔IgG;
实验动物:新西兰大耳白兔(雌性,2-3kg);
菌株:肺炎链球菌(ATCC 39938,购自ATCC)。
1.2方法
1.2.1抗原的制备
参照实施例1抗原的制备过程。
1.2.2多克隆抗体的制备
1.2.2.1新西兰兔的免疫
选用新西兰大耳白兔皮下免疫,4-6点免疫。每12-16天免疫一次,同剂量免疫2-4次。
1.2.2.2未纯化多克隆抗体效价的测定
兔源多克隆抗体效价测定采用间接ELISA法,以碳酸盐缓冲液为包被液,将包被抗原标准品C-多糖,做倍比稀释包被ELISA板,100μl/孔,4℃过夜包被,次日拍干,洗板两次,37℃封闭1h后拍干;每孔依次加入100 μl经3倍比稀释的兔抗血清(1:100、1:300、1:900、1:2700、1:8100、1:24300、1:72900,1%BSA作为空白对照),37℃封闭孵育1h,PBST洗涤3次;将稀释10000倍的磷酸酶标记的羊抗兔IgG加入每孔孵育1h,PBST洗涤4次;最后每孔加入100μl TMB显色液,暗处反应15min,终止反应后,酶标仪检测波长为450nm的吸光度值,计算每个孔的P/N值,P/N≥2.1时抗体最大稀释倍数即为多克隆抗体的效价。
1.2.2.3兔抗血清的收集
间接ELISA法测定的血清效价满足纯化要求后,收集兔血清,具体方法:麻醉新西兰兔,并于耳静脉注射抗凝剂,插管于颈动脉进行放血,试管分装后,4℃暂放3h,然后9500r/min离心20min,收集上清后分装,于-80℃保存。
1.2.3兔抗血清的纯化、浓度鉴定
1.2.3.1兔抗血清的纯化鉴定
采用Protein-A亲和层析法纯化抗体。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)法测定纯化后多克隆抗体的纯度。
1.2.3.2纯化后多克隆抗体浓度测定
采用Bradford试剂盒测定多克隆抗体的纯度,按照试剂盒说明书进行操作。
1.2.3.3纯化后多克隆抗体效价测定
纯化后多克隆抗体抗体效价的测定采用间接ELISA法,以碳酸盐缓冲液为包被液,将包被抗原标准品C-多糖,做倍比稀释包被ELISA板,100μl/孔,4℃过夜包被,次日拍干,洗板两次,37℃封闭1h后拍干;每孔依次加入100μl经3倍比稀释的兔抗血清(1:100、1:300、1:900、1:2700、1:8100、1:24300、1:72900,1%BSA作为空白对照),37℃封闭孵育1h,PBST洗涤3次;将稀释10000倍的辣根过氧化物酶标记的羊抗兔IgG加入每孔孵育1h,PBST洗涤4次;最后每孔加入100μlTMB显色液,暗 处反应15min,终止反应后,酶标仪检测波长为450nm处的吸光度值,计算每个孔的P/N值,P/N≥2.1时抗体最大稀释倍数即为多克隆抗体的效价。
实施例4胶体金免疫体系的建立
1纳米金制备
在纯化水加入1%金氯酸水溶液(配置时间不超过半年,4℃储存),加热磁力搅拌器上搅拌煮沸,逐滴加入柠檬酸三钠水溶液(现用现配),煮沸15分钟,溶液颜色逐步由淡黄色变为黑色最后至酒红色,待完全冷却后,在可见分光光度计上扫描最大吸收峰,525-535nm处有最大吸收峰。
2胶体金标记
使用碳酸钾溶液调节金溶液pH,将实施例3制备的多克隆抗体逐滴加入上述金溶液中,搅拌20-40分钟,然后加BSA逐滴加入上述混合溶液,搅拌15分钟,封闭胶体金,PEG(分子量为20000)逐滴加入混合溶液至终浓度0.1%,搅拌15分钟,增加胶体金稳定性。离心,速度8000-9000rpm,4℃,0.5-1小时,离心后悬浮沉淀弃上清,后加入稀释液混匀。
3胶体金垫制备
胶体金垫制备主要以浸金进行,将玻璃纤维完全浸入上述标记好的金溶液中,将浸好的胶体金条带置于37℃干燥,湿度恒定在20%后,收起并密封贮存。注:使用时切割整条条带即可,注意金条带两端边缘要弃除,因有边缘效应。
4NC膜制备
分别将实施例2制备的C-Ps单克隆抗体和羊抗兔IgG以合适的浓度均匀铺在NC膜上作检测线T和质控线C,烘箱干燥,37℃2小时至湿度20%以下,后密封包装待用。
5试纸条的组装
(1)将NC膜非点样面粘贴于PVC底板;
(2)胶体金垫粘贴在NC膜的上方,覆盖NC膜1mm;
(3)吸水垫粘贴在NC膜的上方,覆盖NC膜2mm;
(4)样品垫粘贴在胶体金垫的上方,覆盖胶体金垫2mm;
(5)用裁纸机将粘贴好的检测板剪切成4mm宽的条;
试纸条结构如图1所示,使用时将待测样品滴在样品垫上,样品向吸水垫方向流动,依次经过胶体金垫、NC膜;检测线和质控线均显色时检测样品为阳性,质控线显色而检测线不显色时检测样品为阴性,如质控线不显色则检测无效,需更换试纸条重新检测。
6检测结果
采用上述试纸条对抗原浓度分别为1000、100、50、25、12.5、6.25、3.25、1.5、0.75ng的样品进行测试,并设置阴性对照组。检测结果如表2所示,其中,“+”表示显色,其个数代表显色效果,“-”表示不显色。由表2中数据可知,测试中质控线均显色且显色效果较好,即所有检测均为有效测试,且上述试纸条的检测灵敏度可达到ng级别,本发明的胶体金试纸条可用于C-Ps的定性检测,且检测准确率和灵敏度高,稳定性好。
表2胶体金试纸条检测结果
上述试纸条以C-Ps单克隆抗体为包被抗体,以C-Ps多克隆抗体为标记抗体,以二抗为对照,进行抗原的检测,本领域技术人员也可根据实际情况以上述多抗为包被抗体,以上述单抗为标记抗体,以二抗为对照,进行抗原的检测。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换等,均应包含在本发明 的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!