一种茶碱诱导性RNA干扰开关系统及其基因调节方法和用途与流程
本发明涉及基因调控技术领域,尤其涉及一种茶碱诱导性RNA干扰开关系统及其基因调节方法和用途。
背景技术:
核酸开关,常被定义为“具有功能性的非编码RNA区域”,通过选择性结合代谢产物来控制相关基因表达,出现在多种类型细菌的转录和转录后水平调节网络上。一系列对核酸开关的开发应运而生,包括基因治疗方面。受益于合成生物学的进步,这些天然的核酸开关可被改造成可识别任何指定信号来调节任何指定相关基因表达的工具。
人工核酸开关的多功能性拓展了基因研究的开展方式,其中茶碱适体是最常见最被广泛应用的调节基因表达装置之一,在不同的平台中充当开启或关闭的开关装置调节蛋白表达。茶碱诱导性的miRNA或shRNA同样在以往的研究中强调过。然而,现在仍未开发茶碱诱导性的“RNAi-ON”开关。
技术实现要素:
本发明提供一种茶碱诱导性RNA干扰开关系统及其基因调节方法和用途,该RNA干扰开关系统根据茶碱浓度依赖性能够激活或抑制RNA干扰通路来控制靶基因的表达。
根据本发明的第一方面,本发明提供一种茶碱诱导性RNA干扰开关系统,该RNA干扰开关系统至少包括一RNA干扰关闭器件,该RNA干扰关闭器件本身是一人工miRNA前体或者经转录成为一人工miRNA前体,上述人工miRNA前体包括miRNA前体部分以及融合到上述miRNA前体部分的环状区域的茶碱RNA适体部分,上述茶碱RNA适体部分可以被茶碱结合以阻碍RNA干扰作用的发生。
进一步地,上述RNA干扰开关系统还包括一RNA干扰开启器件,该RNA干扰开启器件包括上述RNA干扰关闭器件和靶向靶基因的shRNA,上述RNA干扰关闭器件中的miRNA的成熟体能够与上述shRNA骨架的环状区域匹配结合使得shRNA前体转录被抑制,以便通过添加茶碱来激活RNA干扰作用的发生。
进一步地,上述靶基因是与癌症发生相关的基因。
进一步地,上述与癌症发生相关的基因是TINCR基因。
进一步地,上述人工miRNA前体对应的DNA序列本身是或者包括SEQ ID NO:5所示的序列。
进一步地,上述shRNA对应的DNA序列本身是或者包括SEQ ID NO:9所示的序列。
根据本发明的第二方面,本发明提供一种基于茶碱诱导性RNA干扰开关系统的基因调节方法,该基因调节方法包括将第一方面的茶碱诱导性RNA干扰开关系统导入细胞内,在茶碱的存在下,激活或抑制RNA干扰作用的发生,从而控制靶基因的表达。
进一步地,上述方法对RNA干扰作用的激活或抑制作用具有茶碱浓度依赖性。
进一步地,上述方法中,上述人工miRNA前体对应的DNA序列本身是或者包括SEQ ID NO:5所示的序列;上述shRNA对应的DNA序列本身是或者包括SEQ ID NO:9所示的序列。
根据本发明的第三方面,本发明提供第一方面的茶碱诱导性RNA干扰开关系统在制备由癌症发生相关的靶基因引起的疾病的药物中的用途。
本发明提供一种新颖的RNA调节器(茶碱诱导性RNA干扰开关系统),根据茶碱浓度依赖性它能够激活或抑制RNA干扰通路来控制靶基因的表达。申请人尤其是以新发现的膀胱癌相关非编码RNA TINCR作为靶基因,验证茶碱诱导性RNA干扰开关系统的功能,发现该开关系统在膀胱癌细胞中能够定量控制非编码RNA TINCR的表达量来抑制膀胱癌细胞的进展。
附图说明
图1显示si-TINCR转染膀胱癌细胞5637和SW780后,TINCR表达水平被显著性抑制。
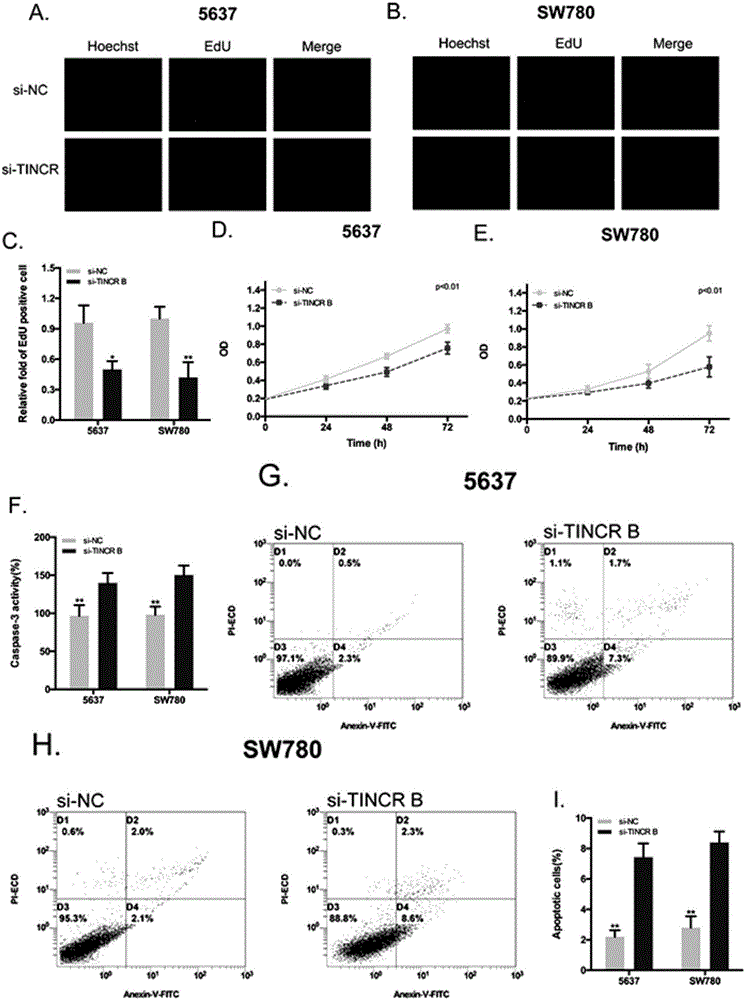
图2显示(A,B)转染siRNA TINCR后EdU检测膀胱癌细胞增殖的代表性图片。(C)分别在转染si-TINCR后,发现5637及SW780膀胱癌细胞增殖受到显著性地抑制。(D,E)转染si-TINCR后0,24,48,72小时,膀胱癌细胞T24、5637显著抑制癌细胞的生长。(F)转染siRNA TINCR后,ELISA法检测细胞凋亡法发现膀胱5637和SW780癌细胞中caspase 3酶的活性显著性提高。(G,H)siRNA TINCR后流式细胞仪检测膀胱癌细胞凋亡的代表性图片。(I)转染siRNA TINCR后,膀胱癌细胞中早期凋亡细胞数显著性提高。
图3显示茶碱诱导性RNA干扰开关系统的设计与描述。(A)关闭器件:茶碱的RNA适体被整合到人工miRNA的环状区域,当结合茶碱时RNA干扰将会被抑制。RNA转录的二级结构、适体结构域、miRNA成熟体结构域和分阶段的公式如图所示。(B)开启器件:由茶碱调控的人工miRNA能够抑制shRNA对TINCR沉默作用。miRNA前体、shRNA前体、适体结构域、miRNA成熟体结构域和分阶段的公式如图所示。s表示miRNA或shRNA在正常生理条件下正常表达率;n表示RNA干扰的抑制参数,即miRNA或shRNA在细胞内降解率;λ表示miRNA或shRNA靶位点与RISC复合体的亲和力;K表示lncRNA结合RISC复合体后降解率;[x]表示茶碱浓度x。
图4显示体外验证茶碱诱导性RNA干扰开关系统。(A)0-4mM茶碱下TINCR在膀胱癌细胞的表达量。(B,C)CCK8结果提示在0-2mM茶碱对膀胱癌细胞生长具有很小的影响。(D)转染人工miRNA之后TINCR在膀胱癌细胞的表达量,amiRNA-TINCR在5637和SW780中能够有效地敲低TINCR。(E,F)转染突变茶碱适体的RNA干扰开关对照系统后,在0/2mM茶碱下膀胱癌细胞TINCR的表达量。(G-J)转染茶碱诱导性RNA干扰开关对照系统后,在不同茶碱浓度下膀胱癌细胞TINCR的表达量。
图5显示体外茶碱诱导性RNA干扰关闭器件对膀胱癌细胞增殖及凋亡的影响。(A,B)转染关闭器件后EdU检测膀胱癌细胞增殖的代表性图片。(C)EdU试验提示在2mM茶碱情况下,关闭器件可抑制由沉默TINCR引起的膀胱癌细胞增殖抑制。(D,E)CCK8试验提示在2mM茶碱情况下,关闭器件可抑制由沉默TINCR引起的细胞生长抑制。(F)ELISA试验提示在2mM茶碱情况下,关闭器件可抑制由沉默TINCR引起的caspase 3酶活性的提高。(G,H)转染关闭器件后流式细胞仪检测膀胱癌细胞凋亡的代表性图片。(I)流式凋亡细胞试验提示在2mM茶碱情况下,关闭器件可抑制由沉默TINCR引起的细胞早期凋亡。
图6显示体外茶碱诱导性RNA干扰开启器件对膀胱癌细胞增殖及凋亡的影响。(A,B)转染开启器件后EdU检测膀胱癌细胞增殖的代表性图片。(C)EdU试验提示在2mM茶碱情况下,开启器件可激活由沉默TINCR引起的膀胱癌细胞增殖抑制。(D,E)CCK8试验提示在2mM茶碱情况下,开启器件可激活由沉默TINCR引起的细胞生长抑制。(F)ELISA试验提示在2mM茶碱情况下,关开启器件可激活由沉默TINCR引起的caspase 3酶活性的提高。(G,H)转染关闭器件后流式细胞仪检测膀胱癌细胞凋亡的代表性图片。(I)流式凋亡细胞试验提示在2mM茶碱情况下,开启器件可激活由沉默TINCR引起的细胞早期凋亡。
具体实施方式
下面通过具体实施方式结合附图对本发明作进一步详细说明。
在本发明中,所谓的“RNA干扰开关系统”是指特别设计的核苷酸序列,其结构特征表现为,包括一RNA干扰关闭器件,该RNA干扰关闭器件本身是一人工miRNA前体或者经转录成为一人工miRNA前体,上述人工miRNA前体包括miRNA前体部分以及融合到上述miRNA前体部分的环状区域的茶碱RNA适体部分,上述茶碱RNA适体部分可以被茶碱结合以阻碍RNA干扰作用的发生。
同时,本发明的RNA干扰开关系统还可以包括一RNA干扰开启器件,该RNA干扰开启器件包括上述RNA干扰关闭器件和靶向靶基因的shRNA,上述RNA干扰关闭器件中的miRNA的成熟体能够与上述shRNA骨架的环状区域匹配结合使得shRNA前体转录被抑制,以便通过添加茶碱来激活RNA干扰作用的发生。
需要说明的是,根据本发明的构思,本发明的RNA干扰开关系统并不局限于实施例中给出的具体核苷酸序列,而是只要具有本发明中所描述的结构特征就能够广泛地适用于各种RNA干扰的关闭和开启。
本发明中,靶基因可以是与癌症发生相关的基因,例如TINCR基因。因此,通过本发明的RNA干扰开关系统能够关闭或开启与TINCR基因相关的RNA干扰。因此,本发明的RNA干扰开关系统在制备由癌症发生相关的靶基因(例如TINCR基因)引起的疾病的药物中有重要用途。
以下通过实施例详细说明本发明的技术方案和技术效果。应当理解,实施例仅是示例性的,不能理解为对本发明保护范围的限制。
I.技术与方法
1.siRNA、质粒构建
本次实验中所有的siRNA和质粒由中国上海吉玛有限公司合成。siRNA的序列如下:si-TINCRB(正义链):5'-GAUCCCGAGUGAGUCAGAAUU-3'(SEQ ID NO:1);si-NC(正义链,阴性对照):5'-UUCUCCGACGUGUCACGUTT-3'(SEQ ID NO:2)。茶碱诱导性RNA干扰开关系统序列和对照系统序列设计后通过化学合成得到,表1所示的序列插入到siCHECKTM-2载体的Xhol/Notl位点,表2所示的序列插入到pGPU6-GFP-Neo载体的BbsI/BamHI位点。
表1
表2
注:本发明中所涉及的核苷酸序列以表1和表2中的记载为准。
2.细胞培养和转染
膀胱癌细胞(5637,SW780)和SV40永生化人尿路上皮细胞(SV-HUC-1)购自中国上海市中国科学院细胞研究中心。5637细胞系用1640培养基(Invitrogen,CA),SW780细胞系用DMEM培养基(Invitrogen,CA),SV-HUC-1用F12K培养基(Invitrogen,CA),以上培养基均加入10%的胎牛血清(Invitrogen)和1%的双抗,贴壁生长,37℃和5%CO2条件下培养,0.05%胰酶消化传代。对于瞬时转染实验,根据Lipofectamine3000说明书,当细胞密度达到70-80%后,使用Lipofectamin3000试剂及质粒的混合液处理细胞。
3.RNA提取和实时定量PCR
总RNA提取按照TRIzol RNA提取试剂(Life Technologies)操作说明进行,Nanodrop测定总RNA的含量和浓度。总RNA按照PrimeScript RT Reagent Kit with gDNA Eraser(Takara)逆转录试剂盒操作说明逆转录成cDNA。实时定量PCR按照SYBR Premix Ex Taq II(Takara)试剂操作说明利用ABI VIVI7荧光定量PCR系统(Applied Biosystems,Foster City,CA,USA)执行。
相关引物如下:
TINCR正向引物:5’-TGTGGCCCAAACTCAGGGATACAT-3’(SEQ ID NO:11),反向引物:5’-AGATGACAGTGGCTGGAGTTGTCA-3’(SEQ ID NO:12);
GAPDH正向引物:5’-CGCTCTCTGCTCCTCCTGTTC-3'(SEQ ID NO:13),反向引物:5’-ATCCGTTGACTCCGACCTTCAC-3’(SEQ ID NO:14)。
PCR循环参数如以下所示:95℃保持15分钟,接着40个循环:94℃保持15秒,55℃保持30秒和72℃保持 30秒。每次试验至少重复三次。内参对照基因为GAPDH基因,所有数据均参照GPADH的表达作归一化处理。
4.细胞增殖实验
细胞增殖实验根据Cell Counting Kit-8,CCK-8试剂盒(Beyotime Institute of Biotechnologya)和ethynyl-2-deoxyuridine,EdU试剂盒(Ribobio)操作说明进行。CCK-8法检测细胞增殖:(1)细胞转染换液后标记为0H,向其中加入培养基体积1/10的CCK-8;(2)将孔培养板继续放置于5%CO2和37℃的培养箱内继续培养约1-4小时,取出孔板用Multiscan GO在450nm波长处检测OD值,并记录实验结果。(3)24H、48H和72H时CCK-8处理方法同上,注意CCK-8孵育时间一致。EdU法检测细胞增殖:(1)用细胞培养基按 1000:1的比例稀释EdU溶液(试剂A),制备适量 50μM EdU培养基;(2)每孔加入 500μl50μM EdU培养基孵育 2小时,弃培养基;(3)PBS清洗细胞 1~2次,每次 5分钟;(4)细胞固定化;(5)Apollo染色;(6)DNA染色。每次试验至少重复三次。
5.细胞凋亡实验
细胞凋亡实验根据按照Caspase-3酶联免疫吸附试剂盒(Cusabio)和Annexin V/PI细胞凋亡检测试剂盒(Transdetect)操作说明进行。Caspase-3酶联免疫吸附实验:(1)配液;(2)温育;(3)加酶标工作液;(4)显色;(5)检测OD值。流式细胞仪检测凋亡细胞实验:细胞转染换液后48h,根据操作说明,收集细胞,使用FITC-Annexin V和PI染料双重颜色,再通过流式流式细胞仪进行分选。每次实验进行至少三次。
6.统计学分析
本实验中设计到数据均使用SPSS22.0统计软件进行统计学分析。两组间采用独立样本t检验方法统计,多组间比较均采用独立样本方差分析(ANOVA)检验方法统计,检验水准以P<0.05表示差别具有统计学意义。
II.实验结果
1.靶向TINCR的siRNAs对膀胱癌细胞增殖、凋亡的影响
为了验证TINCR在膀胱癌的功能,我们利用siRNA敲低两个膀胱癌细胞系的内源性TINCR表达水平进行检测。分别在膀胱癌细胞5637和SW780两个细胞系中转染si-TINCR和si-NC,转染 48小时后,采用qRT-PCR检测细胞中TINCR基因的mRNA表达量。图1显示,与对照组相比,实验组TINCR的表达量在SW780和 5637细胞中均显著地降低,差异均具有显著差异。然后我们分别用CCK-8及EdU细胞增殖法检测TINCRsiRNA对膀胱癌细胞生长的影响。图2A-F结果显示,敲低TINCR过后两个膀胱癌细胞系生长均受到抑制。与此同时我们分别用caspase3酶ELISA和流式细胞术检测膀胱癌细胞的凋亡情况。图2G-I结果显示,相比对照组,实验组的caspase 3酶的活性和早期凋亡细胞均显著地升高。以上数据说明了敲低TINCR表达水平能够抑制膀胱癌细胞增殖及促进其发生凋亡。
2.茶碱诱导性RNA干扰系统的构建
第一步我们先构建出茶碱诱导性RNA干扰关闭器件,该器件能够转录出人工miRNA的前体,而茶碱适体将插入到miRNA前体的骨架的环状区域,而前体配体调控子能够选择性识别miRNA前体的末端环状区,从而阻止剪切复合体的加工,令miRNA的成熟体生成受到抑制。依据此,我们将茶碱RNA适体融合到miRNA前体环状区域。在茶碱诱导性RNA干扰关闭器件中,通过添加茶碱能够阻碍RNA干扰作用同时去除其对TINCR的抑制作用(图3A)。
然后我们通过组合RNA干扰关闭器件和靶向TINCR的shRNA来构建茶碱诱导性RNA干扰开启器件,器件中的miRNA成熟体能够与shRNA骨架的环状区域匹配结合。开启器件的设计是依据空间位阻效应,被miRNA结合后的shRNA前体转录将被抑制。因此在茶碱诱导性RNA干扰开启器件中,通过添加茶碱能够激活RNA干扰作用同时产生对TINCR的抑制作用(图3B)。
最后我们为了阐明两个器件功能的重要参数,我们建立了相关数学模型。通过一系列不同的公式来阐述茶碱浓度与lncRNA敲低效率之间的关系,尽可能细化到每个进程。该模型指出随着浓度输入提高,基因的表达量将大幅度改变,而两者关系体现出非线性和饱和性,正是多种生物学现象的重要特点。
3.体外茶碱诱导性RNA干扰开关系统对TINCR表达量的作用
为了验证开关系统的有效性,根据相关研究我们设置了一系列的茶碱浓度梯度对系统进行验证。首先通过CCK8试验检测不同茶碱浓度对细胞生存的影响,通过实时定量PCR检测不同茶碱浓度对TINCR表达的影响。结果提示在0-2mM浓度范围内,茶碱对细胞生存和TINCR表达影响很小。当茶碱浓度达到4mM,TINCR表达量仍未收影响,但此时膀胱癌细胞生长受一定限制(图4A-C)。接着我们通过实时定量qPCR验证靶向TINCR的人工miRNA的功能,与对照组相比,amiRNA-TINCR能够有效地敲低TINCR(图4D)。分别转染开启、关闭及相关对照器件之后,如果图4G-J所示,在0-2mM茶碱诱导下,茶碱诱导性RNA干扰开启和关闭器件均能够定量调节TINCR的表达企且在2mM达到最大诱导效果。因此后续验证工作我们将采用2mM茶碱为工作浓度。为了进一步确定系统是通过茶碱适体发挥作用,我们构建了另一套突变茶碱适体的诱导RNA干扰开关对照系统,如图4E-F突变茶碱适体的诱导性RNA干扰开关对照系统不具备与茶碱的应答功能。
4.体外验证茶碱诱导性RNA干扰开关系统对膀胱癌细胞增殖及凋亡的作用
膀胱癌细胞5637和SW780分别转染茶碱系统后,在含有0或2mM茶碱的培养基中培养。转染关闭器件后,两种浓度处理对比下,EdU试验和CCK8试验显示0mM茶碱下膀胱癌细胞生长被显著抑制,流式细胞凋亡试验和ELISA试验显示0mM茶碱下膀胱癌细胞凋亡细胞数增多(图5)。再次验证敲低TINCR能够抑制膀胱癌细胞生长和促进其发生凋亡,同时说明RNA干扰能够被器件所抑制。与此相反,转染开启器件后,EdU试验和CCK8试验显示2mM茶碱下膀胱癌细胞生长被显著抑制,流式细胞凋亡试验和ELISA试验显示2mM茶碱下膀胱癌细胞凋亡细胞数增多(图6),证实RNA干扰能够被器件所激活。总体而言,茶碱诱导性RNA干扰开关系统提供了一个具有精确浓度依赖性的平台来调节膀胱癌细胞增殖和凋亡。
结论
在本次研究中,我们的结果证实了茶碱诱导性RNA干扰开关系统能够根据茶碱的浓度开启或者关闭RNA干扰的作用,可对靶基因进行精确且定量调控。通过这种方法我们能够更全面地更简便地对基因进行调节,受益于合生生物学技术的进步,各种强大的应用将会陆续呈现在基础生物学和应用生物学领域中。
以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!