一种CHO‑Dhfr表达系统细胞株的高通量筛选方法与流程
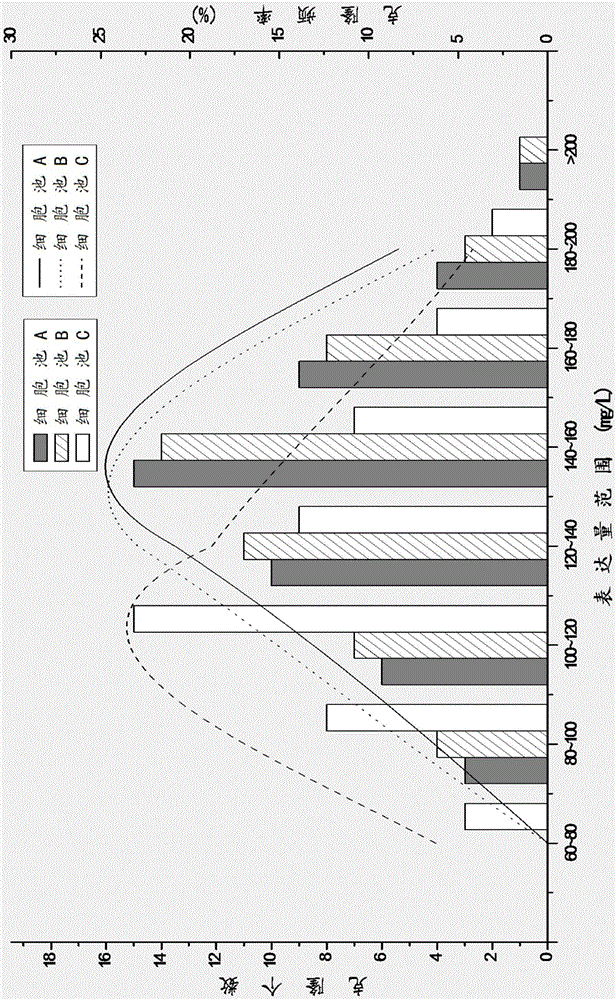
本发明涉及细胞工程领域,具体来说,涉及一种CHO-Dhfr表达系统细胞株的高通量筛选方法。技术背景用于单克隆抗体或者分子量较大的重组蛋白药物生产的“工程细胞”系需具备以下特性:生长特性良好,无血清悬浮培养密度高(1~2×107cell/ml);异源蛋白表达能力强(20~70pg/cell/day,pcd),具备正确的翻译后修饰能力;宿主及重组细胞系遗传背景清晰、表型稳定,符合相关法规要求。目前,业内细胞系构建中最常用的筛选体系之一是CHO-Dhfr系统。CHO细胞即中华仓鼠卵巢细胞(ChineseHamsterOvary),DHFR是指二氢叶酸还原酶(dihydrofolatereductase),催化二氢叶酸转还原为四氢叶酸,DHFR基因敲除的CHO细胞(如Invitrogen的DG44)不能合成四氢叶酸,只能在添加胸苷、甘氨酸和嘌呤的培养基中生长。该系统是将外源基因插入到含有DHFR基因表达载体的下游,并转入至宿主细胞DG44细胞,这样便可在不含胸苷、甘氨酸和嘌呤的培养基中生长。在细胞培养时添加DHFR的抑制剂氨甲蝶呤(methotrexate,MTX),使MTX基因及与之相连的目的基因一起扩增,达到增加目的基因拷贝数,从而提高目的基因表达水平的目的。细胞株筛选的目的在于获得稳定高产的细胞株,其衡量标准包括抗体表达量、产品质量、代谢稳定性、细胞基质稳定性等。常规的筛选方法是:表达构建体的构建→转染至宿主细胞→加压筛选获得细胞池→细胞池(cellpool)的单克隆化→高表达细胞株扩大培养及筛选→细胞株的稳定性评估。细胞池常规获得的方法是:当表达构建体被转染到宿主细胞内,采用多轮加压的策略,直至表达量上升幅度不大后,前一轮为最高加压轮次。将其细胞复苏后,待细胞活力>95%后即为细胞池,或者是用前面提到的细胞池做流式细胞分选表达量TOP2~5%的细胞,待细胞活力再次>95%后即为细胞池。一般来说,在同样的培养环境下,低表达细胞株将营养成分更多用在细胞生长上,故生长较快,而高表达细胞株生长较慢,因此,以上提到的两种活力>95%的细胞池在细胞活力逐渐恢复的过程中,大多数高表达细胞株越长越慢,以至于丧失;而低表达细胞株越长越快;最终导致细胞池的高表达细胞株含量低,低表达的细胞株含量高。同时,在细胞活力恢复的过程中,增加细胞传代次数,据实验经验,每经历一次细胞活力恢复,细胞增加15~20Generations(Generation,世代,细胞每倍增一次,称为1Generation),影响细胞株的稳定性。单克隆化筛选最常规的方法是有限稀释(limitingdilutioncloning,LDC),低成本且易于操作,即将细胞密度按照<1cell/孔铺至96孔板中,培养基为液体培养基,大多时候会按照需求添加一定比例的条件培养基(含有细胞生长因子),对细胞生长状态要求极高,活力<90%的细胞池几乎很难存活,克隆效率极低,即使单克隆化活力>95%的细胞池,克隆效率最高也仅有7%左右,平均水平在3%~4%,且操作繁琐,工作量大,实验周期长,实验效率低,无法实现高通量筛选。用半固体培养基法进行单克隆化筛选,它是将细胞池按照一定的密度铺于半固体培养基上形成单克隆,继而挑选出来逐步扩大培养及筛选高表达细胞株。目前逐渐使用ClonePix2这类高通量筛选仪器在各种半固定培养基上进行高通量筛选,然而参照现有文献,如何提高克隆形成率及更快更易筛选出稳定高表达细胞株一直是本领域的技术难点。技术实现要素:本发明目的在于提供一种CHO-Dhfr表达系统细胞株的高通量筛选方法,该方法克隆形成率高且易于从中筛选出稳定且表达量高的细胞株。具体的,该方法通过选择细胞活力在40%~50%细胞池,在半固体培养基上进行单克隆化,同时利用高通量细胞筛选系统,克服了通过有限稀释法克隆效率极低的问题,从而更容易筛选出稳定高表达的优质细胞株。一种CHO-Dhfr表达系统细胞株的高通量筛选方法,包含以下步骤:(1)表达构建体的构建,(2)转染至宿主细胞,(3)MTX加压筛选获得细胞池,(4)细胞池在半固体培养基上进行单克隆化,(5)利用高通量细胞筛选系统筛选细胞株,(6)细胞株的稳定性评估。其特征在于,步骤(4)所述的细胞池的细胞活力为40%~50%。根据本发明的具体实施例,步骤(3)所述的MTX加压筛选分为三轮,MTX的浓度依次为100nM、1000nM、5000nM;根据本发明的一些实施例,步骤(4)所述在半固体培养基上进行单克隆化,其中,半固体培养基中细胞终浓度为150cells/mL;根据本发明的一些实施例,步骤(4)所述的半固体培养基中含有条件培养基与甲基纤维素。优选的,条件培养基占半固体培养基总体积的10%。优选的,甲基纤维素在半固体培养基中的含量为0.9~1.5g/L。根据本发明的一些实施例,所述条件培养基的制备方法为:取已经转染pOptiVEC(该载体含Dhfr基因,不含有其它外源蛋白的基因)的稳定细胞株在添加8mM谷氨酰胺的OptiCHOMedium中进行批培养,细胞培养至密度在0.9×107~1.1×107cells/mL之间且细胞活力>95%时,经过离心分离上清和细胞,取上清过滤后即得。其中,所述细胞株为DG44细胞。根据本发明的一些实施例,步骤(4)所述的半固体培养基中还含有1%体积比的荧光抗体,所述荧光抗体选自CloneDetect-anti-humanIgG(H+L)detection。根据本发明的一些具体实施例,步骤(5)所述高通量细胞筛选系统为MolecularDevices公司的ClonePix2。根据本发明的一些实施方案中,所述Dhfr表达系统为携带Dhfr基因的并且Dhfr基因下游插入了外源基因的表达载体转染至敲除了Dhfr基因的CHO细胞(DG44)。术语解释二氢叶酸还原酶(DHFR)是指利用还原型辅酶Ⅱ(NADPH)还原二氢叶酸产生四氢叶酸的氧化还原酶,四氢叶酸参与嘌呤、嘧啶的合成,对正常血细胞的生成具有促进作用,DHFR的抑制剂是氨甲喋呤(MTX)。氨甲喋呤(MTX)加压是用于DHFR表达系统以扩增Dhfr基因下游的目的基因,从而实现外源基因的高表达,在本发明中,用三轮大幅度加压的方式,即:100nM、1000nM、5000nM,来获取5000nMMTX加压情况下较低活力的细胞池。新霉素(neomycin)抗性基因(Neo)被整合进真核细胞DNA后,能启动Neo基因编码的序列转录为mRNA,从而获得抗性产物氨基糖苷磷酸转移酶的高效表达,使细胞获得抗性而能在含有新霉素抗性基因的G418的选择性培养基中生长。本发明使用的半固体培养基为含有10%条件培养基的半固体培养基。条件培养基提供细胞生长的营养物质,帮助克隆形成。本发明添加的条件培养基为本实验室自制,制备方法在实施例中描述。本发明使用的半固体培养基为含有甲基纤维素的半固体培养基。甲基纤维素的添加既能使同一单克隆在分裂时成一细胞团,又能使细胞分泌的抗体聚集在细胞团周围与荧光抗体(CloneDetect-anti-humanIgG(H+L)detection(MolecularDevices,货号K8200))结合达到定量检测的目的。目前除了可以使用商品化培养基CloneMatrix(MolecularDevices,货号K8510)外,还能使用甲基纤维素粉末(CAS#:9004-67-5)自行配制甲基纤维素溶液。铺板时将甲基纤维素溶液与基础培养基按照一定的比例混和即为用于本发明的半固体培养基,最终在半固体培养基中,甲基纤维素的含量为0.9~1.5g/mL,所述基础培养基选自OptiCHOMedium(Invitrogen,12681-011)。本发明使用的高通量细胞筛选系统为MolecularDevices公司的ClonePix2,筛选的流程是ClonePix2对细胞进行成像→ClonePix2计算克隆荧光强度→ClonePix2挑取荧光强度高的单克隆→96孔板继续培养。所述荧光强度高的单克隆即代表表达量高的单克隆细胞株,因为标记的荧光抗体作为二抗,与细胞株分泌的抗体结合,表达量高的细胞株结合的荧光抗体就多,荧光强度就高。细胞株的稳定性评估是将筛选得到的高表达细胞株继续传代至60世代,取各细胞株20世代、40世代和60世代的细胞,做500mL批培养评估。比较细胞株在不同代次的表达量水平,根据细胞株表达量下降的百分比,判定细胞株稳定的水平:10%之内,很稳定;30%之内,稳定;超过30%,不稳定。本发明方法的技术有益效果如下:(1)实现了CHO-Dhfr表达系统细胞株的高通量筛选:该筛选方法运用了ClonePix2高通量筛选系统,相较于用传统有限稀释单克隆化筛选的通量提高了50倍以上,筛选周期缩短了至少1/3,机械化操作,直接排除95%以上的低产克隆。(2)克隆形成率高,提高筛选成功率:用传统有限稀释单克隆化细胞活力>95%的细胞池,克隆效率通常为3~4%,使用该筛选方法单克隆化细胞活力在40%~50%的细胞池,不添加与添加条件培养基的克隆效率分别约为60%和100%,在克隆效率方面提升幅度很大。(3)表达量高:比常规使用细胞活力>95%的细胞池进行筛选更容易筛选出更多的高表达细胞株。(4)稳定性好:由细胞活力在40%~50%的细胞池单克隆化筛选得到的细胞株,相较于由活力>95%的细胞池单克隆化筛选得到的细胞株,稳定性显著提高。附图说明图1是细胞池A(活力为41.58%)、细胞池B(活力为49.66%)与细胞池C(活力为95.86%)单克隆化筛选过程中各组克隆在96孔板培养阶段抗体表达量分布的比较图;图2是细胞池A(活力为41.58%)、细胞池B(活力为49.66%)与细胞池C(活力为95.86%)单克隆化筛选过程中各组克隆在6孔板批培养阶段抗体表达量分布的比较图;图3是细胞池A(活力为41.58%)、细胞池B(活力为49.66%)与细胞池C(活力为95.86%)单克隆化筛选过程中各组克隆在500mL摇瓶批培养阶段表达量分布的比较图。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例子仅为了阐明本发明,而非为了限制本发明的应用范围。实验过程中使用的试剂、培养基、耗材等均可通过市售途径获得。实施例1制备细胞池1.表达构建体的构建参照OptiCHOTMAntibodyExpressKit(购自Invitrogen公司)、pOptiVECTM-TACloningKit(购自Invitrogen公司)和pcDNATM3.3-TACloningKit(购自Invitrogen公司)使用说明书,自主制备得到分别表达抗TNFα全人源抗体(在载体名称前用项目编号A-表示)重链和轻链的表达载体,它们分别是:A-pOptiVEC-VL(含Dhfr-VL)和A-pcDNA3.3-VH(含Neo-VH)。2.转染至宿主细胞用HiPurePlasmidDNAPurificationKit(购自Invitrogen公司)抽提Anti-TNFα全人源抗体的A-pOptiVEC-VL和A-pcDNA3.3-VH,经PvuI(购自TaKaRa公司)分别线性化并提纯后,等量汇合,取总量为40μgDNA/电转体系,用电穿孔仪(Bio-RadGenePulserXcellEukaryoticSystem,设置参数为:300V,900μF,脉冲时间20ms)电击转染处于对数生长期的DG44细胞(107cells)(Invitrogen,OptiCHOTMAntibodyExpressKit),将三次电击后的细胞重悬于12mL8mML-谷氨酰胺的OptiCHOMedium中,以2mL/孔加入至1块6孔培养板中,37℃,5.0%CO2条件下静置培养,以恢复电击给带来的细胞机械损伤。所述培养基为L-谷氨酰胺(购自Invitrogen公司)母液与OptiCHOMedium(购自Invitrogen公司)按比例混合,若使用12mL培养基,即取0.5mL200mML-谷氨酰胺母液加入11.5mLOptiCHOMedium中,下述8mML-谷氨酰胺的OptiCHOMedium的配制方法,同此处。上述细胞培养48h后离心换液,将细胞重悬于30mL含有500μg/mLG418、8mML-谷氨酰胺的OptiCHOMedium中,于140rmp,37℃,8.0%CO2条件下振荡培养,三天传一代(Passage),培养3代,细胞活力恢复至80%以上,此时获得了稳定转染双载体(A-pOptiVEC-VL、A-pcDNA3.3-VH)的DG44细胞池Y(活力为83.21%)。所述培养基中的G418来自50mg/mLG418母液(购自Invitrogen公司),使用时按比例添加至OptiCHOMedium中,由于添加体积小,仅为终体积的1%,添加后,终体积的增加可忽略。3.MTX加压筛选获得细胞池将稳定转染A-pOptiVEC-VL、A-pcDNA3.3-VH的DG44细胞池Y用MTX进行三轮加压,37℃,8.0%CO2条件下振荡培养,加压浓度依次为:100nM、1000nM、5000nM。在MTX加压过程中,每个浓度经历3~5代的离心换液传代,待细胞活力恢复至70%以上,细胞密度达到3×105/mL,则增加MTX浓度至下一个梯度,每次传代,取细胞上清,用Fortebio(PALL,QKe)测定抗TNFα全人源抗体的表达情况。其中,所述各浓度MTX(购自Sigma公司)自1mMMTX母液稀释而来,1mMMTX母液配制方法为:用22mLPBS溶液溶解10mgMTX粉末,0.22μm滤膜滤过除菌后,0.5mL/管分装,-20℃保存待用,使用时室温解冻,解冻后可于4℃保存一个月。使用时按比例添加至培养基中,由于添加体积小,仅为终体积的0.01~0.5%,添加后,终体积的增加可忽略。待加压至最后一个浓度5000nM时,选取细胞活力处于40%~55%的细胞池,得到细胞池A(活力为41.58%)、细胞池B(活力为52.66%),细胞池A、B的单位细胞单位时间的抗体表达量较细胞池Y已经增加了125~135倍。继续维持5000nM加压至活力恢复到90%以上,取此时的细胞库C(活力为95.86%)作为实验对照组。实施例2条件培养基对克隆形成的影响1.条件培养基及半固体培养基的制备条件培养基的制备方法:取已经转染pOptiVEC(该载体含Dhfr基因,不含有其它外源蛋白的基因)的稳定细胞株在300mL8mM谷氨酰胺的OptiCHOMedium中进行批培养,细胞培养至密度在0.9×107~1.1×107cells/mL之间且细胞活力>95%时,经过离心分离上清和细胞,取上清用0.22μm膜过滤处理后即得,以10mL/管、25mL/管、50mL/管分装,-80℃保存待用。使用时估算用量选择合适体积的条件培养基于37℃下,水浴解冻,剩余的弃掉。半固体培养基的配制:将表1半固体培养基配方中各成分分别按照配制体系1、2用量在室温下大力混匀,等待气泡慢慢消失,即得。其中,Clonematrix为半固体培养基基质,购自MolecularDevices公司;CloneDetect-anti-humanIgG(H+L)detection为荧光抗体,购自MolecularDevices公司;1mMMTX母液的配制:取10mgMTX粉末溶解于22mLPBS溶液中,0.22μm滤膜滤过除菌后即得;2.5×OptiCHOMedium的配制:称取4.825gCDOptiCHOTMAGTTMMedium粉末(购自Invitrogen公司)至85mL超纯水中,室温搅拌30min后,用超纯水定容至100mL,调节pH7.4~7.8。表1单克隆化细胞池的半固体培养基配方半固体培养基配方配制体系1配制体系2Clonematrix12mL12mLCloneDetect-anti-humanIgG(H+L)detection0.3mL0.3mL无菌水4.35mL1.35mL条件培养基--3mL1mMMTX母液0.15mL0.15mL200mM谷氨酰胺水溶液1.2mL1.2mL2.5×OptiCHOMedium10.5mL10.5mL2.将细胞池A铺至半固体培养基取细胞池A(活力41.58%)的适量细胞离心,分别重悬于4.0mL2.5×OptiCHOMedium(见步骤1的配制过程),得到细胞密度为3000cells/mL的细胞混悬液。取上述细胞池A的细胞悬液1.5mL与配制体系1的半固体培养基混合,轻柔混匀后,以2mL/孔加入至2块6孔培养板中,命名为AK(1)~(2),静置培养10~12天,37℃,5.0%CO2条件下,待细胞团慢慢形成;将剩下的细胞悬液充分混匀后,取1.5mL与配制体系2的半固体培养基混合,轻柔混匀后,以2mL/孔加入至2块6孔培养板中,命名为AK(3)~(4),静置培养10~12天,37℃,5.0%CO2条件下,待细胞团慢慢形成。3.Clonepix成像细胞在6孔板AK(1)~(4)中培养12天后,肉眼能见分布均匀、大小适中(0.3~0.6mm2)的细胞团,此时方可用ClonePix2System(MolecularDevices)挑选荧光强度高的克隆。(1)按照ClonePix2的操作说明书,逐步对仪器进行PrepareForPickRun,这个过程以确保针头正确击发,相机、针头和微孔板匹配,液体系统无菌且可以立即使用。(2)继而运行PickRun,这个过程依次为:包括设置(包括成像设置、挑选设置、灭菌设置、克隆识别设置)。(3)分别对AK(1)~(4)进行成像,其克隆形成效率见表2。表2是否添加条件培养基克隆形成情况比较比较项目配制体系1配制体系26孔板编号AK(1)~(2)AK(3)~(4)细胞总数3600个3600个成像克隆数量2299个3569个克隆形成率63.9%99.1%由表2可以看出:同为将细胞池A铺于半固体培养基上,配制体系2添加10%了条件培养基的实验组克隆形成率接近100%,而未加条件培养基的配置体系1实验组克隆形成率只有约60%。实施例3单克隆化筛选高表达稳定细胞株1.细胞池A、B、C单克隆化按照表1的配制体系2配制3份半固体培养基,取细胞池A(活力41.58%)、细胞池B(活力49.66%)和细胞池C(活力95.86%)的适量细胞离心,分别重悬于1.5mL2.5×OptiCHOMedium,得到三份细胞密度为3000cells/mL的细胞混悬液。将三份细胞悬液分别与三份半固体培养基混合,轻柔混匀后,以2mL/孔加入至2块6孔培养板中,命名为AK(5)~(10),静置培养10~12天,37℃,5.0%CO2条件下,待细胞团慢慢形成。2.ClonePix2成像并挑取克隆细胞在6孔板AK(5)~(10)中培养12天后,肉眼能见分布均匀、大小适中(0.3~0.6mm2)的细胞团,此时方可用ClonePix2System(MolecularDevices公司)挑选荧光强度高的克隆。(1)按照ClonePix2的操作说明书,逐步对仪器进行PrepareForPickRun,这个过程以确保针头正确击发,相机、针头和微孔板匹配,液体系统无菌且可以立即使用。(2)继而运行PickRun,这个过程依次为:包括设置(包括成像设置、挑选设置、灭菌设置、克隆识别设置)。(3)分析AK(5)~(10)的成像结果,分析的依据是以细胞团的大小、规则程度和荧光强度设置阈值,对克隆进行分组。其中,细胞团的规则程度以周长/面积比值,细胞边沿的光滑两个参数度来衡量,目的是使细胞团的形状接近于圆形;细胞团的荧光程度包括多种算法,例如:外部平均荧光强度ExteriorMeanIntensity、外部中位数荧光强度ExteriorMedianIntensity、外部总荧光强度ExteriorTotalIntensity、内部荧光强度标准差InteriorIntensitySD、内部平均中央荧光强度InteriorMeanCentreIntensity、内部平均荧光强度InteriorMeanIntensity、内部中位数荧光强度InteriorMedianIntensity、内部总荧光强度InteriorTotalIntensity、标准化荧光强度NormalizedIntensity、总荧光强度SumTotalIntensity,根据CHO细胞分泌性表达的特点,本发明以外部平均荧光强度作为标准对细胞株进行筛选。(4)从AK(5)~(10)中选取外部平均荧光强度强的细胞株,每个细胞池来源的选取300株挑取至目标板96孔板,每个细胞池来源的细胞各5块板,命名为AKC96(1)~(15),见表3。(5)结束程序,把目标板细胞AKC96(1)~(15)放置培养箱中培养,一般5~7天后成活的克隆汇合度可长至15%以上。表3:不同细胞池单克隆化克隆形成率及外部平均荧光强度比较3.克隆的扩大培养及筛选克隆扩大培养及筛选的过程为:(1)根据外部荧光强度筛选出300个克隆/细胞池,挑取至5个96孔板进行培养,表达量分布范围见附图1;(2)筛选出步骤(1)中表达量相对较高的48个克隆/细胞池转移至6孔板进行扩培,批培养表达量分布范围见附图2;(3)筛选出步骤(2)中表达量相对较高的10个克隆/细胞池转移至500mL摇瓶进行扩培,批培养表达量分布范围见附图3。其中,柱形图表示在一定抗体表达量范围的克隆个数,曲线表示克隆表达量分布的范围及频率;从各扩培阶段趋势图中可以看出,细胞池A、B的筛选出高表达量的菌株更多。4.细胞株的稳定性将分别来源于细胞池A、B、C的细胞株,扩大筛选至摇瓶规模的克隆分别命名为:细胞池A:克隆(1)~(10),细胞池B:克隆(11)~(20),细胞池C:克隆(21)~(30)。将克隆(1)~(30)的细胞株继续传代至60世代,取各细胞株20世代、40世代和60世代的细胞,做500mL批培养评估。比较细胞株在不同代次的表达量水平,根据细胞株表达量下降的百分比,判定细胞株稳定的水平:10%之内,很稳定;30%之内,稳定;超过30%,不稳定。结果见表4。表4:由细胞池A、B、C筛选的克隆(1)~(30)的稳定性评估表从以上结果可以看出,细胞池A、B筛选出的菌株稳定性更高。综合上述实验结果,可以看出,选择细胞活力在40%~50%的细胞池,在特定的半固体培养基中进行单克隆化,克隆形成率显著提高,且能够在较短时间内筛选出更多的表达量高且稳定的菌株。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种构建Hi‑C高通量测序文库的方法与制造工艺
- 桑葚病原菌高通量鉴定及种属分类方法及其应用与制造工艺
- 基于高通量测序技术检测乳腺癌/卵巢癌易感基因的多重PCR特异性引物、试剂盒及方法与制造工艺
- 基于高通量测序检测人EGFR基因变异的质控方法及试剂盒与制造工艺
- 基于高通量测序技术的小麦病原微生物检测方法及其应用与制造工艺
- 一种基于二代高通量测序技术的地中海贫血症的基因检测试剂盒的制造方法与工艺
- 一种基于集群的高通量数据分析方法与制造工艺
- 高通量双折射干涉成像光谱仪装置及其成像方法与制造工艺
- 高通量测序检测人循环肿瘤DNA EGFR基因的捕获探针及试剂盒的制造方法与工艺
- 一种高通量测序检测无创亲子鉴定的方法与制造工艺