一种利用酿酒酵母合成3‑O‑葡萄糖基齐墩果酸和纤维二糖齐墩果酸的方法与流程
本发明属于生物工程领域,具体涉及一种利用工程的化酿酒酵母生产3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸的构建方法。
背景技术:
3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸是重要的齐墩果烷型五环三萜类化合物。该类化合物属于具有特殊价值的植物次生代谢产物,具有抗感染、抗辐射、抗干旱等多种抵御生物和非生物胁迫方面的重要功能,许多物质具有抵御人类疾病的药物活性。3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸广泛分布在人参(Panax ginseng)、甘草(Glycyrrhiza uralensis)、中华雪胆(Hemsleya chinensis cogn)、女贞子(Glossy privet fruit)、油橄榄(Olea europaea)、楤木(Chinese aralis)、蒺藜状苜蓿(Medicago truncatula)等多种植物的叶片、果实及根茎中,具有抗炎、抗肿瘤、治疗二型糖尿病及临床上治疗传染性急性黄疸型肝炎等多种药理活性,其中,齐墩果酸片作为一种非处方药物已经在中国境内销售超过20年,是一类具有重要药理活性的天然产物。
目前获得3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸的主要方式是从各种植物材料中提取。以乙醇、三氯甲烷、乙酸乙酯、甲醇等有机溶剂作为萃取液,通过超临界二氧化碳萃取、溶剂萃取和色谱柱分离几种方法的组合从植物材料中分离获得3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸。然而3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸在植物中的积累量较少,如果直接从植物中提取存在工艺复杂、能耗高、生产周期较长等问题,且提取工艺往往需要高温和有机溶剂,不仅提取成本高,也会造成环境污染。同时,植物材料中3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸的含量也受到季节,气候,土地等因素的限制,是一种劳动密集型,土地占用率高的产业。此外,3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸由于其分子结构的复杂性使得化学合成也难以实现。而利用微生物发酵方法生产3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸生长周期短、过程可控,能够缓解对植物资源的依赖,具有可观的经济效益和绿色环保的社会效益。
与植物相比,微生物具有培养时间短,基因操作简单,不受季节、气候、土地等因素限制的优点,能够利用廉价的碳源,通过大规模发酵,获得高附加值的天然产物。酿酒酵母(Saccharomyces cerevisiae)作为真核模式微生物,遗传背景清晰,基因操作简单,且具有完整的细胞内膜系统有利于萜类合成相关环化酶、P450酶、糖基转移酶的活性表达,同时酿酒酵母内源的MVA途径能够提供更多的胞内IPP,目前,酿酒酵母作为宿主已成功生产出倍半萜类化合物青蒿素、二萜类化合物紫杉二烯、三萜类化合物β-香树脂醇及四萜类化合物β-胡萝卜素等多种萜类化合物,被认为是萜类合成的适宜底盘宿主。通过在酿酒酵母中引入β-香树脂醇合酶、齐墩果酸合酶、UDP-葡萄糖转移酶实现利用酿酒酵母生产植物天然产物3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸,将为植物天然产物的微生物高效合成提供有效的技术支持。
技术实现要素:
本发明的目的是为解决3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸在植物中积累量低和化学法难以合成的局限,提供一种利用酿酒酵母工程菌生产3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸的方法。
为达到上述目的,本发明的技术方案是提供一种能够生产3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸的酿酒酵母工程菌的构建方法。首先对来源于植物的细胞色素单加氧酶,细胞色素还原酶,以及UDP-葡萄糖转移酶的基因进行密码子优化并利用化学法合成相应基因。其中包括分别来自蒺藜状苜蓿(Medicago truncatula)、葡萄(Vitis vinifera)和党参(Maesa lanceolata)的P450细胞色素单加氧酶基因CYP716A12(Genbank注册序列号为DQ335781.1)、CYP716A15(Genbank注册序列号为AB619802.1)和CYP716A75(Genbank注册序列号为KF318733.1);分别来自蒺藜状苜蓿(Medicago truncatula)、青蒿(Artemisia annua)和人参(Panax ginseng)的细胞色素还原酶基因MtCPR(Genbank注册序列号为XM_003602850.2)、AaCPR(Genbank注册序列号为EF197890.1)和PgCPR(Genbank注册序列号为KJ622356.1)以及来自欧洲山芥(Barbarea vulgaris)的UDP-葡萄糖转移酶基因UGT73C10(Genbank注册序列号为JQ291613.1)、UGT73C11(Genbank注册序列号为JQ291614.1)和UGT73C12(Genbank注册序列号为JQ291615.1)。然后利用酿酒酵母的启动子(P)和终止子(T)分别构建P450细胞色素单加氧酶基因表达盒(启动子-细胞色素单加氧酶-终止子),细胞色素还原酶基因表达盒(启动子-细胞色素还原酶-终止子)以及UDP-葡萄糖转移酶基因表达盒(启动子-UDP葡萄糖转移酶-终止子)。其中P450细胞色素单加氧酶基因表达盒PGAL1-CYP716A12-TCYC1、细胞色素还原酶基因表达盒PGAL10-MtCPP-TADH1和UDP-葡萄糖转移酶基因表达盒PGAL1-UGT73C10-TCYC1通过DNA大片段组装构建酿酒酵母表达载体pESC-URA-PGAL1-CYP716A12-TCYC1-PGAL10-MtCPP-TADH1和pESC-TRP-PGAL1-UGT73C10-TCYC1。通过将这两个表达载体共同转化到能够生产β-香树脂醇的酿酒酵母中Sgib中,得到的工程菌SpUOpTG,能够生产齐墩果酸,3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸。其中,Sgib是本实验室早期构建的一株能够生产β-香树脂醇的酿酒酵母,涉及本实验室早期专利(专利授权公布号为CN 103509726 B)。
以酿酒酵母(Saccharomyces cerevisiae)Sgib作为底盘宿主,通过外源导入两个表达载体pESC-URA-PGAL1-CYP716A12-TCYC1-PGAL10-MtCPP-TADH1和pESC-TRP-PGAL1-UGT73C10-TCYC1使其能够生产齐墩果酸,3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸。其中启动子PGAL1为酿酒酵母半乳果糖激酶基因(GAL1)的启动子,终止子TCYC1酿酒酵母细胞色素C1基因(CYC1)的终止子,启动子PGAL10为酿酒酵母UDP-葡萄糖差向异构酶基因(GAL10)的启动子,所述终止子TADH1为酿酒酵母乙醇脱氢酶基因(ADH1)的终止子。由于启动子PGAL1和启动子PGAL10均为半乳糖诱导表达的诱导型启动子,因此酿酒酵母工程菌SpUOpTG在发酵过程中通过添加半乳糖,能够诱导P450细胞色素单加氧酶CYP716A12、细胞色素还原酶MtCPR和UDP-葡萄糖转移酶UGT73C10的表达。其中P450细胞色素单加氧酶CYP716A12和细胞色素还原酶MtCPR共同作用于β-香树脂醇,将其C28位的甲基氧化为羧基生成齐墩果酸;齐墩果酸在UDP-葡萄糖转移酶UGT73C10的作用下,其C3位的羟基与UDP-葡萄糖结合后脱水生成3-O-葡萄糖基齐墩果酸;3-O-葡萄糖基齐墩果酸能够在UDP-葡萄糖转移酶UGT73C10的作用下进一步与UDP-葡萄糖反应生产纤维二糖齐墩果酸,从而实现利用工程化酿酒酵母同时生产齐墩果酸,3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸。
本发明中所述表达盒均指能够在酿酒酵母中有效表达目的基因的DNA序列,表达盒的结构包括启动目的基因转录的启动子,目的基因以及终止目的基因转录的终止子。
本发明的酿酒酵母工程菌具有以下优点:
1、P450细胞色素单加氧酶CYP716A12、细胞色素还原酶MtCPR和UDP-葡萄糖转移酶UGT73C10的表达受到半乳糖的诱导,从而实现在特定阶段生产齐墩果酸,3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸,降低齐墩果酸,3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸这三种具有抑菌活性的物质对酿酒酵母(Saccharomyces cerevisiae)细胞的伤害,提高产量,优化发酵工艺。
2、本发明的酿酒酵母(Saccharomyces cerevisiae)工程菌代谢葡萄糖和半乳糖直接合成齐墩果酸,3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸,实现了植物次生代谢产物齐墩果酸,3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸的酿酒酵母人工合成。
3、本发明利用酿酒酵母(Saccharomyces cerevisiae)工程菌代谢葡萄糖和半乳糖直接合成齐墩果酸,3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸。其中合成的3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸能够透过酿酒酵母细胞膜直接进入发酵液中,简化了下游的分离萃取工艺,降低了成本。
附图说明
图1是基因CYP716A12和MtCPR编码的P450细胞色素单加氧酶和细胞色素还原酶将β-香树脂醇转化为齐墩果酸的反应示意图;
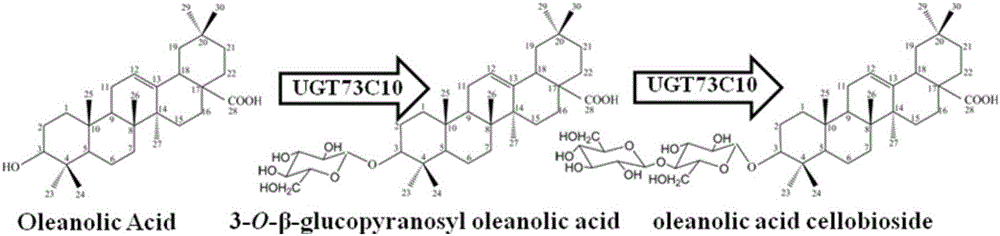
图2是基因UTG73C10编码的UDP-葡萄糖转移酶对齐墩果酸进行糖基化生成3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸的反应示意图;
图3是酿酒酵母工程菌株SpUOpTG的代谢网络示意图;
图4是酿酒酵母工程菌株SpUOpTG生产齐墩果酸,3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸的高效液相质谱分析图,4-1:胞内提取物中的齐墩果酸,4-2:胞内提取物中的3-O-葡萄糖基齐墩果酸,4-3:胞内提取物中的纤维二糖齐墩果酸,4-4:发酵液上清提取物中的3-O-葡萄糖基齐墩果酸,4-5转化后发酵液上清提取物中的纤维二糖齐墩果酸。
图5是酿酒酵母工程菌株SpUOpTG生产齐墩果酸气相质谱分析图。
具体实施方式
下面结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
以下实施例中使用的PCR引物序列:
实施例1合成基因CYP716A12、MtCPR以及UGT73C10
基因CYP716A12编码的P450细胞色素单加氧酶和基因MtCPR编码的细胞色素还原酶,共同作用能够将β-香树脂醇氧化生成齐墩果酸(见图1);基因UGT73C10编码的UDP-葡萄糖转移酶能够将齐墩果酸C-3位的羟基糖基化生成3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸(见图2)。从NCBI数据库中检索到来自蒺藜状苜蓿(Medicago truncatula)的P450细胞色素单加氧酶基因CYP716A12,来自蒺藜状苜蓿(Medicago truncatula)的细胞色素还原酶基因MtCPR以及来自欧洲山芥(Barbarea vulgaris)的UDP-葡萄糖转移酶的基因UGT73C10的序列,利用密码子优化软件JCAT对三个基因进行密码子优化,使其氨基酸编码序列符合酿酒酵母的密码子偏好性。优化后的P450细胞色素单加氧酶基因CYP716A12(SEQ ID NO.1)、细胞色素还原酶基因MtCPR(SEQ ID NO.2)、UGT73C10(SEQ ID NO.3)通过基因合成公司利 用化学法进行合成,并克隆到pUC57克隆载体上得到pUC57-CYP716A12、pUC57-MtCPR和pUC57-UGT73C10。
实施例2构建基因CYP716A12、MtCPR以及UGT73C10的表达载体
以由公司合成的经过密码子优化的pUC57-CYP716A12为模板,采用引物CYP716A12-F-BamHI和CYP716A12-R-SalI扩增蒺藜状苜蓿(Medicago truncatula)的P450细胞色素单加氧酶酶基因CYP716A12,得到长度1455bp的CYP716A12基因片段。通过限制性内切酶BamHI和SalI同时对基因片段和载体pESC-URA酶切,将上述所得基因片段与表达载体pESC-URA连接,转化大肠杆菌TOP10菌株,提取质粒pESC-URA-PGAL1-CYP716A12-TCYC1,对质粒上CYP716A12基因进行测序验证,其序列如SEQ ID No.1所示,结果表明正确无误。
以由公司合成的经过密码子优化的pUC57-CPR为模板,采用引物MtCPR-F-ClaI和MtCPR-R-NotI扩增蒺藜状苜蓿(Medicago truncatula)细胞色素还原酶基因MtCPR,得到长度2100bp的MtCPR基因片段。通过限制性内切酶ClaI和NotI同时对基因片段和载体pESC-URA-PGAL1-CYP716A12-TCYC1酶切,将上述所得基因片段与表达载体pESC-URA-PGAL1-CYP716A12-TCYC1连接,转化大肠杆菌TOP10菌株,提取质粒pESC-URA-PGAL1-CYP716A12-TCYC1-PGAL10-CPR-TADH1,对质粒上CPR基因进行测序验证,其序列如SEQ ID No.2所示,结果表明正确无误。
以由公司合成的经过密码子优化的pUC57-UGT73C10为模板,采用引物对UGT73C10-F-BamHI和UGT73C10-R-KpnI扩增欧洲山芥(Barbarea vulgaris)的UDP-葡萄糖转移酶基因UGT73C10,得到长度1504bp的UGT73C10基因片段。通过限制性内切酶BamHI和KpnI同时对基因片段和载体pESC-TRP酶切,将上述所得基因片段与表达载体pESC-TRP连接,转化大肠杆菌TOP10菌株,提取质粒pESC-TRP-PGAL1-UGT73C10-TCYC1,对质粒上UGT73C10基因进行测序验证,其序列如SEQ ID No.3所示,结果表明正确无误。
实施例3:构建生产齐墩果酸、3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸的工程化酿酒酵母
利用醋酸锂化学转化法将实施例2中构建的表达载体pESC-URA-PGAL1-CYP716A12-TCYC1-PGAL10-MtCPR-TADH1和pESC-TRP-PGAL1-UGT73C10-TCYC1,共转化到能够生产β-香树脂醇的酿酒酵母菌株Sgib中。将化转产物涂布于缺少尿嘧啶和色氨酸的含2%葡萄糖基础培养基(SD-URA-TRP)筛选平板上,30℃培养2-5天。从筛选平板上随机挑选6-10个克隆,分别提取其质粒。以提取的质粒为模板,采用引物对CYP716A12-F-BamHI和CYP716A12-R-SalI扩增蒺藜状苜蓿(Medicago truncatula)的P450细胞色素单加氧酶酶基因CYP716A12;引物对MtCPR-F-ClaI和MtCPR-R-NotI扩增蒺藜状苜蓿(Medicago truncatula)的细胞色素还原酶基因MtCPR;引物对UGT73C10-F-BamHI和UGT73C10-R-KpnI扩增欧洲山芥(Barbarea vulgaris)的UDP-葡萄糖转移酶基因UGT73C10验证转化结果,结果显示两个质粒已成功转化到酿酒酵母Sgib菌株中,并将该菌株命名为SpUOpTG,其代谢网络示意图如图3所示。
实施例4:利用酿酒酵母工程菌SpUOpTG生产齐墩果酸、3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸
挑取实施例3中构建的酿酒酵母工程菌SpUOpTG的单菌落接于SD-URA-TRP液体培养基中,30℃振荡培养36小时后,以体积比5%的接种量接于新的SD-URA-TRP液体培养基,30℃振荡培养48小时,添加半乳糖至2g/L,连续培养5天。发酵结束后,离心,分别收集菌体和上清。
将收集到的菌体置于1.5mL离心管中,添加600μL甲醇丙酮混合液(1:1)和直径1mm的玻璃珠,珠打破碎三次,每次5分钟;离心后收集上清,利用旋转蒸发仪在60℃条件下蒸发1个小时将液体蒸干;用色谱级甲醇对蒸干后的白色固体重溶,经0.2nm有机相滤膜过滤后利用注射器注入液相小瓶,利用液相 质谱对胞内产物进行检测,产物中有齐墩果酸、3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸,检测结果见图4。将液相小瓶中的样品再次蒸干后,利用N,O-双(三甲基硅基)三氟代乙酰胺试剂对其进行烷基化降低齐墩果酸熔点,利用气相质谱对胞内产物进行检测,检测结果如图5所示.
将收集到的上清置于表面蒸发皿中,加热蒸发至固体粉末;利用乙酸乙酯萃取后保留上清,利用旋转蒸发仪在60℃条件下蒸发1个小时将液体蒸干;用色谱级甲醇对蒸干后的白色固体重溶,经0.2nm有机相滤膜过滤后利用注射器注入液相小瓶,利用液相质谱对胞内产物进行检测,检测到3-O-葡萄糖基齐墩果酸和纤维二糖齐墩果酸,说明齐墩果酸的糖基化产物能够跨过工程化酿酒酵母的细胞膜,检测结果见图4。
- 还没有人留言评论。精彩留言会获得点赞!