聚集诱导发光液晶材料的合成及其在蓝色有机电致发光二极管中的应用的制作方法
本发明涉及聚集诱导发光液晶(AIE-LC)材料与有机电致发光二极管(OLEDs)器件领域:1、涉及两类以四苯乙烯-苯基吡啶刚性结构为发光内核,芳环共轭结构(4-氰基联苯、恶二唑、苯并菲)为液晶单元的AIE-LC蓝光材料;2、以其中的两个AIE-LC蓝光材料(TPE-PBN和TPE-2PBN)为发光层掺杂剂,以1,3-二咔唑9基-苯(mCP)作为主体材料,制备了OLEDs器件,获得了外量子效率(EQE)为4.1%的蓝光器件。
背景技术:
液晶材料具有有序结构和高电荷传输性能,过去几十年中在半导体领域得到了广泛的应用,如有机太阳能电池(OPV)[1,2],薄膜晶体管(TFT)[3,4],有机发光二极管(OLEDs)等[5,6]。然而,液晶分子通常是不发光的,这导致其在OLEDs中的应用较少。为了解决这个问题,设计既具有液晶性能又具有发光性能的材料,即液晶发光材料,具有巨大的发展前景。目前,液晶发光材料常用的分子设计思路是在发光材料的末端引入较多的柔性链来有效构筑液晶[7]。Kato和他的团队报道了一系列液晶发光分子,这些分子都是由刚性π-共轭结构(如芘,蒽)和外围的烷氧基链组成[8]。尽管这个方法能有效的获得液晶性能,但外围较多的柔性链使分子内振动增加造成能量的非辐射转换,导致材料的发光效率(ΦPL)不理想。
为了提高液晶发光材料的发光效率,最近有报道将一些过渡金属原子,如铂原子,引入到液晶材料中[9]。Bruce团队以苯基吡啶衍生物作为环金属铂配体,以乙酰丙酮作为辅助配体,合成了一系列基于环金属铂配合物液晶发光材料[10]。在我们的前期工作中,也探索了环金属铂配合物液晶发光材料的结构-性能关系[11]。然而,具有平面结构的环金属铂配合物容易发生聚集,导致其在高浓度溶液中和固体状态中(或器件)的发光都很弱。因此,在固体和器件中获得具有高效发光的液晶材料仍是一项非常艰巨的任务。
自2001年唐本忠团队首次报道聚集诱导发光(AIE)现象以来[12],AIE分子因其具有在固体薄膜中高效发光的特性而在OLEDs中得到广泛应用。因此,将AIE分子引入液晶材料中将会大大提高液晶材料的发光效率。现有技术中,文献报道了一种基于四苯乙烯的AIE液晶分子,在固体状态下发射较强的绿光[13]。尽管基于AIE性能的液晶发光材料在OLEDs显示中具有很好的应用前景,但针对高效蓝色液晶发光材料的研究仍然存在以下两个方面的问题:1、AIE蓝光液晶材料种类很少,且传统的液晶发光材料的分子结构复杂,合成难度大;2、基于AIE蓝光液晶材料的器件效率较低。
附:主要参考文献
(1)Sun,K.;Xiao,Z.Y.;Lu,S.R.;Zajaczkowski,W.;Pisula,W.;Hanssen,E.;White,J.M.;Williamson,R.M.;Subbiah,J.;Ouyang,J.Y.;Holmes,A.B.;Wong,W.W.H.;Jones,D.J.A molecular nematic liquid crystalline material for high-performance organic photovoltaics.Nat.Commun.2015,6,6013-6022.
(2)Hirai,Y.;Babu,S.S.;Praveen,V.K.;Yasuda,T.;Ayyappanpillai,A.;Kato,T.;Hirai,Y.;Babu,S.S.;Praveen,V.K.;Yasuda,T.;Ajayaghosh,A.;Kato,T.Anisotropic Self-Assembly of Photoluminescent Oligo(p-Phenylenevinylene)Derivatives in Liquid Crystals:An Effective Strategy for the Macroscopic Alignment ofπ-Gels.Adv.Mater.2009,21,4029-4033.
(3)Lino,H.;Usui,T.;Hanna,J.Liquid crystals for organic thin-film transistors.Nat.Commun.2015,6,6828-6836.
(4)Ye,Q.;Chang,J.J.;Shao,J.J.;Chi,C.Y.Large core-expanded triazatruxene-based discotic liquid crystals:synthesis,characterization and physical properties.J.Mater.Chem.2012,22,13180-13186.
(5)Liu,S.H.;Lin,M.S.;Chen,L.Y.;Hong,Y.H.;Tsai,C.H.;Wu,C.C.;Poloek,A.;Chi,Y.;Chen,C.A.;Chen,S.H.;Hsu,H.F.Polarized phosphorescent organic light-emitting devices adopting mesogenic host-guest systems.Org.Electron.2011,12,15-21.
(6)Dyreklev,P.;Berggren,M.;Inganas,O.;Andersson,M.R.;Wennerstrom,O.;Hjertberg,T.Polarized electroluminescence from an oriented substituted polythiophene in a light emitting diode.Adv.Mater.1995,7,43-45.
(7)Singh,H.;Balamurugan,A.;Jayakannan,M.Solid State Assemblies and Photophysical Characteristics of Linear and Bent-Coreπ-Conjugated Oligophenylenevinylenes.Appl.Mater.2013,5,5578-5591.
(8)Sagara,Y.;Kato,T.Stimuli-Responsive Luminescent Liquid Crystals:Change of Photoluminescent Colors Triggered by a Shear-Induced Phase Transition.Angew.Chem.Int.Ed.2008,47,5175-5178.
(9)Damm,C.;Israel,G.;Heqmann,T.;Tschierske,C.Recent progress in luminescent liquid crystal materials:design,properties and application for linearly polarised emission.J.Mater.Chem.C 2015,3,7993-8005.
(10)Wang,Y.F.;Chen,Q.;Li,Y.H.;Liu,Y.;Tan,H.;Yu,J.T.;Zhu,M.X.;Wu,H.B.;Zhu,W.G.;Cao,Y.Highly Dichroic Metallomesogen of Dinuclear Platinum Complex:Synthesis and Liquid Crystal and Photophysical Properties.J.Phys.Chem.C 2012,116,5908-5914.
(11)Santoro,A.;Whitwood,A.C.;Williams,J.A.G.;Kozhevnikov,V.N.;Bruce,D.W.Synthesis,Mesomorphism,and Luminescent Properties of Calamitic 2-Phenylpyridines and Their Complexes with Platinum(II).Chem.Mater.2009,21,3871-3882.
(12)Luo,J.D.;Xie,Z.L.;Lam,J.W.Y.;Cheng,L.;Chen,H.Y.;Qiu,C.F.;Kwok,H.S.;Zhan,X.W.;Liu,Y.Q.;Zhu,D.B.;Tang,B.Z.Aggregation-induced emission of 1-methyl-1,2,3,4,5-pentaphenylsilole.Chem.Commun.2001,18,1740-1741.
(13)Yuan,W.Z.;Yu,Z.Q.;Lu,P.;Deng,C.M.;Lam,J.W.Y.;Wang,Z.M.;Chen,E.Q.;Ma,Y.Q.;Tang,B.Z.High efficiency luminescent liquid crystal:aggregation-induced emission strategy and biaxially oriented mesomorphic structure.J.Mater.Chem.2012,22,3323-3326.
技术实现要素:
针对现有的AIE蓝光液晶材料存在的缺陷,本发明的目的是获得高效AIE蓝光液晶材料及有机电致发光二极管:一方面,设计合成以四苯乙烯-苯基吡啶刚性结构为发光内核、以芳环共轭结构(4-氰基联苯、恶二唑、苯并菲)为液晶单元的AIE蓝光液晶分子;另一方面,以其中的两个AIE蓝光液晶分子(TPE-PBN和TPE-2PBN)为发光层掺杂剂,以mCP为主体材料,制备了OLEDs器件,获得了外量子效率(EQE)为4.1%的蓝光OLEDs。其中分子中的TPE代表四苯乙烯-苯基吡啶单元,PBN代表4-氰基联苯单元。与现有的液晶发光材料技术相比,本发明的优势在于分子中含有更少的烷基/烷氧基支链,这有利于减少分子内振动,提高材料的发光效率。
本发明提供了两种新型的聚集诱导蓝色发光液晶材料,该液晶发光材料具有式1或式2所示结构:
其中:
n为6-12;
R为4-氰基联苯、2,5-二苯基恶二唑或苯并菲单元。
优选的AIE蓝光液晶材料中的n为6,R为4-氰基联苯(TPE-PBN和TPE-2PBN)。
本发明还提供了所述的AIE蓝光液晶材料的应用,该应用是将其作为发光材料掺杂剂应用于制备高效蓝色有机电致发光二极管的发光层。
优选的应用方法中以mCP为主体发光材料,与所述的AIE蓝光液晶材料混合制备器件的发光层,并获得了外量子效率高达4.1%蓝色荧光OLEDs。
本发明的蓝色荧光OLEDs器件结构为:ITO/PEDOT:PSS(40nm)/mCP:式1或式2(99:1,20nm)/TmPyPB(50nm)/Liq(1nm)/Al(100nm)。电子传输层为TmPyPB;主体材料为mCP;发光层为本发明优选的TPE-PBN和TPE-2PBN具有AIE液晶性能的蓝光材料和主体材料的共混涂层;阴极层为金属钙和Liq构成。
相对于现在又技术,本发明的有益效果在于:1、获得了两类具有AIE蓝光液晶材料。这类AIE液晶发光材料与现有的相比,主要优势体现在分子结构中含有较少的柔性链,并以末端刚性结构为液晶基元。较少的柔性链可有效的抑制分子内振动,减少分子的非辐射跃迁,提高材料的发光效率。2、这种分子构筑方式可有利于获得高效的蓝色荧光电致发光器件,其中基于TPE-PBN的掺杂OLEDs器件的外量子效率(EQE)为4.1%,这在蓝色荧光OLEDs器件领域中处于较高的水平之列。
附图说明
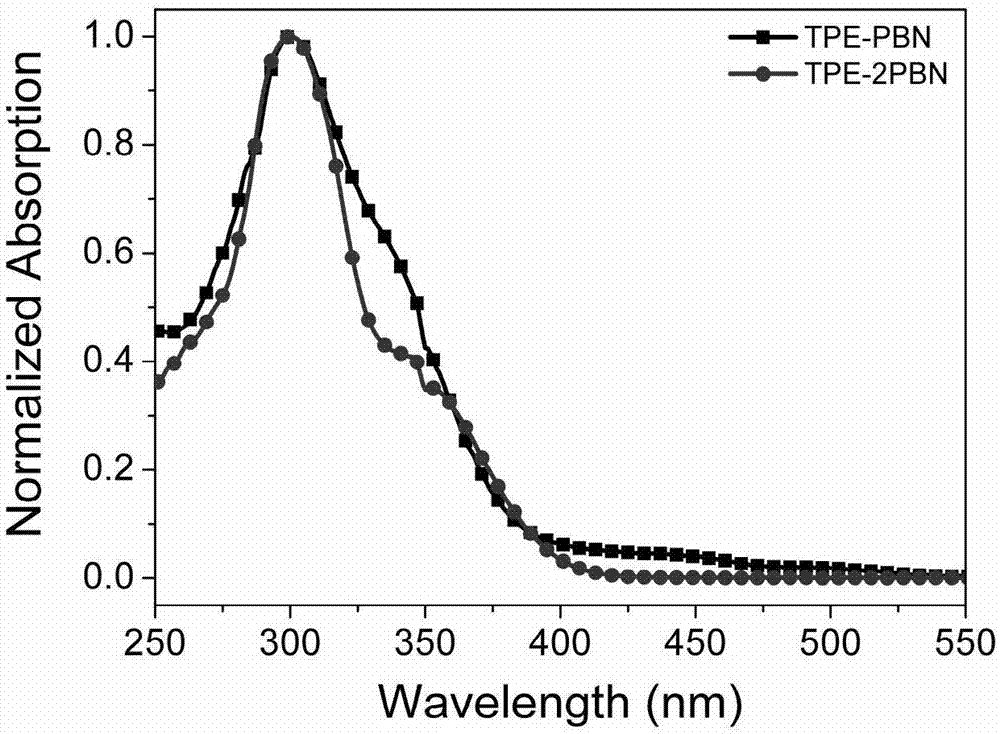
【图1】为本发明实施例1制得的TPE-PBN和TPE-2PBN在四氢呋喃(THF)溶液中的紫外-可见吸收光谱图
【图2a】为本发明实施例1制得的TPE-PBN在四氢呋喃(THF)溶液和THF/水混合物中的光致发光光谱图
【图2b】为本发明实施例1制得的TPE-2PBN在四氢呋喃(THF)溶液和THF/水混合物中的光致发光光谱图
【图3】为本发明实施例1制得的TPE-PBN和TPE-2PBN的热失重(TGA)图
【图4a】为本发明实施例1制得的TPE-PBN的差示扫描量热(DSC)曲线
【图4b】为本发明实施例1制得的TPE-2PBN的差示扫描量热(DSC)曲线
【图5】为本发明实施例1制得的TPE-PBN和TPE-2PBN在降温过程中的偏光显微镜图(POM)(左:TPE-PBN;右:TPE-2PBN)
【图6a】为本发明实施例1制得的TPE-PBN在升温过程中的X射线衍射曲线(XRD)
【图6b】为本发明实施例1制得的TPE-2PBN在升温过程中的X射线衍射曲线(XRD)
【图7】为本发明实施例1制得的TPE-PBN和TPE-2PBN掺杂器件的电致发光光谱图(EL)
【图8】为本发明实施例1制得的TPE-PBN掺杂器件的电流密度-电压-亮度曲线图(J-V-I)
【图9】为本发明实施例1制得的TPE-PBN掺杂器件的外量子效率曲线图(EQE)
具体实施方案
以下具体实施例旨在对本发明作进一步说明,但这些具体实施方案不以任何方式限制本发明的保护范围。
实施例1
TPE-PBN和TPE-2PBN的制备,合成路线如下:
4′-(6-溴己氧基)-联苯-4-甲腈的制备(1)
在250mL三口瓶中,依次加入氰基联苯酚(5.0g,25.6mmol),1,6-二溴己烷(31.0g,128.0mmol),碳酸钾(17.7g,128.0mmol)和碘化钾(127mg,0.8mmol)于200mL丙酮溶液中,抽真空氮气保护,回流反应24h。冷却至室温,反应液用稀HCl调pH=7,蒸馏除去丙酮,然后用CH2Cl2(3×20mL)萃取。萃取液经水洗(3×20mL)、无水硫酸镁干燥、柱分离(PE),得无色透明固体8.2g(产率:86.0%)。1H NMR(400MHz,CDCl3),δ:7.69(d,J=8.0Hz,2H),7.64(d,J=8.0Hz,2H),7.53(d,J=8.0Hz,2H),6.99(d,J=8.6Hz,2H),4.02(t,J=8.0Hz,2H),3.44(t,J=8.0Hz,2H),1.91(t,J=8.0Hz,2H),1.83(t,J=8.0Hz,2H),1.53(t,J=4Hz,4H).MALDI-MS(m/z):calcd.357.07;found.357.02.
化合物3的制备
在250mL三口瓶中,依次加入6-(4-溴苯基)-3-吡啶甲醇(1.0g,3.8mmol),NaH(0.5g,19.0mmol)和25mL DMF,室温下反应15min。再在0℃下缓慢滴加化合物1(1.6g,4.5mmol),反应30min。然后,升温至室温反应24h。加20mL水终止反应,反应液用CH2Cl2(3×20mL)萃取,萃取液经水洗(3×20mL)、无水MgSO4干燥、减压除去溶剂、柱分离(PE/CH2Cl2=2/1),得浅黄色固体2.06g(产率:84.1%)。1H NMR(400MHz,CDCl3),δ:8.66(s,1H),7.89(d,J=12.0Hz,2H),7.78(d,J=8.0Hz,1H),7.72(d,J=4.0Hz,1H),7.70(d,J=4.0Hz,2H),7.65(d,J=8.0Hz,2H),7.61(d,J=8.0Hz,2H),7.54(d,J=8.0Hz,2H),7.00(d,J=8.0Hz,2H),4.58(s,2H),4.03(t,J=8.0Hz,2H),3.56(t,J=8.0Hz,2H),1.85(t,J=8.0Hz,2H),1.71(t,J=8.0Hz,2H),1.52(t,J=4.0Hz,4H).MALDI-MS(m/z):calcd.540.14;found.541.12.
化合物4的制备
在250mL三口瓶中,用150mL重蒸处理的四氢呋喃溶解二苯甲烷(10.0g,59.5mmol),在0℃下缓慢滴加n-BuLi(25mL,2.5M),反应30min,缓慢滴加4-溴苯甲酰苯(5.2g,20.0mmol)。然后,升温至室温反应6h,用氯化铵猝灭,反应液用CH2Cl2萃取(3×20mL),萃取液经水洗(3×20mL)、无水MgSO4干燥、减压除去溶剂得到醇。
用甲苯将上述醇溶液溶解,加入对甲苯磺酸(1.7g,0.01mol),用水分蒸馏装置在110℃下反应3-4h。反应液用碳酸氢钠萃取,萃取液经水洗(3×20mL)、无水MgSO4干燥、减压除去溶剂、柱分离(PE),得白色固体5.3g(产率:66%)。1H NMR(400MHz,CDCl3),δ:7.22(d,J=8Hz,2H),7.13-7.10(m,9H),7.02(m,6H),6.90(d,J=12Hz,2H).MALDI-MS(m/z):calcd.410.07;found.410.02.
化合物6的制备
在250mL三口瓶中,用100mL重蒸处理的四氢呋喃溶解4-溴二苯甲酮(5.0g,19.1mmol),失活处理过的锌粉(2.5g,38.2mmol)。抽真空,氮气保护,在-78℃下缓慢滴加TiCl4(3.6g,19.1mmol),升温至室温反应30min,然后加热回流反应24h。反应用10%碳酸钾溶液猝灭,然后用CH2Cl2萃取(3×20mL),萃取液经水洗(3×20mL)、无水硫酸镁干燥、柱分离(PE),得白色固体7.0g(产率:75.0%)。1H NMR(400MHz,CDCl3),δ:7.27(t,J=8.0Hz,4H),7.16(m,6H),7.01(m,4H),6.90(t,J=8.0Hz,4H).MALDI-MS(m/z):calcd.487.98;found.408.44.
化合物5、7的制备
在250mL单口瓶中,依次加入四苯乙烯溴代物4或6(1eq),双嚬哪醇硼酸酯(1eq或2eq),KOAc(4eq或8eq),PdCl2(dppf)2·CH2Cl2(0.03eq或0.06eq),用1,4-二氧六环溶解,氮气保护下,加热至80℃反应24h。冷却至室温,蒸馏除去1,4-二氧六环,然后用CH2Cl2萃取,萃取液经水洗、无水硫酸镁干燥。
5:柱分离(PE/DCM=5/1),得白色固体2.1g(产率:76.0%)。1H NMR(400MHz,CDCl3),δ:7.54(d,J=8Hz,2H),7.09(m,10H),7.01-7.04(m,7H),1.32(s,12H).MALDI-MS(m/z):calcd.458.24;found.457.70.
7:柱分离(PE/DCM=5/1),得白色固体720mg(产率:60.0%)。1H NMR(400MHz,CDCl3),δ:7.56(d,J=8.0Hz,4H),7.10(m,6H),7.04(m,8H),1.31(s,24H).MALDI-MS(m/z):calcd.584.33;found.584.85.
化合物TPE-PBN和TPE-2PBN的制备
在250mL单口瓶中,依次加入白色固体5或7(1eq),浅黄色固体3(1eq或2eq),2M碳酸钾溶液(4eq或8eq),四(三苯基膦)合钯(0.03eq或0.06eq),用四氢呋喃溶解,氮气保护下,加热至65℃反应24h。冷却至室温,蒸馏除去四氢呋喃,然后用CH2Cl2(3×20mL)萃取,萃取液经水洗(3×20mL)、无水硫酸镁干燥。
TPE-PBN:柱分离(PE/DCM=2/1),得白色固体197.3mg(产率:67.0%)。1H NMR(400MHz,CDCl3),δ:8.65(s,1H),8.02(d,J=8Hz,2H),7.76(d,J=8Hz,2H),7.69-7.61(m,6H),7.51(d,J=4Hz,2H),7.41(d,J=8Hz,2H),7.14-7.03(m,17H),6.98(d,J=8Hz,2H),4.56(s,2H),4.01(d,J=8Hz,2H),3.54(t,J=8Hz,2H),1.83(t,J=8Hz,2H),1.69(t,J=8Hz,2H),1.50(t,J=4Hz,4H).13C NMR(100MHz,CDCl3),δ(ppm):159.78,156.42,149.13,145.28,143.77,143.72,143.14,141.27,141.17,140.49,138.14,137.86,136.32,132.58,132.38,131.88,131.44,131.37,131.30,128.34,127.82,127.74,127.67,127.18,127.17,127.08,126.56,126.47,126.16,120.12,119.13,115.11,110.05,70.59,70.29,68.03,29.74,29.68,29.18,26.00,25.91.MALDI-MS(m/z):calcd.792.37found.792.37.
TPE-2PBN:柱分离(PE/DCM=5/1),得亮黄色固体250.0mg(产率:60.0%)。1H NMR(400MHz,CDCl3),δ:8.68(s,2H),8.06(d,J=8Hz,4H),7.78(d,J=4Hz,4H),7.72-7.66(m,12H),7.54(d,J=8Hz,4H),7.45(d,J=8Hz,4H),7.18-7.14(m,14H),7.01(d,J=12Hz,4H),4.59(s,4H),4.03(d,J=8Hz,4H),3.56(d,J=8Hz,4H),1.85(t,J=8Hz,4H),1.71(t,J=8Hz,4H),1.52(t,J=4Hz,8H).13C NMR(100MHz,CDCl3),δ(ppm):159.78,156.42,149.13,145.28,143.77,143.72,143.14,141.27,141.17,140.49,138.14,137.86,136.32,132.58,132.38,131.88,131.44,131.37,131.30,128.34,127.82,127.74,127.67,127.18,127.17,127.08,126.56,126.47,126.16,120.12,119.13,115.11,110.05,70.59,70.29,68.03,29.74,29.68,29.18,26.00,25.91.MALDI-MS(m/z):calcd.1252.59;found.1252.35.
实施例2
实施例1中TPE-PBN和TPE-2PBN的AIE性能测试:
将TPE-PBN和TPE-2PBN分别配成10-5M的THF/水溶液混合物,在室温下分别测定不同比例水含量的光致发光性能,如图2a和图2b所示。
从图中(图2a)可以看出:激发波长为350nm时,TPE-PBN在fw(水含量)<80%的THF/水溶液中几乎不发光,继续增加水的含量,当fw为80%时,在478nm处出现较强的发射峰;当fw=95%时,发射强度最大,发光强度增加了125倍,并且最大发射峰红移了10nm。
激发波长为350nm时,TPE-2PBN也出现相似的现象(图2b),在fw<30%的THF/水溶液里,溶液几乎不发光。当fw=50%时,在453nm处出现较强的发射峰;继续增加水的含量至fw=70%时,发射峰红移了44nm;当fw=90%时,发光强度达到最大,增加了74倍,但是最大发射峰发蓝移了13nm。这主要是由于TPE-2PBN具有更大的分子扭曲度,在聚集的过程中,芳香环的扭曲结构为了更好形成晶体构型,从而出现激发波长蓝移。
实施例3
实施例1中的化合物TPE-PBN和TPE-2PBN的液晶性能测试:
分别通过热失重分析(图3)、差示扫描量热法(图4)、偏光显微镜(图5)和变温XRD(图6)测了这两种化合物的液晶性能。测试结果表明TPE-PBN具有较好的近晶相液晶(图4a、图5左、图6a),而TPE-2PBN具有较好的柱状相液晶(图4b、图5右、图6b)。
实施例4
基于实施例1中的化合物TPE-PBN和TPE-2PBN的有机电致发光器件(OLEDs)的制作方案和发光性能的测试:
该实施例中的蓝色荧光OLEDs器件结构为:ITO/PEDOT:PSS(40nm)/mCP:TPE-PBN或TPE-2PBN(99:1,20nm)/TmPyPB(50nm)/Liq(1nm)/Al(100nm)。电子传输层为TmPyPB;主体材料为mCP;发光层为本发明优选的TPE-PBN和TPE-2PBN具有AIE液晶性能的蓝光材料和主体材料的共混涂层;阴极层为金属钙和八羟基喹啉锂(Liq)构成。
器件的制作程序:在用丙酮、紫外等程序处理好的ITO玻璃上,旋转涂敷40nm的聚二氧乙基噻吩/聚对苯乙烯磺酸(PEDOT-PSS)(Bayer Batron P4083)空穴注入层、20nm厚的发光层,50nm的电子传输层,然后依次蒸镀1nm Liq层和100nm铝(Al)层。器件的发光面积为0.2cm2。
图7为掺杂器件的EL光谱图和色坐标图。如图所示,基于TPE-PBN和TPE-2PBN的器件分别在469nm和478nm处呈现最大的发射峰,其色坐标分别在(0.18,0.24)和(0.19,0.28),属于蓝光发射。
图8、图9分别为器件的电流-电压-亮度曲线和外量子效率曲线。由图可知,这两个器件的启动电压都为9V。其中基于TPE-PBN的器件显示最大亮度1308cd m-2(16V,153mAcm-2),最大电流效率6.2cd A-1和最大外量子效率4.1%。基于TPE-2PBN的器件显示最大亮度1612cd m-2(19V,213mA cm-2),最大电流效率2.7cd A-1和最大外量子效率1.5%。相对于已报道的蓝色荧光电致发光器件,TPE-PBN的器件外量子效率已经接近理论内量子效率值(5%)。
尽管结合了优选实施例对本发明进行了说明,但本发明并不局限于上述实施例,应当理解所附权利要求概括了本发明的范围。在本发明构思的指导下,本领域的技术人员应当意识到,对本发明的各实施例方案所进行的一定的改变,都将被本发明的权利要求书的精神和范围所覆盖。
- 还没有人留言评论。精彩留言会获得点赞!