一种消除PCR反应试剂自带的内源核酸污染的方法与流程
本发明属于生物
技术领域:
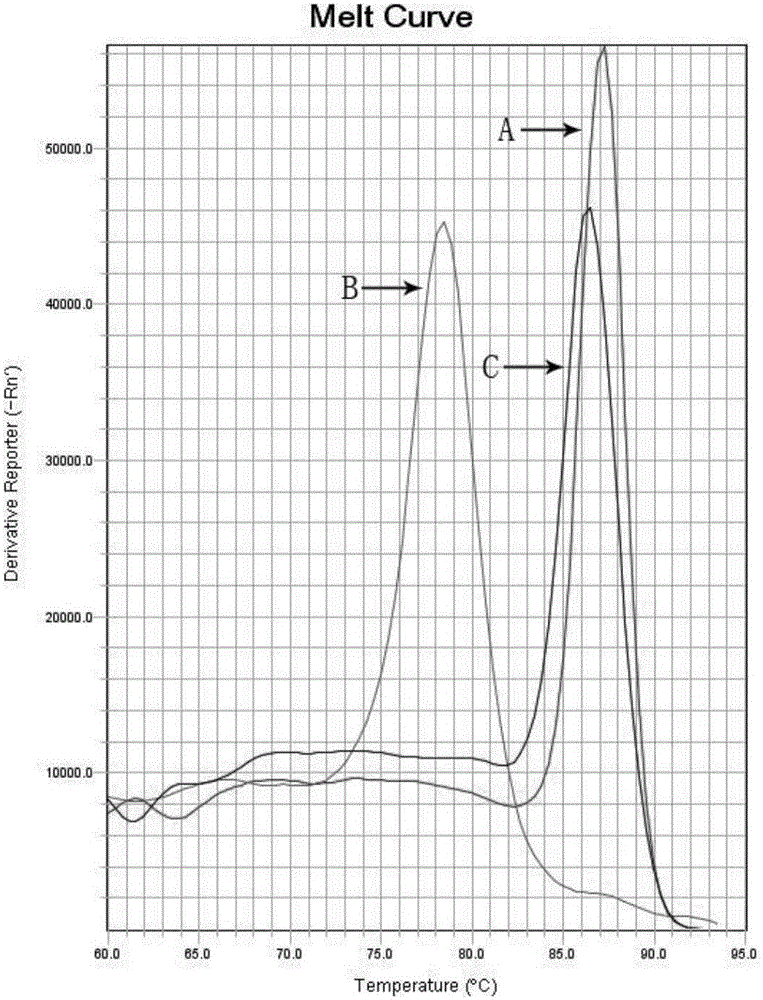
,涉及一种基于II型限制性核酸内切酶消除PCR反应试剂自带的内源核酸污染的方法。技术背景聚合酶链式反应(Polymerasechainreaction,PCR),是现阶段体外酶促合成特异DNA片段的一种常用且高灵敏度的方法。然而,过高的灵敏度使得PCR反应会因为核酸污染而产生假阳性结果,这是PCR方法面临的最大问题。虽然最常见的PCR污染是产物污染,但是在配置PCR反应体系的各种原材料中也存在着能够引起假阳性实验结果的污染源。在PCR反应试剂中,DNA聚合酶主要来源于大肠杆菌工程菌株,目前市面上销售的DNA聚合酶都不能保证其中没有细菌DNA,只是DNA的拷贝数多与少的问题。同时,市面上销售的dNTP也主要消化自细菌基因组DNA,因此也不能保证其中没有基因组DNA的存在。因此,在进行实时荧光定量PCR时,在没有产物污染的情况下,也存在由于设计的引物与内源核酸匹配而引起假阳性结果的可能。目前,常用的和主流的防污染方法主要针对PCR产物,对于反应原材料中携带性核酸污染的去除研究较少,主要是通过过滤的方式尽可能的去除内源污染。但是使用过滤法不能完全去除内源性核酸,同时还会产生大量的浪费。技术实现要素:本发明的目的是提供一种消除聚合酶链式反应体系原材料中自带的内源污染,排除由于内源核酸而产生的PCR假阳性实验结果。而本发明采取的利用II型限制性核酸内切酶建立的防止内源性污染方法既能够去除内源核酸又不会产生不必要的浪费。本发明包括的实验步骤:(1)、依据供货商提供的资料确定DNA聚合酶和dNTP的来源菌株,利用NCBI数据库,以来源菌株的种类为首选,对设计的引物进行序列比对,找寻潜在的结合位点,确认可能存在的污染片段。(2)、对污染片段进行酶切位点分析,找出序列中存在的限制性核酸内切酶,选取适宜的II型限制性核酸内切酶。(3)、将PCR反应体系在适宜的酶切温度下孵育一段时间,从而使得所述的限制性核酸内切酶完全消化反应体系中存在的内源核酸污染。(4)、灭活PCR反应体系中的所述IIS型限制性内切酶,从而获得II型限制性内切酶被灭活的PCR反应体系。(5)、对步骤(4)中获得的PCR反应体系进行分装机模板的添加,然后进行PCR扩增,当内源核酸污染被除去后,NTC空白对照将因为没有模板而无法获得PCR产物,显示为阴性状态。在优选例中,所述的污染是步骤(3)之前的,能够干扰步骤(5)的实验结果,源于反应原材料自有的内源核酸DNA。在优选例中,在步骤(3)中,在适宜的酶切温度下的孵育时间为5-50分钟,最佳地孵育时间为10-15分钟。在优选例中,在步骤(4)中,最适的II限制性核酸内切酶的灭活温度下的孵育时间为5-15分钟,最佳地孵育时间为10分钟。在优选例中,所述的II型限制性核酸内切酶选自下组:BamHI、DpnI、EcoRI、EcoRV、HindIII、KpnI、PstI、SacI、SalI、XbaI;本发明的有益效果:(1)、本发明方法可以消除PCR反应原材料中的内源核酸DNA,不影响正常扩增和特异性,不存在试剂的浪费;(2)、本发明方法可以单独的对各反应原材料进行处理,也可以对配置好的PCR反应体系进行处理;(3)、本发明方法的反应体系仍然是PCR标准体系,若是对配置好的PCR反应体系进行处理,只需向原有的PCR体系中加入适宜的II型限制性核酸内切酶,不改变PCR反应程序即可消除内源性核酸污染。附图说明图1:实施例酶切消化特异性试验结果,其中A为处理的PCR反应液加细菌DNA的实验结果;B为处理的PCR反应液加无核酸无核酸酶水的实验结果;C为未处理的PCR反应液加无核酸无核酸酶水的实验结果。具体实施方法下面以具体实施例进一步阐明本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外,应理解,在阅读了本发明讲授的内容之后,本领域的技术人员可以对本发明作各式改动,但这些等价形式同样落于本申请所附权利要求书所限定的范围。下列实施例未注明具体条件的实验方法,通常按照常规条件,如:分子克隆操作手册,或按照制造厂商所建议的条件。II型限制性核酸内切酶EcoRI为ThermoFisherScientific公司产品。实施例为了考察本方法对反应原材料携带的内源核酸DNA的去除效果,以处理的PCR反应液加大肠埃希菌DNA为阳性对照1,以未处理的PCR反应液加无核酸无核酸酶水为阳性对照2,以处理的PCR反应液加无核酸无核酸酶水为阴性对照进行PCR程序运行。1、引物设计依据NCBI数据库中提供的大肠埃希菌的基因序列为模板设计引物,如下:上游引物:TCCTACGGGAGGCAGCAGT下游引物:GGACTACCAGGGTATCTAATCCTGTT2、PCR体系PCR体系(20ul)处理的PCR反应液(ul)未处理的PCR反应液(ul)10XTaqBuffer22dNTP(25mM)0.240.24正向引物(10uM)0.40.4反向引物(10uM)0.40.4模板22TaqDNA聚合酶(5U/ul)0.20.2SYBRGreen染料(10X)0.80.8EcoRI(1U/ul)0.025--水11.85511.96注:反应液分装入反应管后再加入模板。3、反应参数(1)、反应液消化处理过程37℃10分钟EcoRI消化配置的反应液中的内源核酸DNA80℃10分钟灭活EcoRI(2)、分装反应液,并分别向其中加入细菌DNA和无核酸无核酸酶的水。(3)、PCR运行程序Step195℃,10分钟Step2(40循环)95℃,5秒;60℃,45秒Step3熔解曲线生成4、实验结果为了评价本发明是否能消除反应原材料中的内源核酸污染,我们在上述条件下,将反应液分成3组用实时荧光定量PCR进行验证,熔解曲线的实验结果如图1所示。其中A为处理的PCR反应液加细菌DNA的实验结果;B为处理的PCR反应液加无核酸无核酸酶水的实验结果;C为未处理的PCR反应液加无核酸无核酸酶水的实验结果。由图1可见,未经II型限制性核酸内切酶消化的PCR反应液能够以原材料中自带的内源核酸DNA为模板进行PCR扩增(C),使得实验结果呈现假阳性。而经II型限制性核酸内切酶消化的PCR反应液因为没有适合的模板进行PCR扩增(B),使得结果表现正常为阴性。同时,经II型限制性核酸内切酶消化的PCR反应液以细菌DNA为模板能够进行正常的PCR扩增,表明PCR反应体系是可用的。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1