一种软骨细胞的培养方法与流程
本发明属于细胞
技术领域:
,具体涉及一种软骨细胞的培养方法。
背景技术:
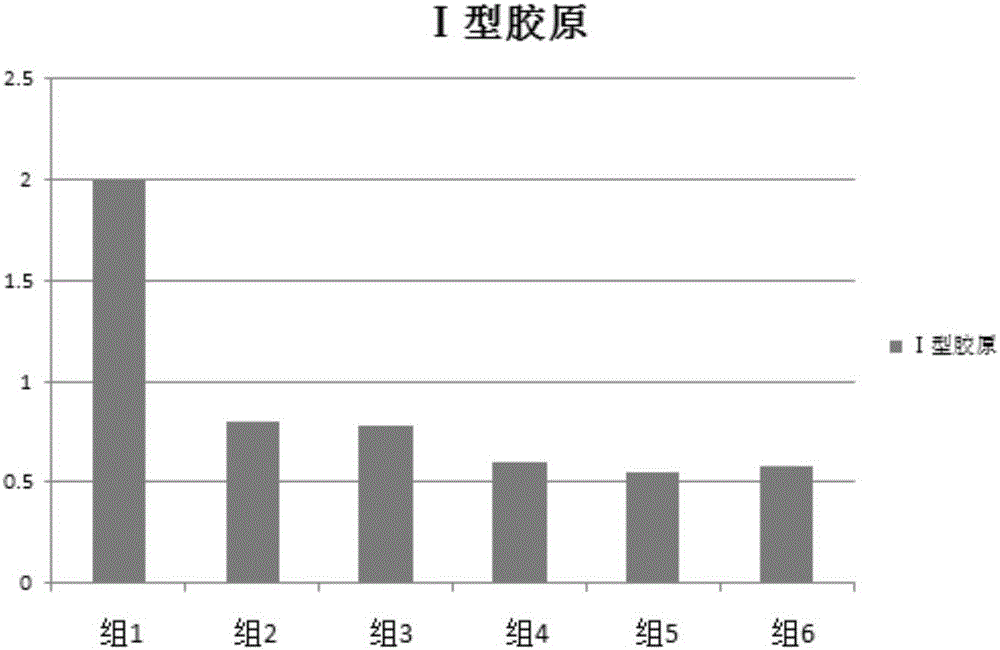
:软骨是有软骨细胞和细胞外基质组成的无血管组织,软骨细胞是关节软骨中唯一的细胞类型,其主要功能是通过分泌II型胶原(typeIIcollagen)及蛋白多糖(aggrecan,Acan)等保持关节软骨的功能,在正常生理条件下,软骨细胞的合成和分解代谢维持着动态平衡。而软骨细胞主要依靠关节的运动和挤压吸收营养物质,无血液供应,细胞代谢缓慢,所以软骨损伤后自我修复能力比较弱,受损关节软骨的修复一直以来都是医学界的难题之一。现有软骨缺损的治疗方法中,反映较好的一种疗法是自体软骨细胞移植(ACI),将正常软骨细胞在体外进行定向(细胞)培养后,再移植至机体内的软骨损伤处。然而,在体外培养过程中由于失去了机体内特定的增殖环境以及本身细胞的全能性因素,软骨细胞体外培养出现了增殖速度较慢并伴随细胞退化的现象,使得体外培养的软骨细胞回植后常常形成纤维软骨,使得软骨的机械性能下降,导致进行透明软骨修复的效果达不到预期,成为影响受损关节软骨治疗的一个主要问题。因此,研发出一种软骨细胞的培养方法,用于解决现有技术中增殖速度较慢并伴随细胞退化的技术缺陷,是本领域技术人员亟待解决的技术问题。技术实现要素:为了克服上述技术缺陷,本发明公开了一种能实现体外培养软骨细胞时既能使细胞大量增殖,同时又能保持软骨细胞的特性的软骨细胞的培养方法。为了实现上述发明目的,本发明的具体技术方案如下:一种软骨细胞的培养方法,包括:a)将软骨细胞接种到三维支架上,开启循环压力控制系统,进行培养;b)培养3~5天后,更换新鲜的无血清培养液并添加莱菔硫烷,继续培养。优选的,所述无血清培养液包含:基础培养基、血清替代物和生长因子。优选的,所述基础培养基为DMEM培养基。优选的,所述生长因子包含:碱性成纤维生长因子、转化生长因子、血小板衍生生长因子、转录因子E2F-1、表皮生长因子、骨形成蛋白和转录因子bHLH。优选的,所述血清替代物包含:层粘连蛋白和大豆蛋白酶抑制剂。在一些实施方案中,所述无血清培养液中所述生长因子由20μg/L碱性成纤维生长因子、20μg/L转化生长因子、12μg/L血小板衍生生长因子、0.5μg/L转录因子E2F-1、20μg/L表皮生长因子、12μg/L骨形成蛋白和0.5μg/L转录因子bHLH组成;所述血清替代物由12μg/L层粘连蛋白、2-10mg/L大豆蛋白酶抑制剂、10g/L葡聚糖、80mg/L丙酮酸钠、2mg/L氢化可的松、2μg/L亚硒酸钠、50mg/L维生素C、5mg/L转铁蛋白、20μg/L生长激素、20-100μM丁二胺、0.5ml/L脂类浓缩剂、0.2μM三碘甲状腺氨酸、0.2μg/L地塞米松、25μMβ-巯基乙醇、200μg/ml谷氨酰胺、40μg/L胰岛素或胰岛素样生长因子、10nM孕酮、2.5mg/L氯化胆碱和632mg/L氨基酸组成。进一步的,所述氨基酸优选为由300mg/LL-精氨酸、20mg/LL-谷氨酸、15mg/LL-组氨酸、40mg/LL-异亮氨酸、15mg/LL-甲硫氨酸、20mg/LL-脯氨酸、20mg/LL-苏氨酸、22mg/LL-酪氨酸、20mg/LL-门冬氨酸、10mg/L甘氨酸、20mg/LL-羟脯氨酸、60mg/LL-亮氨酸、15mg/LL-苯丙氨酸、30mg/LL-丝氨酸、5mg/LL-色氨酸和20mg/LL-缬氨酸组成。优选的,所述莱菔硫烷的浓度为1~10μM。优选的,所述循环压力控制系统设置的循环压力波动幅度为5~200KPa,频率为1~5Hz。优选的,所述三维支架为三维胶原支架材料。优选的,所述三维胶原支架铺在BioPress细胞培养板孔内。优选的,所述BioPress细胞培养板与所述循环压力控制系统配套使用。与现有技术相比,本发明公开的一种软骨细胞的培养方法采用无血清培养液作为培养基,结合循环压力控制系统,在三维胶原支架上对软骨细胞进行了三维培养,不仅避免了含血清培养基的动物源性成分带来的干扰,还减少细胞分化,加速细胞倍增;同时,在软骨细胞的培养过程中,还添加了莱菔硫烷,进一步缓解软骨细胞体外培养时的退化现象,为临床用软骨细胞的培养提供一种新的方法。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。图1为软骨细胞增殖曲线图,其中,系列1代表对比例1,系列2代表对比例2,系列3代表对比例3,系列4代表实施例1,系列5代表实施例2,系列6代表实施例3;图2为软骨细胞外基质的Ⅰ型胶原含量柱状图,其中,组1代表对比例1,组2代表对比例2,组3代表对比例3,组4代表实施例1,组5代表实施例2,组6代表实施例3;图3为软骨细胞外基质的Ⅱ型胶原含量柱状图,其中,组1代表对比例1,组2代表对比例2,组3代表对比例3,组4代表实施例1,组5代表实施例2,组6代表实施例3;图4为软骨细胞外基质的蛋白多糖含量柱状图,其中,组1代表对比例1,组2代表对比例2,组3代表对比例3,组4代表实施例1,组5代表实施例2,组6代表实施例3。具体实施方式本发明公开了一种软骨细胞的培养方法,本发明培养方法既能促进软骨细胞的大量增殖,又能有效避免软骨细胞体外培养过程中的分化,可应用于临床用软骨细胞的培养。本发明软骨细胞的培养方法,包括:将软骨细胞接种到三维支架上,开启循环压力控制系统,进行培养;待培养3~5天后,更换新鲜的无血清培养液并添加莱菔硫烷进行培养。其中,无血清培养液包含:基础培养基、血清替代物和生长因子;基础培养基可以为DMEM培养基、F12培养基或DMEM/F12培养基,优选为DMEM培养基。在本发明中采用无血清培养液作为细胞培养的培养基,为常规无血清培养基中添加层粘连蛋白和大豆蛋白酶抑制剂制备得到,不含动物血清,能有效避免动物源性成分带来的干扰,减少细胞分化,加速细胞倍增。软骨基质主要由蛋白多糖和II型胶原组成,而软骨损伤及其降解往往是II型胶原被基质金属蛋白酶(MMPs)所降解,故抑制金属蛋白酶活性、提高软骨细胞分泌蛋白多糖和II型胶原是实现软骨细胞体外培养维持细胞特性的途径之一。莱菔硫烷是一种从十字花科植物中提取的异硫氰酸酯,别名萝卜硫素,具有消炎、抗肿瘤作用。另有研究表明,莱菔硫烷具有抑制软骨细胞金属蛋白酶的表达,从而降低其对软骨基质(Ⅱ型胶原)的降解作用,所以在软骨细胞培养过程中,添加莱菔硫烷具有很好的防止软骨细胞变性。在本发明实施例中,添加的莱菔硫烷的浓度可以为1~10μM,优选为2~8μM。循环压力装置是购置于flexcell公司的BioPress细胞培养板和FX-5000C压力加载系统,配套使用可提供软骨细胞培养过程中的循环压力,起到促进软骨细胞分泌软骨基质成分如蛋白多糖和Ⅱ型胶原。在本发明实施例中,循环压力控制系统设置的循环压力波动幅度为5~200KPa,频率为1~5Hz。三维细胞培养技术是细胞呈空间立体方式生长,使其更接近于体内生长模式,形成类似于体内组织的结构,发挥其功能。有利于细胞表型的维持和促进增殖,克服单层细胞培养在体外培养环境下容易发生退化且增殖较慢的问题。在组织工程学和临床上都有重要意义。在本发明实施例中,所选择的三维支架的为三维胶原支架,该三维胶原支架的材料形态可为方块、圆柱、球形等,其大小根据具体实验各有不同。下面将结合本发明的实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例只是本发明一部分实施例,而不是全部的实施例。本领域技术人员应当理解,对本发明的具体实施例进行修改或者对部分技术特征进行同等替换,而不脱离本发明技术方案的精神,均应涵盖在本发明保护的范围中。以下实施例中采用的材料和设备为:DMEM培养基,购自Gibco公司;层粘连蛋白,为重组层粘连蛋白LN511,购自上海逍鹏生物科技有限公司;大豆蛋白酶抑制剂,购自Sigma公司(T9003);莱菔硫烷,购自陕西源泰生物科技有限公司;Biopress细胞培养板和FX-5000C压力加载系统(配套使用)购自Flexcell公司。实施例11、软骨细胞的分离1)取人软骨组织若干,置于添加双抗(青霉素和链霉素)的PBS溶液中保存;2)运输至无菌实验室并置于超净台上,用添加了双抗的PBS溶液清洗2~3遍后,移至一个50mL规格的烧杯中;3)加入少量的Ⅱ型胶原酶溶液,用手术剪将软骨组织剪碎至1mm3;4)加入5~10倍组织体积的Ⅱ型胶原酶溶液(浓度为2~10mg/mL),置于37℃摇床上以100rpm的转速消化2~4h;5)收集消化液,过200目筛网,取滤液,再400g离心,取沉淀即得软骨细胞。2、无血清培养液的配制(1)无血清培养液的配方基础培养基:DMEM培养基;血清替代物:生长因子:(2)无血清培养液的制备以DMEM培养基作为基础培养基,按上述配方添加血清替代物和生长因子,混匀。3、三维培养支架构建购买无菌胶原材料,并在超净台上将无菌胶原材料用无菌手术剪剪至1cm×1cm×1cm(长×宽×高)的大小,铺在BioPress细胞培养板孔内。4、软骨细胞的三维体系培养1)将软骨细胞用无血清培养液稀释至2×105个细胞/mL,接种于BioPress细胞培养板孔内的三维支架上,置于培养箱中,开启FX-5000C压力加载系统,调整压力波动幅度:100KPa,频率3Hz;2)培养3~5天后,更换新鲜的无血清培养液并加入2μM莱菔硫烷处理24h,继续培养至汇合度为80%后收集细胞。实施例21、软骨细胞的分离具体操作同实施例1。2、无血清培养液的配制具体操作同实施例1。3、三维培养支架构建具体操作同实施例1。4、软骨细胞的三维体系培养1)将软骨细胞用无血清培养液稀释至2×105个细胞/mL,接种于BioPress细胞培养板孔内的三维支架上,置于培养箱中,开启FX-5000C压力加载系统,调整压力波动幅度:200KPa,频率5Hz;2)培养3~5天后,更换新鲜的无血清培养液并加入5μM莱菔硫烷处理24h,继续培养至汇合度为80%后收集细胞。实施例31、软骨细胞的分离同实施例1。2、无血清培养液的配制同实施例1。3、三维培养支架构建同实施例1。4、软骨细胞的三维体系培养1)将软骨细胞用无血清培养液稀释至2×105个细胞/mL,接种于BioPress细胞培养板孔内的三维支架上,置于培养箱中,开启FX-5000C压力加载系统,调整压力波动幅度:5KPa,频率2Hz;2)培养3~5天后,更换新鲜的无血清培养液并加入8μM莱菔硫烷处理24h,继续培养至汇合度为80%后收集细胞。对比例11、软骨细胞的分离具体操作同实施例1。2、软骨细胞的二维体系培养将软骨细胞用含10%胎牛血清的DMEM培养基稀释至2×105个细胞/mL,接种于6孔板内,置于培养箱中培养;待生长至80%汇合度后收集细胞。对比例21、软骨细胞的分离具体操作同实施例1。2、软骨细胞的二维体系培养将软骨细胞用含10%胎牛血清的DMEM培养基稀释至2×105个细胞/mL,接种于6孔板内,置于培养箱中培养;培养至汇合度达70%时,更换新鲜的培养基并添加8μM莱菔硫烷处理细胞24h,继续培养至汇合度为80%后收集细胞。对比例31、软骨细胞的分离具体操作同实施例12、采用无血清培养液对软骨细胞进行二维培养将软骨细胞用本发明的无血清培养液稀释至2×105个细胞/mL,接种于6孔板内,置于培养箱中培养;培养至汇合度达70%时,更换新鲜的培养基并添加5μM莱菔硫烷处理细胞24h,继续培养至汇合度为80%后收集细胞。实施例4效果测定1、细胞增殖能力测定在上述实施例1至实施例3中,自添加莱菔硫烷进行培养起,每3天细胞计数一次,绘制细胞生长曲线;待细胞培养至15天汇合度达80%后收集细胞,计算细胞总量和细胞活率。在上述对比例1至对比例3中,自软骨细胞经分离并进行培养起,每3天细胞计数一次,绘制细胞生长曲线;待细胞培养至15天汇合度达80%后收集细胞,计算细胞总量和细胞活率。2、Ⅰ型胶原、Ⅱ型胶原和糖胺聚糖的含量测定培养至15天后,采用ELISA试剂盒(上海双赢生物科技有限公司)分别检测软骨细胞分泌的细胞外基质中Ⅰ型胶原、Ⅱ型胶原和糖胺聚糖的含量,以对比软骨细胞培养效果。(1)Ⅰ型胶原和Ⅱ型胶原的测定:收集细胞培养液,按照Ⅰ、Ⅱ型胶原含量检测试剂盒说明书检测Ⅰ、Ⅱ型胶原的含量:a)将特异性抗原与固相载体联结,形成固相抗原;b)加稀释的条件培养基,在37℃条件下反应30min,条件培养基中的特异抗体与固相抗原结合,形成固相抗原抗-体复合物;c)加酶标抗抗体;d)加入酶促反应底物,发生显色反应,显色的深浅与待测抗体的量成正比。30分钟后,在562nm波长处用酶标仪检测吸光度值。(2)蛋白多糖测定:收集细胞培养液,按照糖胺聚糖含量检测试剂盒说明书检测糖胺聚糖的含量:a)将特异性抗原与固相载体联结,形成固相抗原;b)加稀释的条件培养基,在37℃条件下反应30min,条件培养基中的特异抗体与固相抗原结合,形成固相抗原抗-体复合物;c)加酶标抗抗体;d)加入酶促反应底物,发生显色反应,显色的深浅与待测抗体的量成正比。30分钟后,在562nm波长处用酶标仪检测吸光度值。3、实验结果表1为软骨细胞的增殖能力测定结果,图1为软骨细胞的生长曲线图,图2为软骨细胞外基质的Ⅰ型胶原含量柱状图,图3为软骨细胞外基质的Ⅱ型胶原含量柱状图,图4为软骨细胞外基质的蛋白多糖含量柱状图;其中,组1代表对比例1,组2代表对比例2,组3代表对比例3,组4代表实施例1,组5代表实施例2,组6代表实施例3。表1软骨细胞的增殖能力测定结果组别接种细胞量(105)15天后细胞总量(106)细胞活率(%)组121.0893.5%组223.2595.8%组323.8795.2%组424.9695.5%组525.2196.8%组624.8896.2%实验结果显示,在同等条件下,采用本发明所公开的培养方法进行培养的软骨细胞的生长速度高于对比组,进行培养15天后得到的软骨细胞的细胞数量和存活率均明显高于对比组。同时,通过本发明所提供的技术方案得到的软骨细胞(组4-组6)所分泌的Ⅰ型胶原分泌量明显低于对比例(组1-组3),实验组(组4-组6)所分泌的Ⅱ型胶原分泌量明显高于对比例(组1-组3),组2-组6的蛋白多糖分泌量差异不大,但明显高于组1。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1