一种基于硅溶胶密度梯度离心检测种子携带细菌的方法与流程
本发明属于种子质量检测技术领域,具体涉及检测种子携带细菌的方法。
背景技术:
目前,种子健康度检测在很多国家已成为种子“质量评估”、“植物检疫”过程中的例行措施,已成为种子质量控制体系中不可或缺的组成部分,有些国家建立了专门的种子健康测定实验室。种子健康测定是测定种子是否携带有病原菌(如真菌、细菌及病毒)、有害的动物(如线虫及害虫)等健康状况,即对种子所携带病虫害种类及数量进行检测,其中种子携带细菌的检测是种子健康度检测中的重要内容。如国际水稻所自1983年成立种子健康部(SEED HEALTH UNIT)及1987年建成种子健康试验室以来,开始了对种子健康的系统研究。
种子健康检测的目的在于:检测检疫性传染病害;确定种子批的使用价值;评定种子批是否需要经过种子处理;为调查或研究目的而评估某种传染病害的流行情况;探明种子发芽率低的原因,弥补发芽试验的不足。
传统的检测种子携带细菌的方法有洗涤法、琼脂皿法。
洗涤法:随机从种子批中抽取种子40粒,将种子放入已灭菌的250mL三角瓶中,然后加入灭菌水25mL,将三角瓶封口后置于转速为150rpm,25℃的摇床中充分震荡1h,收集悬浮液于已灭菌的10mL离心管中,以3000rpm的转速离心10min,去上清液后加入200μL无菌水悬浮沉淀。将悬浮液用灭菌水进行10倍系列浓度梯度稀释,然后涂LB固体平板进行检测。洗涤法仅能对种子表面携带的部分细菌进行分离,对种子内部的细菌无法分离,而且需要稀释洗涤液,需要多次试验才能较为完整的统计出种子表面携带的细菌种类和数量。同时,由于部分细菌的不可培养性,使用洗涤法不能分离出所有细菌的纯培养物,难以对种子携带的细菌种类进行有效的鉴定。
琼脂皿法:是国家标准GB/T3543.7-1995农作物种子—其它项目检验中规定的对种子携带的细菌进行分离检查方法。目前对种子携带细菌的检测,基本采用国家标准GB/T3543.7-1995中的琼脂皿法。随机从种子批中抽取种子40粒,5mL先用灭菌水清洗水稻种子1次,依次用70%乙醇2.5mL浸泡3min,2.5%的次氯酸钠2.5mL浸泡5min,70%乙醇2.5mL浸泡30s,接着用灭菌水冲洗种子3次,将种子晾干后,置于LB琼脂培养基上,每皿摆放10粒,每个处理4次重复,相同操作下用空白的LB平板作为环境对照,28℃恒温培养72h,然后检测水稻种子携带的细菌种类和数量。与洗涤法相同,由于部分细菌的不可培养性,使用琼脂皿法不能完全分离出所有细菌的纯培养物,难以对种子携带的细菌种类进行有效的鉴定。
硅溶胶属胶体溶液,为纳米级的二氧化硅颗粒在水中或溶剂中的分散液,无臭、无毒。Ludox HS40硅溶胶是一种粒径为12nm的合成无定形二氧化硅,二氧化硅含量为40%,密度为1.312g/mL。
技术实现要素:
本发明要解决的技术问题是克服种子携带细菌检测的现有技术中存在分离细菌种类少,不能完全反应种子所携带的细菌情况,以及分离时间长,不能满足快速检测的缺陷。
为解决上述技术问题,本发明提供一种基于硅溶胶密度梯度离心检测种子携带细菌的方法,包括以下步骤:
(1)待检水稻种子的准备
取待检水稻种子50粒,先用200mL灭菌水清洗待检水稻种子1~2次后,依次用70%乙醇2.5mL浸泡2~3min,2.5%的次氯酸钠2.5mL浸泡3~5min,70%乙醇2.5mL浸泡20s~30s,接着用灭菌水冲洗种子3~4次,将种子晾干后在灭菌研钵中磨碎,用50目筛子过滤,取50目筛子下面的磨碎水稻种子再用100目筛子过滤,取100目筛子下面的磨碎水稻种子置于直径为9cm的灭菌培养皿中备用;
(2)Ludox HS40等渗母液的配制
用10×PBS缓冲液与Ludox HS40硅溶胶按照1︰9体积比的比率混合制成Ludox HS40等渗母液,Ludox HS40等渗母液密度为1.308g/mL;
(3)配制不连续密度Ludox HS40分离工作液
按如下方法配制1#Ludox HS40分离工作液、2#Ludox HS40分离工作液、3#Ludox HS40分离工作液;
1#Ludox HS40分离工作液的配制:用10×PBS缓冲液1mL与9mL Ludox HS40等渗母液混合配制成的溶液即为1#Ludox HS40分离工作液,1#Ludox HS40分离工作液密度为1.108g/mL;
2#Ludox HS40分离工作液的配制:用10×PBS缓冲液4mL与6mL Ludox HS40等渗母液混合配制成的溶液即为2#Ludox HS40分离工作液,2#Ludox HS40分离工作液密度为1.082g/mL;
3#Ludox HS40分离工作液的配制:用10×PBS缓冲液6mL与4mL Ludox HS40等渗母液混合配制成的溶液即为3#Ludox HS40分离工作液,3#Ludox HS40分离工作液密度为1.042g/mL;
(4)在离心管中铺设不连续密度Ludox HS40分离工作液
在10mL灭菌离心管中,用移液器先铺设1#Ludox HS40分离工作液2mL,然后铺设2#Ludox HS40分离工作液2mL,最后铺设3#Ludox HS40分离工作液2mL,铺设完毕后,将离心管置于试管架上,不能晃动;
(5)离心
①取步骤(1)在灭菌培养皿中储备的磨碎水稻种子1.00g,置于10mL灭菌离心管中,再加入1×HEPES缓冲液8mL,在涡旋振荡器上混匀5min,室温放置5h后,取上清液在湘仪H1850R离心机上离心20min,离心条件为:3号转子,4℃,10000rpm,加速度值设为5,刹车值设为5;
②离心后,弃上清,沉淀用1×HEPES缓冲液1mL悬浮得悬浮液,取悬浮液300μL铺设于步骤(4)铺设有不连续密度Ludox HS40分离工作液的离心管中的溶液表面,每个样品检测做8次重复,铺设好后,在湘仪H1850R离心机上离心15min,离心条件为:3号转子,4℃,8500rpm,加速度值设为2,刹车值设为0,形成密度梯度分离层后,将离心管取出,用移液器吸取1#Ludox HS40分离工作液与2#Ludox HS40分离工作液之间的絮状界面层溶液;
(6)用1×TE缓冲液悬浮沉淀
将吸取的絮状界面层溶液装入新的离心管中,加入500μL 10×PBS缓冲液,混匀后,3000rpm离心2min,弃上清去除Ludox HS40,沉淀用1×TE缓冲液悬浮得1×TE悬浮液;
(7)种子携带细菌PCR扩增
以步骤(6)获得的1×TE悬浮液为总DNA模板,用上游引物799F和下游引物1492R进行PCR扩增,总体积为50μL的PCR反应体系为:DNA模板2μL, 1×Taq reaction 5μL,10nM/μL上游引物799F 2μL,10nM/μL下游引物1492R 2μL,1U/μL Taq酶2μL,2.5M/μL dNTPs 4μL,ddH2O 33μL;反应程序:94℃预变性5min,从94℃变性1min,52℃退火1min至72℃延伸1min,30个循环后,72℃延伸10min,4℃保存;PCR产物大小为750bp;所述上游引物799F的碱基序列如SEQ ID NO:1所示,下游引物1492R的碱基序列如SEQ ID NO:2所示;
(8)16S rDNA克隆文库的构建
将扩增得到的PCR产物在1.%的琼脂糖凝胶中电泳,电泳完毕后,在紫外灯下切取700~800bp条带,回收750bp条带,用T载体进行连接后转化JM109感受态细胞得到转化子,再加入SOC培养基培养,将培养后的SOC培养基涂到含有氨苄、IPTG和X-Gal的LB平板培养基上,待菌落长出后,随机挑取160个以上的白色菌落测序;
(9)16S rDNA克隆文库评价
按计算公式:C=(1-n1/N)×100%,其中n1为只含有一条序列的OTU的数目;N为随机挑取的所有白色菌落中出现的总的序列数目,并使用QIIME软件进行C值计算,C值为95%以上,按如下步骤(10)进行细菌种类分析;
(10)细菌种类分析
将步骤(8)的测序结果在NCBI上发布的16S rDNA序列进行序列比对确定细菌种类,经比对,序列相似性为97%以上的归为同一细菌种类。
与现有技术相比,本发明的有益效果是:
1、本发明方法避免了传统检测方法需要培养的步骤,能检测到尽可能全面的信息,能反映该批种子携带细菌的多样性水平。
在自然界中大量微生物是不能够培养的(王凤超,刘巍峰,陈冠军,等.环境微生物不依赖于培养的基因组学研究及应用[J].中国生物工程杂志,2006,26(9):76~83),因此,基于纯培养的方法虽然可以获得菌株实体,但由于培养条件限制,在一个批次的种子带菌检测中,仅能分离到数量有限的细菌,难以完全反映种子携带细菌的整体状况。而使用本发明物理分离的方法,避免了不能培养的细菌难以获得的弊端,可以检测到尽可能全面的信息,从而反映该批种子携带细菌的多样性水平。
2、大大节约时间和成本,且操作简单,分离检测一个样品时间为48h,能满足快速检测的需求。
16S rDNA是细菌的系统分类研究中最有用的和最常用的分子钟,其种类少,含量大(约占细菌RNA含量的80%),分子大小适中,存在于所有的生物中,其进化具有良好的时钟性质,在结构与功能上具有高度的保守性,素有“细菌化石”之称。在大多数原核生物中rDNA都具有多个拷贝,5S、16S、23S rDNA的拷贝数相同。16S rDNA由于大小适中,约1.5Kb左右,既能体现不同菌属之间的差异,又能利用测序技术较容易地得到其序列,相比较传统细菌检测方法,省去了显微观察、生理生化指标测定的步骤,检测一个样品时间为48h,可以大大节约时间和成本,且操作简单。而传统的洗涤法分离与琼脂皿法分离检测一个样品时间为1-2周,检测分离时间长,不能满足快速检测。
3、利用硅溶胶在离心管中铺设不连续密度Ludox HS40分离工作液,能将尽可能多的细菌分离纯化,提高了检测的准确性,克服了现有种子携带细菌检测技术中存在分离细菌种类少,不能完全反应种子所携带的细菌情况的缺陷。
Ludox HS40硅溶胶属胶体溶液,无臭、无毒。硅溶胶为纳米级的二氧化硅颗粒在水中或溶剂中的分散液,分散液的硅胶颗粒大小不一,经过高速离心后,可形成一个连续密度梯度,不同种类细菌比重、沉降系数不同,不同状态下的细菌比重、沉降系数也有差异,可将沉降系数不同的细菌分离纯化。活的不可培养(viable but non-culturable state,VBNC)细菌是细菌抵抗恶劣生存环境的一种自我保护形式。细菌在不良环境中,其细胞缩成球形或表现为细胞伸长,体积增大,用常规培养方法较难或无法进行分离培养,也不能进行检测,但仍具有代谢活性,在一定条件下仍可诱导复苏,具有潜在致病性。使用传统的琼脂皿法在细菌处于VBNC状态时,无法将其培养后进行检测,而使用Ludox HS40硅溶胶密度梯度离心,是根据沉降系数将细菌分离,不同细菌及处于不同状态的细菌沉降系数不同,可以通过密度梯度离心方法获得菌体,并通过PCR的方法将其检出,因此,本发明方法使用Ludox HS40硅溶胶密度梯度及其适宜的参数,相比现有的琼脂皿法,能分离检测到更多的细菌,具有传统分离方法不可比拟的优势。
附图说明
图1:本发明方法密度梯度离心的月亮谷种子携带细菌样品。箭头所指处为1#Ludox HS40分离工作液与2#Ludox HS40分离工作液之间的絮状界面层溶液,即为细菌分离层。
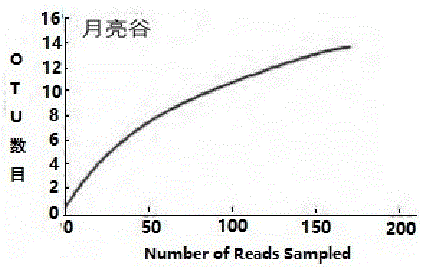
图2:月亮谷种子携带细菌16S rDNA克隆文库稀释曲线,曲线已经达到平台期,因此,可认为库容已经足够满足分析需要,其中横坐标为挑取克隆数,纵坐标为OTU(运算分类单位)的数目。
序列表中SEQ ID NO:1所示的是上游引物799F的碱基序列。
序列表中SEQ ID NO:2所示的是下游引物1492R的碱基序列。
具体实施方式
以下实施例涉及的试剂均为市售,各实施例无特殊说明为常规方法,待检水稻种子为月亮谷种子,由云南省元阳县种子管理站提供,月亮谷种子也是市售产品。
Ludox HS40硅溶胶为市售产品。Ludox HS40硅溶胶是一种粒径为12nm的合成无定形二氧化硅,二氧化硅含量为40%,密度为1.312g/mL。
实施例1
本发明方法,步骤如下:
(1)待检水稻种子的准备
取月亮谷种子50粒,先用200mL灭菌水清洗月亮谷种子1次,依次用体积分数为70%乙醇2.5mL浸泡3min,质量分数为2.5%的次氯酸钠2.5mL浸泡5min,体积分数为70%乙醇2.5mL浸泡30s,接着用灭菌水冲洗月亮谷种子3次,将种子晾干后在灭菌研钵中磨碎,先用50目的筛子过滤,取50目筛子下面的磨碎月亮谷种子,再用100目筛子过滤,取100目筛子下面的磨碎月亮谷种子置于直径为9cm的灭菌培养皿中备用。
(2)Ludox HS40等渗母液的配制
用10×PBS缓冲液与Ludox HS40硅溶胶按照1︰9体积比的比率混合制成Ludox HS40等渗母液,Ludox HS40等渗母液密度为1.308g/mL。
所述10×PBS缓冲液配制:酸二氢钾(KH2PO4):0.27g;磷酸氢二钠(Na2HPO4):1.42g;氯化钠(NaCl):8g;氯化钾(KCl)0.2g;加入800mL去离子水充分搅拌溶解,然后加入浓盐酸调pH值为7.4,最后定容到1L。
(3)配制不连续密度Ludox HS40分离工作液
用10×PBS缓冲液稀释Ludox HS40等渗母液而获得如下3种密度的Ludox HS40分离工作液用于细菌的分离。3种密度的Ludox HS40分离工作液的密度梯度为1.108g/mL、1.082g/m、1.042g/mL。具体按如下方法配制1#Ludox HS40分离工作液、2#Ludox HS40分离工作液、3#Ludox HS40分离工作液;
1#Ludox HS40分离工作液的配制:用10×PBS缓冲液1mL与9mL Ludox HS40等渗母液混合配制成溶液即为1#Ludox HS40分离工作液,1#Ludox HS40分离工作液密度为1.108g/mL;
2#Ludox HS40分离工作液的配制:用10×PBS缓冲液4mL与6mL Ludox HS40等渗母液混合配制成的溶液即为2#Ludox HS40分离工作液,2#Ludox HS40分离工作液密度为1.082g/mL;
3#Ludox HS40分离工作液的配制:用10×PBS缓冲液6mL与4mL Ludox HS40等渗母液混合配制成的溶液即为3#Ludox HS40分离工作液,3#Ludox HS40分离工作液密度为1.042g/mL;
以上10×PBS缓冲液为稀释液,Ludox HS40等渗母液为被稀释液。
密度梯度工作液的溶液密度计算方法如下:
①Vx=V0(ρ0-ρi)/(ρi-ρ10)
②ρi=(V0ρ0+Vxρ10)/(V0+Vx)
其中V0为被稀释液体积,ρ0为被稀释液密度,Vx为稀释液体积(mL),ρi为工作液密度(g/mL),通过上述公式②计算获得,ρ10为稀释液密度(g/mL)。
ρ0通过查阅购买的产品说明书获得,ρ10通过称量方法获得。
以上3种Ludox HS40分离工作液密度计算涉及的值见表1。
表1 3种Ludox HS40分离工作液的密度计算涉及的值
(4)在离心管中铺设不连续密度Ludox HS40分离工作液
在10mL灭菌离心管中,用移液器先铺设1#Ludox HS40分离工作液2mL,然后铺设2#Ludox HS40分离工作液2mL,最后铺设3#Ludox HS40分离工作液2mL,铺设完毕后,将离心管置于试管架上,不能晃动。
(5)离心
①取步骤(1)在灭菌培养皿中储备的磨碎水稻种子1.00g,置于10mL灭菌离心管中,再加入1×HEPES缓冲液8mL,在涡旋振荡器上混匀5min,室温放置5h后,取上清液在湘仪H1850R离心机上离心20min,离心条件为:3号转子,4℃,10000rpm,加速度值设为5,刹车值设为5;
②离心后,弃上清,沉淀用1×HEPES缓冲液1mL悬浮得悬浮液,取悬浮液300μL铺设于步骤(4)依次铺设有1#Ludox HS40分离工作液2mL,2#Ludox HS40分离工作液2mL和3#Ludox HS40分离工作液2mL的10mL离心管中的溶液表面,每个样品检测做8次重复,铺设好后,在湘仪H1850R离心机上离心15min,离心条件为:3号转子,4℃,8500rpm,加速度值设为2,刹车值设为0,形成密度梯度分离层后,将离心管取出,用移液器小心吸取1#Ludox HS40分离工作液与2#Ludox HS40分离工作液之间的絮状界面层溶液;
所述1×HEPES缓冲液配制:取100×HEPES储存液10mL,加入990mL ddH2O,配制成为1×HEPES缓冲液。
所述100×HEPES储存液的配制:取23.8g HEPES溶于90mL双蒸水中,用lmol/L NaOH调pH至7.5~8.0,然后用ddH2O定容至100mL,过滤除菌,4℃或-20℃保存。
(6)用1×TE缓冲液悬浮沉淀
将吸取的絮状界面层溶液装入新的离心管中,加入500μL 10×PBS缓冲液,混匀后,3000rpm离心2min,弃上清去除Ludox HS40,沉淀用1×TE缓冲液悬浮得1×TE悬浮液;
1×TE缓冲液的配制:先称取Tris碱6.06g,加40mL ddH2O溶解,滴加浓HCl约2.1mL调pH至8.0,定容至50mL得Tris溶液;再称取9.306g EDTA-Na2·2H2O,加ddH2O 35mL,搅拌后用约1g NaOH颗粒调pH至8.0,定容至50mL得EDTA溶液。取配制好的Tris溶液1mL,EDTA溶液0.2mL,加ddH2O定容至100mL即为1×TE缓冲液。
(7)种子携带细菌PCR扩增
以步骤(6)获得的1×TE悬浮液为总DNA模板,用上游引物799F和下游引物1492R进行PCR扩增,总体积为50μL的PCR反应体系为:DNA模板2μL,1×Taq reaction 5μL,10nM/μL上游引物799F 2μL,10nM/μL下游引物1492R 2μL,1U/μL Taq酶2μL,2.5M/μL dNTPs 4μL,ddH2O 33μL;反应程序:94℃预变性5min,从94℃变性1min,52℃退火1min至72℃延伸1min,30个循环后,72℃延伸10min,4℃保存;PCR产物大小约为750bp;所述上游引物799F的碱基序列如SEQ ID NO:1所示,下游引物1492R的碱基序列如SEQ ID NO:2所示。
(8)16S rDNA克隆文库的构建
将扩增得到的PCR产物在1.%的琼脂糖凝胶中电泳,电泳完毕后,在紫外灯下切取700~800bp条带,回收750bp条带,用T载体进行连接后转化JM109感受态细胞得到转化子,再加入SOC培养基培养,将培养后的SOC培养基涂到含有氨苄、IPTG和X-Gal的LB平板培养基上,待菌落长出后,随机挑取160个以上的白色菌落测序。具体步骤如下:
①制备含有氨苄、IPTG和X-Gal的LB平板培养基及SOC培养基,每个连接反应准备2个含有氨苄、IPTG和X-Gal的LB平板培养基,涂板前将平板平衡至室温。
含有氨苄、IPTG和X-Gal的LB平板培养基的配制:取酵母提取物5g,胰蛋白胨10g,氯化钠10g和琼脂粉15g,加入ddH2O 1L混合后,121℃,0.1~0.15MPa,灭菌20min,灭菌结束后,冷却到55℃~60℃时加入20mg/mL X-Gal 40μL,200mg/mL IPTG 4μL,100mg/mL氨苄青霉素10μL即为含有氨苄、IPTG和X-Gal的LB平板培养基。
SOC培养基的配制:取胰蛋白胨20g,酵母提取物5g和氯化钠0.5g,加入950mLddH2O溶解后,加入250mM氯化钾溶液10mL,调节pH为7.0,再用ddH2O定容至1L,121℃,0.1~0.15MPa,灭菌20min,灭菌结束后,冷却到55℃~60℃时加入1M灭菌的葡萄糖溶液20mL即为SOC培养基。
②将T载体和回收的PCR产物的0.5mL离心管在4℃,2000rpm,离心30s,使之汇集到0.5mL离心管底部。
③按照以下方法建立连接反应,总体积为10μL的连接反应体系如下:
④用移液器吹打连接反应体系使之混匀后,室温放置1h。
⑤离心使连接反应物汇集到0.5mL离心管底部,取2μL连接反应产物加到置于冰上的1.5mL离心管中。
⑥将冻存的JM109感受态细胞置于冰上溶解5min,轻轻振荡离心管使之混匀。
⑦将溶解的感受态细胞取50μL加入有连接反应物的1.5mL离心管中,混匀后冰浴20min。
⑧在42℃水浴中热击45s~50s(不能振动)。
⑨迅速将离心管转移到冰上,冷却2min。
⑩加入SOC培养基950μL,37℃,150rpm振荡培养1.5h。
将培养后的SOC培养基涂到含有氨苄、IPTG和X-Gal的LB平板培养基上,待菌落长出后,挑取白色的菌落(含有插入片段),蓝色的菌落则舍弃。
JM109感受态细胞为市售产品,购自TakaRa公司。
(9)16S rDNA克隆文库评价
用C值(Coverage Value)对克隆文库进行评价,C值越大,克隆文库的代表性越强,从而能够放映出所构建的克隆文库内样品携带细菌的代表程度。用稀释曲线对克隆文库进行分析和评价,当曲线达到平台期或趋于平缓时则可认为库容已经足够满足分析需要,月亮谷种子携带细菌16S rDNA克隆文库稀释曲线见图2,其中横坐标为挑取克隆数,纵坐标为OTU(运算分类单位)的数目,当曲线趋向平坦时,说明测序数据量合理,更多的数据量只会产生少量新的OTU。图2曲线已经达到平台期,因此,可认为库容已经足够满足分析需要,即该克隆文库可以基本代表“月亮谷”种子携带细菌群落的微生物多样性。
按计算公式:C=(1-n1/N)×100%,其中n1为只含有一条序列的OTU的数目;N为随机挑取的所有白色菌落中出现的总的序列数目,并使用QIIME软件进行C值计算,C值为95%以上,表明步骤(8)所建的16S rDNA克隆文库能够放映出所构建的克隆文库内样品携带细菌的代表程度,在本例中,C值达97.53%(其中n1=3.95;N=160),然后按步骤(10)进行细菌种类分析。如果C值小于95%,则需重新建立文库。
(10)细菌种类分析
将步骤(8)从含有氨苄、IPTG和X-Gal的LB平板培养基随机挑取的160个克隆的测序结果与在NCBI上发布的16S rDNA序列,用BLAST进行序列比对,收索与其同源性较高的近缘物种16S rDNA序列,并确定所测序的序列与NCBI上已知的16S rDNA序列的同源关系,经比对,序列相似性为97%以上的归为同一细菌种类,本实施例检测到的细菌情况详见表2。NCBI网站即美国国家生物信息中心网站(http;//www.ncbi.nlm.nih.gov)。
以上述同批次的月亮谷种子用传统琼脂皿法检测月亮谷种子携带细菌为对照。
表1使用本发明方法与传统琼脂皿法分离检测细菌情况
从表2可看出,对于同批次的月亮谷水稻种子,本发明方法比传统琼脂皿法能多检出8种细菌,提高了检测的准确性,克服了现有种子携带细菌检测技术中存在分离细菌种类少,不能完全反应种子所携带的细菌情况的缺陷。
SEQUENCE LISTING
<110> 云南省农业科学院粮食作物研究所
<120> 一种基于硅溶胶密度梯度离心检测种子携带细菌的方法
<130> /
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 19
<212> DNA
<213> 巨大芽孢杆菌(Bacillus megaterium)
<400> 1
aacaggatta gataccctg 19
<210> 2
<211> 18
<212> DNA
<213> 大肠杆菌(Escherichia coli)
<400> 2
ggtaccttgt tacgactt 18
- 还没有人留言评论。精彩留言会获得点赞!