一种多阶段发酵生产利普司他汀的方法与流程
本发明属于发酵工程技术领域,具体涉及一种多阶段发酵生产利普司他汀的方法。
背景技术:
随着经济发展,饮食生活发生巨大变化,人们摄取了更多的垃圾食品及糖分,运动量不足,导致脂肪过量堆积和和异常分布引起肥胖。肥胖会引发血糖、胰岛素、血脂等机体多项参数水平的紊乱,当然近些年来科学家们越来越关心肥胖和癌症之间的关系。
胰脂肪酶抑制剂利普司他汀由毒三素链霉菌代谢产生,它通过选择性地抑制胃肠道内的胰脂肪酶减少30% 的脂肪的分解和吸收,从而达到减重的目的,是目前唯一通过非中枢神经系统作用治疗肥胖症的药物,其作用机制独特,安全性高,它的四氢衍生物Orlistat( 奥利司他)已被罗氏公司成功开发为减肥药Xenical (赛尼可) ,该药物是目前市场上唯一的OTC 减肥药,占据了减肥药市场80%的市场份额。作为Oristat 合成的关键中间体,生物合成Lipstatin 的发酵备受关注。
利普司他汀主要由链霉菌在细胞膜内合成,属胞内产物,仅有部分产物经渗透后,分泌于发酵液中。微生物正常代谢时,胞内过多的产物积累会对其前导关键合成酶活性产生抑制或阻遏,受制于细胞精密的反馈调节作用,微生物自身难以大量合成某种产物。因此,链霉菌发酵过程中,若采用合适的手段,提高细胞膜的通透性,将合成的利普司他汀及时排出胞外,释放到发酵液中,可有效缓解甚至解除细胞的反馈调节,大大提高利普司他汀产量同时分离纯化难度大大降低。
目前,国内对Lipstatin 发酵的研究多见于对培养基、培养条件的优化,仍然存在发酵周期长,提取分离步骤复杂收率低等问题。如能建立起一套系统的发酵法生产利普司他汀的多阶段发酵与分离偶合基础理论,特别对产物的分离提取及转化进行深入研究,为生物法生产次级代谢产物提供参考。
技术实现要素:
本发明目的在于提供一种多阶段发酵生产利普司他汀的方法,采用多阶段溶氧控制、分批补料发酵,以多阶段发酵生产利普司他汀同时调控链霉菌菌丝体的通透性,使80%以上产物分泌到菌丝体外,利普司他汀产量高,产物易分离,有利于工业化生产。
为了实现上述目的,本发明采用的技术方案为:
一种多阶段发酵生产利普司他汀的方法,包括菌种活化、种子培养和发酵培养阶段,所述发酵培养阶段采用有氧多阶段发酵,发酵的前10~40 h为菌体生长阶段,控制溶氧水平在50-100 %;40h之后是利普司他汀产生阶段,当湿菌体重达到10-12 g/L时,转入微氧发酵阶段,溶解氧水平控制在20-30%。
所述的菌种活化为将砂土管保藏的菌种接种到PDA斜面培养基上,于温度24-27℃,培养6-7天,得孢子斜面。
所述的种子培养为:将孢子斜面用无菌生理盐水洗下来,接种到种子培养基中,在温度24-27℃,pH为6.5-8.5,转速为150-200 rpm的摇床中培养24-48h,得到种子培养液。所述的种子培养基组成为(g/L):玉米淀粉3.0-5.0,鱼蛋白胨3.0-5.0,酵母膏1.0-4.0,NaCl 1.0-3.0,葡萄糖2.0-5.0,压榨大豆油3.0-5.0,K2HPO41.0-3.0,pH7.0-7.2。
所述的发酵培养基的组分(g/L):玉米粉10.0-15.0,鱼蛋白胨8.0-12.0,酵母膏10.0-15.0,甘油6.0-10.0,NaCl 3.0-8.0,葡萄糖5.0-10.0,压榨大豆油5.0-8.0,K2HPO41.0-5.0,MgSO4·7H2O 0.1-1.5,CaCO3 1.0-3.0,FeSO4·7H2O 0.005-0.025,ZnSO4·7H2O 0.005-0.025,MnCl2·4H2O 0.001-0.005,CoCl2·6H2O 0.001-0.005。将发酵培养基溶于60-80℃热水中,搅拌均匀,倒入发酵罐中,通入冷却水,121℃高压蒸汽灭菌25-35min,灭菌前校正溶解氧DO为0%;
所述的发酵过程,发酵培养基的培养温度24-27℃,控制pH6.5-8.5;调节好转速、空气流量及罐压以校正溶氧DO 100%;所述的有氧多阶段发酵为:发酵过程的前10~40 h为菌体生长阶段,空气流量为1.8vvm,搅拌速度为300-350 rpm,溶氧水平DO控制在50-100 %;发酵过程的40h之后是利普司他汀产生阶段,当湿菌体重达到10-12 g/L时,转入微氧发酵阶段,调节空气流量为0.8-1.0vvm,搅拌速度为200-250 rpm,溶解氧水平控制在20-30%。
上述有氧多阶段发酵过程中,当葡萄糖浓度低于1g/L时,开始流加底物Ⅰ,以发酵液中葡萄糖的浓度来指导底物Ⅰ流加速度,使发酵罐内葡萄糖浓度控制在1.0-1.5g/L范围内发酵60-80h。
底物Ⅰ流加10-20h后开始流加底物Ⅱ,控制流加时间10-15h,至反应体系Triton-100浓度0.3-0.5g/L。
底物Ⅰ流加20-30h后开始流加底物Ⅲ,控制流加时间10-15h,至反应体系CaCl2浓度0.5-0.8 g/L。
其中:底物Ⅰ组成为(g/L):葡萄糖 250-350,酵母膏80-120,甘油50-75,配置成水溶液,115℃高压蒸汽灭菌20-30min,冷却至室温备用;底物Ⅱ组成为:Triton-100液体,121℃高压蒸汽灭菌15-20min,冷却至室温备用;底物Ⅲ组成为:CaCl2,配置成浓度40-50 g/L的水溶液,115℃高压蒸汽灭菌15-20min,冷却至室温备用。
所述的菌株为产发酵产物包含利普司他汀的任意菌株,优选为链霉菌,本发明中所采用的是链霉菌Stretomyces toxytricini NRRL 15443(购自美国农业研究菌种保藏中心),将砂土管保藏的菌种接种到斜面活化培养;利用活化的菌种制备发酵种子液;将发酵培养基进行接种前准备灭菌;然后将发酵种子液按发酵培养基体积的2-5%比例接种于发酵培养基,通过控制葡萄糖浓度进行有氧多阶段发酵,同时调控菌丝体的通透性,使产物分泌到发酵液中。
有益效果:
采用链霉菌作为生产用菌种,经过发酵种子液制备、接种前准备及接种、多阶段溶氧控制、分批补料发酵阶段,这是一个有氧、微氧等多阶段集成发酵,实现链霉菌多阶段发酵生产利普司他汀,同时在培养中后期调控菌丝体的通透性,使80%以上产物分泌到菌丝体外。本发明成本低,操作简易,产物利普司他汀效价高,有利于工业化生产。
附图说明
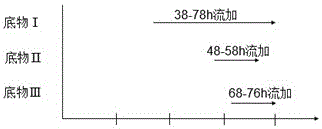
图1 实施例1分批补料发酵底物流加图;
图2实施例2分批补料发酵底物流加图;
图3实施例3分批补料发酵底物流加图。
具体实施方式
实施例中的菌种采用链霉菌Stretomyces toxytricini NRRL 15443(购自美国农业研究菌种保藏中心)。
本发明提供一种链霉菌Stretomyces toxytricini NRRL 15443多阶段发酵方法,下面列举实施例予以进一步说明。
实施例1
①种子的培养
所述的斜面活化培养,是将砂土孢子接种到PDA斜面培养基(土豆200g,葡萄糖20g,琼脂20g,水1000mL,自然pH)上,于温度24℃,培养箱培养7天,得孢子斜面。
将链霉菌Stretomyces toxytricini NRRL 15443孢子斜面用10 mL无菌生理盐水洗下来,取2 mL接种到装种子培养基的500 mL三角瓶中(装液量75mL),在温度27℃,pH为8.0,转速为200 rpm的摇床中培养24 h,得到发酵种子培养液;其中所述的发酵种子培养基组成为(g/L):玉米淀粉3.5,鱼蛋白胨5.0,酵母膏3.0,NaCl 2.0,葡萄糖5.0,压榨大豆油3.0,K2HPO4 1.5,pH 7.2。
②接种前准备
洗净体积为5L的发酵罐,空罐121℃高压蒸汽灭菌20min,冷却到室温,组装好温度计,pH计(已校正)和泡沫传感器,将发酵培养基溶于80℃热水中,搅拌溶解培养基至无沉淀,倒入发酵罐中,补充自来水至培养基体积为3L,通入冷却水,121℃高压蒸汽灭菌30 min,灭菌前校正溶解氧DO为0%;其中所述的发酵培养基的组分(g/L):玉米粉10.0,鱼蛋白胨12.0,酵母膏12.0,甘油9.0,NaCl 6.0,葡萄糖10.0,压榨大豆油8.0,K2HPO4 3.0,MgSO4·7H2O 1.2,CaCO3 3.0,FeSO4·7H2O 0.02,ZnSO4·7H2O 0.025,MnCl2·4H2O 0.004,CoCl2·6H2O 0.005。
③接种
在火焰圈保护下,以2%接种量将链霉菌Stretomyces toxytricini NRRL 15443种子液接种于5L自动控制发酵罐中,装液量3.0L,空气流量1.8vvm,搅拌转速为300r/min,培养温度26℃,校正溶氧100%,自动流加氨水控制pH8.0±0.5。
④多阶段溶氧控制
链霉菌Stretomyces toxytricini NRRL 15443发酵过程分为菌体生长和利普司他汀形成两个阶段。菌体生长阶段为发酵过程的前38h,这一阶段需要大量氧气,初始空气流量为1.8vvm,搅拌速度为300rpm,溶氧水平DO控制在50-100%;利普司他汀形成阶段位于发酵过程的38h之后,当湿菌体重达到11 g/L时,转入微氧发酵阶段。但是由于发酵液粘度较高,氧的传递速率会相对下降,而高强度搅拌增加氧的供给会对菌体造成机械损伤,将加大空气流量与增加搅拌强度相结合有助于解决此问题。此阶段调节空气流量为1.0vvm,搅拌速度为200rpm,溶解氧水平控制在25-30%。
⑤分批补料发酵
发酵38h葡萄糖浓度低于1g/L,开始流加底物Ⅰ,以发酵液中葡萄糖的浓度来指导底物Ⅰ流加速度,使发酵罐内葡萄糖浓度控制在1.0-1.2g/L范围内发酵80h。具体流加方式如下:
底物Ⅰ流加16h后开始流加底物Ⅱ,控制流加时间15h,至反应体系Triton-100浓度0.45 g/L。
底物Ⅰ流加26h后开始流加底物Ⅲ,控制流加时间15h,至反应体系CaCl2浓度0.5 g/L。
其中所述的底物Ⅰ组成为(g/L):葡萄糖 290,酵母膏110,甘油75,配置成水溶液,115℃高压蒸汽灭菌20min,冷却至室温备用。
底物Ⅱ组成为:Triton-100液体,121℃高压蒸汽灭菌15min,冷却至室温备用。
底物Ⅲ组成为:CaCl2配置成50g/L水溶液,115℃高压蒸汽灭菌15min,冷却至室温备用。
发酵80h,放罐,最终测得利普司他汀效价为2200mg/L,发酵液中利普司他汀效价为1806 mg/L,占总效价的82.1%。
实施例2
1、种子的培养
所述的斜面活化培养,是将砂土孢子接种到PDA斜面培养基上,于温度26℃,培养箱培养7天,得孢子斜面。
将链霉菌Stretomyces toxytricini NRRL 15443孢子斜面用10 mL无菌生理盐水洗下来,取2 mL接种到装种子培养基的500 mL三角瓶中(装液量50mL),在温度26℃,pH为8.5,转速为200 rpm的摇床中培养30 h,得到发酵种子培养液;其中所述的发酵种子培养基组成为(g/L):玉米淀粉4.5,鱼蛋白胨4.5,酵母膏4.0,NaCl 3.0,葡萄糖4.5,压榨大豆油5.0,K2HPO4 2.5,pH 7.2。
2、接种前准备
洗净体积为5L的发酵罐,空罐121℃高压蒸汽灭菌20min,冷却到室温,组装好温度计,pH计(已校正)和泡沫传感器,将发酵培养基溶于80℃热水中,搅拌溶解培养基至无沉淀,倒入发酵罐中,补充自来水至培养基体积为3L,通入冷却水,121℃高压蒸汽灭菌30 min,灭菌前校正溶解氧DO为0%;其中所述的发酵培养基的组分(g/L):玉米粉12.0,鱼蛋白胨11.0,酵母膏15.0,甘油10.0,NaCl 5.0,葡萄糖10.0,压榨大豆油8.0,K2HPO4 5.0,MgSO4·7H2O 1.5,CaCO3 3.0,FeSO4·7H2O 0.025,ZnSO4·7H2O 0.015,MnCl2·4H2O 0.005,CoCl2·6H2O 0.005。
3、接种
在火焰圈保护下,以2.5%接种量将链霉菌Stretomyces toxytricini NRRL 15443种子液接种于5L自动控制发酵罐中,装液量3.0L,空气流量1.8vvm,搅拌转速为350r/min,培养温度25℃,校正溶氧100%,自动流加氨水控制pH8.5±0.5。
4、多阶段溶氧控制
链霉菌Stretomyces toxytricini NRRL 15443发酵过程分为菌体生长和利普司他汀形成两个阶段。菌体生长阶段为发酵过程的前42h,这一阶段需要大量氧气,初始空气流量为1.8vvm,搅拌速度为350rpm,溶氧水平DO控制在60-100%;利普司他汀形成阶段位于发酵过程的42h之后,当湿菌体重达到12 g/L时,转入微氧发酵阶段。但是由于发酵液粘度较高,氧的传递速率会相对下降,而高强度搅拌增加氧的供给会对菌体造成机械损伤,将加大空气流量与增加搅拌强度相结合有助于解决此问题。此阶段调节空气流量为1.0vvm,搅拌速度为250rpm,溶解氧水平控制在25-30%。
5、分批补料发酵
发酵42h葡萄糖浓度低于1g/L,开始流加底物Ⅰ,以发酵液中葡萄糖的浓度来指导底物Ⅰ流加速度,使发酵罐内葡萄糖浓度控制在1.2-1.5g/L范围内发酵78h。具体流加方式如下:
底物Ⅰ流加14h后开始流加底物Ⅱ,控制流加时间10h,至反应体系Triton-100浓度(g/L)0.5。
底物Ⅰ流加24h后开始流加底物Ⅲ,控制流加时间10h,至反应体系CaCl2浓度(g/L)0.7。
其中所述的底物Ⅰ组成为(g/L):葡萄糖 350,酵母膏120,甘油75,配置成水溶液,115℃高压蒸汽灭菌20min,冷却至室温备用。
底物Ⅱ组成为:Triton-100液体,121℃高压蒸汽灭菌15min,冷却至室温备用。
底物Ⅲ组成为(g/L):CaCl2 46,配置成水溶液,115℃高压蒸汽灭菌15min,冷却至室温备用。发酵78h,放罐,最终测得利普司他汀效价为2420mg/L,发酵液中利普司他汀效价为2061 mg/L,占总效价的85.2%。
实施例3
1、种子的培养
所述的斜面活化培养,是将砂土孢子接种到PDA斜面培养基上,于温度27℃,培养箱培养6天,得孢子斜面。
将链霉菌Stretomyces toxytricini NRRL 15443孢子斜面用10 mL无菌生理盐水洗下来,取2 mL接种到装种子培养基的500 mL三角瓶中(装液量75mL),在温度24℃,pH为6.5,转速为150 rpm的摇床中培养48 h,得到发酵种子培养液;其中所述的发酵种子培养基组成为(g/L):玉米淀粉5.0,鱼蛋白胨3.0,酵母膏1.0,NaCl 1.5,葡萄糖2.0,压榨大豆油3.5,K2HPO4 3.0,pH 7.0。
2、接种前准备
洗净体积为5L的发酵罐,空罐121℃高压蒸汽灭菌20min,冷却到室温,组装好温度计,pH计(已校正)和泡沫传感器,将发酵培养基溶于60℃热水中,搅拌溶解培养基至无沉淀,倒入发酵罐中,补充自来水至培养基体积为3L,通入冷却水,121℃高压蒸汽灭菌30 min,灭菌前校正溶解氧DO为0%;其中所述的发酵培养基的组分(g/L):玉米粉15.0,鱼蛋白胨8.0,酵母膏10.0,甘油6.0,NaCl 3.0,葡萄糖5.0,压榨大豆油5.0,K2HPO4 1.0,MgSO4·7H2O 0.1,CaCO3 1.0,FeSO4·7H2O 0.005,ZnSO4·7H2O 0.005,MnCl2·4H2O 0.001,CoCl2·6H2O 0.001。
3、接种
在火焰圈保护下,以1.5%接种量将链霉菌Stretomyces toxytricini NRRL 15443种子液接种于5L自动控制发酵罐中,装液量3.0L,空气流量1.8vvm,搅拌转速为350r/min,培养温度27℃,校正溶氧100%,自动流加氨水控制pH6.5±0.5。
4、多阶段溶氧控制
链霉菌Stretomyces toxytricini NRRL 15443发酵过程分为菌体生长和利普司他汀形成两个阶段。菌体生长阶段为发酵过程的前38h,这一阶段需要大量氧气,初始空气流量为1.8vvm,搅拌速度为350rpm,溶氧水平DO控制在50-100%;利普司他汀形成阶段位于发酵过程的38h之后,当湿菌体重达到10 g/L时,转入微氧发酵阶段。但是由于发酵液粘度较高,氧的传递速率会相对下降,而高强度搅拌增加氧的供给会对菌体造成机械损伤,将加大空气流量与增加搅拌强度相结合有助于解决此问题。此阶段调节空气流量为0.8vvm,搅拌速度为200rpm,溶解氧水平控制在20-25%。
5、分批补料发酵
发酵38h葡萄糖浓度低于1g/L,开始流加底物Ⅰ,以发酵液中葡萄糖的浓度来指导底物Ⅰ流加速度,使发酵罐内葡萄糖浓度控制在1.0-1.3g/L范围内发酵75h。具体流加方式如下:
底物Ⅰ流加10h后开始流加底物Ⅱ,控制流加时间12h,至反应体系Triton-100浓度(g/L)0.3。
底物Ⅰ流加20h后开始流加底物Ⅲ,控制流加时间15h,至反应体系CaCl2浓度(g/L)0.8。
其中所述的底物Ⅰ组成为(g/L):葡萄糖 250,酵母膏80,甘油50,配置成水溶液,115℃高压蒸汽灭菌30min,冷却至室温备用。
底物Ⅱ组成为:Triton-100液体,121℃高压蒸汽灭菌20min,冷却至室温备用。
底物Ⅲ组成为(g/L):CaCl2 40,配置成水溶液,115℃高压蒸汽灭菌20min,冷却至室温备用。发酵75h,放罐,最终测得利普司他汀效价为1700mg/L,发酵液中利普司他汀效价为1328 mg/L,占总效价的78.1%。
本发明用于多阶段发酵法生产利普司他汀,具有广阔的应用前景。通过开发链霉菌Stretomyces toxytricini NRRL 15443多阶段发酵生产工艺,降低生产成本、提高了产物利普司他汀的效价,且产物易分离,有利于工业化规模生产。
- 还没有人留言评论。精彩留言会获得点赞!