黄瓜CsERF025基因及其在促进黄瓜果实顺直发育中的应用的制作方法
本发明属于基因工程应用
技术领域:
,涉及一种黄瓜转录因子CsERF025及其在促进黄瓜果实顺直发育中的应用。
背景技术:
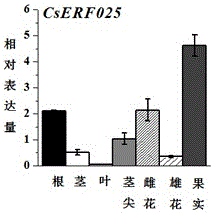
:黄瓜是设施栽培中的重要蔬菜,也是我国保护地栽培的第一大作物。但是我国黄瓜生产的标准商品率却很低,平均二级以上的商品率仅有65%,每年因果实弯曲畸形导致商品性丧失,给农民造成很大的经济损失(Zhouetal.,2009)。为了解决自然生长的黄瓜容易出现弯瓜现象,菜农大多选择“蘸花药(氯吡脲)”处理,促使黄瓜顺直,从而提高黄瓜的商品价值。研究黄瓜果实弯曲形成的分子机理,将会对于指导黄瓜育种和栽培、减少“蘸花药”的使用、提高黄瓜生产的优质商品率、增加农民收入等具有极其重要的生产实际意义。此外,阐明调控黄瓜果实弯曲形成的机理,将会帮助我们更好地理解黄瓜果实发育的分子机制。因此,对黄瓜果实弯曲形成机理进行研究不仅具有重要的生产应用价值,同时也具有重要的理论研究意义,其相关成果在推动本学科领域在果实发育调控等方面的研究和技术应用将有重要作用。ERF是植物特有的一类转录因子,具有一个保守的ERF型DNA结合域。ERF转录因子影响植物的发育可能是影响ABA、乙烯等植物激素的合成的间接结果(Wuetal.,2002;Zhangetal.,2005)。如在拟南芥中超表达番茄ERF转录因子Pti4时,转基因植株表现出抑制根和下胚轴的延伸、顶端过度弯曲以及叶片尺寸变小等表型,这可能是Pti4影响转基因拟南芥乙烯合成的结果(Wuetal.,2002)。超表达TERF1转基因烟草具有乙烯过量生成的形态,表现为黑暗生长的超表达烟草表现出典型的“三重反应”形态,正常光照条件下生长的烟草也表现出叶片狭小、细长的乙烯过量生成形态(Zhangetal.,2009)。在之前研究中,通过解剖学和细胞学研究表明,弯曲果实腹部细胞伸长受到抑制,细胞液泡化,核膜、液泡膜等部分降解,细胞呈现衰老趋势,导致腹部生长缓慢。进而利用Illumina技术对转录组进行测序分析,经qRT-PCR检测,确定转录因子CsERF025和乙烯合成关键基因CsACS2的表达存在一致性,并且CsERF025在黄瓜果实腹部上调表达量是脊部的70倍,表明CsERF025在黄瓜果实弯曲形成过程中发挥着重要作用。乙烯应答反应因子ERF在植物的生长发育与逆境应答反应过程中发挥重要的调控作用,但在黄瓜中ERF因子是否调控乙烯生物合成影响黄瓜果实弯曲还未见报道。技术实现要素:本发明的目的是从黄瓜(CucumissativusL.)中分离、克隆得到一个调控果实顺直和弯曲发育的ERF转录因子CsERF025,并通过农杆菌介导的遗传转化将其导入黄瓜中,鉴定其在果实发育中的功能。本发明的目的是通过以下技术方案实现的:本发明以弯曲果实cDNA为模板,以下述引物进行扩增:正向引物:5′-ATGATCACTACAAAGGAATCCGCT-3′;反向引物:5′-CTAGTGGTAGCTCCAAAGATTTCCA-3′;得到一个新黄瓜基因CsERF025,其核苷酸序列如SEQIDNO.1所示,CsERF025全长513bp;其编码的氨基酸序列如SEQIDNO.2所示,编码170个氨基酸,属于AP2/ERF家族蛋白基因。本发明利用农杆菌介导的遗传转化方法转化黄瓜,获得的转基因植株经生物学功能验证,表明本发明所克隆的CsERF025基因具有促进果实顺直发育的功能,其表达量为弯曲果实>顺直果实,并且弯曲果实的表达量为脊部>腹部。与现有技术相比,本发明具有以下优点:1、依托本发明能有效促进果实的顺直发育,一旦获得转基因材料,生产上可有效减少使用“蘸花药(氯吡脲)”,节约资源,降低生产成本。另一方面,本发明可根据实际生产需求用于改善砧木材料或是其它,应用广泛,易于被接受认可。2、通过农杆菌介导的遗传转化将该基因导到植株中,鉴定其在果实发育中的功能,为植物顺直果实分子设计育种提供新的基因资源,为实施绿色农业、安全农业提供新的遗传资源;同时该基因的开发和利用有利于指导黄瓜育种和栽培、提高黄瓜生产的优质商品率、降低农业生产成本、增加农民收入,减少果实弯曲给农民带来的经济损失,提高黄瓜栽培的经济效益,促进农业产业高效发展。附图说明图1为本发明的技术流程图。图2为本发明的CsERF025基因在顺直和弯曲黄瓜果实不同发育时期的表达模式示意图。图3为本发明的CsERF025基因在顺直和弯曲黄瓜果实不同部位表达模式示意图。图4为本发明的CsERF025基因亚细胞定位荧光示意图,图中Bright为明场,GFP为绿色荧光,Chlorophy为叶绿素自发荧光,Merged为叠加结果,图中标尺为10μm。图5为本发明的黄瓜遗传转化流程图。图6为本发明的CsERF025正义转基因植株的PCR鉴定示意图,图中M是DNAmarkerDL2000;+是阳性对照(pCXSN-CsERF025质粒);—是阴性对照(水);1-15是CsERF025正义转基因植株。图7为本发明的CsERF025反义转基因植株的PCR鉴定示意图,图中M是DNAmarkerDL2000;+是阳性对照(pCXSN-CsERF025质粒);—是阴性对照(水);1-18是CsERF025反义转基因植株。图8为本发明的转CsERF025基因植株的qRT-PCR鉴定示意图,图中WT是野生型株系;Col-2是空载对照;3,4,5,6,8,13,14是转CsERF025正义转基因株系;转CsERF0252,3,4,5,6,7,9:反义转基因株系。图9为本发明转基因黄瓜果实弯曲比率和弯曲度的动态变化比较示意图,图中A是F2代的15个单株弯曲果实的比率示意图;B是正义表达株系果实弯曲度的动态变化示意图;OE1、OE2、OE3是3个正义表达株系;AS1、AS2、AS3是3个反义表达株系。具体实施方式下面结合附图对本发明的技术方案作进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。实施例1:CsERF025基因分离克隆及表达分析对黄瓜果实坐果期(开花2d)弯曲果实脊部和腹部,顺直果实进行转录组测序,鉴定出一个在弯曲果实腹部和脊部表达差异显著的ERF转录因子CsERF025基因,为了得到其全长序列信息,我们在黄瓜基因组数据库(http://www.icugi.org/)中搜索CsERF025的全长序列,利用Primerpremier5.0设计特异性引物,进行PCR扩增。引物序列如下:CsERF025-F:5′-ATGATCACTACAAAGGAATCCGCT-3′;CsERF025-R:5′-CTAGTGGTAGCTCCAAAGATTTCCA-3′。首先使用Trizol(InvetrigenTM)法提取黄瓜果实、茎、叶、花的总RNA(试剂盒购自Invetrigen公司,操作方法按照说明书)。而后取1ul中RNA样品,根据Toyobo反转录试剂盒ReverTraAceqPCRRT-Kit说明书反转录成cDNA第1链。所得的第一链cDNA用于荧光定量PCR反应扩增目的基因的模板。反转录体系中各组分如表1:表1成分加入量(μL)5×RTBuffer2RTEnzymeMix0.5PrimerMix0.5RNA模板1Nuclease-freeWater6总体系10通过在黄瓜基因组数据库(http://www.icugi.org/)中搜索ID号为Csa3M042390.1的CDS全长序列(命名为CsERF025),利用Primer5.0设计特异性引物,进行PCR扩增。PCR克隆体系中各组分如表2:表2成份加入量(μL)10×PCRBuffer(含20mmol·L-1Mg2+)2dNTPs(10mmol·L-1)2上游引物(20μmol·L-1)0.5下游引物(20μmol·L-1)0.5Taq酶(2U)0.2cDNA2ddH2O12.8总体系20PCR扩增反应在Bio-RadDNAEngine®Systems扩增仪上按以下程序完成:94℃预变性5min;94℃变性30s、54℃退火30s、72℃延伸1min(共30个循环);循环完成后72℃延伸10min。PCR扩增结束后产物于-20℃保存。PCR扩增产物的回收是使用1%琼脂糖凝胶电泳,在紫外灯下快速切下目的条带,回收CsABC19基因的目的片段,具体方法参照北京全式金胶回收试剂盒说明书进行。pEASY-T3载体连接与阳性克隆筛选是将CsERF025基因的胶回收产物与北京全式金公司的pEASY-T3载体连接,转入大肠杆菌感受态细胞DH5α中,具体方法参照北京全式金公司pEASY-T3载体说明书,进行蓝白斑筛选。挑取若干白色单菌落于含有抗性LB液体培养基中,在37℃,200rpm/min振荡培养箱过夜,以菌液为模板,进行PCR检验,以及EcoRI酶切验证阳性菌落(PCR体系同上),将鉴定获得的CsERF025基因的阳性菌液,送至苏州金唯智有限公司进行测序。酶切反应体系如表3:表3成分加入量(μL)Buffer1EcorI1质粒3ddH2O6总体系10为了探究CsERF025基因在黄瓜果实不同发育时期表达模式,利用QRT-PCR分析极易弯曲品种“长春密刺”的表达模式。结果表明:CsERF025基因果实中表达最高,其次在雌花和根中表达。在茎、叶、茎尖和雄花中表达相对很低(图2)。不同发育时期,顺直果实CsERF025呈现缓慢上升表达,2-8d弯曲果实CsERF025基因的表达高于顺直果实,在果实发育2d腹部的表达是脊部的2.73倍,然而从果实发育4d开始,脊部的表达高于腹部表达,并且4d脊部与腹部差异最大,为5.39倍(图3)。因此推断,CsERF025基因很可能与黄瓜果实弯曲的形成有关。实施例2:CsERF025基因亚细胞定位在线定位预测指出CsERF025基因定位于细胞核,本发明利用拟南芥原生质体细胞来研究CsERF025基因的亚细胞定位。在这里我们选用了EGFP载体构建CsERF025基因的定位载体。利用RT-PCR扩增出CsERF025基因整个ORF(阅读框),利用PCR扩增无终止密码子序列,纯化PCR产物与pEASY-T3载体连接,使用HindIII和BamhI双酶切带有开放阅读框的pEASY-T3载体和EGFP载体,回收目的片段,用T4-DNA连接酶25℃过夜连接,将目的片段融合到绿色荧光蛋白(GFP)上游HindIII和BamhI中间的位置,构建植物绿色荧光表达载体CsERF025-EGFP,转入大肠杆菌DH5α(方法和体系同上),筛选并验证阳性菌落,送至苏州金唯智有限公司测序。取10μL测序正确且无终止密码的CsERF025-EGFP菌液,加入到50mL(含有50μLKan)LB液体培养基中,于37℃、200rpm的恒温摇床中过夜培养。菌液分装后用提取20管质粒,再将提好的质粒混在一起,加入等体积的异丙醇沉淀,再加入1/10的3MNaAC,在低温离心机中4℃,14000rpm离心10min,用75%的无水乙醇清洗2遍,室温下晾干,沉淀用试剂盒中的EB进行溶解。用紫外分光光度计检测质粒浓度,浓度在1μg/μL左右的纯度,可以用于融入拟南芥原生质体细胞,该浓度的质粒可以提高亚细胞定位的成功率。CsERF025-EGFP质粒转化拟南芥原生质体:1、将上步检验好的拟南芥原生质细胞100g离心3min,弃上清,尽量去除W5溶液,加入2mLMMG溶液,重悬原生质体,使之最终浓度在2×105个/mL;2、取干净的2mL离心管,加入20μL(约30μg)pCAMBIA1302-CsABC19质粒DNA和200μL原生质细胞,轻柔混匀,25℃静止5min;3、加入220μL(等体积)的40%PEG4000溶液,轻柔混匀,25℃静止5min;4、加入1mL预冷的W5溶液,轻柔混匀;5、重复步骤4,加入1mL预冷的W5溶液和1%BSA,轻柔混匀,于25℃光照培养16h;6、利用激光共聚焦显微镜(Leica,Germany)观察融合蛋白表达情况,试验重复3次。48小时之后,用GermanyLeicaTCSSP2型激光共聚焦显微镜,观察CsERF025融合蛋白的亚细胞定位情况。结果显示,GFP对照质粒在整个细胞中都表达,CsERF025-EGFP融合蛋白在仅在细胞核表达,说明CsERF025基因编码的蛋白属于核定位的蛋白(图4)。实施例3:植物转化超表达载体以及反义表达载体构建将提取pCXSN的质粒用XCM1酶切,酶切条件37℃酶切1h,将酶切产物跑电泳,胶回收得到纯化产物后,按1:1的比例将胶回收的CsERF025和pCXSN的大片段用T4DNA连接酶16℃连接16h,连接产物转入Trans1-T1感受态细胞,铺板,在37℃的条件下过夜培养,挑单菌落摇菌,进行PCR及XCMI酶切检测目标条带后,送样测序。之后将重组质粒转入到根癌农杆菌LBA4404中并保存,用于后续遗传转化。20μL的酶切反应体系中各组分如表4:表4质粒7μLXCM11μLBuffer1μLddH2O10μL总体系20μL10μL连接反应体系中各组分如表5:表5胶回收CsERF025aμL胶回收pCXSN的大片段bμLT4DNA连接酶1μLBuffer1μL总体系10μL实施例4:黄瓜遗传转化根癌农杆菌介导的黄瓜遗传转化步骤如下:1、根癌农杆菌培养:取含有CsERF025基因植物过表达载体的农杆菌菌液在含有Rif和Kan抗性的YEB固体培养基上划线,置于28℃恒温培养箱中培养,36-48h后长出清晰可见的单菌落;挑单菌落于5mL含有Rif和Kan抗性的YEB液体培养基中,28℃,200rpm过夜培养16h;接着以1:50比例转入250mL含有Rif和Kan抗性YEB液体培养基中,28℃,200rpm培养至OD600=0.5;取摇好的菌液,分装,4℃,6000rpm,离心10min,在超净工作台中,弃掉上清,收集菌体;将菌体用渗透缓冲液(1/2MS培养基+5%蔗糖+终浓度0.02%-0.03%SilwetL-77)重悬,重悬菌液的OD600=0.2-0.3时做侵染。2、侵染:取预培养2-3d黄瓜的子叶节,放入已高压灭菌的三角瓶中,适量加入已活化的菌液,28℃,200转/分钟,浸染子叶节,时间不宜过长,约15min。3、共培养:将与农杆菌浸染过的子叶节用无菌滤纸吸干后,用镊子插入附加30mg/L乙酰丁香酮的共培养培养基上,28℃,黑暗培养3-4d,培养基表面出现白色可见的菌落即可。4、除菌及筛选培养:取经过共培养的子叶节于无菌三角瓶内,在无菌操作台上先用无菌水冲洗3-4次,用含有500mg/L头孢噻肟钠除菌剂的植物液体培养基,28℃,200r/min浸泡20min,用无菌水冲洗6-8次,再用已灭菌的滤纸吸干,将子叶节插入除菌筛选培养基,利用头孢进行杀菌,利用卡纳筛选抗性芽。温度设置为25℃,光照强度为1500lx、光照时间设置为16小时。5、生根培养:待不定芽长到2-3cm时,将不定芽剪下,此时注意切勿从根部剪下,以免抗性芽粘染农杆菌,不易成活。将剪下的抗性芽插入生根培养基,进行生根培养,两周左右长出不定根。6、黄瓜苗转入土培:将已生根的植株从培养基中取出,洗去根部培养基,栽入装有已灭菌的净河沙的营养钵中,浇灌营养液,并覆盖保鲜膜保湿,在培养箱中温度24/18℃,光照16/8h培养一周左右长出新叶揭去保鲜膜,完成驯化,并栽植于灭菌的营养土中。黄瓜转化苗所用培养基见表6,转化过程如图5所示。表67、阳性转基因黄瓜初步确定将收获的T0代种子彻底消毒后,播种于含有50mg/LKan的MS培养中,4℃黑暗春化2d后,置于22℃/18℃,光照16h、黑暗8h,湿度保持在70%左右的光照培养箱中培养,筛选抗性植株。生长31d后,叶片正常展平,且生根的植株可初步确定为阳性植株。实施例5:转基因植株分子鉴定1、黄瓜叶片DNA的提取取3-5mg新鲜拟南芥叶片,放入1.5mL离心管中,加入200μLDNA提取液,并加入小钢珠,在核酸纯化仪中震荡45s,取出钢珠,剩余液体14000rpm离心5min,取1μL用于PCR鉴定。Edwards液的配制:200mMTris--HCl(PH=7.5),250mMNacl,25mMEDTA,0.5%SDS;TEBuffer的配制:10mMTris--HCl(PH=7.5),1mMEDTA;DNA提取液:用10倍的TEBuffer稀释Edwards液。2、阳性转基因植株的PCR检测除了在DNA水平验证转基因植株是否含有目的基因外,从RNA水平分析目的基因的表达情况,可以进一步验证。提取黄瓜的RNA,并进行荧光定量PCR分析(方法与体系同前)。取抗性转基因黄瓜的叶片,提取DNA,用通用引物(1250-F:CGGCAACAGGATTCAATCTTA,1250-R:CAAGCATTCTACTTCTATTGCAGC)进行PCR鉴定,有目的条带的植株,视为阳性植株,收种,用于下一步试验。结果表明,获得含有目的基因的正义表达转基因株系15株,反义表达转基因株系18株(图6A,图6B,图7)。进而对PCR条带比较亮的转基因株系,提取RNA,并反转录为cDNA,利用基因特异性引物(ERF025-qS:TTCTCAACTTCCCCAACTCA,ERF025-qS:CGACAACAGCATTCCCTC),进行荧光定量PCR。结果表明,正义和反义表达转基因株系中均检测到目的基因的表达,说明该基因能够在黄瓜中正常转录(图8)。因此筛选表达量相对高的3株过表达株系(3、4、13)和反义表达株系(2、4、6)进行繁育F2代,并利用F2代单株进行试验。实施例6:转CsERF025基因植株黄瓜果实弯曲度鉴定调查了F2代正义表达转基因株系和反义表达转基因株系弯曲果实比率。结果表明,“长春密刺”过表达CsERF025基因,弯瓜率与对照相比分别增加了30.30%、23.26%和20.17%,然而,反义表达植株弯曲果实比率与对照相比减少了9.7%、16.82%和14.1%(图9A),且正义表达株系增加弯曲果实角度(图9B)。结果表明,CsERF025基因促进黄瓜果实的弯曲度,正义达的黄瓜果实弯曲度变大,同时弯曲果实的数量增加;反义表达的黄瓜果实弯曲度变小,同时弯曲果实的数量减少。<110>东北农业大学<120>黄瓜CsERF025基因及其在促进黄瓜果实顺直发育中的应用<160>2<210>1<211>513<212>DNA<400>1atgatcactacaaaggaatccgctgccggggtggcaaatgggtctccgagattcgtgagc60cacgtaagactaatcgaatatggctccgcacgtaagactaatcgaatatggctcggcacc120taccctacacccgaaatggctgctgctgcctacgacgtagccgcactcgcactcaagggt180tgcaatgccgttctcaacttccccaactcagttgccttctacccggttcctgcttccaca240tcccccaatgatatccgtattgctgctgctgctgccgccgcgtccaaaaaggttgatgat300caaggagaaaacagttaccataactctcactaccaatctccaccaaccaatgagtttgtc360gatgaagaagcgctgttcggaatgccaaatcttttacatgacatggctgagggaatgctg420ttgtcgcccccacgaatgaactcgtcgccgtctcgacatgattactactcgtggaattca480agtggagatggaaatctttggagctaccactag513<210>2<211>170<212>DNA<400>1mittkesaagvangsprfvshvrlieygsarktnriwlgtyptpemaaaaydvaalalkg60cnavlnfpnsvafypvpastspndiriaaaaaaaskkvddqgensyhnshyqspptnefv120deealfgmpnllhdmaegmllspprmnsspsrhdyyswnssgdgnlwsyh170当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1