烟草NtNAC096基因控制烟草衰老的应用的制作方法
本发明涉及烟草衰老控制领域,尤其涉及一种烟草NtNAC096基因控制烟草衰老的应用。
背景技术:
叶片衰老是叶片发育的最后一个阶段。在叶片衰老过程中,叶绿素和生物大分子物质如蛋白质、脂类、核酸等被降解,叶片光合能力降低,衰老组织中的营养物质降解转化后被运输到幼嫩组织和生殖器官中供进一步生长发育或储存。因此,叶片的衰老影响作物生长、营养积累和产量的形成。烟草是一种叶用经济作物,叶面积大小和衰老成熟度直接影响到生产产量和质量。
目前,对植物衰老的控制主要集中在对植物激素的调节方面,生长素、细胞分裂素等可抑制叶片衰老,乙烯、脱落酸可促进叶片衰老;人为减缓叶片衰老进程,一方面可以通过减少衰老促进激素的合成或代谢,另一方面也可增加衰老抑制激素的合成或代谢。但是激素调节外源作用往往存在效果上的缺陷。鉴于此,利用基因控制衰老的方法开始研究,目前只有少数的烟草衰老基因被鉴定,仍有大量的植物衰老相关的基因有待研究和利用。
技术实现要素:
本发明的目的在于提供烟草NtNAC096基因控制烟草衰老的应用,能够通过NtNAC096基因控制烟草的衰老,通过基因编辑延缓烟草的衰老,从而高效控制烟草的衰老进程。
为了达到上述目的,本发明的技术方案是:
烟草NtNAC096基因控制烟草衰老的应用,烟草NtNAC096基因的基因组DNA序列全长1203bp,其核苷酸序列如下:
其中,序列中双下划线标示的atg为起始密码子,双下划线标示的tga为终止密码子,单下划线标示的部分为内含子,烟草NtNAC096基因由3个外显子和2个内含子组成。
进一步的,烟草NtNAC096基因控制烟草衰老的应用,包括对烟草NtNAC096基因进行基因功能分析,敲除NtNAC096基因,获得延缓衰老的烟草植株。
进一步的,烟草NtNAC096基因控制烟草衰老的应用,包括如下步骤:(1)烟草NtNAC096基因克隆,序列分析;(2)对NtNAC096基因进行表达分析;
(3)通过构建烟草NtNAC096基因过表达载体,进行烟草NtNAC096基因功能分析;(4)利用CRISPR/Cas9基因编辑技术对烟草NtNAC096基因靶位点进行设计,构建NtNAC096基因敲除载体;对烟草品种进行遗传转化,获得延缓衰老的烟草植株。
进一步的,步骤(2)对NtNAC096基因进行表达分析是用qRT-PCR方法检测NtNAC096基因在烟草不同组织和不同叶片生育时期的表达模式。
进一步的,步骤(3)构建烟草NtNAC096基因过表达载体的方法为利用clontech infusion同源重组方法将NtNAC096构建进入过表达载体pRI101-AN,构建烟草NtNAC096基因过表达载体pRI101-NtNAC096。
进一步的,步骤(3)构建烟草NtNAC096基因过表达载体后,利用农杆菌介导的浸花法侵染拟南芥得到转基因拟南芥,进行烟草NtNAC096基因功能分析。
进一步的,步骤(4)对烟草NtNAC096基因设计两个靶位点,人工合成加接头序列,靶位点连接到载体pORE-Cas9上,获得pORE-Cas9/NtNAC096载体。
进一步的,步骤(4)对烟草品种进行遗传转化的具体操作为:pORE-Cas9/NtNAC096载体转化农杆菌感受态LBA4404,利用农杆菌介导的烟草叶盘转化法对烟草进行遗传转化,获得延缓衰老的烟草植株。
相对于现有的烟草衰老控制,本发明的有益效果在于:1、首次发现烟草NtNAC096基因用于控制烟草衰老;2、利用基因编辑技术能够精确快速的利用烟草NtNAC096基因控制烟草衰老进程,通过突变该基因核苷酸序列筛选得到延缓衰老的烟草植株,在农业生产上具有十分重要的应用,对烟叶的采摘、品质控制、筛选烟草品种和提高产量都有十分显著的影响。
附图说明
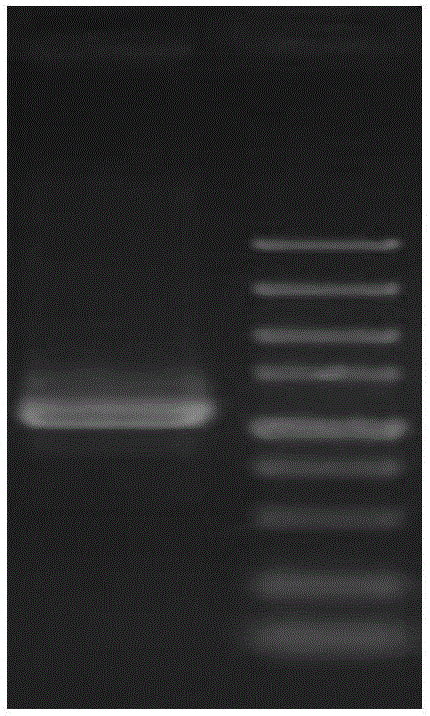
图1为本发明一实施例的烟草NtNAC096基因DNA序列扩增结果电泳图;
图2为本发明一实施例的烟草NtNAC096基因cDNA序列扩增结果电泳图;
图3为本发明一实施例的烟草NtNAC096基因组织表达分析;
图4为本发明一实施例的烟草NtNAC096基因烟草叶片不同发育时期表达分析;
图5为植物过表达载体pRI101-NtNAC096构建和验证电泳图;
图6为pRI101-NtNAC096转基因拟南芥植株鉴定和表型图;
图7为烟草CRISPR/Cas9转基因阳性植株NtNAC096基因包含靶位点序列目的片段电泳图;
图8为转基因烟株内源NtNAC096基因靶序列分析结果图;
图9为烟草NtNAC096敲除突变体表型图。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明实施例提供了一种烟草NtNAC096基因控制烟草衰老的应用,烟草NtNAC096基因的核苷酸序列如SEQ ID NO.1所示,通过分析,烟草NtNAC096基因由3个外显子和2个内含子组成。对烟草NtNAC096基因进行基因功能分析后敲除NtNAC096基因,获得延缓衰老的烟草植株。
本发明实施例还提供了烟草NtNAC096基因控制烟草衰老的应用方法,具体包括如下步骤:
S1烟草NtNAC096基因克隆,序列分析。
本步骤以烟草基因组DNA和cDNA为模板,设计引物,扩增得到烟草NtNAC096基因的基因组DNA和cDNA,分析基因组DNA的内含子和外显子序列。
S2对NtNAC096基因进行表达分析。
本步骤通过对烟草NtNAC096基因的表达进行分析可以获得该基因的作用部位和作用时期。
S3通过构建烟草NtNAC096基因过表达载体,进行烟草NtNAC096基因功能分析。
本步骤中通过过表达载体的构建,利用农杆菌介导制备转基因的拟南芥植株,在拟南芥上对该基因进行功能分析可以对烟草NtNAC096基因进行功能上的验证,为其应用做理论准备。
S4利用CRISPR/Cas9基因编辑技术对烟草NtNAC096基因靶位点进行设计,构建NtNAC096基因敲除载体;对烟草品种进行遗传转化,获得延缓衰老的烟草。
本步骤中运用基因编辑技术可以随机的编辑烟草NtNAC096基因,再通过转基因技术可以调控烟草的衰老,改变烟草的衰老进程,培育晚衰的烟草品种,从整体上控制烟草的衰老。
作为本发明的优选实施例,步骤S2对NtNAC096基因进行表达分析,可以用qRT-PCR方法检测NtNAC096基因在烟草不同组织和不同叶片生育时期的表达模式。qRT-PCR的方法高效直观,但是可以理解的是,本领域其他的检测基因表达的方法,例如RT-PCR、northern杂交等也可以用于上述NtNAC096基因的表达分析。
作为本发明的优选实施例,构建烟草NtNAC096基因过表达载体的方法为利用clontech infusion同源重组方法将NtNAC096构建进入过表达载体pRI101-AN,构建烟草NtNAC096基因过表达载体pRI101-NtNAC096。可以理解的是,过表达载体pRI101-AN是经过筛选的针对烟草NtNAC096基因适宜的载体,其他的基因过表达载体也可以用于上述过表达载体的构建。
作为本发明的优选实施例,利用农杆菌介导的浸花法侵染拟南芥得到T0代种子,培养基筛选获得T1代阳性苗,将阳性苗自交1代并继续筛选,最终获得转基因纯合株系,对转基因纯合株系进行衰老表型分析和衰老指标测定。可以理解的是,其他过表达载体导入拟南芥获得转基因拟南芥的方法也可以用来进行上述烟草NtNAC096基因的功能验证。
作为本发明的优选实施例,利用CRISPR/Cas9基因编辑技术对烟草NtNAC096基因靶位点进行设计,构建NtNAC096基因敲除载体方法为,对NtNAC096基因设计两个靶位点,人工合成加接头序列,靶位点连接到载体上,获得pORE-Cas9/NtNAC096载体。可以理解的是,对NtNAC096基因设计的靶位点不限于两个,可以为多个,可以根据需要确定靶位点的数量。
作为本发明的优选实施例,pORE-Cas9/NtNAC096载体载体转化农杆菌感受态LBA4404,利用农杆菌介导的烟草叶盘转化法对烟草进行遗传转化,获得抗卡那霉素的T0代阳性转化苗,收取T0代转基因阳性种子,卡那霉素抗性平板筛选T1代,抗性苗再经PCR扩增测序筛选得到T1代纯合突变体,测序,获得延缓衰老的烟草。可以理解的是,其他载体导入烟草得转基因烟草的方法也可以用来进行上述操作。
为了更清楚详细地介绍本发明实施例所提供的烟草NtNAC096基因控制烟草衰老的应用,以下将结合具体实施例进行说明。
(一)烟草基因组DNA的提取
(1)取100mg左右的新鲜叶片放入离心管中,液氮速冻,研磨器中磨碎,加入650μL的2×CTAB提取缓冲液(提前预热至65℃),并且迅速混匀;(2)65℃水浴1h,期间每隔15min轻摇一次;(3)混合物冷至室温后加入等体积的酚氯仿异戊醇(25:24:1),轻柔混匀,室温静置15min,4℃,12000rpm离心15min;(4)将上清转移到新离心管中;(5)加入等体积的氯仿异戊醇(24:1),颠倒混匀,4℃,12000rpm离心15min,将上清小心转移到新离心管中;(6)取上清,加入等体积异丙醇,混匀,室温放置10min,12000rpm离心15min沉淀DNA;(7)倒掉异丙醇,75%乙醇漂洗2次,最后一次漂洗后将剩余的液体尽量吸净,真空浓缩仪干燥之后加入适量无菌水溶解DNA备用。
2×CTAB提取液配方:100mM(PH8.0)Tris.Cl,20mM(PH8.0)EDTA,1.4M NaCl,2%(w/v)CTAB,40mM巯基乙醇。
(二)烟草RNA提取:采用RNAiso Reagent(TaKaRa)常规提取。
(三)反转录合成cDNA:采用PrimeScript RT eagent Kit with gDNA Eraser(Perfect Real Time)(Takara,RR047A)进行。
(四)烟草NtNAC096基因克隆
设计烟草NtNAC096基因引物
Primer NtNAC096-F:TATTTCTCCCTTCTATTTATTTCCT(5’UTR区)
Primer NtNAC096-R:TCACTGGTATTGAAAGGCTGG(终止密码子位置)
PCR反应体系:
10×PCR Buffer for KOD-Plus-Neo 5μL
2mM dNTPs 5μL
25mM MgSO4 3μL
Primer NtNAC096-F 1.25μL
Primer NtNAC096-R 1.25μL
DNA(or cDNA)1μL
KOD-Plus-Neo 1μL
ddH2O to 50μL
PCR反应程序:
Step1 94℃2min
Step2 98℃10s
Step3 56℃30s
Step4 68℃1min20s Step2-4 35cycle
Step5 68℃8min
以烟草红花大金元的基因组DNA和cDNA为模板扩增,获得1203bp大小片段,电泳结果参见图1,cDNA电泳结果,获得1079bp大小片段,参见图2,右侧为DL5000marker分子量标记。对基因组进行分析,该基因由3个外显子和2个内含子组成。
(五)利用荧光定量qRT-PCR方法检测NtNAC096基因在烟草不同组织(根、茎、幼叶、花、成熟衰老叶片等)和不同叶片生育时期(S1-S4)表达模式。
采用FastStart UniversalSYBR Green Master(ROX)Realtime试剂盒(Roche)。选用相对定量的方法,以烟草18S基因作为内参基因,模板为上述不同组织或者发育时期下得到的cDNA。每个样品设置3个重复,同时设置阴性对照和阳性对照。
反应体系(20μL)
2×SYBR Green Master MIX 10μL
qRT-F primer(10μM)0.5μL
qRT-R primer(10μM)0.5μL
cDNA稀释模板1μL
ddH2O 8μL
反应体系充分混匀后放入ABI7500荧光定量PCR系统进行PCR反应,采用的三步法的PCR反应程序,利用2-ΔΔCt方法确定目标基因的相对表达量。
qRT-PCR引物序列:
NtNAC096-qRT-F:TTCACGACTATTTGATGACAATGCTAAC
NtNAC096-qRT-R:TATTGGTCATTGTGTTTTGGTTGTT
18S-qRT-F:GGTCCAGACATAGTAAGGATTGACAGA
18S-qRT-R:AGACAAATCGCTCCACCAACTAAG
参见图3、图4,结果表明,NtNAC096基因在衰老叶片中表达量最高,其次是根组织。并且在S2期,NtNAC096基因明显上调约1300多倍,S3期上调37.7倍。
(六)利用clontech infusion同源重组方法将NtNAC096构建进入过表达载体pRI101-AN,参见图5。
所用植物过表达载体pRI101-AN(Takara),选用NdeI和EcoRI对pRI101-AN进行双酶切,高保真酶扩增带有接头的NtNAC096基因,分别回收载体大片段和目的基因片段,利用infusion HD(clontech)无缝连接技术将目的片段连入pRI101-AN。
酶切体系:
pRI101-AN 2μg
10×Cutsmart buffer 4μL
NdeI 2μL
EcoRI-HF 2μL
ddH2O to 40μL
于37℃恒温水浴锅酶切3小时以上。
扩增体系同上述PCR方法,引物序列:
NtNAC096-35s-F:CACTGTTGATACATATGGTTGGGAAAAATAACTCCGAG
NtNAC096-35s-R:TGTTGATTCAGAATTCTCACTGGTATTGAAAGGCTGG
酶切质粒和目的基因扩增通过琼脂糖凝胶电泳检测,常规回收。
Infusion连接体系(5μL):
线性化载体3μL
目的片段1μL
In-fusion HD 1μL
50℃15min
图5表明,Marker左侧为DNA分子量标记DL15000,右侧为DL2000,NtNAC096片段高保真酶扩增,左图左侧为目的片段,pRI101-AN双酶切NdeI和EcoRI,左图右侧酶切的线性pRI101-AN质粒条带,右侧电泳图为pRI101-NtNAC096表达载体菌落PCR验证NtNAC096条带。
利用农杆菌介导的浸花法侵染拟南芥,得到T0代种子,在带有卡那霉素抗性的1/2MS培养基中进行筛选,获得T1代阳性苗,将阳性苗自交1代,并继续筛选,最终获得OE1/OE2两个转基因纯合株系。
(七)对OE1/OE2进行衰老表型分析,并进行相关衰老指标测定:
叶绿素含量的测定
种子萌发后生长45d的拟南芥材料(转基因OE和Col-0野生型植株),各选取30株,每株剪取第6片莲座叶(从下往上数),进行叶绿素含量的测定,
实验操作步骤如下:每3株植株为一组,每组叶片放入一个15mL离心管中,称量叶片鲜重;每管中加入10mL无水乙醇,使乙醇完全浸过叶片;避光放置过夜,使叶片完全脱色;用分光光度计分别测量脱色液在665nm和649nm处的吸光值(以无水乙醇作为参比),分别记为A665和A649;按照如下公式计算每组叶片的叶绿素含量:Ca=13.95A665–6.88A649Cb=24.96A649–7.32A665
总叶绿素含量(mg/g)=(Ca+Cb)×V/W。其中,V为提取液体积,10mL;W为叶片鲜重。
叶绿素荧光(Fv/Fm)的测定
使用OPTI-SCIENCES公司的OS5p+型脉冲式叶绿素荧光计,对叶片进行Fv/Fm的测定,操作步骤如下:种子萌发后生长45d的拟南芥植株材料,各选取5株,在黑暗环境中放置20min;选取第六片莲座叶进行测量;连接好仪器各部件,打开仪器开关,在主界面找到Fv/Fm测量程序并进入;用叶片夹夹住叶片,将测量探头插入叶片夹中,调整参数Ft,使其数值处于150-250范围内;点击界面上的测量标志或按下探头上的测量按钮,测量数值便被自动记录并显示;每测完一组数据后,将数据保存到机身的SD卡中;测量全部完成后,拆卸整理好仪器部件,将SD卡中的数据拷出以作分析。
测定结果参见图6,图6A中WT为野生型Col-0;OE1/OE2为转入pRI101-NtNAC096基因的两个株系。表型图为45天拟南芥生长时期表型图片,可以看出OE株系表现为早衰表型。图6B为转基因拟南芥株系叶绿素和光合速率分析。图6C为转基因拟南芥株系中NtNAC096和衰老相关marker基因SAG12mRNA水平分析。在OE1/OE2两个株系中,NtNAC096表达量明显上调,在播种45天后表现出明显的早衰表型,通过生理指标测定,OE1/OE2叶绿素含量和光化学速率明显低于VC,衰老相关marker基因SAG12表达量明显高于VC。
(八)利用CRISPR/Cas9基因编辑技术对烟草NtNAC096基因靶位点进行设计,构建NtNAC096基因敲除载体;对烟草品种进行遗传转化,获得延缓衰老的烟草植株。
设计靶位点2个:
Target1:GCTATAAAGGAAAGCCCCCTA
Target2:TATAAAGGAAAGCCCCCTAA
人工合成加接头序列
Target1-F:GATTGCTATAAAGGAAAGCCCCCTA
Target1-R:AAACTAGGGGGCTTTCCTTTATAGC
Target2-F:GATTGTATAAAGGAAAGCCCCCTAA
Target1-R:AAACTTAGGGGGCTTTCCTTTATAC
敲除载体构建
①单链oligo DNA退火形成双链DNA
将合成的2条单链的引物稀释成50μM,然后退火。
退火反应体系:
将反应体系PCR仪中95℃孵育3min,孵育后自然冷却至室温。
②表达载体的酶切
表达载体:pORE-Cas9/gRNA
用BsaI酶切表达载体
载体 1μg
10×CutSmart Buffer 5μL
酶 1μL
Add ddH2O to 50μL
37℃酶切1小时,回收酶切产物。
③靶位点连接到表达载体上,连接体系:线性化表达载体5μL,退火的双链DNA 2μL,T4连接酶Buffer 2μL,T4连接酶1μL,Add ddH2O to 20μL,25℃连接10分钟。
④连接产物转化感受态细胞,经PCR验证获得阳性克隆。
将构建好的pORE-Cas9/NtNAC096载体转化农杆菌感受态LBA4404,利用农杆菌介导的烟草叶盘转化法对栽培烟草品种K326进行了遗传转化,获得了具有抗卡那霉素的T0代阳性转化苗。
提取阳性烟苗叶片基因组DNA,在两个gRNA序列的两侧设计引物,以基因组DNA为模板,对目的片段进行PCR扩增,对PCR产物进行纯化回收,连接克隆载体进行测序,用以检测靶位点片段突变形式。
收取靶位点被编辑的T0代转基因阳性植株种子,卡那霉素抗性平板筛选T1代,抗性苗再经PCR扩增测序筛选到T1代纯合突变体,电泳图参见图7。提取叶片基因组DNA,对目的片段进行PCR扩增并进行产物测序。测序结果参见图8,图8表明,烟草植株ntnac096-1和ntnac096-2中NtNAC096基因均已被成功编辑,ntnac096-1植株中检测到NtNAC096靶区区段有一个碱基“C”插入,ntnac096-2植株中检测到NtNAC096靶区区段有一个碱基“T”插入,引起蛋白编码框发生改变,导致蛋白质功能丧失,从而获得延缓烟草衰老的植株。
采用上述拟南芥的叶绿素含量和叶绿素荧光测定方法,叶位计算从顶部开始,依次对第1-6片发育完整叶片随机取三点进行测定。测定结果参见图9,如图9A,突变体在团棵期开始就表现出明显的延缓衰老表型。从顶部开始计算叶位,依次对第1-6片发育完整叶片进行叶绿素含量和光合速率测定,叶绿素含量随着叶位数增加呈明显的下降,且突变体叶绿素含量明显高于对照K326,参见图9B;同样,光合速率在第1-4叶位差异不明显,在5-6叶位突变体光合速率远远高于对照K326,参见图9C。通过表型分析和相关生理指标测定,烟草NtNAC096基因敲除后植株衰老过程明显被延缓,说明采用本发明的方法利用烟草NtNAC096基因成功获得烟草晚衰植株。
<110> 中国农业科学院烟草研究所
<120> 烟草NtNAC096基因控制烟草衰老的应用
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 1203
<212> DNA
<213> 烟草NtNAC096基因
<400> 1
atggttggga aaaataactc cgagcagctt cctcctggat ttaggttcca tcctactgat 60
gaagaattaa tcatgtatta tcttcgaaat caagctacct cgaggccttg tcctgtttca 120
atcatccccg aagttgatgt ctataagttt gatccctggg aattgcctgg ttagtatact 180
cgttaaatcg cgtttaattc aaagaattaa tttgtagttg atttttaagt cttgaattaa 240
ttttttctta tgaaattctt gtagagaaag ctgaatttgg ggaaagggaa tggtactttt 300
tcacccctcg tgataggaag tacccaaatg gagttaggcc aaatagagca gctgtatcag 360
gttattggaa ggctacaggc acagataaag caatatatag tggatcaaaa tatgttggta 420
ttaagaaggc tcttgttttc tataaaggaa agccccctaa gggtattaag actgattgga 480
tcatgcatga atatcgatta agtgaatcca ggtctcaacc aatcaggcca aatggctcca 540
tgagggtaag acttgaattc ttggaattgt tttctactat agtttaactt gtatactatg 600
ttagcataga cgtttttact ctatcagatc attttaaaag gtaattacat gcaataatct 660
atattattga aaatatggca agtaactttc tagaatatgt taagtcgtac tcgtgtaaaa 720
atttcactat aatacatggc agtgttctac catatattat aagagttttt gtcatgacta 780
aaagtacaat tttttcgcca tttttttcag ttggatgatt gggtgctttg tagaatttat 840
aagaagaaga atttgggaaa agctatggag atgatgaaag ttgaagaaga gacacaacag 900
cctgaaatat tgagtactaa tcctgttgaa attattgcta ctactggacc acaaacattg 960
aaattgccaa ggacttgttc actgtctcat ctattggaaa tagattattt tgggtcaatt 1020
tcacgactat ttgatgacaa tgctaacaac caaaacacaa tgaccaatat taatattgga 1080
aatatgcatc atcctgccct ggaaaaattt cagctagggg aattgtcaca ccagtacatg 1140
actagtacca acgttaatgg aaatacgcca atttttgtga atccagcctt tcaataccag 1200
tga 1203
- 还没有人留言评论。精彩留言会获得点赞!
- 一种烟草腋芽生长调控基因NtMOC1及其克隆方法与应用与流程
- 一种烟草KC1基因及其制备方法和应用与流程
- 一种烟草AKT1基因及其制备方法和应用与流程
- RPS23基因作为内参基因在定量检测螟黄赤眼蜂基因表达量中的应用的制造方法与工艺
- 一种烟草抗旱基因NtSAP5及其克隆方法与应用与流程
- 一种烟草HKT1基因及其制备方法和应用与流程
- PABPC1基因作为内参基因在定量检测稻螟赤眼蜂基因表达量中的应用的制造方法与工艺
- 一种应用内参基因快速检测肉制品中羊源性成分含量的方法与流程
- 用于甜瓜果实基因PCR表达分析的内参基因及该内参基因的稳定性验证方法与流程
- 一种烟草干旱响应基因NtXERICO及其克隆方法与应用与制造工艺