一种含有硒脲类sirtuin抑制弹头的sirtuin抑制剂及其制备方法与流程
本发明属于药物化学领域,具体涉及一种含硒类化合物及其制备技术。
背景技术:
作为一种主要的翻译后修饰,赖氨酸侧链酰基化及其去酰基化已在近年证明能有效地调节细胞内被修饰蛋白质的结构和功能[1-3]。细胞内蛋白赖氨酸侧链酰基化及去酰基化是一个动态过程,其中的酰基可以是较小的乙酰基(acetyl)也可以是较庞大的丁二酰基(succinyl)或十四酰基(myristoyl)。需要指出的是,根据现有的知识,酰基化可以是酶催化的过程(比如被乙酰转移酶家族成员(protein lysine acetyltransferases)所催化)[4]也可以是非酶催化的过程[5],而去酰基化是酶催化的过程,即被蛋白酰基赖氨酸去酰化酶家族成员(protein acyl-lysine deacylases)所催化[6-8]。
Sirtuin代表一类细胞内蛋白酰基赖氨酸去酰化酶[7,8]。Sirtuin能催化NAD+和酰基赖氨酸的缩合,形成去酰化的产物以及烟酰胺(nicotinamide)和2’-O-AADPR。现有研究表明,除了组蛋白(histones),sirtuin也接受其它细胞内蛋白质作为天然底物[9]。从细菌到人类的各种活性生物体中均已发现了sirtuin[10]。酵母中的沉默信息调节蛋白2(Sir2)是所发现的首例sirtuin;它的蛋白乙酰赖氨酸去乙酰催化活性是在2000年被发现的[11]。迄今为止,哺乳类动物和人体中已发现了7个sirtuin,即SIRT1,SIRT2,SIRT3,SIRT4,SIRT5,SIRT6,SIRT7。SIRT1,SIRT2和SIRT3均能有效地催化去除较小的乙酰基(acetyl)和较庞大的十四酰基(myristoyl);SIRT5能有效地催化去除丁二酰基(succinyl);SIRT6能有效地催化去除十四酰基(myristoyl)[1,7]。
Sirtuin催化的去酰化反应已被证明能有效地调节一些非常重要的生命过程,比如基因转录,细胞凋亡,DNA损伤修复,代谢[12-14],并且该去酰化反应的抑制被认为是当今发展针对一些人类疾病(比如癌症和代谢疾病)的一个重要新型策略[15-17]。Sirtuin抑制剂也应能帮助更进一步探索抑制sirtuin催化的去酰化反应的治疗潜力。
现有的sirtuin抑制剂主要由两大途径获得[7,15,18]:化合物库筛选(包括虚拟筛选)和sirtuin催化机制导向的设计。后者是由我们课题组(在美国Akron大学期间)和John M.Denu教授课题组(美国Wisconsin大学Madison分校)所开拓的一个重要领域[19,20]。到目前为止,多种sirtuin催化机制导向的抑制剂所赖以发挥sirtuin抑制功效的催化机制导向的sirtuin抑制弹头已被发现[7,18];但是在所有的弹头当中,目前只有硫脲弹头能被sirtuin催化形成一个绝对不能够被继续催化转化的中间体(即化学稳定的异硫脲中间体);而其它的弹头被sirtuin催化形成的中间体仍然能够缓慢地被sirtuin继续催化转化形成终产物,以至于削弱对于sirtuin的抑制功效。然而,硫的极化度和亲核性相对于硒来说都较小,所以硫脲弹头在sirtuin催化下与NAD+的亲核取代反应的能力比硒脲要差,并且硫脲的抗氧化能力也比硒脲的要弱。
参考文献:
1.Choudhary,C.;Weinert,B.T.;Nishida,Y.;Verdin,E.;Mann,M.Nat.Rev.Mol.Cell Biol.2014,15,536-550.
2.Bernal,V.;-Cerezo,S.;Gallego-Jara,J.;Ecija-Conesa,A.;de Diego,T.;Iborra,J.L.;Cánovas,M.New Biotechnol.2014,31,586-595.
3.Ringel,A.E.;Roman,C.;Wolberger,C.Protein Sci.2014,23,1686-1697.
4.Aka,J.A.;Kim,G.W.;Yang,X.J.Handbook of Experimental Pharmacology 2011,(206),1-12.
5.Wagner,G.R.;Payne,R.M.J.Biol.Chem.2013,288,29036-29045.
6.Seto,E.;Yoshida,M.Cold Spring Harb.Perspect.Biol.2014,6,a018713.
7.Chen,B.;Zang,W.;Wang,J.;Huang,Y.;He,Y.;Yan,L.;Liu,J.;Zheng W.Chem.Soc.Rev.2015,44,5246-5264.
8.Bheda,P.;Jing,H.;Wolberger,C.;Lin,H.Annu.Rev.Biochem.2016,85,405-429.
9.Martínez-Redondo,P.;Vaquero,A.Genes Cancer 2013,4,148-163.
10.Greiss,S.;Gartner,A.Mol.Cells 2009,28,407-415.
11.Imai,S.;Armstrong,C.M.;Kaeberlein,M.;Guarente,L.Nature 2000,403,795-800.
12.Dai,Y.;Faller,D.V.Transl.Oncogenomics 2008,3,53-65.
13.Choi,J.E.;Mostoslavsky,R.Curr.Opin.Genet.Dev.2014,26,24-32.
14.Sebastián,C.;Mostoslavsky,R.Semin Cell Dev Biol.2015,43,33-42.
15.Hu,J.;Jing,H.;Lin,H.Future Med Chem.2014,6,945-966.
16.Imai,S.;Guarente,L.Trends Pharmacol Sci.2010,31,212-220.
17.Min,S.W.;Sohn,P.D.;Cho,S.H.;Swanson,R.A.;Gan,L.Front Aging Neurosci.2013,5,53.
18.Zheng,W.Mini Rev Med Chem.2013,13,132-154.
19.Fatkins,D.G.;Monnot,A.D.;Zheng,W.Bioorg.Med.Chem.Lett.2006,16,3651-3656.
20.Smith,B.C.;Denu,J.M.Biochemistry.2007,46,14478-14486.
技术实现要素:
本发明的目的在于提供一种含有硒脲类sirtuin抑制弹头的sirtuin抑制剂及其制备方法。本发明中的sirtuin抑制剂将含有硒脲类抑制弹头,以提高之前报道的含有硫脲类抑制弹头的sirtuin抑制剂的抑制强度及抗氧化能力。采用的具体技术方案如下:
第一种 含有硒脲类sirtuin抑制弹头的sirtuin抑制剂,其特征在于具有下列结构通式(I):
R1是任何烷基、芳基或者芳烷基;X是O或者S或者NH;Y是C=O或者C=S;Z是O或者NH或者CH2;R2是H或者任何烷基、芳基或者芳烷基;R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3;
所述结构通式(I)中:
R1-X-Y是具有任何氨基酸序列的肽,氨基酸数目1-15;其中X是一个氨基酸中与氨基直接相连的碳,Y是羰基;
Z-R2是具有任何氨基酸序列的肽,氨基酸数目1-15;其中Z是NH;
R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3;
所述结构通式(I)中:
R1是H或者任何烷基、芳基或者芳烷基;X是H或者任何烷基、芳基或者芳烷基;
Y是任何烷基、芳基或者芳烷基;
Z是O或者NH或者CH2;
R2是H或者任何烷基、芳基或者芳烷基;
R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者
CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3。
第二种 含有硒脲类sirtuin抑制弹头的sirtuin抑制剂,其特征在于具有下列结构通式(II):
X是任何烷基、芳基或者芳烷基;
Y是任何烷基、芳基或者芳烷基;
Z是–C(=O)-NH–或者–C(=O)-O–或者–NH-C(=O)-NH–或者–O-C(=O)-NH–或者
–O-C(=O)-O–或者–NH-C(=O)–或者–O-C(=O)–或者–NH-C(=O)-O–或者–S–或者–S-S–或
者
–C=C–或者当直接连接在芳环上时,连接点是邻位或者间位或者对位;
R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者
CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3;
所述结构通式(II)中:
X是–C(=O)–或者–C(=S)–或者–NH-C(=O)–或者–NH-C(=S)–或者–O-C(=O)–或者
–S-C(=O)–或者–S-C(=S)–;
Y是NH或者O或者S;
Z是–C(=O)-NH–或者–C(=O)-O–或者–NH-C(=O)-NH–或者–O-C(=O)-NH–或者
–O-C(=O)-O–或者–NH-C(=O)–或者–O-C(=O)–或者–NH-C(=O)-O–或者–S–或者–S-S–或
者
–C=C–或者当直接连接在芳环上时,连接点是邻位或者间位或者对位;
X和Z之间的连接为任何烷基、芳基或者芳烷基;
Y和Z之间的连接为任何烷基、芳基或者芳烷基;
R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者
CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3。
所述结构通式(II)中:
X是具有任何氨基酸序列的肽,氨基酸数目1-15;
Y是具有任何氨基酸序列的肽,氨基酸数目1-15;
Z是–C(=O)-NH–或者–C(=O)-O–或者–NH-C(=O)-NH–或者–O-C(=O)-NH–或者
–O-C(=O)-O–或者–NH-C(=O)–或者–O-C(=O)–或者–NH-C(=O)-O–或者–S–或者–S-S–或
者
–C=C–或者当直接连接在芳环上时,连接点是邻位或者间位或者对位;
X和Z之间的连接为直接或者通过任何烷基、芳基或者芳烷基连接到X肽的N端或者X
肽中任何一个氨基酸的侧链;Y和Z之间的连接为直接或者通过任何烷基、芳基或者芳烷基连接到Y肽的C端或者Y;
肽中任何一个氨基酸的侧链;
R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者
CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3。
第三种 含有硒脲类sirtuin抑制弹头的sirtuin抑制剂,其特征在于具有下列结构通式(III):
X是–C(=O)–或者–C(=S)–或者–NH-C(=O)–或者–NH-C(=S)–或者–O-C(=O)–或者
–S-C(=O)–或者–S-C(=S)–或者任何一个氨基酸;
Y是NH或者O或者S或者任何一个氨基酸;
X和Y的连接:
通过一个具有任何氨基酸序列的肽,氨基酸数目1-20;连接方式:X端
接该肽的N端,Y端接该肽的C端;或者X端接该肽的C端,Y端接该肽的N端;或者X端接该肽的N端,
Y端接该肽中的一个氨基酸侧链;或者X端接该肽的C端,Y端接该肽中的一个氨基酸
侧链;
或者Y端接该肽的N端,X端接该肽中的一个氨基酸侧链;或者Y端接该肽的C端,X
端接
该肽中的一个氨基酸侧链;或者X端接该肽中的一个氨基酸侧链,Y端接该肽中的另一
个氨基酸侧链;
R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者
CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3。
所述第一种含有硒脲类sirtuin抑制弹头的sirtuin抑制剂的制备方法,其特征在于:将结构通式(IV)的化合物(或者其盐酸盐)与结构通式(V)的化合物反应而得:所述的结构通式(IV)为结构通式(V)为
R1,X,Y,Z,R2,R3的定义与权利要求1至3项中的一致,反应时反应物中所有敏感基团需要被预先保护,等反应结束后统一去除保护基团。
所述第二种含有硒脲类sirtuin抑制弹头的sirtuin抑制剂的制备方法,其特征在于通过将结构通式(VI)的化合物或者其盐酸盐与结构通式(V)的化合物反应制备而得;
所述的结构通式(VI)为所述的结构通式(V)为X,Y,Z,R3的定义与权利要求4至6项中的一致,反应时反应物中所有敏感基团需要被预先保护,等反应结束后统一去除保护基团。
所述第三种含有硒脲类sirtuin抑制弹头的sirtuin抑制剂的制备方法,其特征在于:通过将结构通式(VII)的化合物或者其盐酸盐与结构通式(V)的化合物反应而得;
所述的结构通式(VII)为所述的结构通式(V)为X,Y,R3的定义与权利要求第7项中的一致,反应时反应物中所有敏感基团需要被预先保护,等反应结束后统一去除保护基团。
所述三种含有硒脲类sirtuin抑制弹头的sirtuin抑制剂在发展所有sirtuin催化活性抑制剂中的用途。
所述三种含有硒脲类sirtuin抑制弹头的sirtuin抑制剂所发展出的所有sirtuin催化活性抑制剂在治疗癌症,神经退行性疾病,代谢疾病中的运用。
本发明具有有益效果。因为硒比硫有着更高的极化度以至于更强的亲核性,所以硒脲弹头比之前报道的硫脲弹头更容易进行sirtuin催化的第一步与NAD+的亲核取代反应,以及比硫脲弹头具有更强的抗氧化能力,所以本发明的含有硒脲类sirtuin抑制弹头的抑制剂比之前报道的含有硫脲类sirtuin抑制弹头的抑制剂具有更强的sirtuin抑制功效及抗氧化能力。本发明的含有硒脲类sirtuin抑制弹头的抑制剂可用于发展新型的治疗人类疾病的药物,具体地,在治疗癌症、神经退行性疾病、代谢疾病中能得到很好的应用。
附图说明
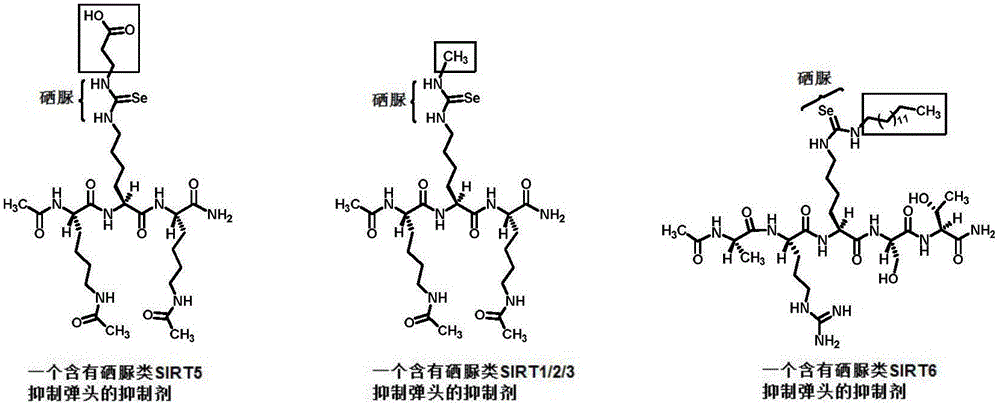
图1中从左到右分别为含有硒脲类SIRT5,SIRT1/2/3,SIRT6抑制弹头的三个抑制剂。
图2为本发明的硒脲类SIRT5抑制剂的合成方案。
图3为本发明的硒脲类SIRT1/2/3抑制剂的合成方案。
图4为本发明的硒脲类SIRT6抑制剂的合成方案。
图5为本发明的另一个硒脲类SIRT5抑制剂的合成方案。
具体实施例
下面结合附图和具体实施例对本发明的技术方案做进一步的详细说明。需要指出的是,本发明人课题组在之前的工作中(参见:Zang,W.;Hao,Y.;Wang,Z.;Zheng,W.Bioorg.Med.Chem.Lett.2015,25,3319-3324;Liu,J.;Zheng,W.Org.Biomol.Chem.2016,14,5928-5935)运用了图1中的肽骨架将硫脲类的抑制弹头装入以评估各个弹头的sirtuin抑制强度,所示的三个弹头的硫脲版是我们之前所发现的最强的硫脲类SIRT5,SIRT1/2/3,SIRT6抑制弹头,所以这些同样的肽骨架也被用于装入硒脲类sirtuin抑制弹头以评估它们对于sirtuin的抑制强度,如图1所示。
实施例1.一个含有硒脲类SIRT5抑制弹头的抑制剂(图1)的化学合成。该化合物的合成过程如图2所示,具体步骤如下:
步骤一.3mmol H3COOC(CH2)2NHCHO溶于15ml的DCM中,加3.6mmol伯吉斯试剂,回流反应2h,生成黄色液体;加10ml的DCM稀释,用10ml蒸馏水分液两次,弃水层;5ml的饱和食盐水分液,保留有机层。往有机层中加入无水硫酸钠干燥,经过滤,旋蒸,得到产物一。
步骤二.将产物一充分溶解于30ml的四氢呋喃(THF)中,加入三乙胺及0.48g硒粉加热回流至充分反应,生成深黄色液体;对所述深黄色液体使用硅藻土过滤,得滤液,经旋蒸、稀盐酸酸化后,再加乙酸乙酯萃取两次,得有机层;对有机层继续用蒸馏水洗去过量的酸后,再用饱和食盐水分离掉过量的水,用无水硫酸钠干燥,过滤取有机层并经旋蒸后,得产物二。所述步骤二为无水无氧反应。
步骤三.称取0.02mmol赖氨酸三聚体,加三乙胺调pH到7,再加入2.8l三乙胺。同时取5μl的产物二溶于250μlDMF和65 l水的混和溶剂中。所配制的两个溶液混合后,先在零下80摄氏度存放4.5min,然后在4摄氏度反应2h,之后用冰乙醚沉降得到产物三。
步骤四.将产物三溶解于甲醇125μl和超纯水42μl的混合溶剂中,加入2.1mg氢氧化锂一水合物(LiOH·H2O),混合均匀,放置在零下80摄氏度4.5min以减缓初始反应速率,然后在4摄氏度环境下充分反应,盐酸酸化后进行冰乙醚沉降处理并使用高效液相色谱法(HPLC)纯化,得到硒脲类SIRT5抑制弹头及含有它的硒脲类SIRT5抑制剂。
实施例2.一个含有硒脲类SIRT1/2/3抑制弹头的抑制剂(图1)的化学合成。该化合物的合成过程如图3所示,具体步骤如下:
步骤一.2mmol CH3NHCHO溶于6ml的DCM中,加3mmol伯吉斯试剂,回流反应2h;加5ml的DCM稀释,用5ml蒸馏水分液两次,弃水层;2ml饱和食盐水分液,保留有机层。有机层中加入无水硫酸钠干燥,经过滤,旋蒸,得到产物一。
步骤二.将产物一充分溶解于24ml四氢呋喃(THF)中,加入三乙胺及0.72g硒粉加热回流5h,生成粗品;对所述粗品使用硅藻土过滤,得滤液,经旋整、稀盐酸酸化后,再加乙酸乙酯萃取两次,得有机层;对有机层继续用蒸馏水洗去过量的酸后,再用饱和食盐水分离掉过量的水,用无水硫酸钠干燥,过滤取有机层并经旋蒸后,得产物二。所述步骤二为无水无氧反应。
步骤三.称取0.02mmol赖氨酸三聚体,加三乙胺调pH到7,再加入2.8 l三乙胺。同时取5μl的产物二溶于250μlDMF和65l水的混和溶剂中。所配制的两个溶液混合后,先在零下80摄氏度存放5min,然后在4摄氏度反应2h,之后用冰乙醚沉降产物并使用高效液相色谱法(HPLC)纯化,得到硒脲类SIRT1/2/3抑制弹头及含有它的硒脲类SIRT1/2/3抑制剂。
实施例3.一个含有硒脲类SIRT6抑制弹头的抑制剂(图1)的化学合成。该化合物的合成过程如图4所示。
步骤一.通过固相多肽合成(SPPS)的方法,侧链完全保护的五肽被接在MBHA树脂上。
步骤二.经1%的TFA/DMF溶液处理,中间位置的赖氨酸侧链被选择性地脱保护释放出游离的氨基。
步骤1a.1mmol H3C(CH2)11NHCHO溶于10ml的DCM,加1.6mmol伯吉斯试剂,回流反应3h;加5ml的DCM稀释,用15ml蒸馏水分液两次,弃水层;10ml饱和食盐水分液,保留有机层;有机层中加入无水硫酸钠干燥,经过滤,旋蒸,得到产物一。
步骤1b.将产物一充分溶解于15ml四氢呋喃(THF)中,加入0.97ml三乙胺及0.24g硒粉加热回流至充分反应,生成粗品;对所述粗品使用硅藻土过滤,得滤液,经旋蒸、稀盐酸酸化后,再加乙酸乙酯萃取两次,得有机层;对有机层继续用蒸馏水洗去过量的酸后,再用饱和食盐水分离掉过量的水,用无水硫酸钠干燥,过滤取有机层并经旋蒸后,得产物二。所述步骤1b为无水无氧反应。
步骤三.取5μl的产物二溶于250μl DMF和65l水的混和溶剂中,然后将此溶液与步骤二得到的树脂混合,先在零下80摄氏度存放5.5min,之后在4摄氏度反应2h,然后树脂用DMF和DCM洗涤,并用真空泵干燥,得到仍连接在树脂上的含有硒脲类SIRT6抑制弹头的侧链完全保护的五肽。
步骤四.步骤三得到的干燥树脂与TFA/DCM/H2O的混合溶剂混匀,在室温反应4h后过滤,滤液经旋蒸浓缩后用冰乙醚沉降产物并使用高效液相色谱法(HPLC)纯化,得到硒脲类SIRT6抑制弹头及含有它的硒脲类SIRT6抑制剂。
实施例4.另一个含有硒脲类SIRT5抑制弹头的抑制剂的化学合成。该化合物的合成如图5所示,具体过程如下:
步骤一.3mmol H3COOC(CH2)2NHCHO溶于15ml的DCM中,加3.6mmol伯吉斯试剂,回流反应2h,生成黄色液体;加10ml的DCM稀释,用10ml蒸馏水分液两次,弃水层;5ml饱和食盐水分液,保留有机层;有机层中加入无水硫酸钠干燥,经过滤,旋蒸,得到产物一。
步骤二.将产物一充分溶解于30ml四氢呋喃(THF)中,加入三乙胺及0.48g硒粉加热回流至充分反应,生成深黄色液体;对所述深黄色液体使用硅藻土过滤,得滤液,经旋蒸、稀盐酸酸化后,再加乙酸乙酯萃取两次,得有机层;对有机层继续用蒸馏水洗去过量的酸后,再用饱和食盐水分离掉过量的水,用无水硫酸钠干燥,过滤取有机层并经旋蒸后,得产物二。所述步骤二为无水无氧反应。
步骤三.取5μl的产物二溶于250μl DMF和65 l水的混合溶剂中,然后将此溶液与0.02mmol如图5所示的环肽混合,先在零下80摄氏度存放4.5min,之后在4摄氏度反应2h,旋蒸后得到产物三。
步骤四.产物三与TFA/DCM/H2O的混合溶剂混匀,在室温反应4h后旋蒸浓缩,之后用冰乙醚沉降产物并使用高效液相色谱法(HPLC)纯化,得到产物四。
步骤五.产物四然后溶解于甲醇125μl和超纯水42μl的混合溶剂中,加入2.1mg氢氧化锂一水合物(LiOH·H2O),混合均匀,放置在零下80摄氏度4.5min以减缓初始反应速率,然后在4摄氏度环境下充分反应,盐酸酸化后进行冰乙醚沉降处理并使用高效液相色谱法(HPLC)纯化,得到最终产物即另一个含有硒脲类SIRT5抑制弹头的抑制剂。
- 还没有人留言评论。精彩留言会获得点赞!