一种免疫磁珠法分离胎盘滋养层细胞的方法与流程
本发明涉及免疫磁珠法的细胞分选技术,具体涉及一种免疫磁珠法分离胎盘滋养层细胞的方法。
背景技术:
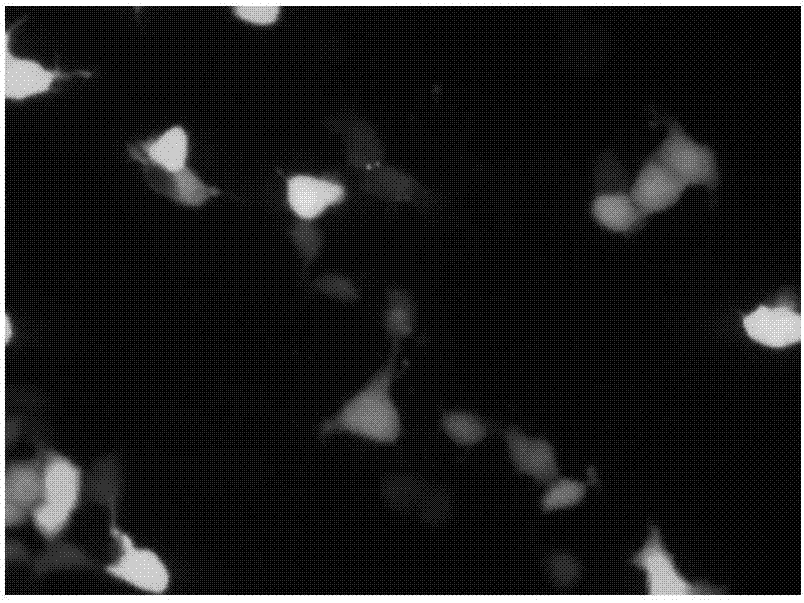
:滋养层细胞是在胚胎发育成桑椹胚后,桑椹胚进一步发育,细胞开始出现分化并沿透明带内壁扩展和排列的较小个体细胞,将来发育成胎膜和胎盘。早期就有研究表明,孕妇宫颈脱落细胞中存在胎盘滋养层细胞,贯穿整个孕期。因此,对滋养层细胞实现有效分离并获取胎儿dna,对于最早期的产前筛查和诊断具有重大意义。许多研究表明,在早孕期包蜕膜和真蜕膜尚未融合时,一定比例的滋养细胞会穿过包蜕膜到达子宫腔,部分脱落到子宫下段,或者通过绒毛退化并脱落至子宫下段或宫颈处,并逐渐积聚,所以若使用一种微创或无创的方法采集宫颈处细胞,就可以精确地进行胎儿的产前诊断,这无疑是一种极具吸引力的方法。免疫磁珠法细胞分选技术是基于细胞表面抗原能与连接有磁珠的特异性单抗相结合,在外加磁场中,通过抗体与磁珠相连的细胞被吸附而滞留在磁场中,无该种表面抗原的细胞由于不能与连接着磁珠的特异性单抗结合而没有磁性,不在磁场中停留,从而使细胞得以分离。细胞分选的方法包括直接法和间接法,直接法即抗体直接与细胞表面抗原结合,间接法即抗体(二抗)通过其本身的抗原(一抗)与细胞表面的抗原结合。人白细胞抗原-g(hla-g)基因是位于6号染色体短臂的一类免疫耐受分子,具有选择性组织分布的特点,hla-g分子主要在人胎盘组织中转录,表达于孕卵着床期母体子宫内膜的胎盘组织中,通常情况下,hla-g可作为孕期胎儿滋养层细胞的特异性标志物。当前胎儿滋养层细胞的分离纯化方案主要有以下几类:1)组织块培养法,根据不同类型细胞的培养悬浮/贴壁状态不同实现对滋养层细胞的分离。取样后制备成单细胞悬液进行培养,血细胞和hofbauer细胞为非贴壁,换液过程容易去除;成纤维细胞和滋养层细胞为贴壁,但成纤维细胞贴壁速度较快且对胰蛋白酶敏感,可在消化过程中分离。此方法得到的滋养层细胞纯度约为80%,成功率在90%左右。2)密度梯度离心法,采用不连续或连续的溶液梯度对细胞进行分离,确定滋养层细胞所处的密度层从而完成分离。可分为percoll法、淋巴细胞分层液法、ficoll法。此方法分离的细胞形态完整、活性较好,纯度可从80%~90%以上,与分层液的类型关系较大。然而,这些方案虽然能够取得较好的分离效果,但这些方法均存在操作过于繁琐,分离时间过长等缺点,严重限制滋养层细胞在胎儿产前筛查领域的应用。技术实现要素:本发明的目的在于提供一种免疫磁珠法分离胎盘滋养层细胞的方法,该方法基于免疫磁珠法细胞分选技术,利用抗体偶联磁珠实现对胎盘滋养层细胞的特异性捕获,简单的几步孵育便能轻松、快速的实现滋养层细胞的分离,且易于实现自动化,有效解决了传统方法存在的繁琐、低效和时间过长等问题。为达上述目的,本发明的主要技术解决手段是提供一种免疫磁珠法分离胎盘滋养层细胞的方法,包括以下步骤:(1)免疫磁珠偶联特异性抗体的制备,向免疫磁珠中加偶联剂和能够特异性捕获胎盘滋养层细胞的抗体进行孵育;(2)洗涤(1)中孵育完成的偶联抗体的免疫磁珠2次,将偶联抗体的免疫磁珠保存在保存液中备用;(3)收集胎盘滋养层样本,采用酶解法将该样本制备为样本细胞悬液;(4)把(3)中的样本细胞悬液洗涤2次;(5)向(4)洗涤后的样本细胞悬液中加入(2)中的偶联有特异性抗体的免疫磁珠进行孵育;(6)洗涤孵育完成的(5)中的免疫磁珠2次,弃上清,即可得到纯化的胎盘滋养层细胞;优选的,所述免疫磁珠为羧基磁珠、环氧基磁珠、甲苯磺酰基磁珠,更优选的,所述免疫磁珠为甲苯磺酰基磁珠,优选供应商为thermofisherm-270epoxy(货号14301),所述偶联剂为与免疫磁珠类型相对应的偶联剂,偶联方法与所购免疫磁珠类型相一致。优选的,能够特异性捕获胎盘滋养层细胞的抗体为hla-g抗体,所述步骤(1)孵育的条件和时间与所购免疫磁珠类型相一致,优选的,孵育条件为37℃偶联16-24h,更优选的,孵育条件为37℃偶联24h。所述步骤(2)、(4)和(6)的洗涤液均为细胞培养用pbs,优选的,pbs构成组分为1.35mnacl,47mmkcl,100mmna2hpo4,20mmnah2po4,且pbs的ph值为7.4。所述步骤(3)的胎盘滋养层样本为5-8周孕妇宫颈脱落细胞,其中包含胎儿滋养层细胞和母体细胞,所述细胞悬液为悬浮细胞的pbs,所述酶解法是利用酶混合物消化胎盘滋养层,具体地,酶混合物为0.25%胰蛋白酶,20u/mldnasei,0.5mg/ml胶原酶i。所述步骤(2)的保存液为去离子水或5%(m/v)bsa。优选的,样本为25-500μl,更优选的,样本为50-150μl。优选的,步骤(5)中的细胞悬液与添加的免疫磁珠的体积比为2:1-1:4,所述步骤(5)的孵育条件为4℃-42℃,30min-24h,优选的,孵育条件为37℃,2h。本发明所述的免疫磁珠法分离胎盘滋养层细胞的方法的具体步骤如下:(1)甲苯磺酰基磁珠偶联hla-g抗体的制备:甲苯磺酰基磁珠为thermofisherm-270epoxy(货号14301),偶联方法参照其产品说明书提供的方法,取磁珠5mg,用pbs溶液洗涤2次(每次1ml),悬于100μlpbs溶液中,加入100μlhla-g抗体,100μl3m(nh4)2so4溶液,涡旋混匀,37℃倾斜摇动孵育24h,避免磁珠沉降,用0.1%bsa/pbs溶液洗涤磁珠4次(每次1ml),磁珠悬浮于1ml0.1%bsa/pbs溶液中备用。(2)含胎盘滋养层细胞的单细胞悬液制备:取5-8周孕妇宫颈脱落细胞样本,用预冷的pbs洗涤2次,2500g离心5min收集细胞,加入由0.25%胰蛋白酶,20u/mldnasei,0.5mg/ml胶原酶i组成的酶混合物于37℃孵育30min消化组织和粘液,用预冷的pbs洗涤2次,2500g离心5min吸除上清,加入100ul预冷pbs重悬细胞。(3)胎盘滋养层细胞分离与纯化:向(2)中制备好的含胎盘滋养层细胞的细胞悬液中加入0.2ml(1)中制备的hla-g抗体偶联磁珠,置于37℃倾斜摇动孵育2h,用pbs溶液洗涤磁珠2次,每次1ml,在磁力架上聚集磁珠并吸除上清,即分离得到纯化的滋养层细胞样本。本发明有益效果是:1、hla-g抗体对胎盘滋养层细胞的特异性选择完成捕获,特异性较高;2、利用免疫磁珠偶联的抗体进行捕获,捕获效率极高且操作方便;3、仅需一次抗体的偶联,与通常的二抗两次偶联相比,使整个操作简便易行;4、能短期快速完成低浓度细胞样本的富集,并且避免细胞扩大培养的不便利,对于早期胎儿的无创产前筛查和诊断具有重大意义。附图说明图1是磁珠捕获jeg-3细胞的结合体状态效果图,图2是hek293ft细胞转染效果示意图,图3是免疫磁珠分离hek293ft和jeg-3混合细胞后,利用荧光显微镜观察对两种细胞的回收数量图示,图4是免疫磁珠分离hek293ft和jeg-3混合细胞后,利用普通显微镜观察对两种细胞的回收数量图示,图5是免疫磁珠分离得到滋养层细胞的图示;图中:具有hla-g抗原的细胞(jeg-3细胞、宫颈滋养层细胞)1、被hla-g抗体偶联的磁珠2。具体实施方式为便于理解,更好地对本发明进行解释,此处结合实验对
发明内容作进一步描述,此处需要说明的是,hla-g为人类白细胞抗原-g,属于非经典人类白细胞抗原i类分子,主要选择性分布在母体胎儿界面绒毛外细胞滋养层。jeg-3为人绒毛膜癌细胞株,能够高度表达hla-g表面抗原,本发明利用jeg-3细胞通过以下实施例对本分离的特异性和效率进行具体描述。以下实施例仅为说明性验证,并非限制性条件。实施例1hla-g偶联免疫磁珠的合成与偶联效率检测(1)取5mg甲苯磺酰基磁珠(thermofisherm-270epoxy(货号14301)),用pbs溶液洗涤2次(每次1ml),悬于100μlpbs溶液中。(2)在(1)含有磁珠的pbs溶液中加入100μlhla-g抗体和100μl3m(nh4)2so4溶液,涡旋混匀,置于37℃倾斜摇动孵育24h,避免磁珠沉降。(3)用0.1%bsa/pbs溶液洗涤(2)中孵育完成的磁珠4次(每次1ml),磁珠悬浮于1ml0.1%bsa/pbs溶液中备用。(4)取偶联前后含hla-g抗体的溶液各10ul,利用quibt3.0fluorometer(lifetechnologies)测定反应前后的蛋白含量,根据差量法计算偶联成功的hla-g抗体含量,结果如下表所示。偶联前后的蛋白含量测定结果蛋白浓度偶联前289.5μg/ml偶联后204.9μg/ml偶联成功的hla-g量25.4μg/(1ml磁珠)实施例2jeg-3细胞样本的培养与计数(1)jeg-3细胞在dmem(含10%fbs、1%青霉素-链霉素双抗溶液)中培养与传代,jeg-3细胞快速生长期取样用于实验;(2)取一皿(1)中的jeg-3细胞,用0.25%胰蛋白酶消化液消化jeg-3细胞,并用pbs洗涤jeg-3细胞两次,2500g离心5min收集jeg-3细胞,将jeg-3细胞悬浮于1mlpbs溶液中;(3)取10μl(2)中收集到的jeg-3细胞悬液,稀释1000倍,用血细胞计数板准确对jeg-3细胞进行计数,3次计数结果统计如下表所示。jeg-3细胞计数结果计数结果第1次8.62x105个/ml第2次8.68x105个/ml第3次8.63x105个/ml平均值8.64x105个/ml实施例3免疫磁珠法分离效率测试(1)取jeg-3细胞悬液1.16μl(1000个细胞),加入pbs溶液补足至总体积100μl;(2)加入实施例1所制备hla-g偶联磁珠悬液200μl,置于37℃倾斜摇动孵育2h;(3)用pbs溶液洗涤(2)中孵育完成的磁珠-细胞结合体2次,每次0.5mlpbs溶液,在磁力架上聚集磁珠吸除上清,加入100ulpbs溶液重悬磁珠-细胞结合体;(4)在显微镜下观察并分辨磁珠中的细胞,用血细胞计数板统计细胞数量,结果如下表所示,并拍照,磁珠-细胞结合体状态如附图1所示:免疫磁珠法回收jeg-3细胞统计结果实施例4hek293ft细胞样品的培养与转染(1)hek293ft细胞在dmem(含10%fbs、1%青霉素-链霉素双抗溶液)中培养与传代,细胞快速生长期取样用于转染实验;(2)转染质粒购自碧云天生物pcmv-c-egfp(参考网站:http://www.beyotime.com/d2626.htm),转染试剂购自碧云天生物lipo6000tm转染试剂(参考网站http://www.beyotime.com/product/c0526.htm);(3)转染后培养48h更换溶液,然后在荧光显微镜下观察并拍照,转染效果如附图2所示;(4)细胞数量的统计方法参照实施例2的方法,统计结果如下表所示:hek293ft细胞计数结果计数结果第1次5.29x105个/ml第2次5.24x105个/ml第3次5.17x105个/ml平均值5.23x105个/ml实施例5免疫磁珠法分离特异性测试(1)取实施例2所制备细胞悬液1.16μl(1000个细胞),混入实施例4所制备细胞悬液17.21μl(9000个细胞),加入pbs溶液补足至总体积100μl;(2)在(1)中制备的100μl细胞悬液中加入实施例1所制备hla-g偶联磁珠悬液200μl,置于37℃倾斜摇动孵育2h;(3)用pbs溶液洗涤(2)中孵育完成的磁珠-细胞结合体2次,每次0.5mlpbs溶液,在磁力架上聚集磁珠吸除上清,加入100ulpbs溶液重悬磁珠-细胞结合体;(4)在荧光显微镜下观察转染磁珠-细胞结合体荧光信号状况(即通过反向法检验免疫磁珠对hek293ft细胞的非特异性捕获)如图3所示,在明场显微镜下观察磁珠-细胞结合体状态如附图4所示。实施例6宫颈脱落样本单细胞悬液制备(1)取孕龄为5周的孕妇宫颈脱落细胞样本,用预冷的pbs洗涤2次,2500g离心5min收集细胞;(2)在步骤(1)收集的细胞中加入由0.25%胰蛋白酶,20u/mldnasei,0.5mg/ml胶原酶i组成的酶混合物,并置于37℃孵育30min消化组织和粘液;(3)用预冷的pbs洗涤2次,2500g离心5min吸除上清,加入100ul预冷pbs重悬细胞。实施例7免疫磁珠法分离胎盘滋养层细胞效果测试(1)向实施例5的步骤(1)中所述的100ul细胞悬液中加入200ul实施例1所制备hla-g偶联磁珠,置于37℃倾斜摇动孵育2h;(2)用pbs溶液洗涤(1)中的磁珠-细胞结合体2次,每次0.5mlpbs溶液,在磁力架上聚集磁珠吸除上清,加入100ulpbs溶液重悬磁珠-细胞结合体。(3)在显微镜下观察并分辨磁珠中的细胞并拍照,捕获的滋养层细胞-磁珠结合体状态如附图5所示。实验结果的说明:图1、图4、图5所示具有表面hla-g抗原的细胞1(jeg-3细胞、宫颈滋养层细胞),被hla-g抗体偶联的磁珠2特异性性偶联,显微镜下观察显示,磁珠结合在细胞周边形成细胞-磁珠结合体。利用绿色荧光蛋白(egfp)转染的hek293ft细胞(图2所示)混入jeg-3细胞,经hla-g磁珠分离后,未检出荧光信号(图3所示),即磁珠未结合到hek293ft细胞,但明场显微镜下观察到磁珠结合的细胞,图4所示即为特异性结合的jeg-3细胞。图5所示磁珠富集得到的细胞即为从宫颈脱落细胞样品中特异性结合到的滋养层细胞。本发明不局限于上述最佳实施方式,任何人在本发明的启示下都可得出其他各种形式的产品,但不论在其形状或结构上作任何变化,凡是具有与本申请相同或相近似的技术方案,均落在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1