能促进心肌细胞再生的三唑酮并噻二唑类化合物及其药物用途的制作方法
本发明属于生物医药技术领域,具体涉及3,6-二取代三唑酮并噻二唑衍生物或其盐,及其在制备药物中的用途。
背景技术:
心脏是生物体发育中出现的第一个功能性器官。心脏发育生长的异常是心血管疾病的标志事件。据美国心脏协会和我国国家心血管病中心最新统计数据表明,心血管疾病是所有致死因素中占比最大的疾病(约占40%)
心力衰竭临床上一般采用药物、介入及手术治疗改善心肌缺血等一般治疗。常见药物有利尿剂、血管紧张素转换酶抑制剂、β-受体阻滞剂、洋地黄类药物、醛固酮桔抗剂、血管紧张素Ⅱ受体拮抗剂、钙拮抗剂等药物治疗。抗凝、抗血小板治疗。心梗急性发作期可以采用口服硝化甘油或安装心脏支架缓解,严重者甚至需要进行心脏移植手术。
心肌梗死和缺血性心脏疾病是由循环到心肌的血液减少所引起,其特征在于心肌细胞的缺失从而导致致命性心律失常和心脏衰竭的发生。尽管现代医学有很大进步,但心肌梗死和心脏衰竭的治疗仍然是一个重大挑战。
在心血管医学领域,刺激心肌细胞再生的新疗法开发处在最前沿。一些细胞疗法已被采取作为治疗方案,用于在患病心脏中来补充新生心肌。这些疗法包括胚胎干细胞(ESCs),骨髓干细胞和ESC来源的心肌细胞等细胞移植,或将内源的成纤维细胞重编程成心肌细胞。然而,这些研究虽然已被证明具有一定的临床价值,但目前尚未克服了强大的技术障碍,如效率,安全性和输送途径。这些问题都突出了开发小分子药物的迫切性,从而使其可刺激患病心肌内源性再生。
3,6-二取代三唑酮并噻二唑衍生物以前被报道具有消炎、抗肿瘤、杀虫、抗菌降压等生物活性【杨知昆,孙学军、米娜、张海科、尤进茂,范志金,三唑并噻二唑衍生物的合成及抑菌活性,应用化学,2009,26(9):1027-30; JiahuiWua, JiannengLic, Ming-Hua Xub, Dongxiang Liua,Structure–activity relationship and interaction studies of new SIRT1 inhibitors with the scaffold of 3-(furan-2-yl)-[1,2,4]triazolo[3,4-b][1,3,4]thiadiazole, Bioorganic & Medicinal Chemistry Letters,2014.24(14): 3050–56; 】。在此之前未见有促进心肌细胞再生的报道。
钟涛等人2011年首次报道了在系列三唑酮并噻二唑衍生物Cardionogen(CDNGs)作为Wnt信号通路的拮抗剂可以增加心肌祖细胞数量,被证明可以增强心肌分化【Terri T. Ni, Eric J. Rellinger, Amrita Mukherjee, Lauren Stephens, Cutris A Thorne, Kwangho Kim, Jiangyong Hu, ShuyingXie, Ethan Lee, Larry Marnett, Antonis K. Hatzopoulos, Tao P. Zhong,Discovering small molecules that promote cardiomyocyte generation by modulating Wnt signaling,Chem Biol. 2011 Dec 23; 18(12): 1658–1668. doi: 10.1016/j.chembiol.2011.09.015】。 CDNGs还能诱导小鼠胚胎干细胞分化成心肌细胞。不像其他的Wnt抑制剂,CDNG作用于斑马鱼胚胎不会导致可见的形态缺陷,例如前后轴线缩短等。其中活性最高的是3位为呋喃环取代的衍生物(CDNG1),活性均有待进一步提高,且心肌损伤动物模型实验验证未深入开展。
经典Wnt途径一般由分泌的Wnt蛋白与Frizzled受体复合物相结合来介导,这导致β-catenin蛋白由细胞质转移至细胞核中,从而激活T细胞因子(TCF)和淋巴增强因子(LEF)介导的基因表达。虽然CDNG抑制Wnt信号途径中TCF / LEF介导的基因转录,但CDNG在Wnt信号通路中的关键靶标仍为未知。
本发明在2011年公开发表CDNGs工作的基础上,通过结构修饰/改造,引入对位-吡啶取代基,活性和成药性能得到进一步提升, 并发现beta-catenin 是CDNGs 作用的关键靶标。
技术实现要素:
本发明的目的是提供具有促心肌细胞再生的活性小分子3,6-二取代三唑酮并噻二唑衍生物或其盐,及其在制备药物的用途。
本发明提供的3,6-二取代三唑酮并噻二唑衍生物,具有以下结构:
;
其中R为具有5~6碳元的环烷基;如:
或
具体为2种:
(1)化学结构式为C14H15N5S,平均分子量为285.37 g/Mol;英文名:
6-cyclohexyl-3-(pyridin-4-yl)-[1,2,4]triazolo[3,4-b][1,3,4]thiadiazole;
中文名:6-环己基-3-(吡啶-4-基)-[1,2,4]三唑[3,4-b][1,3,4]噻二唑,简称CDNG1A;
(2)化学结构式为C13H13N5S, 平均分子量为271.37g/mol;英文名:
6-cyclopentyl-3-(pyridin-4-yl)-[1,2,4]triazolo[3,4-b][1,3,4]thiadiazole;
中文名:6-环戊基-3-(吡啶-4-基)-[1,2,4]三唑[3,4-b][1,3,4]噻二唑,简称CDNG1B。
本发明的CDNG1A或CDNG1B作为Wnt/β-catenin通路阻滞剂,高内涵活性测试、在分子、细胞及整体动物水平具有比文献报道的CDNG具有更高的活性和更低的毒性,因此成药性更高,可以用于制备预防或治疗心肌梗死、心肌坏死和心肌衰竭等疾病的药物,如心衰、心梗、心律失常和/或心肌细胞损伤修复药物等。
本发明中,所述衍生物的盐为药学上可接受的盐。
本发明中,所述的“药学上可接受的盐”可具体地列举为与盐酸、氢溴酸、磷酸、硫酸或硝酸等无机酸形成的盐,或与甲酸、乙酸、甲磺酸、乙磺酸或柠檬酸等有机酸形成的盐。
本发明公开的CDNG1A、CDNG1B或其盐可以釆用各种常规的制备方法制备。例如, 釆用人工化学合成的方法。
本发明公开的CDNG1A、CDNG1B或其盐在治疗上进行施用(给药)时, 可提供不同的效果。通常,可将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中pH通常约为5-8,较佳地pH约为6-8,尽管 pH值可随被配制物质的性质以及待治疗的病症而有所变化。配制好的药物组合物可以通过常规途径进行给药,其中包括(但并不限于):肌内、腹膜内、皮下、皮内、局部给药或口服。
以本发明公开的CDNG1A、CDNG1B或其盐可以将其与合适的药学上可接受的载体联用,组成药物组合物。这类药物组合物含有治疗有效量的化合物和药学上可接受的载体或赋形剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇等,或其中几种的组合。
本发明的CDNG1A、CDNG1B制备的药物组合物, 可以是针剂、片剂、颗粒冲剂、胶囊、泡腾片或新型纳米缓释剂。
药物制剂应与给药方式相匹配。本发明公开的小分子化合物可以被制成针剂形式, 例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。诸如片剂和胶囊之类的药物组合物, 可通过常规方法进行制备。药物组合物如针剂、溶液、片剂和胶囊宜在无菌条件下制造。活性成分的给药量是治疗有效剂量,例如,每天给药约1-3mg/千克体重;或隔天给药约3-10mg/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
此外,本发明的CDNG1A、CDNG1B还可与其他治疗剂一起使用。
与现有技术相比,本发明具有如下优点和有益效果:
本发明化合物通过体内构效关系实验进行了结构改造与修饰,结构新颖且活性得到提高;
本发明化合物进一步阐明了调控Wnt信号通路的分子机制是作为Wnt阻滞剂通过下调β-catenin表达量抑制Wnt/β-catenin;
本发明化合物进一步在小鼠心梗模型中得到实验证实。制备预防或治疗心肌坏死、心肌梗死、心肌衰竭等病的药物,但不仅限于此。
附图说明
图1为空白对照(CTL)、CDNG1、CDNG1A、CDNG1B给药组心肌细胞计数图。
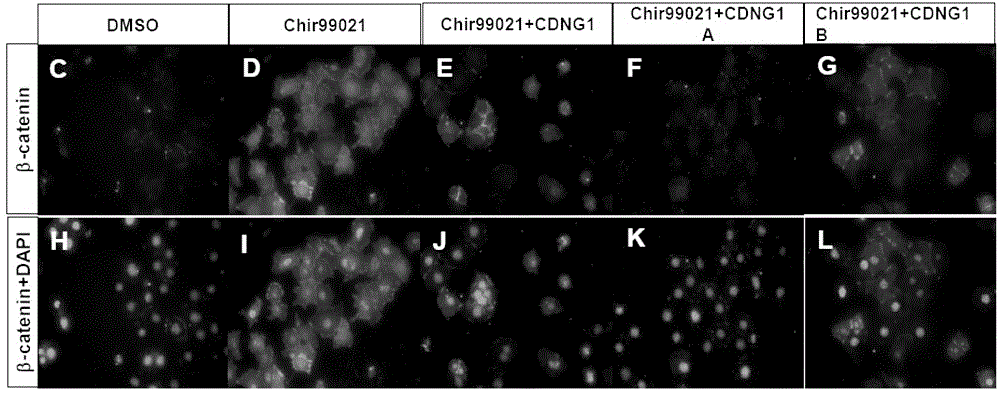
图2:C-L为免疫荧光法测定的C184小鼠精源干细胞用不同药物处理的beta-catenin蛋白表达水平。其中,H-L为DAPI叠合beta-catenin蛋白荧光免疫染色图像。
图3在不同CDNG类化合物给药下PCNA-、Edu-标记的斑马鱼心肌细胞增殖指数,Ctrl为空白对照。
具体实施方式
下面结合附图和实施例对本发明进一步说明。但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件或者按照试剂供货商提供的条件。所采用的原料或试剂、细胞株或动物模型为商业上可购得的或本领域技术人员根据已知文献制得的。
实施例1: CDNG1A以及CDNG1B的合成。
采用两步合成法:
中间体:4-amino-5-(pyridin-4-yl)-4H-1,2,4-triazole-3-thiol(III)4-氨基-5-(吡啶-4-基)-4H-1,24,-三唑-4-巯基合成,参照文献JMC 2009,52(14), 4200-4209(其中化合物16的合成方法):
二硫化碳(3.3ml,5.5mmol)滴加到含KOH(3.0g,5.5mmol)和吡啶异烟肼(3.6mmol)的乙醇(70ml)溶液中。混合物在室温下搅拌反应过夜,然后冰水浴冷却并用二乙醚稀释。过滤出沉淀物并用二乙醚洗涤并干燥。所的产物(1.6mmol)用水(2ml)溶解,加入水合肼(2.4mmol),混合物在搅拌下回流反应6hr。然后向反应混合物中加水80ml并用浓盐酸中和,沉淀物用水过滤后干燥。中间体III收率为72%. 1H NMR (200 MHz, DMSO-d6): δ [ppm] = 5.86 (s, 2H, -NH2), 8.00-8.03 (d, 2H, 3J = 6.13 Hz, 20,60-H), 8.74-8.77 (d, 2H, 3J = 6.13 Hz,30,50-H), 13.89 (s, 1H,-SH)。
合成:所有溶剂和化学试剂都从Sigma-Aldrich公司购置。干燥微波反应管中加入中间体III(150mg,1077mmol),POCl3 (3 ml) ,环己基甲酸(108mg,0.85mmol)。反应混合物150℃下充分反应15min。冷却至室温后,将反应混合物倒进冰水中,用饱和碳酸氢钠溶液中和。沉淀物过滤后真空干燥,再采用二氯甲烷甲醇快速色谱纯化(0-10% for 10 min),收率85%.1H-NMR ( 400MHz,DMSO) δ 8.82 (d, J= 6 Hz, 2H) 8.15(d, J=6 Hz, 2H), 3.25-3.21 (m, 1H), 2.16-2.12 (m, 2H), 1.85-1.80 (m, 2H), 1.71-1.66 (m, 3H), 1.48-1.42 (m, 2H), 1.40-1.38 (m, 1H); 13C-NMR (DMSO) δ 177.0, 156.5, 151.1, 143.8, 132.8, 119.7, 41.0, 32.1, 29.0, 25.4; C14H15N5S(M+H)+m/z: 286.1。
合成:干燥微波反应管中加入中间体III(150mg,1077mmol),POCl3 (3 ml) ,环戊基甲酸(97mg,0.85mmol)。反应混合物150℃下充分反应15min。冷却至室温后,将反应混合物倒进冰水中,用饱和碳酸氢钠溶液中和。沉淀物过滤后真空干燥,再采用二氯甲烷甲醇快速色谱纯化(0-10% for 10 min),收率80%.1H-NMR ( 400MHz,DMSO) δ 8.80 (d, J= 6.0 Hz, 2H) 8.12 (d, J= 6 Hz, 2H), 3.62 (m, 1H), 2.20-2.18 (m, 2H), 1.92-1.87 (m, 2H), 1.81-1.74 (m, 2H), 1.74-1.68 (m, 2H); 13C-NMR (DMSO) δ 176.7, 156.0, 151.1, 143.5, 132.7, 119.6, 42.5, 32.9, 25.4;LRMS calculated for C13H13N5S(M+H)+m/z: 272.1, measured 272.0。
该合成路线步骤简单,中间体及相关物质明确,易于鉴定,且原料易得,易于大规模工业化生产。
实施例2:免疫印迹immunoblotting方法进一步验证CDNGs对Wnt通路影响是通过抑制β-catenin实现的(图2)。
步骤一
细胞:鼠源CGR8胚胎干细胞
试剂:已知Wnt通路激动剂Chir99021,CDNG1/CDNG1A/CDNG1B;DMEM(Sigma),10%FBS,100单位/ml LIF,2mM L-谷氨酰胺,50μM β-巯基乙醇,脂质体3000(Life Tech),蛋白酶抑制剂,RIPA细胞裂解液,聚丙烯酰胺凝胶,硝酸纤维素薄膜,脱脂奶粉,β-catenin一抗 (Santa Cruz Biotechnology),GAPDH一抗 (Santa Cruz Biotechnology),HRP二抗。
实验步骤:将鼠源CGR8胚胎干细胞单层平铺在无血清的DMEM中并加入10%FBS,100单位/mlLIF,2mM L-谷氨酰胺和50μM β-巯基乙醇等,置于37℃含有5%CO2的潮湿培养箱中进行培养。细胞处于亚汇合状态时消化接种到24孔板中。将5M Chir99021,10M CDNG1, 10M CDNG1A或10M CDNG1B分别单独或组合加入不同孔中处理细胞。经过3小时处理后,分别收集不同孔中的细胞并用含有蛋白酶抑制剂的RIPA细胞裂解液孵育10分钟。用灭菌枪头吹打裂解混合物若干次后,将混合液置于低温离心机以21000rpm的速度离心10min,取上清待用。用Bradford法进行蛋白定量,标记蛋白浓度。分别取同样量的不同组蛋白,将其进行聚丙烯酰胺凝胶电泳分离并转至硝酸纤维素薄膜上。将含有蛋白的薄膜放入含有5%脱脂奶粉的1XPBSTx中,同时加入β-catenin一抗(1:200)和GAPDH一抗(1:500),4℃过夜孵育。第二天将液体吸干,随后用1XPBSTx洗3次,每次5min。然后换入含有HRP二抗(1:1000)的1XPBSTx中,在室温下孵育1小时。接着同样用1XPBSTx洗3次,每次5min。最后将清洗后的薄膜置于蛋白凝胶成像仪中进行拍照分析。根据蛋白marker的大小确定相应目标蛋白位置并用合适的曝光时间进行拍照。
结果:加入Wnt通路激动剂Chir99021后,以GAPDH作为参照物,细胞的β-catenin量明显上升;但同时再加入CDNG1、CDNG1A或CDNG1B后β-catenin表达量又下降。其中CDNG1A的抑制作用最为显著。
步骤二:免疫荧光定位β-catenin细胞内分布(fig2C-K)
细胞:C184精源干细胞系
试剂:已知Wnt通路激动剂Chir99021,CDNG1/CDNG1A/CDNG1B;DMEM(Sigma),10%FBS,100单位/ml LIF,2mM L-谷氨酰胺,50μM β-巯基乙醇,脂质体3000(Life Tech),β-catenin一抗 (Santa Cruz Biotechnology),羊血清(Invitrogen),AlexaFluor 488荧光二抗(Thermo)。
实验步骤:将鼠源CGR8胚胎干细胞单层平铺在无血清的DMEM中并加入10%FBS,100单位/mlLIF,2mM L-谷氨酰胺和50μM β-巯基乙醇等,置于37℃含有5%CO2的潮湿培养箱中进行培养。细胞处于亚汇合状态时消化接种到24孔板中。将5 M Chir99021,10 M CDNG1, 10M CDNG1A或10M CDNG1B分别单独或组合加入不同孔中处理细胞。经过3小时处理后,将细胞培养基吸干,加入4% PFA室温固定30分钟。用1XPBST洗3次,每次5min,换入新鲜配制的5%山羊血清封闭1小时。向孔中再分别加入β-catenin一抗(1:200)置于4℃过夜孵育。第二天将液体吸干,随后用1XPBST洗3次,每次5min。然后换入新鲜配制的5%山羊血清并分别加入AlexaFluor 488荧光二抗(1:1000),在室温下孵育1小时。接着同样用1XPBST洗3次,每次5min。如需DAPI染色则滴加DAPI封片剂处理。最后将细胞置于荧光显微镜下观察并拍照分析。
结果:与DMSO空白对照相比,加入Chir99021,细胞内核仁和胞浆内的β-catenin均明显增加,再往含有Chir99021的细胞培养孔中加入CDNG1,核仁和胞浆内的β-catenin显著减少,而类似地,共孵育CDNG1A则导致核仁和胞浆内的β-catenin几乎消失,更进一步说明CDNG1A对Wnt/β-catenin通路活性抑制活性更强。
实施例3:免疫组化方法分析CDNG1A促进斑马鱼心肌细胞增值和再生。
动物:4-12月龄的AB野生品系和转基因斑马鱼Tg(cmlc2:nDsRed-nuc)。
试剂:一抗:兔anti-Mef2c(Santa Cruz);小鼠anti-PCNA(Sigma);Click-iT® EdU Alexa-Fluor-488试剂盒 (Invirogen);二抗山羊抗小鼠Alexa-Fluor-488,Alexa-Fluor-555山羊抗兔Alexa-Fluor-488,Alexa-Fluor-555(均购自Invitrogen);含5%醋酸、9%甲醛、0.9%苦酸(Sigma)的Bouin溶液(配制);不溶性苯胺蓝染料(Fisher);G橙色染料(Sigma);酸性品红染料。
实验步骤:用手术剪将4-12月龄斑马鱼用麻醉剂麻醉2分钟,在体视显微镜下将鱼腹面朝上,在心脏部位剪开腹部,使心脏露出。仔细快速切除心尖约20%后放入水中使其苏醒。将手术后的斑马鱼平均分成若干组,每组加入不同的化合物处理。
对于AFOG实验,需从第2天开始每天更换新鲜的化合物处理至术后第21天。对于PCNA/Mef2C免疫组化实验,需从第4天开始每天更换新鲜的化合物处理至术后第7天。对于EdU/DsRed免疫组化实验,需从第2天开始每天更换新鲜的化合物处理至术后第21天,并在术后第6/12/18天分别给斑马鱼注射20mMEdU。化合物处理完毕将斑马鱼麻醉,分离出相应的心脏。4%多聚甲醛室温固定心脏1小时后用1XPBST洗3次,每次5min。随后将心脏置于30%蔗糖溶液4℃过夜平衡。待心脏沉入管底后取出,吸干表面水分放入包埋模块中加入OCT包埋剂,放入-80℃冷冻过夜。取出包埋组织,将冰冻的心脏切成10µm的组织切片。
对于AFOG实验,将Bouin’s液放于60℃预热30分钟,取不同实验组的各一张切片用去离子水洗 10分钟后放入预热的Bouin’s 液于 60℃孵育2小时。接着用自来水冲洗切片30分钟,再用1% Phosphomolybdic acid洗5分钟。再用去离子水洗5分钟后将切片加入AFOG染色液染色5分钟。最后用去离子水洗5分钟后酒精脱水,中性树脂封片。将AFOG染色后的组织切片置于体式显微镜下观察心脏受损后的出血、疤痕及心肌增殖再生情况,其中心肌层、血液和纤维蛋白分别呈现橙色、红色、蓝色。
对于PCNA/Mef2C免疫组化实验,将切片用免疫组化笔将心脏组织圈出,在圈中加入4% PFA室温固定1小时。用1XPBST洗3次,每次5min,换入新鲜配制的5%山羊血清室温封闭1小时。再向切片上同时加入PCNA一抗(1:100)和Mef2C一抗(1:100),置于4℃过夜孵育。第二天用1XPBST洗3次,每次5min。然后换入新鲜配制的5%山羊血清,并同时加入AlexaFluor 488荧光二抗(1:1000)和AlexaFluor555荧光二抗(1:1000)共同在室温下孵育1小时。接着用1XPBST洗3次,每次5min。向切片滴加封片剂后用盖玻片进行封片,最后将封好的切片置于Zeiss LSM 710共聚焦荧光显微镜下观察并拍照分析。每颗心脏需取处于不同位置的三张切片进行拍照,用ImageJ2x软件分别计数PCNA+Mef2c+双阳性和Mef2c+单阳性的细胞数,并用前者除以后者算出相应的心肌细胞增殖再生分数,用统计学计算不同实验组间的差异性。
对于EdU/DsRed免疫组化实验,将切片用免疫组化笔将心脏组织圈出,在圈中加入4% PFA室温固定1小时。根据EDU染色试剂盒说明操作进行,染色后以下步骤均需避光操作。将切片用1XPBST洗3次,每次5min,换入新鲜配制的5%山羊血清室温封闭1小时。再向切片上同时加入DsRed一抗(1:100)置于4℃过夜孵育。第二天用1XPBST洗3次,每次5min。然后换入新鲜配制的5%山羊血清,并同时加入AlexaFluor555荧光二抗(1:1000)在室温下孵育1小时。接着同样用1XPBST洗3次,每次5min。向切片滴加封片剂后用盖玻片进行封片,最后将封好的切片置于Zeiss LSM 710共聚焦荧光显微镜下观察并拍照分析。每颗心脏需取处于不同位置的三张切片进行拍照,用ImageJ2x软件分别计数EDU+DsRed+双阳性和DsRed+单阳性的细胞数,并用前者除以后者算出相应的心肌细胞增殖再生分数,用统计学计算不同实验组间的差异性(如图3所示)。
结果:切除斑马鱼手术21天后受伤心脏切除部位沉积大量血液和胶原蛋白;而从手术后暴露到含CDNG1或CDNG1A的水中的斑马鱼受损心脏部位仅有少量胶原沉淀,而表面大部分覆盖心肌纤维,表明CDNGs可以加速斑马鱼心脏再生。PCNA免疫染色分析结果,与空白对照相比,CDNG1和CDNG1A治疗处理过的受损心脏中心肌细胞增殖分数分别增加57.7%和82.7%。且与CDNG1相比,CDNG1A诱导的心肌细胞增殖指数提高了25%。EDU染色结果(图3)显示CDNGs通过加速心肌细胞增殖来加快心脏再生。与空白对照组相比,CDNG1和CDNG1A治疗组心肌细胞增殖分数分别增加112.5%和220.8%;而CDNG1A治疗组又比CDNG1治疗组促心肌细胞增值效果增高近一倍。
实施例4:CDNG1A促进心梗小鼠心脏修复和增强心脏功能
小鼠:16周龄雄性C57BL/6J小鼠,平均体重25-30g/只;
步骤:20只和14只冠状动脉结扎手术模型小鼠分别用CDNG1A和PBS(空白对照)按照5mg/kg的剂量隔天腹腔注射给药治疗,共10次/21天为一周期。假手术组12只(空白手术对照)。采用超声心电图监测技术分析心脏收缩功能。以乳突肌为参照点,采取随机单盲方式对6次选定的心脏搏动循环采集两次独立扫描并采集结果。末期舒张度(End-diastole)定义为左心室最大舒张尺度;末期收缩度(End-systole)定义为心脏后壁运动峰值。心脏缩短指数FS(Fractional shortening)以左心室尺寸计算,FS=(EDD-ESD)/EDD*100%,心室射血率(EF)则由二维心电图直接计算。
结果:CDNG1A治疗组左心室射血率为52.4%,PBS对照组为41.9%;CDNG1治疗组心脏缩短指数缩小27.1%,对照组为20.8%。尽管相对假手术组而言,治疗组心脏功能有一定程度损伤(74%射血率;68%心脏缩短指数),但CDNG1A治疗组在心脏功能衡量的两项指标左心室射血率和心脏缩短指数FS上分别有25%、30%的改善。进一步观察末期左心室内舒张尺寸(LVIDD)指标发现,与空白组相比,CDNG1A治疗组的LVIDD低出21.5%,说明CDNG1A能阻止心梗发生后的心脏不正常肥大。一般情况下,心梗会导致心脏纤维化以及心脏重量增加。实验结果发现与空白对照组相比,CDNG1A治疗组心脏/体重的比值显著降低14.3%。Masson三元染色实验证实在心梗模型小鼠心脏4种不同截面图显示,与假手术组和空白对照组相比,CDNG1A治疗组心脏损伤部位疤痕和纤维化面积明显降低。
实验结果证明,本发明所述的CDNG1A能显著改善心梗症状,提高受损心脏的功能,是有开发和应用前景的新型药物候选物。
本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解为,在阅读了本发明的上述内容之后,本领域技术人员基于常识有能力对本发明做各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!