用于在放射性核素治疗中保护肾脏的α‑1‑微球蛋白的制作方法
本发明涉及α-1-微球蛋白(a1m)用于减少在用放射性核素标记的小分子来治疗恶性肿瘤(malignancy)如神经内分泌肿瘤期间在放射性核素诊断(rd)、放射性核素治疗(rnt)和放射免疫治疗(rit)中观察到的肾脏相关的副作用。小分子包括受体配体(参见生长抑制素衍生物)、亲和体(affibody)、双体抗体(diabody,双价抗体,双特异抗体,双链抗体)和抗体片段(fab、fv、scfv等)。
此外,本发明涉及a1m用于治疗急性和/或慢性肾损伤。
背景技术:
在过去15年中,肽受体放射性核素治疗(prrt)已成功用来治疗转移性神经内分泌肿瘤[1]。用治疗性放射性核素标记的生长抑素类似肽如奥曲肽用来治疗生长抑素受体阳性肿瘤[2]。然而,肾毒性和慢性肾功能不全是prrt的典型副作用。尽管有保护措施如带正电荷的氨基酸的输注,但已在经历prrt的患者中观察到肾功能的延迟丧失,这是由于近端肾小管再吸收并保留在间质中[1]。因此,肾脏是在prrt中的剂量限制器官。已经观察到用177lu-dotatate加以治疗的患者遭受每年3.8%的肌酸酐清除率损失,以及用90y-dotatoc加以治疗的患者则遭受每年7.3%的肌酸酐清除率损失[3]。另一种利用小分子候选物来进行治疗的方法是亲和体分子、双体抗体和抗体片段以及免疫偶联物(即,fab、scfv等)。在临床前和临床研究中,那些已经被显示具有高肾累积并伴随高肾放射性。
肾毒性的问题还没有得到充分的解决并且仍然需要识别或开发这样的方式,其增加使用prrt的安全并减少相关器官毒性。此外,还在重复的放射性核素诊断(放射性核素成像)期间,alata(低至合理可行的)原则将受益自开发方式来减少来自电离辐射的生物效应。
技术实现要素:
肽受体放射性核素治疗(prrt)在临床使用中是用于神经内分泌肿瘤的治疗。起因于肽的肾小球滤过接着局部辐射和自由基的产生的肾毒性是副作用,其限制上述方法的剂量和用途。α1-微球蛋白(a1m)是人自由基清除蛋白,其显示可防止辐射诱导的体外细胞损伤以及对周围细胞的损伤。a1m是在肝脏中合成,分泌到血液中,平衡到血管外区室以及在肾脏中过滤。
旨在开发针对prrt的肾毒副作用的基于a1m的疗法,作为概念的第一个证据,本发明人已比较了在小鼠中注射重组a1m和生长抑素类似物奥曲肽(octreotide)的动力学和生物分布。两种分子都是主要定位于肾脏,并且与奥曲肽相比,具有a1m的更快速动力学。在静脉(i.v.)注射以后,在10和20分钟时,分别发现在每克肾组织中最大为76%的注射的a1m和46%的注射的奥曲肽。重要地,至少长达注射后60分钟,a1m分子被证明是完整的全长。肾脏的放射自显影表明,在10-60分钟以后,标记的a1m和奥曲肽主要局限于皮质。免疫组化分析和荧光显微术揭示了两种物质主要共定位(co-localization)于近端小管的腔和上皮细胞。结果表明a1m和奥曲肽的高度相似的药物动力学和生物分布,因而使得能够使用a1m来在prrt期间保护肾脏组织。
依据本文报道的与上面简要提到的结果,本发明涉及a1m和prrn(肽受体辐射核素)组合用于放射性核素治疗。
更具体地,本发明涉及:
α1-微球蛋白(a1m),其用于治疗需要放射性核素治疗(rnt)或放射免疫治疗(rit)的恶性肿瘤,其中a1m用作与rnt或rit的共治疗(co-treatment);
a1m和用放射性核素标记的化合物用于治疗需要放射性核素治疗(rnt)或放射免疫治疗(rit)的恶性肿瘤;
a1m,用于治疗肾损伤。
在借助于单或多成像的放射性核素诊断(核医学成像)期间,a1m用于减少来自电离辐射的不想要的生物效应。a1m用来实现alara原理并减少对于患者的电离辐射的不需要的效果。
如下所述,用放射性核素标记的化合物选自由肽受体配体、亲和体和抗体片段组成的组。用放射性核素标记的化合物是耦合到发射辐射的放射性核素的肽。
prrt是分子靶向治疗的一种形式,其是通过使用耦合到发射辐射的放射性核素的小肽来进行。小肽是生长抑素类似物。这种类似物包括奥曲肽、兰瑞肽(lanreotide)、tyr3-奥曲肽(tyr3-octreotide)(toc)、tyr3-奥曲肽酸(tyr3-octrotate)(tate)以及dota+-螯合物dotadoc、dodatate和dota-兰瑞肽。其它生长抑素类似物包括som230(帕瑞肽)、dopastatin和奥曲肽lar。用发射中等和/或高能β粒子如钇-90(90y)或镏-177(177lu)的放射性核素来标记的生长抑素类似物并静脉内(i.v.)给予患者。对患有生长抑素受体阳性肿瘤的患者进行上述治疗。神经内分泌肿瘤(net)的许多但不是所有形式表达一种或多种生长抑素受体亚型。在prrn的给予以后,它结合于定位于肿瘤的生长抑素受体并且prrn被保留在肿瘤中。发射电离辐射的放射性核素的衰减在组织中存储能量,从而导致高吸收剂量。
在本文中,本发明不限于具体prrn如上文提到的那些prrn,而是用任何合适的能够发射电离辐射的放射性核素标记的任何分子,其旨在在本发明的范围内,如放射性核素标记的小分子、亲和体分子、双体抗体、fab、fv、scfv片段和其它免疫偶联物或其它受体配体。优选的是,选择的prrn分布于肾脏并具有与a1m相当的动力学,以实现a1m的最佳保护效果。
如上所述,其中a1m将是有用的疗法之一是神经内分泌肿瘤的治疗。神经内分泌肿瘤(net)包括癌症的异质组,其经常保持无症状的直到原发性肿瘤已经转移。
其他疗法是那些疗法,其可能会导致肾损伤。这样的疗法包括链球菌感染、大肠杆菌感染(ehus)、自体免疫性(sle)、糖尿病等的治疗。
在任何情况下,可以预期的是,a1m具有对肾组织的保护作用。
神经内分泌肿瘤是新生物,其起源于内分泌和神经系统的细胞。这种类型的肿瘤包括胃肠胰腺肿瘤(所谓的dep-net),例如,产生于小肠、十二指肠、胃、或胰腺,但还产生于大肠或肺或许多其他组织。在肠中发生的神经内分泌肿瘤还被称为类癌瘤。
一旦癌细胞已经扩散,则治疗变得困难的并且手术切除是很难或不可能的。存在几种治疗方案来治疗晚期net,其包括手术、生长抑素类似物、化疗等,虽然其中大部分对于完全缓解而言不是最理想的。依据疾病的阶段以及肿瘤的尺寸和侵袭性来确定疗法的选择。
prrt似乎在控制进行性net方面是高效的。虽然完全反应率是相对较低的,但在治疗以后,具有部分缓解和病情稳定的患者的百分率是高的。
如上所述,然而,prrt治疗选项受限于肾脏重吸收和放射性标记肽的保留,从而导致剂量限制肾放射毒性。已在若干患者中描述了辐射性肾病。为了实现肾脏保护,已连同带正电荷的氨基酸、牛明胶溶液(佳乐施)或白蛋白片段一起来共给予prrn。然而。尚未发现最佳溶液。
放射性核素肿瘤治疗机制包括在靶组织中的细胞死亡(坏死和凋亡),以及各种形式的针对活细胞的非致死性应激,包括“氧化应激”。通过溶剂和细胞组分的电离来诱导氧化应激,以及通过来自电离辐射的细胞坏死来诱导次级氧化应激。氧化应激被定义为增加的组织氧化,其是由于在氧化化合物的产生和氧化剂的解毒/氧化组织的修复之间的失调[4]。氧化应激的主要介质是反应性氧类(ros)。ros和自由基与蛋白质、dna和其它分子成分反应以引起人细胞和组织的氧化,其导致靶分子的不需要的修饰、功能丧失和细胞死亡。主要通过扰乱氧化过程的区室化,坏死诱导氧化应激。在放射性核素治疗期间,可以观察到“旁观者效应”,即应激反应,其中没有直接暴露于辐射的细胞遭受间接损害。通过来自直接照射的细胞的应激因素的传播来诱导旁观者效应并且表现为在未照射的旁观者细胞中的细胞死亡、基因组不稳定性和基因表达的变化[4-7]。已建议氧化剂和ros作为旁观者效应的介质[8-10]。
抗氧化剂是保护因子,其消除氧化剂或防止有害的氧化反应[4]。人有机体可以响应氧化应激来产生抗氧化剂。这样的内源性抗氧化剂包括过氧化物降解酶,超氧化物歧化酶(sod),过氧化氢降解酶,过氧化氢酶和谷胱甘肽过氧化物酶,以及血红素降解酶,血红素加氧酶-1(ho-1)。通常发生的26kda血浆和组织蛋白,α1-微球蛋白(a1m),最近被显示参与防范氧化组织损伤,其中通过作为自由基和血红素的清除剂以及氧化的还原酶和抑制剂[11-15]。最近的几篇论文表明,a1m保护细胞培养物和器官移植物以防止氧化损伤[16-18],其中部分地通过积累在线粒体中以及保护线粒体功能[19]。确实,在动物模型中,人重组a1m的输注已成功应用于体内治疗氧化应激相关疾病先兆子痫[20]和血红蛋白诱导肾小球损伤[21]。在本发明中特别感兴趣的是,a1m已经显示出,在照射的细胞培养物的旁观者细胞中会抑制细胞死亡、凋亡、和应激反应基因的上调[22,23]。
基于药代动力学研究,本发明人已经发现,在给予以后,a1m和基于生长抑素类似物的prrn均快速分布于肾脏。a1m的保护作用的前提条件在于,在其定位于肾脏以后,蛋白质不会立即降解。如本文中的实施例所示,在静脉注射以后至少60分钟,在肾脏中发现的大部分a1m仍然完好无损。因而,a1m可以发挥对由prrt引起的肾脏损伤的保护作用。
本发明人已经表明,在几分钟内,>30%的静脉给予的125i-标记的a1m是位于肾脏中。基于本发明人的观察、和示出的a1m针对辐射诱导组织损伤的保护性能,本发明人提出使用a1m输注作为用来改善prrt的方法,其中通过减少肾毒性。这样的基于a1m的方法的前提条件是治疗性a1m和奥曲肽的高度共定位。在本文的实验部分中,在器官和细胞水平上探讨了重组人a1m和奥曲肽的动力学和生物分布。
为了评估治疗性a1m的输注是否将能够防止在经历prrt的患者中观察到的副作用,重要的是,研究和比较了在这些肿瘤的治疗中使用的a1m与生长抑素类似物的动力学和分布。在器官和细胞水平上,这些分子的共定位的程度是特别感兴趣的并且进行了深入探讨,如在本文的实验部分中报道的,其中使用几种成像技术。
进行的生物分布研究显示,对于两种分子在肾脏中的高特异性摄取,其中对于a1m和奥曲肽,最大摄取分别为注射后10和20分钟,以及在清除期期间具有重叠动力学(图1)。这表明,应同时,或在奥曲肽注射不久之后,进行任何保护性a1m输注。a1m自肾脏的快速清除还建议,可能需要a1m的几次输注以完全保护肾脏。
反映生物分布结果,非侵入性spect成像显示在肾脏中两种分子的高摄取。与髓质相比,在肾皮质中可以观察到较高浓度的奥曲肽和a1m,其提示,在20分钟以后,已经共定位在这些区域中。
a1m的保护作用的前提条件当然是,在其定位于在肾脏中以后,上述蛋白质并不立即降解。本发明人因此探讨了蛋白质在肾匀浆液中的尺寸。如从图2中可以看出,注射后至少长达60分钟,在肾脏中发现的大多数的a1m显示全长尺寸。类似于大多数小血浆蛋白质,a1m在肾脏中的自然途径是从血液到原尿的肾小球滤过,接着在近端肾小管上皮中的重吸收和溶酶体降解[29,30]。在尿中仍然可以发现一小部分的a1m[24]。因此可以推测,虽然预期大部分在近端肾小管细胞中被降解,但显著量的a1m可以逃逸肾小管重吸收和降解并在开始的10-60分钟期间保持完整和功能。
α1-微球蛋白-一般背景
a1m在肝脏中以高速率被合成,分泌进入血流并穿过血管壁转运到所有器官的血管外区室。还在其他组织(血细胞、脑、肾、皮肤)中但以较低的速率来合成蛋白质。由于小尺寸,自由a1m从肾脏中的血液中迅速过滤。
a1m是脂钙蛋白超家族的成员,上述超家族是一组蛋白质,其来自动物、植物和细菌,并具有保守的三维结构,但具有非常多样化的功能。每种脂钙蛋白组成自160-190个氨基酸链,其被折叠成具有疏水内部的β-桶袋。至少12种人脂钙蛋白基因是已知的。a1m是到目前为止在哺乳动物、鸟、鱼和青蛙中已经确定的26kda血浆和组织蛋白。通过x射线晶体学确定的a1m的三维结构示于图3。a1m是在肝脏中以高速率被合成,分泌进入血流并快速(t1/2=2-3分钟)穿过血管壁转运到所有器官的血管外区室。在血液和间质组织中,发现a1m:具有游离的单体形式以及作为与较大分子(iga、白蛋白、凝血酶原)的共价复合物。由于小尺寸,自由a1m从肾脏中的血液中迅速过滤。然后再吸附主要部分,但显著量被排泄到尿。
a1m的序列和结构性能
人a1m的全序列是已知的。蛋白质组成自具有183个氨基酸残基的多肽。已从其它哺乳动物、鸟类、两栖动物、和鱼类,检测,分离和/或测序了许多另外的a1mcdna和/或蛋白质。a1m的肽链的长度在物种间略有差异,这主要是由于在c端中的差异。不同推导的氨基酸序列的对齐比较表明,同一性的百分率从在啮齿动物或原蹄动物(ferungulate)和人之间的大约75-80%变化到在鱼和哺乳动物之间大约45%。在位置34处的游离半胱氨酸侧链是保守的。已经显示此基团参与氧化还原反应(见下文),参与与其它血浆蛋白质的复合物形成以及参与结合于黄棕色发色团。a1m的三维结构显示,c34是暴露和定位在脂钙蛋白袋的开口附近的溶剂(见图3)。
在本文中,术语“α1-微球蛋白”旨在覆盖α1-微球蛋白,如在seqidno:1(人a1m)以及seqidno:2(人重组a1m)中确定的,以及它们的具有类似的治疗活性的同源物、片段或变体。因而,如在本文中所使用的,a1m是指相对于seqidno:1或seqidno:2具有至少80%序列同一性的蛋白质。优选的是,如在本文中所使用的,a1m相对于seqidno:1或seqidno:2具有至少90%序列同一性。甚至更优选的是,如在本文中所使用的,a1m相对于seqidno:1或seqidno:2具有至少95%如99%或100%序列同一性。在优选的方面,α1-微球蛋白是依据seqidno:1或2(如本文中确定的)。在图12中,给出序列表:人a1m和人重组a1m的氨基酸序列(分别为seqidno1和2)以及相应的核苷酸序列(分别为seqidno3和4)。然而,如在本文中所使用的,术语a1m还包括a1m的同源物、变体和片段,其具有如在下文中确定的蛋白质的重要部分。
如上所述,依据本文的描述还可以使用a1m的同源物。在理论上,来自所有物种的a1m可用于本文所述的目的,包括迄今发现的最原始的a1m,其来自鱼(鲽)。a1m还可以以分离的形式获自人、猩猩、松鼠猴、大鼠、裸鼢鼠、小鼠、兔、豚鼠、母牛、青蛙、鸡、海象、海牛和鲽。
重要的是要注意,即使a1m和尿抑胰酶素具有相同的前体,但它们具有不同的氨基酸组成并具有不同的性能。a1m属于所谓的脂钙蛋白家族,而尿抑胰酶素(还记为乌司他汀)则属于蛋白酶抑制剂超家族。
考虑a1m的同源物、变体和片段,以下已被确定为蛋白质的用于抗氧化作用的重要部分:
y22(酪氨酸,位置22,碱基对64-66)
c34(半胱氨酸,位置34,碱基对100-102)
k69(赖氨酸,位置69,碱基对205-207)
k92(赖氨酸,位置92,碱基对274-276)
k118(赖氨酸,位置118,碱基对352-354)
k130(赖氨酸,位置130,碱基对388-390)
y132(酪氨酸,位置132,碱基对394-396)
l180(亮氨酸,位置180,碱基对538-540)
i181(异亮氨酸,位置181,碱基对541-543)
p182(脯氨酸,位置182,碱基对544-546)
r183(精氨酸,位置183,碱基对547-549)
(在整个文件中氨基酸和核苷酸的编号是指seqid1和3,还见图3和4;如果采用来自其它物种的其它a1m、a1m类似物或它们的重组序列,则本领域技术人员将知道如何确定活性部位或负责酶活性的部位的氨基酸)。
因而,在那些情况下,其中相对于seqidno:1或2之一,a1m例如具有80%(或90%或95%)序列同一性,优选的是,在分子中的适当地方处存在上文提到的氨基酸。
在三个位置处,用寡糖来替代人a1m:两种唾液酸化复合型、很可能双触角碳水化合物,其连接于n17和n96,以及一种更简单的寡糖,其连接于t5。来自不同物种的a1m蛋白质的碳水化合物含量变化很大,虽然,在一系列不同的糖基化模式中,范围自在非洲爪蟾中根本没有糖基化。然而,一个糖基化位点,其对应于在人中的n96,在哺乳动物中是保守的,这提示这种特定的碳水化合物可能是功能上重要的。
当纯化自血浆或尿时,a1m是黄棕色。上述颜色是起因于异质化合物,其共价结合于主要位于袋的入口处的各种氨基酸侧基。这些修饰表示由a1m体内共价捕获的有机氧化剂的氧化降解产物,例如血红素、犬尿氨酸和酪氨酰自由基。
a1m还是电荷和尺寸异质的以及更高棕褐色的a1m分子是更带负电荷的。对于这种异质性的可能的解释是,不同的侧基被不同的自由基修饰到不同程度,以及修饰会改变蛋白质的净电荷。共价连接的有色物质已被定位于c34,以及k92、k118和k130,后者具有100至300da的分子量。发现色氨酸代谢产物犬尿氨酸共价连接于在来自血液透析患者的尿的a1m中的赖氨酰残基以及在这种情况下似乎是蛋白质的棕色的来源[6]。合成自由基abts(2,2′-连氮基-二-(3-乙基苯并噻唑啉)-6-磺酸)的氧化片段结合于y22和y132的侧链。
c34是a1m的反应中心。它变得非常带负电的,这意味着,它具有高电位来放弃电子,其中通过k69、k92、k118和k130的带正电的侧链的接近,其诱导c34巯基的脱质子化,其是硫原子的氧化的前提条件。初步数据显示,c34是已知的最负电基团之一。
理论上,氨基酸,其表征a1m(c34、y22、k92、k118、k130、y132、l180、i181、p182、r183)的性能,这将在下面更详细地描述,可以以相似的三维结构被安排在另一构架上,例如具有同样全局折叠的蛋白质(另一种脂钙蛋白)或完全人造有机或无机分子如塑料聚合物、纳米颗粒或金属聚合物。
某些氨基酸的三维排列(蓝色椭圆形,由,,+“来描述赖氨酸)、a1m构架(桶)、电子流以及自由基捕获示于图4。
因此,同源物,片段或变体,其包含结构,该结构包括反应中心和它的周围(如上所述的),是优选的。
可以对本公开的多肽的结构进行修饰和变化并且仍然导致具有和多肽类似特征的分子(例如,保守氨基酸取代)。例如,某些氨基酸可以代替在序列中的其它氨基酸而没有明显的活性损失。由于,正是多肽的互相作用的能力和特性限定了多肽的生物功能活性,所以可以进行多肽序列中的某些氨基酸序列取代并且仍获得具有相似特性的多肽。
在作出这样的变化时,可以考虑氨基酸的亲水指数。在本领域中通常理解在对多肽赋予交互式生物功能中亲水氨基酸指数的重要性。众所周知的是,某些氨基酸可以代替具有类似亲水指数或得分的其它氨基酸并且仍然导致具有类似生物活性的多肽。基于其疏水性和电荷特性,已指定每种氨基酸的亲水指数。这些指数是:异亮氨酸(+4.5);缬氨酸(+4.2);亮氨酸(+3.8);苯丙氨酸(+2.8);半胱氨酸/半胱氨酸(+2.5);蛋氨酸(+1.9);丙氨酸(+1.8);甘氨酸(-0.4);苏氨酸(-0.7);丝氨酸(-0.8);色氨酸(-0.9);酪氨酸(-1.3);脯氨酸(-1.6);组氨酸(-3.2);谷氨酸(-3.5);谷氨酰胺(-3.5);天冬氨酸(-3.5);天冬酰胺(-3.5);赖氨酸(-3.9);以及精氨酸(-4.5)。
认为,氨基酸的相对亲水特性确定了得到的多肽的二次结构,其反过来限定多肽与其它分子的相互作用,如酶、底物、受体、抗体、抗原等。在本领域中已知的是,可以用具有类似亲水指数的另一种氨基酸来替代氨基酸并且仍然获得功能相当的多肽。在这样的变化中,其亲水指数是在±2内的氨基酸的替代是优选的,那些亲水指数是在±1内的氨基酸的替代是特别优选的,以及那些亲水指数是在±0.5的氨基酸的替代是甚至更特别优选的。
还可以基于亲水性来进行类似氨基酸的替代,尤其是其中借此产生的生物功能等效多肽或肽旨在用于免疫学实施方式。以下亲水性值已赋予氨基酸残基:精氨酸(+3.0);赖氨酸(+3.0);天冬氨酸(+3.0±1);谷氨酸(+3.0±1);丝氨酸(+0.3);天冬酰胺(+0.2);谷氨酰胺(+0.2);甘氨酸(0);脯氨酸(-0.5±1);苏氨酸(-0.4);丙氨酸(-0.5);组氨酸(-0.5);半胱氨酸(-1.0);蛋氨酸(-1.3);缬氨酸(-1.5);亮氨酸(-1.8);异亮氨酸(-1.8);酪氨酸(-2.3);苯丙氨酸(-2.5);色氨酸(-3.4)。据了解,氨基酸可以代替另一种具有类似的亲水性值的氨基酸并且仍然获得生物等效多肽,以及尤其是,免疫等效多肽。在这样的变化中,其亲水性值是在±2内的氨基酸的替代是优选的,那些亲水性值是在±1内的氨基酸的替代是特别优选的,以及那些亲水性值是在±0.5内的氨基酸的替代是甚至更特别优选的。
如上所述,氨基酸替代通常基于氨基酸侧链取代基的相对相似性,例如,它们的疏水性、亲水性、电荷、尺寸等。考虑到一种或多种上述特征的示例性替代是本领域技术人员所熟知的并且包括但不限于(原始残基:示例性替代):(ala:giy、ser)、(arg:lys)、(asn:gin1his)、(asp:giu、cys、ser)、(gin:asn)、(giu:asp)、(giy:ala)、(his:asn、gin)、(ile:leu、vai)、(leu:ile、vai)、(lys:arg)、(met:leu、tyr)、(ser:thr)、(thr:ser)、(trp:tyr)、(tyr:trp、phe)、以及(vai:lle、leu)。因而本公开的实施方式设想如上所述的多肽的功能或生物等同物。尤其是,多肽的实施方式可以包括变体,其相对于感兴趣的多肽具有约50%、60%、70%、80%、90%、和95%序列同一性。
在本文中,通过参数“同一性”来描述在两个氨基酸序列之间或在两个核酸序列之间的同源性。可以利用可用于蛋白质和dna序列对比的全smith-waterman序列对比来进行序列的比对和同源性得分的计算。默认评分矩阵blosum50和同一性矩阵分别用于蛋白质和dna序列对比。对于在缺口中的第一残基的惩分,对于蛋白质是-12以及对于dna是-16,而对于在缺口中的另外残基的惩分,对于蛋白质是-2以及对于dna是-4。可以借助于fasta程序包版本v20u6来进行序列对比。
可以利用“clustalw”来进行蛋白质序列的多序列对比。可以利用蛋白质序列对比作为模板,用来自dna序列的相应的密码子替换氨基酸,来进行dna序列的多序列对比。
可替换地,不同的软件可以用于序列对比氨基酸序列和dna序列。例如通过利用来自emboss程序包(http://emboss.org)版本2.8.0的needle程序来确定两个氨基酸序列的序列对比。needle程序实施其中描述的全局序列对比算法。使用的替代矩阵是blosum62,空位开放罚分是10,以及空位扩展罚分是0.5。
在氨基酸序列;例如seqidno:1和不同氨基酸序列(例如,seqidno:2)之间的同一性的程度被计算为在两个序列的序列对比中精确匹配的数目除以“seqidno:1”的长度或“seqidno:2”的长度,以最短者为准。以百分比同一性为单位来表示结果。
当两个序列在重叠的相同位置处具有相同氨基酸残基时,则发生精确匹配。
如果相关,可以通过wilbur-lipman方法,利用laser-genetmmegaligntm软件(dnastar,inc.,madison,wl),并借助于同一性表和以下多序列对比参数:缺口罚分为10以及缺口长度罚分为10,来确定在两个核苷酸序列之间的同一性的程度。成对序列对比参数是ktuple=3,缺口罚分=3,以及窗口=20。
可以通过i)序列对比两个氨基酸序列,其中利用needle程序,并借助于blosum62替代矩阵、为10的空位开放罚分、和为0.5的空位扩展罚分;ii)计数在序列对比中精确匹配的数目;iii)精确匹配的数目除以两个氨基酸序列中最短者的长度;以及iv)将iii)的除法的结果转换成百分率,来确定多肽的氨基酸序列相对于seqidno:1的氨基酸的同一性的百分率。以类似的方式来计算相对于本发明的其它序列的同一性的百分率。
通过举例的方式,多肽序列可以与参比序列相同,即是100%相同的,或,与参比序列相比,它可以包括多达一定整数的氨基酸改变,以致%同一性小于100%。这样的改变选自:至少一个氨基酸缺失、替代(包括保守和非保守替代)、或插入,以及其中所述改变可以发生在参比多肽序列的氨基或羧基末端位置处或在那些末端位置之间的任何位置处,其单独散布在参比序列的氨基酸之间,或在参比序列内的一个或多个连续基团中。
保守氨基酸变体还可以包含非自然发生的氨基酸残基。非自然发生的氨基酸包括但不限于反式3-甲基脯氨酸、2,4-亚甲基脯氨酸、顺式4-羟脯氨酸、反式-4-羟脯氨酸、n-甲基-甘氨酸、别苏氨酸、甲基苏氨酸、羟基-乙基半胱氨酸、羟乙基高半胱氨酸、硝基谷氨酰胺、高谷氨酰胺、六氢吡啶羧酸、噻唑烷羧酸、脱氢脯氨酸、3-和4-甲基脯氨酸、3,3-二甲基脯氨酸、叔亮氨酸、正缬氨酸、2-氮杂苯基-丙氨酸、3-氮杂苯丙氨酸、4-氮杂苯丙氨酸、以及4-氟苯丙氨酸。用于将非自然发生的氨基酸残基并入蛋白质的几种方法在本领域中是公知的。例如,可以采用体外系统,其中利用化学氨基酰化抑制剂trna来抑制无义突变。用于合成氨基酸和氨基酰化trna的方法在本领域中是公知的。在包含大肠杆菌s30提取物和市售酶以及其它试剂的无细胞系统中,进行含有无义突变的质粒的转录和翻译。通过色谱法来纯化蛋白质。在第二种方法中,通过突变的mrna和化学氨基酰化抑制剂trna的微注射,在爪蟾卵母细胞中进行翻译。在第三种方法中,在缺乏天然氨基酸,其即要被替换,的情况下(例如,苯丙氨酸)以及在所期望的非自然发生的氨基酸(例如,2-氮杂苯丙氨酸、3-氮杂苯丙氨酸、4-氮杂苯丙氨酸、或4-氟苯丙氨酸)的存在下,培养大肠杆菌细胞。将非自然发生的氨基酸并入蛋白质以代替它的自然对应物。可以通过体外化学修饰,将自然发生的氨基酸残基转化到非自然发生的物种。化学修饰可以与定位诱变结合以进一步扩大替代的范围。可以通过其他技术例如人造脚手架、氨基酸替代等来提供可替代的化学结构,其提供足以支持a1m的抗氧化性能的3维结构。此外,设想模拟如上所列和如图3和4所示的a1m的活性部位的结构具有和a1m相同的功能。
药物组合物和剂量
本发明还提供了试剂盒,其包含:
i)包含prrn的药物组合物,以及
ii)包含a1m的药物组合物。
试剂盒具有含有上述两种组合物的一个包的形式。
包含prrn的药物组合物通常是已投放市场的组合物。
包含a1m(或如本文所定义的它们的类似物、片段或变体)的药物组合物旨在用于静脉给予。因此,可以将a1m配制在液体中,例如在溶液、分散体、乳液、悬浮液等中。如从本文的实施例可以看出,用于静脉给予的适宜的载体可以由10mmtris-hcl,ph8.0以及9.125mnacl组成。
对于肠胃外使用,合适的溶剂包括水、植物油、丙二醇以及一般批准用于此类目的的有机溶剂。通常,涉及用于具体配方类型的相关赋形剂和涉及用于制备具体配方的方法,本领域技术人员可以在gennaro等人编辑的“remington’spharmaceuticalscience”(mackpublishingcompany)中、在rowe等人编辑的“handbookofpharmaceuticalexcipients”(phppress)中以及在官方专著(例如,ph.eur.或usp)中找到指导。
将连同放射性核素治疗剂量一起以一个或几个剂量来给予a1m。优选地,将静脉给予每个剂量,作为单剂量,作为单剂量接着在短时间至长达60分钟期间的缓慢输注,或仅作为在短时间至长达60分钟期间的缓慢输注。将和放射性核素治疗肽的同时,或在放射性核素剂量的注射之前的0-60分钟至放射性核素剂量的注射之后的0-30分钟期间,给予第一剂量。在放射性核素治疗剂量的注射以后,可以添加另外的a1m剂量,但可能不是必要的。每个剂量含有与患者体重相关的a1m的量:1-15mga1m/kg患者。在本文的实施例中描述的研究中,采用7mg/kg的剂量(小鼠模型)。
附图说明
图1示出在正常nmri小鼠中125i-a1m(左上)和111in-奥曲肽(右上)的生物分布。左下图示出,随着时间的推移,在肾脏中两种分子的摄取。数据呈现为来自4只动物的%ia/g±sem。
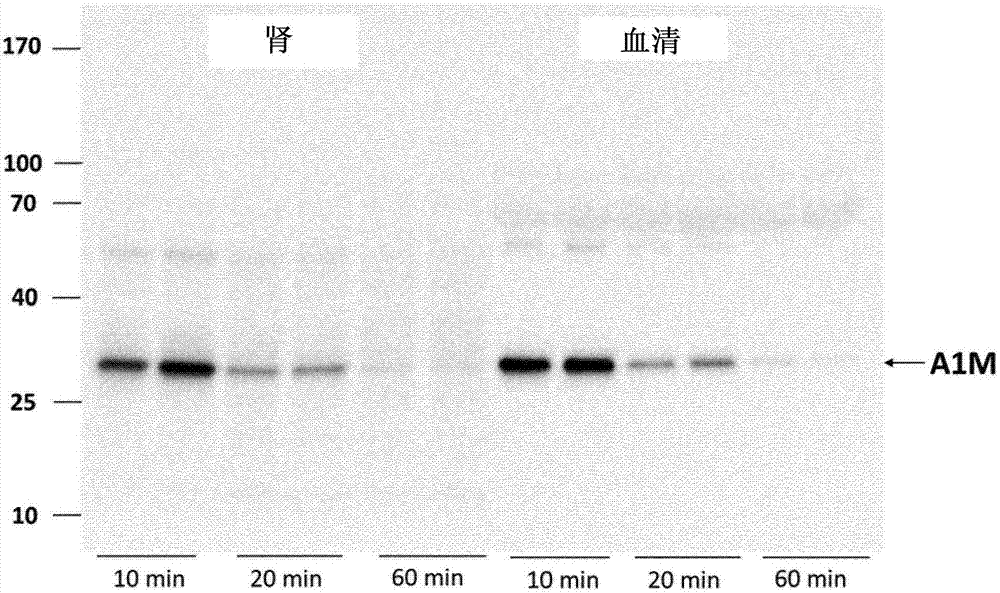
图2示出,在正常nmri小鼠中,在注射后的10、20和60分钟时,在肾脏和血清中全长a1m的存在。对动物静脉注射150μga1m,然后在指定的时间点收集血液和肾脏。允许凝聚血液并通过离心来分离血清。在1mlpbs中均化一个肾脏并离心。将来自肾匀浆液的1μl血清和6μl上清施加于sds-page,转移到pvdf膜以及用抗a1m加以印迹。每个泳道表示单独的小鼠。
图3示出a1m的三维结构。该图是利用pymol[molinspiration,m.v.(2014)]和来自人a1m的晶体结构的坐标[meining,w.,andskerra,a.(2012)所产生。人α1-微球蛋白的晶体结构揭示了潜在的血红素结合位点。biochemj445,175-182]。以绿丝带示出β-链和α-螺旋。c34、k92、k118、k130和h123的侧链,其参与a1m的功能活性,显示为具有蓝色氮原子的绿色棒。四个脂钙蛋白环被标记为#1-#4。
图4示出一些氨基酸(蓝色椭圆形,赖氨酸是由,,+“来描述)、a1m-构架(桶)、电子流和自由基捕获的三维排列。
图5a-d示出在不同的注射后时间的a1m和奥曲肽-a647的管状定位。静脉注射a1m和奥曲肽-a647结合物并在注射以后的20分钟(a,c)和4小时(b,d)终止动物。在共聚焦显微图像(20x/0.8物镜)中,按照在皮质、髓质和集合管中的所选择的管状分布曲线来测量共定位a1m(绿色)和奥曲肽-a647(红色)的百分率。利用dapi(蓝色)来可视化细胞核。代表性剖面(a,b)显示不同程度的共定位(黄色),以及来自所有探讨的样品的共定位数据表示为代表性区域(c,d)的平均值±sem。比例尺表示50μm。
图5e-f示出在不同的注射后时间a1m和奥曲肽-a647的细胞共定位。静脉注射a1m和奥曲肽-a647结合物以及在注射以后的20分钟和4小时终止动物(e,左和右)。在高分辨率共聚焦显微图像(63x/1.4物镜)中,按照在皮质中的所选择的管状分布曲线来测量共定位a1m(绿色)和奥曲肽-a647(红色)的百分率。利用dapi(蓝色)来可视化细胞核。代表性剖面(e)示出不同程度的细胞内共定位(黄色),以及来自所有探讨的样品的共定位数据表示为代表性区域(f)的平均值±sem。比例尺表示20μm。
图6示出注射有5mbq111in-奥曲肽(a和b)和5mbq125i-a1m(c和d)以及成像40分钟的正常nmri小鼠的临床前spect/ct图像。a和c示出整个动物的重建三维视图以及b和d示出通过肾脏的平面切片。肾脏显示高摄取以及在肾皮质中可以看到两种分子的浓度。对于125i-a1m,可以观察到在甲状腺中的轻微摄取。
图7示出在正常小鼠的肾脏中,111in-奥曲肽和125i-a1m的摄取的数字放射自显影图像。(a)125i-a1m,20分钟腹腔注射(p.i.);(b)125i-a1m,1小时腹腔注射;(c)111in-奥曲肽,20分钟腹腔注射;(d)111in-奥曲肽,1小时腹腔注射。所有图像示出在肾皮质中两种分子的局部摄取。需要注意的是,已调节每个图像的比例以最佳说明在每个肾脏切片中放射性核素的相对分布。
图8显示在静脉注射以后20分钟在肾脏中a1m免疫反应性的分布。静脉注射a1m,在20分钟以后终止动物,以及借助于k323抗a1m抗体,利用免疫组化分析,来检测a1m免疫反应性。左图片显示在皮质(a)、髓质(b)、和集合管(collectingduct)(c)中具有a1m-免疫反应性的代表性区域;用a-c来指示这些区域的位置以及在右图片的示意图中用框加以突出。在a-c中比例尺表示100μm。
图9显示在静脉注射以后20分钟和4小时在肾脏中a1m免疫反应性和奥曲肽-a647的分布。在皮质(a)、髓质(b)、和集合管(c)中,借助于k323抗a1m抗体,利用免疫组化分析(左列;明视场显微术)或免疫荧光(中间和右列;共聚焦显微术),来检测a1m免疫反应性。在注射以后20分钟(中间)和4小时(右),探讨了a1m免疫荧光(绿色)和奥曲肽-a647(红色)的分布,以及它们的管状共定位(黄色)。利用dapi(蓝色)来可视化细胞核。比例尺表示50μm。
图10显示在静脉注射以后,a1m免疫荧光和奥曲肽-a647的细胞共定位。静脉注射a1m和奥曲肽-a647结合物以及在注射以后20分钟时终止动物。高分辨率(63x/1.4物镜)共聚焦显微图像显示a1m免疫荧光(绿色)和奥曲肽-a647荧光(红色)的细胞内分布。用dapi(蓝色)来染色细胞核,以及鬼笔环肽-德克萨斯红标记(灰色)用来描述管状分布曲线。通过测量沿着就在细胞核外的细胞质中的轮廓的荧光强度(b;黄线)来显示在一个细胞中强调荧光的分辨率(a;箭头),从而给出沿着在红色和绿色通道中轮廓的强度(c),作为具有8位(256强度水平)/通道的强度分布(d)。比例尺表示10μm。
图11示出实施例2的结果。
图12示出序列seqid1-4。
参考文献:
1.johnjzaknunetal.(2013)thejointiaea,eanm,andsnmmlpracticalguidanceonpeptidereceptorradionuclidetherapy(prrnt)inneuroendocrinetumors.eurjnuclmedmollmaging,800-16.http://www.ncbi.nlm.nih.gov/pubmed/23389427
2.krenningep,bakkerwh,breemanwa,etal(1989)localisationofendocrine-relatedtumorswithradioiodinatedanalogueofsomatostatin.lancet333.242-244.
3.dejongm,krenningep.(2002)newadvancesinpeptidereceptorradionuclidetherapy.jnuclmed43,617-20
4.halliwellb,gutteridgejm.(1994)thedefinitionandmeasurementofantioxidantsinbiologicalsystems.freeradbiolmed16,135-137
5.prisekm,folkardm,michaelbd.(2003)areviewofthebystandereffectanditsimplicationsforlow-doseexposure.radiatprotdosimetry104(4):347-55.
6.mothersillc,seymourc.(2001)radiation-inducedbystandereffects:pasthistoryandfuturedirections.radiatres155(6):759-67.
7.littlejb,azzamei,detoledosm,nagasawah.(2002)bystandereffects:intercel-lulartransmissionofradiationdamagesignals.radiatprotdosimetry99(1-4):159-62.
8.azzamel,detoledosm,littlejb.(2003)oxidativemetabolism,gapjunctionsandtheionizingradiation-inducedbystandereffect.oncogene22(45):7050-7.
9.lyngfm,seymourcb,mothersillc.(2000)productionofasignalbyirradiatedcellswhichleadstoaresponseinunirradiatedcellscharacteristicofinitiationofapoptosis.brjcancer83(9):1223-30.
10.lyngfm,seymourcb,motherslilc.(2002)initiationofapoptosisincellsexposedtomediumfromtheprogenyofirradiatedcells:apossiblemechanlsmforbystander-inducedgenomicinstability?radiatres157(4):365-70.
11.allhornm,
12.allhomm,klapytaa,
13.
14.olssonmg,allhornm,bülowl,hanssonsr,leyd,olssonml,schmidtchena,
15.
16.olssonmg,olofssont,tapperh,
17.mayk,
18.olssonmg,allhornm,larssonj,cederlundm,lundqvist,k,schmidtchena,
19.olssonmg.
20.
21.sverrisonk,axelssonj,rippea,gramm,
22.olssonmg,nilssonejc,rutardottirs,paczesnyj,pallonj,
23.rutardottirs,nilssonejc,pallonj,gramm,
24.larsson,j.,
25.kwaseka,osmarkp,allhornm,lindqvista,
26.greenwoodfc,hunterwm,gloverjs(1963)thepreparationofi-131-labelledhumangrowthhormoneofhighspecificradioactivity.biochemj89:114-123.
27.laemmliuk:cleavageofstructuralproteinsduringtheassemblyoftheheadofbacteriophaget4,nature1970,227:680-685
28.westerl,johanssonmu,
29.stroberw,waldmannta:theroleofthekidneysinthemetabolismofplasmapro-teins.nephron1974,13:35-66
30.nordbergj,allhornm,winqvistl,
31.
具体实施方式
实施例1
实验
材料与方法
重组人a1m
在大肠杆菌中表达重组人a1m,纯化并再折叠,如由kwasek等所描述的[25],但具有另外的离子交换层析步骤。这是通过对用20mmtris-hcl,ph8.0加以平衡的deae-sephadexa-50(gehealthcare,uppsala,sweden)的柱施加a1m来进行。在1ml/分钟的流率下,用线性盐梯度(从20mmtris-hcl,ph8.0,至20mmtris-hcl,0.2mnacl)来洗脱a1m。合并并浓缩含有a1m的馏分(根据在280nm处的吸光率)。
a1m的125i-标记
利用氯胺t方法[26]来用125i来放射性标记a1m。简要地,在0.5m磷酸钠,ph7.5中,分别以1mg/ml和10mci/ml的最终浓度,混合a1m和125i(perkin-elmer,nez033005mc)。将氯胺t加入0.4mg/ml并允许在冰上反应2分钟,然后通过添加nahso3至0.8mg/ml来停止反应。通过凝胶色谱法,用sephadexg-25柱(pd10,gehealthcare,buckinghamshire,uk),从游离碘化物分离蛋白结合碘。获得约50-200kbq/μg蛋白质的比活性。
奥曲肽
生长抑素类似物肽奥曲肽购买自mallinckrodtpharmaceuticals(http://www.mallinckrodt.com/)以及根据商家的指示标记有111in和alexa647(hilytefluor647;anaspec,seraing,belgium)。这些化合物分别被称为111in-奥曲肽和奥曲肽-647。
动物研究
遵照对实验室动物保护的国家立法和动物研究伦理委员会的批准(lunduniversity,sweden),进行所有动物实验。使用6-8周龄的雄性和雌性nmri正常小鼠(taconic,ry,denmark)。
生物分布
进行生物分布研究以确定125i-a1m和111in-奥曲肽的药物动力学和生物分布。通过尾静脉注射,将125i-a1m(100kbq,1μg)和111in-奥曲肽(100kbq,10μg)静脉给予nmri小鼠(n=3/注射分子和时间点)。注射后10、20、40、60分钟(a1m和奥曲肽),4和24小时(奥曲肽),终止动物,并取样血液和器官,然后称重和测量(用nai(ti)孔计数器(wallacwizard1480wizard,perkinelmer))。器官特异性摄取值计算为百分比注射活性/克组织(%ia/g)或百分比注射活性(%ia)。
数字放射自显影
利用biomolex700成像系统(biomolexas,norway)来进行数字放射自显影。对两组(n=2)正常小鼠静脉注射125i-a1m(0.5mbq,5μg)和111in-奥曲肽(0.5mbq,50μg)。利用干冰来冰冻在包埋介质中的肾脏并用恒冷切片机(leicamicrosystemsab,sweden)切片成50μm厚切片,然后用biomolex系统加以成像。利用内部软件来重建图像。
蛋白质印迹
对来自已静脉注射有非标记a1m(100μl/动物,1.5mg/ml)的动物的肾脏和血清进行sds-page分析。在注射后10、20和60分钟时终止动物,取样血液和肾脏,然后洗涤肾脏并放置在1mlpbs中。在机械组织均化以后,在10,000xg下离心组织10分钟,然后将上清转移到新管并用于进一步分析(如下所述)。通过在1,000xg下离心10分钟,从血液样品获得血清。在还原条件下运行sds-page凝胶,并利用转印迹turbo传送系统(bio-rad,delaware,usa)将分离的蛋白质转移到聚偏二氟乙烯(pvdf)膜(immobilon-p,millipore,bedford,ma,usa)。随后阻断pvdf膜并用兔多克隆抗a1m抗血清的igg部分(k322,5μg/ml)来温育过夜,如前所述[28],接着用alexafluor647山羊抗兔igg(稀释3000x;分子探针)加以温育。利用chemidocmp成像系统(biorad)来显影膜。
spect成像
在nanospect/ct(bioscan,washingtondc,usa)的成像期间,用2%至3%异氟醚气体(baxter;deerfield,il,usa)来麻醉动物。用大约5mbq的125i-a1m(大约30μg)和5mbq的111in-奥曲肽来静脉注射动物并腹腔注射20m借助于nsp-106多针孔小鼠准直仪来成像。对于125i成像,20%的能量窗口集中于35kev光峰以及对于111in,则集中于175和241光峰。利用hispect软件(scivis;goettingen,germany)来重建spect数据。在每个全身spect以前进行ct成像。在1小时时的spect成像以后,切除肾脏并包埋在
肾脏-样品制备和a1m的免疫标记
在同时静脉注射150μga1m(未结合的)和100μgalexa647标记的奥曲肽(奥曲肽-647)的10、20、40、60分钟和4小时以后,处死动物。评估所有时间点,但仅包括从20分钟至4小时的肾脏,其显示在细胞水平上的详细分析,包括激光共焦扫描显微术和定量图像分析。重要地,对野生型和裸鼠,进行所有实验并评估,显示出具有相同的标记模式。然而,仅包括野生型数据。
在安乐死以后,直接除去肾脏,并冰冻和包埋在tissuetec中。在恒冷切片机(microm,hm500om,walldorf,gmbh)中切片组织块,以及用superfrost加载玻片(merck,darmstadt,germany)来收集切片(10μm)。进行连续切片,收集3-4个切片/载玻片,其中相邻载玻片用于色素原免疫组化分析(ihc)或免疫荧光(if)标记。将切片后固定在4%多聚甲醛(pfa,sigma,st.louis,mo,usa,溶解于pbs,0.1m,ph7.4)中15分钟,然后在pbs中冲洗两次,时间为5分钟。
对于a1m的单标记,用0.03%过氧化氢(h2o2,merck,darmstadt,germany)来温育切片5分钟,用于色素原可视化(ihc)。对于色素原和荧光可视化,用1%牛血清白蛋白(bsa,sigma,st.louis,mo,usa;稀释在pbs中)来温育切片30分钟。然后,在4℃下,用兔抗人a1m(k:323,igg),稀释1:7500(在pbs中,其含有1%bsa、0.02%tritonx-100(sigma,st.louis,mo,usa),来温育切片16小时。
对于a1m的色素原可视化,在室温下,用与辣根过氧化物酶结合的山羊抗兔igg(hrp,dakoglostrup,denmark)来温育切片20分钟。在室温下,通过在含有0.03%h2o2的二氨基联苯胺(dab)溶液中温育10分钟来进行免疫反应。在pbs中冲洗(2x10分钟)切片,并用苏木素(mayers,hematoxylinmayershtxhistolabproductsab,gothenburg,sweden)加以复染色,接着在梯度酒精系列中脱水以及浸没在100%二甲苯中。在pertex(histolabproductsab,gothenburg,sweden)中封固和盖玻片切片。
对于a1m的if标记,其用于奥曲肽-647的同时检测,用初级抗体来温育切片,如上所述用于色素原检测,接着结合alexafluor488的次级山羊抗兔igg(af488,invitrogen,分子探针,usa),其1:150稀释在含有1%bsa的pbs中。在室温下进行温育45分钟,接着在室温下在4',6-二脒基-2-苯基吲哚(dapi,核标记,invitrogen,分子探针,usa)中温育15分钟。在室温下,还用结合德克萨斯红(结合于f肌动蛋白)的鬼笔环肽来温育切片的子集1小时以形态上描述管状结构。在pbs中冲洗切片,然后抗褪色溶液(prolonggold,invitrogen,分子探针,usa)中封固和盖玻片。
在肾切片中a1m和奥曲肽-647的光学检测
可视化色素原单标记的a1m并以明场显微镜(leicadmre)加以数字记录。用leica数码相机(dfc500)来收集数字图像。校正用于说明的图像的色平衡、亮度和反差。
为了在组织和细胞水平上if标记的a1m(a1m-af488)和奥曲肽-647的同时可视化,使用了zeiss共焦激光扫描显微镜(clsm,lsm510meta,dept.biology,lunduniversity)。通过来自alexafluor488(a1m)、hilytefluor647(奥曲肽)、德克萨斯红(f肌动蛋白)和dapi(细胞核)的发射的扫描来检查切片。
通过皮质、髓质和集合管的区域来收集数字图像数据,一个或多个光学部分(z-堆叠)。图像文件用于计算a1m-af488和奥曲肽-647荧光的单独存在和共存。为了文档化,选择来自每个切片的3个肾脏区域作为代表性区域(通过采集软件zen2009所标记和存储的x/y阶段位置)。用20x/0.8planapochromat物镜(提供1.8μm厚光学部分,其具有约400nmx/y光学分辨率)、以及用63x/1.4油浸没planapochromat物镜(提供0.9μm厚光学部分,其具有约250nmx/y光学分辨率)来进行扫描(以1024x1024帧尺寸)。光学部分和扫描深度的选择确定自在扫描场中大多数核(dapi标记)的中心位置。对显示af488、hilytefluor647、dapi和德克萨斯红荧光的通道进行顺序扫描。对于每个通道,选择具有最高荧光强度的肾脏剖面作为参比,从其优化采集设置(激光功率、pmt检测器增益、数字偏移)并用于所有扫描区域。本文提供的图像说明选自个别光学部分,其含有用于定量测量的区域/结构。
在肾切片中奥曲肽-647和a1m的定量图像分析
奥曲肽-647荧光和a1m-af488if的clsm图像用于定量分析。探讨了在肾结构(来自皮质、髓质和集合管)中以及在管状上皮细胞内的详细分布。分析了三(3)个区域/clsm图像以及10至20个之间的图像/动物。借助于imagej软件(版本1.49g,rasband,w.s.imagej,nih,usa),开发了分析协议以用作宏脚本。简要地,clsm图像的显示是借助于”叠加图像”,其呈现所有合并在一起的通道(用于af488、hl647、dapi和德克萨斯红)的复合图像。样品区的选择是依据管状结构的形态来进行并且由核和/或鬼笔环肽标记来描述。利用套索函数来划定用于测量的个别区域。然后绿色(a1m-af488)和红色(奥曲肽-647)通道用作输入图像,以及利用”共定位”插件程序,探讨了单独的绿色或红色像素或它们的共定位的比率。利用origin9.0软件(microcal,northampton,ma,usa)来进行统计分析。在图5中的直方图显示在每个时间点获自3个肾脏的代表性数据并且被绘制为平均值±sem。
结果
生物分布
图1示出在注射后10、20、40和60分钟时111in-奥曲肽的体内生物分布,在注射后10、20、40和60分钟以及注射后4和24小时时125i-a1m的离体生物分布。还图示了随着时间的推移在肾脏中两种分子的比较摄取(%ia/g)。对于111in-奥曲肽和125i-a1m,观察到在肾脏中的高摄取,其中峰值分别在注射后的10和20分钟。通过sds-page和蛋白质印迹,探讨了在血液血清和溶解肾脏中注射的非标记的a1m的尺寸分布。如图2所示,a1m,作为均匀带,迁移,其中在肾脏和血清中表观分子量总是约25kda,以及次要的弱带为50kda。强带最可能表示理论分子量为22.6kda的单体a1m以及后者则表示二聚体形式。在10分钟时看到最高量,其支持在图1下图片中示出的125i-标记的a1m的动力学。这些结果表明,在血液和肾脏中发现的a1m是完整的、全长,因此降解是微不足道的。
spect/ct图像分析
对111in-奥曲肽和125i-a1m进行定性spect/ct分析以及可视化在中肾脏的活性分布。在图6中的spect/ct图像表明在肾脏中两种分子的高摄取。虽然与111in-奥曲肽相比(图6a和b),可以看到在外围肾脏结构中125i-a1m的明显较高浓度(图6c和d),但两种分子似乎共定位在肾皮质中。还可以看到在甲状腺中125i-a1m的轻微摄取。已忽略汇集在膀胱中的111in-奥曲肽的活性,这是因为强信号使它难以表明在肾脏中的分布和摄取。
数字放射自显影
在图7中显示的数字放射自显影结果清楚地说明两种分子在肾皮质中的定位,其反映了spect/ct结果。可以观察到,在注射后20和60分钟,结果是类似的,其表明,在20分钟以后,已完成肽和蛋白质的定位。在这些图像中不能观察到进一步的亚区室化;然而,在皮质中活性分布不是完全同质的。在前两个图像(7a和b)和接着的两个图像(7c和d)之间可以观察到反差和分辨率的明显差异。除它的低能量转换电子(30.6kev)之外,125i还在27.5和27.2kev下发射低能x射线光子。这些光子贡献于在图像中的噪声以及与转换电子的能量上的接近使得它们难以从最终图像中排除。
荧光显微术
a1m免疫反应性主要分布在皮质中,并在髓质和集合管中具有降低的免疫反应性。此外,a1m免疫反应性标记的强度在皮质中最高,在髓质中较弱以及在集合管中最弱。在图8和9(左图片)中示出在肾脏20分钟腹腔注射的所选区域中a1m免疫反应性的分布。强标记存在于管状结构的子集中,其被在形态上加以描述以连累近端小管和肾小球的子集。a1m和奥曲肽-a647的荧光双标记表明它们的管状共存,以及高度的细胞共定位(图5、9和10)。在髓质和皮质中,20分钟腹腔注射,存在两种分子的强标记,其包括高度的管状共存和细胞共定位(还见图10)。在4小时腹腔注射,存在两种分子的荧光检测的显着下降,其在皮质和髓质中是非常低的以及在集合管中不存在(图9)。依据20分钟和4小时腹腔注射的clsm图像,进行两种分子的管状定位的定量分析,并且显示20分钟腹腔注射相应程度的共定位(图5)。当在细胞水平上研究在管状结构中的共定位时,如在图5中可视化和量化的,在皮质中看到类似结果。通过在指定轮廓(图5)中个别像素的强度的比较,来表明a1m和奥曲肽-a647的细胞内共定位。
实施例2
借助于在prrt中的a1m,肾脏的短期辐射保护
除非下文另有说明,在实施例1下提到的材料与方法还用于实施例2。
目的:8天177lu-奥曲肽prrt肾脏损伤小鼠模型的初步测试,包括用a1m加以治疗
放射性核素活性:150mbq177lu-dotatate(177lu-dota0,tyr3]奥曲肽酸)
辐射保护和安全:150mbq177lu-dotatate在1cm的距离处产生7msv/h。
a1m剂量:7mg/kg(在载体2中:10mmtris-hcl,ph8.0+0.125mnacl)
a1m治疗时间点:t=0和t=+60分钟。nb,在t=0时,分开注射177lu-dotatate和a1m。
分析方法:
1.血液
2.尿
3.在肾脏中的基因表达
4.组织化学一般组织损伤
5.免疫组化分析
凋亡tunel,半胱氨酸天冬氨酸蛋白水解酶
γh2ax双链断裂
6.放射自显影
7.器官活性测量
协议:
取决于可用性(lu-177-oct(奥曲肽)),将优先考虑组,具体如下:1天、8天、4天。
样品处理:
1.血液:
在管中的样品血液,依据使用说明书进行离心并将血浆/血清转移到新管,在-80℃下冷冻。
2.尿:
在-80℃下立即冷冻。
3.肾脏:
a.将一个肾脏pcr-解剖成2片。放入2个不同的管(一个用于mrna以及一个用于蛋白质提取)并放置在干冰上。
b.显微术和放射自显影
·在哥本哈根成像的一些肾脏
·在液氮中立即干燥并冷冻肾脏
4.器官活性:
根据和以前的研究相同的协议,一个肾脏用于活性分析。还见下点6。
5.spect分析:
在第8天对第4组(至少3只动物)进行
6.另外的器官:
如果可能的话,还处理肝脏、脾、心脏、肠、原肠、脑、胰腺、肺和皮肤(放置在干冰上)并根据以前的协议来分析活性。后来的器官用于蛋白质分析。
结果
在第一实验中,对balb/c(nu/nu)鼠注射150mbq177lu-奥曲肽(dotatate)、150mbq177lu-奥曲肽(dotatate)+150μga1m、或仅缓冲液(对照)。留下小鼠1天或8天,然后处死,并采样血浆和尿,如上所述。因而,收集了6组(n=4)样品:
作为肾脏功能的初步估计,测量在血浆中的肌酸酐,以及测量在尿样品中的白蛋白(图11)。血浆肌酸酐是肾小球滤过率(gfr)的标志物,以及结果表明,在1和8天以后,dotatate注射导致显着增加的肌酸酐水平,即降低的gfr。a1m的同时输注使gfr恢复到对照水平,以及在8天以后效果是非常显著的(p<0.01)。为了估计蛋白尿,在1和8天以后,通过dotatate注射,会显着升高在尿中的白蛋白浓度,以及在1天以后是更显着的。在1天以后,同时a1m治疗导致显著减少的蛋白尿,但在8天以后则不是如此。
总结来说,177lu-奥曲肽注射导致受损的肾脏功能(减少的肾小球滤过和蛋白尿),其可以借助于与a1m一起的共治疗加以治疗。
序列表
<110>布·阿克斯特罗姆
斯特凡·汉松
<120>用于在放射性核素治疗中保护肾脏的α-1-微球蛋白
<130>p015472pct1
<160>4
<170>siposequencelisting1.0
<210>1
<211>183
<212>prt
<213>智人(homosapiens)
<400>1
glyprovalprothrproproaspasnileglnvalglngluasnphe
151015
asnileserargiletyrglylystrptyrasnleualaileglyser
202530
thrcysprotrpleulyslysilemetaspargmetthrvalserthr
354045
leuvalleuglygluglyalathrglualagluilesermetthrser
505560
thrargtrparglysglyvalcysglugluthrserglyalatyrglu
65707580
lysthraspthraspglylyspheleutyrhislysserlystrpasn
859095
ilethrmetglusertyrvalvalhisthrasntyraspglutyrala
100105110
ilepheleuthrlyslyspheserarghishisglyprothrilethr
115120125
alalysleutyrglyargalaproglnleuarggluthrleuleugln
130135140
asppheargvalvalalaglnglyvalglyileprogluaspserile
145150155160
phethrmetalaaspargglyglucysvalproglygluglnglupro
165170175
gluproileleuileproarg
180
<210>2
<211>201
<212>prt
<213>智人(homosapiens)
<400>2
methishishishishishishishisglyglyglyglyglyileglu
151015
glyargglyprovalprothrproproaspasnileglnvalglnglu
202530
asnpheasnileserargiletyrglylystrptyrasnleualaile
354045
glyserthrcysprotrpleulyslysilemetaspargmetthrval
505560
serthrleuvalleuglygluglyalathrglualagluilesermet
65707580
thrserthrargtrparglysglyvalcysglugluthrserglyala
859095
tyrglulysthraspthraspglylyspheleutyrhislysserlys
100105110
trpasnilethrmetglusertyrvalvalhisthrasntyraspglu
115120125
tyralailepheleuthrlyslyspheserarghishisglyprothr
130135140
ilethralalysleutyrglyargalaproglnleuarggluthrleu
145150155160
leuglnasppheargvalvalalaglnglyvalglyileprogluasp
165170175
serilephethrmetalaaspargglyglucysvalproglyglugln
180185190
gluprogluproileleuileproarg
195200
<210>3
<211>549
<212>dna
<213>智人(homosapiens)
<400>3
ggccctgtgccaacgccgcccgacaacatccaagtgcaggaaaacttcaatatctctcgg60
atctatgggaagtggtacaacctggccatcggttccacctgcccctggctgaagaagatc120
atggacaggatgacagtgagcacgctggtgctgggagagggcgctacagaggcggagatc180
agcatgaccagcactcgttggcggaaaggtgtctgtgaggagacgtctggagcttatgag240
aaaacagatactgatgggaggtttctctatcacaaatccaaatggaacataaccatggag300
tcctatgtggtccacaccacctatgatgagtatgccatttttctgaccaagaaattcagc360
cgccatcatggacccaccattactgccaagctctacgggcgggcgccgcagctgagggaa420
actctcctgcaggacttcagagtggttgcccagggtgtgggcatccctgaggactccatc480
ttcaccatggctgaccgaggtgaatgtgtccctggggagcaggaaccagagcccatctta540
atcccgaga549
<210>4
<211>603
<212>dna
<213>智人(homosapiens)
<400>4
atgcatcaccatcaccatcaccatcacggtggaggagggggtatcgagggccgcggccct60
gtgccaacgccgcccgacaacatccaagtgcaggaaaacttcaatatctctcggatctat120
gggaagtggtacaacctggccatcggttccacctgcccctggctgaagaagatcatggac180
aggatgacagtgagcacgctggtgctgggagagggcgctacagaggcggagatcagcatg240
accagcactcgttggcggaaaggtgtctgtgaggagacgtctggagcttatgagaaaaca300
gatactgatgggaggtttctctatcacaaatccaaatggaacataaccatggagtcctat360
gtggtccacaccacctatgatgagtatgccatttttctgaccaagaaattcagccgccat420
catggacccaccattactgccaagctctacgggcgggcgccgcagctgagggaaactctc480
ctgcaggacttcagagtggttgcccagggtgtgggcatccctgaggactccatcttcacc540
atggctgaccgaggtgaatgtgtccctggggagcaggaaccagagcccatcttaatcccg600
aga603
- 还没有人留言评论。精彩留言会获得点赞!