用于治疗炎性肠病和异位性皮炎的组合物的制作方法
本发明涉及用于抑制胸腺基质淋巴细胞生成素(TSLP)从肥大细胞分泌的化合物,及其用于治疗炎性肠病和异位性皮炎的用途。
背景技术:
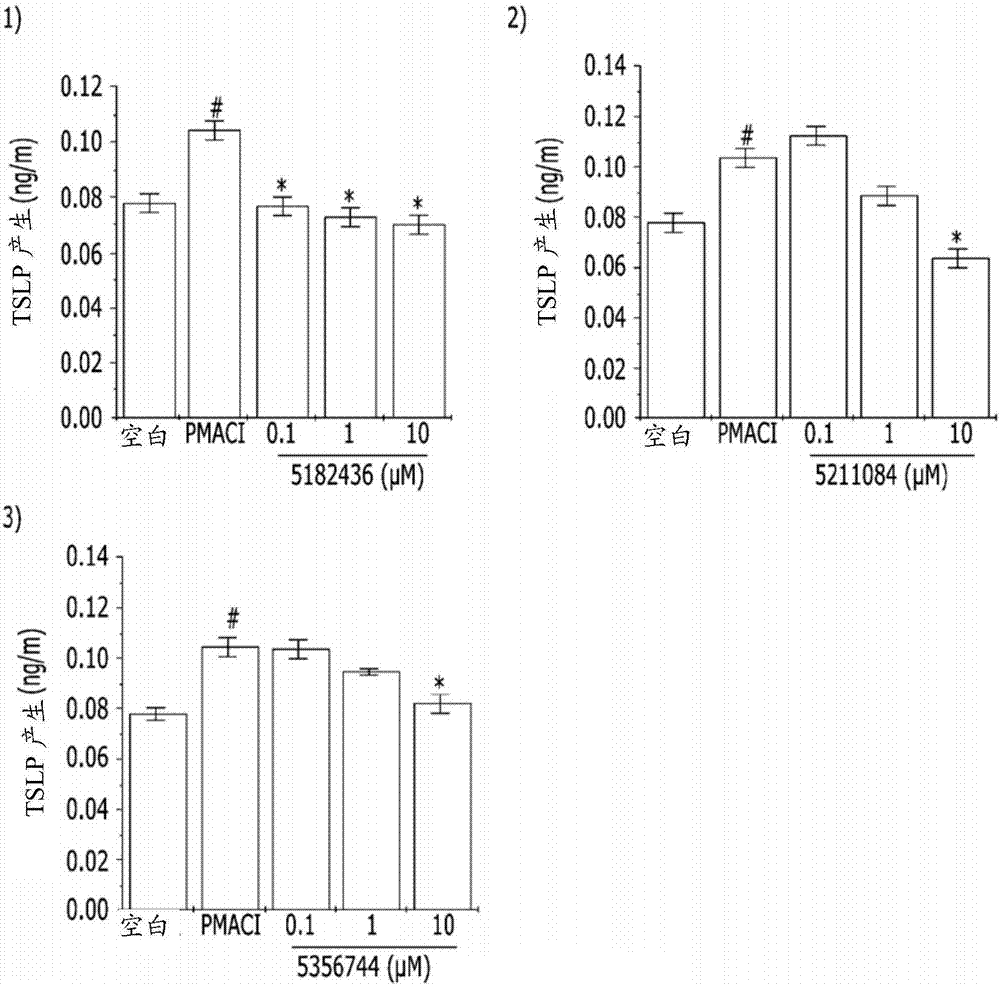
:变态反应(allergy)是与外源性物质接触的活体对该物质表现出不同于正常反应的反应的现象。当有机体与外源性物质接触时,抗原-抗体反应引起机体对其反应能力的突然变化,这称作变态反应。对于异源性物质,活生物体产生与抗原特异性反应的抗体和淋巴细胞,并且当活生物体在与抗原再次接触时,其引起各种免疫应答。所述免疫应答或免疫反应是活体自我保护的重要防御机制之一,并且通常对活体起保护作用,但是有时所述机制对活体起不利的作用,因此引起障碍。变态反应意指“过敏的”,其源自希腊单词异常(allos),该单词意指“改变的”。1906年,术语“变态反应”由法国学者vonPirque首次使用。变态反应在英语中的发音为al-ler-gi或el-ler-gi,并且在德语中的发音为al-le-r-gie,并且两种发音在韩国可互换使用。引起过敏反应的抗原称作变应原,并且代表性的变应原包括花粉、药物、植物纤维、细菌、食物、染料、化学品等。免疫系统具有几种防御机制,以保护机体对抗抗原。所述机制的最常见类型是淋巴细胞,其对特异性抗原的反应是特异的,并包括B细胞和T细胞。B细胞结合至抗原,以产生抗体,抗体是破坏和中和抗原的蛋白质。T细胞直接结合至抗原,以由此激发攻击,而不是产生抗体。过敏反应发生为速发型变态反应或延迟型变态反应,并依据抗原与B细胞和T细胞中的那一个反应而确定。对于变态反应引起的疾病,存在各种疾病,包括自身免疫疾病、胶原病等,并且变应性疾病通常包括经典变应性疾病例如过敏性休克、食物过敏、变应性鼻炎、花粉病、支气管哮喘、药物过敏、植物过敏、荨麻疹、湿疹和变应性接触性皮炎。存在变态反应引起的疾病,但是还存在变态反应发作需要其他体内条件的病例。此外,非-变应性机制可引起相同的症状。异位性皮炎是慢性、高复发的炎性皮肤病,其主要发生于婴儿期或儿童期,并伴随瘙痒症(瘙痒)、皮肤干燥和特征性湿疹。在婴儿期,其开始于面部和四肢展开部分的湿疹,但是随着婴儿生长,特征性地在手臂的弯曲部分和膝盖后侧的弯曲部分出现湿疹。在一些情况下,随着孩子长大,异位性皮炎趋向于自然缓解。在成年人中,苔藓样硬化出现,所述苔藓样硬化是折叠的皮肤部分增厚的情况,并且许多成年病例在面部出现不同于儿童时代的湿疹。在全球,异位性皮炎预期增加,并且流行率已报道为人口的20%。尽管对过敏患者的先进过敏治疗和优秀过敏治疗剂销售的日趋增加,人们的变态反应症状已变得严重,并且过敏患者的数目迅速增加。这些可归因于有限的现有治疗剂,包括通过各种其它途径的变态反应疾病的扩增、暂时改善作用等。现有的异位性皮炎的治疗剂缓解瘙痒并恢复受损皮肤表面,并且大部分是公认具有副作用的免疫抑制剂或甾体物质。因此,在特应性治疗中,需要开发能通过解决特应性的根本原因,治疗由于免疫超敏性的特应性的治疗剂,不同于先前已报道具有副作用的免疫抑制剂或甾体物质。同时,炎性肠病(IBD)分为两种疾病:溃疡性结肠炎和克罗恩氏病,它们临床上类似,但是在组织学、内窥镜和免疫学方面互不相同,并且已知炎性细胞的激活是IBD的重要病因学。肠内免疫系统持续或不适当的激活在慢性粘膜炎症的病理生理学方面起重要作用,并且特别是中性白细胞、巨噬细胞、淋巴细胞和肥大细胞的渗透最终引起粘膜破坏和溃疡形成。渗入并活化的中性白细胞致使活性氧种类(species)和活性氮种类产生,并且所述活性种类是细胞毒物质,其通过交联蛋白、脂质和核酸,引起细胞的氧化应激,并引起上皮功能障碍和损害。当炎性疾病产生时,各种炎症性细胞因子分泌于肠道的黏膜内。在患溃疡性结肠炎的患者的结肠腔和结肠上皮细胞中,TNF-α是高表达的。根据最近的研究,已经已知的是TNF-α在溃疡性结肠炎的发病机制中起重要作用。已经已知为抗TNF-α抗体的英利昔单抗(Infliximab)不仅在疮的治疗中有效,而且在先前未治疗的克罗恩氏病治疗中有效。然而,所述治疗是昂贵的,并且在一些患者中,所述治疗引起副作用例如流体响应或感染性并发症。目前,将基于阻断前列腺素类产生的5-氨基水杨酸(5-ASA)例如柳氮磺胺吡啶(sulfasalazine)等的药物或者免疫抑制剂例如甾体类用作炎性肠病的治疗剂。柳氮磺胺吡啶易于引起副作用或有害作用例如腹部饱胀、头痛、疹、肝病、白血球减少症、粒细胞缺乏症、男性不育等。此外,不清楚的是在患部肠切除的患者中或者显示改善的患者中,柳氮磺胺吡啶是否具有抑制复发的充足作用。甾体免疫抑制剂是肾上腺皮质类固醇,其可显示短期作用,但是不能改善长期预后,并且由于副作用例如诱导感染性疾病、继发性肾上腺皮质功能不全、消化性溃疡、糖尿病、精神障碍和甾体性肾疾病,具有仅用于急性病例的局限性。因此,还不存在炎性肠病的可靠疗法,并由此,需要开发其有效治疗剂。【现有技术参考文献】韩国专利公开号1020100058104。【公开内容】【技术问题】根据上述问题,完成本发明,并且本发明的目的是提供治疗变应性异位性皮炎的新候选物质。本发明的另一个目的是提供治疗炎性肠病的新候选物质。【技术方案】为了实现上述目的,本发明提供选自下式1~4所示的化合物的一种化合物或其药学上可接受的盐。在本发明的一实施方案中,所述化合物可以抑制胸腺基质淋巴细胞生成素(TSLP)从肥大细胞中分泌,但不限于此。在本发明的另一实施方案中,所述化合物可在治疗异位性皮炎方面是有效的,但是本发明不限于此。在本发明的另一实施方案中,所述化合物可在治疗炎性肠病方面是有效的,但是本发明不限于此。本发明的药学上可接受的盐包括衍生自以下物质的盐:无机碱例如锂(Li)、钠(Na)、钾(K)、钙(Ca)、镁(Mg)、铁(Fe)、铜(Cu)、锌(Zn)和锰(Mn);衍生自有机碱例如N,N'-二乙酰基乙二胺、葡糖胺、三乙胺、氯、氢氧化物、二环己胺、二甲双胍、苄胺、三烷基胺、硫胺素及其等价物;手性碱例如烷基苯胺、甘氨醇、苯基甘氨醇及其等价物;天然氨基酸盐例如甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、正亮氨酸、酪氨酸、胱氨酸、半胱氨酸、甲硫氨酸、脯氨酸、羟基脯氨酸、组氨酸、鸟氨酸、赖氨酸、精氨酸、丝氨酸及其等价物;含有烷基硫酸酯例如卤代烷、MeI和(Me)2SO4及其等价物的本发明化合物的季铵盐;人造氨基酸例如D-异构体、取代的氨基酸等;胍、鸟嘌呤,其被选自下述基团的基团取代:硝基、氨基、烷基、烯基和炔基,铵或取代的铵盐和铝盐。盐可包括酸加成盐,并且适当的盐的示例包括硫酸盐、硝酸盐、磷酸盐、高氯酸盐、硼酸盐、氢卤酸盐、乙酸盐、酒石酸盐、马来酸盐(maliates)、柠檬酸盐、富马酸盐、琥珀酸盐、棕榈酸盐、甲磺酸盐、苯甲酸盐、水杨酸盐、苯磺酸盐、抗坏血酸盐、甘油磷酸盐、酮戊二酸盐及其等价物。药学上可接受的溶剂化合物包括结晶溶剂例如氢氧化物类或醇。本发明还提供预防和治疗异位性皮炎的药物组合物,其包含本发明化合物作为活性成分。本发明还提供预防和治疗变态反应的药物组合物,其包含本发明化合物作为活性成分。本发明还提供治疗炎性肠病的药物组合物,其包含本发明化合物作为活性成分。可将本发明的单个单位剂型经口服、粘膜内(例如经鼻、舌下、阴道、口服或直肠地)、肠胃外(例如皮下、静脉内、推注、肌内或动脉内地)或透皮施用至患者。剂型的示例包括但不限于片剂;囊片;胶囊剂例如弹性软明胶胶囊剂;扁囊剂;糖锭(troches);锭剂;分散剂;栓剂;软膏剂;湿润剂(巴布剂);糊剂;粉剂;护理剂(dressing);乳膏剂;膏药;溶液剂;贴剂;气雾剂(例如鼻腔喷雾或吸入剂);凝胶剂;混悬剂(例如含水或无水液体混悬剂、水包油液体乳剂或者油包水液体乳剂、溶液剂和适合于口服施用至患者或者经粘膜施用至患者的液体制剂包括酏剂;以及适合于肠胃外施用的液体制剂和可加工成适合于肠胃外施用的液体剂型的无菌固体制剂(例如晶体或非晶状固体)。本发明剂型的组成、形状和类型通常可根据其用途而变化。例如,适合于粘膜施用的剂型可包括比用于治疗相同疾病的适合于口服施用的剂型中更少量的活性成分。本发明的这些方面对本领域技术人员将是非常显而易见的(参考文献:Remington'sPharmaceuticalSciences(1990)第18版,MackPublishing,EastonPA)。典型的药物组合物和剂型包括一种或多种赋形剂。适当的赋形剂对制药领域普通技术人员是显而易见的,并且本发明不限于文中所述的适当赋形剂的示例。具体的赋形剂是否适合于药物组合物或剂型取决于本领域公知的各种因素,包括配制要施用至患者的制剂的方法,但是不限于此。例如,口服施用的剂型诸如片剂可包括不适合用于非口服施用制剂中的赋形剂。特定赋形剂的适合性还可取决于剂型的特定活性成分。例如,某些活性成分的降解可被赋形剂例如蔗糖加速或者通过暴露于含水溶剂而加速。活性成分包括伯胺或仲胺(例如N-去甲基文拉法辛和N,N-二去甲基文拉法辛)是对所述加速降解特别敏感的。本发明还提供药物组合物和剂型,其包括降低活性成分降解速率的一种或多种化合物。这些化合物包括但不限于抗氧化剂例如抗坏血酸、pH缓冲溶液和盐缓冲溶液。类似于赋形剂的量和类型,剂型中活性成分的量和类型可根据因素例如施用至患者的方法而变化,但是本发明不限于此。然而,本发明的典型剂型以大约1mg至大约1,000mg、优选大约50mg至大约500mg、并最优选大约75mg至大约350mg的量包括本发明的化合物或其药学上可接受的盐。对于特定患者,适当剂量或剂型的确定是在本发明所属领域的范围内。本发明还提供用于缓解和减轻异位性皮炎的化妆品组合物,其包含本发明的化合物作为活性成分。本发明还提供用于缓解和减轻变态反应的化妆品组合物,其包括本发明的化合物作为活性成分。本发明的化妆品组合物可制备成各种形式,例如乳剂、洗剂、乳膏剂(水包油型、油包水型、多相)、溶液剂、混悬剂(无水的和含水的)、无水产品(油和二醇)、凝胶剂、面模、护肤霜、粉末等。本发明还提供用于缓解和减轻异位性皮炎的食品组合物,其包含本发明的化合物作为活性成分。本发明还提供用于缓解和减轻变态反应的食品组合物,其包括本发明的化合物作为活性成分。【本发明的作用】正如从本发明上述显而易见的,已发现本发明的化合物显著抑制肥大细胞的TSLP分泌,并因此可用作治疗和预防异位性皮炎和/或变应性皮炎和炎性肠病的候选物质。【附图简述】图1显示胱天蛋白酶-1和ChemBridge数据库化合物的对接结果。图2显示人肥大细胞(HMC-1细胞)中TSLP的量的测量结果。图3显示HMC-1细胞中的细胞毒性测量结果。图4显示经IPS-07001(5182436)的HMC-1细胞中TSLP和mRNA表达的测量结果:1)经IPS-07001的TSLP量的测量和2)经IPS-07001的mRNA表达的测量。图5显示通过IPS-07001(5182436),HMC-1细胞中胱天蛋白酶-1活性的测量结果:1)测量IPS-07001对胱天蛋白酶-1活性的作用和2)通过蛋白质印迹法,经IPS-07001活性的胱天蛋白酶-1表达的变化。图6显示IPS-07001(#5182436)对胱天蛋白酶-1活性抑制作用的测量结果。图7显示HMC-1细胞中炎性细胞因子mRNA表达的测量结果。图8显示患DNCB-诱导的异位性皮炎的balb/c小鼠血清中,表达测量结果。图9显示患DNCB-诱导的异位性皮炎的balb/c小鼠背侧皮肤中胱天蛋白酶-1活性测量结果。图10显示患DNCB-诱导的异位性皮炎的balb/c小鼠背侧皮肤中炎症细胞因子的调控。图11显示患DNCB-诱导的异位性皮炎的balb/c小鼠背侧皮肤中炎症细胞因子的调控:1)RT-PCR电泳结果和2)利用光密度计测量的电泳结果。图12显示图片,该图片表明用IPS-07001和地塞米松治疗(分别0.01μM、0.1μM和1μM),患DNCB-诱导的异位性皮炎的balb/c小鼠的治疗结果。图13显示H&E-染色的背侧皮肤的组织学特征:1)表皮厚度值测量结果和2)对于患DNCB-诱导的异位性皮炎的balb/c小鼠(表皮厚度)(##p<0.01正常对照组vsDNCB;*p<0.01DNCBvs用0.01μM、0.1μM和1μM治疗的;**p<0.01DNCBvs分别用0.01μM、0.1μM和1μM治疗的)。图14显示甲苯胺蓝-染色的背侧皮肤的组织学特征:1)染色皮肤组织的成像和2)患DNCB-诱导的异位性皮炎病患的balb/c小鼠中肥大细胞的量的测量结果(##p<0.01正常对照组vsDNCB;**p<0.01DNCBvs分别用0.01μM、0.1μM和1μM治疗的)。图15显示患DNCB-诱导的异位性皮炎的balb/c小鼠血清中IgE测量结果(##p<0.01正常对照组vsDNCB;**p<0.01DNCBvs分别用0.01μM、0.1μM和1μM治疗的)。图16显示细胞因子&趋化因子抗体蛋白质微阵列分析,其中在1)中,对照指仅用1%DNCB处理的皮肤组织样品,ISP-07001指用1%DNCB和1μMIPS-07001处理的皮肤组织样品,并且在INR荧光成像中,红色意指表达增加,绿色意指表达降低,并且黑色意指表达方面无差异;和2)1.1或更高的INR值表示表达增加,并且0.9或更小的INR值表示表达降低。图17显示患DNCB-诱导的异位性皮炎的balb/c小鼠背侧皮肤中,细胞因子蛋白质表达的变化:1)蛋白质印迹法成像和2)显示带的强度的测量结果的图形。图18显示在DSS-诱导的动物模型中,IPS-07001(式1)对急性炎性肠病(IBD)的抑制作用。图19显示在DSS-诱导的动物模型中,IPS-07001(式1)对慢性IBD的抑制作用。图20显示在DSS-诱导的动物模型中,IPS-07001(式1)对腹泻评分的作用。图21显示在DSS-诱导的动物模型中,IPS-07001(式1)对脾脏重量的抑制作用。图22显示IPS-07004(式4)对HaCat细胞增殖的作用。图23显示IPS-07001(式1)和IPS-07004(式4)对人重组胱天蛋白酶-1活性的抑制作用。图24显示在HMC-1细胞中,IPS-07004(式4)对人胱天蛋白酶-1活性的作用。图25显示在DSS-诱导的动物模型中,IPS-07004(式4)对急性IBD的抑制作用。图26显示在DSS-诱导的动物模型中,IPS-07004(式4)对体重变化的抑制作用。图27显示在DSS-诱导的动物模型中,IPS-07004(式4)对出血评分的抑制作用。图28显示在DSS-诱导的动物模型中,IPS-07004(式4)对腹泻评分的抑制作用。【实施例】下文中,将参照下述非限制性实施例,进一步详细描述本发明。然而,提供所述实施例,仅用于解释性目的,并且不是旨在限制本发明的范围。实施例1:治疗候选物质的发现利用CADD技术,基于结构的电脑虚拟筛选A.实验方法:为了在胱天蛋白酶-1靶蛋白上完成电脑虚拟筛选,进行计算机辅助的分子对接模拟。(1)蛋白质准备:将蛋白质数据库(PDB)胱天蛋白酶-1结构(PDBid2HBQ)用作靶蛋白的起始结构,并且将建模软件用于补充缺失的氢原子,并除去非结晶的水分子,由此完成靶蛋白的分子模型。将完成的蛋白质模型利用能量最小化稳定,然后用于模拟。(2)配体准备:利用Ligprep模块,在化合物库中将ChemBridge的636,565个化合物进行脱盐和离子化。(3)受体网格形成:将对接位点限于3-[2-(2-苄氧基羰基氨基-3-甲基-丁酰基氨基)-丙酰基氨基]-4-氧代-戊酸(z-VAD-FMK)连接位点附近的30个框。用于计算的软件是从Schrodinger获得的Glide程序。Glide函数作为评分函数,并且得到用于最终结果的Glide评分。(4)配体对接:对于每个配体化合物,计算最多10个对接姿势,以分数降低顺序,得到结果,并获得输出文件。用Glide-SP模型完成结构搜索,以最高至最低的最终评分(其被校正为对接计算的结果)顺序,获得化合物的结果。实施例2:用变应性异位性皮炎体外模型,研究活性成分对特应性-相关因子调控的效果基于细胞的候选物质的变态反应抑制活性体外分析A.试验方法(1)细胞培养:在补充10%FBS的IMDM中,于37℃和5%CO2下,培养人肥大细胞系(HMC-1)。将候选物质溶解于DMSO中,然后利用0.22μm过滤器过滤。将得到的候选物质用DMSO稀释,并随后用其处理HMC-1细胞。(2)细胞毒性(MTT-测试):将肥大细胞(3x105细胞/ml)稳定1小时,然后用10μM候选物质处理,随后用PMA和A23187(PMACI)处理,然后培养8小时。培养后,将培养基替换为新鲜培养基,然后向其中加入5mg/mlMTT溶液,并将肥大细胞在37℃下培养4小时。向肥大细胞中,加入250DMSO,从其中提取MTT甲臜,并利用ELISA酶标仪,在540nm下,测量每个孔的吸收度。(3)酶联免疫吸附测定(ELISA):将肥大细胞(3x106细胞/ml)稳定1小时,然后用0.1μM、1μM和10μM候选物质处理,随后用PMACI处理8小时。将肥大细胞离心,以得到上清液。利用ELISA测量细胞分泌的TSLP的量。在涂有1μg/孔的TSLP捕获Ab的96-孔板中,完成ELISA。将涂敷的板子用PBS冲洗两次。将细胞用含有10%FBS的PBS处理2小时。随后,将细胞用含有0.05%吐温-20(Sigma)的PBS冲洗,并将重组TSLP用于绘制标准曲线。随后,将板子暴露于生物素化的-TSLP抗体、抗生物素蛋白过氧化物酶和含有30%H2O2的ABTS底物,然后在405nm下测量。(4)胱天蛋白酶-1测试:使重组胱天蛋白酶-1和药物反应,然后利用胱天蛋白酶-1测试试剂盒(R&DSystemsInc.,明尼阿波利斯,MN,USA),完成活性测量。(5)逆转录-聚合酶链反应(RT-PCR)定量实时PCR:从细胞和组织分离全部的RNA,并利用逆转录酶合成cDNA,然后与要分析的细胞因子引物反应,随后进行PCR和实时PCR。将RT-PCR产物进行使用1.5%琼脂凝胶的凝胶电泳,用于分析。(6)蛋白印迹分析:将细胞种于6-孔板中,然后用药物处理,并且一段时间后,收获细胞。收获后,将细胞用PBS冲洗,然后溶解。将50μg组织蛋白和细胞提取蛋白在12%凝胶上进行电泳,转移至硝化纤维纸上,然后用6%牛血清白蛋白阻断2小时。每种蛋白质与初级抗体反应过夜,并用PBS-吐温冲洗。随后,产生的蛋白质与次级抗体反应2小时,冲洗,然后利用ECL溶液试剂盒检测。(7)统计分析:通过完成至少三次试验,得到试验结果,并记录其平均值,并利用SPSSver11.5完成分析。比较治疗组间的统计显著性,并通过ANOVA和独立t-检验和Tukey'sposthoctest,进行比较,P<0.05的结果认为是统计显著性的。实施例3:体内试验的构建试验方法A.试验动物:让购自DaehanBiolink(Eumseong,Chungbuk)的5-周龄雄性BALB/c小鼠在Hoseo大学安全评价中心的清洁动物饲养室(小动物室#2-302)适应2周,设定环境条件下:温度22±3℃;相对湿度50±20%;通风频率10~15次/小时;照明12小时;和照度150Lux~300Lux,然后用于试验中。将4试验动物置于各个聚碳酸酯笼子(270×500×200mm,KYERYONGSCIENCE)中。保证自由摄取饲料(5053-PicolabRodent20,PMINutritionInternational)和饮水(紫外灭菌的过滤水)。Hoseo大学安全评价中心伦理委员会(HTRC-15-19)批准后,完成所有的试验操作。B.皮炎诱导:除去每只小鼠背部的毛,并保持24小时,然后将150μl1%2,4-二硝基氯苯(DNCB)溶液(丙酮:橄榄油=3:1)施用至除去毛的位置,一周一次,持续3周。3周后,将DNCB溶液施用在该位置,一周两次,持续3周,以诱导异位性皮炎。C.处理:将小鼠分成6组,并将0.5%DMSO施用在动物上,作为对照,将0.01μM、0.1μM和1μM测试物质各200μl施用在动物上作为实验组,持续3周。将溶解于粗酒精的50μl0.1%地塞米松每隔2天施用在动物上作为阳性对照。[表1]实验组测试物质动物数治疗浓度第1组对照(0.5%DMSO)60第2组DNCB60第3组DNCB+地塞米松60.1%第4组DNCB+测试物质60.01μM第5组DNCB+测试物质60.1μM第6组DNCB+测试物质61μMD.活组织检查:测试物质施用完成后,在心脏麻醉的条件下,将各试验动物的背侧皮肤切割,将它们中的一些用液氮快速冷冻,并在分析前,贮存于-70℃下,并将剩余的用10%中性福尔马林缓冲液固定24小时。通过常规组织处理,将固定的组织准备在载玻片上,然后进行苏木素&曙红(H&E)染色,以测量表皮层的厚度。此外,完成甲苯胺蓝染色,以观察肥大细胞的定量变化。利用光学显微镜观察染色组织,利用图像分析仪(OlympusDP-21)获得表皮层的厚度和肥大细胞数目。E.IgE水平测量:当完成解剖后,利用收集的血清,经(SHIBAYAGI,Japan)测量血液中的IgE浓度。将50μLIgE标准溶液和样品置于连接抗体的96孔板中,并让其反应2小时,然后将50μL生物素-缀合的抗-IgE抗体溶液加入到各孔中,并让其反应2小时。此后,让得到的样品与HRP-抗生物素蛋白溶液反应1小时,与发色底物(TBM)试剂反应20分钟,并利用反应终止剂终止反应。利用ELISA(MoleculardevicesEmax),在450nm下,测量样品的吸收度。实施例4:急性皮肤毒性测试试验方法A.饲养环境(1)环境条件:在本试验中,试验动物在Hoseo大学安全评价中心的清洁动物饲养室(小动物室#2-302)饲养,设定环境条件下:温度22±3℃;相对湿度50±20%;通风频率10~15次/小时;照明期12小时;和照度150Lux~300Lux。(2)笼子和毯子:在适应期间,将每个性别2只或3只动物置于每个带有不锈钢网盖的聚碳酸酯笼子(270×500×200mm,KYERYONGSCIENCE)中,分组后,将每个性别1只动物置于其中。对于毯子,使用γ射线照射的无菌Betachips(NEPCO)。(3)饲料和饮水:动物自由摄取PMINutritionInternational生产的实验动物小鼠饲料(5053-PicolabRodent20),并将紫外灭菌处理的过滤水(R/O水)作为饮用水,自由提供。(4)饲料和饮水的污染检测:通过接受饲料生厂商的测试结果,检测饲料的污染,并且利用根据本研究所的相应SOP的定期检查,检测饮水质量的污染,并确证不存在污染物。B.测试方法(1)实验组的组成[表2](2)施用:[表3]施用途径和选择的原因:根据试验委托人的要求,选择经皮施用。施用次数:每天一次,单次施用后,暴露24小时。剂量计算:基于施用日子的体重,计算剂量(mg/kg)。(3)试验方法(A)施用前大约24小时,除去背部的毛,以便除毛位置占其全部表面积的大约10%或更多,并且注意不要损伤皮肤。(B)施用的日子,计算各个个体的剂量,然后将测试物质用溶剂充分润湿,然后施用在相应于全部表面积大约10%(大约44cm)的位置。(C)24小时暴露期间,利用孔状纱布、非刺激性带子和绷带,保持测试物质与皮肤接触。(D)当暴露期终止后,利用温水除去剩余的测试物质。(4)观察项目(A)全身症状观察:施用后30分钟至4小时,密切观察所有动物,并且每天一次观察全身症状,持续14天。观察时,基于个体,记录死亡和临床症状。(B)体重测量:在收到时、分组时、临施用前(施用日子),以及施用开始后第1天、第4天、第7天、第10天和第14天,测量所有动物。(C)尸体解剖:测试期间,将死亡动物立即进行尸体解剖,并用裸眼检查器官,并且在测试末期,将所有活的动物通过吸入CO2气体而安乐处死并切开静脉,然后可视地检查器官。(D)计算致死剂量(LD50):因为在本测试给药期间未观察到死亡,所以未计算致死剂量(LD50)。(E)统计学分析:体重数据表示为平均值和标准偏差,并未对体重进行统计学分析。实施例5:构建抗体微点阵体系试验方法A.组织样品的制备:将小鼠皮肤组织冷冻在液氮中,然后在研钵中精细研磨。将液氮立即加入,以防止组织解冻。将精细研磨的皮肤组织置于LysisM缓冲液中,以制备组织样品裂解物。B.组织裂解物的荧光标记:从用样品处理一段时间的组织裂解物和未处理的组织裂解物(LysisM提取液,Roche)中,提取蛋白质,并用荧光物质(Cy3或Cy5)(GEHealthcare)标记。首先,将来自各个组织裂解物的蛋白质的量调整至是至少1mg,然后加入偶联缓冲液(0.1M碳酸钠缓冲液,pH9.3),并充分混合。将Cy3和Cy5染料加入到其中已加入偶联缓冲液的各组织裂解物中,并充分混合,以在4℃下标记16小时。将仅用DNCB处理的对照用Cy3和Cy5标记,并将用样品处理的实验组也用Cy3和Cy5标记。用荧光染料标记后,利用Post-reactiveSpin柱(Sigma)除去游离的染料。C.构造抗体微阵列:ProteoChipTM(Proteogen,Inc.,首尔,韩国)用作蛋白质芯片,在ProteoChipTM通过将针对26种蛋白质的抗体点样在细胞中构造抗体微阵列,所述细胞在用200μg/ml蛋白质A固定的基质上。首先,用含有30%甘油的磷酸盐缓冲溶液,将抗体稀释至100μg/ml,并将抗体阵列在4℃下固定过夜。将抗体芯片用PBST冲洗3次,并在室温下,于搅拌器中,用3%BSA封闭1小时。封闭后,将芯片用PBST溶液(含有0.05%吐温20的磷酸盐缓冲液)冲洗,以除去过量的BSA,并用N2气体干燥。D.抗体阵列的杂交:将用荧光物质标记的组织裂解物定量(Bradford方法),并将30μg荧光标记的各样品混合于10ml反应溶液中。将抗体芯片浸于缓冲液中,其中放置荧光标记的样品,以保证反应在30℃下进行1小时。反应后,将抗体芯片用PBST溶液冲洗两次,并用氮气气体干燥。利用荧光微阵列扫描仪,分析每个载玻片。调整PMT值,以便Cy3和Cy5的主峰是大约10,000后,完成扫描。利用软件(Genepix6.0),计算各点中Cy5与Cy3的比率。通过样品-Cy5/对照-Cy3x样品-Cy3/对照-Cy5,计算INR值。如果表达不存在差异,理想的INR值是1,1或更大的值意指表达的增加,并且小于1的值意指表达的降低。E.蛋白印迹分析:完成蛋白印迹分析,以证实上述抗体阵列试验中,蛋白质表达的差异。在SDS-PAGE上,分离组织裂解物中的蛋白质。然后,将经电泳的蛋白质转移到PVDF膜上。用PBST溶液冲洗后,将PVDF膜用5%脱脂奶粉封闭1小时,然后与初级抗体在4℃下反应过夜。将膜用PBST溶液冲洗,并与用辣根过氧化物酶(HRP)缀合的次级抗体(抗-IgG)在室温下反应1小时,并用光致抗蚀剂膜检测。在下文中描述上述实施例的结果。利用CADD技术的基于结构的电脑虚拟筛选得到具有校正的最高最终评分(作为对接计算的结果)的50个化合物的结果,并将其分子结构列于表中。A.化合物的评分结果列于下表中。[表4]ID评分ID评分ID评分15173488-8.259027249234-7.190737936732-7.0322525572011-8.105395541710-7.182646589632-7.0274235116307-8.095055182410-7.139117579578-7.0231545173962-7.838985119461-7.123657270409-6.9839657663208-7.756095182436-7.121157290917-6.9443365356744-7.497067808944-7.107695566788-6.939775117545-7.443775916129-7.096316181266-6.9160585116232-7.35765248955-7.082617933953-6.913697231009-7.315249198688-7.04555808421-6.90651107894092-7.210139150101-7.034555535147-6.89749[表5]ID评分ID评分17123737-6.895189138070-6.8003327940511-6.862249030779-6.7982635173510-6.856427967935-6.7961345211084-6.854825235245-6.7922257238182-6.853479141139-6.7852269339450-6.838579143017-6.7767976392971-6.81217933471-6.7718484031614-6.809557271310-6.7538595554416-6.806177934027-6.74975107247002-6.801337614505-6.74535B.将化合物的结构信息列于下表中。[表6]基于细胞的候选物质变态反应抑制活性的体外分析A.异位性皮炎致病因子TSLP的调节剂筛选胱天蛋白酶-1诱导TSLP分泌,TSLP是异位性皮炎致病因子。为了探索TSLP调节物质,将异位性皮炎的致病细胞肥大细胞用PKC活化剂PMA和钙离子载体A23187(PMACI)刺激。与未刺激细胞(空白)的TSLP分泌相比,发现刺激的肥大细胞的TSLP分泌显著增加,并检测各种候选物质的作用。因此,发现物质5182436、5211084和5356744显著抑制肥大细胞的TSLP分泌(参见图2)。B.TSLP调节物质的细胞毒性验证为了检测活性物质的细胞毒性,完成MTT-测试,并且MTT-测试结果显示IPS-07002(5211084)和IPS-07003(5356744)在10μM浓度不显示细胞毒性。然而,证实IPS-07001(5182436)在10μM浓度显示细胞毒性。根据在各种浓度下重复完成的试验的结果,IPS-07001(5182436)在高达1μM显示无细胞毒性(参见图3)。C.IPS-07001(5182436)对TSLP生产调控作用的重复实验完成重复试验,以在无细胞毒浓度下,检测IPS-07001对TSLP产生的调控的作用,并根据重复试验结果,证实在0.011μM浓度,IPS-07001显著调控TSLP产生。IPS-07001还显著抑制TSLPmRNA表达(参见图4)。D.IPS-07001(5182436)对胱天蛋白酶-1活性调控作用的分析为了研究#5182436对胱天蛋白酶-1活性的调控作用,利用细胞提取物进行胱天蛋白酶-1测试。因此,发现IPS-07001以浓度依赖的方式显著抑制胱天蛋白酶-1活性。此外,发现IPS-07001抑制活性胱天蛋白酶-1的表达(参见图5)。E.基于动力学测试的IPS-07001(5182436)对胱天蛋白酶-1活性调控作用的验证为了研究IPS-07001对胱天蛋白酶-1活性的调控作用,进行胱天蛋白酶-1测定。因此,发现IPS-07001以浓度依赖的方式显著抑制胱天蛋白酶-1活性(参见图6)。F.#5182436对人肥大细胞(HMC-1)中炎性细胞因子产生的调控作用的试验。IPS-07001(#5182436)显著抑制各种炎性细胞因子的产生和mRNA表达(参见图7)。G.IPS-07001(#5182436)对DNCB-施用的balb/c小鼠血清中组胺、IL-4和IgE水平调控作用的分析测量DNCB-施用的balb/c小鼠血清中组胺、IL-4和IgE水平。发现在0.011μM浓度,IPS-07001(#5182436)显著调控血清组胺、IL-4和IgE水平(参见图8)。H.IPS-07001(#5182436)对DNCB-施用的balb/c小鼠的背部皮肤中胱天蛋白酶-1活性调控作用的分析在异位性皮炎体内模型中,为了检测IPS-07001(#5182436)对胱天蛋白酶-1活性的调控作用,利用DNCB-施用的balb/c小鼠的背部皮肤,进行胱天蛋白酶-1分析。因此,发现IPS-07001(#5182436)以浓度依赖的方式,显著抑制胱天蛋白酶-1活性(参见图9)。I.IPS-07001(#5182436)对DNCB-施用的balb/c小鼠的背部皮肤中炎性细胞因子调控作用的分析在DNCB-施用的balb/c小鼠的背部皮肤中,分析炎性细胞因子水平。发现在0.011μM浓度,IPS-07001(#5182436)显著调控IL-4和IL-6水平(参见图10)。J.#5182436对DNCB-施用的balb/c小鼠的皮肤组织中炎性细胞因子mRNA表达调控作用的分析根据分析DNCB-施用的balb/c小鼠的皮肤组织中,炎性细胞因子mRNA表达是否得到调控的结果,发现IPS-07001(#5182436)调控异位性皮肤损害中的TARC、TNF-a和IL-6mRNA表达(参见图11)。在接触性异位性皮炎动物模型中,研究DNCB对特应性-相关因子的调控作用A.视觉观察银屑病和异位性皮炎已知为显示皮肤干燥的代表性疾病。其中,特别是异位性皮炎,除皮肤干燥外,以角化过度、红斑、水肿、严重瘙痒、渗出物、疮和结疤为特征,并且伴随各种症状例如皮肤炎症等,诸如急性期的大水疱和慢性期的皮肤增厚(BieberT.异位性皮炎.NEnglJMed.2008;358:1483-94)。因此,在本试验中,观察到皮肤临床症状主要集中于红斑、干燥皮肤、水肿&抓痕、糜烂和苔藓样硬化。根据观察结果,与正常对照组相比,在仅用DNCB治疗的组中,观察到明显的干燥、红斑、抓痕和苔藓样硬化。相反,除了红斑外,在地塞米松-治疗组中DNCB-诱导的皮肤症状大多被消除。在0.01μM和0.1μM测试物质治疗组中,未观察到显著视觉变化,但是与DNCB组相比,1μM减轻红斑、抓痕和苔藓样硬化(参见图12)。B.表皮厚度变化在患诱导的特应性(atopy)的DNCB组,组织学观察显示小鼠皮肤组织中的角化过度。DNCB组的表皮厚度是87.1±13.0μm,其比正常对照组的厚度即24.5±10.3μm显著更大,表明异位性皮炎典型的角化过度的发生。作为阳性对照的地塞米松-治疗组显示39.9±9.4μm的皮肤厚度,表明表皮层厚度的显著降低。在用测试物质以0.01μM、0.1μM和1μM浓度治疗的组中,表皮厚度分别降低至70.8±4.3μm、74.4±7.1μm和60.0±8.2μm(参见图13)。C.皮肤组织中肥大细胞的数目通过作为瘙痒的主要起因,由此损害皮肤屏障并诱导皮肤炎症,经由异位性皮炎中肥大细胞脱粒分泌的组胺已知在异位性皮炎的进程中起主要作用(Lee,E.J.,G.E.Ji和M.K.Sung.2010.Inflamm.Res.59(10):847-854)。测试物质施用3周后,0.1μM测试物质-施用组(25.8±3.5,p<0.01)和1μM测试物质-施用组(23.8±5.1,p<0.01)显示统计学显著的降低。这些结果类似于DNCB-治疗组的结果,其表明测试物质在通过降低肥大细胞数量而缓解瘙痒方面是有效的(参见图14)。D.血液IgE水平血清IgE增加已知是异位性皮炎的指标。具体地讲,IgE已知与临床严重性密切相关(M.Ban和D.Hetich,Toxicol.Lett,118,129(2001))。异位性皮炎增加IgE抗体应答(Matsuda,H.,Watanabe,N.,Geba,G.P.,Sperl,J.,Tsudzuki,M.和Hiroi,J.:Int.Immunol.9,461(1997))。此外,IgE产生的增加引起抗体应答增加和IgE-依赖的组胺玻璃样活性增加,因此促进组胺分泌。组胺已知诱导嗜酸细胞渗透,以及引起急性超敏反应和瘙痒(H.C.Sung,W.J.Lee,S.J.Lee和D.W.Kim,Kor.J.Dermatol,44,1051(2006))。因此,IgE的降低认为是异位性皮炎减轻的主要指标。在本试验中,与正常对照相比,DNCB组(790.0±151.8)显示IgE水平的70%或更高的增加,而地塞米松-治疗组(703.8±86.5)显示轻微降低的IgE水平,但是不具有统计学显著性。在用各浓度测试物质治疗的组中,0.1μM测试物质-施用组(632.6±138.8,p<0.05)和1μM测试物质-施用组(537.9±132.9,p<0.01)显示IgE水平统计学显著的降低(参见图15)。。急性皮肤毒性试验为了确证IPS-07001的毒性样式和毒性强度,将0μM和200μM单一经皮施用施用至雌性和雄性SD大鼠,然后观察死亡和濒死动物的出现或缺失、临床症状和体重变化,持续14天。完成观察后,将SD大鼠解剖,并检查各个个体的异常,由此得到下述结果。A.死亡率测试期,在所有测试物质-施用组,未观察到死亡动物(参见表7)。[表7]表7显示用测试物质治疗后的死亡率。B.临床症状IPS-07001施用后,在施用0μM/kg和200μM/kgbw组的雄性和雌性大鼠中,未观察到临床症状包括皮肤损害(参见表8)。在0μM/kg和200μM/kg组的每组的一只大鼠中,观察到皮肤红斑,但是这不认为是由测试物质引起的,并且施用后一天内,所述症状消失。[表8]表8显示用测试物质治疗引起的临床症状。C.体重变化在施用后第1天,施用测试物质的所有雌性和雄性大鼠的组显示体重的降低。所述结果认为归因于测试物质治疗过程中的环境变化,并且从第2天开始,显示正常体重增加模式。[表9]表9显示用测试物质治疗的雄性大鼠体重的变化。a):14小时饥饿后得到的数据b):从第0天至第14天计算的体重增加。[表10]表10显示用测试物质治疗的雌性大鼠体重的变化。a):14小时饥饿后得到的数据b):从第0天至第14天计算的体重增加。D.解剖发现观察期结束后,对存活动物完成视觉病理学检测,并且无个体显示任何异常(参见表11)。[表11]表11显示测试物质-治疗的大鼠的解剖学结果。NGF:无异常发现a):第15天存活动物中观察的E.致死剂量在雌性和雄性大鼠中,测试物质透皮施用的致死剂量(LD50)是200μM/kg/4mlbw或更大。建立抗体微阵列体系,以确定机制A.细胞因子&趋化因子抗体微阵列蛋白质芯片将通过破裂仅用DNCB处理的各皮肤组织,以及用DNCB和IPS-07001处理的皮肤组织而得到的组织裂解物用荧光物质(Cy3或Cy5)标记,并利用抗体芯片进行蛋白质表达分析。参照ProteoChip上固定的抗体地图,完成抗体微阵列蛋白芯片分析。图16-1显示通过比较固定26种抗体的抗体芯片上的表达水平而得到的荧光图像。图16-2中显示INR分析结果的图。根据基于抗体芯片的分析结果,皮肤组织样品不超过作为测定升高/降低的阈值的1±0.1的范围,但是在皮肤组织样品中,发现三种细胞因子蛋白质IL-6、IL-22和IL-33的表达降低,它们的水平最接近于阈值。已报道Th2细胞分泌的IL-6在患异位性皮炎的患者的T细胞中增加(Toshitani,Akito等人,JInvestDermatol100.3(1993):299-304)。已知Th17细胞产生的IL-22促进炎性皮肤疾病的形成,并在炎性疾病中起关键作用。此外,已报道IL-22的表达在异位性皮炎中增加(Cho,Kyung-Ah等人,Internationalimmunology24.3(2012):147-158)。最近已知属于IL-1家族的细胞因子IL-33与Th2-型免疫应答相关,并于屏障组织的细胞中表达。然而,其在变应性皮肤炎症中的作用未被很好了解,但是强烈地表明其是与异位性皮炎相关的。根据最近的研究,已报道IL-33的表达在诱导的异位性皮炎中增加(Savinko,Terhi等人,JournalofInvestigativeDermatology132.5(2012):1392-1400)。已报道IL-6、IL-22和IL-33在异位性皮炎的皮肤中增加,并与异位性皮炎的恶化密切相关。在本发明中,认为由于异位性皮炎症状的减轻,上述三种细胞因子降低。B.蛋白印迹分析将通过破裂仅用DNCB处理的皮肤组织,以及用DNCB-和IPS-07001处理的皮肤组织而得到的组织裂解物进行SDS-PAGE,然后转移至PVDF膜,并且利用特异性结合抗体,检测特定蛋白质的表达水平。因此,皮肤组织样品未超过确定抗体微阵列蛋白芯片结果中增加/降低的阈值的1±0.1的范围,但是非常接近阈值的三种细胞因子IL-6、IL-22和IL-33的蛋白印迹表明蛋白表达水平轻微变化,但是是降低的(参见图17)。实施例6:IPS-07004(式4)和异位性皮炎07001(式1)筛选后,根据对具有类似于07001结构的化合物的文献检索,发现IPS-07004,并且其购自KeyOrganics(伦敦,UK)。(1)细胞培养:在37℃和5%CO2下,将人皮肤细胞系(HaCat细胞)培养于含有10%FBS的RPMI中。将候选物质溶解于DMSO中,然后用0.22μm过滤器过滤。将得到的候选物质用DMSO溶解,并将HaCat细胞用其处理。(2)细胞毒性(MTT-测试):稳定HaCat细胞(3x105细胞/ml)1小时后,从10μM浓度开始,将其用不同浓度的候选物质处理,随后用Poly(I:C)处理8小时。然后,将培养基替换为新鲜培养基,然后向其中加入5mg/mlMTT溶液,并将肥大细胞在37℃下培养4小时。向HaCat细胞中,加入250DMSO,从其中提取MTT甲臜,并利用ELISA酶标仪,在540nm下,测量每个孔的吸收度。(3)胱天蛋白酶-1活性分析:使重组胱天蛋白酶-1和药物反应,然后利用胱天蛋白酶-1测试试剂盒(R&DSystemsInc.,明尼阿波利斯,MN,USA),测量活性。实施例7:炎性肠病试验动物6-周龄雌性SPF(无特定病原)C57BL/6小鼠购自DuPontBiotech。在Hoseo大学安全评价中心的动物室适应1周后,让小鼠自由摄取饲料和水,动物室保持于温度21±3℃、湿度50±20%和12h/12h的明/暗周期。Hoseo大学动物试验伦理委员会批准后,进行本项动物试验中的所有操作(HTRC-15-19和HTRC-16-22(2))。分组和肠炎诱导将作为结肠炎诱导剂的葡聚糖硫酸钠(Mpbio.Com的目录号160110)用饮用水稀释至3%浓度,并口服施用至小鼠,以诱导肠炎。将小鼠分成6组,并将DW施用至对照动物,并将1.0mg/kg和10mg/kg测试物质口服施用至本实验组的动物,一天一次,持续5周。将溶解于天然橄榄油中的柳氮磺胺吡啶(100mg/kg)口服施用至阳性对照的动物,一天一次。在急性情况下,施用5天后,检测疾病恶化的水平。在慢性情况下,施用5天后的15天和30天,检测疾病恶化的水平(参考文献:ToxicologyReports2(2015)10391045–通过调控主要与结肠炎相关的基因表达,石竹烯减轻葡聚糖硫酸钠诱导的结肠炎(Caryophylleneattenuatesdextransulfatesodium-inducedcolitisinmiceviamodulationofgeneexpressionassociatedmainlywithcoloninflammation))。体重测量和粪便观察测试期间,5天或更多天,测量一次体重。如果与正常对照相比,不存在差异,将测量的体重定量为0分;15%的体重减轻比率,定量为1分;510%,2分;1015%,3分;和>15%,4分。完成粪便观察,以检测腹泻的发病率,并将其结果定量为评分(0,正常粪便;1,轻度的软粪便;2,非常软的粪便;3,非常软的粪便(无规则形状);4,水样便)。收集组织和血样在每次解剖期间,从5个个体采集直肠组织和血液。将Yuhanketamine(YuhanCorporation,韩国)和Rompun(拜耳,USA)以3:1的比率混合,然后通过肌肉注射麻醉动物。将各个麻醉的动物进行剖腹术,以从腹部动脉采集血液,并且血液采集后,将腹部动脉切开,并进行静脉切开术和处死,以收集直肠组织。测量收集的组织的长度和重量,以计算每1cm组织的重量。将一些收集的组织用于活组织检测,并将其中一些冷冻于液氮中,且在分析之前,贮存于-70℃。组织学检查对于组织学评价,将直肠的一些组织固定于4%的中性福尔马林缓冲液中(4%NBF)后,进行常规组织学检查,然后利用切片机,将其显微切片为4μm厚度,并对其完成苏木精&曙红染色。基于光学显微镜下的观测,将炎症程度分为5个阶段(正常-0,最小-1,轻度-2,中度-3和严重-4)。下文中,将描述上述实施例的结果。IPS-07004的特应性抑制作用对于IPS-07004,在基于HaCat细胞的测试中,未观察到细胞毒性,并且发现该化合物抑制重组胱天蛋白酶-1活性和HMC-1细胞中的胱天蛋白酶-1活性,由此抑制特应性(参见图22~24)。IPS-07001(式1)和IPS-07004(式4)的IBD肠炎抑制作用利用根据上述试验方法构建的DSS-诱导的动物模型,观察IPS-07001和IPS-07004对肠炎的抑制作用。将剂量分成1.0mg/kg和10mg/kg,并完成口服施用。利用肠重与肠长度的比率(wt/cm)分析功效,并通过重量变化、腹泻、黑粪症等进一步分析。根据试验结果,发现与DSS对照相比,在10mg/kg剂量,两种物质显示优良的肠炎抑制活性(参见图18~20、25、27和28)。体重变化与正常组的体重变化类似,并且观察到与DSS-诱导组相比,显著降低黑粪症(参见图20、26和27)。认为通过抑制炎性体的关键蛋白胱天蛋白酶-1,所述肠炎抑制机制控制炎症诱导机制。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1