用于电化学检测相关分子的系统的制作方法
本发明涉及用于电化学检测相关分子的系统以及实施所述系统的方法。
背景技术:
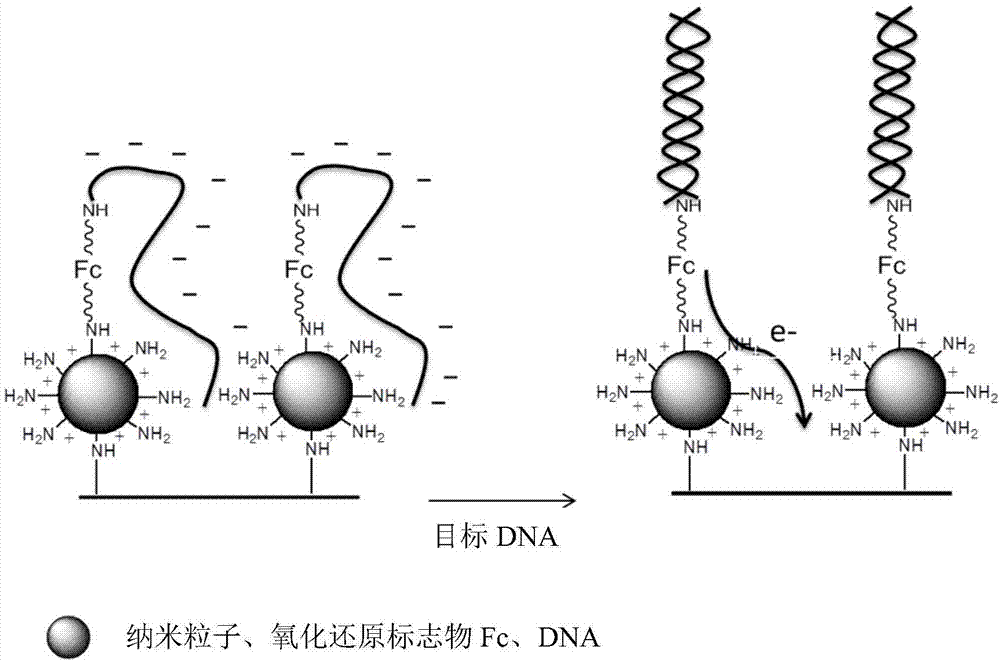
测量样品中的生物分子,特别是dna分子或致病蛋白分子在不同的分析领域如诊断、环境或农业食品工业中是非常有用和必需的。该检测目前通过需要技术环境和大量工具(如pcr)的分析系统来进行。为了用于临床分析领域,该检测系统应当是灵敏的,并且甚至能够以极低的假阳性概率来量化待分析样品中浓度非常低的,例如飞摩尔量级(10-15mol/l)的病原体的存在。电化学装置满足这一挑战。由现有技术已知,生物传感器使用与相关dna分子互补的dna探针和产生电化学信号的氧化还原探针来指示相关分子,特别是dna分子的存在。在现有技术的电化学检测装置中可以确定两种类型的生物传感器:“signal-off”生物传感器和“signal-on”生物传感器。“signal-off生物传感器”在dna探针与相关dna分子杂化后会降低电化学信号。事实上,形成双链dna迫使氧化还原探针远离电极表面,由此减少了氧化还原探针与电极之间的电子转移。例如,farjami等人(anal.chem.,2011,83(5),第1594-1602页)描述了使用涉及生物传感器的电化学方法检测dna,所述生物传感器包含:-发夹型dna探针,在金电极上在其3’端固定,和-氧化还原探针,经由该dna探针的发夹结构连接在位于所述电极附近的所述dna探针的5’端。采用这种类型的生物传感器的缺点是关于信号降低的起因的不确定性,这可能是由于氧化还原探针的降解或老化所致。“signal-on”生物传感器在dna探针与相关dna分子杂化时引发电化学信号的提高。这些生物传感器需要:-对dna探针为特异性的预构建,以使氧化还原探针能够远离电极表面移动或遮蔽其,和-dna探针针对各相关dna分子的结构调整。当生物传感器与目标dna分子接触时,dna探针与生物传感器之间的相互作用释放氧化还原探针,其随后可以移动至更靠近电极并产生电化学信号。在这种类型的生物传感器中采用的dna探针可以是双链形式,或甚至三链结构,并任选地构造成发夹形式。xiao等人(j.am.chem.soc.,2007,129,11896-11897)描述了含有用氧化还原探针标记的单链dna探针的电化学dna生物传感器。所述dna探针形成三链结构,使得能够使该氧化还原探针远离电极表面移动。在与该dna探针杂化的过程中,该氧化还原探针接触导电表面,导致电流增加。该电化学生物传感器的灵敏度阈值限于5nm。“signal-on”类型的已知生物传感器的主要缺点在于dna探针的必要且复杂的构建,这需要对各种待检测的相关dna分子进行优化。此外,这些dna电化学生物传感器具有不能令人满意的检测灵敏度阈值。由此,特别是在临床和食品分析领域,仍然需要开发能够检测浓度非常低的相关分子,而无需对dna探针进行预构建或优化的电化学生物传感器。技术实现要素:本发明的主题是提供一种“signal-on”生物传感器类型的电化学检测系统,其灵敏度非常高,并且无需调整dna探针。本发明的用于电化学检测相关分子的系统包含:-导电材料,-共价键合到所述导电材料上的至少一种带有阳性官能团的纳米材料,-至少一种氧化还原分子,和-至少一种靶向相关分子的单链寡核苷酸探针,所述氧化还原分子共价键合到所述纳米材料上;所述寡核苷酸探针共价键合到所述纳米材料上或氧化还原分子上;所述纳米材料的阳性官能团的数量大于寡核苷酸探针的数量。本发明基于以下令人惊喜的事实:该寡核苷酸探针的磷酸根基团的负电荷与该纳米材料的正电荷之间的相互作用允许三维组织化,以使其阻断电子由氧化还原分子转移至导电材料。在不存在待检测的相关分子的情况下,带负电荷的磷酸根基团与纳米材料表面存在的阳性官能团相互作用。离子类型的这些相互作用包括将寡核苷酸探针叠在该纳米材料上,从而阻止电子从氧化还原分子转移到纳米材料的表面。从待检测的相关分子存在于分析的样品中的那一刻起,相关分子与寡核苷酸探针之间的反应改变了寡核苷酸探针的构象,例如在待检测的相关dna分子与寡核苷酸探针之间形成双链dna,并中断了后者与纳米材料之间的相互作用,这使得能够暴露氧化还原分子,并允许电子从氧化还原分子转移至纳米材料表面。电子的转移产生了可以被电分析方法检测到的感应电流。在本发明的框架内,该电流的安培数与和该寡核苷酸探针相互作用的相关分子的数量成正比。因此,测量电流能够显示分析的样品中相关分子的含量。本发明的系统的优点之一是其对相关分子的提高的灵敏度。本发明的系统能够量化极低浓度,特别是飞摩尔量级(10-15mol/l)的相关分子。本发明的系统的另一优点在于单链寡核苷酸探无需针对不同的相关分子进行特异性预结构化或优化,因为寡核苷酸探针的磷酸根基团的负电荷与纳米材料的正电荷之间的相互作用允许三维构型,以便阻止电子的转移。此外,不同于已知的电化学检测系统,由于寡核苷酸探针的高特异性和对电子转移的强力阻断,本发明的检测系统极大地限制了假阳性的出现。根据本发明,“寡核苷酸探针”是指对相关分子为特异性的含10至50个核苷酸、特别是10至25个核苷酸的单链寡核苷酸,其5’或3’端的官能化允许所述探针与氧化还原分子之间的共价键合。例如,所述寡核苷酸可以被胺或酸官能化。该胺或酸可以通过含有1至10个碳原子的烃连接基团与该寡核苷酸的末端分离。所述单链寡核苷酸可以是rna分子或dna分子,任选形成适体。作为能够被本发明的电化学检测系统检测的“相关分子”,可以提及dna分子、rna分子、蛋白质、毒素或化学分子。相关dna分子可以是分离的天然基因组dna分子、病毒dna分子、合成的cdna分子或pcr产物。相关rna分子可以是grna分子、mrna分子、mrna前体分子、sirna分子、微小rna分子、rnai分子、trna分子、rrna分子、snrna分子或卫星rna分子。当相关分子是dna分子或rna分子时,靶向所述分子的寡核苷酸探针是具有互补序列的dna分子或rna分子。在样品中存在所述相关分子会导致形成垂直于纳米材料表面的双链结构。当相关分子是蛋白质或毒素时,靶向所述分子的寡核苷酸探针形成适体,所述相关分子在其上可以作为配体固定。此类寡核苷酸探针的序列可以根据本领域技术人员的知识来确定,或根据传统方法如selex(指数富集的配基系统进化)技术来选择。根据本发明,“氧化还原分子”是指对氧化还原反应有活性并能够产生使用与所述氧化还原分子与导电材料之间的电子转移相关联的电分析方法可测量的电化学信号的分子。该电化学信号能够指示与寡核苷酸探针互补的相关分子的存在。根据本发明的一个实施方案,所述氧化还原分子共价键合到所述纳米材料与寡核苷酸探针上,所述纳米材料的阳性官能团的数量相当高以便阻断电子从氧化还原分子向导电材料的转移,特别是所述纳米材料的阳性官能团的数量大于该寡核苷酸探针的数量。本发明的这种类型的检测系统能够同时检测几种相关分子。本发明的一个特定实施方案涉及电化学检测系统,包含:-至少两种类型的氧化还原分子,其氧化还原电位不同,和-至少两种类型的单链寡核苷酸探针,各自靶向不同的相关分子,相同类型的寡核苷酸探针键合到相同类型的氧化还原分子上。在所述电化学检测系统中使用各自键合到一种类型的寡核苷酸探针上的至少两种类型的氧化还原分子能够同时检测样品中至少两种不同的相关分子。各相关分子的存在分别由不同的电化学信号来指示。所述系统特别可用于检测样品中的snp(单核苷酸多态性)。在一个有利的实施方案中,本发明涉及一种电化学检测系统,包含:-两种类型的氧化还原分子,其氧化还原电位不同,和-两种类型的单链寡核苷酸探针,各自靶向不同的相关分子,相同类型的寡核苷酸探针键合到相同类型的氧化还原分子上。在另一有利的实施方案中,本发明涉及一种电化学检测系统,包含:-三种类型的氧化还原分子,其氧化还原电位不同,和-三种类型的单链寡核苷酸探针,各自靶向不同的相关分子,相同类型的寡核苷酸探针键合到相同类型的氧化还原分子上。根据本发明的另一实施方案,本发明的用于电化学检测相关分子的系统包含共价键合到所述纳米材料上的所述氧化还原分子和所述寡核苷酸探针,所述纳米材料的阳性官能团的数量相当高以便阻断电子从氧化还原分子向导电材料的转移,特别是所述纳米材料的阳性官能团的数量大于该寡核苷酸探针的数量。这种类型的检测系统的优点在于合成较不繁琐且快速,因为该氧化还原分子具有单一官能团。在本发明的电化学检测系统中使用的氧化还原分子可以是本领域技术人员已知的任何氧化还原分子,更特别选自二茂铁、醌、亚甲基蓝、金属卟啉和紫精。在一个实施方案中,所述氧化还原分子可以按照常规方法预先官能化,以便共价键合到纳米材料上。例如,氧化还原分子可以被酸官能化,以便引入-cooh基团。由此改性的氧化还原分子任选地在偶联剂的帮助下可以与位于纳米材料表面上的胺反应。更特别地,该氧化还原分子可以官能化,以便既能与寡核苷酸探针反应,又能共价键合至该纳米材料。在其中该寡核苷酸探针共价键合到纳米材料上的实施方案中,所述探针被官能化,以便能够与所述纳米材料反应,而不与也共价键合到所述纳米材料上的所述氧化还原分子反应。例如,寡核苷酸探针可以被-cooh基团改性,以便与该纳米材料的胺官能团共价键合。有利地,预先进行的官能化通过“点击化学”来实现。在本发明的框架中,术语“氧化还原分子”和“氧化还原探针”可以彼此替换。“所述纳米材料的阳性官能团的数量相当高”是指阳性官能团的数量足够高以便该寡核苷酸探针能够有效叠在所述阳性官能团上。“所述纳米材料的阳性官能团的数量大于寡核苷酸探针的数量”是指所述纳米材料携带的阳性官能团数量大于经由氧化还原分子共价键合到纳米材料上的寡核苷酸探针的数量,其确保有效地阻断寡核苷酸探针的磷酸根基团的负电荷与带有阳性官能团的纳米材料的正电荷之间的电子转移。纳米材料携带的阳性官能团数量和寡核苷酸探针的数量可以分别根据现有技术中已知的方法来确定。根据本发明,所述电化学检测系统的带有阳性官能团的纳米材料选自:-树枝状聚合物,优选聚(酰胺-胺)型树枝状聚合物,特别是第二代、第四代或第六代(分别为g2、g4或g6),-金属粒子,如金纳米粒子,-磁性纳米粒子,如氧化铁,-基于壳聚糖的杂化纳米材料,和-导电聚合物,任选地由阳性官能团改性,如聚吡咯、聚苯胺或聚对苯撑(polyparaphenylene)。在一个有利的实施方案中,根据本发明的电化学检测系统使用的纳米材料是聚(酰胺-胺)(pamam)型树枝状聚合物,其结构为球形,并且其直径、以及存在于所述树枝状聚合物表面上的伯胺基团的数量随着代数的变化而增加,另外:-g2pamam具有大约2.9nm的直径,并具有16个伯胺基团,-g4pamam具有大约4.5nm的直径,并具有64个伯胺基团,和-g6pamam具有大约6.7nm的直径,并具有256个伯胺基团。使用携带高密度胺基团的pamam不仅能够促进被不同物质(如不同的氧化还原分子)官能化,还能够提高所述检测系统的灵敏度阈值。在更有利的实施方案中,在本发明的电化学检测系统中使用的纳米材料是g4pamam。在另一有利的实施方案中,在本发明的电化学检测系统中使用的纳米材料是官能化的金纳米粒子。该金纳米粒子具有良好的面容比,使得能够获得可用于构建电化学传感器的三维结构化材料。例如,金纳米粒子可以被胱胺官能化,以成为带有阳性官能团的纳米材料。胱胺包含两个硫原子,其能够附接到金纳米粒子表面并留下游离胺基团。后者随后可以被官能化。在另一有利的实施方案中,在本发明的检测系统中使用的纳米材料是与g4pamam相关的任选官能化的金纳米粒子。该金纳米粒子改善了电导率并进一步增强了该电化学信号。金纳米粒子与pamam的缔合能够扩大本发明的检测系统的动态范围。该纳米材料通过共价键合而键合到该导电材料上。本领域技术人员将知晓如何选择适于纳米材料性质的方法,以便将其沉积在导电材料上。例如,pamam可以通过电沉积法沉积在碳电极的表面上。pamam的胺基团的氧化产生阳离子自由基–nh·+,其与碳表面上的c=c基团相互作用,由此实现共价接枝。为了官能化所述电极,可以通过预先使用n-(3-二甲基氨基丙基)-n’-乙基碳二亚胺盐酸盐/n-羟基琥珀酰亚胺(edc/nhs),经由胺基团将由胱胺官能化的金粒子沉积在碳电极的表面上。在本发明的电化学检测系统中,所述导电材料充当电极并提供附接纳米材料的规则表面。所述材料可以由碳形成,特别是由碳纳米管、玻璃碳、石墨、石墨烯或金属来形成。在一个特定实施方案中,所述导电材料是微电极或纳米电极,其可以分散在溶液中。根据本发明的另一特定实施方案,当所述带有阳性官能团的纳米材料导电时,在所述检测系统中不存在导电材料。例如,金纳米粒子、金属纳米粒子(铂、银等等)、金属氧化物、量子点、石墨或石墨烯可以既是带有阳性官能团的纳米材料,又是导电材料。本发明的电化学检测系统可用于:-检测生物样品中的病原体如细菌、病毒、寄生虫,或生物标志物如肿瘤生物标志物、阿尔茨海默氏病生物标志物、帕金森氏病生物标志物等等,其允许进行体外或体内诊断疾病,-确定至少一种病原体对药品的抗性,-检测农业食品、或药物样品或流出物中的病原体或毒素,例如沙门氏菌属、葡萄球菌属、气单胞菌属、大肠杆菌属、李斯特菌属、梭菌属等等的细菌毒素,和-监控生物流体中存在或不存在至少一种药品,特别是在慢性和/或强化治疗(如化疗或服用抗凝血剂)的框架中。为此,按照以下步骤使用本发明的电化学检测系统:i.使所述电化学检测系统与样品接触,并ii.检测相关的至少一种病原体、至少一种毒素或至少一种药品。例如,本发明的所述电化学检测系统可用于检测赭曲霉毒素a。所述电化学检测系统还可用于检测或区分snp位点。根据一个特定实施方案,本发明的所述电化学检测系统含有序列seqidno:4的寡核苷酸探针。所述系统可用于通过区分结核分枝杆菌基因组中的snp(tcg/ttg)位点来检测耐利福平的结核分支杆菌。本发明的主题还在于提出用于电化学检测样品中的相关分子的方法。所述方法包含以下步骤:(i)使本发明的检测系统与能够含有相关分子的样品接触,并(ii)电化学测量对所述相关分子为特异性的氧化还原信号。“电化学测量”是指测量氧化还原分子的氧化还原电位的变化,或通过在给定电位下观察到的氧化电流的变化来测量安培类型中的变化,或测量给定电位下阻抗的改变。根据本领域技术人员公知的方法测量这些变化。当样品中存在相关分子时,其与寡核苷酸探针的相互作用能够中断所述寡核苷酸探针与带有阳性官能团的纳米材料之间的相互作用,以便暴露该氧化还原分子,由此生成感应电流。电化学测量能够检测该电流,表示为氧化还原信号。由此,该信号对所述相关分子是特异性的。用于实施本发明的电化学测量可以是电位测量、阻抗测量、库仑测量或安培测量。在一个有利的实施方案中,通过安培测量法来实施该电化学测量。可以通过已知的安培技术,优选通过可以是线性、循环、脉冲或甚至电位变化类型(如计时安培分析法)的电位扫描伏安法来进行该电流的测量。根据本发明,该样品应当具有使得在所述检测系统中该寡核苷酸探针带负电荷且该纳米材料带有正电荷的ph。特别地,该样品应当具有6至7的ph。根据本发明,所述样品可以是生物样品。有利地,该样品可以因诊断原因取自患者。该样品例如可以是尿液、血液、血清、血浆、细胞提取物或体液。根据本发明,除了步骤(i)和(ii)之外并在步骤(ii)之后,该电化学检测方法可以包括定量分析所述相关分子。使用根据本领域技术人员已知的方法之一预先建立的校准曲线来进行相关分子的量化。根据一个特定实施方案,本发明涉及对至少两种类型的相关分子进行多重电化学检测的方法。所述方法包括以下步骤:(i)使如上所述包含至少两种类型的氧化还原分子和至少两种类型的寡核苷酸探针的检测系统与能够含有所述相关分子的样品接触;(ii)测量对所述相关分子为特异性的氧化还原信号。所述方法能够同时检测至少两种类型的相关分子。本发明还涉及用于制备该检测系统的改性的载体。所述载体包含:-导电材料,-带有阳性官能团的纳米材料,和-至少一种氧化还原分子,所述纳米材料位于所述导电材料和所述氧化还原分子之间并共价键合到后两者上。所述载体能够根据使用者的需要提供准备被寡核苷酸探针官能化的平台。所述载体可以经由官能化的氧化还原分子键合到其5’端也被改性的寡核苷酸上。所述载体可以根据以下方法来制备:-用带有阳性官能团的纳米材料覆盖导电材料,在所述导电材料与所述纳米材料之间形成共价键;-使用至少一种也被官能化的氧化还原分子官能化所述带有阳性官能团的纳米材料。本发明还提供了用于制备所述电化学检测系统的方法,其包括:(i)使如上所述的所述改性的载体与至少一种靶向相关分子的官能化寡核苷酸接触;(ii)在前述改性的载体与所述官能化寡核苷酸之间形成共价键。在步骤(ii)过程中,在所述改性的载体与所述官能化寡核苷酸之间形成共价键可以在所述官能化寡核苷酸与所述纳米材料之间进行,或在所述官能化寡核苷酸与所述氧化还原分子之间进行。制备本发明的所述电化学检测系统的方法需要在3’或5’端预先官能化该寡核苷酸探针并预先官能化该氧化还原分子。当它们接触时,所述官能化的寡核苷酸与氧化还原分子经由这些官能团形成共价键。“官能化寡核苷酸”是指其5’或3’端被活性官能(如胺、酸、叠氮化物、炔烃、硫醇等等)改性并能够与含有另一相容的活性官能团的化合物进行“点击化学”型快速化学反应的寡核苷酸。有利地,本发明还提出了一种相关分子的超敏感检测试剂盒,其可用于早期诊断或移行(ambulant)诊断。所述试剂盒包含:(i)如上所述的改性的载体,和(ii)至少一种靶向相关分子的寡核苷酸。所述试剂盒使得使用者能够在方便的时候自行制备本发明的电化学检测系统,并能够避免可能给出假阴性的寡核苷酸探针的老化或降解。为了键合到所述改性的载体中所含的氧化还原分子上,所述寡核苷酸在其5’端通过增加胺基团来改性。根据本发明的一个实施方案,用于制备本发明的所述电化学检测系统的试剂盒可以包含:-至少两种类型的氧化还原分子,其氧化还原电位不同,和-至少两种类型的单链寡核苷酸探针,各种类型的寡核苷酸探针键合到氧化还原分子上,其氧化还原电位彼此不同。附图说明下面的图1至10和实施例描述本发明。图1显示了在不存在和存在相关分子,特别是dna分子的情况下本发明的检测系统。图2显示了在不存在和存在相关分子,特别是适体的情况下本发明的检测系统。图3a和3b显示了当所用纳米材料为g4pamam时本发明的检测系统的特异性。图3c显示了可以被所述系统检测的浓度范围。图4a和4b显示了当所用纳米材料为改性的金纳米粒子时本发明的检测系统的特异性。图4c显示了可以被所述系统检测的浓度范围。图5a和5b显示了当所用纳米材料是与改性的金纳米粒子缔合的g4pamam时本发明的检测系统的特异性。图5c显示了可以被所述系统检测的浓度范围。图6显示了当寡核苷酸探针是合成dna分子时本发明的检测系统的特异性,特别是在丙型肝炎病毒的检测中。图7a和7b显示了当寡核苷酸探针是对赭曲霉毒素a为特异性的适体时本发明的检测系统的特异性。特别地,图7b显示了所述检测系统对赭曲霉毒素avs赭曲霉毒素b的选择性。图8显示了本发明的用于检测赭曲霉毒素a的系统的特异性,其中所用纳米材料是用萘醌作为氧化还原探针和对赭曲霉毒素a特异性的适体来改性的g2pamam。图9显示了含有用壳聚糖包覆并用萘醌氧化还原探针改性以便检测赭曲霉毒素a的磁性氧化铁(fe3o4)纳米粒子的本发明的检测系统的特异性。图10显示了含有壳聚糖微球并用萘醌氧化还原探针改性以便检测赭曲霉毒素a的本发明的检测系统的特异性。具体实施方式实施例材料和方法-产品根据本领域技术人员已知的方法合成二茂铁fc(nhp)2。磷酸盐缓冲液(pbs)ph=7.4的溶液含有10mm的na2hpo4、1.8mm的kh2po4、2.7mm的kcl和137mm的nacl。该pbs用双蒸水制备并经0.22微米膜过滤,随后储存在4℃下直到其使用。g4pamam树枝状聚合物在使用前通过0.22微米过滤膜提纯。金纳米粒子(aunps)以0.1mmpbs溶液来自于sigma-aldrich并具有5nm的直径。用于研究本发明的系统的动态范围的寡核苷酸探针,下文中称为“ssdna探针”包含序列seqidno:1(5’gat-act-tct-atc-acc3’)的寡核苷酸,其在5’端被nh2c6-基团改性。所述探针靶向序列seqidno2(5’ggt-gat-aga-agt-atc3’)的相关合成寡核苷酸,在下文中称为相关合成dna分子。不与前述寡核苷酸探针互补的序列seqidno:3(5’cat-tcc-ctc-tta-gg3’)的寡核苷酸用作对照物。在用于检测抗性结核分枝杆菌的试验的背景下,具有411个碱基的pcr产物获自结核分枝杆菌的rpob基因。cpcr是获自在rpob基因中含有突变tcg/ttg的结核分枝杆菌的5个菌株的pcr产物,所述突变是抗利福平的原因。这5个菌株是2-09、7-09、8-09、10-09和11-09。ncpcr是获自结核分枝杆菌的野生株的非突变rpob基因的pcr产物。靶向cpcr的寡核苷酸探针(下文中称为“pcr探针”)包含序列seqidno:4(5’ccg-act-gtt-ggc-gct-ggg3’)的寡核苷酸,其5’端被nh2c6-基团改性,以便实现与二茂铁的共价键合。在用于检测丙型肝炎病毒的试验的背景下,靶向该病毒的寡核苷酸探针含有序列seqidno:5(5’tcaacttcgggaatctcaatgttag3’)的寡核苷酸,其5’端被nh2c6-基团改性,以便实现与二茂铁的共价键合。在用于检测赭曲霉毒素(ota)的试验的背景下,靶向该毒素的探针是序列seqidno:6(5’gatcgggtgtgggtggcgtaaagggagcatcggaca3’)的适体型的探针,其5’端被nh2c6-基团改性,以便实现与二茂铁的共价键合。-测量技术循环伏安法(cv)该分析在含有5mm[fe(cn)6]4-/5mm[fe(cn)6]3-对的0.1m的kcl中在-0.2至0.5v的电位范围内以50mv.s-1的扫描速率进行。阻抗谱(eis)该分析在含有5mm[fe(cn)6]4-/5mm[fe(cn)6]3-对的0.1m的kcl中进行。所有阻抗在0.2vvs.ag/agcl下在10mv的dc电位下获得,频率范围为100khz至0.1hz。方波伏安法(swv)该分析在通过0.22微米的膜过滤并在使用前储存在4℃下的含有10mm的na2hpo4、1.8mm的kh2po4、2.7mm的kcl和137mm的nacl的pbs(ph=7.4)中进行。swv分析在-0.3至0.4的电位范围内进行,调节时间为180s,频率为25hz,调制幅度为20mv。差动脉冲伏安法(dpv)该分析在通过0.22微米的膜过滤并在使用前储存在4℃下的含有10mm的na2hpo4、1.8mm的kh2po4、2.7mm的kcl和137mm的nacl的pbs(ph=7.4)中进行。该dpv分析在0.3至0.4v的电位范围内进行,扫描速率为50mv.s-1,脉冲高度为45mv,脉冲长度为0.05s。实施例1:含有g4pamam的检测系统-用g4pamam树枝状聚合物改性玻璃碳电极表面以50mv.s-1的扫描速率在一个循环过程中扫描0.0至1.1vvs.ag/agcl(作为参比电极)的电位通过cv法在含有0.5m的liclo4的水中产生g4pamam树枝状聚合物在玻璃碳电极上的共价键。在反应过程中,工作电极与对电极在含有200μl的50μmg4pamam溶液的低容量电池(basi)中分离。分子在表面上固定并用双蒸水仔细清洗电极后,进行cv和eis分析。-二茂铁氧化还原分子与序列seqidno:1的改性寡核苷酸的缔合被两个邻苯二甲酰亚胺基改性的二茂铁fc(nhp)2与树枝状聚合物缔合,其表面被改性。通过在环境温度下将电极浸没在二茂铁在乙腈中的1mm溶液中1小时来进行该反应。未键合的残余物用乙腈和双蒸水洗涤。该电极随后在环境温度下浸没在seqidno:1的改性的ssdna-c6nh2探针在pbs中制备的10μm溶液中1小时。该电极随后在蒸馏水和pbs中漂洗,为了饱和该二茂铁邻苯二甲酰亚胺酯,将其在环境温度下浸没在乙醇胺在pbs中的1mm溶液中30分钟。该检测系统随后用蒸馏水和pbs洗涤,随后在pbs中在4℃下储存直到使用。在构建该dna检测系统的各步骤之后,通过swv法测试表面改性。-与seqidno:2的互补寡核苷酸杂化通过在40℃下将电极浸没在合成dna溶液(seqidno:2)中1小时来进行与表面上缔合的seqidno:1的ssdna探针互补的15个碱基的杂化。用于该杂化的不同浓度为100fm、1pm、10pm、100pm、1nm、10nm和100nm。在每次培养后,该电极用蒸馏水和pbs仔细洗涤,随后通过swv法分析该电极。通过将该电极浸没在pbs中的1μm的非互补寡核苷酸(seqidno:3)中并在与相关合成dna分子(seqidno:2)相同的条件(40℃下1小时)下培养来进行对照试验。施加相同的条件以便检测源于pcr的样品,其预先在90℃下处理5分钟,以便将pcr后获得的双链dna“去”杂化。结果a)检测序列seqidno:2的相关合成dna分子通过swv法检测序列seqidno:2的相关合成dna分子。该检测系统在含有100fm至1nm不等的nda浓度的溶液中连续培养,并对各浓度进行swv分析。图3c显示随着各相关dna浓度,在0.11v下对应于二茂铁的电流升高。电流的这种变化与相关合成dna分子的浓度成比例。在相关dna的1pm溶液中培养该检测系统后,获得了相关dna分子检测过程中的第一个正信号,并引起10%的电流变化。并且,在100pm处观察到检测系统的饱和,电流变化为97%,这对应于二茂铁的氧化还原信号的改变。检测相关dna分子过程中电流的提高可解释为通过相关的合成互补dna分子(seqidno:2)与寡核苷酸探针seqidno:1的杂化以及通过使用g4pamam暴露了氧化还原分子。探针ssdna/相关合成互补dna分子(络合物或源于pcr样品)的取向改变导致了二茂铁与g4pamam之间电子转移的增加(图3a和3c)。b)检测源于pcr的相关dna分子根据上述方法制备包含g4pamam和序列seqidno:4的寡核苷酸探针的检测系统,以便检测源于pcr(cpcr)的由411个碱基组成的相关dna分子。在培养后,计算对应于二茂铁的电流变化。通过5次独立试验获得的变化值为86%。当该样品不含有其序列与cpcr相差一个核苷酸的产物ncpcr时,电流变化不超过7%(图3a和图3b)。这些结果表明,所述系统可以有效且特异性地检测相关dna分子,如结核分枝杆菌的相关dna分子,并区分耐受利福平的菌株。其可用于临床领域。实施例2:含有金纳米粒子的检测系统-金纳米粒子的改性以及它们在表面上的缔合2克(0.008摩尔)胱胺二盐酸盐溶解在20毫升5mnaoh(0.1m)中并用10毫升ch2cl2萃取。有机相用10毫升蒸馏水冲洗,在mgso4上干燥并在真空下浓缩。将溶解在双蒸水中的胱胺添加到1毫升金纳米粒子()的溶液中至50μm的最终浓度。该溶液在4℃下培养直到使用。对胱胺浓度以及培养时间进行优化,以便能够获得改性的非聚集金纳米粒子的孔(wells),用于通过紫外-可见光谱法和动态光散射来进行分析。在该反应后,用胱胺改性的金纳米粒子的样品(aunps-nh2)在14,000rpm下离心20分钟,以便除去胱胺残余物。丸粒随后用1毫升双蒸水冲洗两遍并离心,直到消除过量的胱胺。最后,将aunps-nh2样品溶解在300μl水中。100μl的aunps-nh2与100μl的n-(3-二甲基氨基丙基)-n’-乙基碳二亚胺盐酸盐/n-羟基琥珀酰亚胺溶液(10mm/10mm溶解在水中)混合,以便将aunps-nh2缔合到玻璃碳电极上。随后,将用羧酸-cooh基团改性的电极浸没在该混合物中,并在环境温度下培养2小时。测试不同的培养时间,2小时对检测系统的良好性能而言是最佳持续时间。用双蒸水仔细冲洗电极,随后通过eis测量进行分析。通过紫外-可见光谱法优化和监控胱胺对aunps的改性。5nm直径的aunps在520nm下吸收紫外光,而改性的aunps的吸收值提高,由此证实了反应的效力。-电沉积β-丙氨酸和乙醇胺通过以50mv.s-1的扫描速率扫描0.2至1.1vvs.ag/agcl(作为参比电极)的电位10次循环直到饱和,在含有0.5m的liclo4的水中产生β-丙氨酸在玻璃碳电极上的共价键。在反应过程中,工作电极与对电极在含有200μl的10mm的β-丙氨酸溶液的低容量电池(basi)中分离。该电极随后用双蒸水仔细冲洗。通过扫描0.2至1.1vvs.ag/agcl的电位3次循环,在相同条件下进行乙醇胺的表面饱和。用于该反应的乙醇胺浓度为1mm,在含有0.5m的liclo4的水中制备。分子在表面上固定并用双蒸水仔细清洗电极后,进行eis分析。-构建检测系统被两个邻苯二甲酰亚胺基团改性的二茂铁fc(nhp)2缔合在改性的aunps-nh2表面上。通过在环境温度下将电极浸没在二茂铁在乙腈中的1mm溶液中1小时来进行该反应。未键合的残余物用乙腈和双蒸水洗涤。该电极随后在环境温度下浸没在改性的dnaseqidno:1在pbs中制备的10μm溶液中1小时。在蒸馏水和pbs中漂洗该电极之后,将该电极在环境温度下浸没在乙醇胺在pbs中的1mm溶液中30分钟,以便饱和该二茂铁邻苯二甲酰亚胺酯。该检测系统随后用蒸馏水和pbs洗涤,随后在pbs中在4℃下储存直到使用。在构建该dna探针的各步骤之后,通过eis法监控表面改性。-与相关合成互补dna分子杂化通过在40℃下将电极浸没在seqidno:2的相关合成dna分子的溶液中1小时来进行相关合成互补dna分子与表面上缔合的ssdna探针的杂化。用于该杂化的不同浓度为100fm、1pm、10pm、100pm、1nm、10nm和100nm。在每次培养后,该电极用蒸馏水和pbs仔细洗涤,随后通过dpv法分析该电极。该pcr产物含有411个碱基,并根据与上述方法相同的方法在溶液中通过含有seqidno:4的pcr探针的检测系统进行检测。通过将电极浸没在pbs中的1μm非互补靶标中来进行对照测试,并在与相关的互补合成dna分子相同的条件下培养(40℃下1小时)。施加相同的条件以便检测源于pcr的样品。结果a)检测序列seqidno:2的相关合成dna分子通过swv法检测相关dna分子。该检测系统在含有100fm至1nm不等的dna浓度的溶液中连续培养,并对各浓度进行swv分析。图4c显示随着各相关互补dna浓度,在0.11v下对应于二茂铁的电流升高。电流的这种变化与相关合成dna分子(seqidno:2)的浓度成比例。在含有100fm的相关合成dna分子的溶液中培养该检测系统后,获得了相关合成dna分子检测过程中的第一个正信号,并引起10%的电流变化。并且,在100pm处观察到检测系统的饱和,电流变化为97%,这对应于二茂铁的变化。不过,在100pm至1nm的浓度下的分析可以用所用检测系统来进行(图4c)。b)用seqidno:4的寡核苷酸探针构建与实施例2a)中所述相同的检测系统,以便检测包含pcr产物的样品,所述pcr产物对应于结核分枝杆菌的突变rpob基因(cpcr)。当样品中存在该cpcr产物时,所述检测系统能够产生特异性电信号(图4a和4b)。所述系统能够特异性检测耐受利福平的结核分枝杆菌菌株。实施例3:含有金纳米粒子和g4pamam(g4-aunps)的检测系统-用g4pamam树枝状聚合物改性玻璃碳电极表面以50mv.s-1的扫描速率在一个循环过程中扫描0.0至1.1vvs.ag/agcl(作为参比电极)的电位通过cv法在含有0.5m的liclo4的水中产生g4pamam树枝状聚合物在玻璃碳电极上的共价键。在反应过程中,工作电极与对电极在含有200μl的50μmg4pamam溶液的低容量电池(basi)中分离。分子在表面上固定并用双蒸水仔细清洗电极后,进行cv和eis分析。-用g4pamam树枝状聚合物和aunps改性玻璃碳电极表面.构建该检测系统的第一步骤是在玻璃碳电极表面电沉积g4pamam树枝状聚合物。以50mv.s-1的扫描速率在一个循环过程中扫描0.0至1.1vvs.ag/agcl(作为参比电极)的电位通过cv技术进行该电沉积。在该氧化反应过程中,该树枝状聚合物的胺基团形成–nh·+阳离子自由基,其与含碳表面的c=c芳族基团相互作用。-金纳米粒子的改性以及它们在表面的缔合2克(0.013摩尔)胱胺二盐酸盐溶解在20毫升5mnaoh(0.1m)中并用10毫升ch2cl2萃取。有机层用10毫升蒸馏水冲洗,在mgso4上干燥并在真空下浓缩。将溶解在双蒸水中的胱胺添加到1毫升金纳米粒子(od=0.4)的溶液中至50μm的最终浓度。该溶液在4℃下培养直到使用。在该反应后,用胱胺改性的金纳米粒子的样品(aunps-nh2)在14,000rpm下离心20分钟,以便除去胱胺残余物。丸粒随后用1毫升双蒸水冲洗两遍并离心,直到消除过量的胱胺。最后,将aunps-nh2样品溶解在300μl水中。-aunps与g4pamam树枝状聚合物的缔合为了将aunps-nh2缔合到由g4pamam树枝状聚合物改性的玻璃碳电极上,戊二醛用作连接剂(link)。由g4pamam树枝状聚合物改性的电极浸没在0.5%戊二醛溶液中20分钟,随后仔细冲洗。随后,该电极在环境温度下在100μl的aunps-nh2中培养2小时。测试不同的培养时间,2小时对检测系统的良好性能而言是最佳持续时间。用双蒸水仔细冲洗电极,随后通过cv和eis测量进行分析。-二茂铁氧化还原分子与ssdna探针的缔合通过两个邻苯二甲酰亚胺基团改性的二茂铁fc(nhp)2与aunps-nh2缔合,其表面被改性。通过在环境温度下将电极浸没在二茂铁在乙腈中的1mm溶液中1小时来进行该反应。未键合的残余物用乙腈和双蒸水洗涤。该电极随后在环境温度下浸没在ssdna-c6nh2探针在pbs中制备的10μm溶液中1小时。该电极随后在蒸馏水和pbs中漂洗,并在环境温度下浸没在乙醇胺在pbs中的1mm溶液中30分钟,以便饱和该二茂铁邻苯二甲酰亚胺酯。该检测系统随后用蒸馏水和pbs洗涤,随后在pbs中在4℃下储存直到使用。在构建该dna检测系统的各步骤之后,通过swv法监控表面改性。-与序列seqidno:2的相关合成dna分子杂化通过在40℃下将电极浸没在相关合成dna分子的溶液中1小时来进行相关合成dna分子(seqidno:2)与表面上缔合的ssdna探针seqidno:1的杂化。用于该杂化的不同浓度为100fm、1pm、10pm、100pm、1nm、10nm和100nm。在每次培养后,该电极用蒸馏水和pbs仔细洗涤,随后通过swv法分析该电极。通过将该电极浸没在pbs中的1μm的序列seqidno:3的相关非互补dna分子中并在与相关dna分子相同的条件(40℃下1小时)下培养来进行对照试验。施加相同的条件以便检测源于pcr的样品。结果a)检测相关的合成dna分子通过swv法检测序列seqidno:2的相关dna分子。该检测系统在含有100fm至1nm不等的dna浓度的溶液中连续培养,并对各浓度进行swv分析。图5c显示在相关合成dna分子seqidno:2的各个浓度下,在0.11v处对应于二茂铁的电流升高。电流的这种变化与相关合成dna分子的浓度成比例。在相关dna分子seqidno:2的1pm溶液中培养该检测系统后,获得了相关dna分子seqidno:2检测过程中的第一个正信号,并引起10%的电流变化。并且,在100pm处观察到检测系统的饱和,电流变化为97%,这对应于二茂铁的改变。但是,在100pm至1nm的浓度下的分析对所用检测系统是可行的(图5c)。b)用seqidno:4的寡核苷酸探针构建与实施例2中所述相同的检测系统,以便检测包含pcr产物的样品,所述pcr产物对应于结核分枝杆菌的突变rpob基因(cpcr)。当样品中存在该cpcr产物时,所述检测系统能够产生特异性电信号(图5a和5b)。c)用序列seqidno:5的寡核苷酸探针构建与实施例3a)中所述相同的检测系统,以便检测丙型肝炎病毒的合成dna的样品。所述检测系统能够在合成dna分子的存在下产生电信号(图6)。所述系统由此能够检测丙型肝炎病毒。下表i总结了根据前述不同实施例获得的检测范围:检测系统动态范围线性范围定量限pamam1pm–100pm1pm–10pm1pmaunps100fm–1nm1pm–1nm100fmpamam-aunps100fm–10nm100fm–10nm100fm表i实施例4:用包含g4pamam的检测系统检测赭曲霉毒素a(ota)用序列seqidno:6的适体探针构建与实施例1中所述相同的检测系统,以便检测如牛奶或葡萄酒的、基质复杂的食品样品中存在或不存在ota。所述检测系统能够在ota的存在下产生电信号(图7a和7b)。所述系统由此能够检测ota毒素。另一适体非特异性毒素如otb的存在未被检测到(图7b)。实施例5:用含有g2pamam的检测系统检测ota-用g2pamam树枝状聚合物改性玻璃碳电极表面以50mv.s-1的扫描速率在一个循环过程中扫描0.0至1.1vvs.ag/agcl(作为参比电极)的电位通过cv法在含有0.5m的liclo4的水中产生g2pamam树枝状聚合物在玻璃碳电极上的共价键。在反应过程中,工作电极与对电极在含有200μl的50μmg2pamam溶液的低容量电池(basi)中分离。分子在表面上固定并用双蒸水仔细清洗电极后,进行cv和eis分析。-萘醌氧化还原分子与g2pamam的缔合通过丙酸改性的萘醌与该树枝状聚合物缔合。使用1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)作为偶联剂,通过丙酸与该树枝状聚合物表面上的胺官能团之间的肽偶联进行该反应。为了验证氧化还原分子对树枝状聚合物表面的良好接枝,分析该信号,并显示出固定在该表面上的氧化还原分子电位(-0.22v)的强峰。-序列seqidno:6的改性的寡核苷酸探针与g2pamam的缔合该电极在对ota为特异性的在其5’端位置通过cooh基团改性的适体dna溶液中培养。该适体通过表面胺与适体的位置5’处的酸官能团之间的肽偶联共价接枝到树枝状聚合物表面;该反应的持续时间为1小时。清洗该表面,随后在pbs缓冲溶液中稳定并测量信号(图8)。为了验证适体形式的seqidno:6的寡核苷酸探针与树枝状聚合物表面的良好接枝,分析由该氧化还原分子发出的信号,并显示了固定在该表面上的氧化还原分子的电位(-0.22v)的显著降低。-使ota与含有g2pamam的检测系统接触使ota与所制备的检测系统接触1小时,随后清洗该表面。结果使用上述检测系统,以检测如牛奶或葡萄酒的、基质复杂的食品样品中存在或不存在ota。分析萘醌信号(图8)表明在-0.22v的电位处信号增加,这是由于ota与其seqidno:6的互补适体之间的互补键造成的氧化还原分子的暴露。换句话说,含有g2pamam的所述检测系统能够在存在ota毒素的情况下产生电信号。实施例6:用包含磁性纳米粒子的检测系统检测ota使用由壳聚糖改性的磁性纳米粒子作为纳米材料构建与实施例5中所述相同的检测系统,以检测如牛奶或葡萄酒的、基质复杂的食品样品中存在或不存在ota。该磁性纳米粒子是尺寸为10nm至100nm的氧化铁(fe3o4)的磁性纳米粒子,并用常规合成方法获得,随后通过壳聚糖改性以赋予其阳离子性。分析萘醌信号(图9)表明在-0.4v的电位处信号增加,这是由于ota与seqidno:6的其互补适体之间的互补键造成的氧化还原分子的暴露。换句话说,含有用壳聚糖改性的磁性纳米粒子的所述检测系统能够在存在ota毒素的情况下产生电信号。实施例7:用含有壳聚糖纳米粒子的检测系统检测ota使用壳聚糖微球作为纳米材料构建与实施例6中所述相同的检测系统,以检测如牛奶或葡萄酒的、基质复杂的食品样品中存在或不存在ota。分析萘醌信号(图10)表明在-0.22v的电位处信号增加,这是由于ota与seqidno:6的其互补适体之间的互补键造成的氧化还原分子的暴露。换句话说,含有壳聚糖微球的所述检测系统能够在存在ota毒素的情况下产生电信号,尽管信号的变化不如先前明显。但是,优化这些壳聚糖微球的尺寸能够获得信号的更大变化。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1