测试装置和其制备方法、测试方法和测试套装以及用于制备测试装置的转印介质与流程
本发明涉及测试装置和其制备方法、测试方法和测试套装以及用于制备测试装置的转印介质。
背景技术:
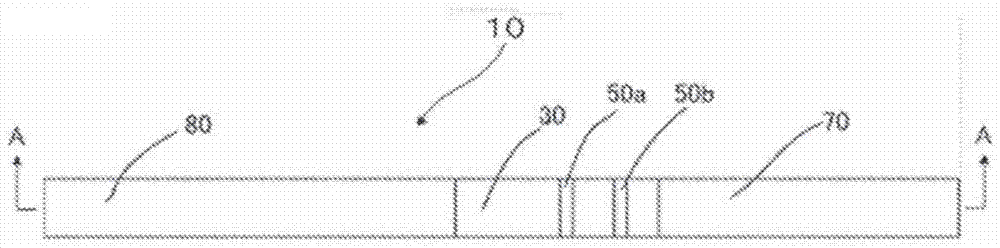
迄今,为测试分析物如血液、dna、食品和饮料,采用其中形成用于流动分析物的流路的测试装置。在测试装置中,能够检测目标核酸的用于核酸检测的侧向流动色谱装置可通过检查可归因于病毒或细菌的核酸(dnas和rnas)是否存在或可归因于特定疾病或体质相关突变基因的核酸是否存在,准确地诊断例如感染性疾病、遗传性疾病如肿瘤、和体质(predispositions)。用于核酸检测的侧向流动色谱装置还用于检测过敏原或特定食品的食品检验和检测环境中存在的微生物的环境勘测。例如,已提出能够检测目标核酸的用于核酸检测的侧向流动色谱装置,其利用:涂布捕捉核酸(capturenucleicacid)的检测部分,该捕捉核酸包括与目标核酸互补的序列;和可与目标核酸结合的标识体(参见,例如,ptl1和2)。引用列表专利文献ptl1:日本未审结专利申请公开号2001-157598ptl2:pct国际申请公开号jp-t-2005-503556的日译文技术实现要素:技术问题本发明的一个目的是提供能够进行高灵敏度测量和获得清晰判定线的目标核酸测试装置。问题解决方案根据本发明的一个方面,测试装置包括多孔流路部件,其构成测试目标液流过的流路;在流路部件上提供的测试目标液滴落部分;标记部分(labelingportion),其被配置以在滴落到测试目标液滴落部分上的测试目标液包含目标核酸时向目标核酸施加标识(label);和检测部分,其被配置以检测在标记部分处被标记的目标核酸。测试装置包括在流路部件上在检测部分处的成形体(shapedbody)。包括与目标核酸能结合和互补的序列的捕捉核酸通过共价结合被固定至成形体和流路部件之间的成形体表面。发明有利效果本发明可提供能够进行高灵敏度测量和获得清晰判定线的目标核酸测试装置。附图说明[图1]图1是示例本发明的测试装置的实例的顶视图。[图2]图2是图1测试装置沿直线a-a截取的示意性横截面视图。[图3]图3是部分放大横截面视图,描绘了在核酸用作标识体(1abelbody)时第一检测部分和流路部件彼此接触的部分。[图4]图4是部分放大横截面视图,描绘了在抗体用作标识体时第一检测部分和流路部件彼此接触的部分。[图5]图5是部分放大视图,描绘了第二检测部分和流路部件彼此接触的部分。[图6]图6是现有测试装置的膜的概念图。[图7]图7是横截面视图,示例了用于本发明测试装置的转印介质的层配置实例。[图8]图8是示例本发明测试套装实例的概念图。[图9]图9是顶视图,示例了比较例1或比较例101的测试装置实例。[图10]图10是图9测试装置沿直线b-b截取的示意性横截面视图。具体实施方式(测试装置)本发明的测试装置包括多孔流路部件,其构成测试目标液流过的流路;在流路部件上提供的测试目标液滴落部分;标记部分,其被配置以在滴落到测试目标液滴落部分上的测试目标液包含目标核酸时向目标核酸施加标识;和检测部分,其被配置以检测在标记部分处被标记的目标核酸。测试装置包括在流路部件上在检测部分处的成形体。包括与目标核酸能结合和互补的序列的捕捉核酸通过共价结合被固定至成形体和流路部件之间的成形体表面。测试装置按需进一步包括其它部件。本发明的测试装置基于来自用于核酸检测的现有侧向流动色谱装置以下发现。即,在用于核酸检测的现有侧向流动色谱装置中,由于诸如捕捉核酸的试剂(reagent)和诸如标记指示物和检测指示物的试剂被固定至流路部件中的纤维,由为了提高分析物传布速度而任意选择的材料形成的流路部件可与诸如标记核酸和标记指示物的试剂具有过强的相互作用并且可能不能使试剂传布(spread)或可与诸如核酸和检测指示物的试剂具有过弱的相互作用并且可能不能使被捕捉的分析物固定。本发明的测试装置还基于以下发现:虽然捕捉核酸扩散性地存在于形成流路部件的亲水性多孔材料中——因为溶解捕捉核酸的液体在判定线如测试线和控制线(对照线,controlline)形成过程中被直接涂布在流路部件上,但捕捉核酸具有小分了量并且可高速扩散从而使判定线如测试线和控制线模糊,或导致判定线颜色不均匀,从而具体地使判定线的轮廓不清晰,或与亲水性多孔材料中存在的捕捉核酸结合的标记颗粒如金胶体颗粒造成的显色因光散射而不能被实际感测,即,大部分捕捉核酸不被有效使用。<流路部件>测试装置的流路部件没有具体限制并且可被适当选择,只要流路部件是能够使测试目标液流过流路部件的多孔部件。流路部件的实例包括亲水性多孔材料。由亲水性多孔材料形成的流路部件包含空隙。流路在测试目标液流过空隙时形成。优选亲水性多孔材料中存在小室,并且小室连接在一起以形成连续的小室。连续小室区别于不连接在一起的独立小室。连续小室具有通过毛细作用吸入液体或使气体通过连续小室的功能——因为连续小室具有小室之间的壁中的小孔。流路部件无需外部致动装置如泵,因为流路部件被配置以通过经空隙利用毛细作用递送测试目标液。流路部件中的传布速度没有具体限制并且可根据意图目的被适当选择。亲水性多孔材料没有具体限制并且可根据意图目的被适当选择。然而,优选使用具有亲水性和高空隙率的材料。亲水性多孔材料指代可容易被水溶液渗透的多孔材料。在水渗透性评价测试(其中0.01ml纯水滴落到在于120℃下干燥1小时的亲水性多孔材料的板状测试件表面上)中0.01ml纯水在10分钟内全部渗透测试件的亲水性多孔材料被称为可容易渗透的。亲水性多孔材料的空隙率没有具体限制,可根据意图目的被适当选择,并且优选是40%以上但90%以下,更优选65%以上但80%以下。当亲水性多孔材料的空隙率为90%以下时,亲水性多孔材料可保持作为流路部件的强度。当亲水性多孔材料的空隙率为40%以上时,测试目标液的渗透性不受影响。亲水性多孔材料的空隙率可基于亲水性多孔材料的基重(g/m2)和平均厚度(微米)和亲水性多孔材料组分的比重根据下列计算式1计算。<计算式1>空隙率(%)={1-[基重(g/m2)/平均厚度(微米)/组分的比重]}×100亲水性多孔材料没有具体限制并且可根据意图目的被适当选择。亲水性多孔材料的实例包括滤纸、普通纸、无木质纸、水彩画纸、肯特纸、合成纸、合成树脂膜、具有涂布层的专用纸、织物、纺织品、膜、无机基材、和玻璃。织物的实例包括人造纤维如人造丝、本伯格铜铵丝(bemberg)、乙酸酯、尼龙、聚酯、和维纶、天然纤维如棉和丝、这些织物的掺混织物、和这些织物的无纺织物。在这些亲水性多孔材料中,优选滤纸,因为滤纸具有高空隙率和有利的亲水性。当测试装置用作核酸检测的侧向流动色谱装置时,优选滤纸作为纸层析的静态床。亲水性多孔材料的形状没有具体限制并且可根据意图目的被适当选择。然而,片材形状是优选的。亲水性多孔材料的平均厚度没有具体限制,可根据意图目的被适当选择,并且优选是0.01mm以上但0.3mm以下。当亲水性多孔材料的平均厚度为0.01mm以上时,亲水性多孔材料可保持作为流路部件的强度。当亲水性多孔材料的平均厚度为0.3mm以下时,可节省测试目标液的需要量。在本发明中,厚度可被限定为制品沿基础材料和流路部件彼此接触的接触平面的垂直方向的长度。<测试目标液滴落部分>测试目标液滴落部分没有具体限制并且可根据意图目的被适当选择,只要测试目标液滴落部分形成在测试目标液滴落在流路部件上的位置处并且能够将测试目标液供给流路。测试目标液滴落部分可选自已知的材料。<标记部分>标记部分是被配置以在滴落到测试目标液滴落部分上的测试目标液包含目标核酸时将标识施加至目标核酸的部分。优选标记部分中包含的标识体包含与目标核酸互补的单链核酸片段,并且目标核酸通过目标核酸和标识体之间的杂交被标记。优选标记部分中包含的标识体包含与目标核酸或与目标核酸结合的化合物或蛋白质具有结合性的抗体,并且目标核酸通过目标核酸和标识体之间的抗体-抗原反应被标记。-标识体-标识体没有具体限制并且可根据意图目的被适当选择,只要标识体可与目标核酸结合。标识体的实例包括包含与目标核酸互补的序列的核酸、和针对标记有测试目标液中的目标核酸的化合物或针对与测试目标液中的目标核酸形成复合物的蛋白质的抗体。当使用核酸时,核酸的碱基序列和长度可根据意图目的来选择。当使用抗体时,针对抗原的抗体可根据意图目的来选择。优选核酸和抗体包含标识。优选的实例是金胶体标记的核酸。用于标记核酸和抗体的颗粒不具体限于金胶体,而可根据意图目的被适当选择。颗粒实例包括金属胶体、包含酶的酶标记颗粒、包含色素的着色颗粒、包含荧光物质的荧光颗粒、和包含磁体的磁体包封颗粒。核酸的种类没有具体限制,只要核酸是单链的。核酸的实例包括脱氧核糖核酸(dna)、核糖核酸(rna)、和肽核酸(pna)。常用具有5个碱基至60个碱基的碱基长度的核酸。具有10个碱基至40个碱基的碱基长度的核酸是优选的。核酸的碱基序列没有具体限制,只要碱基序列与目标核酸互补。然而,与固定至检测部分的捕捉核酸不同的序列是优选的。核酸可直接通过官能团、或借助亲和素-生物素、链霉亲和素-生物素、中性亲和素-生物素、抗生物素抗体-生物素、半抗原-抗半抗原抗体、和地高辛配基-抗地高辛配基抗体的结合性,与标记物质如金胶体结合。抗体可通过吸附与标记物质如金胶体结合,或可通过官能团结合。当核酸用作标识体时,目标核酸与捕捉核酸结合的位点和目标核酸与标识体结合的位点可根据意图目的如特异性和检测温度被适当选择。优选从与捕捉核酸结合的位点一端至与标识体结合的位点一端的长度为50个碱基以下,更优选20个碱基以下,和还更优选10个碱基以下。<检测部分>检测部分是被配置以检测在标记部分被标记的目标核酸的部分。成形体在流路部件上在检测部分处被提供。包括与目标核酸能结合和互补的序列的捕捉核酸通过共价结合被固定至成形体和流路部件之间的成形体表面。优选成形体被提供在流路部件上、检测部分处,并且包括与目标核酸能结合和互补的序列的捕捉核酸通过连接体结合至成形体和流路部件之间的成形体表面。多个检测部分可被设置在流路部件上,并且固定至该多个检测部分的捕捉核酸可具有不同的序列。成形体被提供在流路部件上、检测部分处。包括与目标核酸能结合和互补的序列的捕捉核酸通过共价结合被固定至成形体和流路部件之间的成形体表面。-成形体-作为成形体,包括与目标核酸能结合和互补的序列的捕捉核酸通过共价结合被固定至成形体和流路部件之间的成形体表面。作为成形体,优选包括与目标核酸能结合和互补的序列的捕捉核酸通过连接体与成形体和流路部件之间的成形体表面结合。作为成形体,优选包括与目标核酸能结合和互补的序列和间隔体的捕捉核酸被固定至成形体和流路部件之间的成形体表面。成形体没有具体限制并且可根据意图目的被适当选择,只要成形体是由树脂形成的成形体。优选捕捉核酸通过共价结合被固定至流路部件面临侧的成形体表面。还优选捕捉核酸通过连接体结合至流路部件面临侧的成形体表面。在捕捉核酸固定至流路部件面临侧的成形体表面的情况下,可以控制成形体与测试目标液之间和捕捉核酸与目标核酸之间的亲和力。作为调节亲和力的方法,有下列方法:例如,根据相关目标核酸,改变构成成形体的树脂的种类或构成成形体的树脂的组成比例。--通过连接体结合--连接体是为使捕捉核酸固定至成形体而结合的分子。通过连接体结合(交联)没有具体限制并且可根据意图目的被适当选择,只要捕捉核酸可通过该连接体被固定至成形体。通过连接体结合的实例包括共价结合、配位结合、金属结合、离子结合、氢结合、和范德华结合。在这些结合种类中,在键合强度方面优选共价结合。--树脂--构成成形体的树脂没有具体限制并且可根据意图目的被适当选择,只要该树脂具有与捕捉核酸具有结合性的官能团。然而,优选水不溶性树脂。当使用水不溶性树脂时,可防止水不溶性树脂在测试目标液中溶解。这可以防止流路被堵塞和判定线如控制线和测试线变模糊。优选成形体和捕捉核酸具有彼此具有结合性的官能团。与捕捉核酸具有结合性的成形体官能团的实例包括羧基、酸酐、活性酯基团、醛基团、异氰酸基、异硫氰酸基、甲苯磺酰基、吡啶基二硫基团、溴乙酰基、羟基、氨基、环氧基团、巯基、马来酰亚胺基团、乙烯基砜基团、氨氧基乙酰基、重氮基团、碳二亚胺基团、乙烯基、硝基、砜基团、琥珀酰亚胺基团、酰肼基团、叠氮基、磷酸基团、吖内酯基团、腈基团、酰胺基团、亚氨基、氮烯基团、乙酰基、磺酰氯基团、酰基叠氮基团、酐基团、氟苯基团、碳酸基、酰亚胺酯基团、环氧化物基团、和氟苯基酯基团。这些官能团中的一种可单独使用,或这些官能团中的两种或更多种可组合使用。活性酯基团指代具有高反应性的酯基团。活性酯基团的具体实例包括p-硝基苯基酯基团、n-羟基琥珀酰亚胺酯基团、n-羟基磺基琥珀酰亚胺酯基团、琥珀酸酰亚胺酯基团、苯二甲酸酰亚胺酯基团、和5-降冰片烯-2,3-二羧基酰亚胺酯基团。这些活性酯基团中的一种可单独使用,或这些活性酯基团中的两种或更多种可组合使用。在官能团中,羧基、酸酐、活性酯基团、醛基团、异氰酸基、异硫氰酸基、甲苯磺酰基、吡啶基二硫基团、溴乙酰基、羟基、氨基、环氧基团、马来酰亚胺基团、和巯基是优选的,并且羧基、氨基、羟基、活性酯基团、和马来酰亚胺基团是特别优选的。成形体仅需至少在面临流路部件的成形体表面上具有官能团。可以使用其中通过已知的表面处理方法引入官能团的成形体。在这种情况下,树脂实例包括热塑性树脂和热固性树脂。在这些树脂中,热塑性树脂在生产效率方面是优选的。热塑性树脂的实例包括:直链聚烯烃如聚苯乙烯(ps)树脂、聚乙烯(pe)树脂、和聚丙烯(pp)树脂、环状聚烯烃、乙烯-乙酸乙烯酯(eva)共聚树脂、丙烯腈-苯乙烯(as)共聚树脂、丙烯酸酯聚合(丙烯酸)树脂、甲基丙烯酸酯聚合(丙烯酸)树脂、甲基丙烯酸甲酯(pmma)树脂、聚酰胺(pa)树脂、和聚碳酸酯(pc)树脂;酯树脂,如聚对苯二酸乙二醇酯(pet)树脂和聚对苯二酸丁二醇酯(pbt)树脂;和乙酸纤维素(ca)树脂、环烯烃(co)系树脂、亚胺树脂、乙烯亚胺树脂、和环氧树脂。这些热塑性树脂中的一种可单独使用,或这些热塑性树脂中的两种或更多种可组合使用。树脂以外的构成成形体的化合物的实例包括:天然蜡,如蜂蜡、巴西棕榈蜡、鲸蜡(cetaceum)、日本牛脂、小烛树蜡、米糠蜡、和蒙旦蜡;合成蜡,如石蜡、微晶蜡、氧化物蜡、地蜡、提纯地蜡、酯蜡、聚乙烯蜡、和聚氧化乙烯蜡;高级脂肪酸,如珠光脂酸、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、糠酸、和山嵛酸;高级醇,如硬脂醇和山嵛醇;酯,如山梨糖醇酐的脂肪酸酯;和酰胺,如硬脂酰胺和油酰胺。这些化合物中的一种可单独使用,或这些化合物中的两种或更多种可组合使用。在树脂和树脂以外的化合物中,丙烯酸树脂、聚苯乙烯树脂、聚烯烃树脂、酯树脂、环氧树脂、乙烯亚胺树脂、巴西棕榈蜡、和聚乙烯蜡在使用目的方面是优选的。成形体的表面处理方法没有具体限制并且可根据意图目的被适当选择。例如,为将羧基或羟基引入成形体表面,可采用诸如等离子体处理、电晕放电处理、火焰处理、和紫外线照射处理的方法。在这些方法中,在氧气气氛下的等离子体处理和电晕放电处理在高反应效率方面是优选的。为将氨基引入成形体表面,例如,可采用诸如在氮气气氛下的等离子体处理和氨基烷基硅烷处理的方法。在这些方法中,在氮气气氛下的等离子体处理在处理容易和均匀性方面是优选的。优选成形体是非多孔体。非多孔体指代基本上不含空隙的非多孔结构、和与多孔材料如包含空隙(被提供以促进液体吸收)的膜相反的结构。因此,例如,仅包含在制备过程中不经意地混合在材料中并且对液体吸收作用的促进无贡献的极少小室的材料被包括在非多孔体之内。接下来将描述成形体是非多孔体时本发明所用成形体的特征。迄今为止,判定线如测试线和控制线是通过在由亲水性多孔材料形成的流路部件上直接涂布溶解有捕捉核酸的液体而形成的。因此,捕捉核酸随液体渗透一起同心地在多孔材料内快速扩散,因为捕捉核酸一般是包括约5个碱基至约60个碱基并且具有小分子量的单链核酸。这容易使判定线如测试线和控制线模糊或导致判定线的颜色不均匀,并且具体地使线轮廓不清晰。此外,与多孔材料中存在的捕捉核酸结合的标记颗粒如金胶体颗粒造成的显色因光散射不能被实际感测。这意味着大多数捕捉核酸不被有效使用。总体上,由多孔材料可感测的显色颗粒是距多孔材料表面约5微米深度之处或之上存在的颗粒。为将测试所需的捕捉核酸固定至5微米深度之处或之上的区域,需要涂布大量捕捉核酸——考虑到捕捉核酸沿厚度方向的扩散。即,捕捉核酸的涂布量与多孔材料的厚度成比例地增加。同时,在本发明中,当由包含多个疏水性基团的非多孔体形成的树脂成形体用于固定捕捉核酸时,捕捉核酸仅被固定至成形体表面,而不进入树脂成形体内部。标记颗粒与固定至成形体表面的捕捉核酸结合时显色。颜色可通过由不散射光的非多孔体形成的成形体被感测。这显著提高了标记颗粒造成的显色的利用效率。由于在厚度方向上没有显色颗粒浪费,存在可显著节省捕捉核酸涂布量的优点。例如,当假设由亲水性多孔材料形成的流路部件的厚度为100微米并且仅可利用来自距流路部件表面5微米深度之处和之上区域的显色时,在本发明中用于获得相同显色强度的捕捉核酸量可减少至1/20。因此,在本发明中,当由包含多个疏水性基团的非多孔体形成的成形体被用于固定捕捉核酸时,标记颗粒造成的显色的利用效率可显著提高,并且捕捉核酸的涂布量可相对于迄今使用量减少,因为在厚度方向上没有显色颗粒浪费。优选成形体被固定在流路部件上。固定成形体的方法没有具体限制,只要该方法将成形体以如下状态固定:能够实现捕捉核酸和测试目标液在测试过程中彼此接触。方法实例包括利用例如热转印印制机(printer)将成形体的树脂成分热转印到流路部件上的方法、对成形体的树脂成分施压和用例如点击式印制机转印树脂的方法、和利用例如胶带、粘合剂、增粘剂在流路部件上粘帖成形体的树脂成分的方法。-连接体-连接体仅需在连接体一端包含与成形体前表面上存在的官能团具有反应性的官能团,和在连接体另一端包含与引入捕捉核酸中的官能团具有反应性的官能团。连接体的强度可根据意图目的被适当选择。连接体可以是包含单个官能团并且具有连续与成形体前表面上存在的官能团和与引入捕捉核酸的官能团反应的反应性的连接体。间隔体可被插入连接体的2个官能团之间。官能团之间的距离优选是至少3埃(0.3nm),更优选3埃(0.3nm)至35埃(3.5nm),还更优选3埃(0.3nm)至25埃(2.5nm)。当官能团之间距离长时,优选间隔体是水溶性树脂,从而不抑制目标核酸和捕捉核酸之间的结合。与成形体和捕捉核酸具有结合性的官能团没有具体限制并且可根据意图目的被适当选择。官能团实例包括羧基、酸酐、活性酯基团、醛基团、异氰酸基、异硫氰酸基、甲苯磺酰基、吡啶基二硫基团、溴乙酰基、羟基、氨基、环氧基团、巯基、马来酰亚胺基团、乙烯基砜基团、氨氧基乙酰基、重氮基团、碳二亚胺基团、乙烯基、硝基、砜基团、琥珀酰亚胺基团、酰肼基团、叠氮基团、磷酸基团、吖内酯基团、腈基团、酰胺基团、亚氨基、氮烯基团、和乙酰基。这些官能团中的一种可单独使用或这些官能团中的两种或更多种可组合使用。活性酯基团指代具有高反应性的酯基团。活性酯基团的具体实例包括p-硝基苯基酯基团、n-羟基琥珀酰亚胺酯基团、琥珀酸酰亚胺酯基团、苯二甲酸酰亚胺酯基团、和5-降冰片烯-2,3-二羧基酰亚胺酯基团。在官能团中,羧基、酸酐、活性酯基团、醛基团、异氰酸基、异硫氰酸基、甲苯磺酰基、吡啶基二硫基团、溴乙酰基、羟基、氨基、环氧基团、马来酰亚胺基团、和巯基是优选的,并且羧基、氨基、活性酯基团、和马来酰亚胺基团是特别优选的。水溶性树脂的实例包括聚乙二醇(peg)、单链dna、由rna或pna形成的多核苷酸、和多肽。优选连接体一端包含n-羟基琥珀酸酰亚胺酯基团并且通过酰胺结合与成形体表面上的氨基结合。优选连接体一端包含马来酰亚胺基团并且通过硫醚结合与巯基捕捉核酸5’端或3’端引入的结合。优选原子存在于连接体的n-羟基琥珀酸酰亚胺酯基团和马来酰亚胺基团之间,并且n-羟基琥珀酸酰亚胺酯基团和马来酰亚胺基团间隔至少3埃(0.3nm)。gmbs(包含n-羟基琥珀酸酰亚胺酯基团和马来酰亚胺基团的连接体的实例)的结构式展示如下。[化学1]在结构式中,由于连接体中n-羟基琥珀酸酰亚胺酯基团和马来酰亚胺基团之间的化学键距离,箭头指示的n-羟基琥珀酸酰亚胺酯基团中的碳原子和箭头指示的马来酰亚胺基团中的碳原子之间的距离为至少3埃(0.3nm)。优选连接体中n-羟基琥珀酸酰亚胺酯基团和马来酰亚胺基团之间的距离为3埃(0.3nm)至35埃(3.5nm),更优选3埃(0.3nm)至25埃(2.5nm)。通过实验,优选n-羟基琥珀酸酰亚胺酯基团和马来酰亚胺基团之间的距离为至少7.3埃(0.73nm),更优选7.3埃(0.73nm)至32.5埃(3.25nm),还更优选7.3埃(0.73nm)至24.6埃(2.46nm)。优选连接体在n-羟基琥珀酸酰亚胺酯基团和马来酰亚胺基团之间包含聚乙二醇(peg)。-间隔体-间隔体是插入在中间以确保间距(距离)的分子。构成间隔体的分子的种类没有具体限制并且可根据意图目的被适当选择。优选捕捉核酸中的间隔体被插入以位于成形体和与目标核酸能结合和互补的序列之间。当间隔体位于成形体和与目标核酸能结合和互补的序列之间时,捕捉核酸与目标核酸和标识体的结合效率得到提高,并且序列特异性也得到提高。优选间隔体由烷基形成、或由烷基和磷酸基团形成。这种间隔体的实例包括以下结构式表示的间隔体。[化学2]优选间隔体中的烷基是包含2至12个碳原子的直链烷基。优选间隔体由烷基、四氢呋喃基团、和磷酸基团形成。这种间隔体的实例包括以下结构式表示的间隔体。[化学3]优选间隔体中包括的主链中的原子数为10至40。间隔体优选是以下方通式i表示的间隔体。<通式i>[化学4]在通式i中,r1表示取代的或未取代的亚烷基,r2表示取代的或未取代的亚烷基,n表示整数,并且r2表示的取代亚烷基是具有环状结构的亚烷基。优选r1和r2表示的未取代亚烷基中的碳原子数为2至24,以及r2表示的取代亚烷基中的碳原子数为4。n是优选20以下,更优选0至5的整数。间隔体没有具体限制并且可根据意图目的被适当选择,只要间隔体包含适当的原子数和具有水溶性。核酸如dna通常通过固相合成而合成。例如,dna在被称为cpg的多孔固相上合成。在dna链的3’端固定至cpg的情况下,dna通过沿5′方向逐一连接碱基而延长。各连接步骤通过相继结合一个核(以亚磷酰胺衍生化的dna单体)进行。反应性亚磷酰胺与核苷的3′-oh基团结合,并且二甲氧基三苯甲基基团(即保护基团)与核苷的5′-oh基团结合。二甲氧基三苯甲基基团的去除、包含目的碱基的核苷的连接、和未反应部分的封端反复进行。这使亚磷酰胺和核苷的5′-oh基团彼此反应而延长。存在市售的以亚磷酰胺衍生化的间隔体分子(单体),其具有与核酸固相合成中的延长反应相同方式的反应性。这些间隔体分子在多功能性方面适于间隔体。优选的实例包括:由直链烷基和磷酸基团形成的连接体,如包含2个碳原子的c2连接体、包含3个碳原子的c3连接体、包含4个碳原子的c4连接体、包含6个碳原子的c6连接体、包含9个碳原子的c9连接体、和包含12个碳原子的c12连接体;和由聚乙二醇和磷酸基团形成的间隔体9和间隔体18。优选的实例进一步包括由四氢呋喃基团和磷酸基团形成的1,2-二脱氧核糖(d间隔体)和脱氧-d-核糖(r间隔体)。具体地,c2连接体、c3连接体、c4连接体、d间隔体、和r间隔体是优选的,并且c3连接体和d间隔体是更优选的。这些间隔体可单独或组合使用。<c3连接体>[化学5]<d间隔体>[化学6]间隔体的分子长度没有具体限制,并且可根据意图目的被适当选择和调节。核酸通过固相合成而合成。因此,当捕捉核酸包含引入的官能团时,通常将由烷基形成的间隔体插入官能团和核酸之间。以下化学式表示其中包含羧基作为官能团的捕捉核酸与成形体结合的实例。[化学7]在本发明中,间隔体的分子长度是从成形体具有的且通过以上化学式中的箭头指示的官能团至通过以上化学式中的箭头指示的捕捉核酸中核酸部分第一个磷酸基团的o原子延伸的主链中包括的原子数。在以上化学式中,间隔体具有相应于11原子数的分子长度。例如c3连接体或d间隔体在以上化学式中的插入为烷基和核酸部分第一磷酸基团之间。间隔体的分子长度仅需是相应于1以上原子数的长度。主链中的原子数优选为4至100,特别优选7至60。通过实验,主链中的原子数优选为7至40,特别优选13至40。-捕捉核酸-优选捕捉核酸包含可与成形体表面上存在的官能团共价结合的官能团。捕捉核酸没有具体限制,只要捕捉核酸可与目标核酸和标识体中的至少任一者结合。捕捉核酸的碱基序列和长度可根据意图目的来选择。优选捕捉核酸是单链的,末端以官能团修饰,并且可与目标核酸杂交。捕捉核酸的种类没有具体限制并且可根据意图目的被适当选择。捕捉核酸种类的实例包括脱氧核糖核酸(dna)、核糖核酸(rna)、和肽核酸(pna)。通常使用具有5个碱基至60个碱基的碱基长度的核酸。具有10个碱基至40个碱基的碱基长度的核酸是优选的。可与成形体表面上存在的官能团共价结合的捕捉核酸官能团没有具体限制并且可根据意图目的被适当选择。捕捉核酸官能团的实例包括羧基、酸酐、活性酯基团、醛基团、异氰酸基、异硫氰酸基、甲苯磺酰基、吡啶基二硫基团、溴乙酰基、羟基、氨基、环氧基团、巯基、马来酰亚胺基团、乙烯基砜基团、氨氧基乙酰基、重氮基团、碳二亚胺基团、乙烯基、硝基、砜基团、琥珀酰亚胺基团、酰肼基团、叠氮基团、磷酸基团、吖内酯基团、腈基团、酰胺基团、亚氨基、氮烯基团、乙酰基、磺酰氯基团、酰基叠氮基团、酐基团、氟苯基团、碳酸基、酰亚胺酯基团、环氧化物基团、和氟苯基酯基团。这些官能团中的一种可单独使用或这些官能团中的两种或更多种可组合使用。活性酯基团指代具有高反应性的酯基团。活性酯基团的具体实例包括p-硝基苯基酯基团、n-羟基琥珀酰亚胺酯基团、n-羟基磺基琥珀酰亚胺酯基团、琥珀酸酰亚胺酯基团、苯二甲酸酰亚胺酯基团、和5-降冰片烯-2,3-二羧基酰亚胺酯基团。在捕捉核酸官能团中,羧基、酸酐、活性酯基团、醛基团、异氰酸基、异硫氰酸基、甲苯磺酰基、吡啶基二硫基团、溴乙酰基、羟基、氨基、环氧基团、马来酰亚胺基团、和巯基是优选的,并且羧基、氨基、巯基、活性酯基团、和马来酰亚胺基团是特别优选的。官能团的引入位置可以是核酸分子链端或核酸分子链内。然而,为与目标核酸有效结合,优选官能团在分子链端引入。可根据意图目的选择5’端或3’端。将捕捉核酸固定至成形体的方法没有具体限制并且可根据意图目的被适当选择。方法实例包括将成形体表面上存在的官能团与捕捉核酸具有的官能团直接共价结合的方法,和在成形体和捕捉核酸之间引入具有适当链长的化合物作为中介(间隔体)的方法。当使用表面包含羧基的成形体时,可以在脱水缩合剂如水溶性碳二亚胺如1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)存在的情况下通过引入捕捉核酸分子的氨基和成形体表面上的羧基之间的反应形成酰胺键,使捕捉核酸与成形体结合。当使用表面包含醛基团的成形体时,例如,有如下方法:使引入捕捉核酸分子的氨基与醛基团进行反应形成席夫碱,和使还原剂如氰基硼氢化钠与席夫碱进行反应形成稳定的共价键。具体地,对于将捕捉核酸固定至成形体表面,涂布其中溶解或分散捕捉核酸的液体的方法是优选的。其中溶解或分散捕捉核酸的液体的ph没有具体限制,并且液体可设定成适于固定反应的ph。然而,当捕捉核酸是rna时,ph优选低于9.0,因为rna在碱性条件下水解。在捕捉核酸固定后,可将固定捕捉核酸的表面用包含表面活性剂的水或缓冲剂溶液洗涤,因此多余组分可被去除。当与捕捉核酸具有反应性的官能团保留在固定捕捉核酸的表面上时,优选通过碱化合物或包含伯氨基的化合物进行使保留在表面上的官能团失活的处理。--共价结合--共价结合的种类没有具体限制并且可根据意图目的被适当选择。共价结合种类的实例包括酰胺结合、酯结合、硫脲结合、硫醚结合、醚结合、亚胺结合、和二硫结合。这些共价结合种类中的一种可单独使用,或这些共价结合种类中的两种或更多种可组合使用。亚胺结合指代r1-ch=n-r2。r1和r2表示不同烷基。r1和r2可相同。捕捉核酸是否与成形体表面共价结合可通过例如ft-iratr法确认。<其它部件>其它部件没有具体限制并且可根据意图目的被适当选择。其它部件的实例包括标识体供给部分、标识体传布部件、基础材料、和吸收部件。-标识体供给部分-标识体供给部分没有具体限制并且可根据意图目的被适当选择,只要标识体供给部分能够供给标识体至流路部件。标识体供给部分的实例包括被配置以利用单独的装置和单独的工具使标识体滴落到流路上的结构,和被配置以利用层压在流路上并且包括标识体的标识体传布部件供给标识体的结构。在这些结构中,包括标识体传布部件的结构是优选的。-标识体传布部件-标识体传布部件没有具体限制,并且可根据意图目的选自已知的材料,只要标识体传布部件能够支持标识体(处于标识体可传布的状态)。标识体传布部件的实例包括纤维素滤纸、玻璃纤维、和无纺(non-woven)织物。制备支持标识体的标识体传布部件的方法没有具体限制并且可根据意图目的被适当选择。方法实例包括通过用预定量标识体浸渍标识体传布部件和干燥标识体传布部件来制备标识体传布部件的方法。具体地,需要标识体传布部件能够在标识体传布部件被测试目标液渗透时使标识体容易从标识体传布部件沥滤出来和使标识体随测试目标液一起移动。因此,一般对标识体具有弱吸附力的玻璃纤维是优选的。作为标识体传布部件,例如支持标识体的玻璃纤维在标识体传布部件可传布标识体的状态下被设置在流路部件上检测部分上游位置处。以这种方式,将测试目标液仅滴落到例如下述滴落部分上能够使测试以如下方式进行:当测试目标液中包含目标核酸时,标识体供给部分的标识体传布部件结合具有标识体的目标核酸,并且将目标核酸与标识体一起传布至第二扩散固定部分。这可简化测试装置的操作。-基础材料-基础材料可以具有例如可根据意图目的来选择的任何结构、任何材料、和任何形状。基础材料的结构没有具体限制并且可根据意图目的被适当选择。基础材料的结构实例包括通过将流路部件层压在基础材料的上表面上而获得的结构。基础材料的构成材料没有具体限制并且可根据意图目的被适当选择。基础材料的构成材料实例包括有机、无机、和金属材料。优选基础材料的至少一个表面涂有疏水性树脂,虽然这是非限制性的。当测试装置用作传感器芯片时,优选使用轻量、柔性、和低廉的合成树脂作为基础材料。此外,具有高持久性的构成材料如塑料片材可被选作基础材料。因此,测试装置的持久性由此提高。基础材料的构成材料实例包括聚氯乙烯、聚对苯二酸乙二醇酯、聚丙烯、聚苯乙烯、聚乙酸乙烯酯、聚碳酸酯、聚缩醛、改性聚苯基醚、聚对苯二酸丁二醇酯、和abs树脂。这些构成材料中的一种可单独使用,或这些构成材料中的两种或更多种可组合使用。在这些构成材料中,由聚对苯二酸乙二醇酯形成的基础材料特别优选使用,因为聚对苯二酸乙二醇酯是低价并且高多功能性的。基础材料的形状没有具体限制并且可根据意图目的被适当选择。然而,片材形状是优选的。基础材料的平均厚度没有具体限制,可根据意图目的被适当选择,并且优选为0.01mm以上但0.5mm以下。当基础材料的平均厚度为0.01mm以上时,基础材料具有足够的强度作为基础材料。当基础材料的平均厚度为0.5mm以下时,基础材料具有柔性并且适于传感器。基础材料的平均厚度可以是在测量目标的总共15个位置处用测微计测量的厚度的平均值,即例如,间隔大致相等的长度方向5个位置×宽度方向3个位置。-吸收部件-吸收部件没有具体限制,并且可选自已知的材料,只要吸收部件吸收测试目标液中的液体。例如,但液体是水时,吸收部件的实例包括纤维如纸和布、包含羧基或羧基盐的聚合物化合物、包含羧基或羧基盐的聚合物化合物的部分交联产物、和多糖的部分交联产物。在此将参考附图详细描述本发明的测试装置。在本发明中,有固定了不同核酸的2个检测部分。因此,其中一个检测部分将被称为“第一检测部分50a”,另一个检测部分将被称为“第二检测部分50b”。图1是示例本发明测试装置的实例的顶视图。图2是沿图1的直线a-a截取的示意性横截面视图。图3是部分放大横截面视图,描绘在核酸用作标识体时第一检测部分和流路部件彼此接触的部分。图4是部分放大横截面视图,描绘在抗体用作标识体时第一检测部分和流路部件彼此接触的部分。图5是部分放大视图,描绘第二检测部分和流路部件彼此接触的部分。如图1和图2示例,本发明的测试装置10包括多孔流路部件30——其中形成亲水性测试目标液如血液、脊髓液、尿液、或测试提取液(例如,用分析物收集单元如棍棒收集的包含分析物的液体)流过的流路、和在流路部件30上提供的标识体(核酸)供给部分40、第一检测部分50a、和第二检测部分50b。如图3至图5示例,与测试目标液12中包含的目标核酸14和标识体(核酸)中的至少任一种具有反应性的第一捕捉核酸17和第二捕捉核酸18被固定至第一检测部分50a和第二检测部分50b面向流路部件30的表面。第一捕捉核酸17结合目标核酸14,并且第二捕捉核酸18结合标识体(核酸)16。这可以在多个检测部分中的每一个检测部分处单独调节成形体和捕捉核酸之间的共价结合强度,更容易控制捕捉核酸的固定——甚至在流路部件30根据意图目的被适当选择时。在下文描述中,描述了测试目标液是亲水性液体如血液、脊髓液、尿液、或测试提取液(例如,用分析物收集单元如棍棒收集的包含分析物的液体)的情况。如图1和图2示例,描述了如下情况:在测试装置10中,流路部件30被提供在基础材料20上,并且吸收部件70在基础材料20和流路部件30的一端处被提供在基础材料20和流路部件30上。然而,本发明的测试装置10不限于这种实施方式。当提到某物被提供在流路部件30上时意为该某物被提供以接触流路部件——不论在测试装置10设置到位时该某物处于流路部件的上方还是下方。当提到第一检测部分50a和第二检测部分50b中的任意检测部分时,该任意检测部分将被称为检测部分50。捕捉核酸仅需通过共价结合被固定。如图1至图5示例,第一检测部分50a用作判定目标核酸14是否存在的测试线,并且第二检测部分50b用作指示标识体(核酸)16已到达的控制线如图1和图2示例,标识体(核酸)供给部分40被设置接触流路部件30。如上所述,标识体(核酸)供给部分40在能够传布标识体(核酸)16的状态下在检测部分50上游位置处支持标识体(核酸)16。如图2示例,标识体(核酸)供给部分40在标识体(核酸)供给部分40的流路部件30侧表面上支持标识体(核酸)16。如图1和图2示例,第一检测部分50a被设置接触流路部件30。如图3和图4示例,第一检测部分50a包含与第一检测部分50a的表面上的第一捕捉核酸17具有结合性的官能团。第一捕捉核酸17包含可与第一检测部分50a的表面上存在的官能团结合的官能团。通过该官能团,第一捕捉核酸17在第一检测部分50a面向流路部件30的表面上形成共价键52并且固定至该表面。当流路部件30和第一检测部分50a的相向表面之间形成的间隙充有测试目标液12时,第一捕捉核酸17捕捉处于与标识体(核酸)16结合状态下的目标核酸14。因此,目标核酸14和标识体(核酸)16被固定以显色。因此,第一检测部分50a可用作判定目标核酸14是否存在的测试线。在图4中,参考标志19表示标识体(抗体)。在图4中,第一捕捉核酸17捕捉处于与标识体(抗体)19结合状态下的目标核酸14。为防止目标核酸和捕捉核酸之间的结合被抑制,形成第一检测部分50a的成形体的构成树脂是水不溶性树脂。在本发明中,水不溶性指代基本上水不溶性。在此,在树脂已被浸入25℃的大量水24小时然后通过诸如真空干燥的方法充分干燥时树脂经历按质量计1%以下量的质量变化时,树脂被称为基本上水不溶性。这种树脂基本上水不溶性的原因是按质量计1%以下量的质量变化可归因于树脂产品中包含的副产物(例如,单体组分)沥滤到水中导致的质量减少。如图1和图2示例,第二检测部分50b被设置在第一检测部分50a下游位置处接触流路部件30。如图5示例,第二检测部分50b包含与第二检测部分50b表面上的第二捕捉核酸18具有结合性的官能团。第二捕捉核酸18包含可与第二检测部分50b表面上存在的官能团结合的官能团。通过该官能团,第二捕捉核酸18在第二检测部分50b面向流路部件30的表面上形成共价键52并且固定该表面。当流路部件30和第二检测部分50b的相向表面之间形成的间隙充有测试目标液12时,第二捕捉核酸18捕捉标识体(核酸)16。因此,标识体(核酸)16被固定以显色。因此,第二检测部分50b可用作指示标识体(核酸)16已到达的控制线。为防止标识体和捕捉核酸之间的结合被抑制,形成第二检测部分50b的成形体的构成树脂是水不溶性树脂,类似于第一检测部分50a。如图1和图2示例,滴落部分80被设置在基础材料20上游端,以覆盖标识体(核酸)供给部分40。吸收部件70被设置在与滴落部分80相反的基础材料20下游端,以重叠流路部件30。本发明的测试装置不限于利用核酸杂交和抗体-抗原反应的测试装置。例如,测试装置可被配置以通过将响应结构变化而变化色相的试剂用作试剂对测试目标液中包含的具体组分进行测试。由图6展示的现有测试装置的膜概念图可知,在现有测试装置中,捕捉核酸17被固定至构成膜的纤维f2。因此,可固定至膜的捕捉核酸17已被限制为与纤维f2具有强结合性的捕捉核酸。即,在现有测试装置中,因设计原因,关于可用的纤维f2和可用的捕捉核酸17具有诸多限制。然而,在本发明中的测试装置,成形体和试剂如捕捉核酸通过在检测部分处的共价结合被彼此固定。这点是有利的,因为可以控制成形体与捕捉核酸之间的共价结合强度和成形体与测试目标液之间的亲和力。(用于制备测试装置的转印介质)用于制备本发明测试装置的转印介质是用于制备本发明测试装置的介质。用于制备测试装置的转印介质没有具体限制并且可根据意图目的被适当选择,只要该转印介质可通过转印到流路上而形成检测部分。转印介质包括支持体、剥离层、和试剂固定层,并且可按需包括其它层。<支持体>支持体可具有例如任何形状、任何结构、任何尺寸、和任何材料,其没有具体限制并且可根据意图目的被适当选择。支持体的结构没有具体限制并且可根据意图目的被适当选择。支持体的结构实例包括单层结构和层压结构。支持体的尺寸没有具体限制并且可被适当选择——根据例如测试装置的尺寸。支持体的材料没有具体限制并且可根据意图目的被适当选择。支持体的材料实例包括聚酯如聚对苯二酸乙二醇酯(pet)和聚萘二甲酸乙二醇酯(pen)、聚碳酸酯、聚酰亚胺树脂(pi)、聚酰胺、聚乙烯、聚丙烯、聚氯乙烯、聚偏氯乙烯、聚苯乙烯、苯乙烯-丙烯腈共聚物、和乙酸纤维素。这些材料中的一种可单独使用,或这些材料中的两种或更多种可组合使用。在这些材料中,聚对苯二酸乙二醇酯(pet)和聚萘二甲酸乙二醇酯(pen)是特别优选的。优选施加表面活化处理至支持体的表面,以提高与将在支持体上提供的层的紧密粘着性。表面活化处理的实例包括辉光放电处理和电晕放电处理。在下述试剂固定层转印到基础材料或流路部件上后,支持体可保持在例如基础材料或流路部件侧上。可选地,支持体等可在试剂固定层转印后借助下述剥离层被剥除和去除。支持体没有具体限制,并且可以是适当合成的产品或市售产品。支持体的平均厚度没有具体限制,可根据意图目的被适当选择,并且优选是3微米以上但50微米以下。<剥离层>剥离层具有提高转印过程中支持体和试剂固定层之间剥离性的功能。剥离层具有在用加热/加压装置如热头(thermalhead)加热时热融合以变成低粘度液体和促进试剂固定层在大约加热部分和非加热部分之间的交界处分离的功能。剥离层包含蜡和粘合剂树脂,并且进一步包含按需适当选择的其它组分。蜡没有具体限制并且可根据意图目的被适当选择。蜡的实例包括:天然蜡,如蜂蜡、巴西棕榈蜡、鲸蜡、日本牛脂、小烛树蜡、米糠蜡、和蒙旦蜡;合成蜡,如石蜡、微晶蜡、氧化物蜡、地蜡、提纯地蜡、酯蜡、聚乙烯蜡、和聚氧化乙烯蜡;高级脂肪酸,如珠光脂酸、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、糠酸、和山嵛酸;高级醇,如硬脂醇和山嵛醇;酯,如山梨糖醇酐的脂肪酸酯;和酰胺,如硬脂酰胺和油酰胺。这些蜡中的一种可单独使用,或这些蜡中的两种或更多种可组合使用。在这些蜡中,巴西棕榈蜡和聚乙烯蜡是优选的,因为这些蜡具有优越的剥离性。粘合剂树脂没有具体限制并且可根据意图目的被适当选择。粘合剂树脂的实例包括乙烯-乙酸乙烯酯共聚物、部分皂化乙烯-乙酸乙烯酯共聚物、乙烯-乙烯基醇共聚物、乙烯-甲基丙烯酸钠共聚物、聚酰胺、聚酯、聚氨酯、聚乙烯基醇、甲基纤维素、羧基甲基纤维素、淀粉、聚丙烯酸、异丁烯-马来酸共聚物、苯乙烯-马来酸共聚物、聚丙烯酰胺、聚乙烯醇缩醛、聚氯乙烯、聚偏氯乙烯、异戊二烯橡胶、苯乙烯-丁二烯共聚物、乙烯-丙烯共聚物、丁基橡胶、和丙烯腈-丁二烯共聚物。这些粘合剂树脂中的一种可单独使用,或这些粘合剂树脂中的两种或更多种可组合使用。形成剥离层的方法没有具体限制并且可根据意图目的被适当选择。方法实例包括热熔体涂布方法、和涂布通过在溶剂中分散蜡和粘合剂树脂获得的涂布液的方法。剥离层的平均厚度没有具体限制,可根据意图目的被适当选择,并且优选是0.5微米以上但50微米以下。剥离层累积量没有具体限制,可根据意图目的被适当选择,并且优选是0.5g/m2以上但50g/m2以下。<试剂固定层>试剂固定层的材料等没有具体限制并且可根据意图目的被适当选择,只要试剂固定层包含形成测试装置的检测部分的成形体的构成树脂中的任一种。形成试剂固定层的方法没有具体限制并且可根据意图目的被适当选择。例如,试剂固定层可通过下列方法形成:热熔体涂布方法、和如下方法:通过常用涂布方法如凹版涂布机、线棒涂布机、和辊涂机用通过在溶剂中分散检测部分构成树脂获得的试剂固定层涂布液涂布支持体或剥离层,和干燥涂布液。试剂固定层的平均厚度没有具体限制,可根据意图目的被适当选择,并且优选是200nm以上但50微米以下。当试剂固定层的平均厚度为200nm以上时,成形体将具有良好的持久性并且将没有因摩擦或冲击而断裂的风险。当试剂固定层的平均厚度为50微米以下时,来自热头的热被均匀地传导通过试剂固定层,导致良好的清晰度(sharpness)。试剂固定层上的试剂固定层涂布液累积量没有具体限制,可根据意图目的被适当选择,并且优选是0.2g/m2以上但50g/m2以下。当试剂固定层涂布液累积量为0.2g/m2以上时,累积量充足,并且检测部分不会具有任何缺乏部分。当试剂固定层涂布液累积量为50g/m2以下时,干燥不会耗时,并且检测部分不会具有不均匀性。在试剂固定层涂布液干燥并且试剂固定层形成后,用其中溶解或分散有捕捉核酸的液体涂布试剂固定层表面,形成均匀的涂布膜。在捕捉核酸被固定后,用包含表面活性剂的水或缓冲剂溶液洗涤固定了捕捉核酸的表面,以去除不必要组分。当与捕捉核酸具有反应性的官能团保留在固定了捕捉核酸的表面上时,优选进行借助碱化合物或包含伯氨基的化合物使保留在表面上的官能团失活的处理。通过上述过程,捕捉核酸可被固定至试剂固定层表面。优选涂布涂布膜以具有均匀厚度。干燥方法没有具体限制,并且可以是通流干燥、真空干燥、天然干燥、和冷冻干燥。然而,减压或真空干燥是优选的。优选在20℃至50℃室温范围内的干燥温度下进行干燥,干燥时间为30分钟至24小时。当干燥温度高于20℃时,节约干燥耗时并且因而提高生产率。当干燥温度低于50℃时,无试剂因热变性的风险。当干燥时间长于30分钟时,干燥充分。当干燥时间短于24小时时,生产率提高,并且无需考虑树脂变色。<其它层>其它层没有具体限制并且可根据意图目的被适当选择。其它层的实例包括背层、底涂层、和保护膜。-背层-背层没有具体限制并且可根据意图目的被适当选择。优选转印介质配置有背层——在与配置有剥离层的支持体表面相反的支持体表面上。在转印过程中,以共形于成形体形状的方式将热直接施加至该相反表面——通过例如热头,以形成检测部分。因此,优选背层具有耐高热性和耐摩擦性(与例如热头)。背层包含粘合剂树脂,并且按需进一步包含其它组分。粘合剂树脂没有具体限制并且可根据意图目的被适当选择。粘合剂树脂的实例包括硅酮改性氨基甲酸乙酯树脂、硅酮改性丙烯酸树脂、硅酮树脂、硅酮橡胶、氟树脂、聚酰亚胺树脂、环氧树脂、酚醛树脂、三聚氰胺树脂、和硝基纤维素。这些粘合剂树脂中的一种可单独使用,或这些粘合剂树脂中的两种或更多种可组合使用。其它组分没有具体限制并且可根据意图目的被适当选择。其它组分的实例包括例如滑石、二氧化硅、和有机聚硅氧烷以及润滑剂的无机颗粒。形成背层的方法没有具体限制并且可根据意图目的被适当选择。方法实例包括常用涂布方法,如凹版涂布机、线棒涂布机、和辊涂机。背层的平均厚度没有具体限制,可根据意图目的被适当选择,并且优选是0.01微米以上但1.0微米以下。-底涂层-底涂层可被提供在支持体和剥离层之间、或剥离层和试剂固定层之间。底涂层包含树脂,并且按需进一步包含其它组分。树脂没有具体限制并且可根据意图目的被适当选择。可使用用于试剂固定层和剥离层的各种树脂。-保护膜-优选在试剂固定层上提供保护膜,以保护试剂固定层在储存过程中免遭污染或损坏。保护膜的材料没有具体限制并且可根据意图目的被适当选择,只要该材料可容易从试剂固定层剥除。保护膜的材料实例包括硅酮纸、聚烯烃片材如聚丙烯、和聚四氟乙烯片材。保护膜的平均厚度没有具体限制,可根据意图目的被适当选择,并且优选是5微米以上但100微米以下,更优选10微米以上但30微米以下。迄今,当固定捕捉核酸的树脂成形体以制备测试装置的转印介质形式制备时,需要通过如下储存转印介质:将转印介质围绕核芯缠绕成多层压状态的卷筒形式。如果捕捉核酸和树脂成形体之间的结合力弱,如当捕捉核酸物理吸附至树脂成形体时,试剂将可能脱落至转印介质的背面(该背面是固定试剂的表面的相反面)。这引起储存稳定性低的问题。同时,在本发明中,捕捉核酸通过共价结合被固定。这使得试剂较难脱落至转印介质背面——甚至在转印介质被层压时。其优点在于储存稳定性高。(制备测试装置的方法)用于制备本发明测试装置的方法包括下列步骤:使转印介质的试剂固定层和流路部件彼此接触从而将试剂固定层转印到流路部件上,并且按需进一步包括其它步骤。将试剂固定层转印到流路部件上的步骤没有具体限制并且可根据意图目的被适当选择。步骤实例包括利用试剂固定层热转印到流路部件上的方法的步骤。将参考附图详细描述试剂固定层转印,作为制备测试装置的方法。图7是示例用于测试装置的转印介质的层叠状态的横截面视图。试剂固定层的转印不具体受限于例如流路的结构,只要试剂固定层被转印到了流路上。因此,试剂固定层可根据意图目的以适当方式形成。在此将描述将试剂固定层热转印到流路部件上的方法。如图7示例,转印介质100包括记载顺序的层叠状态的支持体101、剥离层102、和试剂固定层103,并且在支持体101的层叠剥离层102的表面的相反表面上进一步包括背层104。试剂固定层103热转印到流路部件30上的方法的实例包括这样的方法:该方法包括以下步骤:使转印介质100的试剂固定层103和流路部件30彼此接触以将试剂固定层103转印到流路部件30上。用于热转印的印制机没有具体限制并且可根据意图目的被适当选择。印制机的实例包括热印制机,其包括例如串式热头(serialthermalhead)和行式热头(linethermalhead)。施加用于热转印的能量没有具体限制,可根据意图目的被适当选择,并且优选是0.05mj/点以上但0.5mj/点以下。当施加能(施加能,appliedenergy)为0.05mj/点以上时,试剂固定层103充分融合。当施加的热量为0.5mj/点以下时,无试剂因热变性的风险,并且无转印介质100的试剂固定层103之外的部分融合的风险。这防止热头被污染。<测试装置的应用>测试装置的应用没有具体限制并且可根据意图目的被适当选择。测试装置的应用实例包括用于核酸检测的侧向流动色谱装置、用于血液测试和dna测试的生化传感器(感应芯片)、和用于例如食品和饮料质量控制的小尺寸分析装置(化学传感器)。在这些应用中,测试装置优选是用于核酸检测的侧向流动色谱装置。用于核酸检测的侧向流动色谱装置可通过检测可归因于病毒或细菌的核酸(dna和rna)是否存在或可归因于具体疾病或体质相关突变基因的核酸是否存在,准确地诊断例如感染性疾病、遗传性疾病如肿瘤和体质。用于核酸检测的侧向流动色谱装置还用于食品检验以检测过敏原或具体食品,和环境勘测以检测环境中存在的微生物。用于生化测试的样品(分析物)没有具体限制并且可根据意图目的被适当选择,只要该样品包含单链核酸,即目标。样品的实例包括病原体如细菌和病毒、从活生物体分离的血液、唾液、损伤组织等、和排泄物如粪尿。进一步,为进行产前诊断,样品可以是羊水中的部分胎儿细胞或测试管中的部分分裂卵细胞。此外,这些样品可按需直接或通过例如离心凝聚成沉淀,然后经历预处理,如核酸提取处理、核酸扩增、和改性或这些处理的任何组合。测试装置还具有层析(分离或精制)测试目标液的功能,因为流路部件充当静态床。在这种情况下,包括连续小室(其内壁具有亲水性)的流路部件充当静态床(或支持体)。测试目标液中的不同组分以不同速度流过流路——由于在渗透流路的过程中与静态床相互作用的差异,即,组分是亲水性还是疏水性的差异。具有较高亲水性的组分较容易吸附至充当静态床的多孔部分,并且反复吸附和解吸较多次,导致通过流路的渗透速度较低。相比之下,具有较高疏水性的组分在不吸附至静态床的情况下渗透流路,因此较快地移动通过流路。通过基于测试目标液中移动速度的差异选择性地提取测试目标液中的目标组分和使目标组分发生反应,可以将本发明的测试装置用作高功能性化学或生化传感器。(测试方法)本发明的测试方法没有具体限制——只要该测试方法是利用本发明的测试装置进行测试的测试方法,并且可包括供给分析物至流路部件的分析物供给步骤、和通过固定至成形体的捕捉核酸捕捉部分分析物的步骤。在具体操作中,使测试目标液12滴落并供给到测试装置10的流路部件30上提供的滴落部分80(参见图1和图2)上。随后,使被供给的测试目标液12和标识体(核酸)供给部分40支持的标识体(核酸)16彼此接触,以从标识体(核酸)供给部分40释放标识体(核酸)16。当测试目标液12中包含任何目标核酸14时,从标识体(核酸)供给部分40释放的标识体(核酸)16与目标核酸14反应并结合。随后,将包含标识体(核酸)16和目标核酸14的测试目标液12沿流路部件30传布,以到达设置第一检测部分50a的区域。固定至第一检测部分50a的面向流路部件30的表面的第一核酸17结合并捕捉处于与标识体(核酸)16结合状态的目标核酸14。如上所述,第一捕捉核酸17通过共价键52固定至成形体。因此,即使在第’捕捉核酸17接触测试目标液12时,第一捕捉核酸17也不对测试目标液12具有亲和力,并且不容易释放到测试目标液12中。即使一部分第一捕捉核酸17释放到测试目标液12中,释放的部分也很快与构成流路部件30的纤维结合。这促进标识体(核酸)16固定至第一检测部分50a附近。因此,充当测试线的第一检测部分50a清晰显色。经过第一检测部分50a而未被捕捉的任何标识体(核酸)16沿流路部件30传布以到达设置第二检测部分50b的区域。在第二检测部分50b处,标识体(核酸)16通过与第二捕捉核酸18结合而被捕捉。由于第二捕捉核酸18被固定,充当控制线的第二检测部分50b清晰显色。(测试套装)本发明的测试套装包括本发明的测试装置和被配置以收集分析物的分析物收集单元,并且按需进一步包括其它部件。为按照上述本发明测试方法进行测试,可以利用测试套装,该测试套装包括测试装置10、以及被配置以收集分析物的器具(分析物收集单元的实例)和用于处理分析物的液体中的至少一种,如图8示例。被配置以收集分析物的器具的实例包括已知的器具,如用于从例如喉咽部和鼻腔收集分析物的灭菌棉签201。用于处理分析物的液体的实例包括已知的液体,如用于稀释分析物的稀释液202和用于提取分析物的提取液。在上述实施方式中,描述了由标识体(核酸)供给部分和检测部分供给的试剂是核酸的情况。本发明不限于这种实施方式。用于化学测定的指示物指代用于指示溶液的化学性质的试剂。指示物没有具体限制并且可根据意图目的被适当选择。指示物的实例包括ph指示物、通过与诸如铅离子、铜离子和亚硝酸根离子的各种离子反应而变色的各种离子载体、和通过与各种农用化学品反应而变色的试剂。在上述实施方式中,描述了支持体101和转印介质100的试剂固定层103在转印过程中因热而彼此分离的情况。本发明不限于这种实施方式。例如,支持体101和试剂固定层103可因光而彼此分离。在这种情况下,剥离层102可包含光吸收剂如炭黑,并且可使光吸收剂吸收光和产生热,因此剥离层102融合并释放试剂固定层103。可选地,剥离层102可包含响应光照射而改变性质的材料并且可使材料吸收光,因而剥离层102变脆,从而释放试剂固定层103。在上述实施方式中,描述了贯穿流路部件30形成流路的情况。本发明不限于这种实施方式。在流路部件30的部分区域中形成流路的方法的实例包括如下方法:通过按照已知的方法用疏水性材料填充亲水性多孔材料的空隙,形成限定流路外边缘的流路壁。本实施方式的测试装置10可配置有任意保护部件,该保护部件被配置以防止手通过触碰流路部件30而被污染。保护部件的实例包括被配置以覆盖整个测试装置10的外壳、和在流路部件30上提供的膜。当提供保护部件时,优选在流路部件30上的滴落部分80上方位置处提供开口。还优选在保护部件中提供开口,以消散流路中的内部压力。在上述实施方式中,描述了测试目标液具有亲水性的情况。本发明不限于这种实施方式。例如,测试目标液可以是亲脂性或亲溶剂性的。亲溶剂性测试目标液的实例包括亲溶剂性液体,其包含有机溶剂,如醇,如甲醇、乙醇、1-丙醇、和2-丙醇;和酮,如丙酮和甲基乙基酮(mek)。当测试目标液具有亲溶剂性时,上述实施方式中的术语“亲水性”替换成“疏水性”,并且术语“疏水性”替换成“亲水性”。[实施例]下文通过实施例对本发明进行描述。然而,本发明不应被解释为受限于这些实施例。(制备例1)-制备背层涂布液-将硅酮系橡胶乳液(可获自shin-etsuchemicalco.,ltd.,ks779h,其中固体浓度为按质量计30%)(16.8质量份)、氯铂酸催化剂(0.2质量份)、和甲苯(83质量份)混合,以获得背层涂布液。(制备例2)-制备剥离层涂布液-将聚乙烯蜡(可获自toyoadlcorporation,polywax1000,熔点为99℃并且25℃下的渗透度为2)(14质量份)、乙烯-乙酸乙烯酯共聚物(可获自dupont-mitsuipolychemicalsco.,ltd.,ev-150,重均分子量为2,100,并且vac为按质量计21%)(6质量份)、甲苯(60质量份)、和甲基乙基酮(20质量份)进行分散处理直到平均粒径为2.5微米,以获得剥离层涂布液。(制备例3)-制备试剂固定层涂布液-通过添加甲苯作为溶剂,将氨基乙基化丙烯酸聚合物(polymentnk-380,可获自nipponshokubaico.,ltd.)稀释至按质量计15%,以获得试剂固定层涂布液。(制备例4)-制备测试线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胸腺嘧啶(t)碱基(20basesofthymine(t))并且在5’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的磺基-gmbs(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例5)-制备控制线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胞嘧啶(c)碱基(20basesofcytosine(c))并且在3’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的磺基-gmbs(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例6)-制备标识体(核酸)试剂涂布液-利用1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)(可获自thermofisherscientificinc.),使羧基改性的金胶体通过酰胺结合与连续包含20个鸟嘌呤(g)碱基(20basesofguanine(g))并且在3’端引入氨基的dna片段结合。将所得物用50mmtris-hcl缓冲剂(ph=8.2)洗涤,悬浮在标识体稀释液(20mmtris-hcl缓冲剂(ph=8.2)、按质量计0.05%聚乙二醇、按质量计5%蔗糖、和纯化水)中,并调节至od=2,以获得标识体试剂涂布液。(制备例7)-制备测试线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)4(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例8)-制备控制线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胞嘧啶(c)碱基并且在3’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)4(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例9)-制备测试线试剂涂布液-用te缓冲剂(10mmtris-hcl和1mmedta,ph=7.4,可获自takarabioinc.)制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入巯基的dna片段至25μm,以获得测试线试剂涂布液。(制备例10)-制备控制线试剂涂布液-用te缓冲剂(10mmtris-hcl和1mmedta,ph=7.4,可获自takarabioinc.)制备连续包含20个胞嘧啶(c)碱基并且在3’端引入巯基的dna片段至25μm,以获得控制线试剂涂布液。(制备例11)-制备标识体(抗体)试剂涂布液-向金胶体溶液(可获自bbisolutions,emgc50)(9ml),添加制备成50mm的kh2po4缓冲剂(ph=7.0)(1ml),然后添加制备成50微克/ml的抗生物素单克隆抗体(可获自bethyllaboratories,inc.,anti-biotin,goat-polya150-111a)(1ml),并搅拌。将所得物静置10分钟。向所得物添加按质量计1%的聚乙二醇水溶液(可获自wakopurechemicalindustries,ltd.,168-11285)(550微升)并搅拌。向所得物进一步添加按质量计10%的bsa水溶液(可获自sigma-aldrichco.,llc,a-7906)(1.1ml)并搅拌。然后,将此溶液进行离心30分钟,然后在上清液被去除后,利用超声清洗器进行金胶体再分散。在4℃下利用离心机(可获自hitachikokico.,ltd.,himaccf16rn)以8,000×g的离心加速度进行离心。随后,将所得物分散在金胶体防腐溶液[20mmtris-hcl缓冲剂(ph=8.2)、按质量计0.05%聚乙二醇(重均分子量为2,000)、150mmnacl、按质量计1%bsa水溶液、和按质量计0.1%nan3水溶液](20ml),在如上所述相同条件下再次进行离心,并且在上清液被去除残留约1ml后,利用超声清洗器进行金胶体再分散。这些操作反复进行以制备在金胶体防腐溶液中的od=15溶液,以获得标识体试剂涂布液。(制备例12)-制备测试线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入n-羟基琥珀酰亚胺酯基团的dna片段以具有2.5μm的最终浓度,以获得测试线试剂涂布液。(制备例13)-制备控制线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胞嘧啶(c)碱基并且在3’端引入n-羟基琥珀酰亚胺酯基团的dna片段以具有2.5μm的最终浓度,以获得控制线试剂涂布液。(制备例14)-制备测试线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入巯基的dna片段以具有2.5μm的最终浓度,以获得测试线试剂涂布液。(制备例15)-制备控制线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胞嘧啶(c)碱基并且在3’端引入巯基的dna片段以具有2.5μm的最终浓度,以获得控制线试剂涂布液。(制备例16)-制备试剂固定层涂布液-将氮丙啶衍生物(cl2502,可获自arakawachemicalindustries,ltd.)——含氨基的乙烯亚胺树脂——与固化催化剂(acs-164,可获自arakawachemicalindustries,ltd.)以100∶4的比例(质量比)混合,以获得试剂固定层涂布液。(制备例17)-制备试剂固定层涂布液-通过添加溶剂甲基乙基酮/甲苯混合液(体积比为6∶4),将含羧基的酯树脂(ap2510,可获自arakawachemicalindustries,ltd.)稀释至按质量计15%,以获得试剂固定层涂布液。(制备例18)-制备试剂固定层涂布液-将含羟基的丙烯酸树脂(da105,可获自arakawachemicalindustries,ltd.)与固化剂(cl102h,可获自arakawachemicalindustries,ltd.)以10∶3.8的比例(质量比)混合,以获得试剂固定层涂布液。(制备例19)-制备测试线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入氨基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的dsg(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例20)-制备控制线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胞嘧啶(c)碱基并且在3’端引入氨基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的dsg(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例21)-制备测试线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自doiindolaboratories),制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入羧基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例22)-制备控制线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories),制备连续包含20个胞嘧啶(c)碱基并且在3’端引入羧基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例23)-制备测试线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories),制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入氨基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例24)-制备控制线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories)制备连续包含20个胞嘧啶(c)碱基并且在3’端引入氨基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例25)-制备测试线试剂涂布液-用具有100mm最终浓度的硼酸缓冲剂(ph=8.5),制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的pmpi(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例26)-制备控制线试剂涂布液-用具有100mm最终浓度的硼酸缓冲剂(ph=8.5),制备连续包含20个胞嘧啶(c)碱基并且在3’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的pmpi(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(实施例1)<制备测试线转印介质>-形成背层-将制备例1的背层涂布液涂布在支持体的一个表面上——该支持体是具有4.5微米平均厚度的聚对苯二酸乙二醇酯(pet)膜(可获自torayindustries,inc.lumirrorf57),并且在80℃下干燥10秒,以形成具有0.02微米平均厚度的背层。-形成剥离层-然后,将制备例2的剥离层涂布液涂布在pet膜的背层形成表面的相反表面上,并在25℃下干燥30分钟,以形成具有30微米平均厚度的剥离层。-形成试剂固定层-然后,将制备例3的试剂固定层涂布液涂布在剥离层表面上,并在50℃下干燥30分钟,以形成具有3微米平均厚度的试剂固定层。以这种方式,制备了转印介质。<固定捕捉核酸>-测试线(固定第一捕捉核酸)-然后,将制备例4的测试线试剂涂布液倒入浅方桶,并将转印介质漂浮在测试线试剂涂布液上,使得仅试剂固定层表面接触测试线试剂涂布液。在这种状态下,将浅方桶覆盖并在25℃下静置30分钟。随后,将试剂固定层表面用50mmtris-hcl缓冲剂(ph=9.0)洗涤,并在25℃下进行30分钟真空干燥,以将试剂固定至试剂固定层。以这种方式,制备了实施例1的测试线转印介质。通过ft-iratr方法(ft-ir6800,可获自jascocorporation),基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此共价结合。<制备控制线转印介质>-控制线(固定第二捕捉核酸)-以与上述<制备测试线转印介质>相同的方式制备实施例1的控制线转印介质——除了不同于<制备测试线转印介质>,利用制备例5的控制线试剂涂布液代替测试线试剂涂布液。通过ft-iratr方法(ft-ir6800,可获自jascocorporation),基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层彼此共价结合。<制备测试装置>以下述方式制备图1和图2示例的测试装置10。图1是实施例的测试装置的顶视图。图2是沿直线a-a截取的图1的测试装置的示意性横截面视图。-制备纸基材(基材+流路部件)-将作为热塑性树脂的聚酯系热熔体粘合剂(可获自toagoseico.,ltd.,aronmeltpes375s40)加热至190℃,然后用辊涂机涂布在切割成40mm宽和80mm长尺寸的pet膜(可获自torayindustries,inc.,lumirrors10,具有50微米平均厚度)20上以在pet膜上具有50微米平均厚度,以形成粘合剂层。将其上形成粘合剂层的pet膜20静置2小时以上。随后,将切割成40mm宽和35mm长尺寸的硝基纤维素膜(可获自merckmilliporecorporation,hf180)与粘合剂层表面在距粘合剂层表面长方向一端(此端是上游端,相反端是下游端)33mm位置处重叠——在硝基纤维素膜和粘合剂层表面在宽方向上吻合的状态下——并将1kgf/cm2的负荷在150℃温度下施加于重叠产物10秒,以形成流路部件30。最后,将获得的产物沿产物的长方向切割成4mm宽和80mm长尺寸,以获得纸基材。按照下方计算式1,基于流路部件的基重(g/m2)和平均厚度(微米)和流路部件组分的比重,计算作为纸基材的流路部件30的硝基纤维素膜的空隙率。结果是,硝基纤维素膜的空隙率为70%。<计算式1>空隙率(%)={1-[基重(g/m2)/平均厚度(微米)/组分的比重]}×100当流路部件的空隙率为40%以上但90%以下时,流路部件可被称为是多孔的。-转印测试线-使纸基材的流路部件30和测试线转印介质的试剂固定侧彼此面对和重叠。随后,利用热转印印制机,如图1和图2示例,将测试线转印介质以具有4mm宽度和0.7mm长度的线形状转印到距流路部件30上游端9mm的位置上(第一检测部分50a)。作为热转印印制机,用具有300dpi点密度的热头(可获自tdkcorporation)构建具有42mm/sec印制速度和0.17mj/点施加能的评价系统。-转印控制线-然后,将控制线转印介质以具有4mm宽度和0.7mm长度的线形状转印到距测试线转印介质的转印位置5mm的位置上(第二检测部分50b)。-形成标识体供给部分-然后,制备例6的标识体试剂涂布液以60微升/cm2的量涂布在切割成4mm宽和18mm长尺寸的玻璃纤维垫(可获自merckmilliporecorporation,gfcp203000)上,并在减压下干燥过夜,以制备标识体支持垫。如图1和图2示例,将标识体支持垫设置在距纸基材上游端17mm的位置处,与纸基材上提供的粘合剂层重叠并粘贴在该粘合剂层上(标识体供给部分40)。-形成滴落部分-如图1和图2示例,将具有4mm宽度和35mm长度的样品垫(可获自merckmilliporecorporation,cfsp223000)以如下方式设置和粘帖:与标识体供给部分40的上表面重叠18mm(滴落部分80)。-吸收部件-提供吸收部件70(可获自merckmilliporecorporation,cfsp223000),如图1和图2示例。以这种方式,获得实施例1的用于核酸检测的侧向流动色谱装置(测试装置10)。<线的评价>-制备测试目标液-用5×ssc缓冲剂(75mm柠檬酸钠和750mm氯化钠,可获自nacalaitesque,inc.)制备包括从5’端起包含连续20个胞嘧啶(c)碱基、重复包含10个胸腺嘧啶(t)和鸟嘌呤(g)碱基(10basesofthymine(t)andguanine(g))的序列、和连续20个腺嘌呤(a)碱基(20basesofadenine(a))的碱基序列的dna片段以具有1.0μm最终浓度,以获得测试目标液。-反应-将测试目标液以100微升量滴落在图1和图2示例的用于核酸检测的侧向流动色谱装置10的上游端部分上。30分钟后,基于目视观察按照下述标准对线进行评价。结果展示在表2中。<评价标准>a:识别测试线和控制线各位置清晰显色,贯穿全线颜色光密度均匀,而不存在线中断。b:线无中断并且能够实现判定,但各位置之间颜色光密度略不均匀。c:勉强识别显色为线形状,但线中有部分中断。d:不识别显色,或显色不是线形状,如当线流至下游侧时。评价标准实例展示在表1中。表1中的照片均是测试线在测试后的照片。[表1]<线密度测量>将用于核酸检测的侧向流动色谱装置在显色和如上用于线评价后用色谱读取器(chromatoreader)(可获自hamamatsuphotonicsk.k.,c10066)测量,以获得线的光密度和s/n比,其按照下述标准评价。结果展示在表3中。线的光密度越大越优选,并且s/n比越大越优选,因为线的轮廓更清晰。当色谱读取器检测不到线光密度时,结果展示为“一”。<线光密度评价标准>a:光密度为200以上。b:光密度为100以上但小于200。c:光密度为30以上但小于100。d:光密度为小于30。e:因线识别不出,光密度检测不到。<s/n比评价标准>a:s/n比为30以上。b:s/n比为10以上但小于30。c:s/n比为3以上但小于10。d:s/n比为小于3。e:不能计算s/n比。<总评价标准>将所达到的等级以下列方式转换成数字:a是5点,b是4点,c是3点,d是2点,和e是1点,以基于f线评价、光密度评价、和s/n比评价中达到的等级总和进行总评价。s:特别优越:15点以上a:优越:14点以上但小于15点b:良好:13点以上但小于14点c:普通:12点以上但小于13点d:略差但及格:11点以上但小于12点e:不及格,不可视:小于11点(实施例2)实施例2的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备——除了不同于实施例1,制备例7的测试线试剂涂布液用于<制备测试线转印介质>并且制备例8的控制线试剂涂布液用于<制备控制线转印介质>;并以实施例1与相同的方式评价。结果展示在表2和表3中。在实施例2中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此共价结合。在实施例2中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层彼此共价结合。(实施例3)实施例3的其上仅转印测试线的用于核酸检测的侧向流动色谱装置(测试装置)10以与实施例1相同的方式制备——除了不同于实施例1,制备例11的标识体试剂涂布液用于<形成标识体供给部分>;并以与实施例1相同的方式评价——除了在<线评价>中,测试目标液用如下dna片段制备:5’端以生物素标记并且包括碱基序列,该碱基序列从5’端起包含:重复包含10个胸腺嘧啶(t)和鸟嘌呤(g)碱基的序列、和连续20个腺嘌呤(a)碱基。结果展示在表2和表3中。在实施例3中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此共价结合。在实施例3中,以与实施例1相同的方式,通过ft-iratr方法。基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层彼此共价结合。(实施例4)实施例4的其上仅转印测试线的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例2相同的方式制备——除了不同于实施例2,制备例11的标识体试剂涂布液用于<形成标识体供给部分>;并以与实施例1相同的方式评价,除了在<线评价>中,测试目标液用如下dna片段制备:5’端以生物素标记并且包括碱基序列,该碱基序列从5’端起包含:重复包含10个胸腺嘧啶(t)和鸟嘌呤(g)碱基的序列、和连续20个腺嘌呤(a)碱基。结果展示在表2和表3中。在实施例4中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此共价结合。在实施例4中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层彼此共价结合。(实施例5)实施例5的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备——除了不同于实施例1,制备例12的测试线试剂涂布液用于<制备测试线转印介质>并且制备例13的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例1相同的方式评价。结果展示在表2和表3中。在实施例5中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此共价结合。在实施例5中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层彼此共价结合。(实施例6)实施例6的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备——除了不同于实施例1,制备例16的试剂固定层涂布液用于-形成试剂固定层-;并以与实施例1相同的方式评价。结果展示在表2和表3中。在实施例6中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此共价结合。在实施例6中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层彼此共价结合。(实施例7)实施例7的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备——除了不同于实施例1,制备例16的试剂固定层涂布用于-形成试剂固定层-,制备例19的测试线试剂涂布液用于<制备测试线转印介质>,和制备例20的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例1相同的方式评价。结果展示在表2和表3中。在实施例7中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的氨基与连接体一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此共价结合。在实施例7中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的氨基与连接体一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层彼此共价结合。(实施例8)实施例8的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备——除了不同于实施例1,制备例16的试剂固定层涂布液用于-形成试剂固定层-,制备例21的测试线试剂涂布液用于<制备测试线转印介质>,和制备例22的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例1相同的方式评价。结果展示在表2和表3中。在实施例8中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的羧基与试剂固定层中的氨基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此共价结合。在实施例8中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的羧基与试剂固定层中的氨基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层彼此共价结合。(实施例9)实施例9的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备——除了不同于实施例1,制备例17的试剂固定层涂布液用于-形成试剂固定层-,制备例23的测试线试剂涂布液用于<制备测试线转印介质>,和制备例24的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例1相同的方式评价。结果展示在表2和表3中。在实施例9中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的氨基与试剂固定层中的羧基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此共价结合。在实施例9中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的氨基与试剂固定层中的羧基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层彼此共价结合。(实施例10)实施例10的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备——除了不同于实施例1,制备例18的试剂固定层涂布液用于-形成试剂固定层-,制备例25的测试线试剂涂布液用于<制备测试线转印介质>,和制备例26的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例1相同的方式评价。结果展示在表2和表3中。在实施例10中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的羟基与连接体另一端的异氰酸基新形成醚键(共价键)和酰胺键(共价键)而产生的醚键和酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此共价结合。在实施例10中,以与实施例1相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的羟基与交联体(交叉连接体,cross-linker)另一端的异氰酸基新形成醚键(共价键)和酰胺键(共价键)而产生的醚键和酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层彼此共价结合。(比较例1)<制备测试装置>以下述方式制备图9和图10示例的测试装置10。图9是比较例的测试装置的顶视图。图10是沿直线b-b截取的图9的测试装置的示意性横截面视图。-制备纸基材-将作为热塑性树脂的聚酯系热熔体粘合剂(可获自toagoseico.,ltd.,aronmeltpes375s40)加热至190℃,然后用辊涂机涂布在切割成40mm宽和35mm长尺寸的pet膜(可获自torayindustries,inc.,lumirrors10,平均厚度为50微米)上以在pet膜上具有50微米的平均厚度,以形成粘合剂层。将其上形成粘合剂层的pet膜静置2小时以上。随后,充当流路部件30并且切割成与pet膜相同尺寸的硝基纤维素膜(可获自merckmilliporecorporation,hf180)与粘合剂层形成表面重叠,并且在150℃温度下将1kgf/cm2的负荷施加于重叠产物10秒,以形成纸基材。-固定捕捉核酸-如图9和图10示例,用正压喷雾装置(可获自biodot,inc.,biojet),将制备例9的测试线试剂涂布液以具有0.7mm长度的线形状涂布在距纸基材的流路部件30上游端9mm的位置处(测试线90a)。用正压喷雾装置,将制备例10的控制线试剂涂布液以具有0.7mm长度的线形状涂布在5mm距测试线90a的位置处(控制线90b)。在涂布后,将涂布液在20℃、20rh%下干燥16小时。以与实施例1相同的方式,通过ft-iratr方法,基于流路部件表面分析,确认捕捉核酸未通过共价结合固定至流路部件,证实固定前和固定后之间无光谱变化。-形成标识体供给部分-然后,制备例6的标识体试剂涂布液以60微升/cm2的量涂布在切割成40mm宽和18mm长尺寸的玻璃纤维垫(可获自merckmilliporecorporation,gfcp203000)上,并在减压下干燥过夜,以制备标识体支持垫。-测定组装件(测试装置)-在流路部件的试剂涂布面的相反侧面对基膜(pet膜)的状态下,将流路部件30粘贴在基膜上距沿基膜(pet膜)长方向的基膜(pet膜)一端33mm的位置处,基膜是切割成40mm宽和80mm长尺寸的pet膜(可获自torayindustries,inc.lumirrors10,平均厚度为100微米)。然后,将上述制备的并且具有40mm宽和18mm长尺寸的标识体支持垫以与流路部件30的上游端重叠2mm的方式设置和粘贴在流路部件30的上表面上(标识体供给部分40),并且将具有40mm宽和35mm长尺寸的样品垫(可获自merckmilliporecorporation,cfsp223000)以与标识体支持垫的上表面重叠18mm的方式设置和粘帖,以制备样品滴落垫(滴落部分)80。然后,将具有40mm宽和28mm长尺寸的吸收垫(可获自merckmilliporecorporation,cfsp223000)以与流路部件30的下游端重叠16mm的方式设置和粘贴在流路部件30的上表面上,以提供吸收部件70。最后,将获得的产物沿产物的长方向切割成4mm宽和80mm长的尺寸,以获得比较例1的用于核酸检测的侧向流动色谱装置(测试装置10)。以与实施例1相同的方式评价制备的比较例1的用于核酸检测的侧向流动色谱装置。结果展示在表2和表3中。(比较例2)比较例2的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备——除了不同于实施例1,制备例14的测试线试剂涂布液用于<制备测试线转印介质>并且制备例15的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例1相同的方式评价。结果展示在表2和表3中。在比较例2中,以与实施例1相同的方式,通过ft-iratr方法,基于流路部件表面分析,确认捕捉核酸未通过共价结合固定至流路部件,证实固定前和固定后之间无光谱变化。[表2][表3]根据表2和表3的结果,在线评价中,可以观察到实施例1至10中的线具有贯穿全线均匀的颜色光密度并且具有高可视性。在光密度评价中,可以观察到除例如实施例5和7外所有实施例的线都具有高密度。在s/n比方面,所有实施例都观察到高于或等于20的高数值。由总评价揭示,当成形体具有的官能团和捕捉核酸具有的官能团的组合是氨基和巯基的组合、氨基和羧基的组合、羧基和氨基的组合、和羟基和巯基的组合时,线的可视性特别优越。与此相比,在比较例1中,在线评价中,观察到显色,但线附近模糊严重,因而勉强可以观察到显色。在光密度评价中,线中的标记颗粒扩散在纸中,以使显色模糊化以具有低密度,导致显著低的s/n比。在比较例2中,在线的评价中不能观察到显色。(实施例11)实施例11的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备。在<线评价>中,用测试目标液测量线密度,该测试目标液通过如下制备:用5×ssc缓冲剂(75mm柠檬酸钠和750mm氯化钠,可获自nacalaitesque,inc.)制备包括从5’端起包含连续20个胞嘧啶(c)碱基和连续20个腺嘌呤(a)碱基的碱基序列的dna片段,至1.0μm的最终浓度。结果展示在表4中。(实施例12)实施例12的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备。在<线评价>中,用测试目标液测量线密度,该测试目标液通过如下制备:用5×ssc缓冲剂(75mm柠檬酸钠和750mm氯化钠,可获自nacalaitesque,inc.)制备包括从5’端起包含连续20个胞嘧啶(c)碱基、连续5个胸腺嘧啶(t)碱基、和连续20个腺嘌呤(a)碱基的碱基序列的dna片段,至1.0μm的最终浓度。结果展示在表4中。(实施例13)实施例13的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备。在<线评价>中,用测试目标液测量线密度,该测试目标液通过如下制备:用5×ssc缓冲剂(75mm柠檬酸钠和750mm氯化钠,可获自nacalaitesque,inc.)制备包括从5’端起包含连续20个胞嘧啶(c)碱基、连续10个胸腺嘧啶(t)碱基、和连续20个腺嘌呤(a)碱基的碱基序列的dna片段,至1.0μm的最终浓度。结果展示在表4中。(实施例14)实施例14的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备。在<线评价>中,用测试目标液测量线密度,该测试目标液通过如下制备:用5×ssc缓冲剂(75mm柠檬酸钠和750mm氯化钠,可获自nacalaitesque,inc.)制备包括从5’端起包含连续20个胞嘧啶(c)碱基、连续20个胸腺嘧啶(t)碱基、和连续20个腺嘌呤(a)碱基的碱基序列的dna片段,至1.0μm的最终浓度。结果展示在表4中。(实施例15)实施例15的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备。在<线评价>中,用测试目标液测量线密度,该测试目标液通过如下制备:用5×ssc缓冲剂(75mm柠檬酸钠和750mm氯化钠,可获自nacalaitesque,inc.)制备包括从5’端起包含连续20个胞嘧啶(c)碱基、连续30个胸腺嘧啶(t)碱基、和连续20个腺嘌呤(a)碱基的碱基序列的dna片段,至1.0μm的最终浓度。结果展示在表4中。(实施例16)实施例16的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例1相同的方式制备。在<线评价>中,用测试目标液测量用于核酸检测的侧向流动色谱装置的线密度,该测试目标液通过如下制备:用5×ssc缓冲剂(75mm柠檬酸钠和750mm氯化钠,可获自nacalaitesque,inc.)制备包括从5’端起包含连续20个胞嘧啶(c)碱基、连续40个胸腺嘧啶(t)碱基、和连续20个腺嘌呤(a)碱基的碱基序列的dna片段,至1.0μm的最终浓度。结果展示在表4中。[表4]根据表4的结果,实施例11至16全部的线都观察到显色。s/n值为20以上,虽然其实际测量没有展示。当与捕捉核酸结合的位点一端和与标识体结合的位点一端之间的距离为20个碱基以下,并且具体地10个碱基以下时,观察到高显色强度。(制备例101)-制备背层涂布液-将硅酮系橡胶乳液(可获自shin-etsuchemicalco.,ltd.,ks779h,其中固体浓度为按质量计30%)(16.8质量份)、氯铂酸催化剂(0.2质量份)、和甲苯(83质量份)混合,以获得背层涂布液。(制备例102)-制备剥离层涂布液-将聚乙烯蜡(可获自toyoadlcorporation,polywax1000,熔点为99℃并且25℃下的渗透度为2)(14质量份)、乙烯-乙酸乙烯酯共聚物(可获自dupont-mitsuipolychemicalsco.,ltd.,ev-150,重均分子量为2,100,并且vac为按质量计21%)(6质量份)、甲苯(60质量份)、和甲基乙基酮(20质量份)进行分散处理直到平均粒径为2.5微米,以获得剥离层涂布液。(制备例103)-制备试剂固定层涂布液-通过添加甲苯作为溶剂,将氨基乙基化丙烯酸聚合物(polymentnk-380,可获自nipponshokubaico.,ltd.)稀释至按质量计15%,以获得试剂固定层涂布液。已知氨基乙基化丙烯酸聚合物容易劣化(deteriorate),并且充分考虑其可对试剂的固定具有影响。因此,氨基乙基化丙烯酸聚合物的制备基于需要。(制备例104)-制备测试线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的gmbs(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。gmbs的结构式展示如下。连接体的间隔体长度是从箭头指示的n-羟基琥珀酸酰亚胺酯基团的碳原子至箭头指示的马来酰亚胺基团的碳原子的距离。[化学8](制备例105)-制备控制线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胞嘧啶(c)碱基并且在3’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的gmbs(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例106)-制备标识体(核酸)试剂涂布液-利用1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)(可获自thermofisherscientificinc.),通过酰胺结合使羧基改性的金胶体与连续包含20个鸟嘌呤(g)碱基并且在3’端引入氨基的dna片段结合。将所得物用50mmtris-hcl缓冲剂(ph=8.2)洗涤,悬浮在标识体稀释液(20mmtris-hcl缓冲剂(ph=8.2)、按质量计0.05%聚乙二醇、按质量计5%蔗糖、和纯化水)中,并调节至od=2,以获得标识体试剂涂布液。(制备例107)-制备测试线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)2(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例108)-制备控制线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胞嘧啶(c)碱基并且在3’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)2(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例109)-制备测试线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)4(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例110)-制备控制线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胞嘧啶(c)碱基并且在3’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)4(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例111)-制备测试线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)6(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例112)-制备控制线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胞嘧啶(c)碱基并且在3’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)6(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例113)-制备测试线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)8(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例114)-制备控制线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胞嘧啶(c)碱基并且在3’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)8(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例115)-制备测试线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)12(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例116)-制备控制线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胞嘧啶(c)碱基并且在3’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)12(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例117)-制备测试线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)24(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例118)-制备控制线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta,制备连续包含20个胞嘧啶(c)碱基并且在3’端引入巯基的dna片段以具有2.5μm的最终浓度。向所得物添加具有1mm最终浓度的sm(peg)24(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例119)-制备标识体(抗体)试剂涂布液-向金胶体溶液(可获自bbisolutions,emgc50)(9ml)添加制备成50mm(1ml)的kh2po4缓冲剂(ph=7.0),然后添加制备成50微克/ml(1ml)的抗生物素单克隆抗体(可获自bethyllaboratories,inc.,anti-biotin,goat-polya150-111a),并搅拌。将所得物静置10分钟。向所得物添加按质量计1%的聚乙二醇水溶液(可获自wakopurechemicalindustries,ltd.,168-11285)(550微升)并搅拌。向所得物进一步添加按质量计10%的bsa水溶液(可获自sigma-aldrichco.,llc,a-7906)(1.1ml)并搅拌。然后,将此溶液进行离心30分钟,然后在上清液被去除后,利用超声清洗器进行金胶体再分散。用离心机(可获自hitachikokico.,ltd.,himaccf16rn)以8,000×g的离心加速度在4℃下进行离心。随后,将所得物分散在金胶体防腐溶液[20mmtris-hcl缓冲剂(ph=8.2),按质量计0.05%聚乙二醇(重均分子量为2,000)、150mmnacl、按质量计1%bsa水溶液、和按质量计0.1%nan3水溶液](20ml)中,在如上所述相同条件下再次进行离心,并且在上清液被去除残留约1ml后,利用超声清洗器进行金胶体再分散。这些操作反复以制备在金胶体防腐溶液中od=15的溶液,以获得标识体试剂涂布液。(制备例120)-制备测试线试剂涂布液-用te缓冲剂(10mmtris-hcl和1mmedta,ph=7.4,可获自takarabioinc.)制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入巯基的dna片段至25μm,以获得测试线试剂涂布液。(制备例121)-制备控制线试剂涂布液-用te缓冲剂(10mmtris-hcl和1mmedta,ph=7.4,可获自takarabioinc.)制备连续包含20个胞嘧啶(c)碱基并且在3’端引入巯基的dna片段至25μm,以获得控制线试剂涂布液。(制备例122)-制备测试线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入巯基的dna片段以具有2.5μm的最终浓度,以获得测试线试剂涂布液。(制备例123)-制备控制线试剂涂布液-用具有100mm最终浓度(ph=7.2)的磷酸钠缓冲剂和具有5mm最终浓度的edta制备连续包含20个胞嘧啶(c)碱基并且在3’端引入巯基的dna片段以具有2.5μm的最终浓度,以获得控制线试剂涂布液。(实施例101)<制备测试线转印介质>-形成背层-将制备例101的背层涂布液涂布在支持体的一个表面上——支持体是具有4.5微米平均厚度的聚对苯二酸乙二醇酯(pet)膜(可获自torayindustries,inc.lumirrorf57)——并在80℃下干燥10秒,以形成具有0.02微米平均厚度的背层。-形成剥离层-然后,将制备例102的剥离层涂布液涂布在pet膜的背层形成表面的相反表面上,并在25℃下干燥30分钟,以形成具有30微米平均厚度的剥离层。-形成试剂固定层-然后,将制备例103的试剂固定层涂布液涂布在剥离层表面上,并在50℃下干燥30分钟,以形成具有3微米平均厚度的试剂固定层。以这种方式,制备了转印介质。<固定捕捉核酸>-测试线(固定第一捕捉核酸)-然后,将制备例104的测试线试剂涂布液倒入浅方桶,并使转印介质漂浮在测试线试剂涂布液上,使得仅试剂固定层表面接触测试线试剂涂布液。在这种状态下,将浅方桶覆盖并在25℃下静置30分钟。随后,将试剂固定层表面用50mmtris-hcl缓冲剂(ph=9.0)洗涤并在25℃下进行30分钟真空干燥,以使试剂固定至试剂固定层。以这种方式,制备了实施例101的测试线转印介质。该测试线转印介质在转印介质制成后立即用于制备用于核酸检测的侧向流动色谱装置。通过ft-iratr方法(ft-ir6800,可获自jascocorporation),基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层通过连接体彼此结合。<制备控制线转印介质>-控制线(固定第二捕捉核酸)-实施例101的控制线转印介质以与上述<制备测试线转印介质>相同的方式制备,除了不同于<制备测试线转印介质>,利用制备例105的控制线试剂涂布液代替测试线试剂涂布液。控制线转印介质在转印介质制成后立即用于制备用于核酸检测的侧向流动色谱装置。通过ft-iratr方法(ft-ir6800,可获自jascocorporation),基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层通过连接体彼此结合。<制备测试装置>以下述方式制备图1和图2示例的测试装置10。图1是实施例的测试装置的顶视图。图2是沿直线a-a截取的图1的测试装置的示意性横截面视图。在测试装置制成后立即进行反应和评价。-制备纸基材(基材+流路部件)-将作为热塑性树脂的聚酯系热熔体粘合剂(可获自toagoseico.,ltd.,aronmeltpes375s40)加热至190℃,然后用辊涂机涂布在切割成40mm宽和80mm长尺寸的pet膜(可获自torayindustries,inc.,lumirrors10,平均厚度为50微米)20上以在pet膜上具有50微米的平均厚度,以形成粘合剂层。将其上形成粘合剂层的pet膜20静置2小时以上。随后,将切割成40mm宽和35mm长尺寸的硝基纤维素膜(可获自merckmilliporecorporation,hf180)与粘合剂层表面在距粘合剂层表面长方向一端(此端是上游端,相反端是下游端)33mm的位置处重叠——在硝基纤维素膜和粘合剂层表面在宽方向上吻合的状态下——并在150℃温度下将1kgf/cm2的负荷施加于重叠产物10秒,以形成流路部件30。最后,将获得的产物沿产物的长方向切割成4mm宽和80mm长的尺寸,以获得纸基材。按照下方计算式1,基于流路部件的基重(g/m2)和平均厚度(微米)和流路部件组分的比重,计算作为纸基材的流路部件30的硝基纤维素膜的空隙率。结果是,硝基纤维素膜的空隙率为70%。<计算式1>空隙率(%)={1-[基重(g/m2)/平均厚度(微米)/组分的比重]}×100当流路部件的空隙率为40%以上但90%以下时,流路部件可被称为是多孔的。-转印测试线-使纸基材的流路部件30和测试线转印介质的试剂固定侧彼此面对并重叠。随后,用热转印印制机,如图1和图2示例,将测试线转印介质以具有4mm宽度和0.7mm长度的线形状转印到距流路部件30上游端9mm的位置上(第一检测部分50a)。作为热转印印制机,用具有300dpi点密度的热头(可获自tdkcorporation)构建具有42mm/sec的印制速度和0.17mj/点的施加能的评价系统。-转印控制线-然后,将控制线转印介质以具有4mm宽度和0.7mm长度的线形状转印到距测试线转印介质转印位置5mm的位置上(第二检测部分50b)。-形成标识体供给部分-然后,将制备例106的标识体试剂涂布液以60微升/cm2的量涂布在切割成4mm宽和18mm长尺寸的玻璃纤维垫(可获自merckmilliporecorporation,gfcp203000)上,并在减压下干燥过夜,以制备标识体支持垫。如图1和图2示例,将标识体支持垫设置在距纸基材上游端17mm的位置处,并与纸基材上提供的粘合剂层重叠和粘贴在该粘合剂层上(标识体供给部分40)。-形成滴落部分-如图1和图2示例,将具有4mm宽度和35mm长度的样品垫(可获自merckmilliporecorporation,cfsp223000)以如下方式设置和粘帖:与标识体供给部分40上表面重叠18mm(滴落部分80)。-吸收部件-如图1和图2示例提供吸收部件70(可获自merckmilliporecorporation,cfsp223000)。以这种方式,获得实施例101的用于核酸检测的侧向流动色谱装置(测试装置10)。<线评价>-制备测试目标液-用5×ssc缓冲剂(75mm柠檬酸钠和750mm氯化钠,可获自nacalaitesque,inc.)制备包括从5’端起包含连续20个胞嘧啶(c)碱基、重复包含10个胸腺嘧啶(t)和鸟嘌呤(g)碱基的序列、和连续20个腺嘌呤(a)碱基的碱基序列的dna片段以具有1.0nm的最终浓度,以获得测试目标液。-反应-将测试目标液以100微升量滴落在图1和图2示例的用于核酸检测的侧向流动色谱装置10的上游端部分上。30分钟后,基于目视观察按照下述标准对线进行评价。结果展示在表6中。<评价标准>a:识别测试线和控制线各位置清晰显色,贯穿全线均匀的颜色光密度,而不存在线中断。b:线无中断并且能够实现判定,但各位置之间颜色光密度略不均匀。c:勉强识别显色为线形状,但线中有部分中断。d:不识别显色,或显色不是线形状,如当线流至下游侧时。评价标准实例展示在表5中。表5中的照片均是测试线在测试后的照片。[表5]<测量线的光密度>用色谱读取器(可获自hamamatsuphotonicsk.k.,c10066)测量用于核酸检测的侧向流动色谱装置在显色和如上用于线评价后,以获得线光密度。按照下述标准评价光密度。结果展示在表7中。线光密度越大越优选。当通过色谱读取器检测不到线光密度时,结果展示为“-”。当通过此色谱读取器得到的光密度为20以上时,显色可目视识别。<线光密度评价标准>a:光密度为250以上。b:光密度为150以上但小于250。c:光密度为20以上但小于150。d:光密度为小于20,或因线识别不出而不能测量。(实施例102)实施例102的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例101相同的方式制备——除了不同于实施例101,制备例107的测试线试剂涂布液用于<制备测试线转印介质>并且制备例108的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例101相同的方式评价。结果展示在表6和表7中。在实施例102中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层通过连接体彼此结合。在实施例102中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层通过连接体彼此结合。(实施例103)实施例103的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例101相同的方式制备——除了不同于实施例101,制备例109的测试线试剂涂布液用于<制备测试线转印介质>并且制备例110的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例101相同的方式评价。结果展示在表6和表7中。在实施例103中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层通过连接体彼此结合。在实施例103中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层通过连接体彼此结合。(实施例104)实施例104的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例101相同的方式制备——除了不同于实施例101,制备例111的测试线试剂涂布液用于<制备测试线转印介质>并且制备例112的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例101相同的方式评价。结果展示在表6和表7中。在实施例104中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层通过连接体彼此结合。在实施例104中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层通过连接体彼此结合。(实施例105)实施例105的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例101相同的方式制备——除了不同于实施例101,制备例113的测试线试剂涂布液用于<制备测试线转印介质>并且制备例114的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例101相同的方式评价。结果展示在表6和表7中。在实施例105中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层通过连接体彼此结合。在实施例105中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层通过连接体彼此结合。(实施例106)实施例106的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例101相同的方式制备——除了不同于实施例101,制备例115的测试线试剂涂布液用于<制备测试线转印介质>并且制备例116的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例101相同的方式评价。结果展示在表6和表7中。在实施例106中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层通过连接体彼此结合。在实施例106中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层通过连接体彼此结合。(实施例107)实施例107的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例101相同的方式制备——除了不同于实施例101,制备例117的测试线试剂涂布液用于<制备测试线转印介质>并且制备例118的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例101相同的方式评价。结果展示在表6和表7中。在实施例107中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层通过连接体彼此结合。在实施例107中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层通过连接体彼此结合。(实施例108)实施例108的其上仅转印测试线的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例103相同的方式制备——除了不同于实施例103,制备例113的标识体试剂涂布液用于<形成标识体供给部分>;并以与实施例101相同的方式评价——除了在<线评价>中,测试目标液用如下dna片段制备:5’端以生物素标记并且包括碱基序列,该碱基序列从5’端起包含:重复包含10个胸腺嘧啶(t)和鸟嘌呤(g)碱基的序列、和连续20个腺嘌呤(a)碱基。在实施例108中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第一捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层通过连接体彼此结合。在实施例108中,以与实施例101相同的方式,通过ft-iratr方法,基于可归因于由第二捕捉核酸中的巯基与连接体一端的马来酰亚胺基团新形成硫醚键(共价键)而产生的硫醚键的光谱是否存在和可归因于由试剂固定层中的氨基与连接体另一端的n-羟基磺基琥珀酰亚胺酯基团新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层通过连接体彼此结合。(比较例101)<制备测试装置>以下述方式制备图9和图10示例的测试装置10。图9是测试装置的顶视图。图10是沿直线b-b截取的图9的测试装置的示意性横截面视图。-制备纸基材-将作为热塑性树脂的聚酯系热熔体粘合剂(可获自toagoseico.,ltd.,aronmeltpes375s40)加热至190℃,然后用辊涂机涂布在切割成40mm宽和35mm长尺寸的pet膜(可获自torayindustries,inc.,lumirrors10,平均厚度为50微米)上以在pet膜上具有50微米的平均厚度,以形成粘合剂层。将其上形成粘合剂层的pet膜静置2小时以上。随后,将充当流路部件30并且切割成与pet膜相同尺寸的硝基纤维素膜(可获自merckmilliporecorporation,hf180)与粘合剂层形成表面重叠,并在150℃温度下将1kgf/em2的负荷施加于重叠产物10秒,以形成纸基材。-固定捕捉核酸-如图9和图10示例,用正压喷雾装置(可获自biodot,inc.,biojet),将制备例120的测试线试剂涂布液以具有0.7mm长度的线形状涂布在距纸基材的流路部件30上游端9mm的位置处(测试线90a)。用正压喷雾装置,将制备例121的控制线试剂涂布液以具有0.7mm长度的线形状涂布在距测试线90a5mm的位置处(控制线90b)。在涂布后,将涂布液在20℃、20rh%下干燥16小时。以与实施例101相同的方式,通过ft-iratr方法,基于流路部件表面分析,确认捕捉核酸未通过连接体固定至流路部件,证实固定前和固定后之间无光谱变化。-形成标识体供给部分-然后,将制备例106的标识体试剂涂布液以60微升/cm2的量涂布在切割成40mm宽和18mm长尺寸的玻璃纤维垫(可获自merckmilliporecorporation,gfcp203000)上,并在减压下干燥过夜,以制备标识体支持垫。-测定组装件(测试装置)-在流路部件的试剂涂布面的相反侧面对基膜(pet膜)的状态下,将流路部件30在基膜(pet膜)长方向上距基膜(pet膜)一端33mm的位置处粘贴在基膜上,基膜是切割成40mm宽和80mm长尺寸的pet膜(可获自torayindustries,inc.lumirrors10,平均厚度为100微米)。然后,将上述制备的并且具有40mm宽和18mm长尺寸的标识体支持垫以与流路部件30上游端重叠2mm的方式设置和粘贴在流路部件30的上表面上(标识体供给部分40),并将具有40mm宽和35mm长尺寸的样品垫(可获自merckmilliporecorporation,cfsp223000)以如下方式设置和粘帖:与标识体支持垫的上表面重叠18mm,以制备样品滴落垫(滴落部分)80。然后,将具有40mm宽和28mm长尺寸的吸收垫(可获自merckmilliporecorporation,cfsp223000)以与流路部件30下游端重叠16mm的方式设置和粘贴在流路部件30的上表面上,以提供吸收部件70。最后,将获得的产物沿产物的长方向切割成4mm宽和80mm长的尺寸,以获得比较例101的用于核酸检测的侧向流动色谱装置(测试装置10)。以与实施例101相同的方式评价比较例101制备的用于核酸检测的侧向流动色谱装置。结果展示在表6和表7中。(比较例102)比较例102的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例101相同的方式制备——除了不同于实施例101,制备例122的测试线试剂涂布液用于<制备测试线转印介质>并且制备例123的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例101相同的方式评价。结果展示在表6和表7中。在比较例101和102中,以与实施例101相同的方式,通过ft-iratr方法,基于流路部件表面分析,确认捕捉核酸不与流路部件结合,证实固定前和固定后之间无光谱变化。[表6][表7]根据表6和表7的结果,在实施例101至108中,在可视性评价中,可以观察到线具有贯穿全线的均匀颜色光密度并且具有高可视性。在光密度评价中,可以观察到线具有高密度,并且所用连接体全部产生良好结果。与此相比,在比较例101中——其中捕捉核酸不与试剂固定层共价结合,在可视性评价中,观察到显色,但线附近模糊严重,使得勉强可以观察到显色。同样,在比较例102中,不能观察到线上显色。(实施例109)实施例109的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例101相同的方式制备。<线评价>-制备测试目标液-用5×ssc缓冲剂(75mm柠檬酸钠和750mm氯化钠,可获自nacalaitesque,inc.)制备包括从5’端起包含连续20个胞嘧啶(c)碱基、重复包含10个胸腺嘧啶(t)和鸟嘌呤(g)碱基的序列、和连续20个腺嘌呤(a)碱基的碱基序列的dna片段以具有1×10-13m至1×10-7m(0.1pm至100nm)的10倍间隔的最终浓度,以获得具有7种不同浓度的测试目标液。-反应-将各测试目标液以100微升量滴落到图1和图2示例的用于核酸检测的侧向流动色谱装置10的上游端部分上。30分钟后,用色谱读取器(可获自hamamatsuphotonicsk.k.,c10066)测量显色后的用于核酸检测的侧向流动色谱装置,以获得线的光密度。按照下述标准评价光密度。通过制备的用于核酸检测的侧向流动色谱装置,将每种具有对应浓度的测试目标液用于反应和测量3次,并且将平均值用于评价。线光密度越大越优选。当通过色谱读取器检测不到线光密度时,结果展示为“-”。当通过此色谱读取器得到的光密度为20以上时,显色可目视识别。基于标准偏差,按照下述标准评价光密度差异。另外按照下述标准评价可检测浓度范围。关于核酸检测,可检测浓度范围越宽越优选。结果展示在表8-1和表8-2中。<线光密度评价标准>++++:光密度为250以上。+++:光密度为150以上但小于250。++:光密度为50以上但小于150。+:光密度为20以上但小于50。-:光密度为小于20,或因线识别不出而不可检测。<线光密度差异评价标准>a:标准偏差在20%之内。b:标准偏差超过20%但在40%之内。c:标准偏差超过40%但在60%之内。d:标准偏差超过60%。(实施例110)实施例110的用于核酸检测的侧向流动色谱装置以与实施例102相同的方式制备并以与实施例109相同的方式评价。结果展示在表8-1和表8-2中。(实施例111)实施例111的用于核酸检测的侧向流动色谱装置以与实施例103相同的方式制备并以与实施例109相同的方式评价。结果展示在表8-1和表8-2中。(实施例112)实施例112的用于核酸检测的侧向流动色谱装置以与实施例104相同的方式制备并以与实施例109相同的方式评价。结果展示在表8-1和表8-2中。(实施例113)实施例113的用于核酸检测的侧向流动色谱装置以与实施例105相同的方式制备并以与实施例109相同的方式评价。结果展示在表8-1和表8-2中。(实施例114)实施例114的用于核酸检测的侧向流动色谱装置以与实施例106相同的方式制备并以与实施例109相同的方式评价。结果展示在表8-1和表8-2中。(实施例115)实施例115的用于核酸检测的侧向流动色谱装置以与实施例107相同的方式制备并以与实施例109相同的方式评价。结果展示在表8-1和表8-2中。[表8-1][表8-2]差异可检测浓度范围(m)实施例109a1×105实施例110a1×105实施例111a1×104实施例112b1×104实施例113c1×103实施例114c1×102实施例115c1×103根据表8-1和表8-2的结果,实施例109至111的光密度具有小差异。实施例109至112具有1×104m以上的可检测浓度范围,其是宽泛的可检测浓度范围。具体地,实施例109和110呈现1×105m以上的宽泛的可检测浓度范围。(制备例201)-制备背层涂布液-将硅酮系橡胶乳液(可获自shin-etsuchemicalco.,ltd.,ks779h,其中固体浓度为按质量计30%)(16.8质量份)、氯铂酸催化剂(0.2质量份)、和甲苯(83质量份)混合,以获得背层涂布液。(制备例202)-制备剥离层涂布液-将聚乙烯蜡(可获自toyoadlcorporation,polywax1000,熔点为99℃并且25℃下的渗透度为2)(14质量份)、乙烯-乙酸乙烯酯共聚物(可获自dupont-mitsuipolychemicalsco.,ltd.,ev-150,重均分子量为2,100并且vac为按质量计21%)(6质量份)、甲苯(60质量份)、和甲基乙基酮(20质量份)进行分散处理直到平均粒径为2.5微米,以获得剥离层涂布液。(制备例203)-制备试剂固定层涂布液-通过添加甲苯作为溶剂,将氨基乙基化丙烯酸聚合物(polymentnk-380,可获自nipponshokubaico.,ltd.)稀释至按质量计15%,以获得试剂固定层涂布液。已知氨基乙基化丙烯酸聚合物容易劣化并且充分考虑其可对试剂的固定具有影响。因此,氨基乙基化丙烯酸聚合物的制备基于需要。(制备例204)-制备测试线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories)制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入羧基的dna片段,以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例205)-制备控制线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories)制备连续包含20个胞嘧啶(c)碱基并且在3’端引入羧基的dna,以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例206)-制备标识体(核酸)试剂涂布液-利用1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)(可获自thermofisherscientificinc.),使羧基改性的金胶体通过酰胺结合与连续包含20个鸟嘌呤(g)碱基并且在3’端引入氨基的dna片段结合。将所得物用50mmtris-hcl缓冲剂(ph=8.2)洗涤,悬浮在标识体稀释液(20mmtris-hcl缓冲剂(ph=8.2)、按质量计0.05%聚乙二醇、按质量计5%蔗糖、和纯化水)中,并调节至od=2,以获得标识体试剂涂布液。(制备例207)-制备测试线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories)制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入羧基和1分子c3连接体的dna片段,以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。dna片段由下方通式a表示,其中n=1。<通式a>[化学9]在通式a中,n表示整数,优选20以下,更优选0至5。(制备例208)-制备测试线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories)制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入羧基和2分子c3连接体的dna片段,以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。制备例208的dna片段由上方通式a表示,其中n=2。(制备例209)-制备测试线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories)制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入羧基和3分子c3连接体的dna片段,以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。制备例209的dna片段由上方通式a表示,其中n=3。(制备例210)-制备测试线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories),制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入羧基和4分子c3连接体的dna片段,以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。制备例210的dna片段由上方通式a表示,其中n=4。(制备例211)-制备测试线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories)制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入羧基和5分子c3连接体的dna片段,以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。制备例211的dna片段由上方通式a表示,其中n=5。(制备例212)-制备试剂固定层涂布液-通过添加甲基乙基酮/甲苯混合液(体积比为6∶4)作为溶剂,将含羧基的酯树脂(ap2510,可获自arakawachemicalindustries,ltd.)稀释至按质量计15%,以获得试剂固定层涂布液。(制备例213)-制备测试线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories)制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入氨基的dna片段,以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例214)-制备控制线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories)制备连续包含20个胞嘧啶(c)碱基并且在3’端引入氨基的dna片段,以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得控制线试剂涂布液。(制备例215)-制备测试线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories)制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入氨基和5分子c3连接体的dna片段,以具有2.5μm的最终浓度。向所得物添加具有1.25mg/ml最终浓度的edc(可获自thermofisherscientificinc.)作为连接体,以获得测试线试剂涂布液。(制备例216)-制备标识体(抗体)试剂涂布液-向金胶体溶液(可获自bbisolutions,emgc50)(9ml)添加制备成50mm的kh2po4缓冲剂(ph=7.0)(1ml),然后添加制备成50微克/ml的抗生物素单克隆抗体(可获自bethyllaboratories,inc.,anti-biotin,goat-polya150-111a)(1ml),并搅拌。将所得物静置10分钟。向所得物添加按质量计1%的聚乙二醇水溶液(可获自wakopurechemicalindustries,ltd.,168-11285)(550微升)并搅拌。向所得物进一步添加按质量计10%bsa的水溶液(可获自sigma-aldrichco.,llc,a-7906)(1.1ml)并搅拌。然后,将此溶液进行离心30分钟,然后在上清液被去除后,利用超声清洗器进行金胶体再分散。用离心机(可获自hitachikokico.,ltd.,himaccf16rn)以8,000×g的离心加速度在4℃下进行离心。随后,将所得物分散在金胶体防腐溶液[20mmtris-hcl缓冲剂(ph=8.2)、按质量计0.05%聚乙二醇(重均分子量为2,000)、150mmnacl、按质量计1%bsa水溶液、和按质量计0.1%nan3水溶液](20ml)中,在如上所述相同条件下再次进行离心,并且在上清液被去除残留约1ml后,利用超声清洗器进行金胶体再分散。这些操作反复进行以制备在金胶体防腐溶液中od=15的溶液,以获得标识体试剂涂布液。(制备例217)-制备测试线试剂涂布液-用te缓冲剂(10mmtris-hcl和1mmedta,ph=7.4,可获自takarabioinc.)制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入羧基的dna片段至25μm,以获得测试线试剂涂布液。(制备例218)-制备控制线试剂涂布液-用te缓冲剂(10mmtris-hcl和1mmedta,ph=7.4,可获自takarabioinc.)制备连续包含20个胞嘧啶(c)碱基并且在3’端引入羧基的dna片段至25μm,以获得控制线试剂涂布液。(制备例219)-制备测试线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories)制备连续包含20个胸腺嘧啶(t)碱基并且在5’端引入羧基的dna片段以具有2.5μm的最终浓度,以获得测试线试剂涂布液。(制备例220)-制备控制线试剂涂布液-用具有100mm最终浓度的mes缓冲剂(可获自dojindolaboratories)制备连续包含20个胞嘧啶(c)碱基并且在3’端引入羧基的dna片段以具有2.5μm的最终浓度,以获得控制线试剂涂布液。(实施例201)<制备测试线转印介质>-形成背层-将制备例201的背层涂布液涂布在支持体的一个表面上——支持体是具有4.5微米平均厚度的聚对苯二酸乙二醇酯(pet)膜(可获自torayindustries,inc.lumirrorf57)——并在80℃下干燥10秒,以形成具有0.02微米平均厚度的背层。-形成剥离层-然后,将制备例202的剥离层涂布液涂布在pet膜的背层形成表面的相反表面上并在25℃下干燥30分钟,以形成具有30微米平均厚度的剥离层。-形成试剂固定层-然后,将制备例203的试剂固定层涂布液涂布在剥离层表面上,并在真空中在室温下干燥30分钟,以形成具有6微米平均厚度的试剂固定层。以这种方式,制备了转印介质。<固定捕捉核酸s>-测试线(固定第一捕捉核酸)-然后,将制备例204的测试线试剂涂布液倒入浅方桶,并使转印介质漂浮在测试线试剂涂布液上,使得仅试剂固定层表面接触测试线试剂涂布液。在这种状态下,将浅方桶覆盖并在25℃下静置2小时。随后,将试剂固定层表面用50mmtris-hcl缓冲剂(ph=9.0)洗涤,并进行空气干燥,以制备实施例201的测试线转印介质。将测试线转印介质在转印介质制成后立即用于制备用于核酸检测的侧向流动色谱装置。通过ft-iratr方法(ft-ir6800,可获自jascocorporation),基于可归因于由第一捕捉核酸中的羧基与试剂固定层中的氨基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存,确认第一捕捉核酸和试剂固定层彼此结合在。<制备控制线转印介质>-控制线(固定第二捕捉核酸)-实施例201的控制线转印介质以与上述<制备测试线转印介质>相同的方式制备,除了不同于<制备测试线转印介质>,利用制备例205的控制线试剂涂布液代替测试线试剂涂布液。控制线转印介质在转印介质制成后立即用于制备用于核酸检测的侧向流动色谱装置。通过ft-iratr方法(ft-ir6800,可获自jascocorporation),基于可归因于由第二捕捉核酸中的羧基与试剂固定层中的氨基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层彼此结合。<制备测试装置>以下述方式制备图1和图2示例的测试装置10。图1是实施例的测试装置的顶视图。图2是沿直线a-a截取的图1的测试装置的示意性横截面视图。在测试装置制成后立即进行反应和评价。-制备纸基材(基材+流路部件)-将作为热塑性树脂的聚酯系热熔体粘合剂(可获自toagoseico.,ltd.,aronmeltpes375s40)加热至190℃,然后用辊涂机涂布在切割成40mm宽和80mm长尺寸的pet膜(可获自torayindustries,inc.,lumirrors10,平均厚度为50微米)20上以在pet膜上具有50微米的平均厚度,以形成粘合剂层。将其上形成粘合剂层的pet膜20静置2小时以上。随后,将切割成40mm宽和35mm长尺寸的硝基纤维素膜(可获自merckmilliporecorporation,hf180)与粘合剂层表面在距粘合剂层表面长方向一端(此端是上游端,相反端是下游端)33mm的位置处重叠——在硝基纤维素膜和粘合剂层表面在宽方向上吻合的状态下——并将1kgf/cm2的负荷在150℃温度下施加于重叠产物10秒,以形成流路部件30。最后,将获得的产物沿产物的长方向切割成4mm宽和80mm长的尺寸,以获得纸基材。按照下方计算式1,基于流路部件的基重(g/m2)和平均厚度(微米)和流路部件组分的比重,计算作为纸基材的流路部件30的硝基纤维素膜的空隙率。结果是,硝基纤维素膜的空隙率为70%。<计算式1>空隙率(%)={1-[基重(g/m2)/平均厚度(微米)/组分的比重]}×100当流路部件的空隙率为40%以上但90%以下,流路部件可被称为是多孔的。-转印测试线-使纸基材的流路部件30和测试线转印介质的试剂固定侧彼此面对并重叠。随后,用热转印印制机,如图1和图2示例,将测试线转印介质以具有4mm宽度和0.7mm长度的线形状转印到距流路部件30上游端9mm的位置上(第一检测部分50a)。作为热转印印制机,用具有300dpi点密度的热头(可获自tdkcorporation)构建具有42mm/sec的印制速度和0.17mj/点的施加能的评价系统。-转印控制线-然后,将控制线转印介质以具有4mm宽度和0.7mm长度的线形状转印到距测试线转印介质转印位置5mm的位置上(第二检测部分50b)。-形成标识体供给部分-然后,将制备例206的标识体试剂涂布液以60微升/cm2的量涂布在切割成4mm宽和18mm长尺寸的玻璃纤维垫(可获自merckmilliporecorporation,gfcp203000)上,并在减压下干燥过夜,以制备标识体支持垫。如图1和图2示例,将标识体支持垫设置在距纸基材上游端17mm的位置处,并与纸基材上提供的粘合剂层重叠和粘贴在该粘合剂层上(标识体供给部分40)。-形成滴落部分-如图1和图2示例,将具有4mm宽度和35mm长度的样品垫(可获自merckmilliporecorporation,cfsp223000)以如下方式设置和粘帖:与标识体供给部分40的上表面重叠18mm(滴落部分80)。-吸收部件-如图1和图2示例提供吸收部件70(可获自merckmilliporecorporation,cfsp223000)。以这种方式,获得实施例201的用于核酸检测的侧向流动色谱装置(测试装置10)。<线评价>-制备测试目标液-用5×ssc缓冲剂(75mm柠檬酸钠和750mm氯化钠,可获自nacalaitesque,inc.)制备包括从5’端起包含连续20个胞嘧啶(c)碱基、重复包含10个胸腺嘧啶(t)和鸟嘌呤(g)碱基的序列、和连续20个腺嘌呤(a)碱基的碱基序列的dna片段,以具有10pm最终浓度、1nm最终浓度和100nm最终浓度,以获得测试目标液。-反应-将具有1nm最终浓度的测试目标液以100微升量滴落到图1和图2示例的用于核酸检测的侧向流动色谱装置10的上游端部分上。30分钟后,基于目视观察按照下述标准对线进行评价。结果展示在表10中。<评价标准>a:识别测试线和控制线各位置清晰显色,贯穿全线颜色光密度均匀,而不存在线中断。b:线无中断并且能够实现判定,但各位置之间颜色光密度略不均匀。c:勉强识别显色为线形状,但线中有部分中断。d:不识别显色,或显色不是线形状,如当线流至下游侧时。评价标准实例展示在表9中。表9中的照片均是测试线在测试后的照片。[表9]<测量线的光密度>用色谱读取器(可获自hamamatsuphotonicsk.k.,c10066)测量显色和如上用于线评价后的用于核酸检测的侧向流动色谱装置,以获得线光密度。按照下述标准评价线光密度。结果展示在表11中。线光密度越大越优选。当通过色谱读取器检测不到线光密度时,结果展示为“-”。当通过此色谱读取器得到的光密度为20以上时,显色可目视识别。<线光密度评价标准>++++:光密度为250以上。+++:光密度为150以上但小于250。++:光密度为50以上但小于150。+:光密度为20以上但小于50。-:光密度为小于20,或因线识别不出而不可测量。(实施例202)实施例202的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例201相同的方式制备——除了不同于实施例201,制备例207的测试线试剂涂布液用于<制备测试线转印介质>;并以与实施例201相同的方式评价。结果展示在表10和表11中。在实施例202中,通过ft-iratr方法,以与实施例201相同的方式,基于可归因于由第一捕捉核酸中的羧基与试剂固定层中的氨基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此结合。(实施例203)实施例203的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例201相同的方式制备——除了不同于实施例201,制备例208的测试线试剂涂布液用于<制备测试线转印介质>;并以与实施例201相同的方式评价。结果展示在表10和表11中。在实施例203中,通过ft-iratr方法,以与实施例201相同的方式,基于可归因于由第一捕捉核酸中的羧基与试剂固定层中的氨基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此结合。(实施例204)实施例204的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例201相同的方式制备——除了不同于实施例201,制备例209的测试线试剂涂布液用于<制备测试线转印介质>;并以与实施例201相同的方式评价。结果展示在表10和表11中。在实施例204中,通过ft-iratr方法,以与实施例201相同的方式,基于可归因于由第一捕捉核酸中的羧基与试剂固定层中的氨基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此结合。(实施例205)实施例205的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例201相同的方式制备——除了不同于实施例201,制备例210的测试线试剂涂布液用于<制备测试线转印介质>;并以与实施例201相同的方式评价。结果展示在表10和表11中。在实施例205中,通过ft-iratr方法,以与实施例201相同的方式,基于可归因于由第一捕捉核酸中的羧基与试剂固定层中的氨基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此结合。(实施例206)实施例206的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例201相同的方式制备——除了不同于实施例201,制备例211的测试线试剂涂布液用于<制备测试线转印介质>;并以与实施例201相同的方式评价。结果展示在表10和表11中。在实施例206中,通过ft-iratr方法,以与实施例201相同的方式,基于可归因于由第一捕捉核酸中的羧基与试剂固定层中的氨基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此结合。(实施例207)实施例207的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例201相同的方式制备——除了不同于实施例201,制备例212的试剂固定层涂布液用于-形成试剂固定层-,制备例213的测试线试剂涂布液用于<制备测试线转印介质>,和制备例214的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例201相同的方式评价。结果展示在表10和表11中。在实施例207中,通过ft-iratr方法(ft-ir6800,可获自jascocorporation),基于可归因于由第一捕捉核酸中的氨基与试剂固定层中的羧基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此结合。在实施例207中,通过ft-iratf方法(ft-ir6800,可获自jascocorporation),基于可归因于由第二捕捉核酸中的氨基与试剂固定层中的羧基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第二捕捉核酸和试剂固定层彼此结合。(实施例208)实施例208的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例207相同的方式制备——除了不同于实施例207,制备例215的测试线试剂涂布液用于<制备测试线转印介质>;并以与实施例201相同的方式评价。结果展示在表10和表11中。在实施例208中,通过ft-iratr方法(ft-ir6800,可获自jascocorporation),基于可归因于由第一捕捉核酸中的氨基与试剂固定层中的羧基新形成酰胺键(共价键)而产生的酰胺键的光谱是否存在,确认第一捕捉核酸和试剂固定层彼此结合。(实施例209)实施例209的其上仅转印测试线的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例201相同的方式制备——除了不同于实施例201,制备例216的标识体试剂涂布液用于-形成标识体供给部分-;并以与实施例201相同的方式评价——除了在<线评价>中,测试目标液用如下dna片段制备:5’端以生物素标记并且包括碱基序列,该碱基序列从5’端起包含:重复包含10个胸腺嘧啶(t)和鸟嘌呤(g)碱基的序列、和连续20个腺嘌呤(a)碱基。(实施例210)实施例210的其上仅转印测试线的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例206相同的方式制备——除了不同于实施例206,制备例216的标识体试剂涂布液用于-形成标识体供给部分-;并以与实施例201相同的方式评价——除了在<线评价>中,测试目标液用如下dna片段制备:5’端以生物素标记并且包括碱基序列,该碱基序列从5’端起包含:重复包含10个胸腺嘧啶(t)和鸟嘌呤(g)碱基的序列、和连续20个腺嘌呤(a)碱基。(比较例201)<制备测试装置>以下述方式制备图9和图10示例的测试装置10。图9是比较例的测试装置的顶视图。图10是沿直线b-b截取的图9的测试装置的示意性横截面视图。-制备纸基材-将作为热塑性树脂的聚酯系热熔体粘合剂(可获自toagoseico.,ltd.,aronmeltpes375s40)加热至190℃,然后用辊涂机涂布在切割成40mm宽和35mm长尺寸的pet膜(可获自torayindustries,inc.,lumirrors10,平均厚度为50微米)上以在pet膜上具有50微米的平均厚度,以形成粘合剂层。将其上形成粘合剂层的pet膜静置2小时以上。随后,将充当流路部件30并且切割成与pet膜相同尺寸的硝基纤维素膜(可获自merckmilliporecorporation,hf180)与粘合剂层形成表面重叠,并将1kgf/cm2的负荷在150℃温度下施加于重叠产物10秒,以形成纸基材。-固定捕捉核酸-如图9和图10示例,用正压喷雾装置(可获自biodot,inc.,biojet),将制备例217的测试线试剂涂布液以具有0.7mm长度的线形状涂布在距纸基材的流路部件30上游端9mm的位置处(测试线90a)。用正压喷雾装置,将制备例218的控制线试剂涂布液以具有0.7mm长度的线形状涂布在距测试线90a5mm的位置处(控制线90b)。在涂布后,将涂布液在20℃、20rh%下干燥16小时。通过ft-iratr方法,以与实施例201相同的方式,基于流路部件表面分析,确认捕捉核酸不与流路部件结合,证实固定前和固定后之间无光谱变化。-形成标识体供给部分-然后,将制备例206的标识体试剂涂布液以60微升/cm2的量涂布在切割成40mm宽和18mm长尺寸的玻璃纤维垫(可获自merckmilliporecorporation,gfcp203000)上,并在减压下干燥过夜,以制备标识体支持垫。-测定组装件(测试装置)-在流路部件的试剂涂布面的相反侧面对基膜(pet膜)的状态下,将流路部件30在基膜(pet膜)长方向上距基膜(pet膜)一端33mm的位置处粘贴在基膜上,基膜是切割成40mm宽和80mm长尺寸的pet膜(可获自torayindustries,inc.lumirrors10,平均厚度为100微米)。然后,上述制备的并且具有40mm宽和18mm长尺寸的标识体支持垫以与流路部件30的上游端重叠2mm的方式设置和粘贴在流路部件30的上表面上(标识体供给部分40),并将具有40mm宽和35mm长尺寸的样品垫(可获自merckmilliporecorporation,cfsp223000)以与标识体支持垫的上表面重叠18mm的方式设置和粘帖,以制备样品滴落垫(滴落部分)80。然后,将具有40mm宽和28mm长尺寸的吸收垫(可获自merckmilliporecorporation,cfsp223000)以与流路部件30下游端重叠16mm的方式设置和粘贴在流路部件30的上表面上,以提供吸收部件70。最后,将获得的产物沿产物的长方向切割成4mm宽和80mm长的尺寸,以获得比较例201的用于核酸检测的侧向流动色谱装置(测试装置10)。以与实施例201相同的方式评价比较例201制备的用于核酸检测的侧向流动色谱装置。结果展示在表10和表11中。(比较例202)比较例202的用于核酸检测的侧向流动色谱装置(测试装置10)以与实施例201相同的方式制备——除了不同于实施例201,制备例219的测试线试剂涂布液用于<制备测试线转印介质>并且制备例220的控制线试剂涂布液用于<制备控制线转印介质>;并以与实施例201相同的方式评价。结果展示在表10和表11中。在比较例202中,通过ft-iratr方法,以与实施例201相同的方式,基于流路部件表面分析,确认捕捉核酸不与流路部件结合,证实固定前和固定后之间无光谱变化。[表10][表11]根据表10和表11的结果,在实施例201至210中,在可视性评价中,可以观察到线具有贯穿全线均匀的颜色光密度并且具有高可视性。在光密度评价中,可以观察到线具有高密度,并且在使用具有相应于16以上主链原子数的间隔体长度的捕捉核酸时获得良好结果。与此相比,在比较例201中——其中捕捉核酸直接涂布在流路部件上并干燥,在可视性评价中,观察到显色但线附近模糊严重,使得勉强可以观察到显色。同样,在比较例202中,不能观察到线上显色。本发明的方面如下,例如。<1>测试装置,其包括:构成测试目标液流过的流路的多孔流路部件;在流路部件上提供的测试目标液滴落部分;标记部分,被配置以在滴落到测试目标液滴落部分上的测试目标液包含目标核酸时向目标核酸施加标识;和检测部分,其被配置以检测在标记部分处被标记的目标核酸,其中测试装置在流路部件上检测部分处包括由树脂形成的成形体,并且其中包括与目标核酸能结合和互补的序列的捕捉核酸通过共价结合被固定至成形体和流路部件之间的成形体表面。<2>根据<1>所述的测试装置,其中共价结合包括选自酰胺结合、醚结合、和硫醚结合的至少一种。<3>根据<2>所述的测试装置,其中捕捉核酸是单链的和与目标核酸能杂交的。<4>根据<3>所述的测试装置,其中共价结合通过成形体表面上和捕捉核酸中的选自氨基、羧基、羟基、和巯基的至少一种官能团的反应而形成。<5>根据<1>所述的测试装置,其中包括与目标核酸能结合和互补的序列的捕捉核酸通过连接体与成形体结合。<6>根据<5>所述的测试装置,其中成形体包括具有反应性的官能团,并且其中捕捉核酸通过官能团和连接体与成形体的表面结合。<7>根据<6>所述的测试装置,其中成形体包括氨基作为官能团。<8>根据<7>所述的测试装置,其中连接体在一端包括n-羟基琥珀酸酰亚胺酯基团,并且通过酰胺结合与成形体表面上的氨基结合。<9>根据<5>至<8>中任一项所述的测试装置,其中连接体在一端包括马来酰亚胺基团,并且通过硫醚结合与捕捉核酸在5’端或3’端引入的巯基结合。<10>根据<9>所述的测试装置,其中连接体中的n-羟基琥珀酸酰亚胺酯基团和马来酰亚胺基团之间存在原子,并且其中n-羟基琥珀酸酰亚胺酯基团和马来酰亚胺基团间隔至少3埃。<11>根据<10>所述的测试装置,其中连接体中的n-羟基琥珀酸酰亚胺酯基团和马来酰亚胺基团间隔3埃至35埃。<12>根据<10>或<11>所述的测试装置,其中连接体在n-羟基琥珀酸酰亚胺酯基团和马来酰亚胺基团之间包括聚乙二醇(peg)。<13>根据<1>所述的测试装置,其中捕捉核酸包括:与目标核酸能结合和互补的序列;和间隔体,捕捉核酸被固定至成形体的表面。<14>根据<13>所述的测试装置,其中间隔体包括烷基、或烷基和磷酸基团。<15>根据<13>或<14>所述的测试装置,其中间隔体以下方通式i表示,<通式i>[化学10]其中在通式i中,r1表示取代的或未取代的亚烷基,r2表示取代的或未取代的亚烷基,n表示整数,并且通过r2表示的取代的亚烷基是具有环状结构的亚烷基。<16>根据<1>至<15>中任一项所述的测试装置,其中标记部分中包括的标识体包括与目标核酸互补的单链核酸片段,并且其中目标核酸通过目标核酸和标识体之间的杂交被标记。<17>根据<16>所述的测试装置,其中目标核酸与捕捉核酸结合的位点和目标核酸与标识体结合的位点之间的长度为20个碱基以下。<18>根据<1>至<17>中任一项所述的测试装置,其中标记部分中包括的标识体包括与目标核酸或与目标核酸结合的化合物或蛋白质具有结合性的抗体,并且其中目标核酸通过目标核酸和标识体之间的抗体-抗原反应被标记。<19>根据<1>至<18>中任一项所述的测试装置,其中成形体是非多孔体。<20>用于制备测试装置的转印介质,所述转印介质意在用于制备根据<1>至<19>中任一项所述的测试装置,所述转印介质包括:支持体;在支持体上提供的剥离层;和在剥离层上提供的试剂固定层,其中转印介质具有下列结构:其中与目标核酸具有反应性的试剂被固定至试剂固定层的表面。<21>用于制备测试装置的方法,所述方法包括使根据<20>所述的用于制备测试装置的转印介质的试剂固定层与流路部件彼此接触以将试剂固定层转印到流路部件上的步骤。<22>测试套装,其包括:根据<1>至<19>中任一项所述的测试装置;和分析物收集单元,被配置以收集分析物。<23>测试方法,包括:将分析物供给至根据<1>至<19>中任一项所述的测试装置的流路部件的分析物供给步骤;和通过固定至成形体的捕捉核酸捕捉部分分析物的步骤。根据<1>至<19>中任一项所述的测试装置、根据<20>所述的用于制备测试装置的转印介质、根据<21>所述的用于制备测试装置的方法、根据<22>所述的测试套装、和根据<23>所述的测试方法可解决相关领域的各种问题,并且可实现本发明的目的。[参考符号列表]10:测试装置12:测试目标液14:目标核酸15:与目标核酸结合的化合物或蛋白质16:标识体(核酸)(试剂的实例)17:第一捕捉核酸(试剂的实例)18:第二捕捉核酸(试剂的实例)19:标识体(抗体)(试剂的实例)20:基础材料30:流路部件40:标识体供给部分50a:第一检测部分50b:第二检测部分100:用于制备测试装置的转印介质101:支持102:剥离层103:试剂固定层104:背层200:测试套装201:灭菌棉签202:稀释液当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1